Method Article
Generación de cultivos de tejido de pulmón humano 3D (3D-LTCs) para el modelado de la enfermedad
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para la preparación de rodajas de agarosa llena el pulmón humano de precisión de corte de tejido resecado paciente aptas para generar cultivos de tejido 3D pulmón enfermedades de pulmón humano modelo en estudios biológicos y biomédicos.
Resumen
Traducción de nuevos descubrimientos en la enfermedad humana está limitada por la disponibilidad de modelos a base de tejido humanos de la enfermedad. Pulmón de precisión de corte rodajas (PCLS) usado como cultivos de tejidos de pulmón 3D (3D-LTCs) representan un elegante y modelo de célula 3D biológicamente muy relevantes de la cultura, que se asemejan a altamente tejido in situ debido a su complejidad, biomecánica y molecular composición. Corte de tejido se aplica ampliamente en varios modelos animales. 3D-LTCs derivadas PCLS humano pueden utilizarse para analizar las respuestas a fármacos nuevos, que además podrían ayudar a comprender mejor los mecanismos y efectos funcionales de los medicamentos en el tejido humano. La preparación de PCLS de muestras de tejido pulmonar resecado quirúrgicamente de los pacientes, que experimentaron el lobectomy pulmonar, aumenta la accesibilidad de los enfermos y el tejido peritumoral. Aquí, describimos un protocolo detallado para la generación de PCLS humana del tejido quirúrgico resecado suave elástico pulmonar paciente. Agarosa se introdujo en el espacio broncoalveolar de la resectates, así preservando la estructura del pulmón y aumentar la rigidez del tejido, que es crucial para el posterior corte. rodajas gruesas de 500 μm se prepararon desde el bloque de tejido con un vibratome. Punzones de biopsia tomadas de PCLS aseguran tejido comparable a tamaños de muestra y aumentan la cantidad de muestras de tejido. Las culturas de tejido pulmonar generado se puede aplicar en una variedad de estudios en Biología del pulmón humano, incluyendo la fisiopatología y los mecanismos de diferentes enfermedades, como procesos fibróticos en sus niveles celulares mejores (sub-). El mayor beneficio del LTC 3D vivo ex modelo es su representación cercana del pulmón humano in situ en tejido 3D arquitectura, diversidad de tipo celular y anatomía de pulmón así como el potencial para la evaluación del tejido de pacientes individuales, que es relevante desarrollar estrategias novedosas para la medicina de precisión.
Introducción
Enfermedades pulmonares crónicas y agudas son una causa importante de morbilidad y mortalidad en todo el mundo1. Para los pacientes con enfermedades pulmonares crónicas como la enfermedad pulmonar obstructiva (EPOC)2, asma severa3, cáncer de pulmón4 y pulmonar parenquimal difusa enfermedades5, terapias curativas no están disponibles actualmente. Aunque los estudios en modelos animales para enfermedades pulmonares han profundizado la comprensión de los pathomechanisms de la enfermedad6 y han llevado a la identificación de potenciales dianas terapéuticas novela7,8,9, Estos modelos muestran diferencias biológicas y fisiológicas relevantes en comparación con los seres humanos10. Para superar estas discrepancias entre biología murina y humana así como anatomía humana ex vivo cultivo de tejidos de pulmón 3D (3D-LTC) sistemas se utilizan en diversas áreas de la investigación biomédica. Estos sistemas de cultivo 3D-LTC se basan en lonchas de pulmón de precisión de corte (PCLS). La generación de PCLS ex vivo permite el análisis de una tercera dimensión espacial, que permite la investigación de las relaciones espaciales y funcionales de las células en todo alvéolos y las vías respiratorias11, así como el intersticio, la vasculatura y mesotelio. En particular, PCLS ex vivo modelos son pluricelulares, lo que significa que contienen células más funcionales de los pulmones in situ, lo que representa cerca entorno biológico natural de las células y superando así la limitada célula-célula y célula-matriz de interacción en 2D más Acerca de la cultura de célula. Hasta ahora, ex vivo murinos PCLS fueron utilizados para modelar las enfermedades pulmonares, como EPOC12, pulmón fibrosis13, cáncer de pulmón14, infección viral15,16, displasia broncopulmonar17y asma18. Sin embargo, una proporción considerable de las terapias de fármaco nuevo en enfermedades de los pulmones humanos que se investigaron en los ensayos clínicos no se traducen a la clínica debido a su falta de eficacia o seguridad, presumible debido a todavía considerables diferencias entre humanos y murino biología y enfermedad19,20,21.
Durante varios años, PCLS humanas se han utilizado en gran medida para evaluar la toxicidad pulmonar de fármacos y productos químicos. Recientemente, se ha utilizado tejido pulmonar humano de pacientes con EPOC22,23asma24y25años fibrosis pulmonar, para perseguir estudios fisiopatológicos y farmacológicos. Por usar material de órganos de pacientes resecados y generando PCLS, uno puede recapitulan las características principales de la enfermedad en un complejo tejido 3D medio ambiente22 representar y mantener la mayor parte de la diversidad celular nativa del órgano. Por otra parte, tejido enfermo aplicado en una variedad de configuraciones experimentales se demostró que mímico enfermedad-como cambios en el hígado, intestino y riñón26,27,28,29.
Sin embargo, procesamiento del tejido pulmonar sigue siendo un reto por varias razones. A diferencia de los tejidos sólidos, parenquimia de pulmón nativo tiende a colapsar sin ventilación y exhibe la menor rigidez del tejido. Estas propiedades impiden el corte del tejido. Así, relleno de vías aéreas y el espacio alveolar con bajo punto de fusión punto de agarosa mantiene la estructura del pulmón nativo y proporciona la rigidez necesaria para la precisión de corte de corte de los pulmones murinos y humanos30. Resectates de pulmón humano donados para fines de investigación son por su naturaleza anatómica, genética y fisiológicamente muy diversa, a menudo presentando así una elevada variabilidad entre paciente al realizar experimentos25. En contraste con el lóbulo entero o explantes de pulmón entero, muestras de pulmón resecadas mediante cirugía torácica no necesariamente seguir los segmentos anatómicos y, por lo tanto, requieren de una preparación especial. En este artículo, nos proporcionan un protocolo detallado y optimizado para la generación de PCLS humano de tejido pulmonar resecado y su posterior cultivo y uso experimental para la enfermedad pulmonar modelo.
Protocolo
El uso de tejido humano fue aprobado por el Comité de ética de la Universidad Ludwig-Maximillian [Munich, Alemania (proyecto número 455-12)]. Resección de pulmón libre de tumor humano fueron proporcionados por el Asklepios Biobank para enfermedades pulmonares (número de proyecto de Gauting, Alemania, 333-10).
Nota: Todos los procedimientos de producción PCLS humanos (figura 1) se realizan bajo campana de flujo laminar estéril.
1. elaboración de instrumentos y materiales
-
Preparar todos los materiales para la inflación del tejido pulmonar con agarosa como se describe a continuación.
- Preparar el medio de cultivo: modificado Eagle Medium (DMEM) F-12 de Dulbecco suplementado con L-glutamina, HEPES, penicilina IE 10.000, 10.000 IE estreptomicina y 0.1% (v/v) de suero fetal bovino.
Nota: Se utiliza medio a 37 ° C. - Preparar una bandeja de metal estéril cubierta con papel de seda. Coloque una placa de cultivo de células estériles de 15 cm en la bandeja.
- Llenar la placa de cultivo celular con 15 mL del medio de cultivo.
- Preparar una solución de agarosa al 3% (p/v) disolviendo la cantidad adecuada de agarosa de punto de bajo punto de fusión en un mínimo de 30 mL de medio de cultivo.
- Calentar la solución en el microondas hasta que hierva. Enfríe la solución de agarosa a 42 ° C en un baño de agua. Mantener la solución de agarosa líquida almacenada en el baño de agua.
- Preparar varios tubos cónicos de 50 mL con la agarosa líquida.
- Preparar el medio de cultivo: modificado Eagle Medium (DMEM) F-12 de Dulbecco suplementado con L-glutamina, HEPES, penicilina IE 10.000, 10.000 IE estreptomicina y 0.1% (v/v) de suero fetal bovino.
2. tejido pulmonar resecado
- Tienda tumor fresco tejido de pulmón libre de lobectomía resectates inmediatamente después de la resección en medio DMEM F-12 a 4 ° C hasta el paso 3.
- Sin exceder el tiempo de isquemia fría de 4-8 h antes del procesamiento.
3. inspección y selección de tejido resecado antes del llenado de la agarosa
- Levantar el tejido del medio con las pinzas. Para evitar cualquier daño a los tejidos, especialmente a la pleura, manejar el tejido con pinzas en las vías aéreas sólo.
- Puntuación de la calidad del tejido por criterios del pulmón agarosa relleno Score definido en la tabla 1.
- Proceda al paso 4 Si la calidad del tejido es puntuado por encima o igual a 72. Si la calidad del tejido es puntuado por debajo de 60, no siga más con agarosa al relleno.
Nota: Si la puntuación de tejido es entre 60 y 68, la agarosa-relleno y corte de tejido todavía podrían producir resultados razonables, y una decisión final para la prolongación del experimento tiene que hacerse caso a caso. Sin embargo, el tejido pulmonar que no cumplían con los requisitos antes mencionados, sobre todo falla en agarosa de relleno.
4. pulmón tejido inflación llenándolo de agarosa
- Levantar el tejido desde el medio de almacenamiento y drene el exceso de medio de los tejidos. Transferir el tejido pulmonar en la placa de cultivo de 15 cm en 1.1.2.
- Llene una jeringa de 30 mL con la agarosa de bajo punto de fusión de punto de 1.1.3.
- Preparar un catéter venoso periférico quitando el obturador y coloque a una jeringa de 30 mL
- Identificar un bronquio (0.5-3 mm de diámetro) en el tejido que es una sección intacta del tejido de ventilación (ver figura 2).
- Inserte la cánula en el bronquio seleccionado (0.5-3 mm de diámetro).
- Empuje suavemente la cánula suavemente hacia adelante lo más lejos posible.
- Sello del bronquio alrededor de la cánula por la compresión de la pared bronquial alrededor de la cánula con pinzas, idealmente de sujeción alguna arteria pulmonar adyacente al mismo tiempo.
- Ocluir otras vías aéreas adicionales con una pinza quirúrgica para evitar que la agarosa que se escapa a través de estas vías aéreas.
- Levantar el tejido con el fórceps de la placa de cultivo.
- Manualmente verter la agarosa con la jeringa no superior a 0,3 mL/seg. La velocidad de la agarosa de llenado puede variar entre aproximadamente 0.05 y 0.3 mL/s debido a la resistencia heterogénea de las vías respiratorias o atelectasia.
-
Si se observa resistencia al llenado o agarosa escaparse del tejido, vuelva a intentar el procedimiento entero con un bronquio diferentes del paso 4.4. Realizar solución de problemas como se describe a continuación.
Nota: El grado de llenado de agarosa es altamente dependiente en la posición del catéter en el tejido y la penetración profunda de los resultados de catéter en agarosa relleno de cono pequeño como regiones (*) del tejido pulmonar (figura 2).- En caso de alta resistencia, trate de colocación de las puntas de catéter al llenado correcto de la mayoría de las regiones del tejido (#) (Figura 2D).
- Como tacos de agarosa solidificada temprano en los bronquios proximales o de otra obstrucciones (flecha) pueden dar lugar a un llenado incompleto del tejido (Figura 2E) de la vía aérea, no fuerce la agarosa llenado como esto podría dar lugar a defectos en el área de llenado, pero no en un relleno de las piezas de tejido obstruido.
- Si el árbol respiratorio derivado del bronquio canulado se daña durante la resección y la agarosa llenado de resultados de un escape constante de la agarosa líquida (flecha en figura 2F), inserte el catéter en una parte más periférica del sistema de las vías respiratorias Llene al menos una parte menor de los tejidos (*) (figura 2). Además, sellar la vía aérea periférica dañada con una pinza quirúrgica (flecha) (figura 2 H).
- Aplicar la agarosa hasta que el tejido pulmonar se llene completamente. No infle excesivamente el tejido ya que puede causar daños irreversibles a la estructura del tejido y sus células.
- Sujete el bronquio que se utilizó para el relleno inmediato. Retire la cánula antes de la fijación.
- Incubar el tejido del medio de cultivo a 4 ° C durante 30 minutos asegurar la solidificación de la agarosa.
- Si el tejido resecado tiene varias entradas bronquiales, repita el paso 4.2 a 4.13 hasta que todas las partes del tejido están llenas de agarosa.
- Tienda la agarosa llena las secciones de tejido pulmonar en medio frío de 4 ° C hasta cortar.
5. corte de pulmón precisión de corte
-
Identificar las regiones en el tejido pulmonar que sólidamente se llenan con la agarosa. Regiones sólidamente llenas no se derrumbará cuando ellos se presionan suavemente con una pinza contra la parte inferior de la placa de cultivo celular.
- Suprimir un bloque3 de 1-1.5 cm de regiones descrito en 5.1, mientras que un lado todavía debe estar cubierto por la pleura.
- Fije cada bloque individual tejido con el lado pleural en contacto con el titular de la vibratome usando un pegamento de cianocrilato.
Nota: La pleura es ligeramente elástica y por lo tanto impide el corte con la hoja vibratome. Coloca en el soporte de tejido, la pleura no interferirá con la corte y, importante, forma una barrera natural entre el pegamento de cianoacrilato y parénquima del tejido permitiendo mínima difusión del pegamento. - Cortar el tejido pulmonar con vibratome con los siguientes valores: espesor: 500 μm, frecuencia: 100 Hz, amplitud de la cuchilla: 1,2 mm, velocidad de avance de la cuchilla de 3 a 12 μm/s, que depende de la rigidez del tejido. Reducir la velocidad de la saliente de la hoja si el segmento no se corta correctamente, o si el bloque de tejido se empieza a vibrar.
- Transferencia suavemente la rodaja, levantándola con pinzas desde la bandeja de vibratome en un pozo de una placa de 12 pozos llenado con medio de cultivo. Por último, incubar las lonchas de pulmón en una incubadora bajo condiciones de cultivo de célula estándar.
- Parada de corte cuando se dejan 2-3 mm del bloque del tejido desactivan puesto que el pegamento del cianocrilato puede haber comprometido la integridad del tejido de esta región.
6. generación de golpes PCLS
- Transferir las lonchas de pulmón de un pozo único a un plato vacío de 10 cm.
- Coloque un golpeador de biopsia 4 mm ortogonalmente a la superficie superior de un PCLS y comienza a moverse el golpeador en rotaciones hacia la derecha y hacia la izquierda.
- Llene el medio de cultivo celular en los pocillos de una placa de 96 pocillos. Levante los golpes de tejido con pinzas y transferir los golpes en los pocillos de una placa de 96 pocillos. Por último, incubar los golpes de pulmón sumergidos en el medio preparado en 1.1.1. en una incubadora de cultivo celular bajo condiciones estándares (oxígeno de 21% (v/v), 5% (v/v) de dióxido de carbono y el 95% de humedad, a 37 ° C).
7. cultivo de tejidos y la recolección de la muestra
- La cultura la PCLS y golpes durante la noche en una incubadora bajo condiciones de cultivo de célula estándar.
- Cultura PCLS y golpes bajo condición de contorno para un máximo de 120 horas después de su generación para asegurar la función y la viabilidad celular.
- Para la recolección de proteínas y RNA, lavar PCLS y golpes tres veces en tampón fosfato salino (PBS), transferencia en crioviales y snap-congelación en nitrógeno líquido.
-
Sobrenadante medio muestra de culto PCLS sacadores para el análisis de proteínas secretadas.
- Para el análisis histológicos, lavar los PCLS y golpes tres veces con PBS y fijarlos con paraformaldehído al 4% por incubación durante 30 min a 37 ° C. Por último, guarde la PCLS en PBS a 4 ° C para la tinción más abajo.
Resultados
Generación del PCLS
La generación de PCLS puede dividirse en cuatro pasos esenciales: resección de tejido pulmonar quirúrgica, relleno de agarosa, vibratome generación PCLS y cultura de PCLS. El tejido pulmonar resecado está lleno de agarosa de punto de bajo punto de fusión, que añade la rigidez en el tejido del pulmón para rebanar y preserva la estructura del pulmón nativo y la arquitectura. De nota, PCLS generación es muy desperdiciador de tiempo, a menudo durante la noche almacenaje del tejido pulmonar llenado en medio DMEM F-12 puede ser incluido como un paso adicional y generación PCLS se inicia al día siguiente. Según la siguiente configuración experimental, PCLS generados pueden ser incubadas durante la noche en medio de cultivo de célula estándar que contiene 0.1% (p/v) de suero fetal bovino, antes de aplicación las condiciones experimentales. 3D-LTCs eran viables y funcionalidad celular (como la secreción de proteína surfactante) hasta 120 h22 en las condiciones de cultivo descritos en este protocolo (figura 1) y puede optimizarse a seguir mejorando sus.
Relleno de agarosa
Para el relleno de la agarosa del tejido, una cánula de un catéter venoso periférico con un diámetro de 1,3 mm conectado a la jeringa llena de agarosa fue insertada en un bronquio en la superficie del tejido cortado (figura 2A). Bronquios se localizan a menudo cerca de una arteria pulmonar. Mientras que las arterias tienen paredes más delgadas y tienden a colapsar, bronquios exhibieron una buena luz visible. Dependiendo de la integridad del tejido, el catéter puede avanzar a través de varias generaciones del árbol respiratorio en la periferia del pulmón. El bronquio penetrado fue sellado alrededor de la cánula mediante el uso de pinzas (figura 2B). La arteria pulmonar puede sujetarse con las pinzas al mismo tiempo. Luego, el tejido es levantado y agarosa líquida suavemente es instilado en las vías respiratorias.
Dependiendo de la posición del catéter, la mayoría de los tejidos puede llenarse con líquido agarosa (Figura 2D). Opcionalmente, cono como partes del tejido pulmonar, que reflejan la parenquimia de pulmón ventilado por el bronquio penetrado, podría conseguir lleno de agarosa (figura 2). En ambos escenarios, se puede observar un patrón característico de las regiones de tejido sólido lleno: en primer lugar, una parte importante del tejido se rellena en cuñas (Figura 2D), o en segundo lugar, más pequeñas que sobresalen alrededor de las áreas de fondo tejido lleno las regiones aparecen ( Figura 2). Si partes de las vías respiratorias se obstruyen debido a coágulos de agarosa o por otras causas, partes del tejido pueden no ser llena de agarosa. Así, sólo partes del tejido pueden ser aplicables para cortar. En caso de fugas durante el procedimiento de llenado de agarosa, partes del árbol respiratorio lleno podrían obtener perforadas y relleno del tejido pulmonar es casi imposible, sin embargo, posibles soluciones incluyen el relleno a través de un bronquio más periférico, una más profundo penetración de la cánula en las vías aéreas distales (figura 2), o potencial de fijación de la zona de salida (figura 2 H).
Corte de pulmón de precisión de corte
Bloques de tejido en un largo y ancho de 1-1.5 centímetros fueron suprimidas de las regiones de tejido, que estaban completamente llenos de agarosa solidificada ()Figura 3A-3B). A continuación, los bloques de tejido individual estaban pegados sobre el soporte de tejido de vibratome (figura 3). 500 μm de espesor PCLS fueron generados, mientras que el bloque de tejido en el vibratome avanzaba hacia adelante con velocidades de entre 3 a 12 μm/s. (figura 3D-3F). Finalmente, las PCLS fueron sumergidos en medio de cultivo celular que contiene 0.1% (p/v) de suero fetal bovino y cultivadas en condiciones de cultivo de célula estándar, como se paso 7.
Lecturas experimentales de humano 3D-LTC después de 48h de cultivo
Una tinción de inmunofluorescencia representativa, como se describió anteriormente por Alsafadi et al25, se muestra en la Figura 4A-4 C. Inmunomarcación de fibronectina (rojo) y los núcleos de célula (DAPI, azul), permitidos la proyección de imagen de la estructura alveolar conservada en el 3D-LTC humana ex vivo. Tratamiento del humano PCLS golpea con una citoquina de citosinas cóctel (incluyendo el factor de crecimiento transformante beta 1, factor de crecimiento derivado de plaquetas AB, ácido lipophosphatidyl y el factor de necrosis tumoral alfa) por 48 h dio lugar a la fibrosis como cambios en humanos 3D-LTCs. Por qPCR, se observó una significativa inducción de las fibrosis relevante matriz extracelular componentes colágeno tipo 1 y fibronectina genes en 3D-LTC golpes sobre el tratamiento con el cóctel de citosinas (figura 4). Además, la proteína el vimentin marcador mesenquimal se encontraron niveles de alza en 3 de cada 4 pacientes después del tratamiento de golpes de 3D-LTC (figura 4E).
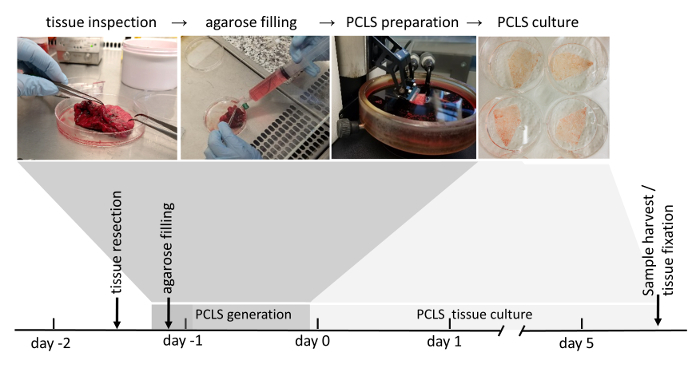
Figura 1: flujo de trabajo de generación de PCLS. Zonas libres de tumor de resecciones pulmonares son inspeccionadas minuciosamente debido a su integridad del tejido. Si el tejido se calcula el puntaje adecuado para su uso posterior (puntuación se explica en detalle en la sección material y métodos), a continuación se llena con agarosa líquida. Bloques de tejido llenados de agarosa solidificada posteriormente son cortadas con un vibratome. Sumergido en medio de cultivo celular, 3D-LTC se cultivan hasta 120 h después de su generación. Análisis aguas abajo de las 3D-LTCs implican la expresión de proteínas o RNA, fluorescencia del tejido vivo de imágenes, así como inmunofluorescencia, tinción después de la fijación del tejido. Haga clic aquí para ver una versión más grande de esta figura.
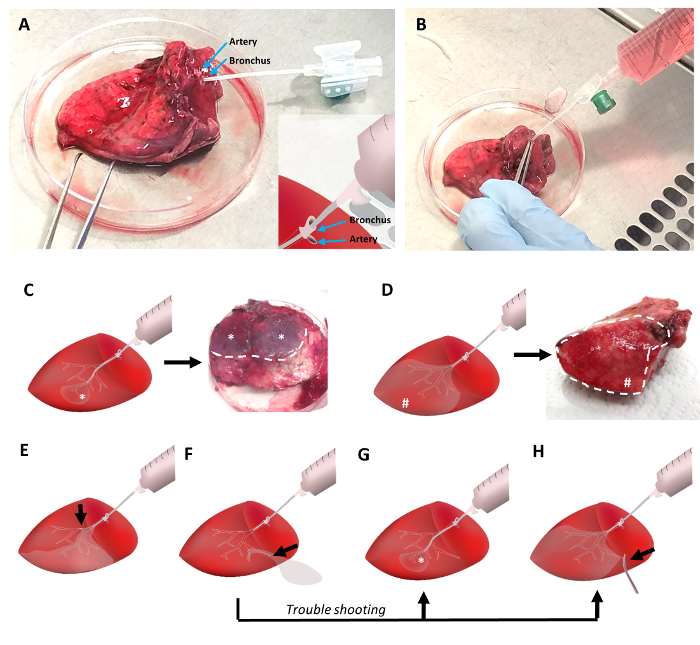
Figura 2: llenando el tejido pulmonar con bajo punto de fusión punto de agarosa. El tejido pulmonar es canulado con un catéter venoso periférico que se inserta en un bronquio adyacente a la arteria pulmonar (figura 2A). Pinzas se utilizan para fijar la cánula en el bronquio y la arteria pulmonar para evitar fugas de la agarosa líquida de la abrazadera. Agarosa líquida a 42 º C se vierte en el tejido pulmonar con una jeringa de 30 mL (figura 2B). Un posicionamiento distal de la cánula durante el llenado producirá en pequeñas áreas de tejido lleno (figura 2), mientras que posición proximal asegurará el llenado de un volumen más grande de tejido (Figura 2D). Obstrucciones de las vías respiratorias reducirá la cantidad de tejido volumen que puede ser llenado (Figura 2E). En caso de fuga de agarosa, una cánula distal de posicionamiento y sujeción de la parte de salida permite agarosa apropiado relleno del tejido pulmonar ()figura 2F-2 H). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: corte de precisión de corte pulmonar. Un tejido pulmonar con éxito lleno de agarosa se utiliza para suprimir un pedazo de un bloque de tejido (1 cm x 1,5 cm x 1 cm) con un bisturí (Figura 3A). Luego se pega el bloque del tejido suprimido para el portapapel higiénico, barra de escala indica 1 cm (figura 3B). Preferiblemente, el tejido se pega con su superficie pleural a la superficie del soporte del tejido como se muestra en la figura 3. 500 μm rodajas se cortan por el vibratome con un cuchillo del zafiro en un ángulo de 10° - 15° en relación con el tejido (figura 3D y 3E). El procedimiento de corte resulta en 2-3 cm3 pulmón intacto grandes rodajas, escala de la barra = 5 mm (figura 3F). Además, mediante el uso de un punzón de biopsia, se pueden generar pequeños golpes reproducibles con un diámetro de 4 mm. Haga clic aquí para ver una versión más grande de esta figura.
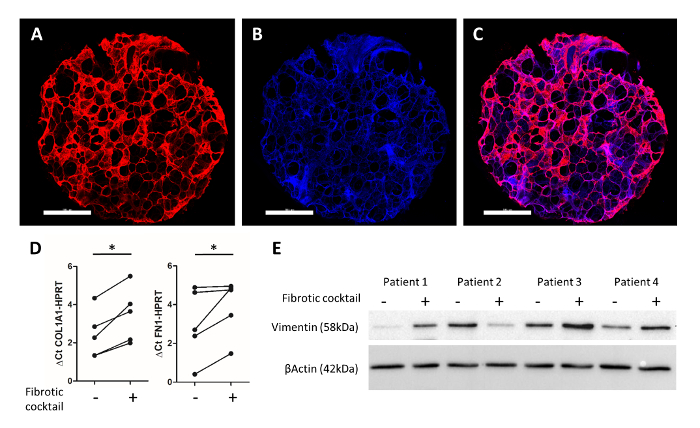
Figura 4: lecturas experimentales de humanos 3D-LTCs después de 48h de cultura. Un golpe humano 3D-LTC de 4 mm de diámetro fue immunostained para la fibronectina (en rojo) y DAPI (en azul) ()Figura 4A-4C). Barras de escala = 1.000 μm. figura 4 muestra la imagen fusionada. Análisis del ARN del PCLS por RT-PCR cuantitativa muestran un aumento significativo de la expresión del gen de COL1A1 y FN1 por el cóctel de citosinas25. Figura 4E muestra un immunoblot de lisados de proteína entera de PCLS, que fueron tratados con un cóctel fibrótica25. Sondeo para β-actinia y el Vimentin demostró una expresión creciente de la proteína del marcador mesenquimal (vimentina) después de tratamiento con citosinas factores en muestras de pacientes 1, 3 y 4. Haga clic aquí para ver una versión más grande de esta figura.
| Criterio | Puntos |
| La muestra de tejido tiene superficie pleural intacto. | 20 |
| La muestra de tejido parece macroscópicamente intacta, carecer de incisiones, aplastamiento, rupturas y distorsiones. | 20 |
| La muestra de tejido contiene al menos un bronquio con un diámetro > 1mm. | 20 |
| La muestra de tejido no contiene o solamente poco cantidades de sangre. | 4 |
| La muestra de tejido se almacena completamente en medio y no muestra evidentes señales de atelectasia. | 4 |
| La muestra de tejido fue resecada en las últimas cuatro horas. | 4 |
| La muestra de tejido es mayor que 5cm en su diámetro más grande. | 4 |
| Puntuación basada en suma: |
Tabla 1: agarosa pulmón llenado de la Score. El pulmón agarosa relleno puntuación (LAFS) se correlaciona con la tasa de éxito para llenar una resección de tejido con agarosa para su posterior vibratome PCLS producción. La cuenta resume todos los puntos de los criterios por el tejido. Un LAFS igual o por encima de 72 predice agarosa buenas propiedades de relleno, una puntuación por debajo de 60 predice un muy probable fracaso de agarosa relleno del tejido.
Discusión
El protocolo descrito en este manuscrito cubre la generación de PCLS de resectates de tejido de pulmón humano llenando con agarosa líquida y posterior vibratome corte. Generación de rebanadas de tejido fue demostrado antes de un par de órganos, como hígado y cerebro, mientras que la rigidez inherente de estos órganos permite directa de corte sin ninguna modificación de los tejidos. A destacar la preparación inicial adecuada del tejido pulmonar es el paso más crucial en la generación de PCLS. Relleno de la agarosa del pulmón es el método de elección para estabilizar su naturaleza suave y elástico y para asegurar una generación de PCLS homogénea y reproducible. Vías aéreas grandes del tejido pulmonar resecado son canuladas para proporcionar acceso a las vías respiratorias pequeñas, así como a la parenquimia de pulmón intacto. La falta de una pleura intacta, que hace casi imposible el agarosa relleno, es una razón importante por qué tejido pulmonar es sobre todo útil para rebanar de pulmón. Anticipado, una pleura sintético diseñado originalmente para llevar a cabo experimentos funcionales sobre andamios decellularized potencialmente podría aplicarse para lograr el éxito agarosa relleno de explantes que carecen de una pleura intacta31. Resecciones en un pedazo de tejido de pulmón humano con pleura intacta son esenciales para la generación de bloques de tejido para cortar. Tejido resecado está más disponible debido al tejido de tumor-libre de resecciones de cáncer de lóbulos intactas o explantes pulmonar total de pacientes sometidos a trasplante de pulmón.
Comúnmente, se utilizan dos sistemas para producir PCLS: Krumdieck tejido cortar15 los Micrótomos vibratorios (vibratomes). Cortadoras de tejido generan sectores atravesando un bloque de tejido de un recipiente del metal, que corta la PCLS en 90° al final de este buque. Vibratomes generar PCLS moviendo un vibrante cuchillo horizontalmente sobre un bloque de anclado del tejido que está sumergido en un baño medio refrigerado, que comparado con la máquina de cortar Krumdieck ejerce menos fuerza sobre el tejido. Esto resulta en menos severo tratamiento del tejido antes de cultivo. Por otro lado, el corte de vibratome es más tiempo y consumiendo trabajo. En nuestras manos, vibratome corte permitió la producción de un máximo de 100 PCLS o 500 PCLS golpes en un día, suficiente para estudios más experimentales. PCLS puede cultivarse en diversas formas: (a) al Trans-wells, generando una interfaz líquido aire sistema (ALI), (b) como cultivo dinámico (DOC), o (c) sumergido en medio de cultivo celular en condiciones de cultivo de célula estándar. El cultivo en detalle del PCLS fue descrita22,23,25; sin embargo, un estándar común de las condiciones de cultivo entre su uso en varios laboratorios alrededor del mundo está todavía ausente. En particular, el tiempo de la cultura podría ser crítico: como en murinos PCLS, se observa una pérdida de células de tipo alveolar positiva 2 SFTPC después de 144 h, pero no después de 120 h22. Además, actividad metabólica parece permanecer estable en murinos22 y humano PCLS25 de 120 h.
Hay un par de limitaciones técnicas para la generación de PCLS: el número y tamaño de la resectates fluctúa en el tiempo. la eficiencia de la agarosa de relleno, que depende de la presencia de pleura intacta dentro del tejido obtenido, determina el éxito final de la generación del PCLS; y destrucción del tejido causada por cambios patológicos en el tejido pulmonar (enfermo) obtenidos podría interferir con la preparación del PCLS. Obstrucciones de la vía aérea y tejido fibrótico que carecen de espacio alveolar intacta impiden con agarosa al relleno y así hacen una exigente tarea de corte de tejido fibrótico. Enfisematosos tejidos como encontraron en enfermedades como EPOC o deficiencia de alfa-1-anti-tripsina podría no soportar la presión de llenado de agarosa y resultará en ruptura de los alvéolos y objetos arquitectónicos. En estos casos, el uso de agarosa baja concentración, por ejemplo,, 1% (p/v), podría ser útil para disminuir la presión y la velocidad durante el llenado de la agarosa. En general, el estado de enfermedad del tejido puede limitar drásticamente el uso del tejido para la generación de PCLS. Todos estos parámetros determinan la cantidad de PCLS que puede generarse a partir de tejido pulmonar, y también la cantidad de tiempo que se necesita para producir la PCLS. Otras limitaciones del PCLS son inconsistencias entre lonchas de pulmón diferentes con respecto a contenido tamaño o tejido, que requiere más pasos de normalización para los experimentos. Para superar esto, se pueden generar Punzones de biopsia de regiones similares del mismo segmento. Este procedimiento es apto para reducir la variabilidad del tejido y, como beneficio adicional, aumentar el número de muestras PCLS que puede ser utilizado para experimentos.
En conclusión, lleno de cultivos de tejido de pulmón humano 3D de agarosa PCLS proporcionan un modelo humano complejo para estudiar la fisiología del pulmón y las enfermedades. El protocolo proporciona una descripción detallada de la preparación de PCLS de tejido pulmonar resecado y su cultivo y además enfrenta los desafíos en el relleno de la agarosa de resecciones de pulmón humano y cómo superarlos.
Divulgaciones
Todos los autores no declaran a intereses financieros en competencia.
Agradecimientos
Los autores agradecemos a Marisa Neumann experta asistencia técnica. Todos los tejidos del pulmón fueron amablemente proporcionados por el CPC-M Bio-archivo. Este trabajo fue apoyado por el centro alemán de investigación del pulmón (DZL), la Asociación Helmholtz y CPC investigación escuela subvenciones.
Materiales
| Name | Company | Catalog Number | Comments |
| Vibratome Hyrax V50 | Zeiss | - | |
| Hyrax CU 65 | Zeiss | - | |
| Vasofix Braunüle 18 G | B. Braun Melsungen AG | 4268130B | |
| 30 mL NORM-INJECT | Henke Sass Wolf | 4830001000 | |
| Guarded disposable scalpels, sterile | Swann-Morton | ||
| Loctite 406 | Henkel | LOCTITE 406 | |
| Synthetic Single Crystal Sapphire | Delaware Diamond Knives | - | |
| Dulbecco's Modified Eagle Medium F-12 Nutreient Mixture (Ham) + L-Glutamine + 15mM HEPES | Gibco | 31330-038 | |
| Penicillin Streptomycin | Gibco by Life Technologies | 15070-063 | |
| Special process fetal bovine serum (Sera Plus) | Pan Biotech | P30-3702 | |
| Disposable Biopsy Punch | pfm medical | 48401 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate, Flat Bottom with Lid, sterile | Falcon / Corning | 353219 | |
| Agarose, low geling temperature | Sigma | A9414-100G |
Referencias
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2095-2128 (2010).
- Rosenberg, S. R., Kalhan, R., Mannino, D. M. Epidemiology of Chronic Obstructive Pulmonary Disease: Prevalence, Morbidity, Mortality, and Risk Factors. Seminars in Respiratory and Critical Care Medicine Med. 36 (4), 457-469 (2015).
- Hekking, P. P., et al. The prevalence of severe refractory asthma. The Journal of Allergy and Clinical Immunology. 135 (4), 896-902 (2015).
- Woodard, G. A., Jones, K. D., Jablons, D. M. Lung Cancer Staging and Prognosis. Cancer Treatment and Research. 170, 47-75 (2016).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine. 183 (4), 431-440 (2011).
- Burgstaller, G., et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. European Respiratory Journal. 50 (1), (2017).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. The American Journal of the Medical Sciences. 341 (6), 444-449 (2011).
- Fricker, M., Deane, A., Hansbro, P. M. Animal models of chronic obstructive pulmonary disease. Expert Opinion on Drug Discovery. 9 (6), 629-645 (2014).
- Sagar, S., Akbarshahi, H., Uller, L. Translational value of animal models of asthma: Challenges and promises. European Journal of Pharmacology. 759, 272-277 (2015).
- Williamson, J. D., Sadofsky, L. R., Hart, S. P. The pathogenesis of bleomycin-induced lung injury in animals and its applicability to human idiopathic pulmonary fibrosis. Experimental Lung Research. 41 (2), 57-73 (2015).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of beta2-adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Skronska-Wasek, W., et al. Reduced Frizzled Receptor 4 Expression Prevents WNT/beta-Catenin-driven Alveolar Lung Repair in Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 196 (2), 172-185 (2017).
- Lehmann, M., et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. European Respiratory Journal. 50 (2), (2017).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Communication and Signaling. 12, 73 (2014).
- Ebsen, M., et al. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathology - Research and Practice. 198 (11), 747-753 (2002).
- Kennedy, J. L., et al. Effects of rhinovirus 39 infection on airway hyperresponsiveness to carbachol in human airways precision cut lung slices. The Journal of Allergy and Clinical Immunology. 141 (5), 1887-1890 (2018).
- Royce, S. G., et al. Airway Remodeling and Hyperreactivity in a Model of Bronchopulmonary Dysplasia and Their Modulation by IL-1 Receptor Antagonist. American Journal of Respiratory Cell and Molecular Biology. 55 (6), 858-868 (2016).
- Donovan, C., et al. Rosiglitazone elicits in vitro relaxation in airways and precision cut lung slices from a mouse model of chronic allergic airways disease. American Journal of Physiology-Lung Cellular and Molecular Physiology. 309 (10), L1219-L1228 (2015).
- Zscheppang, K., et al. Human Pulmonary 3D Models For Translational Research. Biotechnology Journal. 13 (1), (2018).
- Fisher, R. L., et al. The use of human lung slices in toxicology. Human & Experimental Toxicology. 13 (7), 466-471 (1994).
- Wang, L., et al. Differences between Mice and Humans in Regulation and the Molecular Network of Collagen, Type III, Alpha-1 at the Gene Expression Level: Obstacles that Translational Research Must Overcome. International Journal of Molecular Sciences. 16 (7), 15031-15056 (2015).
- Uhl, F. E., et al. Preclinical validation and imaging of Wnt-induced repair in human 3D lung tissue cultures. European Respiratory Journal. 46 (4), 1150-1166 (2015).
- Switalla, S., et al. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicology and Applied Pharmacology. 246 (3), 107-115 (2010).
- Banerjee, A., et al. Trichostatin A abrogates airway constriction, but not inflammation, in murine and human asthma models. American Journal of Respiratory Cell and Molecular Biology. 46 (2), 132-138 (2012).
- Alsafadi, H. N., et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices. American Journal of Physiology-Lung Cellular and Molecular Physiology. 312 (6), L896-L902 (2017).
- Westra, I. M., Oosterhuis, D., Groothuis, G. M., Olinga, P. Precision-cut liver slices as a model for the early onset of liver fibrosis to test antifibrotic drugs. Toxicology and Applied Pharmacology. 274 (2), 328-338 (2014).
- Vatakuti, S., Schoonen, W. G., Elferink, M. L., Groothuis, G. M., Olinga, P. Acute toxicity of CCl4 but not of paracetamol induces a transcriptomic signature of fibrosis in precision-cut liver slices. Toxicology in Vitro. 29 (5), 1012-1020 (2015).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Disease Models & Mechanisms. 8 (10), 1227-1236 (2015).
- Li, M., de Graaf, I. A., Groothuis, G. M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research. Expert Opinion on Drug Metabolism & Toxicology. 12 (2), 175-190 (2016).
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Wagner, D. E., et al. Design and Synthesis of an Artificial Pulmonary Pleura for High Throughput Studies in Acellular Human Lungs. Cellular and Molecular Bioengineering. 7 (2), 184-195 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados