Method Article
组织细胞外囊泡与肝脏分离
摘要
这是一种从肝脏中分离组织细胞外囊泡(EV)的协议。该协议描述了一个两步过程,涉及胶原酶灌注,然后是差异性超离心,以分离肝组织EV。
摘要
细胞外囊泡 (EV) 可以从许多不同的细胞类型中释放出来,并在大多数(如果不是全部)体液中检测到。EV 可以通过将RNA或蛋白质等生物活性分子从一个细胞穿梭到另一个细胞,从而参与细胞与细胞之间的交流。大多数EV研究是在细胞培养模型或从体液中分离出来的EV中进行的。人们开始关注将EV与组织分离出来,以研究它们对生理过程的贡献,以及它们在疾病中是如何改变的。从组织中分离出具有足够产量的EV在技术上具有挑战性,因为需要组织分离,而不会造成细胞损伤。该方法描述了从小鼠肝脏组织分离EV的程序。该方法涉及两步过程,从原位胶原酶消化开始,然后是差分超离心。使用胶原酶进行组织灌注,由于其获得EV的产量增加,比机械切割或肝组织均质化具有优势。使用这两步过程从肝脏分离EV将有用的研究组织EV。
引言
细胞外囊泡 (EV) 是膜结合的囊泡,从体内许多不同类型的细胞中释放出来。EV包含一批分子,包括RNA、DNA和蛋白质。EV将这种货物从一个细胞转移到另一个细胞,被假定为组织内细胞相互通信的一种机制。大部分有关EV在正常健康和疾病中的货物或作用的信息来自从培养细胞中获得的或从循环或其他体液中收集的关于EV的研究2。为了了解它们在体内的生理作用,一种强有力的方法是必要的,以分离组织EV,捕获所有人群的EV,并避免细胞损伤或污染3。本文所述方法的总体目标是从小鼠肝脏中分离组织 EV。
肝脏中的大多数细胞类型已被证明能产生EV,而基于EV的信号学研究正在增进对肝病的基本知识和了解。然而,来自组织内不同细胞类型的EV的综合影响只是部分理解。为了了解EV在组织环境中的原位贡献,有必要从肝脏组织中分离EV。本文所述的方法基于两步灌注,以增强组织解离和尽量减少细胞损伤。随后,从分离的肝组织分离出EV。自20世纪50年代初以来,一直采用两步灌注分离肝细胞的方法。这些肝细胞分离方法已被修改和持续改进,现在是在培养物、细胞悬浮物和组织5、6、7中分离肝细胞的标准方法。在第一步,肝脏接受无钙缓冲液(汉克的平衡盐溶液(HBSS)的非循环灌注。在第二步中,肝脏与胶原酶结合,溶解细胞外基质,以进一步分离去染色体细胞与细胞的结。胶原酶溶解的最佳治疗时间是7至10分钟。治疗时间较短会导致肝脏不完全溶解和细胞接触,而较长的持续时间可能会导致肝损伤或门户静脉中断。然后,使用差分离离分离电动汽车,以清除细胞和细胞碎片。这导致高产量的EV收集,可用于进一步的下游分析或研究。
研究方案
所有涉及动物的研究都按照梅奥诊所机构动物护理和使用委员会批准的协议进行。
1. 工作台准备
- 准备一个水浴,并将其设置为37°C。其他必要的设备和设置如图1所示。
- 测量 100 mg 的胶原酶 IV 型,并将其添加到水浴 (40 °C) 中含有 100 mL HBSS 的 125 mL 烧瓶中。确保胶原酶通过搅动烧瓶中的液体溶解,并确保烧瓶完全浸入水浴中。为了提高效率,允许胶原酶溶解至少30分钟,即使它可能看起来立即溶解。
- 将含有 50 mL HBSS 的 125 mL 烧瓶浸入 40°C 的水浴中。这将用于初始刷新。
- 用70%乙醇喷洒所有仪器的表面,如剪刀和钳子。准备一些干净的棉签。
- 通过泵中 70% 乙醇,冲洗泵的油管,然后用自来水冲洗两次,去除任何残留的乙醇。
- 在实验室工作台上放置一个吸水式工作台垫,并将一个硬箱容器放在顶部。在小鼠灌注过程中,需要包含任何多余的液体。用铝箔包裹聚苯乙烯泡沫垫,并将其放入容器内。
- 将无菌的 10 厘米培养皿放在长凳附近。灌注完成后,这将用于保存消化的肝脏。
- 提前将10 mL的胶原酶培养基(步骤1.2)倒入无菌培养皿中。
- 使用带翼的血液采集组,将 23 号表连接到泵管的自由端(切断蝴蝶管的翅膀可以导致更好的操作)。通过,直到血液收集管的尖端被填补。
2. 动物准备
- 在开始使用异曲兰麻醉之前,请确保在手术过程中有足够的供气。在 1-2L 处打开感应室的氧气 (O 2) 供应,然后使用流量计在 2-4% 之间打开开的开路。
- 将鼠标放入感应室并关闭顶门。监视鼠标,直到其卧塞。
注:室内的气体会使小鼠麻醉几分钟。 - 将鼠标放在用铝箔包裹的聚苯乙烯泡沫垫上。将流量从感应室切换到锥体。确保麻醉充足。如果鼠标开始响应,轻轻地将其抑制在鼻锥中,直到完全麻醉。
- 通过监测呼吸和对手术过程中的刺激反应来确保麻醉。根据需要调整速率流量计,以确保充分麻醉。爪子必须对麻醉下的捏合测试没有反应。其他详情可从动物护理实验室指南中获得。
- 胶带或固定鼠标的所有四肢。
- 用70%乙醇喷洒,用纱布和酒精垫擦去,清洁腹部皮肤。此步骤对于避免小鼠毛皮污染至关重要。
- 使用一套无菌剪刀,从前部到骨盆骨,在皮肤上进行宽开的切割。小心不要割断任何内脏器官。使用棉倒施用器将肠道转移到动物的左侧,轻轻露出入口静脉 (PV) 和低劣的 vena 卡瓦 (IVC)。
3. 灌注和灌注(0.5小时)
- 使用弯曲的钳子,在门静脉下面放置一个螺纹,并松散地打结,准备在咬紧后紧紧扣住。
- 将管状(从血液采集集中的 23G)插入连字下方 5-10 mm 的门户静脉中。请勿将导管插入第一个门户分支,否则右前叶可能未充分注入。管状可以使用塞结固定或用螺纹固定。
- 启动泵以低流量(1-2 mL/min)注入 HBSS。一旦罐被确认是成功的,肝脏将开始发泡。
- 切断 IVC 以释放压力,让肝脏内的过多液体排出。最好使用另一只手操作,以便不移动导管。
- 在接下来的5分钟内,缓慢地将流速提高到8 mL/min,并使用整个50 mL的HBSS体积通过肝脏完成灌注。
- 在 HBSS 开始耗尽之前,将含有介质的胶原酶(步骤 1.2)放入烧杯中。更换介质时,确保气泡不存在,且不会流入肝脏。
- 用钳子夹紧,每隔 5 秒对 IVC 施加瞬态压力。这将导致肝脏膨胀,帮助组织消化和解散(7-8分钟)。随着消化的进展,肝脏会膨胀并变白。肝脏可以均匀膨胀到大约其原始大小的两倍。
- 消化完成后,关闭泵并拆下导管。肝脏消化的完成将取决于小鼠的大小和肝脏的状况。如果使用棉签施用器轻轻探查肝脏,则可以观察到肝脏的凹痕。
- 从肝脏中取出胆囊,小心不要撕裂。使用一把洗过的剪刀和钳子,从小鼠中提取肝脏到含有磷酸盐缓冲盐水(PBS)的无菌10厘米培养盘中,用于表面清洗。小心地将肝脏转移到含有胶原酶培养基的无菌 10 厘米培养盘中(从步骤 1.8 开始)。这是避免小鼠血液和胆汁污染的关键步骤。
- 抓住和撕开肝脏与两个干净的钳子,同时轻轻地摇动细胞从肝脏。发生这种情况时,介质将变得阴云密布。所有的肝细胞都可以被动摇,留下结缔组织和血管组织。
- 使用 3 mL 注射器多次对细胞溶液进行三聚,直到肝脏未消化的部分被甩掉。将其倒入50 mL锥形管中,带70 μm尼龙细胞过滤器,以过滤任何未消化的结缔组织。用 HBSS 清洗盘子,收集剩余的细胞,并填充 50 mL 锥形管。
- 在 50 x g 的摆动铲斗转子中轻柔地将 50 mL 锥形管离心 10 分钟,在 4°C 下。
- 将上清液转移到新的 50 mL 锥形管中。
4. EV 隔离(5 小时)
- 在 4°C 下在 300 x g下离心 10 分钟。将上清液转移到新的 50 mL 锥形管中。
- 在 2000 x g下将上清液在 4°C 下离心 20 分钟,以清除细胞碎屑和集料。
- 将上清液转移到圆底管中,在 4°C 下以 10,000 x g 将上清液离心 70 分钟。
- 收集上清液,并放入聚碳酸酯超离心管和离心机在100,000 x g在4°C70分钟。
- 将颗粒收集在超离心管中,然后在PBS中重新悬浮洗涤。在 4°C 下,在 100,000 x g 下进一步离心,70 分钟。
- 由细胞纳米囊组成的最终颗粒可直接用于实验或重新悬浮1000μL的PBS,并储存在-80°C。
5. 隔离的质量和产量评估
- 根据仪器制造商的协议,使用纳米粒子跟踪分析或可调电阻脉冲感应来评估尺寸分布和浓度。
- 根据特定的实验需求,通过添加蔗糖梯度或缓冲、免疫亲和力技术或尺寸排除色谱等多种方法,对特定囊泡种群进行进一步分离和纯化。
结果
这些隔离所需的设备包括标准实验室设备,因此这种方法相对简单且具有成本效益。从十二至三十周大的雄性小鼠和雌性Balb/c或FVB小鼠进行分离。装有鼠标的托盘在硬壁容器内内衬着铝箔,在灌注过程中收集多余的液体。含有HBSS或胶原酶培养基的烧瓶浸入水浴(40°C)中,随时可以使用。使用两个无菌的 10 厘米培养皿。一个用于用PBS表面清洗,另一个用于肝细胞分离从结缔组织成分。
在这种方法中,肝脏通过门户静脉以非连续的方式注入,而不是从劣质的vena卡瓦中分离。另一种常用灌注方法是通过对劣质文纳卡瓦进行逆行灌注,并切割用于排水的门户静脉。然而,门户静脉可以很容易访问,并涉及一小段距离到肝脏,因为门户静脉直接送入肝脏8。选择插入点进行插罐对于最佳成功至关重要(图2)。管状被放置在胃和胰腺静脉的分支,但不是超过第一个门户分支(左右肝门户静脉)。一旦确定了门户静脉中的最佳插入位置,则使用弯曲的钳子将螺纹放在门户静脉下方,并打一个松结。管针用螺纹固定,使用止穿针,防止针头脱落。
图3概述了肝组织EV分离差异离心的总体处理方案。超中光可去除细胞、碎屑和其他杂质。前四个离心步骤(50 x g、300 x g、2,000 x g、10,000 x g)分别用于去除肝细胞、完整的其他细胞、死细胞或细胞碎片。(图 4A和4B) .在这些步骤之后,在 100,000 x g 下再次执行超离心以收集颗粒(图 4C)。颗粒在PBS中重新悬浮,并在100,000 x g处进行最终超离心。与来自条件培养的EV相比,超离心化后的颗粒在此过程中是绝对可见的和粘稠的。需要多次移液,直到任何棕色的骨料消失并完全溶解。最终颗粒被重新悬浮与1000 μL的PBS(图4D)。超中心化可去除等离子体中的杂质和其他可溶性污染物,从而影响功能性实验结果。离心在4°C下进行。
从小鼠肝脏,这种方法产生从1.74到4.00 x 1012的组织EV浓度,平均值为3.46 x 1012粒子每mL由纳米粒子跟踪分析(NTA)(图5)。分离肝组织EV的平均尺寸为157.7nm,模式尺寸为144.5nm,EV尺寸为NTA为100-600nm。EV的产量将取决于诸如肝脏重量和渗透或超离心步骤中的损耗等因素。
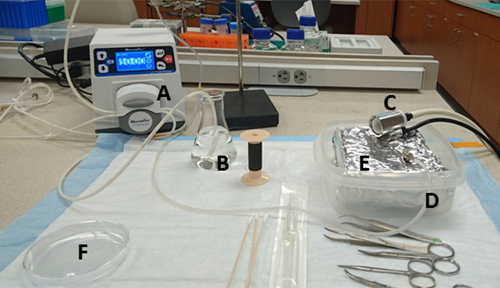
图 1: 工作台准备。材料及其位置为:(A) 泵,(B) 加热的 125 mL 烧瓶,含有 HBSS 和吸水口,(C) 鼻锥连接到异可兰蒸发器,(D) 泵的水排气口用针连接,(E) 托盘内衬铝箔硬壁容器和(F)10厘米培养皿,其中胶原酶培养基提前浇注。请点击此处查看此图的较大版本。
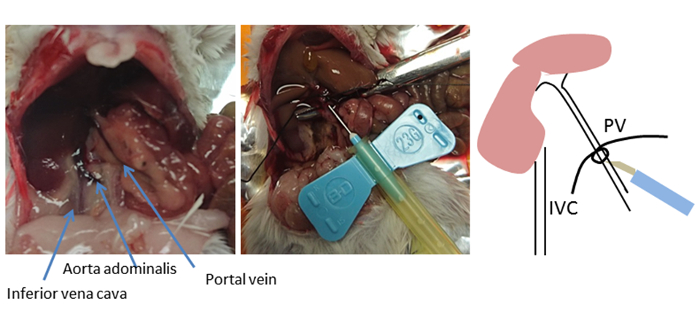
图 2: 可分会场。显示了小鼠腹部的解剖结构。使用弯曲的钳子,将螺纹放置在入口静脉 (PV) 下方,并绑上松结。插入位置靠近肝脏,在结扎下方 5-10 mm,但不超过第一个门户分支(左和右肝门户静脉)。管扣固定或固定使用带止止结的螺纹。此结用作 PV 位置的标记,如果管套脱落。请点击此处查看此图的较大版本。
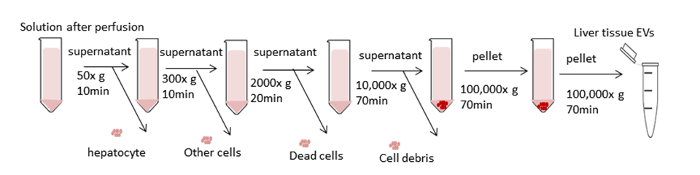
图 3:离心步骤的原理图。目标是删除不需要的细胞和其他组件,并隔离 EV。前四个离心步骤旨在使用差分离离移去除肝细胞和其他细胞、死细胞或细胞碎片。在这些步骤之后,在 100,000 x g 下执行超离心,以收集 EV 的颗粒。颗粒在PBS中重新悬浮,并在100,000 x g处进行最终超离心。所有离心步骤均在4°C下执行。请点击此处查看此图的较大版本。
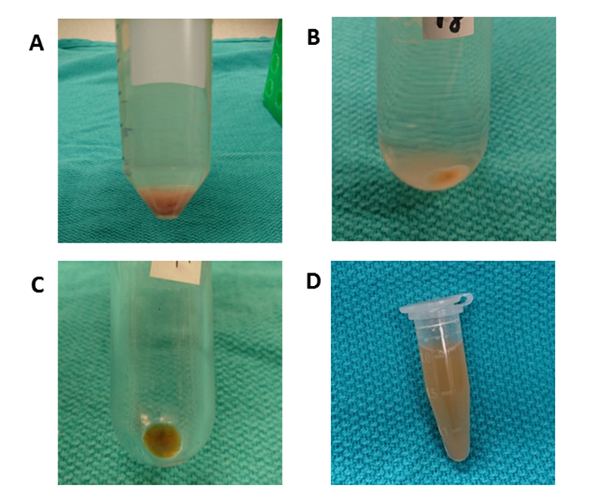
图 4:差分离离。(A) 在50 x g离心10分钟后,观察到含有肝细胞的颗粒。(B) 圆底管用于在10,000 x g下离心70分钟,以清除细胞碎片。(C) 聚碳酸酯超离心管用于100,000 x g离心70分钟。颗粒被收集在一个管中,并通过用PBS重新悬浮来洗涤。(D) 最终颗粒在 PBS 的 1000 μL 中重新悬浮。请点击此处查看此图的较大版本。
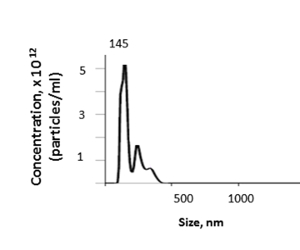
图 5:代表性结果。肝组织EV的大小和浓度可以通过纳米粒子跟踪分析(NTA)确定。请点击此处查看此图的较大版本。
讨论
该协议描述了一种最佳且可重复的方法,用于通过门户静脉使用两步灌注过程分离肝组织EV,然后进行差分超离心。该过程的重要步骤包括管状放置、胶原酶浓度和消化时间、介质的流动速度、消化后组织处理以及经典差分超离心。
细胞分离是通过使用胶原酶IV型消化后从结缔组织成分分离实现的。用于灌注的胶原酶的浓度范围为0.1至5mg/mL。胶原酶对组织消化的功效可能有相当大的批次变化。测试了0.5至5mg/mL的胶原酶浓度,但所使用的浓度对获得的EV的产量没有重大影响。使用高浓度的胶原酶将导致肝脏更迅速的肿胀和美白。目标是获得令人满意的细胞分离,而不会造成过度污染或损害。在这些分离中使用的胶原酶的最佳浓度为1-2mg/mL,在8 mL/min的流速下注入7-8分钟。灌注过程过长会增加破坏肝脏内结缔组织的风险,并增加技术风险,如针从入口静脉分离或静脉空气陷印。
该协议最具挑战性的方面是门户静脉的可分扫描。这可能具有挑战性,特别是在18至25克大小的小鼠中。胶原酶灌注技术最初开发用于大鼠,后来在多次修改和调整后用于小鼠。使用23G血液采集集进行采集比在小光度血管中放置导管更容易。建议使用带塞结的螺纹固定管断,以避免脱落,并且该结还可用作入口静脉位置的标志,以防管状从船上脱落。
对于下游分析,将细胞污染降至最低非常重要。消化后组织处理有好几个重要的考虑因素。首先,在提取肝脏以避免血液污染时,钳子和剪刀会发生变化。其次,必须小心地从肝脏中取出胆囊,以避免胆汁撕裂和不必要的污染。第三,一旦肝脏从小鼠中取出,肝脏被非常轻轻地用PBS洗去任何血液。尽量减少对细胞的污染应比降低获得的EV产量更优先。
超中心化是EV8、9、10、11的隔离和纯化最常用的方法。这种方法将去除大多数节状细胞,如肝细胞或胆囊和非节细胞,如Kupffer细胞,正弦内皮细胞和硬质细胞,此外,细胞碎片,细胞聚集和死细胞也将通过差分离离去除。通过尺寸排除色谱法去除任何非细胞蛋白聚集物或脂蛋白,可以进一步纯化和分离特定人群。
该协议的一个限制是,它可能无法捕获所有组织囊泡,因为某些囊泡可能在渗透剂中被去除。如果需要进行全球评估,应考虑收集渗透剂,并在渗透内分离囊泡。另一个限制是细胞损伤的可能性。为了监测细胞过度死亡的潜在影响,可以监测细胞活力,并将其纳入组织EV分离的质量参数中。总之,此过程描述了使用两步灌注技术通过门户静脉的优化工作流程,然后进行差分超离心,以高产量从小鼠肝脏获得肝组织 EV。这些组织EV适用于下游分析,如生物分子成分的表征和其他研究,旨在描述其生理或病理生理学作用或潜在应用作为疾病标志物。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了国家癌症研究所资助CA-217833的资助。
材料
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
参考文献
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , Chapter 3 (Unit 3.22) (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。