Method Article
간에서 조직 세포 외 소포의 격리
요약
이것은 간에서 조직 세포 외 소포 (EV)를 격리하는 프로토콜입니다. 이 프로토콜은 콜라게나아제 관류와 관련된 2단계 과정을 설명하고 간 조직 EV를 분리하기 위한 차동 초원심분리를 설명합니다.
초록
세포외 소포 (EV)는 많은 다른 세포 모형에서 풀어 놓이고 전부는 아니더라도, 체액에서, 대부분의에서 검출될 수 있습니다. EV는 RNA 또는 단백질과 같은 생리 활성 분자를 한 세포에서 다른 세포로 차단하여 세포 간 통신에 참여할 수 있습니다. 전기 EV의 대부분의 연구는 세포 배양 모델에서 또는 체액에서 분리 된 전기 에서 수행 되었습니다. 생리적 과정에 대한 그들의 기여와 질병에서 어떻게 변경되는지 연구하기 위하여 조직에서 EV의 격리에 있는 신흥 관심사가 있습니다. 조직에서 충분한 수율을 가진 전기 의 고립은 세포 손상없이 조직 해리의 필요성 때문에 기술적으로 도전적이다. 이 방법은 마우스 간 조직으로부터 EV의 분리를 위한 절차를 기술한다. 이 방법은 시투 콜라게나아제 소화에서 시작하여 차동 초원심분리를 포함하는 2단계 과정을 포함합니다. 콜라게나아제(collagenase)를 이용한 조직 관류는 얻어진 EV의 수율이 증가하여 간 조직의 기계적 절단 또는 균질화에 비해 이점을 제공합니다. 간에서 전기 를 격리하는이 2 단계 과정의 사용은 조직 전기 의 연구에 유용 할 것입니다.
서문
세포외 소포 (EV)는 바디에 있는 세포의 많은 다른 모형에서 풀어 놓이는 막 바인딩한 소포입니다. EV는 RNA, DNA 및 단백질을 포함하는 분자의 화물을 포함합니다. 한 세포에서 다른 세포로 전기에 의해이화물의 전송은 조직 내의 세포가서로 통신하는 하나의 메커니즘으로 가정1 . 정상적인 건강 및 질병에서 전기자동차의 화물 또는 역할에 관한 대부분의 정보는 배양된 세포로부터 획득되거나 순환 또는 기타 체액으로부터 수집된 전기자동차에 대한 연구에서 유래되었다2. 생체 내에서생리적 역할을 이해하기 위해서는 모든 전아를 포착하고 세포 손상 이나 오염을 피하는 조직 EV의 격리를 위해 강력한 방법이 필요합니다3. 본 명세서에 기재된 방법의 전반적인 목표는 마우스 간으로부터 조직 EV를 분리하는 것입니다.
간에서 대부분의 세포 유형은 전기 를 생산하는 것으로 나타났습니다, EV 기반 신호의 연구는 간 질환의 기본 지식과 이해를 발전하고있다. 그러나, 조직 내의 다른 세포 모형에서 EV의 결합한 충격은 단지 부분적으로 이해됩니다. 간 조직으로부터 의 전동EV의 분리는 조직 milieu 내의 전기 EV의 내부 기여도를 이해하기 위하여 필요합니다. 본 원에 기재된 접근법은 조직 해리를 강화하고 세포 손상을 최소화하기 위해 2단계 관류에 기초한다. 이어서, 전기 자동차는 해리 된 간 조직에서 분리. 간세포의 격리를 위한 2단계 관류를 이용한 접근법은 1950년대 초부터 사용되어 왔다4. 간세포 분리에 대한 이러한 방법은 수정되고 지속적으로 개선되었으며, 이제 는 배양, 세포 현탁액 및 조직 5,6,7에서간세포를 분리하기 위한 표준 접근법이다. 첫 번째 단계에서 간은 칼슘이없는 완충액인 행크의 균형 잡힌 소금 용액 (HBSS)으로 비 순환 관류를 받습니다. 두 번째 단계에서, 간은 세포 외 기질을 용해시키기 위해 콜라게나아제와 함께 침투되어 세포 간-세포 간 접합을 추가로 분리한다. 콜라게나제 용해를 위한 최적의 치료 시간은 7-10분입니다. 치료의 짧은 기간 불완전 한 용 해를 일으킬 것입니다 및 간에서 세포 접촉을 유지, 반면 긴 기간 간 손상 또는 포털 정맥 중단을 일으킬 수 있습니다. 그런 다음 차동 원심분리를 사용하여 세포와 세포 파편을 제거하기 위해 전기 를 분리합니다. 이로 인해 추가 다운스트림 분석 또는 연구에 사용할 수 있는 높은 수율의 EV 컬렉션이 생성됩니다.
프로토콜
동물과 관련된 모든 연구는 메이요 클리닉 기관 동물 관리 및 사용 위원회에 의해 승인 된 프로토콜에 따라 수행되었다.
1. 벤치 준비
- 수조를 준비하고 37 °C로 설정합니다. 기타 필요한 장비 및 설정은 그림1에 나와 있습니다.
- 콜라게나아제 타입 IV 100 mg을 측정하고 수조(40°C)에서 HBSS 100 mL를 함유하는 125 mL 플라스크에 첨가합니다. 콜라게나아제는 플라스크의 액체를 소용돌이치면서 용해되었는지 확인하고 플라스크가 수조에 완전히 잠겨 있는지 확인하십시오. 효율성을 높이기 위해 콜라게나아제는 즉시 용해되는 것처럼 보일지라도 적어도 30분 동안 용해되도록 하십시오.
- 40°C의 수조에 50 mL의 HBSS를 함유한 125 mL 플라스크를 담급니다. 이것은 초기 플러싱에 사용됩니다.
- 가위와 집게와 같은 모든 기기의 표면에 70% 에탄올을 뿌린다. 깨끗한 면봉몇 개 준비합니다.
- 펌프를 통해 70 % 에탄올을 실행하여 펌프의 튜브를 헹구고 흐르는 물로 두 번 헹구어 잔류 에탄올을 제거하십시오.
- 흡수성 벤치 패드를 실험실 벤치에 놓고 하드 박스 용기를 위에 놓습니다. 이것은 마우스 관류 도중 어떤 과잉 액체든지 포함하는 것을 필요로 할 것입니다. 알루미늄 호일로 폴리스티렌 폼 패드를 감싸고 용기 안에 넣습니다.
- 멸균 10cm 배양 접시를 벤치 가까이에 놓습니다. 이것은 관류가 완료된 후에 소화된 간을 붙들기 위하여 이용될 것입니다.
- 콜라게나아제 배지 10 mL(1.2단계)를 멸균 배양 접시에 미리 붓습니다.
- 날개 달린 혈액 수집 세트를 사용하여 23 게이지를 펌프 튜브의 자유 끝에 연결하십시오 (나비 캐뉼라에서 날개를 자르면 더 나은 핸들링으로 이어질 수 있습니다). 혈액 채취의 캐뉼라 끝이 채워지때까지 통과합니다.
2. 동물 준비
- isoflurane를 사용하여 마취를 시작하기 전에 절차 기간 동안 적절한 양의 공급 가스를 사용할 수 있는지 확인하십시오. 산소 (O2)공급을 1-2 L에서 유도 챔버에 켜고 유량계를 사용하여 2-4 % 사이의 이소플루란을 켭니다.
- 유도 챔버에 마우스를 넣고 상단 문을 닫습니다. 마우스가 다시 작동될 때까지 모니터링합니다.
참고 : 챔버의 가스는 몇 분 동안 마우스를 마취 유지합니다. - 알루미늄 호일로 감싼 폴리스티렌 폼 패드에 마우스를 놓습니다. 유도 챔버에서 노코콘으로 흐름을 전환합니다. 마취가 적절한지 확인하십시오. 마우스가 반응하기 시작하면 완전히 마취될 때까지 코 콘에 부드럽게 억제하십시오.
- 시술 중 호흡과 자극에 대한 반응을 모니터링하여 마취를 보장합니다. 적절한 마취를 보장하기 위해 필요에 따라 속도 유량계를 조정합니다. 발은 마취하에 핀치 테스트에 반응하지 않아야합니다. 동물 관리를 위한 추가 상세 정보는 실험실 가이드로부터 얻을 수 있다.
- 마우스의 네 개의 팔다리를 테이프로 붙이거나 고정합니다.
- 70% 에탄올을 분사하고 거즈와 알코올 패드로 닦아내면 복부 에디멘의 피부를 깨끗하게 합니다. 이 단계는 마우스 퍼의 오염을 방지하는 데 중요합니다.
- 멸균 가위 세트를 사용하여 앞쪽에서 골반 뼈까지 피부를 넓게 잘라냅니다. 내부 장기를 자르지 않도록주의하십시오. 면 팁 어플리케이터를 사용하여 동물의 왼쪽으로 장의 변위를 하여 문맥(PV)과 열등한 정맥(IVC)을 부드럽게 노출시십시오.
3. 통조림 및 관류 (0.5 시간)
- 구부러진 집게를 사용하여 문 정맥 아래에 스레드를 놓고 매듭을 느슨하게 묶어 통조림 후 단단히 조여냅니다.
- 캐뉼라 (혈액 채취 세트에서 23G)를 합자 아래 5-10mm의 문맥에 삽입하십시오. 그렇지 않으면 오른쪽 전방 엽이 부적절하게 perfused 될 수 있습니다, 첫 번째 포털 분기 를 지나 캐뉼라를 삽입하지 마십시오. 캐뉼라는 스토퍼 매듭을 사용하여 스레드로 고정하거나 고정 할 수 있습니다.
- 펌프를 시작하여 낮은 유량(1-2mL/min)으로 HBSS에 주입합니다. 통조림이 성공으로 확인되면 간이 희미해지기 시작합니다.
- 압력을 완화 하 고 배수 간 내 과도 한 액체를 허용 하기 위해 IVC를 잘라. 캐뉼라가 이동되지 않도록 다른 손으로 연산자를 사용하여 수행하는 것이 가장 좋습니다.
- 천천히 8 mL /min로 유량을 증가시키고 다음 5 분 동안 간을 통해 HBSS의 전체 50 mL 부피를 사용하여 관류를 완료하십시오.
- HBSS가 다 소진되기 직전에 배지(1.2단계)를 함유한 콜라게나아제들을 비커로 바꾼다. 기포가 존재하지 않고 매체를 변경할 때 간으로 흘러 들어가지 않도록 하십시오.
- 집게로 클램핑하여 5s 간격으로 IVC에 과도 압력을 가합니다. 이것은 간이 팽창하고 조직 소화 및 해리를 돕습니다 (7-8 분). 소화가 진행됨에 따라 간은 부풀어 오며 하얗게 됩니다. 간은 원래 크기의 약 두 배로 균일하게 팽창 할 수 있습니다.
- 소화가 완료되면 펌프를 끄고 캐뉼라를 제거합니다. 간 소화의 완료는 마우스의 크기와 간 상태에 따라 달라집니다. 면 팁 어플리케이터를 사용하여 간을 부드럽게 탐사하면 간에서 움푹 들어간 곳을 관찰 할 수 있습니다.
- 간에서 담낭을 제거, 그것을 찢어하지 않도록주의. 세척된 가위와 집게를 사용하여 마우스에서 간을 표면 세척을 위해 인산완충식염수(PBS)를 함유한 멸균 된 10cm 배양 접시로 추출합니다. 콜라게나아제 배지가 함유된 멸균 10cm 배양 접시에 간을 조심스럽게 옮김(1.8단계부터). 이것은 마우스 혈액과 담즙에서 오염을 피하기위한 중요한 단계입니다.
- 간에서 세포를 부드럽게 흔들면서 두 개의 깨끗한 집게로 간을 잡고 찢어버십시오. 이 경우 미디어는 흐려집니다. 모든 간세포는 결합 조직과 혈관 조직을 남기고 멀리 흔들 릴 수 있습니다.
- 간장의 소화되지 않은 부분이 흔들릴 때까지 3 mL 주사기를 사용하여 세포 용액을 여러 번 삼중화하십시오. 70 μm 나일론 세포 스트레이너가있는 50 mL 원엽 튜브에 부어 소화되지 않은 결합 조직을 필터링하십시오. 나머지 세포를 수집하고 50mL 원엽 튜브를 채우기 위해 HBSS로 접시를 씻으십시오.
- 원심분리기는 50 x g에서 스윙 버킷 로터에서 50 mL 원엽 튜브를 4°C에서 10분 동안 부드럽게 한다.
- 상급체를 새로운 50 mL 원유관으로 옮김.
4. 전기 자동차 분리 (5 시간)
- 4°C에서 10분 동안 300 x g에서 상원지를 한다. 상급체를 새로운 50 mL 원유관으로 옮김.
- 4°C에서 20분 동안 2000 x g에서 상원지를 제거하여 세포 파편 및 응집체를 제거하였다.
- 상급체를 둥근 바닥 튜브로 옮기고 4°C에서 70분 동안 10,000 x g의 상급원지를 원심분리합니다.
- 상급체를 수집하고 4 °C에서 70 분 동안 100,000 x g에서 폴리 카보네이트 초원심분리기 튜브 및 원심 분리기에 놓습니다.
- 다음 PBS에서 다시 일시 중단하여 세척되는 초원심분리튜브에 펠릿을 수집합니다. 4°C에서 70분 동안 100,000 x g에서 상원지를 더 심분리한다.
- 세포 나노베시클으로 구성된 최종 펠릿은 1000 μL의 PBS로 실험또는 재부유및 -80°C에서 저장되는 실험에 직접 사용될 수 있다.
5. 격리의 품질 및 수율 평가
- 기기 제조업체의 프로토콜에 따라 나노입자 추적 분석 또는 조정 가능한 저항 펄스 감지를 사용하여 크기 분포 및 농도를 평가합니다.
- 특정 실험 적 필요에 기초하여 자당 그라데이션 또는 쿠션, 면역 affinity 기술 또는 크기 배제 크로마토그래피의 첨가와 같은 다양한 접근법에 의해 특정 소포 집단의 추가 절연 및 정제를 수행한다.
결과
이러한 격리에 필요한 장치는 표준 실험실 장비로 구성되므로 비교적 간단하고 비용 효율적인 접근 방식입니다. 격리는 12-30 주 된 남성과 여성 Balb/c 또는 FVB 마우스에서 수행 되었습니다. 마우스를 들고 트레이는 관류 중에 여분의 유체를 수집하는 단단한 벽 컨테이너 내부에 알루미늄 호일로 줄 지어있습니다. HBSS 또는 콜라게나아제 함유 배지를 함유하는 플라스크는 사용 가능한 수조(40°C)에 침수됩니다. 2 개의 멸 균 10cm 배양 접시가 사용 됩니다. 하나는 PBS로 표면 세척에 필요하고, 다른 하나는 결합 조직 구성 요소로부터 간세포 분리를 위해 필요합니다.
이 방법에서, 간은 열등한 정맥으로부터 의한 통조림에 우선순위로 문맥을 통해 비연속적인 방식으로 관영된다. 대안적이고 일반적으로 사용되는 관류 접근법은 열등한 정맥을 캐뉼링하고 배수를 위한 문맥을 절단하여 역행 관류를 수행하는 것입니다. 그러나, 문맥 통조림은 접근하기 쉽고, 문맥이 간으로 직접 공급되기 때문에 간까지 짧은 거리를 포함한다8. 캐넌레이션을 위한 삽입 점의 선택은 최적의 성공을위해 매우 중요합니다(그림 2). 캐뉼라는 위와 췌장 정맥의 가지를 지나서 있지만 첫 번째 포털 지점 (오른쪽 및 왼쪽 간 포털 정맥)을 넘어서는 것은 아닙니다. 포털 정맥의 최적의 삽입 위치가 확인되면 곡선 집게를 사용하여 문 정맥 아래에 스레드를 배치하고 느슨한 매듭을 묶습니다. 캐뉼라의 바늘은 바늘이 떨어지는 것을 막기 위해 스토퍼 매듭을 사용하여 실로 고정됩니다.
도 3은 간 조직 EV 격리에 대한 차동 원심분리에 대한 전반적인 처리 체계를 간략하게 설명한다. 초원심분리는 세포, 파편 및 기타 불순물을 제거합니다. 처음 네 개의 원심 분리 단계 (50 x g, 300 x g, 2,000 x g, 10,000 x g)는 간세포를 제거하도록 설계되었으며, 그대로 다른 세포, 죽은 세포 또는 세포 이물질을 각각 제거하도록 설계되었습니다. (그림4A 및 4B). 이러한 단계 후, 초원심분리는 펠릿을 수집하기 위해 100,000 x g에서 다시 수행된다(도4C). 펠릿은 PBS에서 재중단하여 세척하고 100,000 x g에서 최종 초원심분리를 실시합니다. 초원심분리 후 펠릿은 컨디셔닝 된 배양 배지에서 EV에 비해이 절차에서 절대적으로 눈에 띄고 점색됩니다. 갈색 골재가 보이지 않아 완전히 용해될 때까지 여러 번 파이펫팅이 필요합니다. 최종 펠릿은 PBS의 1000 μL로 다시 부유한다(도4D). 초원심분리는 플라즈마에서 불순물 및 기타 수용성 오염물질을 제거하여 기능적인 실험 결과에 영향을 줄 수 있습니다. 원심분리는 4°C에서 수행된다.
마우스 간에서, 이 방법은 나노 입자 추적 분석 (NTA)에 의해 결정된 바와 같이 mL당 3.46 x 1012 입자의 평균으로 1.74 에서 4.00 x 1012 범위의 조직 EV 농도를 산출한다 (그림 5). 단리된 간 조직 EV의 평균 크기는 157.7 nm, NTA에 의해 100-600 nm에 이르는 144.5 nm 및 EV 크기의 모드 크기였다. EV의 수율은 이백 또는 초원심분리 단계 내의 간 무게 및 손실과 같은 요인에 달려 있습니다.
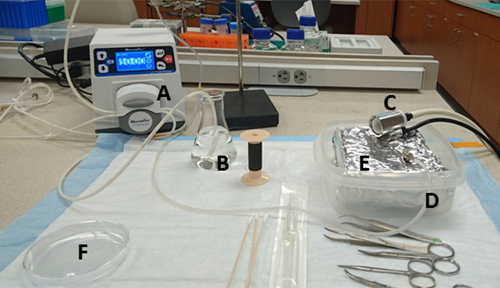
그림 1 : 벤치 준비. 재료 및 그 위치는 다음과 같습니다 : (A) 펌프, (B) HBSS 및 물 흡입 포트를 포함하는 125 mL 플라스크, (C) 코 콘이 이소플루란 기화기와 연결된 펌프의 (D) 물 배기 포트, (E) 내부에 알루미늄 호일로 줄 지어 있는 펌프의 단단한 벽으로 둘러싸인 용기, (F) 10cm 배양 접시에 콜라게나아제 배지를 미리 붓는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
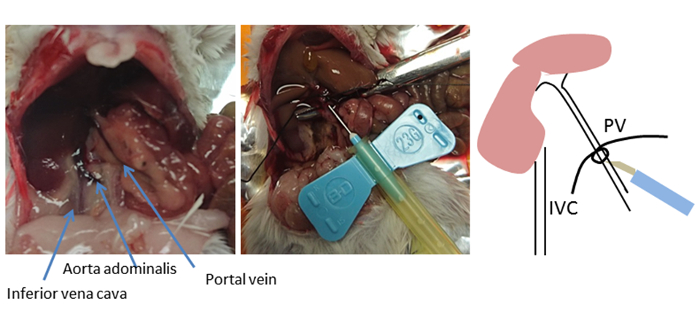
그림 2 : 통조림 사이트. 마우스 복부의 해부학이 표시됩니다. 곡선 집게를 사용하면 스레드가 포털 정맥(PV) 아래에 배치되고 느슨한 매듭이 연결됩니다. 삽입 위치는 간 근처, 합자 아래 5-10 mm, 하지만 첫 번째 포털 분기 를 넘어 (왼쪽과 오른쪽 간 포털 정맥). 캐뉼라는 스토퍼 매듭이있는 스레드를 사용하여 고정되거나 고정됩니다. 이 매듭은 캐뉼라가 빠진 경우 PV 위치의 마커 역할을 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
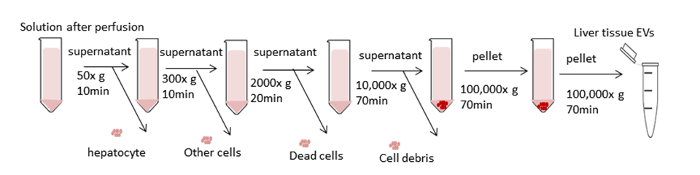
그림 3 : 원심분리단계의 개략성. 목표는 원치 않는 세포 및 기타 구성 요소를 제거하고 전기 를 격리하는 것입니다. 처음 네 개의 원심분리 단계는 차동 원심분리를 사용하여 간세포 및 기타 세포, 죽은 세포 또는 세포 파편을 제거하도록 설계되었습니다. 이러한 단계 후, 초원심분리는 100,000 x g에서 수행되어 전기 자동차 펠릿을 수집합니다. 펠릿은 PBS에서 재중단하여 세척하고 100,000 x g에서 최종 초원심분리를 실시합니다. 모든 원심분리 단계는 4°C에서 수행된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
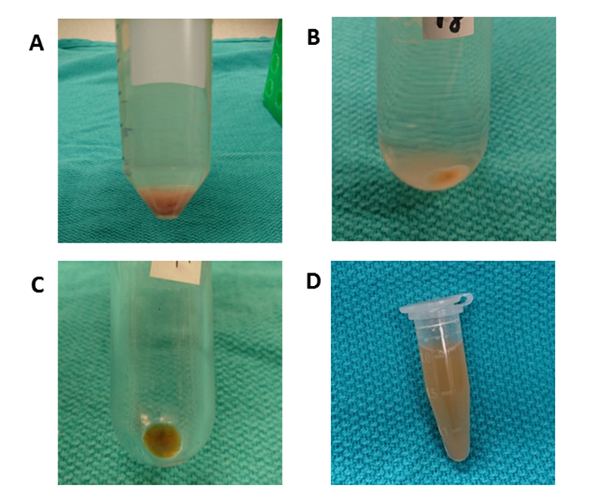
그림 4 : 차동 원심분리. (A) 10 분 동안 50 x g에서 원심 분리 후 간세포가 함유 된 펠릿이 관찰됩니다. (B) 둥근 바닥 튜브는 세포 파편을 제거하기 위해 70 분 동안 10,000 x g에서 원심 분리에 사용됩니다. (C) 폴리 카보네이트 초원심지 튜브는 70 분 동안 100,000 x g에서 원심 분리에 사용됩니다. 펠릿은 하나의 튜브에서 수집되고 PBS로 다시 중단하여 세척됩니다. (D) 최종 펠릿은 PBS의 1000 μL에서 다시 부유한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
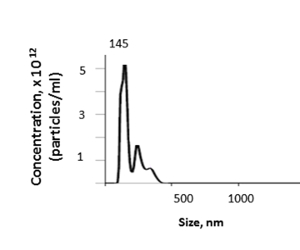
그림 5 : 대표적인 결과. 간 조직 EV의 크기 및 농도는 나노 입자 추적 분석 (NTA)에 의해 결정될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 체동 초원심분리에 이어 문맥을 통한 2단계 관류 과정을 이용하여 간 조직 EV의 격리를 위한 최적이고 재현 가능한 방법을 설명한다. 절차의 중요한 단계는 캐뉼라 배치, 콜라게 나아제 농도 및 소화 시간, 배지의 유속, 소화 후 조직 처리 및 고전적인 차동 초원심분리를 포함합니다.
세포 분리는 콜라게나아제 타입 IV를 사용하여 소화 후 결합 조직 구성 요소로부터 분리함으로써 달성됩니다. 관류에 사용되는 콜라게나아제의 농도는 0.1에서 5 mg/mL까지 다양합니다. 조직 소화를 위한 콜라게나아제의 효능에 상당한 배치-배치 변화가 있을 수 있습니다. 0.5 내지 5 mg/mL의 콜라게나아제 농도를 시험하였지만, 사용된 농도는 얻어진 EV의 수율에 큰 영향을 미치지 않았다. 콜라게나아제의 높은 농도를 사용하면 간이 더 빠른 붓기와 미백이 발생합니다. 목표는 과도한 오염이나 손상없이 만족스러운 세포 해리를 얻는 것입니다. 이러한 격리에 사용되는 콜라게나아제의 최적 농도는 8 mL/min의 유량으로 7-8분 동안 1-2 mg/mL로 교배됩니다. 너무 긴 관류 절차는 간 내의 얇은 결합 조직을 파괴의 리스크를 증가할 뿐만 아니라 문맥 에서 바늘 dislodgment 또는 정맥으로 공기 트랩핑과 같은 기술적 위험을 증가시킬 것입니다.
이 프로토콜의 가장 어려운 측면은 포털 정맥의 통조림입니다. 이것은 18- 25-g 크기 범위에 있는 마우스에서, 특히 능력을 발휘하기 어려울 수 있습니다. 콜라게나아제 관류 기술은 원래 쥐에 사용하기 위해 개발되었으며, 이후 수많은 수정 및 조정 후에 마우스에서 사용하기 위해 채택되었습니다. 23G 혈액 수집 세트를 사용하여 통조림은 작은 발광 직경의 혈관에 카테터를 배치하는 것보다 쉽습니다. 마개 매듭으로 스레드를 사용하여 캐뉼라를 고정하는 것이 좋습니다.
다운스트림 분석의 경우 세포로부터의 오염을 최소화하는 것이 매우 중요합니다. 소화 후 조직 처리에 몇 가지 중요한 고려 사항이 있습니다. 첫째, 혈액 오염을 피하기 위해 간을 추출 할 때 집게와 가위가 변경됩니다. 둘째, 담낭이 담즙에서 찢어지고 원치 않는 오염을 피하기 위해 간에서 조심스럽게 제거하는 것이 중요합니다. 셋째, 간이 마우스에서 제거되면, 간은 혈액을 제거하기 위해 PBS를 사용하여 매우 부드럽게 세척됩니다. 셀로 오염을 최소화하는 것은 얻어진 EV의 수율 감소보다 더 높은 우선 순위를 부여해야 한다.
초원심분리는전기자동차8, 9,10,11의분리 및 정화를 위해 가장 일반적으로 사용되는 방법이다. 이 접근법은 간세포 또는 담관엽세포 및 Kupffer 세포, 정현파 내피 세포 및 별과 같은 비-실화 세포와 같은 대부분의 실치세포를 제거할 것이며, 또한 세포 파편, 세포 응집 및 죽은 세포도 제거될 것이다. 분동 원심분리에 의해 제거됩니다. 특정 집단의 추가 정제 및 격리는 임의의 비-비-비-비-비-비-비-비-비-비질단백질 응집체 또는 지단백질을 제거하기 위해 크기 배제 크로마토그래피에 의해 수행될 수 있다.
이 프로토콜의 한계는 일부 소포가 향수에서 제거 될 수있는 가능성을 감안할 때 모든 조직 소포를 캡처하지 않을 수 있다는 것입니다. 글로벌 평가가 필요한 경우, 향수의 수집과 향수 내소포의 분리를 고려해야합니다. 추가 제한은 세포 손상에 대 한 잠재력. 과도한 세포 사멸의 잠재적 영향을 모니터링하기 위해, 세포 생존능력을 모니터링하고 조직 EV 격리에 대한 품질 매개 변수 내에 통합 할 수 있습니다. 결론적으로, 이 절차는 높은 수율에서 마우스 간에서 간 조직 EV를 얻기 위한 분별 초원심분리에 선행된 문맥을 통해 2단계 관류 기술을 사용하여 최적화된 워크플로우를 기술한다. 이러한 조직 EV는 생물분자 조성물의 특성화 및 질병 마커로서의 생리적 또는 병리생리학적 역할 또는 잠재적 응용을 특성화하는 것을 목표로 하는 다른 연구의 특성화와 같은 다운스트림 분석에 적합합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 연구는 국립 암 연구소 그랜트 CA-217833에서 자금지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
참고문헌
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , Chapter 3 (Unit 3.22) (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유