Method Article
בידוד של מסחטות ושלפוחיות רקמה מהכבד
In This Article
Summary
זהו פרוטוקול לבידוד ושלפוחיות רקמות (EVs) מהכבד. הפרוטוקול מתאר תהליך דו-שלבים המעורב בקולגן ומלווה באמצעות מעקב דיפרנציאלי לבידוד רקמת הכבד EVs.
Abstract
שלפוחית שלפוחיות (EVs) ניתן לשחרר מסוגים רבים של תאים שונים וזיהה ברוב, אם לא כל, נוזלי הגוף. EVs יכול להשתתף בתקשורת תא אל התא על ידי שוליים מולקולות אקטיביים כגון RNA או חלבון מתא אחד למשנהו. רוב המחקרים של EVs בוצעו במודלים של תרבות התא או בEVs מבודדים מנוזלי הגוף. יש עניין המתעוררים בבידוד של EVs מרקמות ללמוד את תרומתם לתהליכים פיסיולוגיים וכיצד הם שונו במחלה. הבידוד של EVs עם תשואה מספקת מרקמות הוא מאתגר מבחינה טכנית בגלל הצורך לדיסוציאציה רקמות ללא נזק תאי. שיטה זו מתארת הליך לבידוד של EVs מרקמת הכבד של העכבר. השיטה כרוכה בתהליך של שני שלבים החל מתוך העיכול באתרו , ולאחריו באולטרה-צנטריפוגה דיפרנציאלי. הפרזיה רקמה באמצעות הקולגן מספק יתרון על פני גזירה מכנית או הומוגון של רקמת הכבד בשל התשואה מוגברת של השיג EVs. השימוש בתהליך שני שלבים זה כדי לבודד EVs מן הכבד יהיה שימושי לחקר EVs רקמות.
Introduction
שלפוחיות שלפוחית (EVs) הם ממברנה מאוגד ושלפוחיות שפורסמו מסוגים רבים של תאים שונים בגוף. EVs מכילים מטען של מולקולות הכוללות RNA, DNA, ו חלבון. העברת מטען זה על-ידי EVs מתא אחד למשנהו היא היסוד כמנגנון אחד שדרכו תאים בתוך הרקמות לתקשר אחד עם השני1. רוב המידע לגבי המטען או התפקידים של EVs בריאות רגילה ומחלות נגזר ממחקרים על EVs שהתקבלו מתאים בתרבות או שנאספו מהדם או נוזלי גוף אחרים2. כדי להבין את התפקידים הפיזיולוגיים שלהם ב vivo, שיטה איתנה היא הכרחית לבידוד של EVs רקמות לוכדת את כל האוכלוסיות של EVs ונמנע נזק הסלולר או זיהום3. המטרה הכוללת של השיטה המתוארת בזאת היא לבודד רקמות EVs מפני כבדי העכבר.
רוב סוגי התא בכבד הוכחו לייצר EVs, והמחקר של איתות EV מבוסס מקדמת ידע בסיסי והבנה של מחלות הכבד. עם זאת, ההשפעה המשולבת של EVs מסוגי תאים שונים בתוך הרקמות מובנת רק חלקית. בידוד של EVs מרקמות הכבד הוא הכרחי כדי להבין את התרומות באתרו של EVs בתוך הסביבה רקמות. הגישה המתוארת במסמך זה מבוססת על שילוב של שני שלבים כדי לשפר את הדיסוציאציה של הרקמה ולמזער את נזקי התאים. לאחר מכן, EVs מבודדים מרקמת הכבד שהונתק. מתחילת שנות ה-50 של המאה העשרים, שימשו הגישות לבידוד של הפאציטים בשני שלבים. שיטות אלה לבידוד הפציט שונו והשתפרו ברציפות וכיום גישות סטנדרטיות לבידוד של הפטציטים בתרבויות, בתא השעיות, ומרקמות5,6,7. בשלב הראשון, הכבד הוא נתון לפרזיה ללא הסדר מחודש עם מאגר נטול סידן, תמיסת מלח מאוזנת של האנק (HBSS). בשלב השני, הכבד מיועד עם הקולגן כדי לפזר את מטריצת החילוץ עבור הפרדה נוספת של הצמתים מפני תא desmoזומתיים. זמן טיפול אופטימלי עבור התפרקות הקולגן הוא 7 עד 10 דקות. משך הטיפול הקצר יגרום לפירוק שלם ולשמירה על הקשר התאי בכבד, ואילו משך זמן ארוך יותר עלול לגרום לנזק בכבד או להפרעה בווריד השער. EVs מבודדים אז באמצעות צנטריפוגה דיפרנציאלי להסרת תאים ופסולת סלולרית. התוצאה היא אוסף EV בתשואות גבוהות, כי ניתן להשתמש עבור ניתוח נוסף במורד הזרם או לימודים.
Protocol
כל המחקרים הכרוכים בבעלי חיים בוצעו בהתאם לפרוטוקול שאושר על ידי הוועדה לטיפול בבעלי חיים מוסדיים של מאיו מרפאת ושימוש.
1. הכנת ספסל
- הכן מרחץ מים והגדר אותו ל-37 ° c. הציוד וההגדרה האחרים הנחוצים מוצגים באיור 1.
- למדוד 100 מ"ג של הקולגן מסוג IV ולהוסיף אותו בקבוקון 125 mL המכיל 100 mL של HBSS באמבט מים (40 ° c). ודא כי הקולגן הומס כבר התפרקה על ידי מתערבל את הנוזל בבקבוקון, וגם לוודא כי הבקבוקון מתחת למים לחלוטין באמבטיה. ליעילות רבה יותר, לאפשר את הקולגן כדי לפזר לפחות 30 דקות למרות שהוא עשוי להיראות להתמוסס באופן מיידי.
- לטבול בקבוקון 125 mL המכיל 50 mL של HBSS באמבט מים ב 40 ° c. זה ישמש עבור השטיפה הראשונית.
- רסס את פני השטח של כל המכשירים כגון מספריים מלקחיים עם 70% אתנול. הכינו כמה מטליות כותנה נקיות.
- לשטוף את אבובים של המשאבה על ידי הפעלת 70% אתנול דרך המשאבה ולהסיר כל אתנול שיורית על ידי שטיפה אותו פעמיים עם מים זורמים.
- הניחו משטח ספסל סופג על ספסל המעבדה והניחו מכולה בקופסה קשה למעלה. זה יהיה צורך להכיל כל הנוזלים עודף במהלך perfusion העכבר. עוטפים משטח פוליסטירן מוקצף עם רדיד אלומיניום ומניחים אותו בתוך המיכל.
- מניחים צלחת תרבותית 10 ס מ קרוב הספסל. זה ישמש להחזיק את הכבד מתעכל לאחר זלוף הושלמה.
- יוצקים 10 מ ל של קולגן בינוני (שלב 1.2) לתוך תבשיל תרבות סטרילית מראש.
- באמצעות ערכת איסוף דם כנפיים, לחבר את 23 מד לקצה החופשי של צינורות המשאבה (חיתוך כנפיים מתוך צינורית פרפר יכול להוביל לטיפול טוב יותר). לעבור עד קצה הצינורית של איסוף הדם מתמלא.
2. הכנה לבעלי חיים
- לפני תחילת ההרדמה באמצעות isofלאנה, ודא שכמות מספקת של גז האספקה זמינה למשך ההליך. הפעל את החמצן (O2) לחדר אינדוקציה ב 1-2 L, ואז להפעיל את isof, בין 2-4% באמצעות flowmeter.
- הכניסו את העכבר לחדר האינדוקציה וסגרו את הדלת העליונה. נטר את העכבר עד שהוא שכיבה.
הערה: הגזים בחדר ישמור על העכברים מורדם למשך מספר דקות. - מניחים את העכבר על משטח קצף קלקר עטוף ברדיד אלומיניום. . העבר את הזרם מחדר האינדוקציה לנוס1 . תוודא שההרדמה מספיקה אם העכבר התחיל להגיב, בעדינות לרסן אותו בקונוס אף עד שהוא מורדם לחלוטין.
- להבטיח הרדמה על ידי ניטור נשימה ותגובה גירוי במהלך ההליך. התאימו את הקצב flowmeter לפי הצורך כדי להבטיח הרדמה נאותה. כפות הרגליים בטח לא מגיבות. לבדיקת הצביטה בהרדמה פרטים נוספים ניתן לקבל ממדריך המעבדה לטיפול בבעלי חיים.
- קלטת או להצמיד את כל ארבעת הגפיים של העכבר.
- נקה את העור על הבטן על ידי ריסוס עם 70% אתנול וניגוב אותו עם גזה וכרית אלכוהול. שלב זה הוא קריטי כדי למנוע זיהום מפרוות העכבר.
- לעשות חתך רחב לחתוך דרך העור מן הקדמי אל עצם האגן באמצעות סט של מספריים סטרילי. היזהרו לא לחתוך איברים פנימיים. הגבר את המעיים לצד שמאל של בעל החיים באמצעות כותנה משופעת בעדינות כדי לחשוף את הווריד הפורטל (PV) והוריד הנחות (IVC).
3. צינורית ופרזיה (0.5 h)
- שימוש מלקחיים מעוקל, המקום חוט מתחת לווריד השער ולקשור קשר באופן רופף כדי להכין הדוק לאחר הצינורית.
- הכנס את הצינורית (23G מערכת איסוף הדם) לתוך הווריד השער 5-10 מ"מ מתחת לקשירה. אין להכניס את הצינורית לעבר ענף הפורטל הראשון, אחרת האונה הקדמית הימנית יכולה להיות מספקת. הצינורית יכולה להיות קבועה או מהודקת עם פתיל באמצעות קשר פקק.
- הפעל את המשאבה כדי להחדיר HBSS בקצב הזרימה נמוכה (1-2 mL/min). ברגע שהצינורית תאשר. שתצליח, הכבד יתחיל להתנחל
- חותכים את ה-IVC כדי להקל על הלחץ ולאפשר נוזלים מוגזמת בתוך הכבד כדי לנקז. הדבר הטוב ביותר נעשה באמצעות מפעילי היד האחרת כך שהצינורית לא תועבר.
- לאט להגדיל את קצב הזרימה של 8 mL/min ולהשלים את הפרפיוז באמצעות הנפח כולו 50 mL של HBSS דרך הכבד, במהלך 5 דקות הבאות.
- לשנות את הקולגן המכיל בינוני (שלב 1.2) לתוך הגביע ממש לפני HBSS מתחיל לרוץ החוצה. ודא כי בועות אוויר אינם נוכחים ולא לזרום לתוך הכבד בעת שינוי המדיום.
- החל לחץ ארעי על ה-IVC במרווחי זמן של 5 על ידי העצמה עם מלקחיים. זה יגרום לכבד להתנפח ולעזור עם עיכול והדיסוציאציה של רקמות (7-8 דקות). ככל שעיכול מתקדם, הכבד יהיה מתנפח והופך לבן. הכבד יכול להתנפח בצורה אחידה כפליים מגודלה המקורי.
- כבו את המשאבה והסירו את הצינורית לאחר השלמת העיכול. השלמת עיכול הכבד יהיה תלוי בגודל של העכבר והמצב של הכבד. שקע בכבד ניתן להבחין אם המוליך משופעת כותנה משמש כדי לחקור בעדינות את הכבד.
- , להסיר את כיס המרה מהכבד. להיזהר לא לקרוע אותו באמצעות זוג שטוף של מספריים ומלקחיים, לחלץ את הכבד מהעכבר לתוך מאכל מעוקר 10 ס מ המכיל מלוחים פוספט באגירה (PBS) עבור שטיפת פני השטח. העבר את הכבד בזהירות לתוך המנה סטרילי 10 ס מ תרבות המכילה קולגן בינוני (משלב 1.8). זהו צעד קריטי עבור הימנעות זיהום דם העכבר מרה.
- לתפוס ולקרוע את הכבד עם שני מלקחיים נקיים תוך לטלטל בעדינות את התאים מהכבד. כשזה יקרה, המדיום. יהיה מעורפל כל הפטוציטים יכולים להיות מזועזעת, להשאיר מאחורי רקמת החיבור ורקמת כלי הדם.
- Triturate פתרון התאים פעמים רבות באמצעות מזרק 3 מ ל עד החלקים הבלתי מתעכל של הכבד מזועזעת. יוצקים את זה לתוך שפופרת 50 mL עם 70 מיקרומטר תא ניילון לסנן כל רקמת חיבור שלא מתעכל. לשטוף את הצלחת עם HBSS לאסוף את התאים הנותרים ולמלא את הצינור 50 mL חרוט.
- צנטריפוגה בעדינות את צינור 50 mL ברוטור דלי מנופף ב 50 x g עבור 10 דקות ב 4 ° c.
- העבר את הסופרנטנט לשפופרת חרוט חדשה 50 mL.
4. בידוד של EVs (5 שעות)
- צנטריפוגה את הסופרנטנט ב-300 x g במשך 10 דקות ב -4 ° c. העבר את הסופרנטנט לתוך צינורית חרוט 50 mL חדשה.
- צנטריפוגה את supernatant ב 2000 x g עבור 20 דקות ב 4 ° צ' כדי להסיר פסולת תא ואגרגטים.
- העבר את הסופרנטאנט לצינור התחתון עגול ולצנטריפוגה את supernatant ב 10,000 x g עבור 70 דקות ב 4 ° c.
- לאסוף את supernatant ואת המקום לתוך שפופרת פוליקרבונט ultracentrifuge ו צנטריפוגה ב 100,000 x g עבור 70 דקות ב 4 ° c.
- לאסוף את הגלולה בצינור ultracentrifuge אשר נשטף אז על ידי השעיית מחדש ב-PBS. צנטריפוגה את הסופרנטנט עוד ב 100,000 x g עבור 70 דקות ב -4 ° c.
- הגלולה האחרונה המורכבת של ננו שלפוחית תאית ניתן להשתמש ישירות עבור ניסויים או מחדש מושעה עם 1000 μL של PBS ומאוחסן ב-80 ° c.
5. הערכת איכות ותשואה של בדלציות
- העריכו את התפלגות הגודל והריכוז באמצעות ניתוח מעקב ננו-חלקיק או הדופק התנגדות מסוגל חישה לאחר הפרוטוקולים של יצרן המכשיר.
- ביצוע בידוד נוסף וטיהור של אוכלוסיות שלפוחית מיוחדות בגישות שונות כגון תוספת של מעבר שיפוע או כרית, טכניקות של זיקה חיסונית או כרומטוגרפיה של החרגת מהגודל, בהתבסס על צרכים ניסיוניים ספציפיים.
תוצאות
המנגנון הנדרש עבור הבודדים האלה כולל ציוד מעבדה סטנדרטיים, מה שהופך את זה גישה פשוטה יחסית חסכונית. הבודדים בוצעו מ-12 עד 30 שבועות זכר ונקבה Balb/c או FVB עכברים. המגש המחזיק בעכבר מצופה ברדיד אלומיניום בתוך מכולה בעלת חומה קשה האוספת נוזלים מיותרים במהלך הפרזיה. מבחנות המכילות HBSS או קולגן המכילים בינוני מתחת למים באמבטיה (40 ° c) מוכן לשימוש. במסעדה משתמשים בשתי מנות של תרבות בגודל 10 ס מ. אחד צריך לשטוף את פני השטח עם PBS, והשני עבור הפרדה hepatocyte מרכיבי רקמת החיבור.
בשיטה זו, הכבד מושם בצורה לא רציפה דרך וריד הפורטל בהעדפה לצינורית הווריד הנחות. גישה חלופית ובשימוש נפוץ היא לבצע היתוך הנסיגה על ידי canנולה הווריד הנחותים וחיתוך וריד השער לניקוז. עם זאת, הצינורית וריד השער קלה לגישה וכרוכה במרחק קצר אל הכבד, כאשר וריד השער מוזן ישירות לתוך הכבד8. הבחירה של נקודת ההכנסה עבור הצינורית חיונית להצלחה אופטימלית (איור 2). הצינורית מונחת מעבר לענפי הקיבה והלבלב, אך לא מעבר לענף הפורטל הראשון (ורידי הכבד של השער הימני והשמאלי). לאחר מיקום הכניסה האופטימלי בווריד הפורטל מזוהה, מלקחיים מעוקל משמשים למקום חוט מתחת וריד הפורטל ולקשור קשר רופף. המחט של צינורית הוא קבוע עם פתיל באמצעות קשר פקק לעצור את המחט מליפול.
איור 3 מתווה את ערכת העיבוד הכוללת עבור הצנטריפוגה הדיפרנציאלי עבור רקמת הכבד EVs בידוד. הדבר מסיר תאים, פסולת וזיהומים אחרים. ארבעת הצעדים הראשונים צנטריפוגה (50 x g, 300 x g, 2,000 x g, 10,000 x g) נועדו להסיר hepatocytes, תאים אחרים שלמים, תאים מתים, או פסולת תאים בהתאמה. (דמויות 4A ו- 4a). לאחר שלבים אלה, מבוצע שוב ב 100,000 x g כדי לאסוף את הגלולה (איור 4ג). הגלולה הוא שטף על ידי השעיית מחדש ב-PBS ו נתון הסופי הסופית ב 100,000 x g. הגלולה לאחר הניתוח הינה גלויה לחלוטין ומועלת בהליך זה בהשוואה לEVs מתוך מדיה תרבותית ממוזגת. ליטוף פעמים רבות נדרש עד כל אגרגטים חומים הם מחוץ לטווח הראייה התפרקה לחלוטין. הגלולה האחרונה היא מחדש מושעה עם 1000 μL של PBS (איור 4ד). הסרת זיהומים ומזהמים מסיסים אחרים מן הפלזמה, אשר יכולים להשפיע על תוצאות נסיוניות פונקציונליות. הצנטריפוגה מתבצעת ב -4 ° c.
מתוך הכבד של העכבר, שיטה זו מניבה ריכוז מרקמת EV כי נע בין 1.74 אל 4.00 x 1012 עם ממוצע של 3.46 x 1012 חלקיקים ל-mL כפי שנקבע על ידי ננו-חלקיק מעקב ניתוח (ת א) (איור 5). הגודל הממוצע של רקמת הכבד המבודד EVs היה 157.7 ננומטר, עם גודל במצב של 144.5 nm ו-EV גדלים החל 100-600 nm על ידי נ. ב. א. התשואה של EV תהיה תלויה בגורמים כגון משקל הכבד והפסדים בתוך הצעדים המשבאים או ההפוגות.
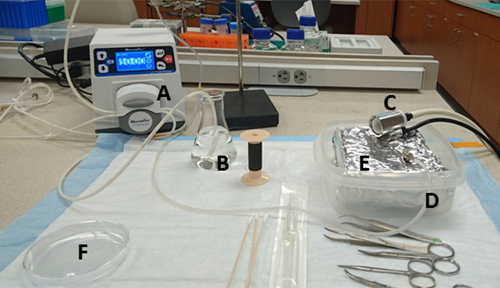
איור 1 : הכנת ספסל. החומרים והמיקומים שלהם הם: (א) משאבה, (ב) שחומם 125 mL בקבוקון המכיל HBSS ושאיבה הנמל, (ג) אף חרוט מחובר מכשיר הוואמסר, (ד) הפליטה המים של המשאבה חיבור עם מחט, (E) מגש מצופה אלומיניום רדיד בתוך מכולה קשה חומה, ו (F) 10 ס מ מאכל התרבות שבו שפכו בינוני הקולגן מראש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
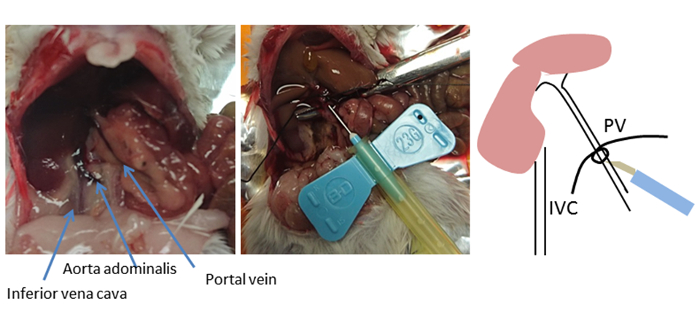
איור 2 : אתר הצינורית. האנטומיה של הבטן של העכבר מוצג. באמצעות מלקחיים מעוקל, הליך ממוקם מתחת לווריד הפורטל (PV) וקשר רופף הוא קשור. מיקום ההכנסה הוא ליד הכבד, 5-10 מ"מ מתחת לקשירה, אבל לא מעבר לענף הפורטל הראשון (ורידי שער הכבד השמאלי והימני). הצינורית קבועה או מהודקת באמצעות פתיל עם קשר בפקק. קשר זה משמש כסמן של מיקום PV אם הצינורית מסומנת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
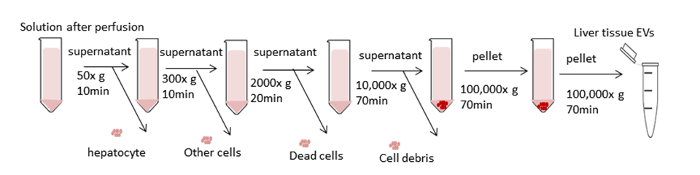
איור 3 : סכמטית של צעדים צנטריפוגה. המטרה היא להסיר תאים לא רצויים ורכיבים אחרים ולבודד EVs. ארבעת השלבים הראשונים הצנטריפוגה נועדו להסיר את hepatocytes ותאים אחרים, תאים מתים או פסולת תא באמצעות צנטריפוגה דיפרנציאלי. לאחר שלבים אלה, מבוצעת הארכה ב 100,000 x g כדי לאסוף את הגלולה של EVs. הגלולה הוא שטף על ידי השעיית מחדש ב-PBS ו נתון הסופי הסופית ב 100,000 x g. כל הצעדים הצנטריפוגה מתבצעים ב -4 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
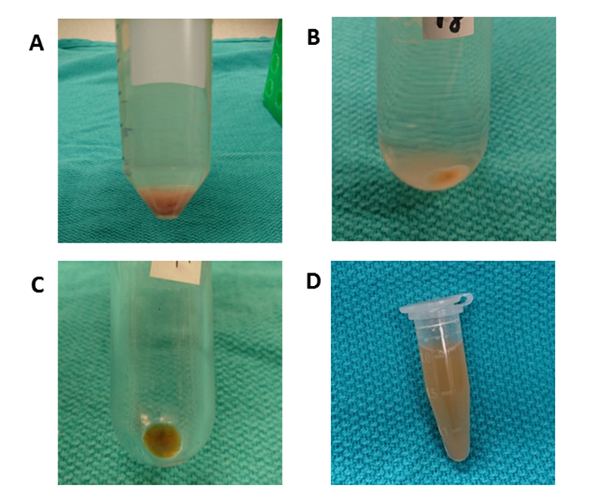
איור 4 : צנטריפוגה דיפרנציאלי. (א) לאחר צנטריפוגה ב 50 x g עבור 10 דקות, גלולה המכילה hepatocytes הוא נצפתה. (ב) צינורית עגולה התחתונה משמשת לצנטריפוגה ב 10,000 x g עבור 70 דקות כדי להסיר פסולת תא. (ג) צינורית פוליקרבונט ultracentrifuge משמשת לצנטריפוגה ב 100,000 x g עבור 70 דקות. הגלולה נאסף בצינור אחד שטף ידי השעיית מחדש עם PBS. (ד) הגלולה האחרונה הוא הושעה מחדש ב 1000 μL של PBS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
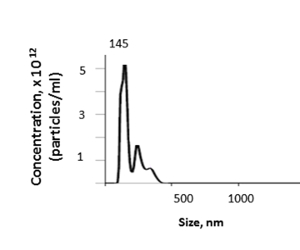
איור 5 : התוצאה הייצוגית. הגודל והריכוז של רקמת הכבד EVs ניתן לקבוע על ידי ניתוח מעקב ננו-חלקיק (נ. ת. ע). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שיטה אופטימלית ומיטבית לבידוד של רקמת הכבד EV באמצעות תהליך של שני צעדים זלוף באמצעות וריד הפורטל ואחריו לאחר ההבדלים הדיפרנציאלי. השלבים החשובים של ההליך כוללים מיקום צינורית, כגון הריכוז וזמן העיכול, מהירות הזרימה של המדיום, טיפול ברקמה לאחר העיכול, והפוגות הדיפרנציאליות הקלאסיות.
הפרדת התא מושגת על ידי הפרדה מרכיבי רקמת חיבור לאחר העיכול באמצעות הקולגן סוג IV. הריכוז של הקולגן בשימוש עבור זלוף יכול לנוע בין 0.1 ל 5 מ"ג/mL. יכול להיות הרבה אצווה-to-אצווה וריאציה על היעילות של הקוליואז לעיכול רקמות. ריכוזי הקולגן של מ0.5 עד 5 מ"ג/mL נבדקו, אבל הריכוז בשימוש לא היה השפעה גדולה על התשואה של EVs השיגה. באמצעות ריכוז גבוה יותר של הקוליגנאז יגרום נפיחות מהירה יותר הלבנת הכבד. המטרה היא להשיג דיסוציאציה תא משביע רצון ללא זיהום או נזק מופרז. ריכוז אופטימלי של הקולגן משמש הבודדים האלה היא 1-2 mg/mL בשימוש עבור 7-8 דקות בקצב הזרימה של 8 mL/min. הליך זלוף ארוך מדי יגדל את הסיכון להרוס את רקמת החיבור הדק בתוך הכבד, כמו גם להגביר את הסיכונים הטכניים כגון מחט dislodgment מן הווריד הפורטל או השמנה אוויר עם הווריד.
ההיבט המאתגר ביותר של פרוטוקול זה הוא הצינורית של וריד השער. זה יכול להיות מאתגר לבצע, במיוחד בעכברים בטווח של 18 עד 25-g גודל. הטכניקות עבור קולגן הקולאז פותחו במקור לשימוש חולדות ולאחר מכן אומצה לשימוש בעכברים לאחר שינויים רבים והתאמות. הצינורית באמצעות מערכת איסוף דם של 23G קלה יותר מאשר הצבת צנתר בכלי הדם של קוטר קטן של לומיאל. תיקון הצינורית באמצעות פתיל עם קשר פקק מומלץ להימנע מdislodgement והקשר משמש גם כסמן של מיקום וריד הפורטל במקרה שהצינורית יוצאת מכלי הקיבול.
עבור ניתוח במורד הזרם, חשוב מאוד לקבל זיהום מינימלי מתאים. ישנם מספר שיקולים חשובים בטיפול ברקמה לאחר העיכול. ראשית, מלקחיים ומספריים משתנים כאשר הכבד מופק כדי למנוע זיהום דם. שנית, זה קריטי כי כיס המרה להיות הוסר בקפידה מן הכבד כדי למנוע קריעה וזיהום לא רצוי של מרה. שלישית, ברגע שהכבד הוסר מהעכבר, הכבד נשטף בעדינות רבה באמצעות ה-PBS כדי להסיר כל דם. מזעור זיהום עם תאים צריך להינתן עדיפות גבוהה יותר מאשר ירידה ביבול של EVs השיגה.
השיטה הנפוצה ביותר לבידוד וטיהור של EVs8,9,10,11. גישה זו תסיר את מרבית התאים הצוכוניים כגון הפטוציטים או תאי המרה ותאים שאינם מצוכוניים כגון תאי קופפר, תאי sinusoidal אנדותל, ותאי stellate, בנוסף, הריסות תאים, הוספת תאים ותאי מוות יהיו גם הוסר על-ידי צנטריפוגה דיפרנציאלי. טיהור נוסף ובידוד של אוכלוסיות ספציפיות ניתן לבצע על ידי הדרה כרומטוגרפיה גודל כדי להסיר את כל אגרגטים חלבונים שאינם מווסיקיות או ליפופרוטאינים.
הגבלה של פרוטוקול זה היא כי הוא עלול לא ללכוד את כל הרקמה שלפוחיות, בהתחשב באפשרות כי כמה שלפוחיות ניתן להסיר בתוך מבשם. אם יש צורך בהערכה גלובלית, יש לקחת בחשבון את אוסף המבשם והבידוד של שלפוחיות בתוך מבשם. הגבלה נוספת היא הפוטנציאל לפגיעה בתאים. כדי לפקח על ההשפעה הפוטנציאלית של מוות תאים מוגזם, הכדאיות התא ניתן לפקח ומשולבים בתוך פרמטרים איכותיים עבור רקמות EV בדלתים. לסיכום, הליך זה מתאר זרימת עבודה ממוטבת באמצעות טכניקת הפרזיה של שני שלבים דרך וריד הפורטל ואחריו באמצעות מעקב דיפרנציאלי משלים לקבלת EVs רקמת הכבד מפני כבדי העכבר בתשואה גבוהה. EVs רקמות אלה מתאימים לניתוח במורד הזרם כגון אפיון של קומפוזיציה ביוקולארית ומחקרים אחרים המטרתם לאפיין את התפקידים הפיזיולוגיים או הפתופיזילוגיים או יישומים פוטנציאליים כסמני מחלות.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה היה נתמך על ידי מימון של המכון הלאומי לסרטן גרנט CA-217833.
Materials
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
References
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , Chapter 3 (Unit 3.22) (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved