Method Article
线虫的核苷酸和蛋白质提取联合
摘要
在这里, 我们提出了一个从同一样本中分离 RNA、DNA 和蛋白质的协议, 以减少变异, 提高重现性, 并促进解释。
摘要
单个生物样本包含大量的信息, 现在的普遍做法是同时研究几个大分子, 以捕捉分子处理的多层次和不同条件之间的变化的全貌。该协议提出了从线虫线虫的同一样本中分离 DNA、RNA 和蛋白质的方法, 以消除这些生物分子从类似处理但最终被复制的复制中分离时引入的变异不同的样品。从线虫中提取核酸和蛋白质, 采用酸性鸟苷-硫氰基-酚-氯仿萃取法, 并对每种物质进行沉淀、洗涤和溶解。我们展示了从三个线虫和平拉细胞的单个样本中成功分离 RNA、DNA 和蛋白质的结果, 在成年动物中具有更好的蛋白质分离结果。此外, 与传统的 RIPA 蛋白质提取相比, 从线虫中提取的 guanidinium 硫氰酸酯-苯酚-氯仿蛋白可提高较大蛋白质的分辨率, 免疫印迹可以提高可检测的检测水平。
本文介绍的方法对于使用多组法调查样本非常有用, 特别是用于蛋白质组和转录组的探索。同时评估多元经济学的技术很有吸引力, 因为复杂生物现象背后的分子信号被认为是在互补的层面上发生的;然而, 越来越普遍的情况是, mRNA 水平的变化并不总是反映蛋白质水平的相同变化, 收集时间与生物钟规定的背景相关。此方法在检测同一样本中的不同内容时, 可消除任何样本间的变化 (在采样范围内)。
引言
多组学是一种使用基因组、蛋白质组、转录组、表观基因组、微生物组或脂质体等组学组合的分析方法, 在处理用于疾病特征鉴定的大型数据集时越来越流行1, 2。越来越多的证据表明, 限制对单个 "ome" 的方法提供了一个不完整的分子分析 (由 Rotroroff 和 Motsinger-Reif1审查)。生成大型数据集, 特别是在使用高吞吐量技术执行屏幕时, 但为了绘制完整的图片或确定最相关的目标, 最好采用多组方法。然而, 随着多组学方法的使用, 经常观察到 mrna 和蛋白质水平 3、4、5、6之间的差异。值得注意的是, 用于 RNA 测序 (RNAseq) 和液相色谱-串联质谱 (LC-MS塞MS) 的并排转录和蛋白质组学分析的 mRNA 和蛋白质, 往往是从经过类似处理的样品中获得的。不同的重复, 可能会引入相同条件之间的变化 3,4,5,6。Harvald 等人进行了一项优雅的线虫饥饿时间过程过程研究, 将野生类型蠕虫的转录组和蛋白质组与缺乏重要的长寿转录 因子的 hlh-30 突变蠕虫的转录组和蛋白质组进行了比较7. 值得注意的是, RNA 和蛋白质是从相同条件下复制的, 因此不是从同一样本中提取的。他们的发现显示, 每个时间点的 mRNA 水平与蛋白质水平之间的相关性较低 (r = 0.559 至 0.628)。事实上, 他们的热图形成了四个集群: i 团的 mRNA 水平大幅下降, 但相应的蛋白质水平几乎没有或根本没有下降, Ii 类细胞的 mRNA 水平几乎没有增加或没有增加, 但蛋白质水平的增加, 第三集团有 mRNA 的增加水平, 但蛋白质水平的下降, 和第四组有 mRNA 水平的增加, 但只有蛋白质水平4的微妙变化。此外, 在没有完全同时采集相同条件的样品的情况下, 也可以引入这种样品间的变化。例如, 由生理周期调节的 mrna 和蛋白质会根据第8、9 天的时间或更具体地说 , 线虫暴露于光9而波动;这些生理蛋白的表达可能会推迟到8小时后, 基因表达诱导10。然而, 这一观察的普遍程度不一定意味着它是错误的;事实上, 这可能被证明是信息性的。蛋白质和 mRNA 在形成和降解之间处于恒定的动态状态。此外, 蛋白质通常在翻译后进行修饰, 以增加稳定性或诱导其降解11。例如, 它们的泛化状态可导致激活或靶向蛋白酶体或溶酶体降解12。此外, 非编码 Rna 在调节转录和转录后13阶段的基因表达方面发挥着重要作用.因此, 问题是如何限制变量, 以确认我们在这些线虫研究中观察到的差异是真实的。
在这里, 我们提出了一种方法, 删除样本间变量, 允许分析不同的大分子从同一样本。该协议的目的是提供一种方法, 从单个线虫样本 (也称为蠕虫) 中持续分离 dna、rna 和蛋白质, 以减少变异, 提高重现性, 并促进解释。使用相同样本的其他好处包括在样品收集过程中节省时间和资源, 促进对有价值和有限的样品进行横截面分析, 包括难以生长和维护的菌株, 以及获得更多深入了解基于 mRNA 和蛋白质水平的检测内变化的大分子的差异调节。
该方法适用于评估单个蠕虫样本的基因表达和蛋白质水平, 从而可以更全面地评估多层次的分子处理。鸟苷硫氰酸酯-苯酚-氯仿 (GTCp) 试剂14是一种常用的分离 rna 的化学物质, 用于从蠕虫身上提取核酸和蛋白质, 并随后对每一种物质进行沉淀、洗涤和增溶。该协议是各种协议15,16的汇编, 稍作修改, 设计的重点是线虫, 但我们也成功地分离出 rna, 蛋白质和 dna 的颗粒的 hela 细胞后,相同的步骤。虽然没有在这里测试, 但这种协议很可能也适用于组织17,18。
研究方案
请注意:每个大分子沉淀步骤按顺序进行, 然后同时进行洗涤;但是, 建议先完成 RNA 隔离, 因为它本质上是不稳定的。
1. 样品收集
- 种子 1, 000个蠕虫蛋每10厘米板材以适当的成长情况19。在20°c 下孵化72小时。
请注意:漂白生育鸡蛋的成年人为了收集鸡蛋, 如前面所述的 19。 - 用约5毫升的 ML 缓冲液清洗盘子, 并将 1, 000只成年蠕虫收集到一个管中。
请注意:MM 缓冲液由 35 mM 磷酸钠二基、102 m 氯化钠、22 mM 磷酸二甲酸钾和 1 mM 硫酸镁在无菌水中组成19。 - 以 1, 000 x克的速度离心蠕虫, 将上清液丢弃, 并将带有1毫升 mL 缓冲液的颗粒蠕虫转移到 1.5 ml 的微离心管中。
- 再次离心在 845 x 克 1分钟, 并丢弃大部分上清液。将颗粒蠕虫存放在-80°c, 至少4小时。
请注意:使用冷冻颗粒比新鲜颗粒产生更高的产量。建议在干冰上使用液氮或95% 乙醇进行一系列冻融循环, 以破解蠕虫角质层。在颗粒上留下少量的 M9 将有助于在冷冻时打破角质层。
2. 核苷酸和蛋白质分离
- 从解冻的颗粒中取出任何上清液, 加入1毫升冷 GTCp 试剂。通过上下移液很好地混合。将样品放在冰上 10分钟, 然后通过倒置偶尔混合。
注意事项:苯酚具有腐蚀性、神经毒性和剧毒, 可能导致化学烧伤和失明。
请注意:我们使用了多达 5, 000只成年蠕虫作为起始材料与报告的体积;每个卷是基于使用1毫升的 GTCp 试剂。使用较大的样品时, 可能需要向上扩展。 - 在蠕虫和 GTCp 溶液中加入200Μl 的冷氯仿。将管子夹在手指之间, 用力摇晃 15秒, 在室温 (RT) 下保持3分钟。
注意事项:氯仿是一种有毒的刺激物, 可能会引起皮肤溃疡和其他器官靶向伤害, 是一种可能的致癌物质。 - 在4°c 条件下, 以 13, 500 x g离心管15分钟。
请注意:在这个自旋后形成三个层: 顶部, 清澈的水相, 底部, 粉红色的有机相, 和小的, 多云的中间相, 包含脂质和 DNA。 - 使用微移液器, 将透明顶层 (水相) 移动到新的无 rnase 1.5 mL 微离心管 (管 a), 通过酒精沉淀分离 rna (如步骤2.5 中详细说明), 并将粉红色层 (有机相) 从剩余的颗粒移动到新的管 (管 B), 并把它放在冰上。
请注意:粉红色的有机相可以在-80°c 下冷冻, 直到从这个样本中分离出 DNA 和蛋白质。较大的样品将在水相和有机相之间产生厚厚的白色层。这个分数包含 DNA。如果可以在不干扰其他阶段的情况下去除这一层, 请这样做, 并将其放入单独的管 (管 B2) 中。 -
将 RNA 隔离如下。
- 从 A 管中清澈的水相中沉淀 RNA, 用500μl 的100% 异丙醇沉淀。在 RT 孵化10分钟。然后, 离心管 A 在 13, 500 x g下 10分钟, 在4°c。
请注意:在试管底部应该可以看到一个白色的小颗粒。 - 装饰大部分的上清液。用针头用1毫升注射器取出其余的, 并丢弃上清液。
请注意:针头的大小并不重要;然而, 一个更大的针表将提供更多的控制, 以避免干扰颗粒。如果没有针头, 可以使用微型移液器。 - 在 a 管中加入1毫升75% 的乙醇来清洗颗粒。在4°c 下, 以 5, 300 x g旋转管5分钟。
- 如步骤2.5.2 所述, 通过脱皮和使用带针头的1毫升注射器将上清液从颗粒中取出, 并将其丢弃。
- 让颗粒风干 5-10分钟, 但不要让它过度干燥。在 rna 颗粒完全透明之前, 使用50Μl 的无 rnase 水重建 RNA 颗粒。
请注意:这是1000–3000蠕虫的足够启动量, 但可能需要根据使用的起始材料的数量进行调整。 - 在55–60°c 下将颗粒培养10分钟以溶解。
- 使用分光光度计测量浓度和纯度。记录吸收率为260纳米, 用于 rna 浓度, 并记录在230和280纳米的吸收率, 以识别任何杂质。
- 通过色谱柱纯化或随后的乙醇清洗和 DNASE 处理, 清除 rna 以去除任何污染物, 如苯酚残留物或 Dna。
请注意:此时, RNA 已准备好用于 RNAseq 分析, 也可用于使 cDNA 用于 RT-qPCR (详见第3.1 节)。RNA 可储存在-80°c, 直到进一步使用。
- 从 A 管中清澈的水相中沉淀 RNA, 用500μl 的100% 异丙醇沉淀。在 RT 孵化10分钟。然后, 离心管 A 在 13, 500 x g下 10分钟, 在4°c。
-
分离 DNA, 如下所示。
- 从 B 管中的粉红色有机相和 B2 管中的样品中, 如果有的话, 通过添加300Μl 的100% 乙醇并通过倒置混合来沉淀 DNA。将地铁在 RT 处停留2-3分钟。
- 在4°c 条件下, 以 375 x g 离心 b 和 B2管, 5分钟, 以颗粒 dna。
- 将上清液从 B 管和 B2 中移, 将其倒入新的2毫升管 (C 管) 中, 并将其留在冰上进行随后的蛋白质分离。用1毫升 0.1 m 柠檬酸钠在10% 乙醇中清洗 b 或 B2 中的 Dna 颗粒 30分钟. 在4°C 下, 在375xg 处, 用 b 管和 B2管清洗5分钟。
请注意:钠与 DNA 主干结合, 使 DNA 在柠檬酸钠和乙醇中更容易沉淀, 从而通过低速离心去除杂质。 - 按照步骤2.6.3 中的说明重复清洗步骤。将颗粒在75% 乙醇的 1.5 mL 中重新使用, 并将其保留在 RT 20分钟, 偶尔通过向上混合。
- 在4°C 下, 以 375 x g 离心管 B 和 B2 5分钟。
- 丢弃上清液, 让其干燥5-10分钟。
- 溶解颗粒在150μl 的 8 Mm 氢氧化钠。如有必要, 使用 HEPES 调整到所需的 pH 值。在4°c 下将样品以 375 x g旋转5分钟。
- 使用微移液器, 将上清液 (DNA) 移动到一个新的管。使用分光光度计测量浓度并确定纯度。记录 DNA 浓度为260纳米, 在230和280纳米时记录吸收率, 以识别任何杂质。
-
分离蛋白质如下。
- 为了沉淀蛋白质, 在 c 管中的粉红色上清液中加入高达 1.5 mL 的100% 异丙醇, 通过多次倒置混合, 并在 RT 孵育10分钟。
- 在 13, 500 x g 的离心管 c, 在4°c 下10分钟。
- 在 RT 中, 在 5300 x g 的离心管 c 中, 在4°c 下用2毫升 0.3 m 鸟嘌呤盐酸2毫升的颗粒在 rt 离心管 C 中清洗 20分钟, 5分钟。
- 按照步骤 2.7.3 2x 中的说明, 重复清洗步骤。
- 将蛋白质颗粒移动到新的 1.5 mL 管 (C2 管), 并将95% 的乙醇加起来达到 1.5 mL。漩涡, 让它坐在 RT 20分钟。
- 离心管 C2 在 5, 300 x g下 5分钟, 在4°c 下。丢弃上清液, 让颗粒在 RT 干燥 10分钟, 在50°c 下溶解500Μl 中的颗粒, 在50°C 下干燥60分钟。
注: 可能需要更长的孵育时间才能完全溶解蛋白质颗粒。过去, 颗粒在不牺牲质量的情况下孵育长达6小时。 - 在 13,500 x g 的离心管 C2, 在17°c 下 10分钟. 将上清液移到新管上。
- 使用与洗涤剂兼容的首选蛋白质定量检测方法测量浓度。
请注意:该蛋白可用于 SDS-PAGE 和西方印迹。它可以存储在-20°c, 供将来使用。对于其他技术, 如 LC-MSMS, 洗涤剂将需要透析关闭。
3. 评估 mRNA 和蛋白质水平
-
RT-qPCR
- 使用以下热环素协议, 用1纳气的 rna 逆转录酶进行逆转录酶制备 cDNA: 启动 (25°c 时 5分钟)、逆转录酶 (46°c 时 20分钟) 和 RT 失活 (95°c 时 1分钟)。
- 在96孔板的单个井中加入100μl 的1:100 稀释剂, 制作一个 cDNA 的股票板。包括适当的控制, 如没有只有温度的井, 以及从1:25 到1:400 的连续稀释样品 (源自所分析的所有样本中的集合 cDNA), 以便为所分析的每个基因建立一个标准曲线, 建立引信效率。
请注意:这种格式可与96井微分配器一起使用, 它允许将板中的所有样品转移到 RT-qPCR 板, 并减少井到井移液的变化。此后, 可以使用多通道移液器将适当的主组合 (例如 SYBR + 引物) 添加到每口井中。总体而言, 这种方法减少了手工移液每个样品时出现的错误, 从而进一步减少了可变性。 - 从股票板中加入3μl 的 cDNA 到 RT-qPCR 板的井中。
- 对每套引物进行主混合, 其中包括1x 的超级混合物, 其中包含 dna 插层氰化物染料, 每个正向和反向引物为 5μm, 每个样品的水最高为7Μl。在 RT-qPCR 板的适当井中加入 7μl, 轻轻搅拌混合。
请注意:包括样本来测量家务基因, 作为参考, 使结果正常化 20。 - 使用适用于所使用引物的 RT-qPCR 协议运行板。
-
西方污点
请注意:有关西方印迹的详细信息, 请参阅马哈茂德和杨21。- 将20μg 的蛋白质与相同体积的 2x Laemmli 样品缓冲器结合起来, 在95°c 下煮沸 10分钟, 为 SDS-PAGE 准备样品。
- 将样品装入 4%--15% 的弗里斯-甘氨酸凝胶, 并以 150 V 的速度运行 1小时, 或者直到染料前部到达凝胶底部。
- 在半液转移装置中, 将蛋白质从凝胶转移到 25 V 的硝化纤维素膜30分钟。
- 用 Ponceau S 染色染色, 确认膜的正确转移。
- 用0.01% 的聚山梨酸盐 20 (TBS-T) 彻底清洗膜上的污渍。
- 在 trt 用5% 的脱脂牛奶在 TBS-T 中阻止膜1小时。
- 根据供应商的建议, 在适当的稀释下对原代抗体中的膜进行培育。将其放置在4°c 的摇杆上过夜。
- 用 TBS-T 清洗膜 3倍, 每次5分钟。
- 根据供应商的建议, 在适当的稀释下将膜在适当的二级抗体中进行培育。把它放在 RT 的摇杆上1小时。
- 用 TBS-T 清洗膜 3倍, 每次5分钟。
- 图像和量化西方污点, 使用首选的方法。
结果
对 RNA、DNA 和蛋白质样本进行了分析, 并介绍了利用 RNA 和分离蛋白的代表性结果。此外, 我们比较了使用 GTCp 方法采集的蛋白质样本与常用的 RIPA 裂解方法22。在我们的实验中, 我们使用了四个独立复制的每个 wt (n2) 蠕虫和两个长寿命突变蠕虫, eat-2和rsks-123,24。
RNA 和 DNA 的数量和质量
在50μl 水中重新悬浮时, RNA 的浓度从0.2–2Μμμl 不等, 使用了大约 3, 000只成年蠕虫作为起始材料。表明纯度的吸收率从22.0 到2.2 不等, a260a280 和1.9 到2.5 的 A260/A230 (表 1) 表明, 在不受 GTCp 成分污染的情况下, 如盐酸苯酚或鸟嘌呤成分成功提取了 rna。
DNA 提取是成功的, 但质量是可变的。在150μl 的 NaOH 中重新悬浮时的 DNA 浓度从0.04 到1.1Μμμl 不等。A260/A280 和0.9 到1.6 的吸收率从1.8 到2.1 不等 (表 1), 表明 dna 的提取是成功的;然而, 有些样品被 GTCp 成分污染, 如苯酚或盐酸鸟嘌呤。如果 DNA 分离是必要的, 在将中间层与 GTCp 相分离分离时必须小心, 并且可能需要进行更多的清洗。
选定目标的 RT-qPCR
从每个蠕虫株的四个独立样本中分离出的 RNA 是成功的, 并被送往 RNAseq 分析, 随后使用含有氰化物染料的超级混合物进行 RT-qPCR。RT-qPCR 分析的目标是根据两个突变体与 WT 蠕虫相比最常见的差异调控基因从一个大型 RNAseq 数据集中选择的。F07C4.1225 是人类神经黄素 3, 异形 b 的同源物, 是选定的共享控制目标。我们还包括了两个突变体mrp-126之间的不同调控基因, 用于额外的分析, 这在eat-2蠕虫中被上调, 但在rsks-1蠕虫中被下调。通过 RT-qPCR 证实了mrp-1的表达变化;然而, RNAseq 分析预测的rsks-1蠕虫的 F07c4.12 可提高未被 Rsks-1 (图 1) 所看到。
还对其他具有抗蠕虫抗体的目标进行了研究。其中包括 Hadwiger 等人的几个细胞器标记。这些标记中的一些在突变蠕虫的 mRNA 水平上有不同的表达。如图 1所示, lmp-128和dlg-129在eat-2蠕虫中被放大;hsp-430、 hsp-7030 和 lmp-1在rsks-1蠕虫中被放大;hsp-6031和pas-732在eat-2蠕虫中被下调;hsf-60和tac-1- 33 在 rsks-1蠕虫中被下调。
同时与 RIPA 蛋白的制备
为了用上述 GTCp 方法肯定蛋白质的效率和质量, 我们将其与使用更传统的 RIPA 裂解22法收集的蛋白质进行了比较.使用相同数量的起始材料, 即只有成年人 (约 10, 000 头蠕虫) 或成人、幼虫和卵 (约 130, 000 蠕虫) 的混合种群, 当 GTCp 在平均端容量中重新悬浮时, 收集的总量较少 (表 1)。);然而, 从成人人口中提取的东西比从混合人口中提取的人更成功。此外, 蛋白质的质量是相似的, 尽管 gtcp 提取的蛋白质显示了更大的蛋白质在总蛋白质的相等负荷下更好的分辨率, 如图 2中的库马西染色所示。事实上,图 3中由西方印迹评估的目标在大多数情况下显示出类似的水平;然而, 大于 75 kDa 的蛋白质在 ripa 提取的蛋白质中显示出较低的水平, 而 gtcp 提取的蛋白质则较低 (图 3A, 右车道;图 3b, 黄色条)。
本文提出的提取方法也在哺乳动物细胞系 HeLa 中进行了评价。作为参考, 用 RIPA 从600万例 HeLa 细胞 (~ 25μl 颗粒) 的紧凑型颗粒中提取的蛋白质含量与从 130, 000个蠕虫混合种群 (~ 75μl 紧凑型颗粒) 中提取的蛋白质含量相当, 约为 10, 000 种小粒中提取的蛋白质的一半。成虫 (约100μl 重力固定颗粒), 如表 1所示。我们表明, 与 HeLa 细胞中的 ripa 提取蛋白质相比, GTCp 中蛋白质提取的效率 (表1) 和较大蛋白质的分辨率 (图 2) 有所下降, 这表明这种技术在成人人群中的效果更好。蠕虫。gtcp 提取的 HeLa 蛋白蛋白颗粒的不完全增溶可能是这种方法在哺乳动物细胞中的局限性。
RT-qPCR 分析免疫印迹靶点
接下来, 我们研究了 RT-qPCR 测试的基因产物的蛋白质水平, 以确定 mRNA 水平是否与蛋白质水平相关。如图 3所示, 许多目标的蛋白质平均表达变化与平均 mrna 表达发生了变化;然而, 一些蛋白质水平并不反映 mRNA 水平的变化。通常情况下,吃-2蠕虫的 mrna 水平高于其他菌株, 但蛋白质水平与同一目标的其他菌株相同或较低。最突出的观察是在吃-2蠕虫中的Dlg-1 mrna 含量非常高, 这并没有转化为更多的蛋白质;事实上, 与其他菌株相比, dlg-1蛋白水平较低 (图 3)。
最后, gtcp 提取蛋白和 ripa 提取蛋白中的水平有显著差异。RNA 是以相同的方式为两者提取的;然而, RIPA 裂解收集的相似但独立的样本显示蛋白质水平显著降低, 特别是对于那些大于 75 kDa 的蛋白质含量 (图 3 a, 右车道;图 3b, 黄色条)。
mRNA 和蛋白质水平的不足比较
该协议的目标之一是确定我们在 mRNA 和蛋白质水平上看到的变异是真实的, 还是可能是样本间变异的产物。在图 4中, 比较了单个样本中的目标子集。每个样品显示为点的相同阴影和颜色, 样本1是最暗的阴影, 样本4是灰色 (WT)、蓝色 (eat-2) 或红色 (rsks-1) 的最轻阴影。在大多数样本中, mRNA 水平的变异性较低, 蛋白质水平的变异性较大, 这是西方印迹半定量分析的一个潜在缺陷。当观察每个有色点在 mRNA 和蛋白质对之间的位置时, 从最高到最低的顺序往往不匹配;例如, 在 WT 中, hss-60 mrna 顺序为样本4、3、2、1, 但蛋白质水平为1、2、3、4。因此, 样品中 mRNA 和蛋白质水平之间的差异当然存在, 但所提出的方法允许用户删除收集时间, 将其作为观察到的差异的可能来源。
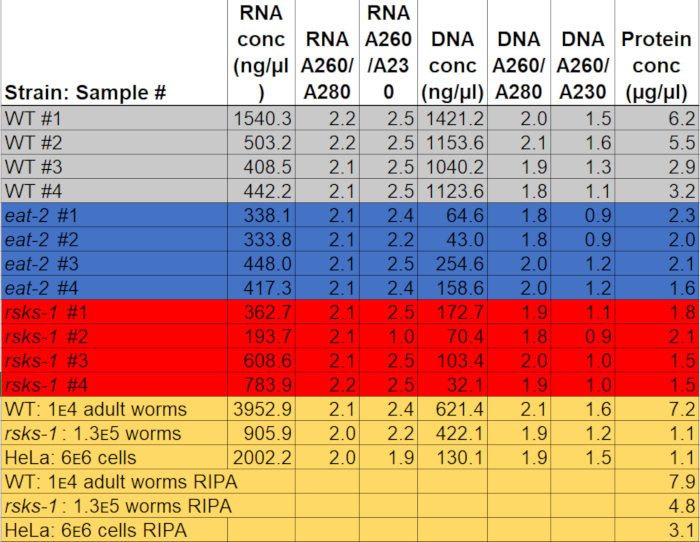
表 1: 浓度和吸收率.在分光光度法上测定了 RNA 和 DNA 的浓度和纯度。蛋白质浓度是用比色蛋白质定量测定的。灰色、蓝色和红色突出了用于 RT-qPCR 和西方印迹的样品。黄色表示用于将 GTCp 与 RIPA 蛋白提取或蠕虫蛋白与 HeLa 蛋白进行比较的样品。请点击此处下载此文件.
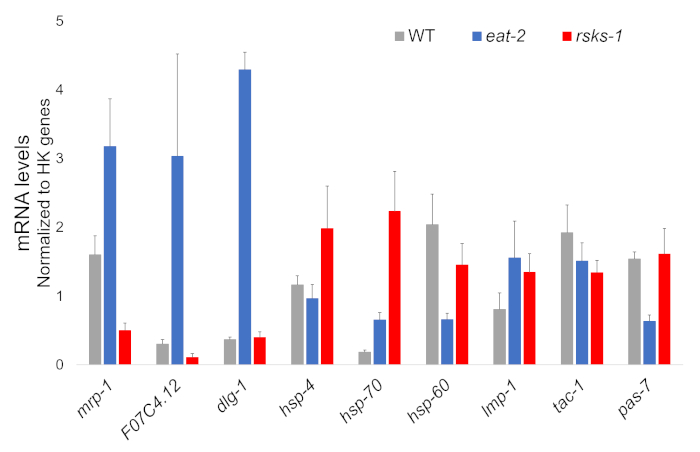
图 1: RT-qPCR 的基因表达.该方法获得的 mRNA RT-qPCR 分析, 确定了从 Rnasq 数据中识别的靶点, 以及细胞器标记基因。误差线表示标准偏差;n = 4。mRNA 的浓度是根据每一组引物的标准曲线定义的。所有 mRNA 水平都被归一化为作为参考基因的六个家养基因的平均值, 其中包括act-1、 cdc-、 ama-1、nhr-23、pmp-3和np-1. 请点击这里查看此图的较大版本.
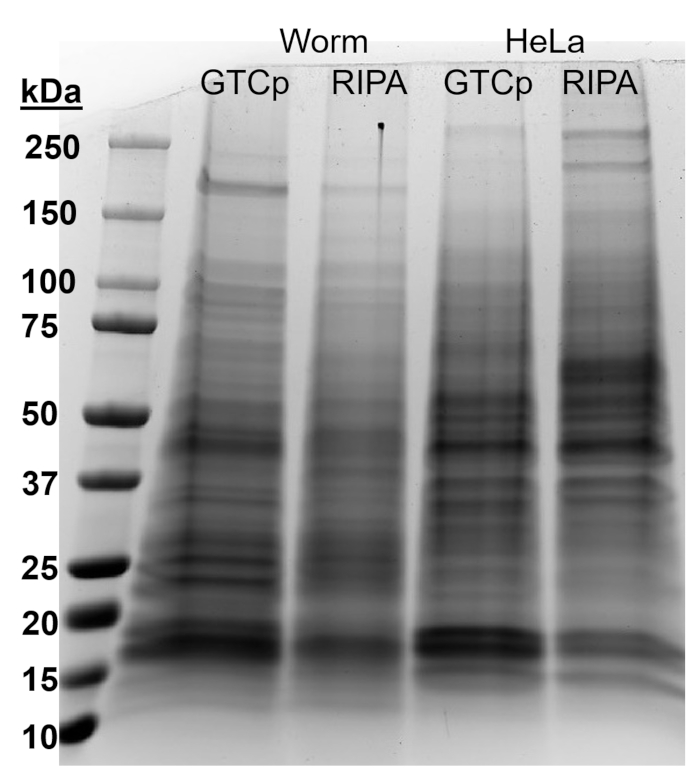
图 2: 蠕虫和 Hara 细胞中 gtcp 与 ripa 提取的蛋白质的比较.通过 GTCp 或 RIPA 裂解方法采集的野生蠕虫或 HeLa 细胞的总蛋白, 用 SDS-PAGE 分离, 用 Coomassie 蓝色染色。每条车道含有25微克的总蛋白质。请点击这里查看此图的较大版本.
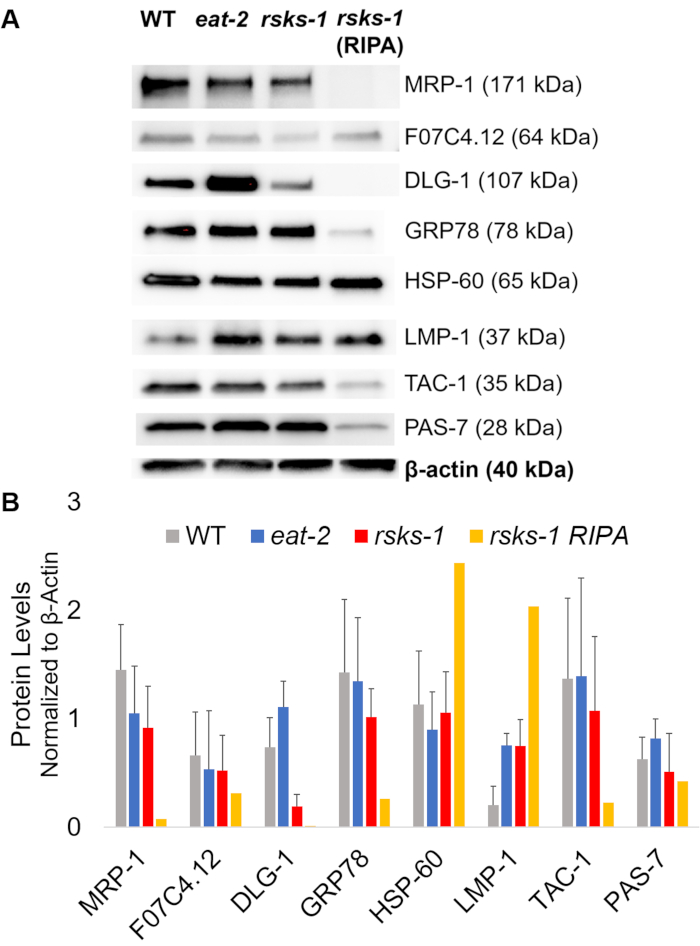
图 3: 蠕虫的蛋白质水平.(a) 用 rt-qpcr 和 (b) 密度测量信号强度分析研究的目标的西方印迹。每条车道含有20μg 的总 gtcp 提取的蛋白质从野生类型 (WT), eat-2, 或rsks-1突变蠕虫。所显示的图像是每个蠕虫应变的四个独立复制的表示形式。β-肌动蛋白 (底部) 用于控制每个目标的相等载荷;只显示一个代表性集。右车道含有20μa 从rsks-1突变蠕虫中提取的总 ripa 蛋白。(b) 利用 ImageJ 对相应的信号强度进行了量化。误差线表示标准偏差;n = 4。请点击这里查看此图的较大版本.
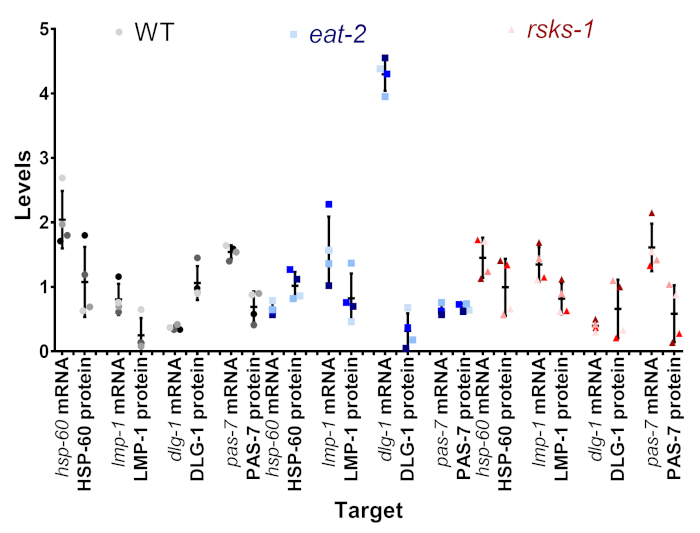
图 4: 减少 mRNA 和蛋白质水平的比较.每个菌株的目标子集中单个样本中的 mRNA 和蛋白质水平是一致的。颜色是表 1的代表。灰黑色为 WT, 蓝色为eat-2, 红色为rsks-1。同一靶点的 mRNA 和蛋白质彼此配对, 并通过线虫菌株分离。请点击这里查看此图的较大版本.
讨论
生物分子分离的方法, 如 DNA、RNA 和蛋白质, 通常是优化的, 没有技术上的重叠或组合。在难以获得样品的情况下, 这尤其不利, 这可能导致在不同时间在相同条件下采集样本。根据细胞途径的不同, 在不同时间收集的复制可能会产生变异。这份手稿提供了一个程序来规避这一障碍, 使每个生物分子同时分离和纯化从相同的蠕虫样本, 减少不同的分离技术引入的变化, 样品收获的时间,或不平等的收获。控制这些变量不仅节省时间和资源, 而且还有助于重现性。在这里, 我们展示了一种组合方法, 避免损害 RNA 和蛋白质质量, 尽管 DNA 的结果是可变的。使用 DNA 清洗程序可以进一步优化制剂。我们用线虫和海拉细胞中的材料演示了这种方法。
此前探索 n2wt 动物和 eat-2 和rsks-1突变体的转录组和蛋白质组的研究提供了对各种途径的洞察, 包括延长寿命的机制 4,34,35 ,36岁。为了研究延长寿命的热量限制机制, 细胞培养 (ILAC) 中的一种用氨基酸标记的稳定同位素标记发现, eat-2蠕虫对全球蛋白质合成有整体的下调作用。36. 这里提供的数据与这一发现是一致的, 尽管相同目标的 mrna 水平大大增加。另一组旨在识别 S6K 介导的寿命的效应因子, 从而对rsks-1蠕虫34进行了蛋白质组学筛选。从目前研究中发现的 RNAseq 数据中, 我们发现了至少三个基因, 这些基因与从这个屏幕上检测到的蛋白质作了佐证;注册会计师和神经利金 (F07C4.12) 的 MRP-1 和同源物在rsks-1蠕虫中的表达与 Wtn2 34的表达不同。
使用此方法生成的数据与以前的多组研究一致。9个靶点的 mRNA 水平被用来预测每个样本中的蛋白质水平。在这些靶子中, 许多目标的蛋白质水平是可预测的, 取决于 mRNA 水平。然而, mRNA 和蛋白质水平之间存在显著差异。重要的是, 这里介绍的协议允许科学家通过从同一样本中收集 mRNA 和蛋白质来消除样本间的可变性, 从而自信地评估和解释这些差异。此外, 我们还将 mRNA 水平与从同一样本中收集的蛋白质水平进行了比较, 或从使用 RIPA 采集的相似但不同的样本中收集的蛋白质水平进行了比较。我们表明, 对于一些目标, ripa 提取样本中的蛋白质水平要低得多。如果不控制样本间的变化, 就不可能知道这种差异是否由于 mRNA 和蛋白质的差异调节。
重要的是要记住, 有一些协议专门针对这些不同的大分子, 所以如果横截面分析不是实验的最终目标, 那么使用这些方法将是相关的。使用 GTCp 分离 DNA 和蛋白质会使它们变得不那么容易溶解, 需要在 NaOH 等薄弱的碱基中重组 DNA, 并将蛋白质溶解在洗涤剂浓度高的缓冲液中加热, 风险不完全增 溶。此外, GTCp 含有鸟苷硫氰酸酯和酸性苯酚, 它会使蛋白酶 (如蛋白酶) 失活, 但随着时间的推移会慢慢降解蛋白质, 除非冷冻。研究人员将酌情决定规避这些限制是否值得。
重要的是, 在使用 RNA 时, 这是一种无菌技术, 除非另有说明, 否则可将样品保持在冰上, 建议使用市售的去污试剂, 以保持 RNA 的完整性。值得注意的是, 较大的样品一开始就需要更多的 GTCp, 在这种情况下, 每个提取溶剂也需要扩大规模。当使用正确的 GTCp 量时, 该协议不需要蠕虫或细胞样品的任何手动同质化。在 DNA 分离的背景下, 产量高度依赖于恢复有机 (粉红色) 层的熟练程度。最后, 为了提高蛋白质在分离过程中的增溶性, 可能需要增加溶解性缓冲液的体积或添加其他洗涤剂, 而不是 SDS。事实上, 来自成人的蠕虫群体的蛋白质, 而不是成人、幼虫和卵子的混合物, 更容易恢复。
总体而言, 使用该协议提供了一种综合方法来处理生物分子隔离, 并有助于解释 mRNA 和蛋白质水平之间的相关性, 或缺乏相关性, 这些相关性可能来自不同的生物分子的单独采集。样品。使用这种方法可以帮助科学家正确地识别 mRNA 转化为蛋白质不相关的情况, 并可导致在各种条件下对转录后和翻译后的调节机制进行更深入的研究。
披露声明
作者没有什么可透露的。
致谢
l. r. l. 的资金来自 NIH/NIA (R00 AG042494 和 R01 AG051810)、格伦医学研究基金会衰老研究奖和美国老龄问题研究联合会的初级教师赠款。作者要感谢安妮塔·库马尔和石泉黄在撰写这份手稿时提供的有益反馈。
材料
| Name | Company | Catalog Number | Comments |
| 4–15% Mini-PROTEAN® TGX Stain-Free™ Protein Gels | BIORAD | 4568084 | |
| Antibodies: | |||
| CePAS7-s | DHSB- U of Iowa | ||
| CeTAC1-s | DHSB- U of Iowa | ||
| DLG1-s | DHSB- U of Iowa | ||
| GRP78 | Novus Bio. | NBp1-06274 | |
| HRP Goat Anti-Mouse | Li-Cor | 926-80010 | |
| HRP Goat Anti-Rabbit | Li-Cor | 92680011 | |
| HSP60-s | DHSB- U of Iowa | ||
| LMP1-s | DHSB- U of Iowa | ||
| MRP-1 | Abcam | ab24102 | |
| Neuroligin 3 | Abcam | ab172798 | |
| β-actin | Millipore | MAB1501R | |
| ChemiDoc MP Imaging System | BIORAD | ||
| Chloroform | Fisher | C298-500 | Health hazard, Irritant, Toxic |
| Coomassie Brilliant Blue | ThermoSci | 20279 | |
| DC Protein assay | BIORAD | 500-0116 | |
| Epoch 2 microplate reader | BioTek | ||
| Ethanol (200 proof) | Fisher | 04-355-223 | Flammable, health hazard |
| HeLa cells | ATCC | CCL-2 | BSL2 |
| iScript Reverse Transcription Supermix | BIORAD | 1708840 | |
| Hydra microdispenser: Matrix Hydra | Robbins/ThermoFisher | ||
| Isopropanol | Fisher | A516-4 | Flammable, health hazard |
| M9 buffer: 3 g KH2PO4 6 g Na2HPO4 5 g NaCl Add H2O to 1 liter. Sterilize by autoclaving. After solution cools down, add 1 mL sterile 1 M MgSO4 | |||
| Laemmli Sample Buffer (2x) | BIORAD | 161-0737 | |
| NanoDrop One | ThermoSci | ||
| PAGE apparatus | BIORAD | ||
| Ponceau S | Alfa Aesar | J60744 | |
| Primers | IDT | 25 nmole DNA Oligo with Standard Desalting | |
| dlg-1: F (5'-GGTCCTACCA GGCAGTTGAG-3') R (5'-CACGTCCGTT AACCTCTCCC-3') | |||
| hsp-4: F (5'-AGAGGGCTTT GTCAACCCAG-3') R (5'-TCGTCAGGGT TGATTCCACG-3') | |||
| hsp-70: F (5'-CGGCATGTGA ACGTGCTAAG-3') R (5'-GAGCAGTTGA GGTCCTTCCC-3') | |||
| hsp-60: F (5'-ATTGAGCAAT CGACGAGCGA-3') R (5'-CAACACCTCC TCCTGGAACG-3') | |||
| lmp-1: F (5'-ACAACAACAC CGGACTCACG-3') R (5'-ATCGAGCTCC CACTCTTTGG-3') | |||
| tac-1: F (5'-AGTGGCAGGC AAAGTTCCTC-3') R (5'-TGAGCACCTT GATCTCGTCG-3') | |||
| pas-7: F (5'-GTACGCTCAA AAGGCTGTCG-3') R (5'-CTGAATCGGC ATTGGCTCAC-3') | |||
| mrp-1: F (5'-TTTGCCTTGC GCTTGTTCTG-3') R (5'-AGTTCCAGTG CGGAGCATAC-3') | |||
| F07C4.12: F (5'-TGCTGAGCAT GAAGGACTGT-3') R (5'-TGGCAATAGC TCCTCCGTTG-3') | |||
| HK Actin: F (5'-CTACGAACTT CCTGACGGACAAG-3') R (5'-CCGGCGGACT CCATACC-3') | |||
| HK cyn-1: F (5'-GTGTCACCAT GGAGTTGTTC-3') R (5'-TCCGTAGATT GATTCACCAC-3') | |||
| HK nhr-23: F (5'-CAGAAACACT GAAGAACGCG-3') R (5'-CGATCTGCAG TGAATAGCTC-3') | |||
| HK ama-1: F (5'-TGGAACTCTG GAGTCACACC-3') R (5'-CATCCTCCTT CATTGAACGG-3') | |||
| HK cdc-42: F (5'-CTGCTGGACA GGAAGATTACG-3') R (5'-CTCGGACATT CTCGAATGAAG-3') | |||
| HK pmp-3: F (5'-GTTCCCGTGT TCATCACTCAT-3') R (5'-ACACCGTCGA GAAGCTGTAGA-3') | |||
| LightCycler 96 qPCR machine | Roche | ||
| RIPA buffer: 10 mM Tris-Cl (pH 8.0) 1 mM EDTA 1% Triton X-100 0.2% SDS 140 mM NaCl 1 tablet of Roche protease inhibitor per 20 mL | |||
| SsoAdvanced Universal SYBR Supermix | BIORAD | 1725274 | |
| SuperSignal West Femto Max Sens Substrate | ThermoSci | 34095 | |
| Trans-Blot Transfer apparatus | BIORAD | ||
| Trans-Blot Turbo Transfer Pack | BIORAD | 170-4159 | |
| TRIzol reagent | Invitrogen | 15596026 | Health hazard (skin, eyes) |
| Worm strains: | Caenorhabditis Genetics Center (CGC) | ||
| N2 (wild type) | Caenorhabditis Genetics Center (CGC) | ||
| eat-2 (MAH95) | Caenorhabditis Genetics Center (CGC) | ||
| rsks-1 (VB633) | Caenorhabditis Genetics Center (CGC) |
参考文献
- Rotroff, D. M., Motsinger-Reif, A. A. Embracing Integrative Multiomics Approaches. International Journal of Genomics. 2016, 1715985 (2016).
- Chen, R., Snyder, M. Promise of personalized omics to precision medicine. Wiley Interdisciplinary Reviews: System Biology and Medicine. 5 (1), 73-82 (2013).
- Anderson, L., Seilhamer, J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 18 (3-4), 533-537 (1997).
- Harvald, E. B., et al. Multi-omics Analyses of Starvation Responses Reveal a Central Role for Lipoprotein Metabolism in Acute Starvation Survival in C. elegans. Cell Systems. 5 (1), (2017).
- Griffin, T. J., et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae. Molecular and Cell Proteomics. 1 (4), 323-333 (2002).
- Greenbaum, D., Colangelo, C., Williams, K., Gerstein, M. Comparing protein abundance and mRNA expression levels on a genomic scale. Genome Biology. 4 (9), 117 (2003).
- Lapierre, L. R., et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans. Nature Communications. 4, 2267 (2013).
- Doherty, C. J., Kay, S. A. Circadian control of global gene expression patterns. Annual Reviews Genetics. 44, 419-444 (2010).
- Goya, M. E., Romanowski, A., Caldart, C. S., Benard, C. Y., Golombek, D. A. Circadian rhythms identified in Caenorhabditis elegans by in vivo long-term monitoring of a bioluminescent reporter. Proceedings of the National Academy of Sciences USA. 113 (48), E7837-E7845 (2016).
- Dalvin, L. A., Fautsch, M. P. Analysis of Circadian Rhythm Gene Expression With Reference to Diurnal Pattern of Intraocular Pressure in Mice. Investigative Ophthalmology and Visual Science. 56 (4), 2657-2663 (2015).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Current Opinion in Structural Biology. 19 (2), 156-163 (2009).
- Swatek, K. N., Komander, D. Ubiquitin modifications. Cell Research. 26 (4), 399-422 (2016).
- Cech, T. R., Steitz, J. A. The noncoding RNA revolution-trashing old rules to forge new ones. Cell. 157 (1), 77-94 (2014).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Triant, D. A., Whitehead, A. Simultaneous Extraction of High-Quality RNA and DNA from Small Tissue Samples. Journal of Heredity. 100 (2), 246-250 (2009).
- Liu, X., Harada, S. RNA Isolation from Mammalian Samples. Current Protocols in Molecular Biology. 103 (1), 11-14 (2013).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
- Kopec, A. M., Rivera, P. D., Lacagnina, M. J., Hanamsagar, R., Bilbo, S. D. Optimized solubilization of TRIzol-precipitated protein permits Western blotting analysis to maximize data available from brain tissue. Journal of Neuroscience Methods. 280, 64-76 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Hoogewijs, D., Houthoofd, K., Matthijssens, F., Vandesompele, J., Vanfleteren, J. R. Selection and validation of a set of reliable reference genes for quantitative sod gene expression analysis in C. elegans. BMC Molecular Biology. 9 (1), 9 (2008).
- Mahmood, T., Yang, P. -. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Peach, M., Marsh, N., MacPhee, D. J., Kurien, B. T., Scofield, R. H. Protein solubilization: Attend to the choice of lysis buffer. Protein Electrophoresis: Methods and Protocols. , 37-47 (2012).
- Lakowski, B., Hekimi, S. The genetics of caloric restriction in Caenorhabditis elegans. Proceedings of the National Academy of Science USA. 95 (22), 13091-13096 (1998).
- Pan, K. Z., et al. Inhibition of mRNA translation extends lifespan in Caenorhabditis elegans. Aging Cell. 6 (1), 111-119 (2007).
- Gaudet, P., Livstone, M. S., Lewis, S. E., Thomas, P. D. Phylogenetic-based propagation of functional annotations within the Gene Ontology consortium. Briefings in Bioinformatics. 12 (5), 449-462 (2011).
- Broeks, A., Gerrard, B., Allikmets, R., Dean, M., Plasterk, R. H. Homologues of the human multidrug resistance genes MRP and MDR contribute to heavy metal resistance in the soil nematode Caenorhabditis elegans. The EMBO Journal. 15 (22), 6132-6143 (1996).
- Hadwiger, G., Dour, S., Arur, S., Fox, P., Nonet, M. L. A Monoclonal Antibody Toolkit for C. elegans. PLoS One. 5 (4), e10161 (2010).
- Kostich, M., Fire, A., Fambrough, D. M. Identification and molecular-genetic characterization of a LAMP/CD68-like protein from Caenorhabditis elegans. Journal of Cell Science. 113 (14), 2595 (2000).
- Firestein, B. L., Rongo, C. DLG-1 is a MAGUK similar to SAP97 and is required for adherens junction formation. Molecular Biology of the Cell. 12 (11), 3465-3475 (2001).
- Heschl, M. F., Baillie, D. L. Characterization of the hsp70 multigene family of Caenorhabditis elegans. DNA. 8 (4), 233-243 (1989).
- Yoneda, T., et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. Journal of Cell Science. 117 (18), 4055 (2004).
- Takahashi, M., Iwasaki, H., Inoue, H., Takahashi, K. Reverse Genetic Analysis of the Caenorhabditis elegans 26S Proteasome Subunits by RNA Interference. Biological Chemistry. 383, 1263 (2002).
- Le Bot, N., Tsai, M. C., Andrews, R. K., Ahringer, J. TAC-1, a regulator of microtubule length in the C. elegans embryo. Current Biology. 13 (17), 1499-1505 (2003).
- McQuary, P. R., et al. C. elegans S6K Mutants Require a Creatine-Kinase-like Effector for Lifespan Extension. Cell Reports. 14 (9), 2059-2067 (2016).
- Larance, M., et al. Global Proteomics Analysis of the Response to Starvation in C. elegans . Molecular and Cell Proteomics. 14 (7), 1989-2001 (2015).
- Yuan, Y., et al. Enhanced energy metabolism contributes to the extended life span of calorie-restricted Caenorhabditis elegans. Journal of Biological Chemistry. 287 (37), 31414-31426 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。