Method Article
Combinato di nucleotidi e proteina estrazioni in Caenorhabditis elegans
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per l'isolamento di RNA, DNA e proteina dallo stesso campione, nel tentativo di ridurre le variazioni, migliorare la riproducibilità e facilitare interpretazioni.
Abstract
Un singolo campione biologico detiene una pletora di informazioni, e ora è pratica comune per studiare simultaneamente diverse macromolecole per acquisire un quadro completo dei livelli multipli di trattamento molecolare e cambiamenti tra diverse condizioni. Questo protocollo presenta il metodo di isolamento di DNA, RNA e proteina dallo stesso campione del nematode Caenorhabditis elegans per rimuovere la variazione introdotta quando queste biomolecole sono isolate da repliche di trattati allo stesso modo ma alla fine diversi campioni. Acidi nucleici e proteine sono estratte dal nematode utilizzando il metodo di estrazione del tiocianato-fenolo-cloroformio di guanidinium acido, con conseguente precipitazione, lavaggio e solubilizzazione di ciascuno. Mostriamo il successo isolamento di RNA, DNA e proteina da un singolo campione di tre ceppi di nematodi e cellule HeLa, con migliori risultati di isolamento della proteina negli animali adulti. Inoltre, guanidinio tiocianato-fenolo-cloroformio-estratti della proteina da nematodi migliora la risoluzione delle proteine più grandi, con i livelli rilevabili di avanzata, come osservato dall'immunoblotting, rispetto alla tradizionale estrazione RIPA di proteina.
Il metodo presentato qui è utile durante l'analisi di campioni utilizzando un approccio di multiomic, in particolare per l'esplorazione del trascrittoma e proteoma. Tecniche che contemporaneamente valutare multiomics sono interessanti perché fenomeni biologici complessi sottostanti di segnalazione molecolari è pensato per accadere ai livelli complementari; Tuttavia, è diventato sempre più frequente vedere che i cambiamenti nei livelli di mRNA non riflettono sempre lo stesso cambiamento nei livelli della proteina e che al momento della raccolta è rilevante nel contesto del regolamento circadiano. Questo metodo rimuove qualsiasi variazione intersample quando analizzante contenuti differenti nello stesso campione (intrasample).
Introduzione
Multiomics, l'approccio analitico che utilizza una combinazione di omics, quali genoma, proteoma, trascrittoma, epigenoma, microbiome o lipidome, è diventato sempre più popolare durante l'elaborazione di grandi insiemi di dati per malattia caratterizzazione1, 2. Le prove crescenti ha dimostrato che limitando approcci ad un unico "ome" fornisce un'analisi molecolare incompleta (recensita da Rotroff e Motsinger-Reif1). Grandi insiemi di dati vengono generati, in particolare quando si eseguono schermi utilizzando tecniche di alto-rendimento, ma al fine di dipingere un quadro completo o identificare i bersagli più rilevanti, multiomic approcci sono preferibili. Con l'uso di approcci multiomics, tuttavia, c'è l'osservazione frequente delle discrepanze tra mRNA e proteina livelli3,4,5,6. In particolare, mRNA e proteina utilizzata per side-by-side trascrittomica e proteomica analisi con sequenziamento di RNA (RNAseq) e liquida cromatografia-spettrometria di massa (LC-MS/MS), rispettivamente, sono spesso ottenuti da campioni allo stesso modo trattati da diverse repliche, potenzialmente introdurre variazione tra le stesse condizioni di3,4,5,6. Harvald et al. eseguite un elegante studio di tempo-corso di inedia elegans del c. che ha confrontato il trascrittoma e proteoma del selvaggio-tipo (peso) worm a quella di hlh-30 vermi mutanti privi di un fattore di trascrizione importante nella longevità 7. della nota, il RNA e le proteine sono state raccolte dalla stessa replica di condizione, quindi non dallo stesso campione. Le loro scoperte mostrano una bassa correlazione tra i livelli di mRNA e livelli della proteina in ogni momento (r = 0,559 a 0.628). Infatti, loro heatmap formate quattro cluster: Cluster ho avuto una grande diminuzione in mRNA livelli ma poca o nessuna diminuzione nei livelli della proteina corrispondente, Cluster II ha avuto poco o nessun aumento nei livelli di mRNA ma un aumento nei livelli della proteina, Cluster III ha avuto un aumento in mRNA livelli, ma una diminuzione nei livelli della proteina e Cluster IV aveva un aumento nei livelli di mRNA, ma solo un cambiamento sottile nella proteina livelli4. Inoltre, questa variazione di intersample può essere introdotti in casi dove i campioni della stessa condizione non vengono raccolti al tempo stesso esatto. Ad esempio, mRNA e proteine regolate dal ciclo circadiano variano a seconda del tempo di giorno8,9, o, più specificamente, l'esposizione di c. elegans a luce9; espressione di queste proteine circadiane può essere ritardata fino a 8 h dopo gene espressione induzione10. Tuttavia, la prevalenza di questa osservazione non significa necessariamente che è sbagliato; in realtà, questo può rivelarsi per essere informativo. MRNA e proteina sono in un costante stato di dinamico tra formazione e degradazione. Inoltre, proteine sono spesso posttranslationally modificate per aumentare la stabilità o per indurre la loro degradazione11. Per esempio, loro status di ubiquitinazione può portare a attivazione o targeting al proteasoma o lisosoma per degradazione12. Inoltre, RNA non codificanti gioca un ruolo importante nella regolazione dell'espressione genica a fasi post-trascrizionale e post-trascrizionali13. Così, la questione è come limitare le variabili per confermare che le discrepanze che osserviamo in questi studi del nematode sono reali.
Qui, vi proponiamo un metodo che rimuove la variabile intersample consentendo analisi delle macromolecole diverse dallo stesso campione. L'obiettivo del presente protocollo è quello di offrire un metodo per isolare costantemente DNA, RNA e proteine da un singolo campione di c. elegans (noto anche come vermi) nel tentativo di ridurre le variazioni, migliorare la riproducibilità e facilitare interpretazioni. Ulteriori vantaggi dell'utilizzo dello stesso campione includono il risparmio di tempo e risorse durante il prelievo, facilitando l'analisi trasversale dei campioni preziosi e limitati, compresi i ceppi che sono difficili da coltivare e mantenere e guadagnando visioni del regolamento differenziale di macromolecole sulla base intrasample variazioni nei livelli di mRNA e proteina.
Questo metodo è adatto per valutare espressioni geniche e livelli della proteina da un singolo campione di vermi, consentendo una valutazione più completa di livelli multipli di trattamento molecolare. Guanidinio tiocianato-fenolo-cloroformio (CDP) reagente14, un prodotto chimico comunemente usato per isolare il RNA, è utilizzato per l'estrazione di acidi nucleici e proteine da vermi, con conseguente precipitazione, lavaggio e solubilizzazione di ciascuno. Questo protocollo è una raccolta di vari protocolli15,16 con modifiche minori, progettato con un focus su c. elegans, ma anche con successo abbiamo isolato il RNA, proteine e DNA da una pallina di cellule HeLa seguendo il stessa procedura. Anche se non testato qui, questo protocollo è probabile che il lavoro sui tessuti anche17,18.
Protocollo
Nota: Ogni fase di precipitazione macromolecola è eseguita in modo sequenziale, seguita da lavaggi fatto simultaneamente; Tuttavia, si raccomanda di completare l'isolamento di RNA prima come è intrinsecamente instabile.
1. raccolta del campione
- Semi di 1.000 uova di verme per piastra di 10 cm con crescita adeguate condizioni19. Incubare a 20 ° C per 72 h.
Nota: Candeggina uovo-cuscinetto adulti al fine di raccogliere le uova come precedentemente descritto19. - Lavare la piastra con circa 5 mL di tampone di M9 e raccogliere 1.000 vermi adulti in una provetta.
Nota: Buffer di M9 è composto da 35 mM sodio fosfato bibasico, 102 mM di cloruro di sodio, 22 millimetri di fosfato di potassio monobasico e 1 mM il solfato di magnesio in acqua sterile19. - Centrifugare i vermi a 1.000 x g per 1 min, scartare il surnatante e trasferire i vermi pellettati con 1 mL di tampone di M9 in una microcentrifuga da 1,5 mL.
- Centrifugare nuovamente a 845 x g per 1 minuto e scartare la maggior parte del surnatante. Conservare i vermi pellettati a-80 ° C per un minimo di 4 h.
Nota: Usando un batuffolo di congelato produce un rendimento più elevato rispetto a un pellet di fresco. Una serie di cicli di gelo/disgelo con liquido azoto o 95% etanolo su ghiaccio secco per rompere la cuticola di vite senza fine è consigliata se usando un batuffolo di fresco. Lasciando una piccola quantità di M9 sul pellet contribuirà a rompere la cuticola quando si congela.
2. nucleotide e l'isolamento della proteina
- Rimuovere qualsiasi supernatante dal pellet scongelati e aggiungere 1 mL di reagente di CDP freddo. Miscelare bene pipettando su e giù. Il campione viene posto in ghiaccio per 10 min e mescolare occasionalmente girandolo sottosopra.
Attenzione: Fenolo è corrosivo, neurotossici e altamente tossico e può causare ustioni chimiche e cecità.
Nota: Abbiamo usato fino a 5.000 vermi adulti come materiale di partenza con i volumi segnalati; ogni volume è basato sull'uso di 1 mL di reagente di CDP. Quando si utilizza un campione più ampio, può essere necessario di scalabilità. - Per la soluzione di worms e CDP, aggiungere 200 µ l di cloroformio freddo. Tenere il tubo tra le dita e agitare energicamente per 15 s. lasciare a temperatura ambiente (TA) per 3 min.
Attenzione: Cloroformio è un tossico irritante, può causare piaghe della pelle e altri danni al targeting per organo ed è un possibile cancerogeno. - Centrifugare la provetta a 13.500 x g per 15 min a 4 ° C.
Nota: Tre strati sono formati dopo questo spin: cima, fase acquosa limpida, fondo, rosa fase organica e l'interfase piccolo, nuvoloso contenente lipidi e DNA. - Usando una micropipetta, spostare il livello trasparente in alto (fase acquosa) ad un nuovo RNAsi-libera 1,5 mL microcentrifuga tubo (tubo A) isolare RNA tramite precipitazione di alcool (come dettagliato al punto 2.5) e spostare lo strato rosa (fase organica) dalla pallina restante in un nuovo tubo ( tubo B) e posizionarlo sul ghiaccio.
Nota: La fase organica rosa può essere congelata a-80 ° C fino a quando l'isolamento di DNA e proteine da questo esempio. I più grandi campioni produrrà uno spesso strato bianco tra la fase acquosa e organica. Questa frazione contiene DNA. Se questo strato può essere rimosso senza disturbare le altre fasi, farlo e metterlo in un tubo separato (tubo B2). -
Isolare il RNA come segue.
- Dalla fase acquosa limpida nel tubo A, precipitare il RNA con 500 µ l di isopropanolo 100%. Incubare per 10 min a RT. Quindi, centrifuga A tubo a 13.500 x g per 10 min a 4 ° C.
Nota: Una piccola pallina bianca di RNA deve essere visibile nella parte inferiore del tubo. - Decantare la maggior parte del surnatante. Rimuovere il resto con una siringa da 1 mL con ago e scartare il surnatante.
Nota: La dimensione dell'ago non è importante; Tuttavia, un più grande calibro dell'ago offrirà maggiore controllo per non disturbare il pellet. Una micropipetta può essere utilizzata se gli aghi non sono disponibili. - Aggiungere 1 mL di etanolo al 75% al tubo A per lavare la pallina. Girare il tubo a 5.300 x g per 5 min a 4 ° C.
- Rimuovere il supernatante dal pellet decantazione e utilizzando una siringa da 1 mL con un ago, come descritto al punto 2.5.2 ed eliminarlo.
- Lasciate che il pellet asciugare all'aria per 5 – 10 min, ma non lasciare che stata. Utilizzare 50 µ l di acqua RNAsi-libera per ricostituire il pellet di RNA prima che diventi completamente trasparente.
Nota: Si tratta di un volume di partenza adeguato per 1.000-3.000 viti senza fine, ma potrebbe dover essere regolato a seconda di quanto materiale di partenza è stato utilizzato. - Incubare il pellet a 55 – 60 ° C per 10 min per dissolverlo.
- Misurare la concentrazione e la purezza utilizzando uno spettrofotometro. Registrare l'assorbanza a 260 nm per la concentrazione di RNA e a 230 e 280 nm per identificare eventuali impurità.
- Pulire il RNA per rimuovere eventuali contaminanti, quali residui di fenolo o DNA, purificazione della colonna o con etanolo successivi lavaggi e trattamento della dnasi.
Nota: A questo punto, il RNA è pronto per essere inviato per l'analisi di RNAseq o può essere usato per fare del cDNA da utilizzare per RT-qPCR (vedere la sezione 3.1 per dettagli). RNA può essere conservato a-80 ° C fino ulteriore uso.
- Dalla fase acquosa limpida nel tubo A, precipitare il RNA con 500 µ l di isopropanolo 100%. Incubare per 10 min a RT. Quindi, centrifuga A tubo a 13.500 x g per 10 min a 4 ° C.
-
Isolare il DNA come segue.
- Da rosa fase organica in tubo B e il campione nel tubo B2, se del caso, precipitare il DNA aggiungendo 300 µ l di etanolo al 100% e mescolare capovolgendo. Lasciare le provette a temperatura ambiente per 2 – 3 min.
- Centrifugare le provette B e B2 a 375 x g per 5 min a 4 ° C a pellet del DNA.
- Spostare il surnatante da tubi B e B2 versandolo in una nuova provetta da 2 mL (tubo C) e lasciarlo sul ghiaccio per l'isolamento di proteine successive. Lavare la pallina di DNA in tubo B o B2 con 1 mL di citrato di sodio 0,1 M in etanolo di 10% per 30 min. provette da centrifuga B e B2 a 375 x g per 5 min a 4 ° C.
Nota: Sodio si lega alla spina dorsale del DNA, produzione di DNA precipitato più prontamente in citrato di sodio ed etanolo, permettendo le impurità da rimuovere mediante centrifugazione a bassa velocità. - Ripetere il passaggio di lavaggio come al punto 2.6.3. Risospendere il pellet in 1,5 mL di etanolo al 75% e lasciarlo a RT per 20 min, con occasionali di miscelazione da sbaragliare.
- Centrifuga del tubo B e B2 a 375 x g per 5 min a 4 ° C.
- Scartare il sopranatante e lasciare asciugare per 5 – 10 min.
- Dissolva la pallina in 150 µ l di idrossido di sodio di 8 mM. Se necessario, regolare a pH desiderato con HEPES. Girare il campione a 375 x g per 5 min a 4 ° C.
- Usando una micropipetta, spostare il surnatante (DNA) in un nuovo tubo. Misurare la concentrazione e determinare la purezza utilizzando uno spettrofotometro. Registrare l'assorbanza a 260 nm per la concentrazione di DNA e a 230 e 280 nm per identificare eventuali impurità.
-
Isolare la proteina come segue.
- Per precipitare le proteine, aggiungere fino a 1,5 mL di isopropanolo 100% al supernatante rosa in tubo C, mix capovolgendo più volte e incubare a temperatura ambiente per 10 min.
- Centrifugare la provetta C a 13.500 x g per 10 min a 4 ° C.
- Scartare il surnatante e lavare la pallina con 2 mL di cloridrato della guanidina 0.3 M in etanolo al 95% per 20 min a RT. provetta C a 5.300 x g per 5 min a 4 ° C.
- Ripetere la fase di lavaggio, come descritto nel passaggio 2.7.3 2x.
- Spostare la pallina di proteina in una nuova provetta da 1,5 mL (tubo C2) e aggiungere fino a 1,5 mL di etanolo al 95%. Vortice e lasciare sedersi al RT per 20 min.
- Centrifugare la provetta C2 a 5.300 x g per 5 min a 4 ° C. Scartare il sopranatante e lasciare il pellet asciugare per 10 min a RT. sciogliere il pellet in 300 µ l di 5% SDS a 50 ° C per 60 min.
Nota: Un tempo di incubazione più lungo può essere necessaria per sciogliere completamente il pellet di proteina. In passato, il pellet è stato incubato per fino a 6 h senza sacrificare la qualità. - Centrifugare la provetta C2 a 13.500 x g per 10 min a 17 ° C. Spostare il surnatante in un nuovo tubo.
- Misurare la concentrazione usando un'analisi di quantificazione della proteina preferito che è compatibile con il detersivo.
Nota: La proteina è pronta per essere utilizzato in SDS-PAGE e western blotting. Esso può essere conservato a-20 ° C per un uso futuro. Per altre tecniche, come LC-MS/MS, il detersivo dovrà essere dializzata fuori.
3. valutare i livelli della proteina e del mRNA
-
RT-qPCR
- Preparare cDNA da trascrizione d'inversione con 1 ng di RNA, utilizzando il seguente protocollo di thermocycler: adescamento (5 min a 25 ° C), trascrizione d'inversione (20 min a 46 ° C) e l'inattivazione di RT (1 min a 95 ° C).
- Rendere un piatto stock di cDNA aggiungendo 100 µ l della diluizione 1: 100 di ogni campione di cDNA singoli pozzetti di una piastra a 96 pozzetti. Includere i controlli appropriati, quali nessun modello/acqua solo wells e campioni diluiti in serie da 01:25 a 1: 400 (originati con cDNA riunito da tutti i campioni analizzati) per consentire una curva standard stabilire l'efficienza di primer per ogni gene analizzato.
Nota: Questo formato può essere utilizzato con il micro dispensatore di 96 pozzetti, che permette il trasferimento di tutti i campioni in un piatto ad una piastra del RT-qPCR e per la mitigazione delle variazioni pipettaggio pozzetto a altro. Il mix master appropriato (ad esempio, SYBR + primer) possa essere aggiunti a ogni bene da allora in poi, con una pipetta multicanale. Nel complesso, questo approccio riduce errori introdotti quando si mano-pipetta ogni campione, riducendo così ulteriormente la variabilità. - Aggiungere 3 µ l di cDNA dalla piastra di stock ai pozzetti della piastra RT-qPCR.
- Fare un mix master per ogni set di primers che include 1 supermix x contenente un colorante cianina intercalanti del DNA, 5 µM ciascuna di forward e reverse primer e acqua fino a 7 µ l per campione. Aggiungere 7 µ l in appositi pozzetti di una piastra di RT-qPCR e agitare leggermente per mescolare.
Nota: Sono campioni per misurare geni housekeeping utilizzare come riferimento per normalizzare i risultati20. - Eseguire la piastra utilizzando un protocollo di RT-qPCR che è adatto per i primers utilizzati.
-
Occidentale della macchia
Nota: Per informazioni dettagliate su western blot, consultare Meneghini e Yang21.- Preparare i campioni per SDS-PAGE combinando 20 µ g di proteine con un volume uguale di 2 x tampone di Laemmli e fate bollire a 95 ° C per 10 min.
- Caricare i campioni su un gel di Tris-glicina 4 – 15% ed eseguirli a 150 V per 1 h, o fino a quando la parte anteriore della tintura raggiunge il fondo del gel.
- Consente di trasferire una membrana di nitrocellulosa a 25 V per 30 min in un apparato di trasferimento semistagna proteine dal gel.
- Confermare il corretto trasferimento macchiando la membrana con la macchia di Ponceau S.
- Lavare la macchia dalla membrana con soluzione fisiologica tamponata (TBS) con 0,01% polisorbato 20 (TBS-T).
- Bloccare la membrana con 5% di latte scremato in TBS-T per 1 h a TA.
- Incubare la membrana nell'anticorpo primario presso la diluizione appropriata secondo le raccomandazioni del fornitore. Lasciare il rocker a 4 ° C durante la notte.
- Lavare la membrana 3 x, per 5 minuti ciascuno, con TBS-T.
- Incubare la membrana nell'anticorpo secondario appropriato alla diluizione appropriata secondo le raccomandazioni del fornitore. Lasciarlo acceso il rocker per 1 h a TA.
- Lavare la membrana 3 x, per 5 minuti ciascuno, con TBS-T.
- Immagine e quantificare il western blot, utilizzando metodi preferiti.
Risultati
Sono stati analizzati i campioni di RNA, DNA e proteine, e risultati rappresentativi utilizzando gli isolati di RNA e proteine sono presentati qui. Inoltre, mettiamo a confronto il campione della proteina raccolto utilizzando il metodo di CDP al metodo comune RIPA Lisi22. Per il nostro esperimento, abbiamo usato indipendente quattro repliche di ogni Worm WT (N2) e due vermi mutanti longevi, mangiare-2 e rsks-123,24.
Qualità e la quantità di RNA e DNA
La concentrazione di RNA quando risospeso in 50 µ l di acqua hanno variato da 0,2 a 2 µ g / µ l, utilizzando circa 3.000 adulti worm come materia prima. I rapporti di assorbanza, che indicano la purezza, hanno variato da 2.0 a 2.2 per A260/A280 e 1,9 a 2,5 per A260/A230 (tabella 1), che indica l'estrazione di RNA senza contaminazione con componenti di CDP, come fenolo o guanidina cloridrato.
L'estrazione del DNA è stata completata, ma la qualità era variabile. La concentrazione di DNA quando risospesi in 150 µ l di NaOH ha variato da 0,04 a 1,1 µ g / µ l. I rapporti di assorbanza variati da 1,8 a 2.1 per A260/A280 e 0,9-1,6 per A260/A230 (tabella 1), che indica l'estrazione del DNA; Tuttavia, alcuni esempi sono stati contaminati con componenti di CDP, come fenolo o guanidina cloridrato. Se l'isolamento del DNA è necessario, cura deve essere presa quando separa lo strato intermedio la separazione di fase di CDP e lavaggi più possono essere necessarie.
RT-qPCR di target selezionati
L'isolamento di RNA da quattro campioni indipendenti di ogni ceppo di vite senza fine ebbe successo e fu inviato per l'analisi di RNAseq, con successive RT-qPCR eseguita utilizzando un supermix contenente un colorante cianina. Bersagli analizzati mediante RT-qPCR sono stati selezionati da un dataset di grandi dimensioni RNAseq basato sui geni differenzialmente più regolamentati comuni in entrambi mutanti rispetto i vermi WT. F07C4.1225, un omologo di neuroligin umano 3, isoforma b, fu il bersaglio selezionato sovraregolati condivisa. Abbiamo anche incluso un geni differenzialmente tra entrambi mutanti, mrp-126, per ulteriori analisi, che era upregulated in 2 mangiare vermi ma downregulated a worms rsks-1 . Cambiamenti di espressione di mrp-1 sono stati confermati tramite RT-qPCR; Tuttavia, il upregulation F07C4.12 a rsks-1 worms previsto dall'analisi RNAseq non è stato visto da RT-qPCR (Figura 1).
Obiettivi supplementari con anticorpi convalidati per i worm sono stati studiati come bene. Questi hanno incluso parecchi indicatori organello caratterizzati in Hadwiger et al.27. Un numero di questi marcatori sono stati differenzialmente espressi al livello del mRNA nei vermi mutanti. Come si vede nella Figura 1, lmp-128 e dlg-129 sono stati aumentati a worms mangiare-2 ; HSP-4 30, hsp-7030e lmp-1 sono stati aumentati a worms rsks-1 ; HSP-60 31 e pas-732 downregulated in 2 mangiare vermi; HSP-60 e tac-133 downregulated a worms rsks-1 .
Preparazione della proteina simultanea vs RIPA
Per affermare l'efficienza e la qualità della proteina con il metodo di CDP, come descritto in precedenza, abbiamo confrontato a proteina raccolta utilizzando il metodo più tradizionale di RIPA Lisi22. Utilizzando la stessa quantità di materiale, vale a dire solo per adulti (circa 10.000 vermi) o una popolazione mista di adulti, larve e uova (circa 130.000 vermi), di partenza il quantitativo globale raccolto con CDP era di meno quando risospesi in volumi uguali fine (tabella 1 ); Tuttavia, l'estrazione da una popolazione di soli adulti era più successo che da una popolazione mista. Inoltre, la qualità delle proteine era simile, anche se la proteina estratta da CDP ha mostrato una migliore risoluzione delle proteine più grandi al momento uguale carico di proteine totali, come mostrato dalla macchia del Coomassie nella Figura 2. Infatti, gli obiettivi valutati mediante western blot in Figura 3 ha mostrato livelli simili nella maggior parte dei casi; Tuttavia, le proteine più grandi di 75 kDa hanno mostrato livelli inferiori nella proteina RIPA-estratti rispetto alla proteina estratta da CDP (Figura 3A, corsia di destra; Figura 3B, giallo bar).
Il metodo di estrazione presentato qui inoltre è stato valutato nella linea cellulare dei mammiferi HeLa. Per riferimento, la quantità di proteina estratta con RIPA da un pellet compatto delle cellule HeLa 6 milioni (una pallina di ~ 25 µ l) era paragonabile a quella estratta da una popolazione mista 130.000 di vermi (un pellet compact ~ 75 µ l), o circa la metà di quello che viene Estratto da 10.000 vermi adulti (un ~ 100 µ l si stabilirono gravità della pallina), come si vede nella tabella 1. Ci mostrano che l'efficienza di estrazione della proteina (tabella 1) e la risoluzione delle proteine più grandi (Figura 2) è state diminuite in CDP rispetto al RIPA-estratti della proteina in cellule HeLa, suggerendo che questa tecnica funziona meglio in una popolazione adulta di viti senza fine. La solubilizzazione incompleta del pellet da CDP-estratti HeLa proteina proteina può essere una limitazione di questo metodo in cellule di mammifero.
Obiettivi di immunoblotting analizzati mediante RT-qPCR
Successivamente, abbiamo studiato i livelli di proteina dei prodotti genici testati da RT-qPCR per determinare se i livelli del mRNA ha correlato con i livelli della proteina. Come si vede nella Figura 3, i cambiamenti di espressione media di proteina correlata con le espressioni di mRNA medio cambiate per molti obiettivi; Tuttavia, alcuni livelli di proteina non riflette i cambiamenti nei livelli di mRNA. Spesso, i livelli di mRNA in 2 mangiare vermi erano superiori a quelli di altri ceppi, ma i livelli della proteina erano sia uguale o inferiore ad altri ceppi dello stesso bersaglio. L'osservazione più eccezionale era i livelli molto elevati di dlg-1 mRNA in 2 mangiare vermi, che non si è tradotta per più proteine; in realtà, c'erano dlg-1 proteina livelli inferiori rispetto agli altri ceppi (Figura 3).
Infine, i livelli della proteina estratta da CDP e la proteina RIPA-estratti hanno mostrato una differenza vistosa. il RNA è stato estratto nello stesso modo per entrambi; Tuttavia, simile ma distinto campione raccolto da RIPA Lisi ha mostrato contrassegnato ha ridotto i livelli di proteine, in particolare per quelli più grandi di 75 kDa (Figura 3A, corsia di destra; Figura 3B, giallo bar).
Intrasample confronto dei livelli di mRNA e proteina
Uno degli obiettivi del presente protocollo era di determinare se la variazione che abbiamo visto al mRNA e proteina livello era reale, o se potrebbe essere un artefatto di variazione intersample. In Figura 4, un sottoinsieme di target è stato confrontato all'interno di singoli campioni. Ogni singolo campione viene visualizzato come la stessa tonalità e colore del punto, con il campione 1 essendo l'esempio 4 e una tonalità più scura come la tonalità più chiara di grigio (WT), blu (mangiare-2), o rosso (rsks-1). All'interno della maggior parte dei campioni, c'era una bassa variabilità dei livelli di mRNA, con una maggiore variabilità a livello proteico, un potenziale difetto dell'analisi semiquantitativa dei western blot. Quando si guarda la posizione di ciascuno dei punti colorati fra le coppie di mRNA e proteina, l'ordine di massima-minima spesso non corrisponde; ad esempio, nel WT, l'ordine di mRNA di hsp-60 era campione 4, 3, 2, 1, ma i livelli della proteina sono stati 1, 2, 3, 4. Così, certamente esistono differenze tra i livelli di mRNA e proteina all'interno di un campione, ma il metodo proposto permette agli utenti di rimuovere al momento della raccolta come una possibile fonte della differenza osservata.
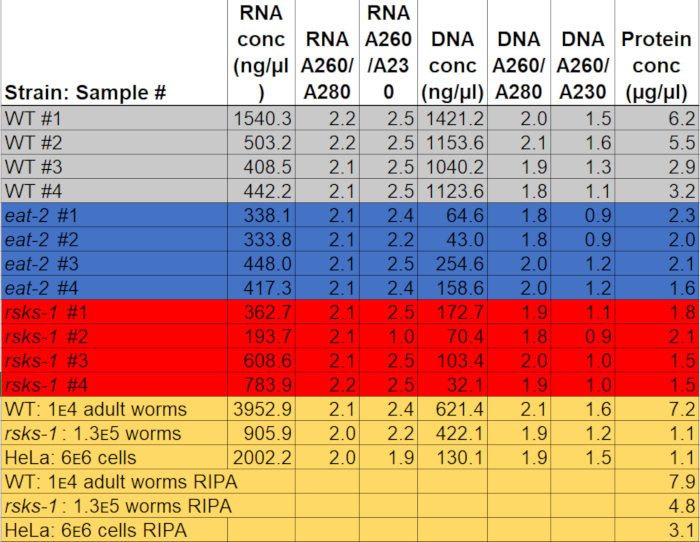
Tabella 1: concentrazioni e rapporti di assorbimento. Rapporti di purezza e concentrazioni di RNA e DNA sono stati misurati su uno spettrofotometro. Concentrazioni di proteina sono state determinate mediante un'analisi di quantificazione della proteina colorimetrico. Il grigio, il blu e il rosso evidenziare i campioni utilizzati per RT-qPCR e western blot. Il giallo indica campioni utilizzati per confrontare CDP all'estrazione della proteina RIPA o verme della proteina a proteina di HeLa. Per favore clicca qui per scaricare questo file.
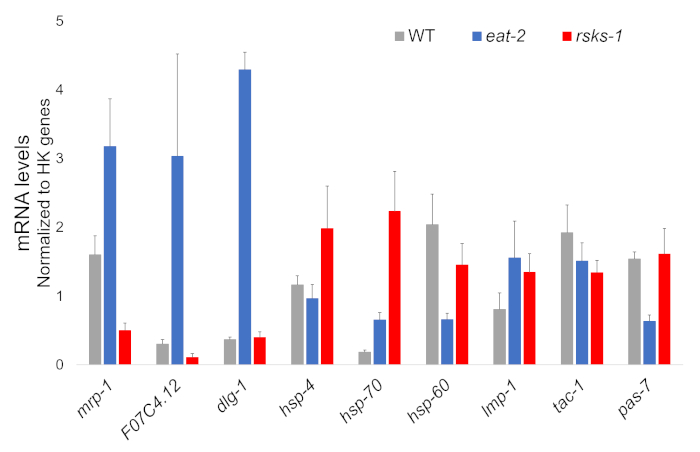
Figura 1: espressione genica mediante RT-qPCR. Analisi di RT-qPCR per il mRNA ottenuto con questo metodo, confermando gli obiettivi identificati da RNAseq dati e dei geni marcatori organello. Le barre di errore rappresentano la deviazione standard; n = 4. La concentrazione di mRNA è stata definita contro una curva standard per ogni set di primers. Tutti i livelli di mRNA sono stati normalizzati per la media di un insieme di sei geni housekeeping utilizzato come geni di riferimento, che includono act-1, cdc-42, ama-1, nhr-23, pmp-3e cyn-1. Clicca qui per visualizzare una versione più grande di questa figura.
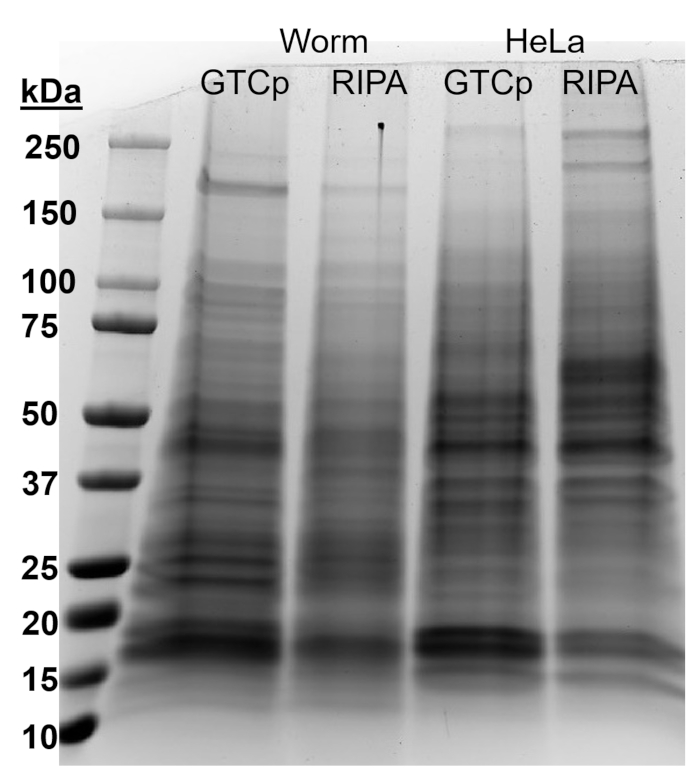
Figura 2: confronto di CDP-contro RIPA-estratti della proteina in cellule HeLa e vermi. Proteine totali da wild type (WT) worms o cellule HeLa raccolte tramite metodo di lisi di CDP o RIPA, separate da SDS-PAGE e colorate con blu di Coomassie. Ogni corsia contiene 25 µ g di proteina totale. Clicca qui per visualizzare una versione più grande di questa figura.
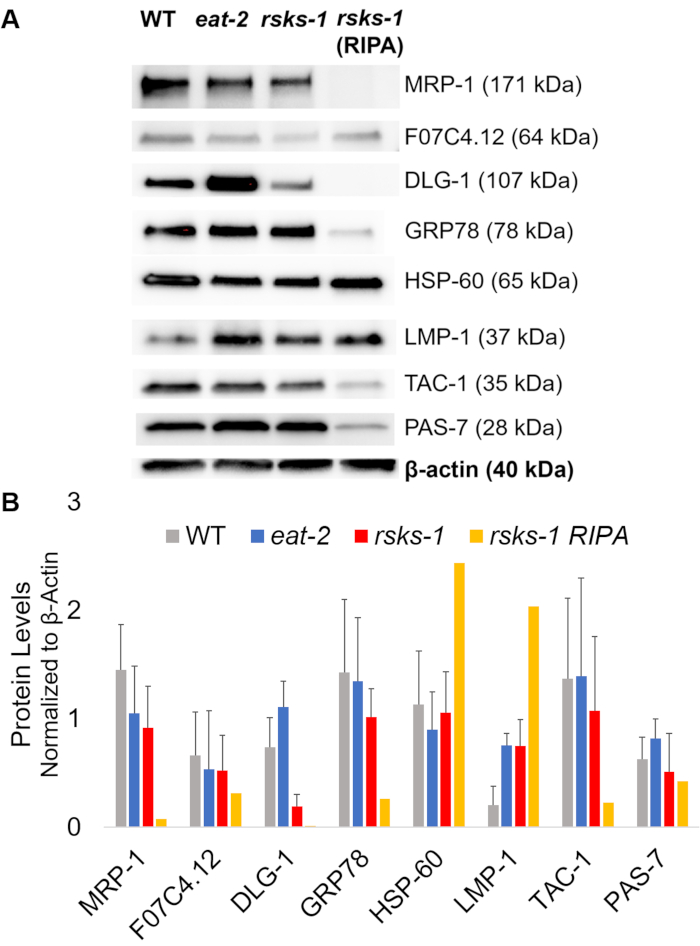
Figura 3: i livelli della proteina a worms. (A) Western blot di bersagli studiato da RT-qPCR e (B) analisi di densitometria dell'intensità del segnale. Ogni corsia contiene 20 µ g di proteina totale di CDP-estratti da wild-type (WT), mangiare-2o vermi mutanti rsks-1 . L'immagine mostrata è una rappresentazione di quattro ripetizioni indipendenti per ceppo di vite senza fine. Β-actina (in basso) è stato utilizzato per controllo di carico uguale per ogni destinazione; solo un insieme rappresentativo è mostrato. La corsia di destra contiene 20 µ g di proteina totale di RIPA-estratti da vermi mutanti rsks-1 . (B) corrispondente intensità del segnale sono state quantificate utilizzando ImageJ. Le barre di errore rappresentano la deviazione standard; n = 4. Clicca qui per visualizzare una versione più grande di questa figura.
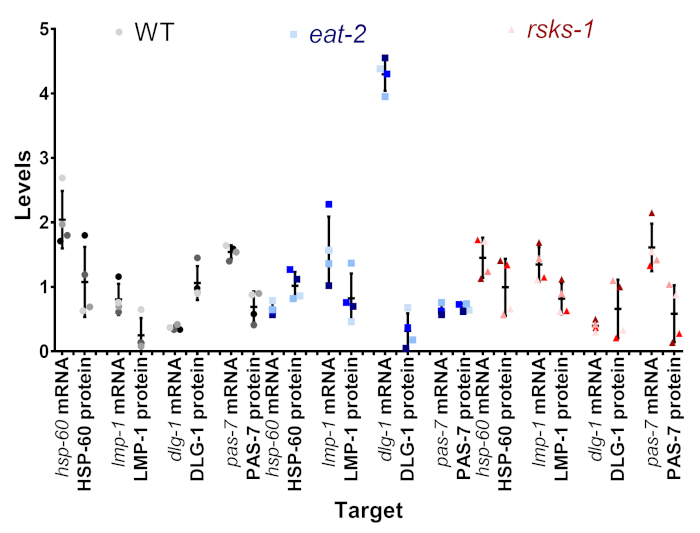
Figura 4: confronto di livello Intrasample mRNA e proteina. I livelli di mRNA e proteina da singoli campioni da un sottoinsieme degli obiettivi per ogni ceppo sono allineati. Il colore è il rappresentante della tabella 1. Grigio/nero è WT, il blu è mangiare-2e il rosso è rsks-1. mRNA e proteina dello stesso bersaglio sono accoppiati uno accanto a altro e separati da ceppo del nematode. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Metodi per isolamenti di biomolecole, come il DNA, RNA e proteine, spesso sono ottimizzati senza sovrapposizione di tecniche o combinazioni. Questo è particolarmente svantaggioso quando i campioni sono difficili da ottenere, che potrebbe portare alla raccolta di campioni nelle stesse condizioni in momenti diversi. A seconda delle vie cellulari, replicati raccolti ai tempi differenti possono generare variazione. Questo manoscritto offre una procedura per aggirare questo ostacolo abilitando il simultanea isolamento e purificazione di ogni biomolecola dallo stesso campione di vermi, variazioni introdotte mediante tecniche di isolamento diverso, di ridurre i tempi di raccolta del campione, o raccolta disuguale. Controllare queste variabili non solo consente di risparmiare tempo e risorse, ma facilita anche la riproducibilità. Qui, dimostriamo un approccio combinatorio che evita di compromettere RNA e proteina qualità, seppur con risultati variabili con il DNA. Preparati possono essere ulteriormente ottimizzati usando il DNA delle procedure di pulizia. Abbiamo dimostrato l'approccio utilizzando materiale dalle cellule del nematode c. elegans e HeLa.
Lavoro precedente esplorando il trascrittoma e proteoma di N2 WT animali e mangiare-2 e rsks-1 mutanti hanno offerto insight in varie vie, tra cui meccanismi che estendono la durata della vita4,34,35 ,36. Nel tentativo di studiare il meccanismo della restrizione calorica nell'estendere la durata della vita, una marcatura a isotopi stabili di/con gli amminoacidi nella cella analisi cultura (SILAC) ha trovato i vermi che mangiano-2 hanno un downregulation complessiva della sintesi proteica globale 36. i dati presentati qui sono coerenti con ciò che trova, anche se i livelli di mRNA degli stessi obiettivi sono notevolmente aumentati. Un altro gruppo mirato ad identificare gli effettori della longevità S6K-mediata e, pertanto, effettuata una schermata di proteomica di rsks-1 worm34. Dai dati RNAseq trovati con lo studio corrente, abbiamo identificato almeno tre geni che confermano con proteine identificate da questa schermata; MRP-1 e gli omologhi del CPA e neuroligin (F07C4.12) sono stati scoperti come differenzialmente espressi in vermi rsks-1 rispetto al WT N234.
I dati generati utilizzando questo metodo sono coerenti con le indagini precedenti multiomic. I livelli di mRNA di nove obiettivi sono stati utilizzati per prevedere i livelli di proteina in ciascun campione. Di questi obiettivi, molti avevano livelli di proteina prevedibile sulla base dei livelli di mRNA. Tuttavia, ci erano notevoli discrepanze tra i livelli di mRNA e proteina. D'importanza, il protocollo presentato qui permette agli scienziati di tranquillamente valutare e interpretare queste differenze rimuovendo variabilità intersample raccogliendo mRNA e proteina dallo stesso campione. Inoltre, abbiamo confrontato i livelli di mRNA per i livelli di proteina raccolti dallo stesso campione o raccolti da un campione simile ma diverso raccolto con RIPA. Abbiamo dimostrato che per un certo numero di bersagli, c'erano molto più bassi livelli della proteina nel campione RIPA-estratta. Senza il controllo della variazione intersample, sarebbe impossibile sapere se questa differenza era dovuto la regolazione differenziale di mRNA e proteina.
È importante tenere a mente che ci sono protocolli ottimizzati appositamente per queste macromolecole diverse, così se un'analisi trasversale non è l'obiettivo finale dell'esperimento, quindi sarebbe opportuno impiegare tali metodi invece. Utilizzando CDP per isolare il DNA e proteina provoca loro di diventare meno solubile, che richiedono la ricostituzione del DNA in una base debole, come NaOH e solubilizzanti la proteina in un buffer con un'alta concentrazione di detergente con riscaldamento, con il rischio di incompleta solubilizzazione. Inoltre, CDP contiene tiocianato di guanidinium e fenolo acida, che inattiva gli enzimi quali le proteasi, ma lentamente si degrada proteine nel tempo a meno che non congelati. Sarà a discrezione del ricercatore di decidere se l'elusione di queste limitazioni varrà la pena.
Cosa importante, quando si lavora con il RNA, una tecnica sterile, mantenendo il campione sul ghiaccio, se non diversamente specificato e l'uso di decontaminazione commercialmente disponibili reagente raccomanda di mantenere intatta il RNA. In particolare, i più grandi campioni avrà bisogno più CDP per cominciare, in cui ogni solvente di estrazione dovrà anche essere scalato. Questo protocollo non richiede alcun manuale omogeneizzazione dei campioni worm o cella quando viene utilizzata la quantità corretta di CDP. Nel contesto di isolamento del DNA, il rendimento dipende fortemente la capacità di recuperare lo strato organico (rosa). Infine, per migliorare la solubilizzazione delle proteine durante l'isolamento, aumentando il volume di tampone di resolubilization o l'aggiunta di altri detergenti oltre SDS può essere necessario. Infatti, le proteine da una popolazione di soli adulti di vermi invece di una miscela di uova, larve e adulti sono molto più facili da resolubilize.
Nel complesso, usando questo protocollo fornisce un approccio integrato alla biomolecola isolamenti e facilita l'interpretazione delle correlazioni, o la loro mancanza, tra i livelli di mRNA e proteine che possono derivare dalla raccolta separatamente biomolecole da diversi campioni. Utilizzando questo metodo può aiutare gli scienziati a identificare correttamente i casi in cui la traduzione di mRNA a proteina non è correlativo e può portare all'indagine più approfondita dei meccanismi di regolazione post-trascrizionale e post-traduzionali in varie condizioni.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
L.R.L. è stato finanziato da sovvenzioni dal NIH/NIA (R00 AG042494 e AG051810 R01), un Glenn Foundation per Medical Research Award for Research in meccanismi biologici di invecchiamento e una sovvenzione di facoltà Junior della Federazione americana per la ricerca di invecchiamento. Gli autori vorrei ringraziare Anita Kumar e Shi Quan Wong per il loro feedback utile nella scrittura di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 4–15% Mini-PROTEAN® TGX Stain-Free™ Protein Gels | BIORAD | 4568084 | |
| Antibodies: | |||
| CePAS7-s | DHSB- U of Iowa | ||
| CeTAC1-s | DHSB- U of Iowa | ||
| DLG1-s | DHSB- U of Iowa | ||
| GRP78 | Novus Bio. | NBp1-06274 | |
| HRP Goat Anti-Mouse | Li-Cor | 926-80010 | |
| HRP Goat Anti-Rabbit | Li-Cor | 92680011 | |
| HSP60-s | DHSB- U of Iowa | ||
| LMP1-s | DHSB- U of Iowa | ||
| MRP-1 | Abcam | ab24102 | |
| Neuroligin 3 | Abcam | ab172798 | |
| β-actin | Millipore | MAB1501R | |
| ChemiDoc MP Imaging System | BIORAD | ||
| Chloroform | Fisher | C298-500 | Health hazard, Irritant, Toxic |
| Coomassie Brilliant Blue | ThermoSci | 20279 | |
| DC Protein assay | BIORAD | 500-0116 | |
| Epoch 2 microplate reader | BioTek | ||
| Ethanol (200 proof) | Fisher | 04-355-223 | Flammable, health hazard |
| HeLa cells | ATCC | CCL-2 | BSL2 |
| iScript Reverse Transcription Supermix | BIORAD | 1708840 | |
| Hydra microdispenser: Matrix Hydra | Robbins/ThermoFisher | ||
| Isopropanol | Fisher | A516-4 | Flammable, health hazard |
| M9 buffer: 3 g KH2PO4 6 g Na2HPO4 5 g NaCl Add H2O to 1 liter. Sterilize by autoclaving. After solution cools down, add 1 mL sterile 1 M MgSO4 | |||
| Laemmli Sample Buffer (2x) | BIORAD | 161-0737 | |
| NanoDrop One | ThermoSci | ||
| PAGE apparatus | BIORAD | ||
| Ponceau S | Alfa Aesar | J60744 | |
| Primers | IDT | 25 nmole DNA Oligo with Standard Desalting | |
| dlg-1: F (5'-GGTCCTACCA GGCAGTTGAG-3') R (5'-CACGTCCGTT AACCTCTCCC-3') | |||
| hsp-4: F (5'-AGAGGGCTTT GTCAACCCAG-3') R (5'-TCGTCAGGGT TGATTCCACG-3') | |||
| hsp-70: F (5'-CGGCATGTGA ACGTGCTAAG-3') R (5'-GAGCAGTTGA GGTCCTTCCC-3') | |||
| hsp-60: F (5'-ATTGAGCAAT CGACGAGCGA-3') R (5'-CAACACCTCC TCCTGGAACG-3') | |||
| lmp-1: F (5'-ACAACAACAC CGGACTCACG-3') R (5'-ATCGAGCTCC CACTCTTTGG-3') | |||
| tac-1: F (5'-AGTGGCAGGC AAAGTTCCTC-3') R (5'-TGAGCACCTT GATCTCGTCG-3') | |||
| pas-7: F (5'-GTACGCTCAA AAGGCTGTCG-3') R (5'-CTGAATCGGC ATTGGCTCAC-3') | |||
| mrp-1: F (5'-TTTGCCTTGC GCTTGTTCTG-3') R (5'-AGTTCCAGTG CGGAGCATAC-3') | |||
| F07C4.12: F (5'-TGCTGAGCAT GAAGGACTGT-3') R (5'-TGGCAATAGC TCCTCCGTTG-3') | |||
| HK Actin: F (5'-CTACGAACTT CCTGACGGACAAG-3') R (5'-CCGGCGGACT CCATACC-3') | |||
| HK cyn-1: F (5'-GTGTCACCAT GGAGTTGTTC-3') R (5'-TCCGTAGATT GATTCACCAC-3') | |||
| HK nhr-23: F (5'-CAGAAACACT GAAGAACGCG-3') R (5'-CGATCTGCAG TGAATAGCTC-3') | |||
| HK ama-1: F (5'-TGGAACTCTG GAGTCACACC-3') R (5'-CATCCTCCTT CATTGAACGG-3') | |||
| HK cdc-42: F (5'-CTGCTGGACA GGAAGATTACG-3') R (5'-CTCGGACATT CTCGAATGAAG-3') | |||
| HK pmp-3: F (5'-GTTCCCGTGT TCATCACTCAT-3') R (5'-ACACCGTCGA GAAGCTGTAGA-3') | |||
| LightCycler 96 qPCR machine | Roche | ||
| RIPA buffer: 10 mM Tris-Cl (pH 8.0) 1 mM EDTA 1% Triton X-100 0.2% SDS 140 mM NaCl 1 tablet of Roche protease inhibitor per 20 mL | |||
| SsoAdvanced Universal SYBR Supermix | BIORAD | 1725274 | |
| SuperSignal West Femto Max Sens Substrate | ThermoSci | 34095 | |
| Trans-Blot Transfer apparatus | BIORAD | ||
| Trans-Blot Turbo Transfer Pack | BIORAD | 170-4159 | |
| TRIzol reagent | Invitrogen | 15596026 | Health hazard (skin, eyes) |
| Worm strains: | Caenorhabditis Genetics Center (CGC) | ||
| N2 (wild type) | Caenorhabditis Genetics Center (CGC) | ||
| eat-2 (MAH95) | Caenorhabditis Genetics Center (CGC) | ||
| rsks-1 (VB633) | Caenorhabditis Genetics Center (CGC) |
Riferimenti
- Rotroff, D. M., Motsinger-Reif, A. A. Embracing Integrative Multiomics Approaches. International Journal of Genomics. 2016, 1715985 (2016).
- Chen, R., Snyder, M. Promise of personalized omics to precision medicine. Wiley Interdisciplinary Reviews: System Biology and Medicine. 5 (1), 73-82 (2013).
- Anderson, L., Seilhamer, J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 18 (3-4), 533-537 (1997).
- Harvald, E. B., et al. Multi-omics Analyses of Starvation Responses Reveal a Central Role for Lipoprotein Metabolism in Acute Starvation Survival in C. elegans. Cell Systems. 5 (1), (2017).
- Griffin, T. J., et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae. Molecular and Cell Proteomics. 1 (4), 323-333 (2002).
- Greenbaum, D., Colangelo, C., Williams, K., Gerstein, M. Comparing protein abundance and mRNA expression levels on a genomic scale. Genome Biology. 4 (9), 117 (2003).
- Lapierre, L. R., et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans. Nature Communications. 4, 2267 (2013).
- Doherty, C. J., Kay, S. A. Circadian control of global gene expression patterns. Annual Reviews Genetics. 44, 419-444 (2010).
- Goya, M. E., Romanowski, A., Caldart, C. S., Benard, C. Y., Golombek, D. A. Circadian rhythms identified in Caenorhabditis elegans by in vivo long-term monitoring of a bioluminescent reporter. Proceedings of the National Academy of Sciences USA. 113 (48), E7837-E7845 (2016).
- Dalvin, L. A., Fautsch, M. P. Analysis of Circadian Rhythm Gene Expression With Reference to Diurnal Pattern of Intraocular Pressure in Mice. Investigative Ophthalmology and Visual Science. 56 (4), 2657-2663 (2015).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Current Opinion in Structural Biology. 19 (2), 156-163 (2009).
- Swatek, K. N., Komander, D. Ubiquitin modifications. Cell Research. 26 (4), 399-422 (2016).
- Cech, T. R., Steitz, J. A. The noncoding RNA revolution-trashing old rules to forge new ones. Cell. 157 (1), 77-94 (2014).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Triant, D. A., Whitehead, A. Simultaneous Extraction of High-Quality RNA and DNA from Small Tissue Samples. Journal of Heredity. 100 (2), 246-250 (2009).
- Liu, X., Harada, S. RNA Isolation from Mammalian Samples. Current Protocols in Molecular Biology. 103 (1), 11-14 (2013).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
- Kopec, A. M., Rivera, P. D., Lacagnina, M. J., Hanamsagar, R., Bilbo, S. D. Optimized solubilization of TRIzol-precipitated protein permits Western blotting analysis to maximize data available from brain tissue. Journal of Neuroscience Methods. 280, 64-76 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Hoogewijs, D., Houthoofd, K., Matthijssens, F., Vandesompele, J., Vanfleteren, J. R. Selection and validation of a set of reliable reference genes for quantitative sod gene expression analysis in C. elegans. BMC Molecular Biology. 9 (1), 9 (2008).
- Mahmood, T., Yang, P. -. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Peach, M., Marsh, N., MacPhee, D. J., Kurien, B. T., Scofield, R. H. Protein solubilization: Attend to the choice of lysis buffer. Protein Electrophoresis: Methods and Protocols. , 37-47 (2012).
- Lakowski, B., Hekimi, S. The genetics of caloric restriction in Caenorhabditis elegans. Proceedings of the National Academy of Science USA. 95 (22), 13091-13096 (1998).
- Pan, K. Z., et al. Inhibition of mRNA translation extends lifespan in Caenorhabditis elegans. Aging Cell. 6 (1), 111-119 (2007).
- Gaudet, P., Livstone, M. S., Lewis, S. E., Thomas, P. D. Phylogenetic-based propagation of functional annotations within the Gene Ontology consortium. Briefings in Bioinformatics. 12 (5), 449-462 (2011).
- Broeks, A., Gerrard, B., Allikmets, R., Dean, M., Plasterk, R. H. Homologues of the human multidrug resistance genes MRP and MDR contribute to heavy metal resistance in the soil nematode Caenorhabditis elegans. The EMBO Journal. 15 (22), 6132-6143 (1996).
- Hadwiger, G., Dour, S., Arur, S., Fox, P., Nonet, M. L. A Monoclonal Antibody Toolkit for C. elegans. PLoS One. 5 (4), e10161 (2010).
- Kostich, M., Fire, A., Fambrough, D. M. Identification and molecular-genetic characterization of a LAMP/CD68-like protein from Caenorhabditis elegans. Journal of Cell Science. 113 (14), 2595 (2000).
- Firestein, B. L., Rongo, C. DLG-1 is a MAGUK similar to SAP97 and is required for adherens junction formation. Molecular Biology of the Cell. 12 (11), 3465-3475 (2001).
- Heschl, M. F., Baillie, D. L. Characterization of the hsp70 multigene family of Caenorhabditis elegans. DNA. 8 (4), 233-243 (1989).
- Yoneda, T., et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. Journal of Cell Science. 117 (18), 4055 (2004).
- Takahashi, M., Iwasaki, H., Inoue, H., Takahashi, K. Reverse Genetic Analysis of the Caenorhabditis elegans 26S Proteasome Subunits by RNA Interference. Biological Chemistry. 383, 1263 (2002).
- Le Bot, N., Tsai, M. C., Andrews, R. K., Ahringer, J. TAC-1, a regulator of microtubule length in the C. elegans embryo. Current Biology. 13 (17), 1499-1505 (2003).
- McQuary, P. R., et al. C. elegans S6K Mutants Require a Creatine-Kinase-like Effector for Lifespan Extension. Cell Reports. 14 (9), 2059-2067 (2016).
- Larance, M., et al. Global Proteomics Analysis of the Response to Starvation in C. elegans . Molecular and Cell Proteomics. 14 (7), 1989-2001 (2015).
- Yuan, Y., et al. Enhanced energy metabolism contributes to the extended life span of calorie-restricted Caenorhabditis elegans. Journal of Biological Chemistry. 287 (37), 31414-31426 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon