Method Article
在鼻内siRNA输送到中枢神经系统期间放置小鼠的定位装置
摘要
在这里,我们提出了一个协议,使用鼠标定位装置,使小鼠能够适当地放置,用于脑靶向肽-siRNA配方的内源性给政,从而在中枢神经系统中实现有效的基因沉默。
摘要
内鼻 (IN) 药物输送到大脑已成为绕过血脑屏障 (BBB) 将药物输送到中枢神经系统 (CNS) 的一种有希望的方法。最近的研究表明,使用肽RVG9R,结合狂犬病病毒糖蛋白的最小受体结合域,诱导siRNA输送到大脑的神经元。在此协议中,肽-siRNA配方在显性手中用移液器进行内送,而麻醉小鼠则被非主导手的"头向下和向前位置"的刮毛所抑制,以避免排入肺部和胃吸入后。这种精确的小鼠抓握可以学习,但并不容易,需要实践和技能,导致有效的CNS接受。此外,这个过程是漫长的,需要大约45分钟,每次吸入1-2μL液滴体积中,总体积为±20-30μL溶液,每次吸入之间休息3-4分钟。本研究的目的是揭示一种小鼠定位装置,使小鼠能够适当放置,以便有效地给肽-siRNA配方进行IN管理。多个功能被纳入设备的设计,如四或八个定位椅,可调高和倾斜,以抑制麻醉小鼠在头部向下和向前的位置,使小鼠的鼻和内置加热垫,在手术过程中保持小鼠的体温。重要的是,以这种方式使用RVG9R-siRNA复合物同时治疗四到八只小鼠的能力,使得研究能够以更快的速度进行,以测试IN治疗性siRNA方法。总之,该装置允许适当和受控的小鼠头定位,用于在内应用RVG9R-siRNA和其他治疗分子,如纳米颗粒或抗体,用于CNS输送。
引言
BBB防止系统施用的>400-600 Da分子进入大脑,对治疗性生物分子的提供对影响中枢神经系统和大脑1的疾病构成重大挑战。直接将药物输送到大脑可以通过立体定向注射实现;然而,这需要外科专业知识,并高度限制在交付到接近注射部位的区域,使其不适合常规临床使用2。通过绕过BBB,向大脑输送也会导致直接的大脑传递,允许各种物质直接和快速地传输到大脑3,4。这种转移被认为是通过嗅觉和三叉神经的传递机制发生的,这些神经将鼻腔通道连接到大脑、脑脊液和淋巴系统5。由于直接的鼻子到脑的路线不涉及周围器官和组织,它大大减少了系统副作用,提高了效力。IN管理是一种有前途的非侵入性替代本地和系统途径的大脑交付治疗剂,并可能代表一个强大的方法,以对抗神经系统疾病,包括阿尔茨海默病,帕金森病,和脑癌,并正在探索在几个临床试验6,7,8。
几个实验因素,如接种量和方法,以及制剂pH,通过鼻对脑途径9对中枢神经系统的输药有强烈的影响。在与小鼠的研究中,IN药物输送的成功在很大程度上取决于正确的头部定位,这对于有效的脑沉积和避免药物排入外部环境或气道至关重要。值得注意的是,大多数啮齿动物研究采用头背位置(supine),倾斜70°-90°,用于将药物输送到嗅觉上皮,即使头部定位在0°可能有利于排入气管9。与在苏普因位置的任何应用相比,在醒着的小鼠中提供药物会导致大脑沉积减少,这主要是因为科学家无法将小鼠置于所需位置更长时间。此外,醒着小鼠的皮肤抓握方法所需的倒置位置导致药物沉积主要在三叉神经和嗅球,以及周围器官,如肾脏和肺,在30分钟内接种后10.临床研究中通过大型动物(如非人类灵长类动物)的嗅觉或三叉神经提供治疗药物的最适当的身体位置似乎是头向下和向前的位置(即所谓的"到麦加祈祷")位置")11.然而,在小鼠模型中,这一位置尚未得到很好的研究,在啮齿动物研究中,其位置得到了更广泛的应用。
此前,我们已经表明,RVG9R,一种基于狂犬病病毒的最小受体结合域设计的肽,对表达尼古丁乙酰胆碱受体亚单位的细胞(如神经元和巨噬细胞)表现出对流蛋白,并介导细胞内通过受体参与和受体聚集部位的临时血浆膜脱定位的机制进行siRNA的传递。12、13。重要的是,RVG9R-siRNA复合物的全身静脉注射使siRNA的血管传递到CNS14。然而,系统途径稀释了交付给CNS的siRNA量,最近的数据表明,对位于头部向下和向前位置的小鼠的IN给小鼠的IN给小鼠,导致广泛传播的目标基因敲除。大脑的多个区域15。重要的是,在四剂2天疗养中,只需使用13.5 μg的siRNA,就达到了这种击倒水平,而IV路线需要每次注射的剂量提高5倍,以实现可比的击倒。IN 方法的唯一缺点是,这是一个艰巨的程序,要求在管理解决方案时使用双手,同时持续地将小鼠抓住头部,然后向下和向前,在两者之间处于放松的位置。每次吸入治疗时间相当长(每次吸入30-45分钟,有效吸出每只小鼠20-30μL体积)。使用此处提供的鼠标定位装置,能够正确放置对动物和执行协议的人员进行物理胁迫的小鼠,并在合理的时间内对多群小鼠进行治疗,在疾病晚期,对使用siRNA治疗西尼罗河脑炎的小鼠进行深入研究。
研究方案
所有实验均符合汉阳大学动物护理和使用委员会批准的指南和规程。在本协议中,使用重达20-25克的6周大Balb/c小鼠(每组n = 3)。这些动物被安置在一个无病原体的设施中,在可控的温度和湿度水平上有12小时的光/暗循环,可以自由获得水和食物。
1. 设备组装
- 组装定位装置的各个部件,如图1A所示。
注:器件由单个部件提供,易于组装和拆卸。
2. 材料设置
注:液化药物的内药管理需要以下预处理步骤。
- 准备所需的材料,包括定位装置、10 μL 微移液器、10 μL 微移液器尖端、治疗溶液(例如 RVG9R-siRNA 复合物)、定时时钟和 70% 乙醇(参见图 2A)。
- 在实验前至少 15-20 分钟,插入电源代码以打开设备加热系统。动物实验的最佳温度自动保持在+37°C。
- 以1:0.5:8.5的比例制备麻醉氯胺酮:西拉津:磷酸盐缓冲盐水(PBS),每只小鼠注射一次腹内(i.p.),最终体积为每20克小鼠200μL。
注:请注意,任何优化的药物,以确保麻醉条件在30-45分钟期间可以使用。
3. 鼠标定位
- 通过踏板反射(坚定的脚趾捏)评估麻醉水平,以保持手术平面。
- 将定位装置放置在适当的距离和高度,以便方便地访问所有需要的试剂。
- 一旦小鼠被正确麻醉,用拇指和指针手指轻轻抬起每只老鼠的脖子,并将其放在指定的椅子上。
- 在这个阶段,将鼠标正确定位在椅子上非常重要。将鼠标的后背与椅子的后背平行放置,在 90° 处放在座椅上。抬起鼠标的手,让动物自然地躺在头部向下和向前的位置,无需推或按,如图2B所示。当动物处于这种放松的位置时,确保小鼠的前肢提供自然支撑,对小鼠没有任何不适。
- 一旦小鼠被正确定位,用椅子带将小鼠绑在内,然后立即开始IN接种。
4. 内期交付
注:此协议描述了使用鼠标定位装置的RVG9R:siRNA复合物的IN交付。使用此协议,在 2 μL 滴落中,可轻松为每个小鼠施用最多 20-30 μL 的溶液。此体积低于小鼠的鼻腔,即0.032 cm 3,因此该过程不会导致致命的鼻孔阻塞或窒息。该协议允许同时接种至少四只小鼠和每个设备最多八只小鼠,从而优化时间并减少可变性。
- 取取 10 μL 微管,并将其调整到 2 μL。
- 用2μL的RVG9R:siRNA复合溶液加载微管(例如,5.2 μg的siCy5复合物与104μg的RVG9R进行输送实验,13.5μg的siSOD1与270μg的RVG9R复合用于沉默实验,最终体积为25μL的PBS 5%葡萄糖。
- 将移液器握在主导手上时,通过将弯头放在工作台上来调整位置。用另一只手支撑手部,避免在管理时不受控制地移动。
- 将 ±2 μL 的落差放在非常接近一个鼻孔的位置,以便鼠标可以直接吸入滴(参见图2B)。如果不容易形成一个小的滴,则用新的移液器尖端替换,然后重复操作。使用秒表验证接种之间的时间间隔。
- 此装置允许一次治疗至少四只小鼠。如果另一组小鼠需要重复步骤 4.4,请在第一栏上方或下方设置四把椅子,并设置四把椅子,以便一次在设备上容纳多达 8 只鼠标。
- 在第一次接种后 3-4 分钟后,用另一个鼻孔重复步骤 4.4。这个时间间隔足以让小鼠完成第一剂的吸入并恢复正常的呼吸。如果吸入溶液的一滴由于意外从小鼠的鼻吸出而脱落,则重新接种另外2μL溶液。
- 用备用鼻孔重复整个过程,直到20-30 μL剂量完成。完成整个接种过程需要约30-45分钟。
- 在老鼠回到指定的笼子里之前,先把湿的鱼膏放在老鼠的眼上。
注意:在小鼠恢复足够的意识以维持胸腔回位之前,不要让小鼠无人看管。
5. 数据分析
- 为了确认标有氟标记的RVG9R的大脑沉积,对小鼠进行麻醉(如步骤2.3所述),并分离大脑以及其他外围器官,如肺、肝、脾和肾脏。将每个器官放在图像站上,并使用 ImageStation 可视化荧光。
- 要可视化 Cy5 标签下的荧光,请准备 20 μm 厚的低温节,与 Hoechst 33342 共染色,并使用共聚焦显微镜执行全脑扫描。
- 为了评估基因沉默,从各种大脑区域中提取RNA,如嗅球、皮层、海马、丘脑、下丘脑、小脑和脑干,使用RNA纯化试剂盒,反向转录到cDNA中。合成试剂盒,并执行qPCR与引物对如前15所述。
结果
在IN管理期间,头部位置对向大脑输送药物的效率有重要影响。在这里,我们描述了头部向下和向前的位置,使用鼠标定位装置为IN给脑靶向肽-siRNA配方,将混合物输送到小鼠的CNS。为了验证通过IN途径的传递,我们使用RVG9R肽,先前证明能有效地结合在体外和体内的神经元细胞14,16。
我们首先使用此处描述的鼠标定位装置测试了标有 Alexa Fluor 488 (RVG9R-A488)的 RVG9R 肽的鼻子到大脑传递。在接种后48小时,各种器官,包括大脑,网下,肺,肝脏,脾脏和肾脏被切除,以测量组织相关的A488荧光。单独488或对照肽(RVM9R-A488)14不结合nAchR,被用作负对照。不出所料,在接种后48小时(图3A,左)的任何器官均未发现A488和RVM9R-A488。另一方面,在RVG9R接种组的大脑中专门检测到强荧光A488信号。此外,我们比较了这种小鼠放置位置与先前使用的苏比恩位置方法,以及唤醒方法,以提高效率。我们在接种后48小时接种了固定量的RVG9R-A 488(100μg)和测定生物分布。结果表明,将小鼠头部上下定位,改善了RVG9R-A488在整个脑组织的渗透和沉积(图3A,右图)。相比之下,在苏普恩位置接种的动物导致RVG9R-A488输送到大脑,但不如定位装置方法那样强。为了进一步确认siRNA向大脑传递,我们在将RVG9R复合物的单个IN给基5标记的siRNA400pmol(5.2 μg)后进行了全脑扫描。与PBS或RVM9R相比,与RVG9R复合导致在主要大脑区域,包括嗅球、皮层、海马、丘脑、下丘脑、中脑和小脑(图3B)中,siRNA的强积累).
最后,我们采用RT-qPCR分析来验证针对超氧化物歧化酶-1(SOD1)基因的功能性siRNA的细胞内传递。小鼠连续接种RVG9R:siSOD1(13.2 μg siRNA),在上次接种后24小时对SOD1 mRNA表达进行内接种。RVG9R:siSOD1给政导致嗅球(63%)、皮层(47%)、海马(61%)、丘脑(53%)、下丘脑(55%)、中脑(39%)和小脑(30%)中的SOD1表达大幅减少。(图4)总之,使用定位装置可以方便小鼠接种RVG9R复合型siRNA,从而诱导目标基因的脑特异性siRNA传递诱导功能沉默。
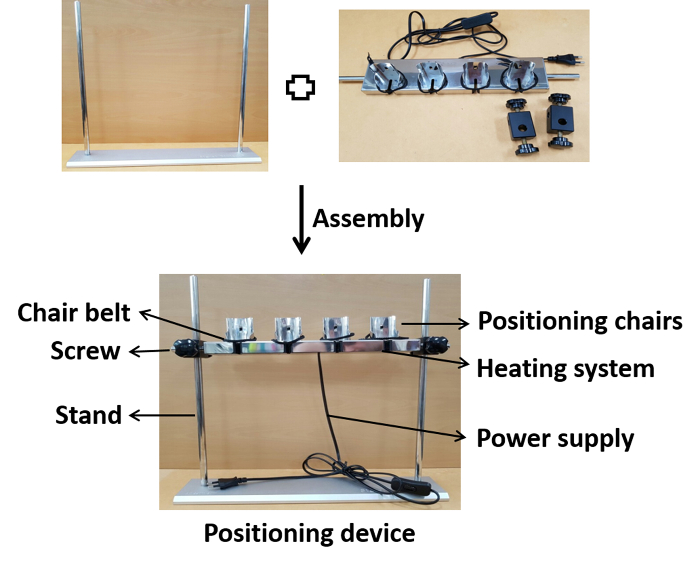
图 1:设备组件的摄影演示。定位椅用螺钉组装在适当的高度上。组装后,设备连接到电源,用于在接种期间加热到生理温度。请点击此处查看此图的较大版本。

图 2:使用定位装置对IN接种过程进行照片演示。(A) IN接种所需的实验设备.(B) 头部向下和向前位置的动物坐在设备上(左)和2μL滴的沉积,用于接种(右)。请点击此处查看此图的较大版本。
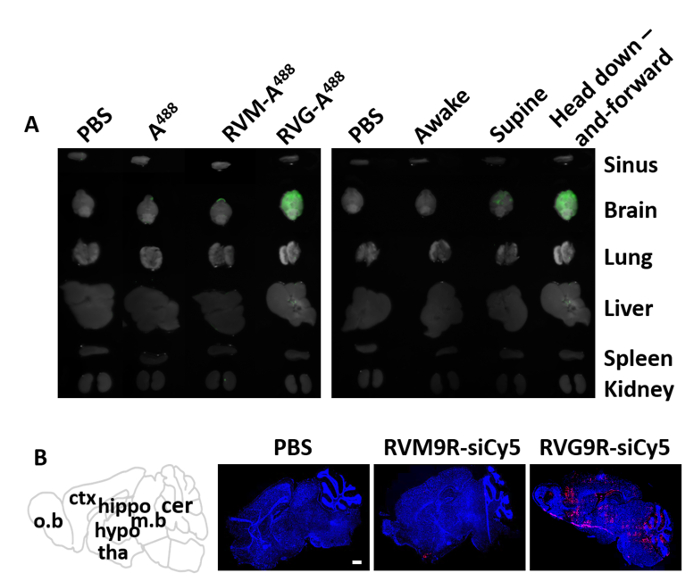
图 3:在IN给给后,荧光标记肽和siRNA的分布。(A) 单次接种后48小时内输气RVG9R肽的生物分布。大脑和其他周围器官被评估为接种盐水(PBS)、A 488、RVM-A488和RVG-A488(左)的小鼠存在荧光。在小鼠清醒时,在苏佩位置和在小鼠定位装置中,在头部向下和向前位置(右)进行上述处理的小鼠的成像。(B) RVG9R:siRNA复合物在大脑中的生物分布(n = 每组3)。Cy5标记siRNA的分布在全脑冷冻区可视化,使用共聚焦激光显微镜在动物接种盐水(PBS),siRNA与对照肽(RVM9R-siCy5)复合,或大脑靶向肽RVG9R(RVG9R-siCy5)。刻度条表示 1 mm. 缩写: o.b = 嗅球;ctx = 皮层;海马 + 海马;低丘脑 = 下丘脑;塔 = 丘拉木;m.b = 中脑;cer = 小脑。请点击此处查看此图的较大版本。
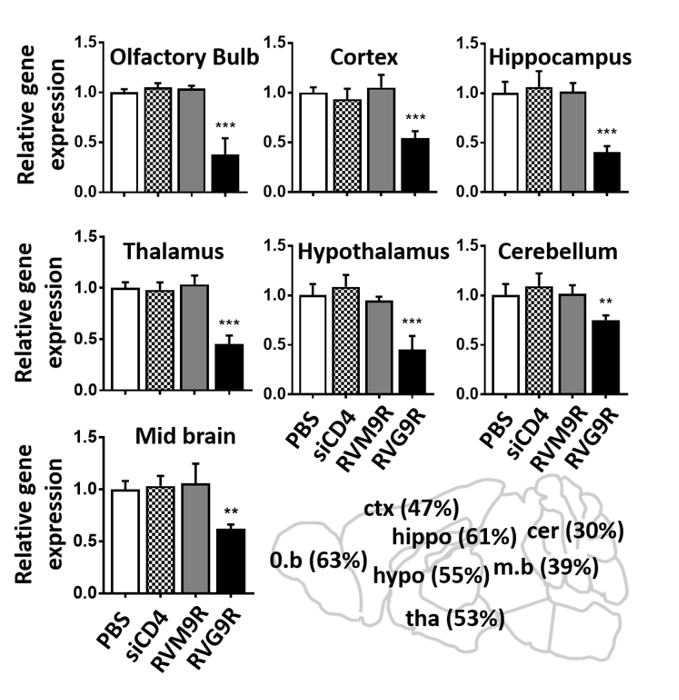
图 4:在RVG9R:siSOD1的应用中,诱导大脑多个区域的目标基因沉默。qPCR 分析在指示的大脑区域中 24 小时后 24 h 下最后 IN 接种盐水 (PBS), RVG9R:siCD4 (siCD4), RVM9R:siSOD1 (RVM9R) 和 RVG9R:siSOD1 (RVG9R).显示嗅球、皮层、海马(上部)、丘脑、下丘脑、小脑(中)和中脑(下)的相对SOD1沉默。数据表示与盐类处理小鼠的相应数据(n = 每组 3)规范化后相对于 GAPDH的平均值 = SD。显示 IN 接种后指示大脑区域中 SOD1 mRNA 的百分比的卡通(右下)。•P < 0.01, ==P < 0.001。缩写: o.b = 嗅球;ctx = 皮层;海马 + 海马;低 =海马;塔 = 丘拉木;m.b = 中脑;cer = 小脑。请点击此处查看此图的较大版本。
讨论
我们开发了一种小鼠定位装置,用于最佳定位小鼠,用于治疗药物的鼻子到大脑。该设备具有不同的功能,确保动物易于同时操作。它还配备了加热垫,用于在实验期间维持动物的生理体温。麻醉小鼠可以通过专门设计的椅子保持头部向下和向前的位置,对动物的不适最小。定位椅的高度可以调整的方式,最好是可视化动物鼻孔,同时给药。
大脑输送有几个内在的局限性,包括鼻孔的表面面积小(每次给塞最大体积为20-30μL),鼻刺激,上皮损伤,以及鼻腔上皮18的吸收受限。通过移液器或聚氨酯管(24 G x 19 mm)将液体药物滴入动物的替代鼻孔(24 G x 19 mm),用于大脑输送。20.虽然使用管道系统在嗅觉上皮附近释放药物是一种可能合适的方法,但它在重复给药后会引起刺激或鼻炎。此外,鼻腔的体积小限制了这种方法,特别是在小鼠中,可以通过重复和药物配方,坚持在鼻黏粘中克服。另一种选择是IN管理治疗唤醒小鼠10。然而,这种方法要求在接种期间进行熟练的动物处理程序。此外,它会导致动物压力,因此,不是理想的疾病模型,特别是传染病模型。此外,由于动物抓取不完美,药物引入肺部或胃部很容易导致给药不一致。这里介绍的方法使科学家能够克服这些技术障碍。头部向下和向前的位置减少药物泄漏的可能性从鼻子到肺部,而吸入,有利于直接和选择性的siRNA传递到大脑。使用鼠标定位装置进行分娩不需要任何专门技术在接种期间处理或抓取动物。一次治疗四只动物至少30-45分钟。该过程可以通过增加一个四主席杆来扩大,以便在同一实验环节中轻松管理多达8只小鼠。因此,按照这种方法,单个操作者可以诱导药物长期输送到大群动物的大脑。
鼻腔的解剖结构对鼻子到大脑的传递有强烈的影响(正如Merkus等人11和Ruigrok和deLange21所评论的)。小鼠鼻腔的相对表面积是人体的15倍,嗅觉上皮的相对表面积是人大6倍。虽然人类鼻腔解剖学与啮齿动物存在显著差异,但使用IN方法治疗多种脑部疾病(www.clinicaltrials.gov)的临床试验正在进行中。这里介绍的研究表明,在使用IN输送治疗药物时,科学家应考虑几个因素,如头部位置、睡眠和适当的输送剂。
我们已经显示了荧光标记siRNA在小鼠大脑中的有效和具体沉积。此外,在IN siRNA传递后观察到的SOD1基因表达显著减少,证实了功能效应。我们先前一直表明,针对西尼罗河病毒(WNV)RNA的RVG9R-siRNA复合物的IN给药对WNV脑炎15具有强大的治疗作用。值得注意的是,鼻子到大脑的siRNA传递需要细胞靶向配体(RVG)和带正电荷的分子(9R)到复杂的siRNA。在缺乏这些元素的情况下,分子通过系统回路和淋巴血管被清除48小时后处理(图3A)15。因此,在本文描述的实验设置中,我们研究了肽/siRNA在接种后48小时定位,只对大脑中专门保留的液位进行成像。这种方法可以很容易地用于其他分子,如蛋白质,肽,纳米粒子,或其他治疗,用于治疗一些与大脑有关的疾病。
披露声明
P.K.和S.K.L.是Signet生物技术的联合创始人。P.K.是PCT/US07/12,152专利的专利发明人,部分包括与RVG9R相关的索赔。I.U.、K.C.、P.K.和S.K.L.被列为已提交专利(PCT/KR2016/014220)的专利的共发明者,其中包括与鼠标定位装置相关的权利要求。
致谢
这项工作得到了韩国卫生福利部(HI17C1046)对S.K.L.的支持。
材料
| Name | Company | Catalog Number | Comments |
| Comercial assays | |||
| iScript cDNA synthesis kit | BioRad | Cat# 1708891 | |
| RNAiso plus | TaKaRa Bio | Cat# 9108 | |
| SYBR Premix ExTaq | TaKaRa Bio | Cat# RR420A | |
| Dyes | |||
| Alexa fluor 488 | ThermoFisher | Cat# A30052 | |
| Mouse strain | |||
| Balb/c | Orient Bio | N/A | 6-8 week old, 20-30g |
| Oligonucleotides and primers | |||
| Human CD4 | ST Pharm | N/A | Sense: 5’-GAUCAAGAGACUCCUCAGU-3’ |
| siSOD1 | ST Pharm | N/A | Sense: 5’-GGUGGAAAUGAAGAAAGUA-3’ |
| GAPDH primers | ST Pharm | N/A | F: 5’-AACTTTGGCATTGTGGAAGG-3’ R: 5’-GGAGACAACCTGGTCCTCAG-3’ |
| SOD1 primers | ST Pharm | N/A | F: 5’-CCAGTGCAGGACCTCATTTT-3’ R: 5’-CACCTTTGCCCAAGTCATCT-3’ |
| Peptides | |||
| RVG9R | Peptron | N/A | YTIWMPENPRPGTPCDIFTNSR GKRASNGGGGRRRRRRRRR |
| RVM9R | Peptron | N/A | MNLLRKIVKNRRDEDTQKSS PASAPLDGGGGRRRRRRRRR |
| Software, algorithms and devices | |||
| FlowJo software 4.3 | FlowJO, LLC | N/A | http://docs.flowjo.com/vx/ |
| Mouse positioning device | Signet Biotech | N/A | |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
参考文献
- Pardridge, W. M. The blood-brain barrier: bottleneck in brain drug development. NeuroRx. 2, 3-14 (2005).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (ICV) and intravenous (IV) injection in mice. Journal of Visualized Experiments. (56), e2968(2011).
- Khan, A. R., Liu, M., Khan, M. W., Zhai, G. Progress in brain targeting drug delivery system by nasal route. Journal of Controlled Release. 268, 364-389 (2017).
- Meredith, M. E., Salameh, T. S., Banks, W. A. Intranasal delivery of proteins and peptides in the treatment of neurodegenerative diseases. The AAPS Journal. 17, 780-787 (2015).
- Pardeshi, C. V., Belgamwar, V. S. Direct nose to brain drug delivery via integrated nerve pathways bypassing the blood-brain barrier: an excellent platform for brain targeting. Expert Opinion on Drug Delivery. 10, 957-972 (2013).
- Agrawal, M., et al. Nose-to-brain drug delivery: An update on clinical challenges and progress towards approval of anti-Alzheimer drugs. Journal of Controlled Release. 281, 139-177 (2018).
- Van Woensel, M., et al. Formulations for intranasal delivery of pharmacological agents to combat brain disease: a new opportunity to tackle GBM. Cancers. 5, 1020-1048 (2013).
- Kulkarni, A. D., et al. Nanotechnology-mediated nose to brain drug delivery for Parkinson's disease: a mini review. Journal of Drug Targeting. 23, 775-788 (2015).
- Dhuria, S. V., Hanson, L. R., Frey, W. H. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99, 1654-1673 (2010).
- Hanson, L. R., Fine, J. M., Svitak, A. L., Faltesek, K. A. Intranasal administration of CNS therapeutics to awake mice. Journal of Visualized Experiments. (74), e4440(2013).
- Merkus, P., Ebbens, F. A., Muller, B., Fokkens, W. J. Influence of anatomy and head position on intranasal drug deposition. European Archives of Oto-Rhino-Laryngology and Head & Neck. 263, 827-832 (2006).
- Zeller, S., et al. Attachment of cell-binding ligands to arginine-rich cell-penetrating peptides enables cytosolic translocation of complexed siRNA. Chemistry & Biology. 22, 50-62 (2015).
- Kim, J., et al. Silencing CCR2 in macrophages alleviates adipose tissue inflammation and the associated metabolic syndrome in dietary obese mice. Molecular Therapy-Nucleic Acids. 5, (2016).
- Kumar, P., et al. Transvascular delivery of small interfering RNA to the central nervous system. Nature. 448, 39(2007).
- Beloor, J., et al. Small interfering RNA-mediated control of virus replication in the CNS is therapeutic and enables natural immunity to West Nile virus. Cell Host & Microbe. 23, 549-556 (2018).
- Ullah, I., et al. Trileucine residues in a ligand-CPP-based siRNA delivery platform improve endosomal escape of siRNA. Journal of Drug Targeting. 25, 320-329 (2017).
- Yu, D., Li, G., Lesniak, M. S., Balyasnikova, I. V. Intranasal delivery of therapeutic stem cells to glioblastoma in a mouse model. Journal of Visualized Experiments. (124), e55845(2017).
- Mittal, D., et al. Insights into direct nose to brain delivery: current status and future perspective. Drug Delivery. 21, 75-86 (2014).
- Renner, D. B., Frey, W. H., Hanson, L. R. Intranasal delivery of siRNA to the olfactory bulbs of mice via the olfactory nerve pathway. Neuroscience Letters. 513, 193-197 (2012).
- Serralheiro, A., Alves, G., Fortuna, A., Falcão, A. Intranasal administration of carbamazepine to mice: a direct delivery pathway for brain targeting. European Journal of Pharmaceutical Sciences. 60, 32-39 (2014).
- Ruigrok, M. J., de Lange, E. C. Emerging insights for translational pharmacokinetic and pharmacokinetic-pharmacodynamic studies: towards prediction of nose-to-brain transport in humans. The AAPS Journal. 17, 493-505 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。