Method Article
中枢神経系への鼻腔内siRNA送達中におけるマウスの配置のための位置決め装置
要約
ここでは、脳標的ペプチドsiRNA製剤の鼻腔内投与に対するマウスの適切な配置を可能にするマウス位置決め装置を用いて、中枢神経系における有効な遺伝子サイレンシングを可能にするプロトコルを提示する。
要約
脳への鼻腔内(IN)薬物送達は、中枢神経系(CNS)への薬物の送達のための血液脳関門(BBB)をバイパスする有望な方法として出現した。最近の研究は、脳ウイルス糖タンパク質の最小受容体結合ドメインを組み込んだペプチドRVG9Rの使用を実証し、脳内のニューロンへのsiRNAの送達を引き出す。このプロトコルでは、ペプチド-siRNA製剤は、支配的な手にピペットを持つ内在として送達され、麻酔マウスは肺への排液を避けるために「頭の下と前方の位置」で非支配的な手でスクラフトによって拘束される。吸入時に胃を。マウスのこの正確なグリップは学ぶことができますが、容易ではなく、効果的なCNS取り込みをもたらすには練習とスキルが必要です。さらに、このプロセスは長引きであり、吸入当たり1〜2μL液量で〜20〜30μLの溶液の総体積の投与に約45分を要し、吸入の間に3〜4分の休息期間を要する。本研究の目的は、ペプチド-siRNA製剤の効率的なIN投与のためのマウスの適切な配置を可能にするマウス位置決め装置を開示することである。複数の機能がデバイスの設計に組み込まれており、調整可能な高さと傾斜を持つ4つまたは8つのポジショニングチェアが頭部の下向きの位置で麻酔されたマウスを拘束し、マウスのナレとマウスの容易な視覚化を可能にします。プロシージャの間にマウスの体温を維持するために作り付けの暖房パッド。重要なことは、この方法でRVG9R-siRNA複合体と同時に4〜8匹のマウスを治療する能力は、IN治療用siRNAアプローチの試験のために、はるかに速い時間スケールでの研究を可能にする。結論として、この装置は、RVG9R-siRNAおよびナノ粒子または抗体などの他の治療分子のIN適用のための適切で制御されたマウスヘッド位置決めをCNS送達のために可能にする。
概要
BBBは、>400-600 Daの全身投与分子が脳に入るのを防ぎ、CNSおよび脳1に影響を与える疾患に対する治療生体分子の送達に重大な課題を提起する。脳への直接薬物送達は、定位注射によって達成することができる。しかし、これは外科的専門知識を必要とし、注射部位に近い領域への送達に非常に制限されており、日常的な臨床使用には不向きです2.脳へのIN送達はまた、BBBをバイパスすることによって直接脳送達をもたらし、脳3、4への様々な物質の直接的かつ迅速な移動を可能にする。この転移は、鼻の通路を脳、脳脊髄液、およびリンパ系5に接続する嗅覚および三叉神経を介した輸送機構によって起こると考えられている。直接の鼻から脳へのルートは末梢器官や組織を含まないため、全身的な副作用を実質的に減少させ、効力を向上させます。IN投与は、治療薬の脳送達のための局所的および全身的経路の両方に有望な非侵襲的な代替物であり、アルツハイマー病、パーキンソン病、およびおよびを含む神経疾患と戦うための強力なアプローチを表すかもしれない。脳癌、およびいくつかの臨床試験6、7、8で探索されている。
接種量および接種方法、ならびに製剤pHなどのいくつかの実験因子は、鼻から脳への経路9を介したCNSへの薬物送達に強く影響を与える。マウスを用いた研究では、IN薬物送達の成功は、効率的な脳沈着のために重要であり、外部環境や気道への薬物の排液を避けるために重要である適切な頭部位置決めに強く依存する。特に、げっ歯類研究の大半は、0°での頭部位置が気管9への排水を好むかもしれないにもかかわらず、嗅覚上皮への薬物送達のための70°-90°傾きを持つヘッドバック位置(supine)を採用しています。目を覚ますマウスでの薬物のIN送達は、主に科学者が長期間、所望の位置にマウスを保持することができないため、スナシン位置の任意のアプリケーションと比較して、脳沈着が減少する結果をもたらす。さらに、覚醒マウスに用いられる皮膚グリップ法で必要とされる逆さまの位置は、主に三叉神経と嗅球、ならびに腎臓や肺などの末梢器官に30分以内に薬物沈着をもたらす。接種後 10.臨床研究における非ヒト霊長類のような大きな動物における嗅覚または三叉神経を介した治療の送達に最も適切な身体位置は、頭部の下向きの位置であるように見える(すなわち、いわゆる「メッカへの祈り」)位置")11.しかし、この位置はマウスモデルではよく研究されておらず、げっ歯類の研究では上の位置がより広く使用されています。
以前に、RVG9Rは、狂犬病ウイルスの最小受容体結合ドメインに基づいて設計されたペプチドが、ニューロンやマクロファージのようなニコチン性アセチルコリン受容体サブユニットを発現する細胞に対して栄養を表示し、受容体凝集部位における受容体関与および一時的な血漿膜脱局性を伴うメカニズムによるsiRNAの細胞内送達12,13.重要なことに、RVG9R-siRNA複合体の全身静脈内投与は、CNS14へのsiRNAの血管送達を可能にする。しかし、全身経路はCNSに送達されるsiRNAの量を希釈し、最近のデータは、頭部の下向き位置に位置するマウスに対するRVG9R:siRNA複合体のIN投与が広範囲に及ぶ標的遺伝子ノックダウンを引き起こしていることを示している。脳の複数の領域15.重要なことに、このレベルのノックダウンは、IVルートが同等のノックダウンを達成するために注射当たり約5倍の高用量を必要とする一方で、4回投与、2日間のレジメンで投与されたsiRNAのわずか13.5 μgで達成された。INアプローチの唯一の欠点は、それが困難な手順であり、溶液の投与中に両手を使用する必要がある一方で、マウスを頭の下から前方に連続的につかみ、間のリラックスした位置で交互につかむことです。かなりの長い処置期間のための各吸入(マウスごとの〜20-30 μL容積の有効な取り込みのための30-45分のプロシージャ)。ここで提示したマウスポジショニング装置を使用することで、動物やプロトコルを実行する担当者に対する身体的な取り組みがほとんどないマウスの適切な配置と、合理的な期間内にマウスの複数のコホートの治療を行うことが可能となり、疾患15の後期段階におけるマウスにおける西ナイル脳炎の治療薬としてsiRNAを使用する詳細な研究を可能にする。
プロトコル
すべての実験は、漢陽大学の動物ケアと使用委員会によって承認されたガイドラインとプロトコルに従って行われました.このプロトコルでは、20〜25gの重さの6週齢のBalb/cマウスを使用した(n=3群)。動物は、水と食糧への自由なアクセスと制御された温度と湿度レベルで12時間の光/暗いサイクルを持つ病原体のない施設に収容されました。
1. デバイスアセンブリ
- 図 1Aに示すように、測位装置の個々の部分を組み立てます。
注:装置は容易に組み立てられ、分解することができる個々の部品で供給される。
2. 材料の設定
注:液化薬のIN投与には、以下の前処理ステップが必要です。
- 測位装置、10μLマイクロピペット、10μLマイクロピペットチップ、治療液(例えば、RVG9R-siRNA複合体)、タイマークロック、および70%エタノール(図2A参照)を含む必要な材料を調製する。
- 実験の少なくとも15〜20分前にデバイスの暖房システムをオンにするには、電源コードを差し込みます。動物実験に最適な温度は~37°Cで自動的に維持されます。
- 麻酔ケタミンを調製する:キシラジン:リン酸緩衝生理食べ物(PBS)を1:0.5:8.5の比率で調製し、20gマウス当たり200μLの最終容積で単一の食前内(i.p.)注射で各マウスを麻酔する。
注:30〜45分の期間の麻酔状態を確保するための最適化された薬物を使用することができることに注意してください。
3. マウスの位置決め
- 外科面を維持するためにペダル反射(しっかりしたつま先のピンチ)によって麻酔のレベルを評価する。
- すべての必要な試薬への便利なアクセスを提供するように、配置装置を適切な距離と高さに置きます。
- マウスが適切に麻酔されたら、親指とポインターの指で首の擦り傷で各マウスをそっと持ち上げ、指定された椅子の上に置きます。
- 椅子の上のマウスの適切な位置は、この段階で非常に重要です。マウスの背中を椅子の背面サポートに平行に置き、90°で椅子の座席に置きます。図 2Bに示すように、マウスから手を離し、動物を頭を下にして押さずに自然に横たわるようにします。動物がこのリラックスした位置にいる間、マウスの前肢が自然なサポートを提供することを確認します。
- マウスが適切に配置されたら、マウスを椅子ベルトでストラップし、すぐにIN接種を開始します。
4. 鼻腔内送達
注:このプロトコルは、マウス位置決め装置を用いてRVG9R:siRNA複合体のIN送達について説明する。このプロトコルを使用すると、最大20~30μLの溶液を2μL滴で各マウスに簡単に投与できます。この容積は、0.032 cm3であるマウスの鼻腔のそれよりも低いので、手順は致命的な鼻孔閉塞や窒息をもたらさない。このプロトコルは、少なくとも4匹のマウスとデバイスあたり最大8匹のマウスの同時接種を可能にし、時間の最適化と変動性の低下をもたらす。
- 10 μL マイクロピペットを取り、2 μL に調整します。
- RVG9Rの2 μLでマイクロピペットをロードする:siRNA複合溶液(例えば、送達実験用のRVG9Rの104 μgと複合体化されたsiCy5の5.2 μg、およびサイレンシング実験用のRVG9Rの270 μgと複合体化されたsiSOD1の13.5 μg、PBSの最終容積で 5%のブドウ糖。
- ピペットを支配的な手に持ちながら、ベンチトップに肘を置いて位置を調整します。管理中の制御されていない動きを避けるために、もう一方の手でピペットを保持する手をサポートします。
- マウスが液滴を直接吸入できるように、1つの鼻孔の近くに~2 μL滴を置きます(図2Bを参照)。小さなドロップが簡単に形成されない場合は、ピペットの先端を新しいチップに交換し、操作を繰り返します。ストップウォッチを使用して、接種間の時間間隔を確認します。
- この装置は一度に少なくとも4匹のマウスの処置を可能にする。別のマウス群がステップ4.4を繰り返す必要がある場合は、デバイス上で一度に最大8匹のマウスを収容するために、最初のバーの上または下に4つの椅子を持つ別のバーを設定します。
- 最初の接種から3-4分後に他の鼻孔でステップ4.4を繰り返します。この時間間隔は、マウスが最初の用量の吸入を完了し、正常な呼吸を回復するのに十分である。吸入した溶液の滴がマウスのナリスから偶発的にいびきをかいたために取り除かれた場合は、さらに2μLの溶液を再接種する。
- 20-30 μLの用量が終わるまで、交互の鼻孔でプロセス全体を繰り返します。接種手順全体を完了するのに約30~45分かかります。
- マウスを指定したケージに戻す前に、マウスの目に濡れたointmentを置きます。
注:彼らは厳しい回復を維持するために十分な意識を取り戻すまで、マウスを放置しないでください。
5. データ分析
- Fluor標識RVG9Rの脳沈着を確認するために、マウスを麻酔し(ステップ2.3に記載)、脳ならびに肺、肝臓、脾臓、腎臓などの他の末梢器官を隔離する。各臓器をImageStation上に配置し、ImageStationを使用して蛍光を可視化します。
- Cy5ラベルによる蛍光を可視化するには、20μm厚の凍結切片を用意し、Hoechst 33342をコソニングし、共焦点顕微鏡で全脳走査を行います。
- 遺伝子サイレンシングを評価するには、嗅球、皮質、海馬、視床下部、視床下部、小脳、脳幹などの様々な脳領域からRNAを抽出し、RNA精製キットを用いてcDNAに逆転写する。合成キットは、前述の15に記載されているようにプライマーペアでqPCRを実行する。
結果
IN投与中の頭部位置は、脳への薬物送達の効率に大きな影響を与える。ここでは、マウスのCNSへの混合物の送達のための脳標的ペプチド-siRNA製剤のIN投与のためのマウス位置決め装置を用いた頭部の下方位置について説明した。IN経路を介した送達を検証するために、我々はRVG9Rペプチドを用いて、以前にインビトロおよびインビボ14、16の両方で神経細胞に効率的に結合することが示された。
まず、ここで説明するマウス位置決め装置を用いて、Alexa Fluor 488(RVG9R-A488)とラベル付けされたRVG9Rペプチドの鼻から脳への送達を試験した。48時間の接種後、脳、前頭取、肺、肝臓、脾臓、腎臓を含む様々な器官を切除し、組織関連A488蛍光を測定した。488単独で、またはnAchRを結合しない対照ペプチド(RVM9R-A488)14は、陰性対照として用いた。予想通り、A488もRVM9R-A488も48時間の接種後のいずれの臓器においても検出されなかった(図3A、左)。一方、強い蛍光A488シグナルはRVG9R接種群の脳内でのみ検出された。また、このマウス位置位置を、以前に使用したサフィン位置法と、覚醒法と比較し、有効性を求めた。我々は、RVG9R-A 488(100 μg)の一定量を接種し、48時間の接種後に生体分布をアッセイした。その結果、マウスの頭部を上下に位置させることで、脳組織全体におけるRVG9R-A488の浸透性および沈着が改善されたことが示された(図3A、右)。対照的に、サピネ位置で接種した動物は、RVG9R-A488を脳に送達したが、位置決め装置法で見られるほど強くない。さらに脳へのsiRNA送達を確認するために、Cy5標識siRNAの400pmol(5.2 μg)に複合体化したRVG9Rの単一IN投与後にフルブレインスキャンを行った。PBSまたはRVM9Rとは対照的に、RVG9Rと複合体化すると、嗅球、皮質、海馬、視床下部、視床下部、中脳、小脳を含む主要な脳領域にsiRNAが強く蓄積した(図3B)).
最後に、RT-qPCR解析を用いて、スーパーオキシドジムターゼ-1(SOD1)遺伝子を標的とする機能性siRNAの細胞内送達を検証した。マウスはRVG9R:siSOD1(siRNAの13.2 μg)で連続して3回接種し、SOD1 mRNA発現は最後の接種後24時間に分析した。RVG9R:siSOD1投与は、嗅球のSOD1発現(63%)、皮質(47%)、海馬(61%)、視床下部(53%)、視床下部(55%)、中脳(39%)、小脳(30%)の実質的な減少をもたらした。(図4)。結論として、位置決め装置の使用は、マウスにおけるRVG9R複合siRNAの容易なIN接種を可能にし、その結果、標的遺伝子の機能的サイレンシングを誘導する脳特異的siRNA送達をもたらす。
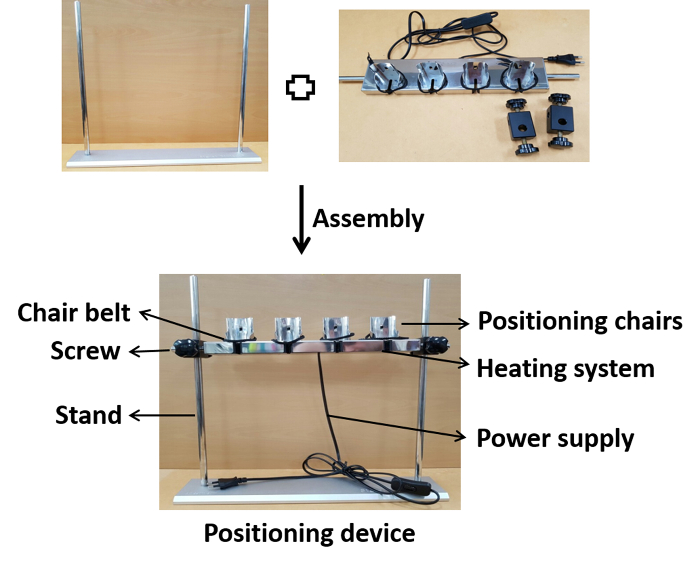
図 1:デバイスアセンブリの写真表示。位置の椅子はねじが付いている適切な高さの立場で組み立てられる。アセンブリの後、装置は接種の間に生理学的温度に加熱するための電源に接続される。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2:測位装置を用いてIN接種手順の写真提示。(A) IN接種に必要な実験装置。(B) 装置に装着した頭部の上下前方位置の動物(左)とIN接種用2μL液滴の堆積(右)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
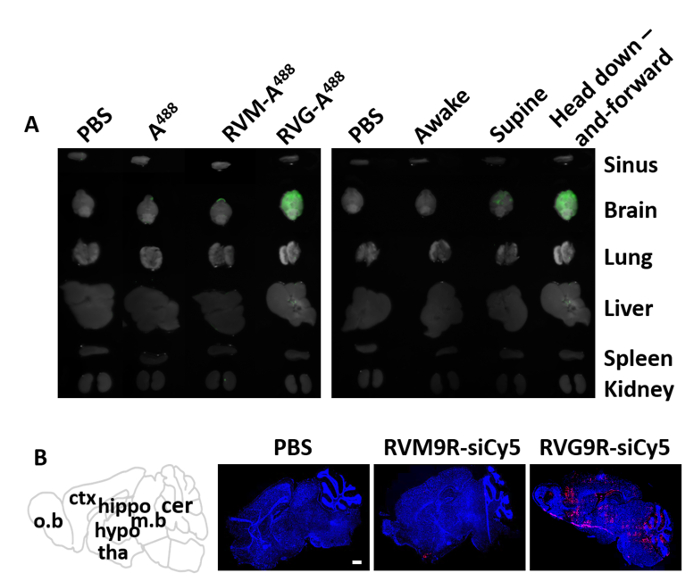
図 3: IN投与後の蛍光標識ペプチドおよびsiRNAの分布。(A) 単一IN接種後48時間で眼内接種RVG9Rペプチドの生体分布。脳および他の末梢器官は、生理食生(PBS)、A 488、RVM-A488、およびRVG-A488(左)を接種したマウスにおける蛍光の存在について評価した。マウスの撮像は、目を覚ます間に上述したように、上の位置、およびマウス位置において頭部の下向き位置(右)で考案する。(B) 脳内のRVG9R:siRNA複合体の生体分布(n=1群当たり3)。Cy5標識siRNAの分布は、生理食生(PBS)を接種した動物における共焦点レーザー顕微鏡を用いて、全脳凍結切除で可視化した、対照ペプチド(RVM9R-siCy5)、または脳標的ペプチドRVG9R(RVG9R-siCy5)と複合体化した。スケールバーは1 mm. 略称を表します: o.b = 嗅球球;ctx = 皮質;カバ = 海馬;低血圧 = 視床下部;tha = 視床;m.b = 中脳;cer = 小脳。この図のより大きなバージョンを表示するには、ここをクリックしてください。
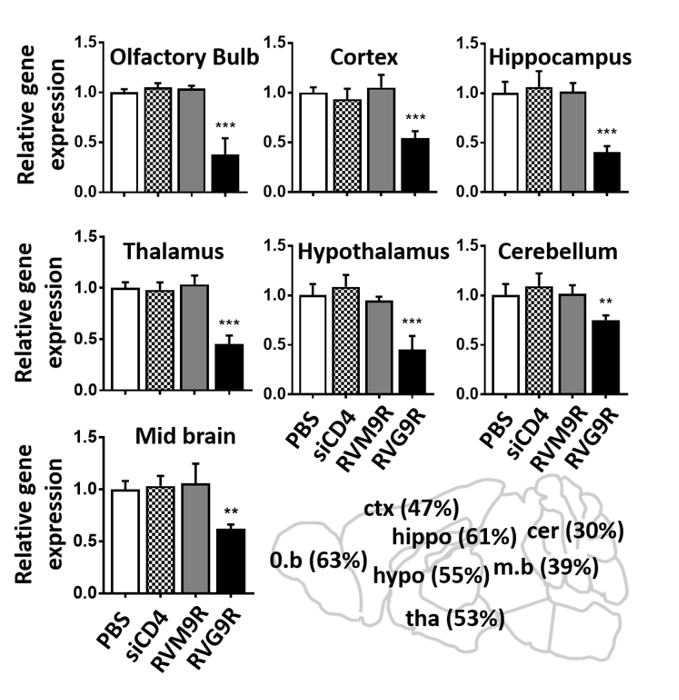
図 4: RVG9R:siSOD1の応用では、脳の複数の領域における標的遺伝子サイレンシングを誘導する。生理食生の最後のIN接種後24時間後のマウスSOD1 mRNAのqPCR分析は、生理食生の最後のIN接種後24時間、RVG9R:siCD4(siCD4)、RVM9R:siSOD1(RVM9R)、およびRVG9R:siSOD1(RVG9R)を示した。嗅球における相対SOD1サイレンシングは、皮質、海馬(上)、視床下部、視床下部、小脳(中央)、および中脳(下)を示す。データは、生理生理生処理マウスの対応するデータ(1群当たりn=3)で正規化した後のGAPDHに対する平均±SDを表す。IN接種後の示された脳領域におけるSOD1 mRNAの割合を示す漫画(右下)。**P < 0.01, ***P < 0.001.略語: o.b = 嗅球;ctx = 皮質;カバ = 海馬;ハイポ = 海馬;tha = 視床;m.b = 中脳;cer = 小脳。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
治療薬の鼻から脳への送達に最適な位置決めを行うマウス位置決め装置を開発した。装置は異なった機能が装備され、動物の容易な同時処理を保障する。それはまた実験の間に動物の生理的な体温の維持のための暖房パッドが装備されている。麻酔マウスは、動物に対する不快感を最小限に抑えながら、特別に設計された椅子によって頭部を下向きの位置に維持することができる。ポジショニングチェアの高さは、薬物を投与しながら動物の鼻孔を視覚化するのが最善であるような方法で調整することができます。
脳の送達には、鼻孔の小さな表面積(投与当たり20〜30μLの最大容積を可能にする)、鼻刺激、上皮損傷、および鼻上皮18にわたる限られた吸収を含むいくつかの固有の制限がある。サピン位置に置かれたマウスに対する薬物のIN投与は、マイクロリットル注射器19に接続されたピペットまたはポリウレタンチューブ(24G x 19 mm)を介して動物の代替ナレに液体薬を投下することによって脳送達に使用されてきた、20.嗅上皮付近の薬物を放出するチューブシステムの使用は潜在的に適切なアプローチであるが、反復投与時に刺激または鼻炎を引き起こす。さらに、鼻腔の小さなサイズは、このアプローチを制限し、特に繰り返しによって克服されうるマウス、ならびに鼻粘膜に持続する薬物製剤によって。別のオプションは、マウス10を目覚めさせる治療薬のIN投与である。しかし、このアプローチは、IN接種中の動物の取り扱いに熟練した手順を必要とします。さらに、それは動物のストレスを引き起こすので、疾患モデル、特に感染症モデルには理想的ではありません。さらに、一貫性のない投薬は、不完全な動物のつかみによる肺または胃への薬物の排液から容易に生じ得る。ここで提示されるアプローチは、科学者がこれらの技術的な障壁を克服することを可能にします。頭部の下向きの位置は吸入している間鼻から肺への薬物漏出の可能性を減らし、脳への直接および選択的なsiRNAの配達を好む。マウス位置決め装置を用いたIN送達は、接種中に動物を取り扱ったりつかんだりするための特殊な技術を必要としない。一度に4匹の動物を少なくとも30〜45分間治療することができる。プロシージャは付加的な4椅子の棒を含めることによってスケールアップすることができ、同じ実験セッションの8匹までのマウスの容易な管理を可能にする。したがって、この方法に従って、単一のオペレータは、長期間にわたって動物の大規模なグループの脳への薬物送達を誘導してもよい。
鼻腔の解剖学的構造は、鼻から脳への送達に強く影響を与える(Merkus et al.11およびRuigrokおよびde Lange21によってレビューされた)。マウスの鼻腔の相対表面積はヒトの15倍、嗅上皮の相対表面積は6倍大きい。ヒトの鼻腔の解剖学にはげっ歯類に大きな違いがありますが、いくつかの脳障害を治療するためにINアプローチを使用して約45の臨床試験が進行中です(www.clinicaltrials.gov)。ここで提示された研究は、治療薬のIN送達を使用する場合、科学者は、頭部位置、睡眠、および適切な送達剤などのいくつかの要因を考慮する必要があることを示しています。
マウス脳に蛍光標識siRNAの効率的かつ特異的な沈着を示した。さらに、IN siRNA送達後に観察されたSOD1遺伝子発現の有意な減少は機能的効果を確認した。我々は以前、西ナイルウイルス(WNV)RNAを標的とするRVG9R-siRNA複合体のIN投与がWNV脳炎15に対して強い治療効果を発揮することを一貫して示した。特に、鼻から脳へのsiRNA送達には、細胞標的リガンド(RVG)と正に帯電した分子(9R)が必要でした。これらの元素が存在しない場合、分子は全身回路およびリンパ管48h後処理(図3A)15を介してクリアされた。そこで、ここで説明する実験セットアップでは、接種後48時間のペプチド/siRNA局在化を調べ、脳内に特異的に保持されたレベルのみを画像化した。このアプローチは、タンパク質、ペプチド、ナノ粒子、または他の治療薬などの他の分子の送達のために、多くの脳関連障害の治療のために容易に実施することができる。
開示事項
P.K.とS.K.L.はシグネットバイオテックの共同創設者です。P.K.は特許PCT/US07/12,152の共同発明者であり、これにはRVG9Rに関する請求も一部含まれています。I.U.、K.C.、およびS.K.L.は、マウス位置決め装置に関するクレームを含む、提出された特許(PCT/KR2016/014220)の共同発明者として記載されています。
謝辞
この作業は、韓国保健福祉省(HI17C1046)がS.K.L.に支援しました。
資料
| Name | Company | Catalog Number | Comments |
| Comercial assays | |||
| iScript cDNA synthesis kit | BioRad | Cat# 1708891 | |
| RNAiso plus | TaKaRa Bio | Cat# 9108 | |
| SYBR Premix ExTaq | TaKaRa Bio | Cat# RR420A | |
| Dyes | |||
| Alexa fluor 488 | ThermoFisher | Cat# A30052 | |
| Mouse strain | |||
| Balb/c | Orient Bio | N/A | 6-8 week old, 20-30g |
| Oligonucleotides and primers | |||
| Human CD4 | ST Pharm | N/A | Sense: 5’-GAUCAAGAGACUCCUCAGU-3’ |
| siSOD1 | ST Pharm | N/A | Sense: 5’-GGUGGAAAUGAAGAAAGUA-3’ |
| GAPDH primers | ST Pharm | N/A | F: 5’-AACTTTGGCATTGTGGAAGG-3’ R: 5’-GGAGACAACCTGGTCCTCAG-3’ |
| SOD1 primers | ST Pharm | N/A | F: 5’-CCAGTGCAGGACCTCATTTT-3’ R: 5’-CACCTTTGCCCAAGTCATCT-3’ |
| Peptides | |||
| RVG9R | Peptron | N/A | YTIWMPENPRPGTPCDIFTNSR GKRASNGGGGRRRRRRRRR |
| RVM9R | Peptron | N/A | MNLLRKIVKNRRDEDTQKSS PASAPLDGGGGRRRRRRRRR |
| Software, algorithms and devices | |||
| FlowJo software 4.3 | FlowJO, LLC | N/A | http://docs.flowjo.com/vx/ |
| Mouse positioning device | Signet Biotech | N/A | |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
参考文献
- Pardridge, W. M. The blood-brain barrier: bottleneck in brain drug development. NeuroRx. 2, 3-14 (2005).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (ICV) and intravenous (IV) injection in mice. Journal of Visualized Experiments. (56), e2968(2011).
- Khan, A. R., Liu, M., Khan, M. W., Zhai, G. Progress in brain targeting drug delivery system by nasal route. Journal of Controlled Release. 268, 364-389 (2017).
- Meredith, M. E., Salameh, T. S., Banks, W. A. Intranasal delivery of proteins and peptides in the treatment of neurodegenerative diseases. The AAPS Journal. 17, 780-787 (2015).
- Pardeshi, C. V., Belgamwar, V. S. Direct nose to brain drug delivery via integrated nerve pathways bypassing the blood-brain barrier: an excellent platform for brain targeting. Expert Opinion on Drug Delivery. 10, 957-972 (2013).
- Agrawal, M., et al. Nose-to-brain drug delivery: An update on clinical challenges and progress towards approval of anti-Alzheimer drugs. Journal of Controlled Release. 281, 139-177 (2018).
- Van Woensel, M., et al. Formulations for intranasal delivery of pharmacological agents to combat brain disease: a new opportunity to tackle GBM. Cancers. 5, 1020-1048 (2013).
- Kulkarni, A. D., et al. Nanotechnology-mediated nose to brain drug delivery for Parkinson's disease: a mini review. Journal of Drug Targeting. 23, 775-788 (2015).
- Dhuria, S. V., Hanson, L. R., Frey, W. H. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99, 1654-1673 (2010).
- Hanson, L. R., Fine, J. M., Svitak, A. L., Faltesek, K. A. Intranasal administration of CNS therapeutics to awake mice. Journal of Visualized Experiments. (74), e4440(2013).
- Merkus, P., Ebbens, F. A., Muller, B., Fokkens, W. J. Influence of anatomy and head position on intranasal drug deposition. European Archives of Oto-Rhino-Laryngology and Head & Neck. 263, 827-832 (2006).
- Zeller, S., et al. Attachment of cell-binding ligands to arginine-rich cell-penetrating peptides enables cytosolic translocation of complexed siRNA. Chemistry & Biology. 22, 50-62 (2015).
- Kim, J., et al. Silencing CCR2 in macrophages alleviates adipose tissue inflammation and the associated metabolic syndrome in dietary obese mice. Molecular Therapy-Nucleic Acids. 5, (2016).
- Kumar, P., et al. Transvascular delivery of small interfering RNA to the central nervous system. Nature. 448, 39(2007).
- Beloor, J., et al. Small interfering RNA-mediated control of virus replication in the CNS is therapeutic and enables natural immunity to West Nile virus. Cell Host & Microbe. 23, 549-556 (2018).
- Ullah, I., et al. Trileucine residues in a ligand-CPP-based siRNA delivery platform improve endosomal escape of siRNA. Journal of Drug Targeting. 25, 320-329 (2017).
- Yu, D., Li, G., Lesniak, M. S., Balyasnikova, I. V. Intranasal delivery of therapeutic stem cells to glioblastoma in a mouse model. Journal of Visualized Experiments. (124), e55845(2017).
- Mittal, D., et al. Insights into direct nose to brain delivery: current status and future perspective. Drug Delivery. 21, 75-86 (2014).
- Renner, D. B., Frey, W. H., Hanson, L. R. Intranasal delivery of siRNA to the olfactory bulbs of mice via the olfactory nerve pathway. Neuroscience Letters. 513, 193-197 (2012).
- Serralheiro, A., Alves, G., Fortuna, A., Falcão, A. Intranasal administration of carbamazepine to mice: a direct delivery pathway for brain targeting. European Journal of Pharmaceutical Sciences. 60, 32-39 (2014).
- Ruigrok, M. J., de Lange, E. C. Emerging insights for translational pharmacokinetic and pharmacokinetic-pharmacodynamic studies: towards prediction of nose-to-brain transport in humans. The AAPS Journal. 17, 493-505 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved