Method Article
SUMO 结合实体 (SUBEs) 作为肝癌中 SUMO 蛋白酶的浓缩、分离、识别和表征的工具
摘要
在这里,我们提出了一个协议,以丰富、分离、识别和描述通过SUMO结合实体(SUBEs)从小鼠模型获得的从人肝细胞和肝肿瘤中获得的体内由SUMO修饰的蛋白质。
摘要
翻译后修饰是调节真核细胞中蛋白质平衡和功能的关键机制。在肝癌中所有泛素样蛋白中,SUMO(小泛素多药)的修饰受到最关注。由于存在活性SUMO特异性蛋白酶,体内内源性SUMOylate蛋白质的分离具有挑战性。体内SUMOylation的初步研究基于对特定SUMOylate蛋白质的分子检测(例如,由西方斑点)。然而,在许多情况下,抗体,一般用非改性重组蛋白制成,没有免疫沉淀SUMOylate形式感兴趣的蛋白质。镍色谱是研究SUMOylation的另一种方法,通过捕获与SUMO分子的分子标记版本。这种方法主要用于细胞均匀地表达或暂时转染与His-SUMO分子。为了克服这些限制,研究SUMO结合实体(SUBEs)来分离内源性SUMOylate蛋白质。在此,我们使用 SUBEs 描述从人类肝细胞和肝癌小鼠模型中的肝细胞和肝组织中扩充、分离和识别 SUMOylate 基质所需的所有步骤。首先,我们描述了人类肝癌细胞和肝肿瘤组织样本的制备和裂口方法。然后,对SUBEs和对照的制备以及蛋白质下拉检测的协议进行了详细的解释。最后,提供了一些示例,说明可用于鉴定和鉴定SUMOylate蛋白酶的选项,即使用西斑分析检测肝肿瘤中特定的SUMOylate基质或使用通过质谱法对肝细胞中SUMOylate蛋白质组和相互作用体进行高通量表征。
引言
肝癌是全球第六大最常见的癌症,也是癌症相关死亡的第二大原因。肝细胞癌(HCC)是最常见的原发性肝癌。从历史上看,HCC发展的常见危险因素包括慢性乙型或丙型肝炎感染和滥用酒精消费。在过去的几十年里,代谢综合征,2型糖尿病非酒精性脂肪肝(NAFLD)已成为HCC2发展的危险因素。HCC 是非常异质的,无论是表观和基因,其中一个复杂的信号通路网络被打乱。在过去的几年中,尽管我们对与HCC发病机制有关的分子途径的了解有所增加,但HCC管理仍然没有有效的治疗方法。许多通路在HCC中被激活,并抑制一个通常驱动补偿通过其他途径3。这是治疗HCC的主要困难之一。因此,更全球化的方法可能为肝癌的临床管理提供一种潜在的治疗方法,例如,针对转化后修饰(PTM),因为多个信号通路可以同时由蛋白质的PTM调节。
翻译后修改被认为是调节蛋白质平衡和功能的关键机制4。结构和功能变化由 PTM 引入,从而增加了蛋白酶的多样性。最常见的PTM包括磷酸化、甲基化、乙酰化、糖基化、泛化以及泛素样蛋白(UbLs)的偶联。在所有UbL中,SUMO(小泛素莫迪费克)的蛋白质修饰因其在各种细胞过程(包括转录、细胞定位、DNA修复和细胞周期进展)中的关键作用而备受关注5.最近,SUMOylation在肝癌6、7、8、9中被改变,并且特定蛋白质的SUMOylation的变化被描述为在肝癌的进展中发挥作用。癌症相关疾病9.
在哺乳动物中,有五个SUMO相扑,SUMO-1到SUMO-5。迄今为止,没有关于存在内源性SUMO-4和内源性SUMO-5结合反应在蛋白质水平10,11,12的实验证据。哺乳动物的SUMOylation由涉及三种酶的酶硫醇酯级联进行,即异质性SUMO激活酶(SAE1/SAE2)或E1、SUMO结合酶(Ubc9)或E2以及针对每种靶蛋白的SUMO-E3-结合酶。SUMO E3的几个家族的作用似乎与SUMO特异性蛋白酶(SUSPs或SENPs)13处于动态平衡状态,使SUMOylation反应高度可逆。此外,只有一小部分的SUMOylatea蛋白质与非SUMOylate的总蛋白存在。因此,在体内分离内源性SUMOylate蛋白质是相当具有挑战性的13。
西体斑点最初利用抗体对感兴趣的蛋白质14进行体内的SUMOylation研究。使用特定抗体对蛋白质进行免疫沉淀,然后用抗SUMO抗体进行PAGE-西体斑点。这种策略的主要问题是,针对非改性重组蛋白产生的抗体并不总是能够免疫沉淀蛋白质的SUMOylate形式。或者,在体素标记(His6)版本的SUMO分子和感兴趣的蛋白质的瞬态表达之后的镍色谱已用于研究细胞中的SUMOylation。在此基础上,从细胞中检测SUMO修改形式将更为方便,以稳稳地表达His6-SUMO15。在体内研究中,演示了基于多SUMO结合的聚氨酯结合16的串联-SUMO相互作用图案(SIM)浓缩。其他组一直在使用表位标记抗体SUMO方法提供了一个可行的工具,以调查原发细胞,组织和器官的内源性SUMOy酰化17,18。最近,尼尔森和他的同事使用基于抗体的富集来识别细胞和组织19中的内源性和位位特异性SUMO。
为了提供关于SUMO在体内作用的补充信息,20日开发了SUMO结合实体(SUBEs),也称为SUMO陷阱。相关的是,串联泛泛物结合实体(TUBEs)被认为是SUBEs的概念前体,是检测和分离多聚体蛋白21的商用工具。SUBEs 是组合蛋白,由 SIM 的串联重复组成,从而识别修饰蛋白上的 SUMO 分子,从而增加 SUMO 基质的整体亲和力。SUMO陷阱是通过将E3泛素蛋白结合物RNF4衍生SIM2和SIM3图案串联到含有谷胱甘肽S-转移酶(GST)的载体中设计的,这是一种异质载体蛋白20。虽然SUBEs不能正确用于识别单SUMOylate靶蛋白,但这种方法提供了一个工具,促进在体内的多SUMO靶蛋白的纯化和识别。本文介绍了SUBEs在人类肝细胞和小鼠肝脏活检中分离SUMOylate蛋白质的应用,这是肝癌研究的重要工具。本手稿中描述的协议的总体方案如图1所示。
研究方案
所有实验都通过了中投生物群动物护理和处理机构委员会的批准。已作出一切努力,尽量减少动物的痛苦和减少使用的动物数量。使用3个月大的雄性甘氨酸N-甲基转移酶(Gnmt)缺乏(Gnmt+/)及其野生型杂物(Gnmt+/))。
1. 细胞制备和莱沙
注:本文使用Huh-7(人肝细胞系)和THLE2(人肝细胞系)。
- 在 5% CO2-95% 湿度的加湿环境中,将标准生长培养基中的 P100 板中的电池保持在 37°C。
- 使用Neubauer造血测定计数室计算细胞,在P100板中以每盘1.2~1.5×106个细胞的密度生长细胞。
- 在DMEM中培养Huh-7,辅以10%胎儿牛血清(FBS)、1%青霉素-链霉素-氨基霉素B(PSA)和1%谷氨酰胺。
- 培养皿中的培养THLE2细胞预涂有0.01mg/mL纤维素,0.01mg/mL牛血清白蛋白(BSA)和0.03mg/mL胶原蛋白I型溶解在生长培养基中,该培养基由支气管上皮细胞生长基底培养基(BEGM)补充生长因子(0.4%BPE、0.1%胰岛素、0.1%氢皮质酮、0.1%视黄酸、0.1%转移蛋白、0.1%三碘甲状腺素以及10%FBS、1%PSA、5纳克/mL表皮生长因子(EGF)和70纳克/mL磷酸胺。
- 在实验结束时,用5 mL无菌1x磷酸缓冲盐水(PBS)从板和洗涤细胞中吸出介质。使用 500 μL 的解酶缓冲液(50 mM Tris pH 8.5、150 mM NaCl、5 mM EDTA、1% 非 idet P-40 (NP40)直接放在冰上的板上的酶细胞,并辅以完整的 EDTA 无蛋白酶抑制剂鸡尾酒和 50 μM PR-619,用于每道 P100 盘中。使用细胞刮刀,轻轻地将细胞从板底部刮入Lysis培养基。
注:在治疗后通过目视检查板底检查所有细胞均已脱离板。 - 或者,通过吸气细胞介质进行胰蛋白化并添加 1 mL 的 1x (0.05%) 来收获细胞胰蛋白酶-EDTA到板,足以覆盖细胞,并将板放在培养箱设置在37°C,5%CO2和95%湿度+5分钟,确保所有细胞从板分离。加入2 mL的预加热生长介质,以阻止胰蛋白酶化。在150克下离心10分钟,吸出上清液。用1x PBS和150 x g的离心机清洗10分钟。吸洗上清液后,加入500 μL的解毒缓冲液(50mM Tris pH 8.5,150 mM NaCl,5 mM EDTA,1%NP40,辅以完整的EDTA无蛋白酶抑制剂鸡尾酒和50μM PR-619每道P100盘。
注: 添加 PR-619 至关重要。 - 在15,500 x g和4°C下离心10分钟,将上清液转移到另一根管中,然后丢弃颗粒。
注:该协议可以暂停,样品存储在-80°C,直到进一步分析。
2. 组织制备和莱沙
- 在动物牺牲时,收集小鼠肝脏,用冷PBS清洗,并立即在液氮中冷冻。储存样品 +80 °C,直到进一步分析。
- 在 1 mL 的冷裂解缓冲液(50 mM Tris pH 8.5, 150 mM NaCl, 5 mM EDTA, 1% NP40) 中,从卡扣冷冻/或新鲜肝脏中均匀化 75 mg 片段,辅以完整的 EDTA 无蛋白酶抑制剂鸡尾酒和 50 μM PR-619)。以 6500 x rpm 的速度运行均质器,每个转速为 2 x 60 s,暂停 30 s(参见材料表)。
- 在15,500 x g和4°C的微熔中将样品离心10分钟。将上清液转移到另一根管中,并丢弃颗粒。
- 或者,在液氮中三聚75毫克冷冻组织。然后在1 mL的莱沙缓冲液中恢复组织。
- 在15,500 x g和4°C的微熔中将样品离心10分钟。将上清液转移到另一根管中,并丢弃颗粒。
注:该协议可以暂停,样品存储在-80°C,直到进一步分析。
3. GST-SUBEs或GST控制与谷胱甘肽-阿加罗斯珠
注:GST-SUBEs或GST控制的综合超出了本手稿的范围,可以在先前发表的文献20中加以审查。或者,GST-和控制子级在商业上可用(例如,SignalChem)。
- 谷胱甘肽珠的制备
- 在70毫克冻干谷胱甘肽-阿加生珠中加入1mL的去离子水。在4°C(或在室温下至少30分钟)重新制作珠子过夜。
- 肿胀后彻底清洗珠子(去除乳糖和乙醇,通常存在于冻干粉糖珠中)。为此,首先用10 mL的去离子水或PBS清洗,然后以300 x g在室温下离心5分钟。执行此三次。
- 3次冲后后,在PBS的1mL中重新悬浮珠子,以获得50%(v/v)浆料。
注:此体积适用于分析 10 个样本。
- 对于每个样品,将 100 μg GST-SUBEs 或 GST 控制(参见参考20)添加到 100 μL 的谷胱甘肽珠浆和 500 μL 的 PBS。
注: 感兴趣的 SUMOlated 蛋白质的相对丰度决定了用于下拉的 GST-SUBEs 的数量。对于每个新的实验模型,通过西方用抗SUMO2/3抗体或针对感兴趣的蛋白质(利弗基纳斯B1(LKB1)对输入、结合和流通(FT)材料进行印迹,分析实际实验前的状况。 - 用 3.2 中制备的珠子孵育所有 GST-SUBEs 或 GST 控制,在 4°C 的旋转器或迷你滚子中缓慢旋转(参见材料表),至少 2 小时(慢量结合反应)。
注: 添加 1 mM 二硫氨酰二醇 (DTT) 可改善 GST 与谷胱甘肽珠的结合。 - 在室温下,在300 x g下离心5分钟,通过离心回收角糖珠。最后,在 PBS 中重新悬浮珠子以获得 50% (v/v) 浆料。
注:该协议可以暂停,样品存储在-80°C,直到进一步分析。
4. GST 下拉式
- 步骤 1.5、2.3 或 2.5 后,取总体积的 1/10(例如 50 μL),在相同体积的 3x 沸腾缓冲液(250 mM Tris-HCl pH 6.8,500 mM β-甲基苯丙醇、50% 甘油醇、10% SDS、溴酚蓝色)中稀释。此分数被视为 INPUT。
- 从步骤1.5、2.3或2.5至100μL谷胱甘肽珠浆中加入450 μL的澄清赖氨酸。用珠子孵育解毒,在4°C下缓慢旋转至少2小时。
注:或者,可以使用步骤1.5、2.3或2.5(用布拉德福德测定量化)的总蛋白质量为450μL的100-200μg。 - 在 300 x g的微熔中旋转珠子 5 分钟,并收集上清液进行分析。将总体积的1/10(例如50μL)转移到单独的管中,以3倍沸腾缓冲液的等量稀释。这个分数是流通过 (FT) 分数.
- 用1 mL冰冷的PBS清洗剩余的样品三次,0.05%补间20,在4°C下旋转1分钟,300 x 克,小心吸气,确保没有液体残留。磁珠对应于 SUBEs BOUND (SB) 分数。
- 用15μL的3x沸腾缓冲液和15μL的溶热缓冲液洗取样品。这称为 BOUND 分数。
5. 西布洛特分析对SUMO目标的识别和特征
- 使用抗SUMO2/3抗体或任何其他特定抗体进行西斑分析,如前22所述。
6. 通过质谱法鉴定和鉴定SUMOylateproteme
注:在质谱分析(MS)中,使用Wisniewski等人23所述的滤辅助样品制备方法处理样品。
- 在MS分析之前,使用阶段尖端C18微柱对肽进行脱盐,并在0.1%的甲酸(FA)中重新悬浮。
- 将样品加载到 LC-MS 系统上(参见材料表),并分析它们三重(技术复制)(图 2b)。
- 使用相关软件进行蛋白质识别和丰度计算。
- 对于统计分析和热图生成,将数据加载到 Perseus 平台 (http://www.perseus.tufts.edu/hopper/)。应用基于排列的错误发现率 (FDR) 校正的 t 检验来比较丰度。q < 0.05 和 SUBEs/GST 比率大于 2 的蛋白质被视为富集24。
注:最终分析考虑至少两种不同的肽标识的蛋白质。
结果
西斑分析对肝肿瘤活检中特异性SUMOy酰化基质的鉴定
肝激酶B1(LKB1)SUMOylation最近已被证明是肝癌9,25的重要致癌驱动因素。缺乏甘氨酸N-甲基转移酶(Gnmt)的小鼠,通常被称为Gnmt[/+),是一种自发发展肝细胞癌(HCC)的模型,这是最常见的原发性肝癌类型。SUBEs被用来丰富和分离在Gnmt[/]小鼠与肝癌小鼠及其野生类型幼崽(Gnmt+/*)的SUMOylate蛋白质。在图2a中,包括SubES下拉算测定中获得的三个不同分数(输入、FT和BOUND)的Ponceau S染色。Ponceau S 染色剂可用于控制对被西方印迹评估的被染色蛋白加载的可能有害影响。图2b显示了使用SUBEs捕获内源性SUMOylateLKB1对LKB1的西方污点分析。LKB1 SUMOy酰化水平在肝肿瘤中增加。在西部印迹分析中,通过庞乔染色观察输入分数的等载荷和转移蛋白,洗洗后(流过分数)没有显著改变。SUBEs捕获的蛋白质量明显较高,特别是在肿瘤中。或者,用库马西蓝染色重复的凝胶也可以提供类似的信息。粘性蛋白质,如p53或SUMOylate形式的某些蛋白质可能会绑定到GST控制。要去除背景,请使用低密度的甘蔗珠,使用 BSA 进行涂层,或加入额外的处理。然而,这可能会影响质谱测量等应用,并可能导致低亲和力相互作用蛋白的丧失。
通过质谱分析对人类肝细胞中SUMO相互作用的表征
为了研究SUMO陷阱与天然SUMOylate蛋白质相互作用的能力,使用Huh-7(人肝)和非转化肝上皮人类THLE2细胞系。第一步是可视化使用 SUBEs 捕获的总材料,并使用 GST 作为负控制。为此,我们可以使用如图3a所示的传统蛋白质染色方案。然后,我们进行了质谱分析。在Huh7 GST样本中平均识别了2268种蛋白质(每个负载分别为2339、2297和2168),而Huh7 SUBEs样本(2815、2817和2806)平均发现了2812种蛋白质。减法后,SUBEs中742种蛋白质被浓缩。另一方面,在THLE2 GST样本(分别为2476、2520和2495)和2763个(2823、2783和2684)中,平均发现了2497种蛋白质。其中,有577个被认为在SUBEs样本中丰富。技术复制分析检索图 3b所示的热图,该热图使用可用的默认设置(欧氏距离、平均链接和使用 k 均值预处理)计算。热图描绘了每个细胞系中100种最显著和纯富蛋白质的分布。
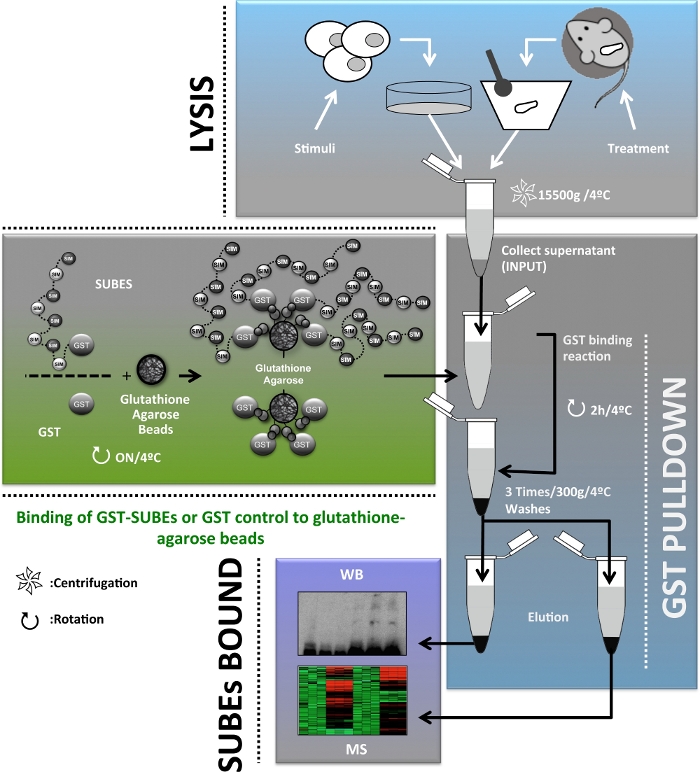
图1:用于扩充、分离、鉴定和表征的用于研究肝癌的SUMOylate蛋白酶的协议流程图的原理图。请点击此处查看此图的较大版本。
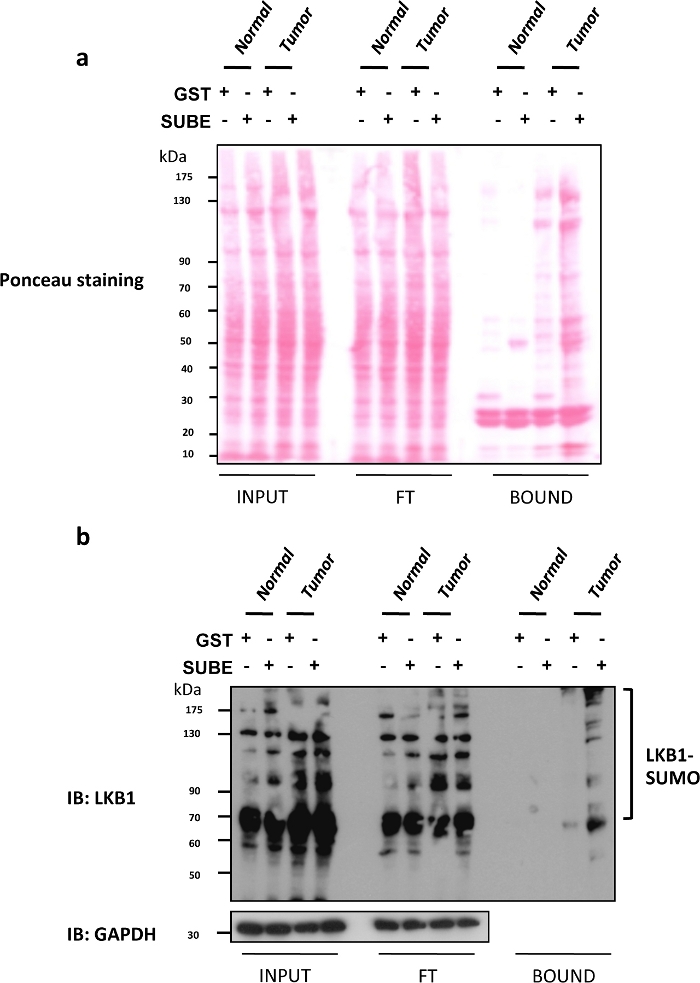
图2:在肝细胞癌小鼠模型中,SUMO-2对LKB1的改性。
(a) 在 SUBEs 下拉式测定中获得的三个不同分数(输入、流通 (FT) 和 BOUND)的 Ponceau S 染色。(b) 使用 SUMO 结合实体 (SUBEs) 捕获内源性 SUMOylate LKB1 的 LKB1 的西方污点分析;GAPDH 用作装载控制。请点击此处查看此图的较大版本。
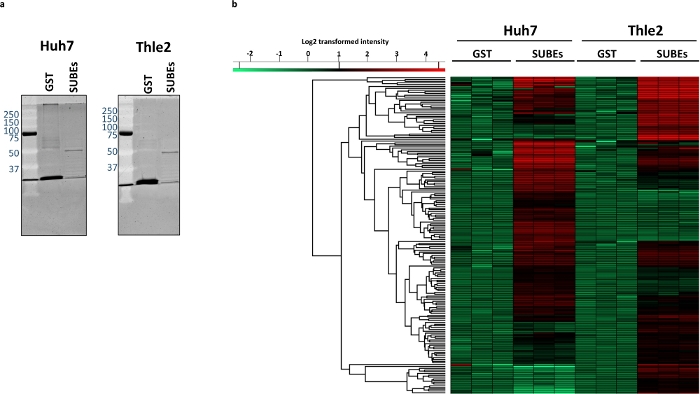
图3:肿瘤Huh-7和非转化肝上皮THLE2人细胞系之间的SUMOylate蛋白酶的差异。
(a) 捕获的蛋白质物质的Sypro染色,与GST(负控制)和SUBEs。(c) 热图描绘了Huh-7和THLE2 SUBE样本中微分富集的蛋白质。请点击此处查看此图的较大版本。
讨论
在此,我们提供了完整和详细的描述方法,报告SUBEs用于肝癌体内的SUMOylate蛋白质的浓缩、分离和鉴定及表征。在小鼠肝肿瘤和人类肝肿瘤细胞中,我们能够正确分离和识别感兴趣的SUMOylate蛋白质,并执行SUMOylateprome和相互作用蛋白的高通量表征。即使SUBEs的合成不在本手稿的范围之内,为了进一步了解,应查阅以下参考文献26。所述协议快速且非常敏感,协议的关键步骤包括使用SENPs抑制剂(PR-619)。在替代中,可以使用酶溶液中的化学等同肽酶抑制剂,如NEM(N-乙酰胺)和IAA(2-Iodoacet酰胺),但是,以前的报告表明,对于SUBEs协议,使用PR-619与其他抑制剂干扰GST与谷胱甘肽珠20结合。
SUBEs 是组合蛋白,由 SIM 的串联重复组成,从而识别修饰蛋白上的 SUMO 分子,从而增加 SUMO 基质的整体亲和力。由于其高特异性和敏感性,使用SUBEs分离SUMOylateproteme相对于文献中的其他方法,如用抗体检测特定的SUMOylate蛋白,对感兴趣的蛋白质或使用SUMO分子的不同分子标记版本的镍色谱。然而,必须考虑到,由于SUBEs协议是在非变性条件下执行的,因此,SUMOylate蛋白质与其他相互作用蛋白之间的相互作用得以维持。因此,我们获得有关SUMO相互作用的信息,而不是仅仅获得SUMOylate目标蛋白的列表。因此,需要进一步的实验,以确认识别的蛋白质是SUMO靶点还是相互作用因子。SUBEs 的其他限制是,所使用的控制 GST 陷阱能够捕获许多与氧化应激相关的背景蛋白。由于该技术的高灵敏度,此问题在 MS 分析中特别相关。为了克服这些限制,已经开发出了26个生物素素SUMO陷阱(生物SUBEs)。SUBBe 的另一个限制在于,我们只能捕获由 SUMO 2 和 SUMO 3 修饰的蛋白质,而 SUMO 1 修饰的蛋白质不能被分离。
对SUBEs使用的其他关注与程序所需的起始材料量有关。用于捕获 SUMOylate 蛋白质的起始材料应考虑探索的不同实验条件。虽然基础SUMOylation已报告在各种细胞环境中,SUMOylation是一个过程,在多重应力条件/刺激后强烈诱导。如果比较未经处理的样本和经过处理的样本,则必须确保柱未饱和,并且可以观察到这些条件之间的差异。在我们分析的小鼠表型的情况下,没有使用任何治疗方法,基础SUMOyyyy化水平较低。因此,使用了大量的蛋白质。后台级别应使用 GST 进行控制,如果未具体绑定较高,则应减少起始材料量或绑定时间。FT 分数的分析可以指示捕获效率,即使这些陷阱倾向于多 SUMOylate 蛋白质,并且不应预期完全耗尽,但总体而言,当捕获效率为最优。
最后,SUBEs技术的其他应用包括SUBEs技术与实时表面疟原虫共振(SPR)的结合,允许与细胞提取物27中的SUMOylate蛋白质进行实时相互作用。此外,最近,生物素素SUMO陷阱(生物SUBEs)已经开发,其优点是减少与较大标签相关的背景,例如,在质谱分析26。此外,生物SUBE版本还可用于利用链球菌结合与生物素结合的链球蛋白,利用链球菌素结合生物素,使用带不同荧光染料的链球蛋白标记,通过荧光检测活细胞中的SUMOYLATE蛋白。此外,SUMOylate蛋白质的检测和定量方法可以考虑与GST和生物SUBEs版本,如它与串联泛素结合实体(TUBEs)21。
总体而言,使用SUBEs分离和鉴定与肝癌相关的SUMOylate蛋白酶是一种快速而敏感的方法,它提供了关于SUMOylation途径在肝癌中仍然相当未知的作用的海量信息。
披露声明
马丁内斯-尚塔尔博士为米托特拉皮蒂克斯有限责任公司提供建议。
致谢
这项工作得到了法国国家癌症研究所赠款、INCa赠款PLBIO16-251(PLBIO16-251)、国家癌症委员会(墨西哥)赠款0280365和法国奥克西塔尼的REPERE方案的支持。此外,NIH(美国卫生与公众服务部)-R01AR001576-11A1, 戈比耶诺瓦斯科-萨卢德2013111114(至M.L.M.-C),ELKARTEK 2016,戈壁野瓦斯科工业部,米内科:SAF2017-87301-R Integrado2013-2016年科菲南西亚多基金会,BIOEF(巴斯克创新与健康研究基金会):EITB马拉托亚BIO15/CA/014;萨卢德·卡洛斯三世研究所:PIE14/00031, 2013-2016年科菲南西亚多·费多尔(到M.L.M.-C),西班牙国家委员会(T.C.D,M.L.M-C),丹尼尔·阿尔基耶奖EASL(到T.C.D),西班牙癌症协会基金会(AECC科学基金会)2017年罕见肿瘤电话(到M.L.M),La Caixa基金会方案(M.L.M.我们感谢MINECO对中投生物群(SEV-2016-0644)的塞韦罗·奥乔亚卓越认证。
材料
| Name | Company | Catalog Number | Comments |
| (Gnmt−/−)/ (Gnmt+/+) mice | CIC bioGUNE | ||
| 0.5% Trypsin-EDTA | Life Technologies | 15400-054 | |
| BEBM | Lonza/Clonetics Corporation | cc-3171 | |
| BEGM Bullet Kit | Lonza/Clonetics Corporation | CC3170 | |
| Bromophenol blue | Sigma | 115-39-9 | |
| BSA | Sigma | A4503 | |
| C18 microcolumns | Millipore | Z720070 | |
| Collagen type I | Santa Cruz Biotechnology | sc-136157 | |
| Complete tablets EDTA-free | Roche | 4693132001 | |
| DMEM | Life Technologies | A14431-01 | |
| DTT | Sigma | 43815 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | e9644 | |
| FBS | Life Technologies | 10270 | |
| Fibronectin | Life Technologies | 33010018 | |
| Glutamine | Life Technologies | 25030-024 | |
| Glutathione agarose beads | Sigma | G4510 | |
| Glycerol | Sigma | G5516 | |
| GST-Control | SignalChem | G52-30H | |
| GST-SUBEs | SignalChem | S291-340G | |
| Huh7 | CLS (Cell Lines Service) | 300156 | https://clsgmbh.de/ |
| IAA (2-Iodoacetamide) | Merck | L58046844 | |
| LKB1 antibody | Santa Cruz Biotechnology | sc-32245 | |
| Mini LabRoller Rotator | LABNET | H5500 | https://www.labnetinternational.com |
| NaCl | Merck | 106404041000 | |
| nanoElute | BRUKER | https://www.bruker.com/ | |
| NEM (N-Ethylmaleimide) | Sigma | E3876 | |
| NP40 | Fluka | 74385 | |
| PBS | Life Technologies | 14190-094 | |
| Peaks software | Bioinformatics Solutions Inc. | http://www.bioinfor.com/ | |
| Phosphoetanolamine | Sigma | P0503 | |
| Ponceau S solution | Sigma | P7170 | |
| PR-619 | Merck | 662141 | |
| Precellys 24 | Bertin Technologies | P000669-PR240-A | |
| PSA | Life Technologies | 151-40-122 | |
| PSG | Life Technologies | 10378-016 | |
| SDS | Sigma | L3771 | |
| SUMO2/3 antibody | Abcam | Ab3742 | |
| THLE-2 | ATCC | ATCC CRL-2706 | http://www.lgcstandards-atcc.org |
| timsTOF Pro with PASEF mass spectrometer | BRUKER | https://www.bruker.com/ | |
| β-mercaptoethanol | Sigma | 60-24-2 |
参考文献
- Forner, A., Llovet, J. M., Bruix, J. Hepatocellular carcinoma. Lancet. 379 (9822), 1245-1255 (2012).
- Gerbes, A., et al. Gut roundtable meeting paper: selected recent advances in hepatocellular carcinoma. Gut. , (2017).
- Avila, M. A., Berasain, C., Sangro, B., Prieto, J. New therapies for hepatocellular carcinoma. Oncogene. 25 (27), 3866-3884 (2006).
- Grotenbreg, G., Ploegh, H. Chemical biology: dressed-up proteins. Nature. 446 (7139), 993-995 (2007).
- Hendriks, I. A., Vertegaal, A. C. A comprehensive compilation of SUMO proteomics. Nature Reviews in Molecular Cell Biology. 17 (9), 581-595 (2016).
- Seeler, J. S., Dejean, A. SUMO and the robustness of cancer. Nature Reviews Cancer. 17 (3), 184-197 (2017).
- Tomasi, M. L., et al. S-adenosyl methionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in murine liver and human cancers. Hepatology. 56 (3), 982-993 (2012).
- Li, J., et al. Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity. Cancer Cell. 25 (1), 118-131 (2014).
- Zubiete-Franco, I., et al. SUMOylation regulates LKB1 localization and its oncogenic activity in liver cancer. EBioMedicine. 40, 406-421 (2019).
- Sarge, K. D., Park-Sarge, O. K. SUMO and its role in human diseases. Internationa Review of Cell and Molecular Biology. 288, 167-183 (2011).
- Da Silva-Ferrada, E., Lopitz-Otsoa, F., Lang, V., Rodriguez, M. S., Matthiesen, R. Strategies to Identify Recognition Signals and Targets of SUMOylation. Biochemical Research International. , 875148 (2012).
- Liang, Y. C., et al. SUMO5, a Novel Poly-SUMO Isoform, Regulates PML Nuclear Bodies. Science Reports. 6, 26509 (2016).
- Mikolajczyk, J., et al. Small ubiquitin-related modifier (SUMO)-specific proteases: profiling the specificities and activities of human SENPs. Journal of Biologucal Chemistry. 282 (36), 26217-26224 (2007).
- Hilgarth, R. S., Sarge, K. D. Detection of sumoylated proteins. Methods in Molecular Biology. 301, 329-338 (2005).
- Vertegaal, A. C., et al. A proteomic study of SUMO-2 target proteins. Journal of Biological Chemistry. 279 (32), 33791-33798 (2004).
- Bruderer, R., et al. Purification and identification of endogenous polySUMO conjugates. EMBO Reports. 12 (2), 142-148 (2011).
- Becker, J., et al. Detecting endogenous SUMO targets in mammalian cells and tissues. Nature Structural Molecular Biology. 20 (4), 525-531 (2013).
- Barysch, S. V., Dittner, C., Flotho, A., Becker, J., Melchior, F. Identification and analysis of endogenous SUMO1 and SUMO2/3 targets in mammalian cells and tissues using monoclonal antibodies. Nature Protocols. 9 (4), 896-909 (2014).
- Hendriks, I. A., et al. Site-specific characterization of endogenous SUMOylation across species and organs. Nature Communications. 9 (1), 2456 (2018).
- Da Silva-Ferrada, E., et al. Analysis of SUMOylated proteins using SUMO-traps. Science Reports. 3, 1690 (2013).
- Hjerpe, R., et al. Efficient protection and isolation of ubiquitylated proteins using tandem ubiquitin-binding entities. EMBO Reports. 10 (11), 1250-1258 (2009).
- Embade, N., et al. Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation. Hepatology. 55 (4), 1237-1248 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Meier, F., et al. Online Parallel Accumulation-Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer. Molecular and Cellular Proteomics. 17 (12), 2534-2545 (2018).
- Ritho, J., Arold, S. T., Yeh, E. T. A Critical SUMO1 Modification of LKB1 Regulates AMPK Activity during Energy Stress. Cell Reports. 12 (5), 734-742 (2015).
- Lang, V., Da Silva-Ferrada, E., Barrio, R., Sutherland, J. D., Rodriguez, M. S. Using Biotinylated SUMO-Traps to Analyze SUMOylated Proteins. Methods in Molecular Biology. 1475, 109-121 (2016).
- Xolalpa, W., Rodriguez, M. S., England, P. Real-Time Surface Plasmon Resonance (SPR) for the Analysis of Interactions Between SUMO Traps and Mono- or PolySUMO Moieties. Methods in Molecular Biology. 1475, 99-107 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。