Method Article
SUMO-Binding Entities (SUBEs) als Werkzeuge zur Anreicherung, Isolierung, Identifizierung und Charakterisierung des SUMO-Proteoms bei Leberkrebs
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur Anreicherung, Isolierung, Identifizierung und Charakterisierung von Proteinen vor, die durch SUMO in vivo sowohl aus menschlichen Häpatomzellen als auch aus Lebertumoren modifiziert wurden, die aus Mausmodellen des hepatozellulären Karzinoms unter Verwendung von SUMO-bindenden Einheiten (SUBEs) gewonnen wurden.
Zusammenfassung
Post-translationale Modifikation ist ein Schlüsselmechanismus zur Regulierung der Proteinhomöostase und Funktion in eukaryotischen Zellen. Unter allen ubiquitinähnlichen Proteinen bei Leberkrebs wurde der Modifikation durch SUMO (Small Ubiquitin MOdifier) die größte Aufmerksamkeit geschenkt. Die Isolierung endogener SUMOylated-Proteine in vivo ist aufgrund des Vorhandenseins aktiver SUMO-spezifischer Proteasen eine Herausforderung. Erste Studien zur SUMOylierung in vivo basierten auf dem molekularen Nachweis spezifischer SUMOylated-Proteine (z.B. durch Western Blot). In vielen Fällen haben Antikörper, die in der Regel mit nicht modifiziertem rekombinantem Protein hergestellt werden, jedoch keine sUMOylated Formen des Proteins von Interesse immunpräzipitiert. Die Nickelchromatographie war der andere Ansatz zur Untersuchung der SUMOylation, indem Histidin-markierte Versionen von SUMO-Molekülen erfasst wurden. Dieser Ansatz wird hauptsächlich in Zellen verwendet, die mit His-SUMO-Molekülen stabil exektiert oder vorübergehend transfiziert werden. Um diese Einschränkungen zu überwinden, wurden SUMO-bindende Einheiten (SUBEs) entwickelt, um endogene SUMOylated-Proteine zu isolieren. Hierin beschreiben wir alle Schritte, die für die Anreicherung, Isolierung und Identifizierung von SUMOylated Substraten aus menschlichen Häpatomzellen und Lebergeweben aus einem Leberkrebs-Mausmodell erforderlich sind, indem wir SUBEs verwenden. Zunächst beschreiben wir Methoden, die an der Herstellung und Lyse der menschlichen Häpatomzellen und Lebertumorgewebeproben beteiligt sind. Dann wird eine gründliche Erklärung der Vorbereitung von SUBEs und Kontrollen zusammen mit dem Protokoll für die Protein-Pull-down-Assays detailliert beschrieben. Schließlich werden einige Beispiele für die Möglichkeiten zur Identifizierung und Charakterisierung des SUMOylated-Proteoms angeführt, nämlich die Verwendung von Western-Blot-Analysen zum Nachweis eines bestimmten SUMOylated-Substrats aus Lebertumoren oder die Verwendung der Proteomik durch Massenspektrometrie zur Hochdurchsatzcharakterisierung des SUMOylated Proteoms und Interoms in Häpatomzellen.
Einleitung
Leberkrebs ist die sechsthäufigste Krebsart weltweit und die zweithäufigste Ursache für krebsassoziierte Todesfälle1. Hepatozelluläres Karzinom (HCC) ist die vorherrschende Form von primärem Leberkrebs. Historisch gesehen waren häufige Risikofaktoren für die Entwicklung von HCC chronische Hepatitis-B- oder C-Infektionen und missbräuchlicher Alkoholkonsum. In den letzten Jahrzehnten hat sich das metabolische Syndrom Typ-2-Diabetes-Nicht-alkoholische Fettleber (NAFLD) als Risikofaktoren für die Entwicklung von HCC2herausgestellt. HCC ist sehr heterogen, sowohl phänotypisch als auch genetisch, wobei ein komplexes Netzwerk von Signalwegen gestört wird. In den letzten Jahren, obwohl unser Wissen über die molekularen Bahnen, die mit der Pathogenese von HCC involviert sind, zugenommen hat, gibt es immer noch keine wirksamen therapeutischen Ansätze für das HCC-Management. Viele Wege werden in HCC aktiviert und hemmend treibt man in der Regel die Kompensation durch andere Wege3. Dies war eine der Hauptschwierigkeiten bei der Behandlung von HCC. Daher kann ein globalerer Ansatz einen potenziellen therapeutischen Ansatz für das klinische Management von Leberkrebs bieten, z. B. auf posttranslationale Modifikationen (PTMs), da mehrere Signalwege gleichzeitig durch PTMs von Proteinen reguliert werden können.
Post-translationale Modifikationen werden als Schlüsselmechanismen zur Regulierung der Proteinhomöostase und der Funktionen4betrachtet. Strukturelle und funktionelle Veränderungen werden durch PTMs eingeführt, wodurch die Proteomvielfalt erhöht wird. Die häufigsten PTMs sind Phosphorylierung, Methylierung, Acetylierung, Glykosylierung, Ubiquitination und Konjugation von Ubiquitin-ähnlichen Proteinen (UbLs). Unter allen UbLs hat die Proteinmodifikation durch SUMO (Small Ubiquitin MOdifier) die Aufmerksamkeit in Verbindung mit seiner kritischen Rolle in einer Vielzahl von zellulären Prozessen auf sich gezogen, einschließlich Transkription, zellulärer Lokalisierung, DNA-Reparatur und Zellzyklusprogression. 5. Kürzlich wurde gezeigt, dass die SUMOylierung bei Leberkrebs verändert wurde6,7,8,9, und Veränderungen in der SUMOylierung spezifischer Proteine wurden beschrieben, um eine Rolle bei der Progression von krebsbedingte Erkrankungen9.
Bei Säugetieren gibt es fünf SUMO-Paralogen, SUMO-1 bis SUMO-5. Bis heute liegen keine experimentellen Beweise für das Vorhandensein endogener SUMO-4- und endogener SUMO-5-Konjugationsreaktionen auf Proteinebene10,11,12vor. Die SUMOylierung bei Säugetieren erfolgt durch eine enzymatische Thiol-Ester-Kaskade mit drei Enzymen, dem heterodimeren SUMO-Aktivierenden Enzym (SAE1/SAE2) oder E1, dem SUMO-Konjugationsenzym (Ubc9) oder E2 und einer SUMO-E3-Ligase, die für jedes Zielprotein spezifisch ist. Die Wirkung mehrerer SUMO E3-Familien scheint in einem dynamischen Gleichgewicht mit SUMO-spezifischen Proteasen (SUSPs oder SENPs)13 zu sein, was die SUMOylierungsreaktion sehr reversibel macht. Darüber hinaus ist nur ein kleiner Bruchteil des SUMOylated Proteins im Vergleich zu nicht-SUMOylated Totalprotein vorhanden. Dabei ist die Isolierung endogener SUMOylated Proteine in vivo ziemlich anspruchsvoll13.
Die SUMOylierung in vivo wurde zunächst mit Western Blot mit Antikörpern gegen das Protein von Interesse14untersucht. Die Immunpräzipitation des Proteins wurde mit spezifischen Antikörpern durchgeführt und dann wurde PAGE-Western Blot mit Anti-SUMO-Antikörpern durchgeführt. Das Hauptproblem bei dieser Strategie ist, dass Antikörper, die gegen ein nicht modifiziertes rekombinantes Protein erzeugt werden, nicht immer in der Lage sind, die SUMOylated Form eines Proteins zu immunisieren. Alternativ wurde die Nickelchromatographie nach der transienten Expression von Histidin-Tags (His6) Versionen von SUMO-Molekülen und dem Protein von Interesse verwendet, um die SUMOylierung in Zellen zu untersuchen. Auf dieser Grundlage wird es bequemer sein, SUMO-modifizierte Formen von Zellen zu erkennen, die stabil His6-SUMO15ausdrücken. Für In-vivo-Studien wurde für die Reinigung der PolySUMO-Konjugate16Tandem-SUMO-interagierende Motive (SIM) demonstriert. Andere Gruppen haben epitopmarkierte Antikörper-SUMO-Ansätze verwendet, die ein praktikables Werkzeug zur Untersuchung der endogene SUMOylierung in Primärzellen, Geweben und Organen17,18. Und in jüngerer Zeit haben Nielsen und Kollegen antikörperbasierte Anreicherung verwendet, um endogene und standortspezifische SUMO in Zellen und Geweben zu identifizieren19.
Um ergänzende Informationen über die Rolle der SUMOylierung in vivo zu liefern, wurden SUMO-bindende Einheiten (SUBEs), auch sUMO-Fallen genannt,20entwickelt. Von Bedeutung sind Tandem-Ubiquitin-Bindungseinheiten (TUBEs) als konzeptionelle Vorläufer von SUBEs und sind kommerziell erhältliche Werkzeuge für den Nachweis und die Isolierung polyubiquitylierter Proteine21. SUBEs sind rekombinante Proteine, die Tandemwiederholungen von SIMs umfassen und dadurch SUMO-Moleküle auf modifizierten Proteinen erkennen, mit einer Erhöhung der Gesamtaffinität für SUMO-Substrate. SUMO-Traps wurden durch die Einführung einer E3-Ubiquitin-Protein-Ligase RNF4-abgeleiteten SIM2- und SIM3-Motive im Tandem in einen Vektor entwickelt, der Glutathion-S-Transferase (GST), ein heterologes Trägerprotein20, enthält. Obwohl SUBEs nicht richtig verwendet werden können, um mono-SUMOylated Zielproteine zu identifizieren, bietet diese Methode ein Werkzeug, um die Reinigung und Identifizierung von Poly-SUMO-Zielproteinen in vivo zu erleichtern. Hierin beschreiben wir die Anwendung von SUBEs, um SUMOylated Proteine sowohl in menschlichen Häpatomzellen als auch in Mausleberbiopsien zu isolieren, ein wichtiges Werkzeug für die Untersuchung von Leberkrebs. Abbildung 1zeigt ein Gesamtschema des in diesem Manuskript beschriebenen Protokolls.
Protokoll
Alle Experimente wurden von den institutionellen Ausschüssen von CIC bioGUNE für Tierpflege und Tierhaltung genehmigt. Alle Anstrengungen wurden unternommen, um das Leiden der Tiere zu minimieren und die Zahl der verwendeten Tiere zu verringern. Es wurden 3 Monate alte männliche Glykole N-Methyltransferase (Gnmt) Mangel (Gnmt)und seine wilden Wurfmatten (Gnmt+/+) verwendet.
1. Zellvorbereitung und Lysis
HINWEIS: Hierbei wurden Huh-7 (menschliche Häpatom-Zelllinie) und THLE2 (menschliche Leberzelllinie) verwendet.
- Halten Sie Zellen in P100-Platten in Standard-Wachstumsmedien bei 37 °C in einer befeuchteten Atmosphäre von 5% CO2-95% Luftfeuchtigkeit.
- Wachsen Sie Zellen in P100-Platten, die mit einer Dichte von 1,2–1,5 x 106 Zellen pro Schale verschichten, indem sie die Zellen mit einer Neubauer Hämozytometrie-Zählkammer zählen.
- Kultur Huh-7 in DMEM ergänzt mit 10% fetalem Rinderserum (FBS), 1% Penicillin-Streptomycin-Amphotericin B (PSA) und 1% Glutamin.
- Kultur THLE2-Zellen in Kulturgerichten, vorbeschichtet mit 0,01 mg/ml Fibronektin, 0,01 mg/ml Rinderserumalbumin (BSA) und 0,03 mg/ml Kollagen Typ I in Wachstumsmedium gelöst, das aus Bronchialepithelialemzellwachstum Basalmedium (BEGM) besteht, ergänzt mit Wachstumsfaktoren (0,4% BPE, 0,1% Insulin, 0,1% Hydrocortison, 0,1% Retinsäure, 0,1% Transferrin, 0,1% Triiodothyronin sowie 10% FBS, 1% PSA, 5 ng/mL epidermaler Wachstumsfaktor (EGF) und 70 ng/ml Phosphoethanolamin.
- Am Ende des Experiments die Medien aus den Platten und Waschzellen mit 5 ml steriler 1x phosphatgepufferter Kochsaline (PBS) aspirieren. Lysezellen direkt auf der Platte auf Eis platziert mit 500 l Lysepuffer (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1% nonidet P-40 (NP40), ergänzt durch komplette EDTA-freie Protease-Hemmer-Cocktail und 50 M PR-619 für jede P100-Schale. Mit einem Zellschaber kratzen Sie die Zellen vorsichtig von der Unterseite der Platte in das Lysis-Medium.
HINWEIS: Überprüfen Sie, ob sich alle Zellen von der Platte gelöst haben, indem Sie die Plattenbasis nach der Behandlung visuell überprüfen. - Alternativ können Sie Zellen durch Trypsinisierung durch Ansaugung von Zellmedien ernten und 1 ml 1x (0,05%) hinzufügen. trypsin-EDTA auf die Platte, genug, um die Zellen zu bedecken und die Platte im Inkubator auf 37 °C, 5%CO2und 95% Luftfeuchtigkeit für 5 min zu setzen, um sicherzustellen, dass sich alle Zellen von der Platte gelöst haben. Fügen Sie 2 ml vorgewärmtes Wachstumsmedium hinzu, um die Trypsinisierung zu stoppen. Zentrifugieren Sie bei 150 g für 10 min und aspirieren Sie den Überstand. Mit 1x PBS und Zentrifuge bei 150 x g 10 min waschen. Nach der Beanstandung des Überstandes 500 L Lysepuffer (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1% NP40, ergänzt durch kompletten EDTA-freien Protease-Inhibitor-Cocktail und 50 M PR-619 für jedes P100-Gericht.
HINWEIS: Die Hinzufügung des PR-619 ist entscheidend. - Zentrifuge bei 15.500 x g und 4°C für 10 min. Überträgt den Überstand in ein anderes Rohr und entsorgt das Pellet.
HINWEIS: Das Protokoll kann hier angehalten und Proben bis zu einer weiteren Analyse bei -80 °C gespeichert werden.
2. Gewebevorbereitung und Lyse
- Nach Tieropfern, sammeln Mausleber, waschen mit kalten PBS, und schnappen sofort einfrieren in flüssigem Stickstoff. Bewahren Sie die Proben bis zur weiteren Analyse bei 80 °C auf.
- Homogenisieren Sie 75 mg-Fragmente aus schnappgefrorenen/oder frischen Lebern in 1 ml eiskalten Lysepuffer (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1% NP40, ergänzt durch kompletten EDTA-freien Protease-Inhibitor-Cocktail und 50 m PR-619). Führen Sie den Homogenisator bei 6500 x Rpm, je 2 x 60 s, mit einer Pause von 30 s (siehe Tabelle der Materialien).
- Zentrifugieren Sie die Proben in einer Mikrofuge bei 15, 500 x g und 4 °C für 10 min. Übertragen Sie den Überstand auf ein anderes Rohr und entsorgen Sie das Pellet.
- Alternativ trituieren Sie 75 mg gefrorenes Gewebe in flüssigem Stickstoff. Dann das Gewebe in 1 ml Lysepuffer wiederherstellen.
- Zentrifugieren Sie die Probe in einer Mikrofuge bei 15, 500 x g und 4 °C für 10 min. Übertragen Sie den Überstand in ein anderes Rohr und entsorgen Sie das Pellet.
HINWEIS: Das Protokoll kann hier angehalten und Proben bis zu einer weiteren Analyse bei -80 °C gespeichert werden.
3. Bindung von GST-SUBEs oder GST-Kontrolle an Glutathion-Agarose-Perlen
HINWEIS: Die Synthese der GST-SUBEs oder der GST-Kontrolle fällt nicht in den Anwendungsbereich dieses Manuskripts und kann in der zuvor veröffentlichten Literatur20eingesehen werden. Alternativ sind GST- und Control SUBEs im Handel erhältlich (z.B. SignalChem).
- Herstellung von Glutathionperlen
- Fügen Sie 1 ml entionisiertes Wasser zu 70 mg lyophilisierte Glutathion-Agarose-Perlen hinzu. Rekonstituieren Sie die Perlen über Nacht bei 4 °C (oder für mindestens 30 min bei Raumtemperatur).
- Waschen Sie die Perlen gründlich nach der Schwellung (um Lactose und Ethanol zu entfernen, die in der Regel in den lyophilisierten Pulver-Agarose-Perlen vorhanden sind). Dazu zuerst mit 10 ml entionisiertem Wasser oder PBS waschen, gefolgt von Zentrifugation bei 300 x g für 5 min bei Raumtemperatur. Führen Sie dies dreimal aus.
- Nach 3 Wähen, setzen Sie die Perlen in 1 ml PBS wieder auf, um eine 50% (v/v) Gülle zu erhalten.
HINWEIS: Dieses Volumen eignet sich für die Analyse von 10 Proben.
- Fügen Sie für jede Probe 100 g GST-SUBEs oder GST-Kontrolle (siehe Referenz20) bis 100 l der Glutathionperlenschlämme und 500 l PBS hinzu.
HINWEIS: Die relative Häufigkeit der sUMOylated Proteine von Interesse bestimmt die Menge der GST-SUBEs, die für Pull-Downs verwendet werden. Analysieren Sie für jedes neue experimentelle Modell den Zustand vor dem eigentlichen Experiment, indem Sie das Input-, Gebunden- und Durchflussmaterial (FT) mit Anti-SUMO2/3-Antikörpern oder gegen Proteine von Interesse (Liver Kinase B1 (LKB1) bloten. - Inkubieren Sie alle GST-SUBEs oder GST-Steuerung mit Perlen in 3.2., langsam rotierend in Rotator oder Mini-Rolle (siehe Tabelle der Materialien) bei 4 °C für mindestens 2 h (langsame Bindungsreaktion).
HINWEIS: Das Hinzufügen von 1 mM Dithiothreitol (DTT) verbessert die GST-Bindung an die Glutathionperlen. - Die Agaroseperlen durch Zentrifugieren bei 300 x g für 5 min bei Raumtemperatur wiederherstellen. Am Ende wurden die Perlen in PBS wieder ausgesetzt, um 50 % (v/v) Gülle zu erhalten.
HINWEIS: Das Protokoll kann hier angehalten und Proben bis zu einer weiteren Analyse bei -80 °C gespeichert werden.
4. GST Pull Down Assay
- Nach Schritt 1,5, 2,3 oder 2,5 1/10 des Gesamtvolumens (z.B. 50 l) nehmen und im gleichen Volumen von 3x Siedepuffer verdünnen (250 mM Tris-HCl pH 6,8, 500 mM -Mercaptoethanol, 50% Glycerin, 10% SDS, Bromphenol blau). Dieser Anteil wird als INPUT betrachtet.
- Fügen Sie 450 l geklärtes Lysat aus den Schritten 1,5, 2,3 oder 2,5 bis 100 l Glutathionperlen schlämm hinzu. Das Lysat mit Perlen bebrüten, langsam bei 4 °C für mindestens 2 h drehen.
ANMERKUNG: Alternativ können 100-200 g Gesamtprotein aus den Schritten 1,5, 2,3 oder 2,5 (quantifiziert mit dem Bradford-Assay) in einem Gesamtvolumen von 450 l verwendet werden. - Drehen Sie die Perlen in einer Mikrofuge bei 300 x g für 5 min und sammeln Sie den Überstand für die Analyse. 1/10 des Gesamtvolumens (z.B. 50 l) in ein separates Rohr übertragen und in einem gleichen Volumen von 3x Siedepuffer verdünnen. Dieser Anteil ist der Durchfluss -FT) Fraktion.
- Waschen Sie die restliche Probe dreimal mit 1 ml eiskaltem PBS, 0,05% Tween 20, drehen Sie bei 4 °C und 300 x g für 1 min. Sorgfältig aspirieren, um sicherzustellen, dass keine Flüssigkeit übrig bleibt. Die Perlen entsprechen der SUBEs BOUND (SB) Fraktion.
- Die Probe mit 15 l 3x Siedepuffer und 15 l des Lysepuffers. Dies wird als BOUND-Fraktion bezeichnet.
5. Identifizierung und Charakterisierung von SUMO-Zielen durch Western Blot-Analyse
- Führen Sie eine Western-Blot-Analyse mit einem Anti-SUMO2/3-Antikörper oder einem anderen spezifischen Antikörper nach Wahl durch, wie zuvorbeschrieben 22.
6. Identifizierung und Charakterisierung des SUMOylated Proteome durch Massenspektrometrie
HINWEIS: Bei der Mass-Spectrometrie-Analyse (MS) wurden Proben nach der von Wisniewski et al.23beschriebenen Filter-Aided Sample Preparation (FASP)-Methode verarbeitet.
- Die Peptide mit Stufenspitzen-C18-Mikrokolonnen entsalzen und vor der MS-Analyse in 0,1% Ameisensäure (FA) wieder aufsetzen.
- Laden Sie die Proben auf ein LC-MS-System (siehe Materialtabelle) und analysieren Sie sie in dreifacher Weise (technische Replikationen) (Abbildung 2b).
- Fahren Sie mit der Proteinidentifikation und Abundance-Berechnung fort, indem Sie eine zugehörige Software verwenden.
- Laden Sie die Daten für statistische Analysen und Heatmap-Generierung auf die Perseus-Plattform (http://www.perseus.tufts.edu/hopper/). Wenden Sie eine permutationsbasierte False Discovery Rate (FDR)-korrigierten t-Test für den Vergleich der Häufigkeiten an. Proteine mit einem q < 0,05 und einem SUBEs/GST-Verhältnis größer als 2 wurden als angereichert24betrachtet.
HINWEIS: Proteine, die mit mindestens zwei verschiedenen Peptiden identifiziert wurden, werden letztendlich berücksichtigt.
Ergebnisse
Identifizierung eines spezifischen SUMOylierungssubstrats in Lebertumorbiopsien durch Western Blot Analysis
Leber Kinase B1 (LKB1) SUMOylierung hat sich vor kurzem als ein wichtiger onkogene Treiber bei Leberkrebs9,25. Mäuse mit einem Mangel an Glycin N-Methyltransferase(Gnmt), oft als Gnmtbezeichnet,ist ein Modell, das spontan hepatozelluläres Karzinom (HCC) entwickelt, die häufigste Art von primärem Leberkrebs. SUBEs wurden verwendet, um die SUMOylated Proteine sowohl in Gnmt-/- Mäusen mit Leberkrebsmäusen und ihren wilden Wurfgenossen (Gnmt+/+) anzureichern undzuisolieren. In Abbildung 2asind ponceau S Färbung der drei verschiedenen Fraktionen (Input, FT und BOUND), die im SUBEs Pull-down-Assay erhalten wurden, enthalten. Ein Ponceau S Fleck ist nützlich, um einen möglichen schädlichen Effekt auf die Belastung von gefleckten Proteinen zu kontrollieren, die von westlichen Flecken bewertet werden. In Abbildung 2b wird eine Western-Blot-Analyse von LKB1 unter Verwendung von SUBEs zur Erfassung endoogenen SUMOylated LKB1 gezeigt. Die Konzentrationen der LKB1-SUMOylierung werden bei Lebertumoren erhöht. Bei der Western Blot-Analyse wurden durch Ponceau-Färbung der Eingangsfraktion gleiche Lasten und übertragene Proteine beobachtet und nach dem Einwälten (Durchflussbruch) nicht signifikant verändert. Die Menge an Protein, die mit SUBEs eingefangen wurde, war signifikant höher, insbesondere bei den Tumoren. Alternativ kann die Färbung eines doppelten Gels mit Coomassie blue ähnliche Informationen liefern. Klebrige Proteine wie p53 oder SUMOylated Formen einiger Proteine könnten an die GST-Kontrolle binden. Um den Hintergrund zu entfernen, verwenden Sie Agarose-Perlen mit geringer Dichte, führen Sie eine Beschichtung mit BSA durch oder integrieren Sie zusätzliche Wärmittel. Dies könnte sich jedoch auf Anwendungen wie die Massenspektrometrie auswirken und zum Verlust von Proteinen mit geringer Affinität führen, die interagieren.
Charakterisierung des SUMO-Interactoms in humanen Hepatomzellen durch Massenspektrometrie-Analyse
Um die Fähigkeit der SUMO-Falle zu untersuchen, mit natürlichen SUMOylated-Proteinen zu interagieren, wurden Huh-7 (humanes Hepatom) und nicht transformierte Leberepithel-Human-THLE2-Zelllinien verwendet. Der erste Schritt ist die Visualisierung des gesamtmit SUBEs erfassten Materials und die Verwendung von GST als Negativkontrolle. Zu diesem Zweck können wir konventionelle Proteinfärbeprotokolle verwenden, wie in Abbildung 3adargestellt. Dann führten wir eine Massenspektrometrieanalyse durch. In den Huh7-GST-Proben wurden durchschnittlich 2268 Proteine identifiziert (2339, 2297 bzw. 2168 für jede Last), während in der Huh7-SUBEs-Probe durchschnittlich 2812 Proteine identifiziert wurden (2815, 2817 und 2806). Nach der Subtraktion wurden 742 Proteine in den SUBEs angereichert. Dagegen wurden in den THLE2-GST-Proben durchschnittlich 2497 Proteine (2476, 2520 bzw. 2495) und 2763 in den SUBEs (2823, 2783 und 2684) identifiziert. Davon wurden 577 in den SUBE-Proben als angereichert angesehen. Die Analyse der technischen Replikationen ruft die in Abbildung 3bdargestellte Heatmap ab, die mit den verfügbaren Standardeinstellungen berechnet wurde (Euklidische Entfernung, durchschnittliche Verknüpfung und vorverarbeitet mit k-Means). Die Heatmap zeigt die Verteilung der 100 wichtigsten und ausschließlich angereicherten Proteine in jeder Zelllinie.
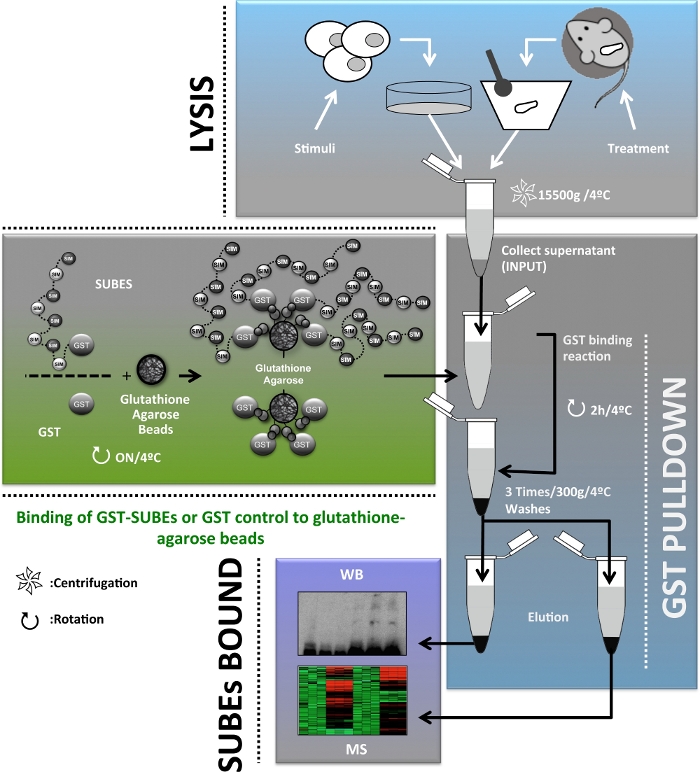
Abbildung 1: Schematische Darstellung des Protokollflussdiagramms, das für die Anreicherung, Isolierung und Identifizierung und Charakterisierung des SUMOylated-Proteoms in vivo zur Untersuchung von Leberkrebs verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
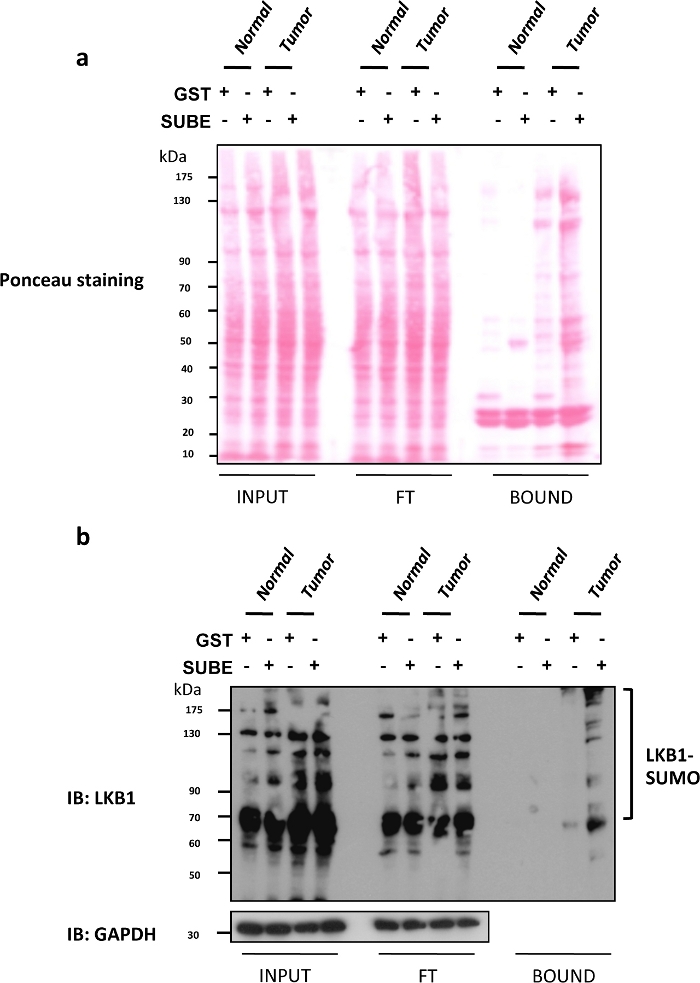
Abbildung 2: Modifikation von LKB1 durch SUMO-2 in Mausmodellen des hepatozellulären Karzinoms.
(a) Ponceau S Färbung der drei verschiedenen Fraktionen (Input, Flow Through (FT) und BOUND), die im SUBEs Pull-Down-Assay erhalten wurden. (b) Western Blot-Analyse von LKB1 unter Verwendung von SUMO-Bindungseinheiten (SUBEs) zur Erfassung endogener SUMOylated LKB1; GAPDH wird als Ladesteuerung verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
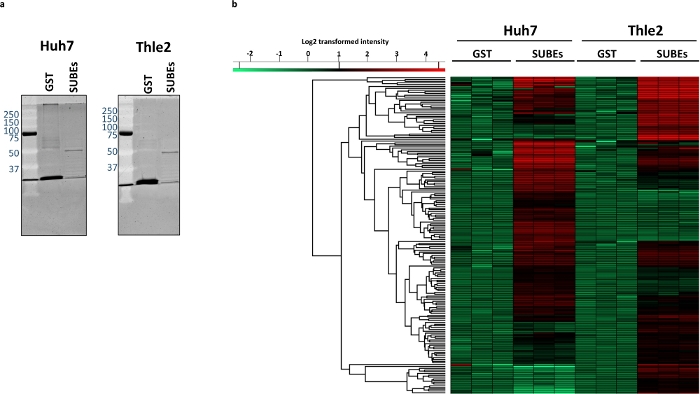
Abbildung 3: Unterschiede zwischen dem SUMOylated Proteom zwischen den tumoralen Huh-7 und nicht transformierten Leberepithel THLE2 menschlichen Zelllinien.
(a) Sypro-Färbung von gefangenem Proteinmaterial mit GST (Negative Control) und SUBEs. (c) Heatmap, die die differenziell angereicherten Proteine in Huh-7- und THLE2-SUBE-Proben darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hierin haben wir eine vollständige und detaillierte Beschreibung der Methodik zur Verfügung gestellt, die die Verwendung von SUBEs für die Anreicherung, Isolierung und Identifizierung und Charakterisierung der SUMOylated Proteine in In-vivo-Modellen von Leberkrebs berichtet. Sowohl in Mauslebertumoren als auch in menschlichen Häpatomzellen waren wir in der Lage, SUMOylated Proteine von Interesse korrekt zu isolieren und zu identifizieren und eine Hochdurchsatzcharakterisierung des SUMOylated Proteoms und Interoms durchzuführen. Auch wenn die Synthese von SUBEs nicht in den Anwendungsbereich dieses Manuskripts fällt, sollten für weitere Informationen die folgenden Hinweise unter26betrachtet werden. Das beschriebene Protokoll ist schnell und sehr sensibel und der kritische Schritt des Protokolls umfasst die Verwendung von SENPs-Inhibitoren (PR-619). Alternativ können chemische Isopeptidase-Inhibitoren wieNEM (N-Ethylmaleimid) und IAA (2-Iodoacetamid) im Lysepuffer verwendet werden, jedoch haben frühere Berichte gezeigt, dass für das SUBEs-Protokoll die Verwendung von PR-619 vorteilhaft ist, da die anderen Inhibitoren stören die GST-Bindung an die Glutathionperlen20.
SUBEs sind rekombinante Proteine, die Tandemwiederholungen von SIMs umfassen und dadurch SUMO-Moleküle auf modifizierten Proteinen erkennen, mit einer Erhöhung der Gesamtaffinität für SUMO-Substrate. Aufgrund seiner hohen Spezifität und Empfindlichkeit ist die Verwendung von SUBEs zur Isolierung des SUMOylated-Proteoms im Vergleich zu anderen Ansätzen in der Literatur von Vorteil, wie z. B. der Nachweis spezifischer SUMOylated-Proteine durch Western-Blot mit Antikörpern gegen das Von Interesse ist, oder die Nickelchromatographie unter Verwendung der verschiedenen Histidin-markierten Versionen von SUMO-Molekülen. Es ist jedoch zu berücksichtigen, dass die Wechselwirkung zwischen SUMOylated-Proteinen und anderen interagierenden Proteinen beibehalten wird, da das SUBEs-Protokoll unter nicht-denaturierenden Bedingungen durchgeführt wird. Daher erhalten wir Informationen über das SUMO-Interactome und nicht nur eine Liste von SUMOylated-Zielproteinen. Daher sind weitere Experimente notwendig, um zu bestätigen, ob es sich bei dem identifizierten Protein um ein SUMO-Ziel oder einen interagierenden Faktor handelt. Eine weitere Einschränkung der SUBEs ist die Tatsache, dass die verwendeten Kontroll-GST-Fallen in der Lage sind, viele Hintergrundproteine im Zusammenhang mit oxidativem Stress zu erfassen. Dieses Problem ist aufgrund der hohen Empfindlichkeit der Technik besonders bei der MS-Analyse relevant. Um diese Einschränkungen zu überwinden, wurden biotinylierte SUMO-Traps (BioSUBEs) entwickelt26. Eine weitere Einschränkung von SUBEs liegt darin, dass wir nur Proteine erfassen können, die durch SUMO 2 und SUMO 3 modifiziert wurden, während SUMO 1-modifizierte Proteine nicht isoliert werden können.
Andere Bedenken bei der Verwendung von SUBEs beziehen sich auf die Menge des Ausgangsmaterials, das für das Verfahren erforderlich ist. Das Ausgangsmaterial, das zum Abfangen von SUMOylated-Proteinen verwendet wird, sollte die verschiedenen untersuchten Versuchsbedingungen berücksichtigen. Während basale SUMOylierung in verschiedenen zellulären Kontexten berichtet wurde, SUMOylation ist ein Prozess, der stark nach mehreren Stressbedingungen /Stimuli induziert wird. Beim Vergleich von unbehandelten und behandelten Proben muss man sicher sein, dass die Säule nicht gesättigt ist und Unterschiede zwischen diesen Bedingungen beobachtet werden können. Im Falle der Maus-Phänotypen, die wir analysieren, wurden keine Behandlungen verwendet und basale SUMOylierungsniveaus sind niedrig. Aus diesem Grund wurden hohe Mengen an Proteinen verwendet. Die Hintergrundebene sollte durch verwendung von GST gesteuert werden, und wenn die unspezifische Bindung hoch ist, sollte die Menge des Ausgangsmaterials oder die Bindungszeit reduziert werden. Die Analyse der FT-Fraktion kann auf die Abscheidungseffizienz hinweisen, auch wenn diese Fallen poly-SUMOylated-Proteine bevorzugen und eine vollständige Erschöpfung nicht zu erwarten ist, eine Verringerung der Gesamt-SUMOylierung ist im Allgemeinen gut beobachtet, wenn die Abscheidungseffizienz optimal.
Schließlich umfasst die andere Anwendung der SUBEs-Technologie die Kombination von SUBEs-Technologie mit Echtzeit-Oberflächen-Plasmon-Resonanz (SPR), die die Echtzeit-Interaktionen mit SUMOylated-Proteinen aus Zellextraktenermöglicht 27. In jüngerer Zeit wurden auch biotinylierte SUMO-Traps (BioSUBEs) mit dem Vorteil entwickelt, den Hintergrund zu reduzieren, der mit größeren Tags verbunden ist, z. B. während der Massenspektrometrieanalyse26. Darüber hinaus kann die bioSUBE-Version verwendet werden, um SUMOylated Proteine in lebenden Zellen durch Fluoreszenz zu erkennen, indem Streptavidin-gekennzeichnet mit ausgeprägten Fluoreszenzfarbstoffen verwendet wird, wobei die Streptavidinbindung an Biotin genutzt wird. Auch Methoden zum Nachweis und zur Quantifizierung von SUMOylated Proteinen können sowohl mit GST- als auch mit BioSUBEs-Versionen in Betracht gezogen werden, wie sie mit den Tandem-Ubiquitin-Bindungseinheiten (TUBEs)21durchgeführt wurden.
Insgesamt ist die Verwendung von SUBEs zur Isolierung und Charakterisierung des bei Leberkrebs relevanten SUMOylated-Proteoms eine schnelle und sensible Methode, die umfassende Informationen über die noch recht unbekannte Rolle des SUMOylierungswegs bei Leberkrebs liefert.
Offenlegungen
Dr. Martinez-Chantar berät für Mitotherapeutix LLC.
Danksagungen
Diese Arbeit wurde durch Stipendien des Institut National du Cancer, FRANCE, DES INCa-Stipendiums PLBIO16-251 (PLBIO16-251), des CONACyT-SRE (Mexiko) Stipendiums 0280365 und des REPERE-Programms von Occitanie, Frankreich (M.S.R.) unterstützt. NIH (US Department of Health and Human Services)-R01AR001576-11A1, Gobierno Vasco-Departamento de Salud 2013111114 (zu M.L.M.-C), ELKARTEK 2016, Departamento de Industria del Gobierno Vasco, MINECO: SAF2017-87301-R integrado en el Plan Estatal de Investigacion Cientifica y Técnica y Innovacién 2013-2016 cofinanciado con Fondos FEDER, BIOEF (Basque Foundation for Innovation and Health Research): EITB Maratoia BIO15/CA/014; Instituto de Salud Carlos III:PIE14/00031, integrado en el Plan Estatal de Investigacién Cientifica y Técnica y Innovacién 2013-2016 cofinanciado con Fondos FEDER (zu M.L.M.-C), Asociacién Espaéola contra el Céncer (T.C.D, M.L.M-C), Daniel Alagille Award von EASL (zu T.C.D), Fundacién Cientéfica de la Asociacién Espaéola Contra el Cancer (AECC Scientific Foundation) Rare Tumor Calls 2017 (to M.L.M), La Caixa Foundation Program (to M.L.M). Wir danken MINECO für die Severo Ochoa Excellence Accreditation to CIC bioGUNE (SEV-2016-0644).
Materialien
| Name | Company | Catalog Number | Comments |
| (Gnmt−/−)/ (Gnmt+/+) mice | CIC bioGUNE | ||
| 0.5% Trypsin-EDTA | Life Technologies | 15400-054 | |
| BEBM | Lonza/Clonetics Corporation | cc-3171 | |
| BEGM Bullet Kit | Lonza/Clonetics Corporation | CC3170 | |
| Bromophenol blue | Sigma | 115-39-9 | |
| BSA | Sigma | A4503 | |
| C18 microcolumns | Millipore | Z720070 | |
| Collagen type I | Santa Cruz Biotechnology | sc-136157 | |
| Complete tablets EDTA-free | Roche | 4693132001 | |
| DMEM | Life Technologies | A14431-01 | |
| DTT | Sigma | 43815 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | e9644 | |
| FBS | Life Technologies | 10270 | |
| Fibronectin | Life Technologies | 33010018 | |
| Glutamine | Life Technologies | 25030-024 | |
| Glutathione agarose beads | Sigma | G4510 | |
| Glycerol | Sigma | G5516 | |
| GST-Control | SignalChem | G52-30H | |
| GST-SUBEs | SignalChem | S291-340G | |
| Huh7 | CLS (Cell Lines Service) | 300156 | https://clsgmbh.de/ |
| IAA (2-Iodoacetamide) | Merck | L58046844 | |
| LKB1 antibody | Santa Cruz Biotechnology | sc-32245 | |
| Mini LabRoller Rotator | LABNET | H5500 | https://www.labnetinternational.com |
| NaCl | Merck | 106404041000 | |
| nanoElute | BRUKER | https://www.bruker.com/ | |
| NEM (N-Ethylmaleimide) | Sigma | E3876 | |
| NP40 | Fluka | 74385 | |
| PBS | Life Technologies | 14190-094 | |
| Peaks software | Bioinformatics Solutions Inc. | http://www.bioinfor.com/ | |
| Phosphoetanolamine | Sigma | P0503 | |
| Ponceau S solution | Sigma | P7170 | |
| PR-619 | Merck | 662141 | |
| Precellys 24 | Bertin Technologies | P000669-PR240-A | |
| PSA | Life Technologies | 151-40-122 | |
| PSG | Life Technologies | 10378-016 | |
| SDS | Sigma | L3771 | |
| SUMO2/3 antibody | Abcam | Ab3742 | |
| THLE-2 | ATCC | ATCC CRL-2706 | http://www.lgcstandards-atcc.org |
| timsTOF Pro with PASEF mass spectrometer | BRUKER | https://www.bruker.com/ | |
| β-mercaptoethanol | Sigma | 60-24-2 |
Referenzen
- Forner, A., Llovet, J. M., Bruix, J. Hepatocellular carcinoma. Lancet. 379 (9822), 1245-1255 (2012).
- Gerbes, A., et al. Gut roundtable meeting paper: selected recent advances in hepatocellular carcinoma. Gut. , (2017).
- Avila, M. A., Berasain, C., Sangro, B., Prieto, J. New therapies for hepatocellular carcinoma. Oncogene. 25 (27), 3866-3884 (2006).
- Grotenbreg, G., Ploegh, H. Chemical biology: dressed-up proteins. Nature. 446 (7139), 993-995 (2007).
- Hendriks, I. A., Vertegaal, A. C. A comprehensive compilation of SUMO proteomics. Nature Reviews in Molecular Cell Biology. 17 (9), 581-595 (2016).
- Seeler, J. S., Dejean, A. SUMO and the robustness of cancer. Nature Reviews Cancer. 17 (3), 184-197 (2017).
- Tomasi, M. L., et al. S-adenosyl methionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in murine liver and human cancers. Hepatology. 56 (3), 982-993 (2012).
- Li, J., et al. Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity. Cancer Cell. 25 (1), 118-131 (2014).
- Zubiete-Franco, I., et al. SUMOylation regulates LKB1 localization and its oncogenic activity in liver cancer. EBioMedicine. 40, 406-421 (2019).
- Sarge, K. D., Park-Sarge, O. K. SUMO and its role in human diseases. Internationa Review of Cell and Molecular Biology. 288, 167-183 (2011).
- Da Silva-Ferrada, E., Lopitz-Otsoa, F., Lang, V., Rodriguez, M. S., Matthiesen, R. Strategies to Identify Recognition Signals and Targets of SUMOylation. Biochemical Research International. , 875148 (2012).
- Liang, Y. C., et al. SUMO5, a Novel Poly-SUMO Isoform, Regulates PML Nuclear Bodies. Science Reports. 6, 26509 (2016).
- Mikolajczyk, J., et al. Small ubiquitin-related modifier (SUMO)-specific proteases: profiling the specificities and activities of human SENPs. Journal of Biologucal Chemistry. 282 (36), 26217-26224 (2007).
- Hilgarth, R. S., Sarge, K. D. Detection of sumoylated proteins. Methods in Molecular Biology. 301, 329-338 (2005).
- Vertegaal, A. C., et al. A proteomic study of SUMO-2 target proteins. Journal of Biological Chemistry. 279 (32), 33791-33798 (2004).
- Bruderer, R., et al. Purification and identification of endogenous polySUMO conjugates. EMBO Reports. 12 (2), 142-148 (2011).
- Becker, J., et al. Detecting endogenous SUMO targets in mammalian cells and tissues. Nature Structural Molecular Biology. 20 (4), 525-531 (2013).
- Barysch, S. V., Dittner, C., Flotho, A., Becker, J., Melchior, F. Identification and analysis of endogenous SUMO1 and SUMO2/3 targets in mammalian cells and tissues using monoclonal antibodies. Nature Protocols. 9 (4), 896-909 (2014).
- Hendriks, I. A., et al. Site-specific characterization of endogenous SUMOylation across species and organs. Nature Communications. 9 (1), 2456 (2018).
- Da Silva-Ferrada, E., et al. Analysis of SUMOylated proteins using SUMO-traps. Science Reports. 3, 1690 (2013).
- Hjerpe, R., et al. Efficient protection and isolation of ubiquitylated proteins using tandem ubiquitin-binding entities. EMBO Reports. 10 (11), 1250-1258 (2009).
- Embade, N., et al. Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation. Hepatology. 55 (4), 1237-1248 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Meier, F., et al. Online Parallel Accumulation-Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer. Molecular and Cellular Proteomics. 17 (12), 2534-2545 (2018).
- Ritho, J., Arold, S. T., Yeh, E. T. A Critical SUMO1 Modification of LKB1 Regulates AMPK Activity during Energy Stress. Cell Reports. 12 (5), 734-742 (2015).
- Lang, V., Da Silva-Ferrada, E., Barrio, R., Sutherland, J. D., Rodriguez, M. S. Using Biotinylated SUMO-Traps to Analyze SUMOylated Proteins. Methods in Molecular Biology. 1475, 109-121 (2016).
- Xolalpa, W., Rodriguez, M. S., England, P. Real-Time Surface Plasmon Resonance (SPR) for the Analysis of Interactions Between SUMO Traps and Mono- or PolySUMO Moieties. Methods in Molecular Biology. 1475, 99-107 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten