Method Article
SumO-Binding Entities (SUBEs) comme outils pour l'enrichissement, l'isolement, l'identification et la caractérisation du protéome SUMO dans le cancer du foie
Dans cet article
Résumé
Ici, nous présentons un protocole pour enrichir, isoler, identifier, et caractériser des protéines modifiées par SUMO in vivo à la fois à partir de cellules humaines d'hépatome et de tumeurs hépatiques obtenues à partir de modèles murins du carcinome hépatocellulaire en utilisant des entités reliures SUMO (SUBEs).
Résumé
La modification post-traductionnelle est un mécanisme clé régulant l'homéostasie et la fonction de protéine dans les cellules eucaryotes. Parmi toutes les protéines de type ubiquitine dans le cancer du foie, la modification par SUMO (Small Ubiquitin MOdifier) a reçu le plus d'attention. L'isolement des protéines endogènes SUMOylated in vivo est difficile en raison de la présence de protéases actives spécifiques au SUMO. Les premières études de SUMOylation in vivo ont été basées sur la détection moléculaire de protéines SUMOylated spécifiques (par exemple, par tache occidentale). Cependant, dans beaucoup de cas, les anticorps, généralement faits avec la protéine recombinante non modifiée, n'ont pas immunoprécipitate des formes SUMOylated de la protéine d'intérêt. La chromatographie nickelée a été l'autre approche pour étudier sumOylation en capturant des versions histidine-étiquetées des molécules de SUMO. Cette approche est principalement utilisée dans les cellules exprimant de façon stable ou transfectée avec des molécules His-SUMO. Pour surmonter ces limitations, des entités reliures sumoïdes (SUBEs) ont été développées pour isoler les protéines sumOylated endogènes. Ici, nous décrivons toutes les étapes requises pour l'enrichissement, l'isolement, et l'identification des substrats SUMOylated des cellules humaines d'hépatome et des tissus hépatiques d'un modèle de souris de cancer du foie en utilisant DES. Tout d'abord, nous décrivons les méthodes impliquées dans la préparation et la lyse des cellules humaines d'hépatome et des échantillons de tissu de tumeur de foie. Ensuite, une explication approfondie de la préparation des SUBEs et des contrôles est détaillée avec le protocole pour les essais de traction des protéines. Enfin, quelques exemples sont fournis concernant les options disponibles pour l'identification et la caractérisation du protéome SUMOylated, à savoir l'utilisation de l'analyse western-blot pour la détection d'un substrat SPÉCIFIQUE SUMOylated à partir de tumeurs hépatiques ou l'utilisation de la protéomique par spectrométrie de masse pour la caractérisation à haut débit du protéome SUMOylated et de l'interagiome dans les cellules d'hépatome.
Introduction
Le cancer du foie est le sixième cancer le plus fréquent dans le monde et la deuxième cause de décès liés au cancer1. Le carcinome hépatocellulaire (HCC) est la forme la plus répandue de cancer primitif du foie. Historiquement, les facteurs de risque courants pour le développement de HCC ont inclus l'infection chronique d'hépatite B ou C et la consommation abusive d'alcool. Au cours des dernières décennies, le syndrome métabolique, le diabète de type 2 stéatose hépatique non alcoolique (NAFLD) est apparu comme des facteurs de risque pour le développement de HCC2. HCC est très hétérogène, à la fois phénotypique et génétiquement, dans lequel un réseau complexe de voies de signalisation sont perturbés. Au cours des dernières années, même s'il y a eu une augmentation de nos connaissances sur les voies moléculaires impliquées dans la pathogénie de HCC, il n'existe toujours pas d'approches thérapeutiques efficaces pour la prise en charge de la HCC. Beaucoup de voies sont activées dans HCC et l'inhibition d'un conduit généralement la compensation par d'autres voies3. Cela a été l'une des principales difficultés lors du traitement de HCC. Ainsi, une approche plus globale peut fournir une approche thérapeutique potentielle pour la gestion clinique du cancer du foie, par exemple, en ciblant les modifications post-traductionnelles (PTM), car les voies de signalisation multiples peuvent être simultanément régulées par les PTM des protéines.
Les modifications post-traductionnelles sont considérées comme des mécanismes clés régulant l'homéostasie et les fonctions des protéines4. Des changements structurels et fonctionnels sont introduits par les PTM, ce qui augmente la diversité des protéomes. Les PTM les plus courants comprennent la phosphorylation, la méthylation, l'acétylation, la glycosylation, l'ubiquitination et la conjugaison de protéines semblables à l'ubiquitine (UbLs). Parmi tous les UbL, la modification des protéines par SUMO (Small Ubiquitin MOdifier) a attiré l'attention en association avec son rôle critique dans une variété de processus cellulaires, y compris la transcription, la localisation cellulaire, la réparation de l'ADN, et la progression du cycle cellulaire 5. Récemment, sumOylation a été montré pour être modifié dans le cancer du foie6,7,8,9, et les changements dans la SUMOylation des protéines spécifiques a été décrit pour jouer un rôle dans la progression de maladies liées au cancer9.
Chez les mammifères, il y a cinq paralogues SUMO, SUMO-1 à SUMO-5. À ce jour, aucune preuve expérimentale n'est disponible sur l'existence de SUMO-4 endogène et de réactions endogènes de conjugaison SUMO-5 au niveau protéique10,11,12. SUMOylation chez les mammifères est réalisée par une cascade enzymatique de thiol-ester impliquant trois enzymes, l'enzyme d'activation sumO hététique (SAE1/SAE2) ou E1, l'enzyme conjugaison SUMO (Ubc9) ou E2 et un SUMO-E3-ligase spécifique pour chaque protéine cible. L'action de plusieurs familles de SUMO E3 semble être en équilibre dynamique avec des protéases spécifiques au SUMO (SUSP ou SENP)13 rendant la réaction sumOOylation très réversible. De plus, seule une petite fraction de la protéine SUMOylated par rapport à la protéine totale non SUMOylated est présente. Par conséquent, isoler les protéines endogènes SUMOylated in vivo est plutôt difficile13.
SUMOylation in vivo a été initialement étudié par western blot en utilisant des anticorps contre la protéine d'intérêt14. L'immunoprécipitation de la protéine a été exécutée avec des anticorps spécifiques et puis la tache de PAGE-western a été effectuée avec des anticorps anti-SUMO. Le principal problème avec cette stratégie est que les anticorps générés contre une protéine recombinante non modifiée ne sont pas toujours en mesure d'immunoprécipiter la forme SUMOylated d'une protéine. Alternativement, la chromatographie de nickel après l'expression transitoire des versions marquées d'histidine (His6) des molécules de SUMO et de la protéine d'intérêt a été employée pour étudier sumOOylation dans les cellules. Sur cette base, il sera plus commode de détecter des formes SUMO-modifiées à partir de cellules exprimant de façon stable His6-SUMO15. Pour les études in vivo, l'enrichissement à base de motifs à interaction tandem-SUMO (SIM) a été démontré pour la purification des conjugués polySUMO16. D'autres groupes ont utilisé des approches SUMO d'anticorps étiquetés épitodes fournissant un outil faisable pour étudier la SUMOylation endogène dans les cellules primaires, les tissus et les organes17,18. Et plus récemment, Nielsen et ses collègues ont utilisé l'enrichissement à base d'anticorps pour identifier sumO endogène et spécifique au site dans les cellules et les tissus19.
Afin de fournir des informations complémentaires sur le rôle de sumOylation in vivo, des entités reliures SUMO (SUBEs), également connues sous le nom de pièges SUMO, ont été développées20. Il est pertinent de voir les entités liant l'ubiquitine en tandem (TUBE) être considérées comme les précurseurs conceptuels des SUBEs et sont des outils disponibles dans le commerce pour la détection et l'isolement des protéines polyubiquitylated21. Les SUBEs sont des protéines recombinantes qui comprennent des répétitions en tandem de CARTES, reconnaissant ainsi les molécules SUMO sur des protéines modifiées avec une augmentation de l'affinité globale pour les substrats SUMO. SumO-pièges ont été conçus en introduisant un E3 ubiquitine-protéine ligase RNF4-dérivé de MOTIFS SIM2 et SIM3 en tandem, dans un vecteur contenant du glutathion S-transferase (GST), une protéine porteuse hétérologue20. Bien que les SUBEs ne puissent pas être utilisés correctement pour identifier les protéines cibles mono-SUMOylated, cette méthode fournit un outil pour faciliter la purification et l'identification des protéines cibles poly-SUMO in vivo. Ici, nous décrivons l'application des SUBEs pour isoler les protéines SUMOylated dans les cellules humaines d'hépatome et dans les biopsies de foie de souris, un outil important pour l'étude du cancer du foie. Un schéma global du protocole décrit dans ce manuscrit est présenté à la figure 1.
Protocole
Toutes les expériences ont été approuvées par les comités institutionnels de CIC bioGUNE pour le soin et la manipulation des animaux. Tous les efforts ont été faits pour minimiser la souffrance animale et réduire le nombre d'animaux utilisés. La glycine mâle de3 mois N -méthyltransferase (Gnmt) déficiente (Gnmt- /) et ses compagnons sauvages de type de litière (Gnmt- /) ont été utilisés.
1. Préparation cellulaire et Lysis
REMARQUE : Ici, Huh-7 (ligne humaine de cellules d'hépatome) et THLE2 (ligne hépatique humaine de cellules) ont été employés.
- Maintenir les cellules dans les plaques P100 dans les milieux de croissance standard à 37 oC dans une atmosphère humidifiée de 5 % d'humidité co2-95 %.
- Cultiver des cellules dans des plaques P100 placage à une densité de 1,2 à 1,5 à 106 cellules par plat en comptant les cellules à l'aide d'une chambre de comptage d'hémocytométrie Neubauer.
- Culture Huh-7 dans DMEM complété avec 10% de sérum bovin foetal (FBS), 1% pénicilline-streptomycine-amphotericin B (PSA) et 1% glutamine.
- Culture THLE2 cellules dans les plats de culture pré-enduit avec 0,01 mg/mL de fibronectine, 0,01 mg/mL d'albumine bovine (BSA) et 0,03 mg/mL de collagène de type I dissous dans le milieu de croissance qui se compose de la croissance épithéliale bronchique de croissance des cellules basiques (BEGM) complétée par facteurs de croissance (0,4 % BPE, 0,1 % d'insuline, 0,1 % d'hydrocortisone, 0,1 % d'acide rétinoïque, 0,1 % de transicanin, 0,1 % de triiodothyronine ainsi que 10 % de FBS, 1 % de PSA, 5 ng/mL de facteur de croissance épidermique (EGF) et 70 ng/mL de phosphosphoamine.
- À la fin de l'expérience, aspirez le support des plaques et lavez les cellules avec 5 ml de salin stérile 1x phosphate-tamponné (PBS). Lyse les cellules directement sur la plaque placée sur la glace à l'aide de 500 l de tampon de lyse (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1% nonidet P-40 (NP40), complétée par un cocktail complet d'inhibiteur de la protéase sans EDTA et 50 M PR-619 pour chaque plat P100. À l'aide d'un grattoir cellulaire, gratter délicatement les cellules du fond de la plaque dans le milieu de Lysis.
REMARQUE : Vérifiez que toutes les cellules se sont détachées de la plaque en inspectant visuellement la base de la plaque après le traitement. - Alternativement, récolter les cellules par trypsinisation par l'aspiration des médias cellulaires et ajouter 1 ml de 1x (0,05%) trypsine-EDTA à la plaque, assez pour couvrir les cellules et placer la plaque dans l'incubateur fixé à 37 oC, 5% CO2, et 95% d'humidité pour 5 min assurant que toutes les cellules se sont détachées de la plaque. Ajouter 2 ml de milieu de croissance pré-chauffé afin d'arrêter la trypsinisation. Centrifugeuse à 150 g pendant 10 min et aspirelelelelement du supernatant. Laver avec 1x PBS et centrifugeuse à 150 x g pendant 10 min. Après avoir aspirant le supernatant, ajouter 500 l de tampon de lyse (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1% NP40, complété par un cocktail complet d'inhibiteur de la protéase sans EDTA et 50 M PR-619 pour chaque plat P100.
REMARQUE : L'ajout du PR-619 est essentiel. - Centrifugeuse à 15 500 x g et 4 oC pendant 10 min. Transférer le supernatant dans un autre tube et jeter la pastille.
REMARQUE : Le protocole peut être mis en pause ici, et les échantillons stockés à -80 oC jusqu'à une analyse plus approfondie.
2. Préparation des tissus et lyse
- Lors du sacrifice des animaux, recueillir les foies de souris, laver avec du PBS froid, et casser le gel immédiatement dans l'azote liquide. Conserver les échantillons à 80 oC jusqu'à ce qu'il y ait une analyse plus approfondie.
- Homogérisez 75 mg de fragments de foies congelés ou frais dans 1 ml de tampon de lyse glacée (50 mM Tris pH 8,5, 150 mM NaCl, 5 mM EDTA, 1 % NP40, complété par un cocktail complet d'inhibiteur de la protéase sans EDTA et 50 M PR-619). Exécuter l'homogénéisateur à 6500 x tr/min, 2 x 60 s chacun, avec une pause de 30 s (voir Tableau des Matériaux).
- Centrifuger les échantillons dans un microfuge à 15, 500 x g et 4 oC pendant 10 min. Transférer le supernatant dans un autre tube et jeter le granule.
- Alternativement, triturate 75 mg de tissus congelés dans l'azote liquide. Puis récupérer le tissu dans 1 ml de tampon de lyse.
- Centrifuger l'échantillon dans un microfuge à 15, 500 x g et 4 oC pendant 10 min. Transférer le supernatant dans un autre tube et jeter la pastille.
REMARQUE : Le protocole peut être mis en pause ici, et les échantillons stockés à -80 oC jusqu'à une analyse plus approfondie.
3. Lier la TPS-SUBEs ou le contrôle de la TPS aux perles de glutathion-Agarose
REMARQUE : La synthèse des TPS-SUBEs ou du contrôle de la TPS ne relève pas du présent manuscrit et peut être examinée dans la littérature publiée antérieurement20. Par ailleurs, les TPS et les SUBE de contrôle sont disponibles dans le commerce (p. ex., SignalChem).
- Préparation des perles de glutathion
- Ajouter 1 ml d'eau désionisée à 70 mg de perles de glutathion-agarose lyophilisées. Reconstituer les perles pendant la nuit à 4 oC (ou pendant au moins 30 min à température ambiante).
- Laver soigneusement les perles après l'enflure (pour enlever le lactose et l'éthanol qui sont habituellement présents dans les perles d'agarose en poudre lyophilisée). Pour ce faire, d'abord laver avec 10 ml d'eau désionisée ou PBS suivie d'une centrifugation à 300 x g pendant 5 min à température ambiante. Exécutez-le trois fois.
- Après 3 lavages, resuspendre les perles dans 1 ml de PBS pour obtenir une boue de 50% (v/v).
REMARQUE : Ce volume convient à l'analyse de 10 échantillons.
- Pour chaque échantillon, ajouter 100 g de TPS-SUBEs ou de contrôle de la TPS (voir la référence20) à 100 l de la boue de perles de glutathion et 500 L de PBS.
REMARQUE : L'abondance relative des protéines d'intérêt SUMOylated détermine le montant des TPS-SUBEs utilisés pour les retraits. Pour chaque nouveau modèle expérimental, analysez l'état avant l'expérience réelle en buvant le matériel d'entrée, de ligotet et d'écoulement (FT) à l'aide d'anticorps anti-SUMO2/3 ou contre les protéines d'intérêt (Liver Kinase B1 (LKB1). - Incuber tous les TPS-SUBEs ou le contrôle de la TPS avec des perles préparées en 3.2., en tournant lentement dans le rotateur ou le mini rouleau (voir Tableau des matériaux) à 4 oC pendant au moins 2 h (réaction lente et contraignante).
REMARQUE : L'ajout d'un dithiothreitol (TNT) de 1 mM améliore la TPS qui lie les perles de glutathion. - Récupérer les perles d'agarose par centrifugation à 300 x g pendant 5 min à température ambiante. À la fin, a suspendu les perles dans PBS pour obtenir 50% (v/ v) boue.
REMARQUE : Le protocole peut être mis en pause ici, et les échantillons stockés à -80 oC jusqu'à une analyse plus approfondie.
4. La TPS tire vers le bas le temps
- Après l'étape 1.5, 2.3 ou 2.5, prenez 1/10 du volume total (par exemple 50 L) et diluez dans le même volume de tampon d'ébullition 3x (250 mM Tris-HCl pH 6.8, 500 m 'mercaptoethanol, 50% glycérol, 10% SDS, bleu bromophenol). Cette fraction est considérée comme INPUT.
- Ajouter 450 l de lysate clarifié à partir des étapes 1.5, 2.3 ou 2.5 à 100 l de l de l'boue de perles de glutathion. Incuber le lysate avec des perles, en tournant lentement à 4 oC pendant au moins 2 h.
REMARQUE : Alternativement, 100 à 200 g de protéines totales des étapes 1,5, 2,3 ou 2,5 (quantifiées avec l'analyse de Bradford) dans un volume total de 450 L peuvent être utilisés. - Faites tourner les perles dans un microfuge à 300 x g pendant 5 min et collectez le supernatant pour l'analyse. Transférer 1/10 du volume total (p. ex., 50 l) dans un tube séparé et diluer dans un volume égal de tampon d'ébullition de 3 x. Cette fraction est la fraction flow-through (FT).
- Laver le reste de l'échantillon trois fois avec 1 ml de PBS glacé, 0,05 % de tween 20, faire tourner à 4 oC et 300 x g pendant 1 min. Aspiratez soigneusement en veillant à ce qu'il n'y ait pas de reste de liquide. Les perles correspondent à la fraction SUBEs BOUND (SB).
- Élichez l'échantillon avec 15 l de tampon d'ébullition 3x et 15 l de la mémoire tampon de lyse. C'est ce qu'on appelle la fraction BOUND.
5. Identification et caractérisation des cibles SUMO par l'analyse Western Blot
- Effectuer l'analyse de tache occidentale utilisant un anticorps anti-SUMO2/3 ou tout autre anticorps spécifique de choix tel que décrit précédemment22.
6. Identification et caractérisation du Protéome SUMOylated par spectrométrie de masse
REMARQUE : Dans le cas de l'analyse de la spectrométrie de masse (SP), des échantillons ont été traités à l'aide de la méthode de préparation d'échantillons assistés par filtre (FASP) décrite par Wisniewski et coll.23.
- Saler les peptides à l'aide de microcolonnes C18 à pointe de stade et les suspendre de 0,1 % en acide formique (FA) avant l'analyse de la SP.
- Chargez les échantillons sur un système LC-MS (voir Tableau des matériaux)et analysez-les en triple (répliques techniques) (Figure 2b).
- Continuez avec l'identification des protéines et le calcul de l'abondance en utilisant un logiciel associé.
- Pour l'analyse statistique et la génération de cartes thermiques, chargez les données sur la plate-forme Perséus (http://www.perseus.tufts.edu/hopper/). Appliquer un faux test de découverte par permutation (FDR) corrigé pour la comparaison des abondances. Les protéines avec un q lt; 0,05 et un ratio SUBEs/GST supérieurs à 2 ont été considérées comme enrichies24.
REMARQUE : Les protéines identifiées avec au moins deux peptides différents sont considérées en dernière analyse.
Résultats
Identification d'un substrat spécifique sumOylation dans les biopsies de tumeur de foie par l'analyse occidentale de blot
Liver Kinase B1 (LKB1) SUMOylation a été récemment montré pour être un conducteur oncogène important dans le cancer du foie9,25. Souris déficientes en glycine N-méthyltransferase (Gnmt), souvent appelé Gnmt- /, est un modèle qui développe spontanément carcinome hépatocellulaire (HCC), le type le plus commun de cancer primitif du foie. Les SUBEs ont été utilisés pour enrichir et isoler les protéines SUMOylated à la fois chez les souris Gnmt- / avec des souris cancéreuses du foie et ses compagnons de litière de type sauvage (Gnmt-/). Dans la figure 2a, la coloration Ponceau S des trois fractions différentes (entrée, FT et BOUND) obtenues dans l'assay de retrait des SUBEs est incluse. Une tache Ponceau S est utile pour contrôler un effet délétère possible sur le chargement des protéines effacées à évaluer par les taches occidentales. Dans la figure 2b, une analyse occidentale de LKB1 en utilisant des SUBEs pour capturer le LKB1 endogène SUMOylated est montrée. Les niveaux de SUMOylation LKB1 sont augmentés dans les tumeurs hépatiques. Dans le cas de l'analyse de tache occidentale, des charges égales et des protéines transférées ont été observées par ponceau coloration de la fraction d'entrée et n'ont pas été sensiblement modifiés après lavages (flux à travers la fraction). La quantité de protéine capturée avec des SUBEs était sensiblement plus élevée, particulièrement dans les tumeurs. Alternativement, la coloration d'un gel en double avec le bleu Decoomassie peut fournir des informations similaires. Les protéines collantes comme le p53 ou les formes SUMOylated de certaines protéines pourraient se lier à la lutte contre la TPS. Pour enlever l'arrière-plan, utilisez des perles d'agarose de faible densité, effectuez un revêtement avec BSA ou incorporez des lavages supplémentaires. Cependant, cela pourrait affecter des applications telles que la spectrométrie de masse et pourrait entraîner une perte de protéines interagissant à faible affinité.
Caractérisation de l'Interactome SUMO dans les cellules de l'hépatome humain par analyse de spectrométrie de masse
Pour étudier la capacité du sumO-piège à interagir avec les protéines naturellement SUMOylated, Huh-7 (hépatome humain) et non transforméfoie épithélial lignées cellulaires humaines THLE2 ont été utilisés. La première étape consiste à visualiser le matériel total capturé avec les SUBEs et à utiliser la TPS comme un contrôle négatif. À cette fin, nous pouvons utiliser des protocoles conventionnels de coloration des protéines comme le montre la figure 3a. Ensuite, nous avons effectué l'analyse de spectrométrie de masse. En moyenne, 2 268 protéines ont été identifiées dans les échantillons de TPS Huh7 (2339, 2297 et 2168 pour chaque chargement, respectivement), tandis que 2812 protéines ont été identifiées en moyenne dans l'échantillon huh7 DEP (2815, 2817 et 2806). Après la soustraction, 742 protéines ont été enrichies dans les SUBEs. D'autre part, une moyenne de 2 497 protéines ont été identifiées dans les échantillons de TPS THLE2 (2476, 2520 et 2495, respectivement) et 2763 dans les SUBEs (2823, 2783 et 2684). De ce nombre, 577 ont été considérés comme enrichis dans les échantillons de SUBEs. L'analyse des répliques techniques récupère la carte thermique indiquée dans la figure 3b, qui a été calculée à l'aide des paramètres par défaut disponibles (distance eucliden, liaison moyenne et pré-traitée avec des moyens k). La carte thermique représente la distribution des 100 protéines les plus significativement et exclusivement enrichies dans chaque lignée cellulaire.
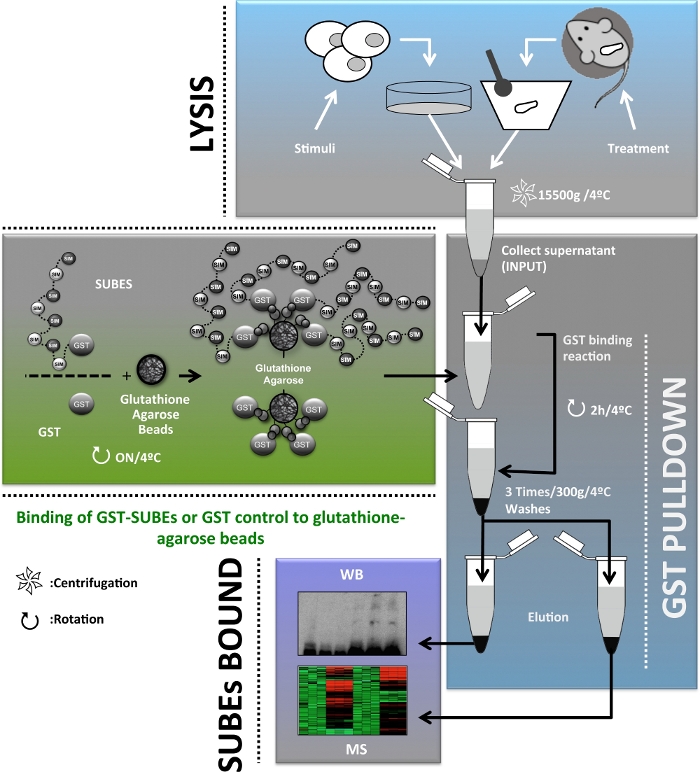
Figure 1 : Diagramme schématique du diagramme de flux de protocole utilisé pour l'enrichissement, l'isolement et l'identification et la caractérisation du protéome SUMOylated in vivo pour l'étude du cancer du foie. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
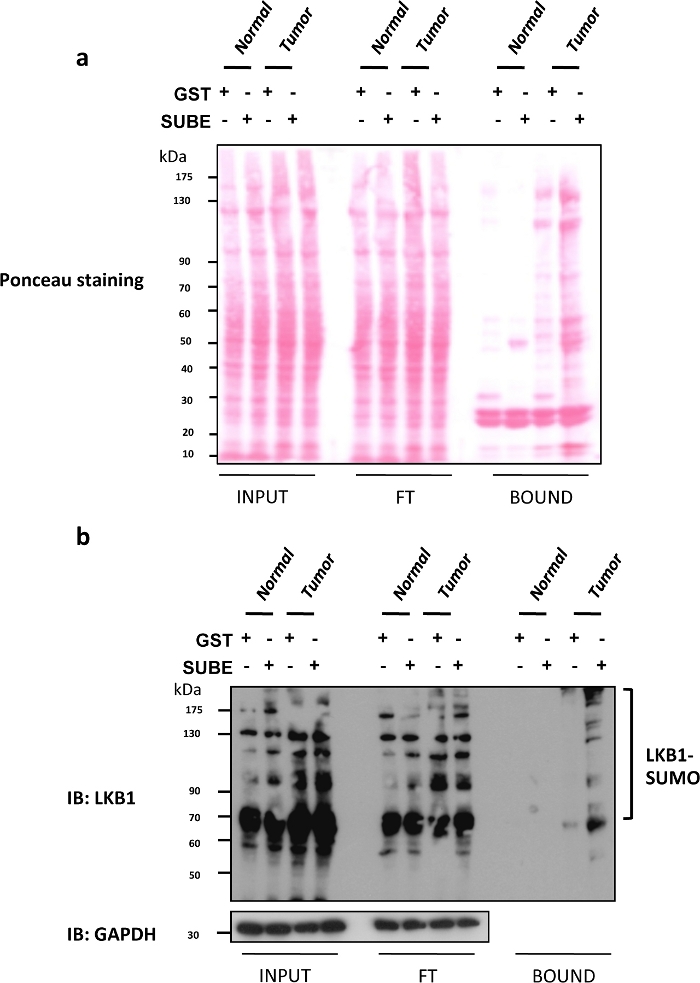
Figure 2 : Modification de LKB1 par SUMO-2 dans les modèles de souris du carcinome hépatocellulaire.
(a) Ponceau S coloration des trois fractions différentes (entrée, Flux à travers (FT) et BOUND) obtenues dans le subEs pull-down. ( b) Analyse de la tache occidentale de LKB1 en utilisant des entités contraignantes SUMO (SUBEs) pour capturer l'endogène SumOylated LKB1; GAPDH est utilisé comme un contrôle de chargement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
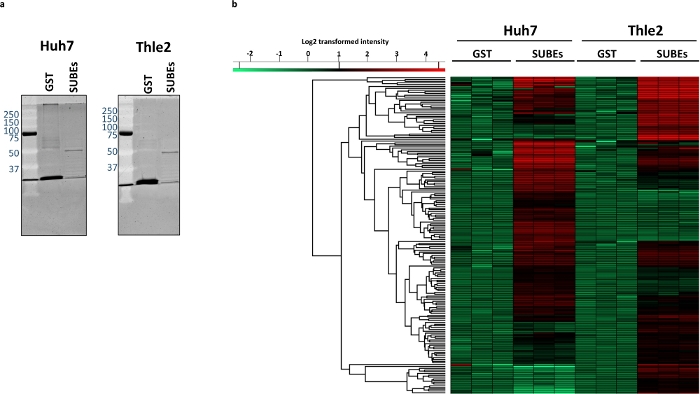
Figure 3 : Différences entre le protéome SUMOylated entre le Huh-7 tumoral et les lignées épithéliales épithéliales non transformées de cellules humaines THLE2.
(a) coloration Sypro de matières protéiques capturées, avec TPS (contrôle négatif) et SUBEs. (c) Heatmap représentant les protéines enrichies différemment dans les échantillons Huh-7 et THLE2 SUBE. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous avons fourni une description complète et détaillée de la méthodologie rapportant l'utilisation des SUBEs pour l'enrichissement, l'isolement et l'identification et la caractérisation des protéines SUMOylated dans les modèles in vivo du cancer du foie. Tant dans les tumeurs du foie de souris et les cellules de l'hépatome humain, nous avons été en mesure d'isoler et d'identifier correctement les protéines SUMOylated d'intérêt et d'effectuer une caractérisation à haut débit du protéome SUMOylated et interactome. Même si la synthèse des SUBEs n'est pas visée par ce manuscrit, pour plus d'informations, les références suivantes doivent être examinées26. Le protocole décrit est rapide et très sensible et l'étape critique du protocole comprend l'utilisation d'inhibiteurs sENP (PR-619). Dans d'autres, les inhibiteurs chimiques de l'isopeptidase tels que NEM ( N-Ethylmaleimide) et IAA (2-Iodoacetamide) dans le tampon de lyse peuvent être utilisés, cependant, des rapports précédents ont montré que pour le protocole SUBEs, l'utilisation de PR-619 est avantageuse comme l'autre inhibiteurs interfèrent avec la TPS liant aux perles de glutathion20.
Les SUBEs sont des protéines recombinantes qui comprennent des répétitions en tandem de CARTES, reconnaissant ainsi les molécules SUMO sur des protéines modifiées avec une augmentation de l'affinité globale pour les substrats SUMO. En raison de sa grande spécificité et sensibilité, l'utilisation de SUBEs pour l'isolement du protéome SUMOylated est avantageuse par rapport à d'autres approches dans la littérature telles que la détection par l'ouest-tache de protéines spécifiques SUMOylated utilisant des anticorps contre la protéine d'intérêt ou la chromatographie de nickel utilisant les différentes versions histidine-étiquetées des molécules de SUMO. Cependant, il faut tenir compte du fait qu'à mesure que le protocole SUBEs est exécuté dans des conditions non dénaturantes, l'interaction entre les protéines SUMOylated et d'autres protéines en interaction est maintenue. Par conséquent, nous obtenons des informations sur l'interactome SUMO plutôt que seulement une liste de protéines cibles SUMOylated. Ainsi, d'autres expériences sont nécessaires pour confirmer si la protéine identifiée est une cible SUMO ou un facteur d'interaction. Une autre limitation des SUBEs est le fait que les pièges à TPS de contrôle utilisés sont en mesure de capturer de nombreuses protéines de fond liées au stress oxydatif. Cette question est particulièrement pertinente lors de l'analyse de la SP en raison de la sensibilité élevée de la technique. Afin de surmonter ces limites, des pièges SUMO biotinylated (bioSUBEs) ont été développés26. Une autre limitation des SUBEs réside dans le fait que nous ne sommes en mesure de capturer que les protéines modifiées par SUMO 2 et SUMO 3 alors que les protéines SUMO 1-modifiées ne peuvent pas être isolées.
Une autre préoccupation concernant l'utilisation des SUBE est liée à la quantité de matériel de départ nécessaire à la procédure. Le matériau de départ utilisé pour capturer les protéines SUMOylated devrait tenir compte des différentes conditions expérimentales explorées. Tandis que la SUMOylation basale a été rapportée dans divers contextes cellulaires, SUMOylation est un processus qui est fortement induit après des conditions multiples d'effort/stimuli. Si l'on compare des échantillons non traités par rapport à des échantillons traités, il faut s'assurer que la colonne n'est pas saturée, et des différences peuvent être observées entre ces conditions. Dans le cas des phénotypes de souris que nous analysons, aucun traitement n'a été utilisé et les niveaux basiques de SUMOylation sont faibles. Pour cette raison, de grandes quantités de protéines ont été utilisées. Le niveau de fond devrait être contrôlé par l'utilisation de la TPS et si la liaison non spécifique est élevée, la quantité de matériel de démarrage ou le temps de liaison devrait être réduite. L'analyse de la fraction FT peut être indicative de l'efficacité de capture même si ces pièges préfèrent les protéines poly-SUMOylated et un appauvrissement total ne devrait pas être prévu, une réduction de sumOylation totale est en général bien observée lorsque l'efficacité de capture est Optimale.
Enfin, d'autres applications de la technologie SUBEs comprend la combinaison de la technologie SUBEs avec la résonance plasmon de surface en temps réel (SPR) permettant les interactions en temps réel avec les protéines SUMOylated à partir d'extraits cellulaires27. De plus, plus récemment, des pièges SUMO biotinylated (bioSUBEs) ont été développés avec l'avantage de réduire l'arrière-plan associé aux étiquettes plus grandes, par exemple, pendant l'analyse de spectrométrie de masse26. En outre, la version bioSUBE peut être utilisée pour détecter les protéines SUMOylated dans les cellules vivantes par fluorescence en utilisant streptavidin-étiqueté avec des colorants fluorescents distincts profitant de la liaison streptavidin à la biotine. En outre, les méthodes de détection et de quantification des protéines SUMOylated peuvent être considérées à la fois avec la TPS et les versions bioSUBEs comme cela a été fait avec les entités liant l'ubiquitine tandem (TUBEs)21.
Dans l'ensemble, l'utilisation des SUBEs pour l'isolement et la caractérisation du protéome SUMOylated pertinent dans le cancer du foie est une méthode rapide et sensible fournissant de vastes informations sur le rôle encore assez inconnu de la voie de SUMOylation dans le cancer du foie.
Déclarations de divulgation
Le Dr Martinez-Chantar conseille pour Mitotherapeutix LLC.
Remerciements
Ces travaux ont été soutenus par des subventions de l'Institut National du Cancer, FRANCE, INCa subvention PLBIO16-251 (PLBIO16-251), CONACyT-SRE (Mexique) subvention 0280365 et le programme REPERE d'Occitanie, France (M.S.R.). En outre, NIH (US Department of Health and Human Services)-R01AR001576-11A1, Gobierno Vasco-Departamento de Salud 2013111114 (à M.L.M.-C), ELKARTEK 2016, Departamento de Industria del Gobierno Vasco, MINECO: SAF2017-87301-R integrado en el Plan Estatal de Investigacion Cientifica y Técnica y Innovacion 2013-2016 cofinanciado con Fondos FEDER, BIOEF (Fondation Basque pour l'innovation et la recherche en santé): EITB Maratoia BIO15/CA/014; Instituto de Salud Carlos III:PIE14/00031, integrado en el Plan Estatal de Investigacion Cientifica y Técnica y Innovacion 2013-2016 cofinanciado con Fondos FEDER (à M.L.M.-C), Asociacion Espaola contra el Câncer (T.C.D, M.L.M-C), Daniel Alagille award de EASL (à T.C.D), Fundacion Cient-fica de la Asociacion Espa'ola Contra el Cancer (AECC Scientific Foundation) Rare Tumor Calls 2017 (à M.L.M), La Caixa Foundation Program (à M.L.M). Nous remercions MINECO pour l'accréditation d'excellence Severo Ochoa à CIC bioGUNE (SEV-2016-0644).
matériels
| Name | Company | Catalog Number | Comments |
| (Gnmt−/−)/ (Gnmt+/+) mice | CIC bioGUNE | ||
| 0.5% Trypsin-EDTA | Life Technologies | 15400-054 | |
| BEBM | Lonza/Clonetics Corporation | cc-3171 | |
| BEGM Bullet Kit | Lonza/Clonetics Corporation | CC3170 | |
| Bromophenol blue | Sigma | 115-39-9 | |
| BSA | Sigma | A4503 | |
| C18 microcolumns | Millipore | Z720070 | |
| Collagen type I | Santa Cruz Biotechnology | sc-136157 | |
| Complete tablets EDTA-free | Roche | 4693132001 | |
| DMEM | Life Technologies | A14431-01 | |
| DTT | Sigma | 43815 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | e9644 | |
| FBS | Life Technologies | 10270 | |
| Fibronectin | Life Technologies | 33010018 | |
| Glutamine | Life Technologies | 25030-024 | |
| Glutathione agarose beads | Sigma | G4510 | |
| Glycerol | Sigma | G5516 | |
| GST-Control | SignalChem | G52-30H | |
| GST-SUBEs | SignalChem | S291-340G | |
| Huh7 | CLS (Cell Lines Service) | 300156 | https://clsgmbh.de/ |
| IAA (2-Iodoacetamide) | Merck | L58046844 | |
| LKB1 antibody | Santa Cruz Biotechnology | sc-32245 | |
| Mini LabRoller Rotator | LABNET | H5500 | https://www.labnetinternational.com |
| NaCl | Merck | 106404041000 | |
| nanoElute | BRUKER | https://www.bruker.com/ | |
| NEM (N-Ethylmaleimide) | Sigma | E3876 | |
| NP40 | Fluka | 74385 | |
| PBS | Life Technologies | 14190-094 | |
| Peaks software | Bioinformatics Solutions Inc. | http://www.bioinfor.com/ | |
| Phosphoetanolamine | Sigma | P0503 | |
| Ponceau S solution | Sigma | P7170 | |
| PR-619 | Merck | 662141 | |
| Precellys 24 | Bertin Technologies | P000669-PR240-A | |
| PSA | Life Technologies | 151-40-122 | |
| PSG | Life Technologies | 10378-016 | |
| SDS | Sigma | L3771 | |
| SUMO2/3 antibody | Abcam | Ab3742 | |
| THLE-2 | ATCC | ATCC CRL-2706 | http://www.lgcstandards-atcc.org |
| timsTOF Pro with PASEF mass spectrometer | BRUKER | https://www.bruker.com/ | |
| β-mercaptoethanol | Sigma | 60-24-2 |
Références
- Forner, A., Llovet, J. M., Bruix, J. Hepatocellular carcinoma. Lancet. 379 (9822), 1245-1255 (2012).
- Gerbes, A., et al. Gut roundtable meeting paper: selected recent advances in hepatocellular carcinoma. Gut. , (2017).
- Avila, M. A., Berasain, C., Sangro, B., Prieto, J. New therapies for hepatocellular carcinoma. Oncogene. 25 (27), 3866-3884 (2006).
- Grotenbreg, G., Ploegh, H. Chemical biology: dressed-up proteins. Nature. 446 (7139), 993-995 (2007).
- Hendriks, I. A., Vertegaal, A. C. A comprehensive compilation of SUMO proteomics. Nature Reviews in Molecular Cell Biology. 17 (9), 581-595 (2016).
- Seeler, J. S., Dejean, A. SUMO and the robustness of cancer. Nature Reviews Cancer. 17 (3), 184-197 (2017).
- Tomasi, M. L., et al. S-adenosyl methionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in murine liver and human cancers. Hepatology. 56 (3), 982-993 (2012).
- Li, J., et al. Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity. Cancer Cell. 25 (1), 118-131 (2014).
- Zubiete-Franco, I., et al. SUMOylation regulates LKB1 localization and its oncogenic activity in liver cancer. EBioMedicine. 40, 406-421 (2019).
- Sarge, K. D., Park-Sarge, O. K. SUMO and its role in human diseases. Internationa Review of Cell and Molecular Biology. 288, 167-183 (2011).
- Da Silva-Ferrada, E., Lopitz-Otsoa, F., Lang, V., Rodriguez, M. S., Matthiesen, R. Strategies to Identify Recognition Signals and Targets of SUMOylation. Biochemical Research International. , 875148 (2012).
- Liang, Y. C., et al. SUMO5, a Novel Poly-SUMO Isoform, Regulates PML Nuclear Bodies. Science Reports. 6, 26509 (2016).
- Mikolajczyk, J., et al. Small ubiquitin-related modifier (SUMO)-specific proteases: profiling the specificities and activities of human SENPs. Journal of Biologucal Chemistry. 282 (36), 26217-26224 (2007).
- Hilgarth, R. S., Sarge, K. D. Detection of sumoylated proteins. Methods in Molecular Biology. 301, 329-338 (2005).
- Vertegaal, A. C., et al. A proteomic study of SUMO-2 target proteins. Journal of Biological Chemistry. 279 (32), 33791-33798 (2004).
- Bruderer, R., et al. Purification and identification of endogenous polySUMO conjugates. EMBO Reports. 12 (2), 142-148 (2011).
- Becker, J., et al. Detecting endogenous SUMO targets in mammalian cells and tissues. Nature Structural Molecular Biology. 20 (4), 525-531 (2013).
- Barysch, S. V., Dittner, C., Flotho, A., Becker, J., Melchior, F. Identification and analysis of endogenous SUMO1 and SUMO2/3 targets in mammalian cells and tissues using monoclonal antibodies. Nature Protocols. 9 (4), 896-909 (2014).
- Hendriks, I. A., et al. Site-specific characterization of endogenous SUMOylation across species and organs. Nature Communications. 9 (1), 2456 (2018).
- Da Silva-Ferrada, E., et al. Analysis of SUMOylated proteins using SUMO-traps. Science Reports. 3, 1690 (2013).
- Hjerpe, R., et al. Efficient protection and isolation of ubiquitylated proteins using tandem ubiquitin-binding entities. EMBO Reports. 10 (11), 1250-1258 (2009).
- Embade, N., et al. Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation. Hepatology. 55 (4), 1237-1248 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Meier, F., et al. Online Parallel Accumulation-Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer. Molecular and Cellular Proteomics. 17 (12), 2534-2545 (2018).
- Ritho, J., Arold, S. T., Yeh, E. T. A Critical SUMO1 Modification of LKB1 Regulates AMPK Activity during Energy Stress. Cell Reports. 12 (5), 734-742 (2015).
- Lang, V., Da Silva-Ferrada, E., Barrio, R., Sutherland, J. D., Rodriguez, M. S. Using Biotinylated SUMO-Traps to Analyze SUMOylated Proteins. Methods in Molecular Biology. 1475, 109-121 (2016).
- Xolalpa, W., Rodriguez, M. S., England, P. Real-Time Surface Plasmon Resonance (SPR) for the Analysis of Interactions Between SUMO Traps and Mono- or PolySUMO Moieties. Methods in Molecular Biology. 1475, 99-107 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon