需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用亚细胞室特异性红氧敏感绿色荧光蛋白评估细胞氧化
摘要
该协议描述了对细胞内亚细胞室特异性氧化还原状态的评估。对氧化还原敏感的荧光探针可在完整细胞中方便地进行比例分析。
摘要
测量细胞内氧化/减少平衡提供了一个有机体的生理和/或病理性红氧状态的概述。硫醇对于通过降低二恶英和氧化二硫化物比来照亮细胞的氧化还原状态尤为重要。工程中含半胱氨酸的荧光蛋白为对氧化还原敏感的生物传感器开启了一个新时代。其中之一,对氧化还原敏感的绿色荧光蛋白(roGFP),可以很容易地引入具有腺病毒转导的细胞中,从而在不中断细胞过程的情况下评估亚细胞室的氧化还原状态。减少的半胱氨酸和氧化的囊肿的roGFP有激发最大值分别在488nm和405nm,发射在525nm。评估这些还原和氧化形式的比率,可以方便地计算细胞内的氧化平衡。在这种方法中,利用不朽的人类三阴性乳腺癌细胞(MDA-MB-231)来评估活细胞内的红氧状态。协议步骤包括MDA-MB-231细胞线转导与腺病毒,以表达细胞状roGFP,治疗与H2O2,并评估半胱氨酸和半胱氨酸比与流动细胞学和荧光显微镜。
引言
1985年,赫尔穆特·西斯将氧化应激定义为"对前者的益氧化剂-抗氧化剂平衡的干扰"1,并进行了大量的研究,,以获得生物1、2、32的疾病、营养和衰老特异性氧化还原状态。13从那时起,对氧化应激的理解变得更加广泛。测试使用抗氧化剂对抗疾病和/或衰老的假设表明,氧化应激不仅造成伤害,而且在细胞中还有其他作用。此外,科学家已经表明,自由基在信号转导2中起着重要的作用。所有这些研究都加强了确定大分子还原氧化(氧化)比变化的重要性。酶活性、抗氧化剂和/或氧化剂以及氧化产物可以通过各种方法进行评估。其中,确定二醇氧化的方法可以说是最常用的方法,因为它们报告了细胞中的抗氧化剂和益氧化剂以及生物体4之间的平衡。具体来说,谷胱甘肽(GSH)/谷胱甘肽二硫化物(GSSG)和/或半胱氨酸(CyS)/半胱氨酸(CySS)之间的比率被用作生物标志物,用于监测生物体的氧化还原状态2。
用于测量益氧化剂和抗氧化剂之间的平衡的方法主要依赖于细胞内还原/氧化蛋白或小分子的水平。西方印迹和质谱法用于广泛评估还原/氧化大分子(蛋白质、脂质等)的比例,GSH/GSSG比率可以通过分光光度测定5来评估。这些方法的一个常见特征是细胞系统通过细胞系统化和/或组织均质化对系统的物理扰动。当需要测量不同细胞室的氧化状态时,这些分析也变得具有挑战性。所有这些扰动都会导致测定环境中的伪影。
对红氧敏感的荧光蛋白开启了一个有利的时代,用于评估氧化还原平衡,而不会在细胞6中引起干扰。它们可以针对不同的细胞内隔间,从而量化隔间特定活动(例如,检测线粒体和细胞溶酶的氧化还原状态),以调查细胞细胞器之间的串扰。黄色荧光蛋白(YFP)、绿色荧光蛋白(GFP)和HyPeR蛋白由Meyer及其同事6日审查。在这些蛋白质中,对氧化还原敏感的GFP(roGFP)是独一无二的,因为它的CyS(例如488nm/em.525nm)和CySS(例如405nm/525nm)的残留物不同,这允许比例分析,不像其他氧化还原敏感蛋白,如YFP77,8。8比例值输出是有价值的,因为它平衡了表达水平、检测敏感性和光漂白8之间的差异。细胞(细胞溶质、线粒体、细胞核)或不同生物体(细菌和哺乳动物细胞)的亚细胞隔间可以通过修改roGFP77、9、109,10来定位。
roGFP检测采用荧光成像技术进行,尤其是用于实时可视化实验。对于具有预定时间点的实验,也可以对roGFPs进行流细胞测量分析。本文描述了使用荧光显微镜和流细胞测定法,通过腺病毒转导对哺乳动物细胞中多表达的roGFP(针对细胞sol)的红氧状态进行比例评估。
Access restricted. Please log in or start a trial to view this content.
研究方案
注:此协议针对 70%-80% 的汇入 MDA-MB-231 单元进行了优化。对于其他细胞系,应重新优化细胞数量和感染数 (MOI)。
1. 细胞的制备(第1天)
- 在75厘米2瓶中保持MDA-MB-231细胞系,在5%CO2加湿的大气中补充10%的胎儿牛血清(FBS), 补充10%的胎儿牛血清(FBS)。
注:DMEM 补充了 10% FBS、37 °C 和 5% CO2加湿气氛,用于整个协议中的所有附件和治疗孵化。 - 准备MDA-MB-231单元进行实验。
- 吸气烧瓶内的介质,将2 mL 0.25%胰蛋白酶-EDTA溶液的细胞分离2分钟,用6 mL的完整介质(10%FBS的DMEM)停用胰蛋白酶活性。将细胞在150 x g下离心5分钟。吸进上清液,将细胞悬浮在5 mL的完整介质中。
- 混合一个相等的体积细胞悬浮液和0.4%锥蓝色。服用这种混合物的10μL,用自动细胞计数器计数细胞。
注:库尔特计数器或血变仪也可用于细胞计数。 - 将细胞种子到6个井板中,进行流细胞测量分析,并在每口1mL的介质中播种150,000个细胞。等待 16 小时进行单元格附件。
- 将细胞放入4个井室幻灯片中,用于荧光成像,并在每口0.5mL的介质中播种25,000个细胞。等待 16 小时进行单元格附件。
注:种子控制井除了处理井。使用其中一个控制孔来确定细胞数(可选:如果细胞的附着周期短于加倍时间,则可以假定细胞数与播种密度相同),另一个用于未受感染的控件 (0 MOI)。
2. 腺病毒roGFP转导(第2天和第3天)
注意:腺病毒可引起疾病。在转导细胞时,使用过滤的尖端和除污尖端、巴斯德移液器和带有10%漂白剂的微离心管。
注:此协议用特定于细胞溶酶的 roGFP 进行了演示,但其他细胞隔间(例如线粒体或线粒体膜间空间)可以采用相同的协议。
- 通过计算MDA-MB-231细胞线每个MOI值所需的腺病毒(mL)体积,为MOI生成剂量响应曲线(表1):
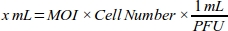
注:每批抗病毒性病毒的功能量位,以每mL表示为斑块成型单元(PFU),由公司提供。转导的最佳MOI因细胞类型而异。对于大多数哺乳动物细胞,最佳MOI范围在10至300之间。根据细胞响应,应重新计算MOI值(例如,如果细胞有细胞毒性反应,则应减小MOI范围,如果细胞转染效率低,则应增加范围)。 - 使用细胞培养基(具有10%FBS的DMEM)使6 x 1010 PFU/mL腺病毒roGFP溶液稀释1:100,实现可靠的移液。
- 移液器,将0.0125 mL(12.5 μL)、0.025 mL(25 μL)、0.05 mL(50 μL)的腺病毒roGFP稀释剂添加到6个孔板的每个孔中,以将150,000个细胞分别与50、100和200 MOI相转,用于流式细胞测定分析(表1)。
- 移液器,在4室滑井中加入0.0042 mL(4.2 μL)腺病毒roGFP稀释剂,以100 MOI转导25,000个细胞,用于荧光成像(表1)。
注:在井中应使用少量的介质,以确保腺病毒roGFP构造和细胞之间的最高相互作用。培养基的血清含量可能需要降低不同的细胞系,因为高水平的血清会对某些细胞类型的转导效率产生负面影响。 - 在细胞维护条件下孵育16~24小时细胞。第二天(第3天),将培养基改为细胞培养基(具有10%FBS的DMEM),使细胞恢复再增加24小时。细胞可以表达roGFP,即使他们有形态变化。
注:在第3天,细胞应开始表达roGFP;因此,可以使用荧光显微镜(带有前488/em.525的过滤器)来监测转染效率。为了获得一致的测定结果,在评估转导效率的同时,了解并记录相位对比显微镜下的形态变化,并观察形态学。 - 使用步骤 2.3 中准备的 50、100 和 200 MOI 样本及其从流式细胞测定分析(步骤 3.1 和 4.1)获得的转导效率结果构建剂量响应曲线。通过记录形态变化(步骤 2.5)和 MOI 的剂量响应曲线,评估最佳转导效率。
注:虽然超过98%的细胞群在100 MOI和200MOI表达roGFP(见代表性的结果),200MOI组显示MDA-MB-231细胞的细胞形态发生实质性变化。因此,MDA-MB-231 细胞最有效的MOI被确定为100 MOI。 - 在选择用于MDA-MB-231细胞系的最佳MOI(此处为100 MOI)后,对测试材料(10μM H2O2及其车辆0.1%去离子水)进行实验。
- 根据第1节准备和播种细胞。使用步骤 2.1 计算的 100 MOI 的脱病毒转导量,重复步骤 2.2_2.4,用于 100 个 MOI 脱病毒转导细胞。然后根据步骤 2.5 孵化板和腔室滑轨。
3. 获取 CyS/CySS 余额
- 流细胞学(第4天)
- 在第 4 天,用 10 μM H2O2从步骤 2.7.1 孵育细胞 1 小时。
注:10μM H2O2用作试验物质,0.1%的去离子水在该协议中用作车辆处理。其他氧化剂可以用作积极的控制在这里。 - 从 6 孔板吸气介质,更换 750 μL 0.25% 胰蛋白酶-EDTA 溶液,等待 2 分钟让细胞分离。使用 2 mL 完整介质(具有 10% FBS 的 DMEM)停用胰蛋白酶,并将体积收集到 15 mL 锥形管中。
- 在 4oC 下,将管子在 150 x g下离心 5 分钟。丢弃上清液,悬浮在500μL的磷酸盐缓冲盐水(PBS) 中。
- 重复步骤 3.1.3
- 使用 40 μm 网格将细胞悬浮液过滤到流式细胞测量兼容管中。保持管在冰上,远离光,并遵循步骤4.1进行数据分析。
- 在第 4 天,用 10 μM H2O2从步骤 2.7.1 孵育细胞 1 小时。
- 显微成像(第4天)
- 第4天,用10μM H2O2治疗细胞,立即获取图像(时间点0)和治疗后1小时,并按照步骤4.2进行数据分析。
4. 数据分析
- 流细胞测量定量
- 通过样品采集软件为3种不同的分析设置流细胞测定方法(参见材料表):x 轴上的正向散射 (FCS) 和 y 轴上的侧散射 (SSC),以评估细胞大小和细胞的复杂性(SSC 可用于对死细胞和活细胞进行粗略识别);例如 488 nm/em。525 nm(氟西辛等质氰酸酯 [FITC]) 带通滤波器在 x 轴和 SSC y 轴上,以评估 CyS-roGFP;例如 405 nm/em。525 nm (亮紫色 510 [BV510]) x 轴上的带通滤波器和 y 轴上的 SSC,用于评估 CySS-roGFP。
- 使用样品采集软件获取 0 MOI 控制和可视化单元。对剩余样本(50、100、200 MOI 组,以及 10 μM H2O2处理的细胞和车辆处理的细胞)重复此步骤。保存文件以进行数据分析。
- 打开数据分析软件(参见材料表)并打开 0 MOI 示例文件。评估感兴趣的细胞群(门1)。设置以下浇注,以尽量减少前 488 nm/em 的背景荧光。525 纳米(门 2)和前 405 nm/em。525 nm (门 3) 带通滤波器与未感染 (0 MOI) 控制细胞。
- 在数据分析软件中打开 50、100 和 200 MOI 样本文件,以评估剂量响应曲线。分析每个样品与 Gates 2 和 3 的平均荧光强度。对测试样本(10 μM H2O2处理的细胞和车辆处理的细胞)重复此步骤。
- 使用以下方程计算氧化与减少形式的roGFP之间的平均荧光强度比。

- 图像评估
- 使用含有CyS-roGFP和CySS-roGFP荧光过滤器的显微镜(例如488nm/em.525nm和ex.405nm/em.525nm过滤器)。
- 在造型室幻灯片的每个井中,选择 4 个随机区域来获取图像,使用 4x 目标来可视化更大的区域。
注:20倍目标也可用于图像显示。 - 使用 ImageJ 软件11打开图像。应用分析|测量每个图像的命令,并使用步骤 4.1.5 中的方程来量化数据。
注:图像的量化是比例的;因此,该协议不包括背景的减法。但是,要比较图像,亮度、对比度和饱和度必须与每个图像相同。通过方差(ANOVA)的单向分析(ANOVA)和图基的后临时测试来评估统计意义。
Access restricted. Please log in or start a trial to view this content.
结果
CyS/CySS 的氧化还原状态可通过转导的 roGFP 轻松测定。荧光探针量化还原和氧化形式之间的比率(激励波长分别为 488 nm 和 405 nm)。荧光数据可以通过流细胞学和显微镜获得。
使用流细胞测定,可以一致、方便地获得大量细胞。分析包括3个主要步骤:1)使用FSC区域滤波器选择感兴趣的细胞群(图1A);2) 用前 488/em 为 roGFP 表达细胞进行门。525 nm 带带通滤?...
Access restricted. Please log in or start a trial to view this content.
讨论
生物体中的硫醇/二硫化物平衡反映了细胞的氧化还原状态。生物有谷胱甘肽、半胱氨酸、蛋白质三醇和低分子量三醇,所有这些都受到氧化水平的影响,并呼应细胞的氧化状态4。工程性 roGfP 允许通过其 CyS 残留物7对硫醇/二硫化物平衡进行无中断定量。roGFP 的比值特性为哺乳动物细胞提供了可靠的氧化还原测量。roGFP可以很容易地引入细胞与转染方法和/或转导...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
在西北大学弗赖伯格医学院和ViraQuest公司的实验室中,分别产生了用于细胞溶质性roGFP的构造和重组腺病毒。这项研究得到了宿主抗癌治疗研究中心的资助,授予P20GM109005,通过NIH国家生物医学研究所生物医学研究中心卓越(COBRE NIGMS),国家普通医学研究所系统药理学和毒理学培训计划赠款T32 GM106999, UAMS 基金会/医学研究捐赠奖 AWD00053956,UAMS 年终校长奖 AWD00053484。流细胞学核心设施部分由微生物发病和宿主炎症反应中心通过COBRE NIGMS授予P20GM103625支持。内容完全由作者负责,不一定代表NIH的官方观点。ATA得到土耳其科学技术研究理事会(TUBITAK)2214-A奖学金的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
参考文献
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。