JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포간 구획-특이적 레독스-에민감한 녹색 형광 단백질을 이용한 세포 산화 평가
요약
이 프로토콜은 셀 내의 세포 전체 구획 별 레독스 상태의 평가를 설명합니다. 레독스에 민감한 형광 프로브는 그대로 있는 세포에서 편리한 비율 측정 분석을 허용합니다.
초록
세포 내 산화/감소 균형을 측정하면 유기체의 생리학적 및/또는 병리학적 레독 상태에 대한 개요를 제공합니다. 티올은 감소된 디티올 과 산화 된 이황화물 비율을 통해 세포의 레독스 상태를 조명하는 데 특히 중요합니다. 엔지니어링 된 시스테인 함유 형광 단백질은 레독스에 민감한 바이오 센서의 새로운 시대를 열어주습니다. 그 중 하나인 레독스에 민감한 녹색 형광 단백질(roGFP)은 아데노바이러스 트랜스듀싱을 통해 세포에 쉽게 도입될 수 있어 세포 과정을 방해하지 않고 세포구획의 레독스 상태를 평가할 수 있습니다. 감소된 시스테인과 roGFP의 산화 된 낭포진은 각각 488 nm와 405 nm에서 흥분 최대가 있으며 525 nm에서 방출됩니다. 이러한 감소 및 산화 형태의 비율을 평가하면 셀 내의 레독스 균형을 편리하게 계산할 수 있습니다. 이 방법 문서에서는, 불멸의 인간 삼중 음성 유방암 세포 (MDA-MB-231)는 살아있는 세포 내의 레독스 상태를 평가하기 위하여 이용되었다. 프로토콜 단계는 세포성 roGFP를 발현하기 위하여 아데노바이러스를 가진 MDA-MB-231 세포주 변환, H2O2를가진 처리 및 유동 세포질 및 형광 현미경 검사법을 가진 시스테인 및 cystine 비율의 평가를 포함합니다.
서문
산화 스트레스는 1985년 헬무트 시에 의해 "이전의 항산화제 균형에 대한교란"1로정의되었으며, 유기체 의 질병, 영양 및 노화 별 레독 스 상태를 얻기 위한 과다한 연구가 수행되었다1,,2,,3. 그 이후로 산화 스트레스에 대한 이해가 더 넓어지고 있습니다. 질병 및/또는 노화에 대한 항산화제를 사용하는 가설을 테스트하는 것은 산화 스트레스가 해를 끼칠 뿐만 아니라 세포에 다른 역할을 한다는 것을 보여주었습니다. 또한, 과학자들은 자유 래디칼이 신호 변환2에중요한 역할을한다는 것을 보여주었습니다. 이러한 모든 연구는 거대 분자의 감소 산화 (redox) 비율의 변화를 결정하는 중요성을 강화합니다. 효소 활성, 항산화제 및/또는 산화물 및 산화 제품은 다양한 방법으로 평가될 수 있습니다. 이들 중, 티올 산화를 결정하는 방법은 틀림없이 세포에 있는 산화방지제와 청록산제 사이 균형에 보고하기 때문에, 유기체4. 구체적으로, 글루타티온(GSH)/글루타티온 디설파이드(GSSG) 및/또는 시스테인(CyS)/시스테인(CySS)의 비율은 유기체2의레독스 상태를 모니터링하기 위한 바이오마커로 사용된다.
프로옥시드와 항산화제 사이의 균형을 말하는 데 사용되는 방법은 주로 세포 내의 감소/산화 단백질 또는 작은 분자 의 수준에 의존합니다. 서양 얼룩 및 질량 분광법은 감소/산화 된 거대 분자 (단백질, 지질 등)의 비율을 광범위하게 평가하는 데 사용되며 GSH / GSSG 비율은 분광성5로평가 될 수 있습니다. 이러한 방법의 일반적인 특징은 세포 리시스 및/또는 조직 균질화에 의한 시스템의 물리적 인 섭류입니다. 이 분석은 또한 다른 셀룰러 구획의 산화 상태를 측정할 필요가 있을 때 도전이 됩니다. 이러한 모든 혼란은 분석 환경에서 아티팩트를 유발합니다.
레독스에 민감한 형광 단백질은 세포 내 의 교란을 일으키지 않고 레독스 균형을 평가하기 위한 유리한 시대를 열었다6. 그(것)들은 셀룰러 세포 기관 사이 상호 토크를 조사하기 위하여 구획 특정 활동 (예를 들면, 미토콘드리아및 cytosol의 redox 상태를 말하는)의 정량화를 허용하는 다른 세포내 구획을 표적으로 할 수 있습니다. 황색 형광 단백질 (YFP), 녹색 형광 단백질 (GFP), 및 HyPeR 단백질은 마이어와 동료6에의해 검토됩니다. 이러한 단백질 중, 레독스 에 민감한 GFP (roGFP)는 CyS (예: 488 nm/ em. 525 nm) 및 CySS (예. 405 nm / 525 nm) 잔류물의 다른 형광 판독으로 인해 독특하며, 이는 다른 홍옥에 민감한 단백질과는 달리 비율 메트릭 분석을7,허용합니다. 비율 측정 출력은 표현 수준, 검출 민감도 및 광표백8사이의 차이에 균형을 맞추기 때문에 유용합니다. 세포의 세포 형 구획 (사이토솔, 미토콘드리아, 핵) 또는 상이한 유기체 (박테리아 및 포유류 세포)는 roGFP7,,9,,10을수정하여 표적으로 할 수 있다.
roGFP 의 소법은 특히 실시간 시각화 실험을 위해 형광 이미징 기술을 사용하여 수행됩니다. roGFP의 흐름 세포 측정 분석은 미리 정해진 시간 점을 가진 실험에도 가능합니다. 현재 문서는 형광 현미경 검사법과 유동 세포측정법의 사용이 모두 설명되어 아데노바이러스 형질 전염을 통해 roGFP (cytosol 표적)를 과발현하는 포유류 세포에서 백강체 상태의 비율 메트릭 평가를 수행합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고: 이 프로토콜은 70%-80% 컨실릭 MDA-MB-231 셀에 최적화되었습니다. 다른 세포주를 위해, 세포의 수 및 감염의 복합성 (MOI)는 재최적화되어야 합니다.
1. 세포 준비 (1 일)
- MDA-MB-231 세포주를 75cm2 플라스크로 유지하여 10mL의 덜벡코의 수정된 이글 배지(DMEM)를 37°C에서 37°C로 보충하여 5%CO2 가습대기 대기시.
참고: DMEM은 10% FBS, 37°C, 및 5%CO2 가습대기로 전체 프로토콜 전반에 걸쳐 모든 부착 및 치료 인큐베이션에 사용됩니다. - 실험을 위해 MDA-MB-231 세포를 준비한다.
- 플라스크 내에서 배지를 흡인시키고, 2분 동안 0.25%의 트립신-EDTA 용액의 2mL로 세포를 분리하고, 6mL의 완전한 매체(10%의 FBS를 가진 DMEM)로 트립신 활성을 비활성화한다. 원심 분리는 5 분 동안 150 x g에서 세포를 흡인하고 완전한 배지의 5 mL에서 세포를 일시 중단합니다.
- 동일한 볼륨 셀 서스펜션과 0.4% 트라이팬 블루를 혼합합니다. 이 혼합물의 10 μL을 가지고 자동화 된 세포 카운터로 세포를 계산합니다.
참고: 쿨터 카운터 또는 혈전계도 세포 계수에 사용할 수 있습니다. - 혈류 세포 분석 및 1mL의 중간 1mL에서 150,000개의 세포를 잘 파종하기 위해 세포를 6웰 플레이트로 시드한다. 셀 부착을 위해 16h를 기다립니다.
- 세포를 형광 이미징을 위한 4웰 챔버 슬라이드로 시드하고 우물당 0.5mL의 배지25,000세포를 시드한다. 셀 부착을 위해 16h를 기다립니다.
참고 : 치료 우물 뿐만 아니라 종자 제어 우물. 대조군 우물 중 하나를 사용하여 세포 수를 결정합니다(선택 사항: 세포에 대한 부착 기간이 두 배시간보다 짧은 경우, 세포 수는 파종 밀도와 동일하다고 가정할 수 있고, 다른 하나는 비감염 대조군(0 MOI)을 위해 한다.
2. 아데노바이러스 로GFP 전관 (2일차, 3일)
주의: 아데노바이러스는 질병을 일으킬 수 있습니다. 세포를 변환하는 동안 여과 된 팁을 사용하고 팁, 파스퇴르 파이펫 및 10 % 표백제로 미세 원심 분리 튜브를 제거하십시오.
참고: 이 프로토콜은 사이토솔 특이적 roGFP로 입증되었지만 다른 셀룰러 구획(예: 미토콘드리아 또는 미토콘드리아 막 간 공간)은 이 동일한 프로토콜을 대상으로 할 수 있습니다.
- MDA-MB-231 세포주(표 1)에 대해 각 MOI 값에 필요한 아데노바이러스(mL)의 부피를 계산하여 가장 높은 트랜스듀션 효율을 얻기 위해 MOI에 대한 용량 반응 곡선을 생성한다(표 1):
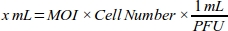
참고: mL당 플라크 성형 장치(PFU)로 표현되는 아데노바이러스 주식의 각 배치의 기능적 티터가 당사에서 제공한다. 트랜스포션을 위한 최적의 MOI는 세포 유형마다 다릅니다. 대부분의 포유류 세포의 경우 최적의 MOI 범위는 10에서 300 사이입니다. 세포 반응에 따르면, MOI 값을 다시 계산해야 한다(예를 들어, 세포가 세포 독성 반응을 갖는 경우 MOI 범위를 줄여야 하며, 세포가 트랜스포션 효율이 낮으면 범위가 증가해야 한다). - 신뢰할 수 있는 파이펫팅을 위해 세포 배양 배지(10% FBS를 가진 DMEM)를 갖춘 6 x10 10 PFU/mL 아데노바이러스 로GFP 용액의 1:100 희석을 확인하십시오.
- 파이펫 및 0.0125 mL(12.5 μL), 0.025 mL(25 μL), 아데노바이러스 로GFP 희석의 0.05 mL(50 μL)를 6웰 플레이트의 각 웰에 추가하여 각각 50, 100, 200 및 20사이클로Table 1구성된 150,000개의 세포를 변환합니다.
- 파이펫및 4챔버 슬라이드 웰에 아데노바이러스 로GFP 희석의 0.0042mL(4.2 μL)를 추가하여 형광 이미징을 위한 100MOI를 가진 25,000개의 세포를 트랜스듀합니다(표1).
참고: 아데노바이러스 로GFP 구조와 셀 간의 가장 높은 상호 작용을 보장하기 위해 우물에서 최소한의 배지를 사용해야 합니다. 혈청의 높은 수준이 일부 세포 유형의 트랜스포션 효율에 부정적인 영향을 미칠 수 있기 때문에 배양 배지의 혈청 함량은 상이한 세포주에 대해 감소될 필요가 있다. - 세포 유지 보수 조건 하에서 16-24 h에 대한 세포를 배양합니다. 다음날(3일)은 배지를 세포 배양 배지(10%FBS를 가진 DMEM)로 변경하여 24시간 동안 세포 회복을 허용합니다. 세포는 형태학적 변화가 있더라도 roGFP를 표현할 수 있습니다.
참고: 3일째에 세포는 roGFP를 발현하기 시작해야 합니다. 따라서 형광 현미경 검사법(전 488/em. 525의 필터)을 사용하여 트랜스듀션 효율을 모니터링할 수 있습니다. 일관된 분석 결과를 얻으려면, 위상 대조 현미경하에서 형태학적 변화를 인식하고 문서화하고 트랜스듀션 효율을 평가하면서 형태학을 관찰한다. - 2.3단계에서 제조된 50, 100 및 200 의 MOI 샘플을 사용하여 용량 반응 곡선을 구성하고 유동 세포 측정 분석(단계 3.1 및 4.1)에서 얻은 이들의 트랜스듀션 효율 결과를 생성한다. 형태학적 변화(단계 2.5)와 MOI의 용량 반응 곡선을 문서화하여 최적의 트랜스듀션 효율을 평가합니다.
참고: 100MOI및 200MOI 익스프레스 roGFP에서 세포 집단의 98% 이상이 (대표 결과 참조)였지만(대표 결과 참조), 200MOI 그룹은 MDA-MB-231 세포의 세포 형태에 상당한 변화를 보였다. 따라서 MDA-MB-231 세포에 대한 가장 효과적인 MOI는 100MOI로 결정되었다. - 최적의 MOI(여기, 100 MOI)가 MDA-MB-231 세포주로 선택된 후, 시험재료(10μMH2O2 및 차량 0.1% 탈온화 수)로 실험을 수행하였다.
- 제1항에 따라 세포를 준비하고 시드합니다. 단계 2.1에서 계산된 100 MOI에 대한 아데노바이러스 전도 부피를 사용하여, 세포의 100MOI 아데노바이러스 전도에 대해 2.2-2.4를 반복한다. 그런 다음 2.5 단계에 따라 플레이트와 챔버 슬라이드를 배양합니다.
3. CyS/CySS 잔액 획득
- 유동 세포측정(4일차)
- 4일째에, 10 μM H2O2로 2.7.1 단계에서 세포를 1h로 배양한다.
참고: 10 μMH2O2는 시험물질로 사용되었고 0.1%의 탈온화수를 이 프로토콜에서 차량 처리로 사용하였다. 다른 산화 제는 여기에서 양수 대조군으로 사용될 수 있다. - 6 웰 플레이트에서 흡인 매체, 0.25 % 트립신 -EDTA 용액의 750 μL로 교체하고 세포가 분리 될 때까지 2 분 기다립니다. 완전한 매체(10% FBS가 있는 DMEM)의 2mL로 트립신을 비활성화하고 15mL 원추형 튜브로 볼륨을 수집합니다.
- 4ºC에서 5 분 동안 150 x g의 튜브원심분리기. 상신을 버리고 인산염 완충식염(PBS)의 500μL에서 세포를 일시 중단한다.
- 반복 단계 3.1.3
- 40 μm 메쉬를 사용하여 세포 현탁액을 유동 세포 측정 호환 튜브로 필터링합니다. 튜브를 얼음 에 보관하고 빛에서 멀리 떨어져 데이터 분석을 위한 단계 4.1을 따르십시오.
- 4일째에, 10 μM H2O2로 2.7.1 단계에서 세포를 1h로 배양한다.
- 현미경 이미징 (4일차)
- 4일째, 10 μM H2 O2로세포를 치료하고, 즉시 이미지를 습득(시점 0) 및 치료 후 1h를 획득하고 데이터 분석을 위한 4.2단계를 따릅니다.2
4. 데이터 분석
- 유동 세포측정정량
- 샘플 획득 소프트웨어를 통한 3가지 분석(재료 표참조): x축 및 측면 분산(SSC)에 대한 전방 분산(FCS)을 사용하여 세포의 세포 크기와 복잡성을 평가하는 흐름 세포 측정 방법을 설정합니다(SSC는 죽은 및 살아있는 세포의 대략적인 식별에 사용될 수 있음); 전 488 nm / em. 525 nm (형광이소 [FITC]) X 축및 SSC에 밴드 패스 필터를 y 축에 평가하기 위해 CyS-roGFP; 전 405 nm / em. 525 nm (브릴리언트 바이올렛 510 [BV510]) CySS-roGFP를 평가하기 위해 y 축에 x 축 및 SSC에 밴드 패스 필터.
- 0개의 MOI 제어를 획득하고 샘플 수집 소프트웨어로 셀을 시각화합니다. 남은 샘플(50, 100, 200 MOI 그룹 및 10 μM H2O2 처리된 세포 및 차량 처리 셀)에 대해 이 단계를 반복하십시오. 데이터 분석을 위해 파일을 저장합니다.
- 데이터 분석 소프트웨어 열기(재료 표참조) 및 0 MOI 샘플 파일 열기. 관심있는 세포 집단을 평가합니다 (게이트 1). 488 nm/em에 대한 배경 형광을 최소화하기 위해 다음 게이팅을 설정합니다. 525 nm (게이트 2) 및 전 405 nm / em. 525 nm (게이트 3) 비감염 (0 MOI) 제어 셀과 밴드 패스 필터.
- 데이터 분석 소프트웨어 내에서 50, 100 및 200 개의 MOI 샘플 파일을 열어 용량 응답 곡선을 평가합니다. 각 샘플에 대해 게이츠 2 및 3을 사용하여 평균 형광 강도를 분석합니다. 시험 샘플(10 μM H2 O2처리된 세포 및 차량 처리 셀)에 대해 이 단계를 반복하십시오.2
- 다음 방정식을 사용하여 산화된 형태와 감소된 형태의 roGFP 사이의 평균 형광 강도 비율을 계산합니다.

- 이미지 평가
- CyS-roGFP 및 CySS-roGFP용 형광 필터를 포함하는 현미경을 사용하십시오(예: 488 nm/em. 525 nm 및 전 405nm/em. 525 nm 필터).
- 챔버 슬라이드의 각 웰에서 4개의 무작위 영역을 선택하여 4배 의 목표를 사용하여 더 큰 영역을 시각화합니다.
참고: 20배 의 목표는 이미지 디스플레이에도 사용할 수 있습니다. - ImageJ소프트웨어(11)로이미지를 엽니다. 분석 적용 | 각 이미지에 대한 명령을 측정하고 4.1.5 단계에서 방정식을 사용하여 데이터를 정량화합니다.
참고: 이미지의 정량화는 비율메트릭입니다. 따라서 프로토콜에는 배경의 뺄셈이 포함되지 않습니다. 그러나 이미지, 밝기, 대비 및 채도를 비교할 수 있으려면 각 이미지마다 동일해야 합니다. 통계적 유의성은 차이(ANOVA) 및 투키의 포스트 호크 테스트에 대한 단방향 분석으로 평가되었다.
Access restricted. Please log in or start a trial to view this content.
결과
CyS/CySS의 레독스 상태는 변환된 roGFP로 쉽게 분석됩니다. 형광 프로브는 감소된 형태와 산화 형태 사이의 비율을 정량화한다(각성 파장 488nm 및 405 nm, 각각). 형광 데이터는 유동 세포측정및 현미경 검사법 모두에 의해 얻어질 수 있다.
많은 수의 세포가 유동 세포측정을 사용하여 일관되고 편리하게 습득할 수 있습니다. 분석은 3개의 주요 단계로 이루어져 있습니다: 1) FSC 영역 ...
Access restricted. Please log in or start a trial to view this content.
토론
유기체의 티올/이황화물 균형은 세포의 레독스 상태를 반영한다. 살아있는 유기체는 글루타티온, 시스테인, 단백질 티올 및 저분자-중량 티올을 가지고 있으며, 모두 산화 수준에 의해 영향을 받고 세포4의레독스 상태를 에코한다. 엔지니어링 된 roGFP는 CyS 잔류물7을통해 티올 / 이황화물 균형의 파괴적 정량화를 허용합니다. roGFP의 비율 메트릭 특성은 포유류 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
세포에서 사이토솔 특이적 roGFP를 표현하기 위한 구성 및 재조합 아데노바이러스는 각각 폴 T. 슈매커, 박사, 프레이버그 의과 대학, 노스웨스턴 대학 및 ViraQuest Inc.의 실험실에서 생성되었다. 이 연구는 NIH 국립 생물 의학 연구 우수성 센터 (COBRE NIGMS), 국립 일반 의료 시스템 약리학 및 독성학 교육 프로그램 보조금 T32 GM106999를 통해, 암 치료 보조금 P20GM109005에 호스트 반응의 연구 센터에 의해 지원되었다, UAMS 재단/의료 연구 인다우먼트 어워드 AWD00053956, UAMS 연말 총리 상 AWD00053484. 유동 세포측정 핵심 시설은 COBRE NIGMS를 통해 P20GM103625를 부여하는 미생물 병리학 및 호스트 염증 반응 센터에 의해 부분적으로 지원되었다. 콘텐츠는 전적으로 저자의 책임이며 반드시 NIH의 공식 견해를 나타내는 것은 아닙니다. ATA는 터키 과학 기술 연구 위원회 (TUBITAK) 2214-A 장학금에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
참고문헌
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유