Method Article
实时测量核苷酸与完整功能性膜蛋白的结合
摘要
该协议提出了一种在细胞环境中实时测量腺嘌呤核苷酸与受体结合的方法。结合测量为三硝基苯基核苷酸衍生物与用非规范荧光氨基酸标记的蛋白质之间的Förster共振能量转移(FRET)。
摘要
我们已经开发出一种方法来测量腺嘌呤核苷酸与细胞或膜环境中完整的功能性跨膜受体的结合。该方法结合了用荧光非规范氨基酸ANAP标记的蛋白质的表达,以及ANAP和荧光(三硝基苯基)核苷酸衍生物之间的FRET表达。我们提出了核苷酸与ANAP标记的KATP 离子通道结合的示例,这些离子通道在无顶质膜和电压钳下切除的由内而外的膜贴片中测量。后者允许同时测量配体结合和通道电流,直接读取蛋白质功能。广泛讨论了数据处理和分析,以及潜在的陷阱和伪影。该方法为KATP 通道的配体依赖性门控提供了丰富的机制见解,并且可以很容易地适应其他核苷酸调节蛋白或任何可以识别合适荧光配体的受体的研究。
引言
几类重要的蛋白质直接受配体结合的调节。这些范围从可溶性酶到膜包埋蛋白,包括受体酪氨酸激酶、G 蛋白偶联受体 (GPCR) 和离子通道。GPCR和通道分别占目前所有药物靶点的~34%和~15%,分别为1,2。因此,在开发提供配体 - 受体相互作用的机制见解的方法方面存在相当大的生物化学和医学兴趣。测量配体结合的传统方法,包括光亲和标记和放射性配体结合研究,需要大量的部分纯化的蛋白质,并且通常在非生理条件和时间尺度下进行。理想的方法只需要少量蛋白质,可以在细胞或膜环境中表达的完整蛋白质上进行,可以实时监测,并且与蛋白质功能的直接读数兼容。
福斯特共振能量转移(FRET)是一种检测两个荧光标记分子之间接近度的方法3。当激发的供体荧光团以非辐射方式将能量转移到受体分子(通常是另一个荧光团)时,就会发生FRET过程。能量转移导致供体荧光发射的猝灭和受体发射的敏化(如果受体是荧光团)。转移效率取决于供体和受体之间距离的6次 方。此外,供体和受体必须靠近(通常小于10nm)才能发生FRET发生。因此,FRET可用于测量荧光标记的蛋白质受体和荧光配体之间的直接结合。
几种不同的蛋白质通过结合细胞内或细胞外腺嘌呤核苷酸(ATP,ADP,AMP,cAMP)来调节或激活。许多转运蛋白在其反应周期中需要ATP水解,包括ATP结合盒转运蛋白和P型ATP酶,如Na + / K +泵4,5。ATP 敏感 K+ (KATP) 通道、囊性纤维化跨膜传导调节因子 (CFTR) 和环核苷酸调节通道都是通过细胞内腺嘌呤核苷酸结合设门的离子通道,使它们对细胞代谢和信号转导的变化非常敏感6,7,8.嘌呤能P2X和P2Y受体对细胞外ATP的变化作出反应,ATP可以作为神经递质或组织损伤的结果释放9。我们开发了一种基于FRET的测定方法,用于实时测量腺嘌呤核苷酸与膜蛋白的结合。我们之前已应用该方法研究核苷酸与KATP通道10,11的结合。
为了通过FRET测量核苷酸结合,必须首先用荧光团标记感兴趣的蛋白质。荧光标签必须特异性地插入目标蛋白质的位点,使其足够接近配体结合位点以使FRET发生,特别注意确保标签不会影响蛋白质的整体结构和功能。为了实现这一目标,我们采用了Chatterjee等人开发的一种技术,使用琥珀色终止密码子抑制来插入荧光非规范氨基酸(l-3-(6-乙酰基萘-2-基氨基)-2-氨基丙酸;ANAP)在所需站点12。我们测量ANAP标记的蛋白质和荧光三硝基苯基(TNP)核苷酸衍生物之间的核苷酸结合(图1A)。ANAP的发射光谱与TNP核苷酸的吸光度光谱重叠,这是FRET发生的必要条件(图1B)。在这里,我们概述了两种不同类型的结合实验。首先,在通过超声处理脱盖的细胞中测量与ANAP标记的KATP通道的细胞内侧的核苷酸结合,在玻璃盖玻片10,11,13,14上留下贴壁的质膜片段。
在第二种方法中,在电压钳下的膜贴片中测量与ANAP标记的KATP 通道的核苷酸结合,从而可以同时测量离子电流和荧光。通过结合这两种实验方法,结合的变化可以直接与通道功能的变化相关11。讨论了典型结果、潜在陷阱和数据分析。
研究方案
1. 准备盖玻片
注意:这些步骤必须在无菌组织培养罩中进行。给出了准备10道菜的数量。
- 将十个高压灭菌的 30 mm 硼硅酸盐盖玻片分别放入 10 个 35 mm 未经处理的无菌培养皿中,并用 2 mL 无菌蒸馏水冲洗一次。
- 将 1 mL 的 0.1% w/v 聚-L-赖氨酸溶液稀释到无菌蒸馏水中至总体积为 10 mL(终浓度为 0.01% w/v)。充分混合,然后将 1 mL 移液到每个盖玻片上,并在室温下孵育 20 分钟。
- 吸出聚-L-赖氨酸,并用至少 2 mL 无菌蒸馏水洗涤每个盖玻片两次。静置至完全干燥,即至少3小时。
2. 接种HEK-293T细胞
注意:这些步骤必须在组织培养罩中进行。选择HEK-293T细胞是因为其低电流背景和易于培养。该方案可以适用于其他细胞类型。
- 用 12 mL 磷酸盐缓冲盐水 (PBS) 冲洗 HEK-293T 细胞的 80-90% 汇合 T75 烧瓶一次,然后与 2 mL 胰蛋白酶孵育 2-5 分钟,或直到细胞完全分离并几乎完全解离。
- 通过添加补充有 10% 胎牛血清、100 U/mL 青霉素和 100 μg/mL 链霉素的 10 mL Dulbecco 改良鹰培养基 (DMEM) 重悬细胞。轻轻移液烧瓶底部以分解剩余的细胞团块。
- 将 2 mL 补充的 DMEM 添加到所需数量的 35 mm 培养皿中,其中包含涂层盖玻片。向每个培养皿中加入 100 μL 重悬细胞。在37°C孵育过夜。
3. 转染
注意:这些步骤必须在组织培养罩中进行。给出10个培养皿转染的数量。对于位点特异性ANAP掺入,必须将用于标记的位置的DNA密码子替换为琥珀色(TAG)终止密码子。该构建体与两种质粒共转染:pANAP和peRF1-E55D12,15。pANAP编码ANAP特异性tRNA / tRNA合成酶对的多个拷贝。在存在ANAP的情况下,该质粒的转染产生带有ANAP的tRNA,可识别琥珀色终止密码子。peRF1-E55D编码一种主要的负核糖体释放因子,可增加全长ANAP标记蛋白的产量。
- 准备含有 10 μg pANAP、10 μg peRF1-E55D 和 DNA 的 1.5 mL 管,用于用 ANAP 标记的构建体。使用未补充的 DMEM 使最终体积达到 500 μL。
- 在单独的试管中,为每 1 μg DNA 制备 3 μL 脂质转染试剂(参见 材料表),并使用未补充的 DMEM 使最终体积达到 500 μL。
- 将DNA和转染试剂混合物合并在单个管中,并在室温下孵育20分钟。
- 将 400 μL 的 1 mM ANAP 原液(30 mM NaOH 中的三氟乙酸盐)加入 20 mL 补充的 DMEM 中,最终浓度为 20 μM ANAP。用每皿 2 mL 含 ANAP 的培养基替换接种细胞中的旧培养基。
- 将10%的DNA转染混合物移液到每个培养皿上。实验前在33°C孵育2-4天。在33°C孵育可减缓细胞分裂并提高每个细胞的蛋白质产量16。
4. 无顶膜实验
- 使用一对镊子将带有转染细胞的盖玻片破碎成更小的片段。
- 按照以下步骤之一打开单元格的屋顶。
- 如果使用预包被的盖玻片,请用PBS冲洗碎片,然后将其放在含有2 mL PBS的35 mm培养皿的底部。使用位于样品上方3-5 mm的探针超声仪(50 W,20%-40%振幅,3 mm探针)进行短暂超声处理,以揭开细胞顶部并留下贴壁质膜碎片(图2A,C)。
注意:超声仪功率、持续时间和样品上方的探头高度都可以改变,以获得高产量的无盖膜,而不会完全剥落盖玻片。 - 如果不使用预包被的盖玻片,用PBS冲洗盖玻片片段,然后浸入含有0.1%w / v聚-L-赖氨酸的管中~30秒,然后短暂超声处理(如步骤4.2.1)以揭开细胞并留下无顶/部分无顶的质膜片段(图2A,C,D)。已证明短暂暴露于聚-L-赖氨酸可提高对盖玻片的依从性13。
- 如果使用预包被的盖玻片,请用PBS冲洗碎片,然后将其放在含有2 mL PBS的35 mm培养皿的底部。使用位于样品上方3-5 mm的探针超声仪(50 W,20%-40%振幅,3 mm探针)进行短暂超声处理,以揭开细胞顶部并留下贴壁质膜碎片(图2A,C)。
- 将超声处理的片段放入装有 2 mL 浴液的盖玻底 35 mm 培养皿中,并安装在配备高数值孔径 60 倍水浸物镜的倒置显微镜上。显微镜的相机端口与高灵敏度CCD相机串联到光谱仪。使用蠕动泵用缓冲液灌注浴室 (0.5 – 1 mL/min)。缓冲液的组成将根据所研究的蛋白质而变化。
注意:如果用户无法接触到工作距离较长的物镜,则由于盖玻片的额外高度,可能无法聚焦在无顶膜碎片上。另一种方法是将细胞直接接种到带有聚-L-赖氨酸玻璃底的培养皿上(例如,请参见 材料表 )。这也将减少与通过两块玻璃聚焦相关的图像中的潜在像差。这些像差不会影响所获得的光谱的形状。 - 通过寻找通道荧光来鉴定表达ANAP标记通道的无顶膜片段(图2C,D)。
注意:建议使用额外的荧光标记(其中发射光谱可与ANAP发射光谱区分开来)以帮助识别含有目标蛋白质的无顶膜。图2 C,D中的实验在带有C端荧光蛋白标签的ANAP标记通道上进行。 - 在显微镜上的相机端口和光谱仪之间部分接合光谱仪掩模(升高~10%)。蒙版的阴影将出现在相机图像上。通过调整显微镜载物台,将无顶膜与光谱仪掩模对齐。获取无顶膜的明场和荧光图像。这些将用于选择感兴趣区域进行分析。
- 使微量灌注系统的尖端靠近无顶膜。
注意:为了减少背景荧光,灌注系统的流出被替换为由硼硅酸盐玻璃制成的定制吸头。 - 要对荧光光谱进行成像,请用 385 nm LED 通过 390/18 nm 带通激发滤光片和 416 nm 边缘二向色性激发膜。通过 400 nm 长通发射滤光片收集发射光(图 2B)。
- 接合光谱仪掩模并确保发射的光通过。接合光谱仪光栅(300 凹槽/毫米)。光栅就位后,光谱仪衍射的光将被投射到CCD相机的芯片上,以产生光谱图像(图3A)。这些影像保留 y 维空间信息。 x 维度替换为波长。
- 可选地,如果目标蛋白质被荧光蛋白标记,则使用适当的滤光片组获取荧光蛋白的光谱图像。
- 在实验开始时进行一次或多次0.1-10 s曝光,同时灌注无核苷酸缓冲溶液。这些将用于在实验的其余部分更正和规范化数据(请参阅下面的第 5 节)。
注意:曝光时间的选择将取决于达到的表达水平、荧光团的亮度和光学元件。应选择曝光时间以最大化信号并最小化观察到的漂白率。4.10中给出的曝光时间范围适用于平衡结合测量,但可用于测量较慢的动力学变化10。使用短曝光时间来跟踪更快动力学的能力将受到蛋白质表达水平和光漂白的限制,而不是硬件。 - 应用一系列浓度的TNP-ATP(通常在浴溶液中制备)以建立浓度 - 响应曲线。灌注每种溶液至少1分钟以确保达到稳定状态,并用浴溶液冲洗出每种浓度至少1分钟。
注意:重要的是要确保灌注系统能够快速达到平衡(图2E)并达到正确的TNP-ATP局部浓度(图2F)。 - 在每个浓度和每次冲洗结束时进行曝光(持续时间与步骤4.10中使用的持续时间相同)。
5. 光谱分析
注意:编写这些说明是为了与分析代码"pcf.m"一起使用,可以在 GitHub 上找到。https://github.com/mpuljung/spectra-analysis 10.可以在 https://github.com/smusher/KATP_paper_201911中找到其他和替代代码。我们在这里描述了软件执行的操作,以便用户可以创建自己的代码或选择手动分析数据。
- 通过在命令行中键入程序的名称("pcf")来启动分析程序。
- 当打开的文件/文件夹对话框打开并提示:"为ROI选择文件"时,选择与无屋顶膜的明场和荧光图像相关的文件名。命令行中将出现一个提示符,以键入输出文件的名称。
- 键入文件名并按回车键。
- 当软件显示明场和荧光图像时,按照软件提示在光谱图像中选择与无顶膜碎片或切除贴片的位置相对应的感兴趣区域(ROI)(参见第6节)。在同一光谱图像中选择一个背景区域(代表与ROI中的波长范围相同的波长范围),对应于未连接膜的盖玻片或培养皿的一部分(图3A)。该软件将提示单击 ROI 的顶部并按 Enter,单击 ROI 的底部并按 Enter ,然后对背景区域重复此过程。
- 当打开的文件/文件夹对话框并出现提示:"选择FP光谱文件"时,选择与荧光蛋白(FP)光谱关联的文件名(可选步骤4.9)。如果未采集 FP 频谱,请选择其他频谱文件。FP光谱用作质量控制,以区分标记的蛋白质和背景荧光。
- 当打开的文件/文件夹对话框并出现提示:"选择要分析的文件"时,选择与ANAP光谱对应的所有文件(从步骤4.10到4.12),包括漂白校正所需的文件。
- 当打开的文件/文件夹对话框并出现提示:"选择要漂白收集的文件"时,选择步骤5.6中的文件子集,对应于实验开始时在无核苷酸溶液中获得的初始光谱或在无核苷酸溶液中洗涤期间获得的光谱用于校正(从步骤4.10到4.12)。
- 对每个图像进行线平均以产生光谱,即在每个波长下平均ROI或背景区域的 y 维上所有像素的强度。(图3B)。从从ROI获得的平均光谱中减去所得的平均背景光谱,以去除背景荧光和未结合TNP-ATP的荧光(图3C)。这些步骤由软件自动执行。
- 通过平均以减去光谱的ANAP峰为中心的5 nm窗口的强度来确定每次曝光的ANAP强度(通常为~470 nm,但可能因ANAP残基的局部微环境而异)。
注意: 图3D 显示了表达ANAP标记通道的无顶膜片段连续10秒曝光获得的6个光谱。插图显示了每个光谱峰值的平均强度。该软件将自动找到采集的第一个光谱中的峰值波长,并始终使用该值。强度将由软件自动计算。 - 通过将给定暴露的 ANAP 强度 (F) 除以时间序列中第一次暴露的 ANAP 强度(在步骤 4.10 (Fmax) 中获取),标准化每个实验的 ANAP 强度。同样,软件会自动执行这些计算。
- 执行以下步骤以获取数据。
- 为了校正ANAP光漂白,首先将单个指数衰减(F / Fmax)= A * exp(-t / τ)+(1-A),其中t是累积曝光时间,τ是时间常数,A是振幅)拟合到TNP-ATP应用之间的中间洗涤步骤或在TNP-ATP上洗涤之前进行的多次初始曝光(图3D, 插图)。
注:软件将显示此适合度,并提示接受或拒绝它。如果拟合被拒绝,将提供另一个机会来选择文件进行漂白校正。 - 将归一化(在步骤5.10中)ANAP谱除以每个时间点的步骤5.11.1的指数拟合的预测值(图3E)。
注意:对于所示示例,在50 s处观察到的归一化峰值荧光为0.65,指数拟合的预测荧光为0.64。要校正漂白,请将观测值(0.65,图3E插图,空圆圈)除以预测值(0.64,图3E插图,虚线)以产生校正值(~1,图3E插图,彩色圆圈)。如果漂白校正足够,则在没有核苷酸的情况下获得的所有暴露的ANAP强度应大致相等(图3E)。这些计算由软件自动执行。 - 获取输出作为绘制数据的图像和选项卡式电子表格,其中包含原始光谱、减去光谱、光漂白校正光谱以及每个文件的峰值数据,以便进行进一步分析。
- 为了校正ANAP光漂白,首先将单个指数衰减(F / Fmax)= A * exp(-t / τ)+(1-A),其中t是累积曝光时间,τ是时间常数,A是振幅)拟合到TNP-ATP应用之间的中间洗涤步骤或在TNP-ATP上洗涤之前进行的多次初始曝光(图3D, 插图)。
6. 膜片钳荧光测定实验
- 当填充移液器溶液时,将贴片移液器从厚壁硼硅酸盐玻璃毛细管中拉出至1.5 MΩ至2.5 MΩ的电阻。移液器溶液的组成将根据所研究的蛋白质而变化。
- 将带有转染细胞的盖玻片转移到含有2 mL浴液的盖玻底35 mm培养皿上,并安装到配备高NA,60倍水浸物镜的倒置显微镜上。使用蠕动泵将浴室(0.5 – 1 mL/min)与浴液灌注。至于移液器溶液,浴液将根据所研究的蛋白质而有所不同。
- 通过在细胞膜上寻找荧光来识别表达ANAP标记通道的细胞。
- 用移液器溶液填充贴片移液器。对移液器施加温和的正压并放入浴室中。将移液器压在细胞膜上并轻轻抽吸以实现GΩ密封(图4A)。
- 通过快速将移液器支架移离细胞来切除贴片(图4A)。
注意:以这种方式切除贴片应形成由内而外的贴片,蛋白质的胞质结构域暴露于灌注系统。如果正在研究的核苷酸结合位点的位置不是胞质的,则需要使用由外而外的贴片或全细胞记录来进行PCF实验。 - 将贴片移液器的尖端靠近灌注系统的尖端,并检查贴片是否在光谱仪面罩的狭缝内(图4A)。
- 如步骤4.10-4.12所示应用TNP-ATP和图像光谱,同时记录离子电流对核苷酸应用的响应。
注意:移液器玻璃可能会在采集的图像中引入空间像差和反射。然而,这些像差不会影响所获取光谱的形状,并且使用光谱仪或长通发射滤光片很容易将反射的激发光与荧光分离。 - 分析光谱。由于从贴片移液器的玻璃中排除了TNP-ATP,从切除的贴片成像的光谱可能会表现出未结合的TNP-ATP荧光的过度减法(图4C-E)。这种过减不会影响ANAP发射光谱,因此可以忽略不计。
注意:由于切除斑块中的荧光信号将低于无盖膜中的荧光信号,因此使用曝光时间非常重要,该曝光时间可提供足够高的信噪比,而不会太快漂白ANAP的信号噪声。
结果
图2描述了测量通过超声处理获得的无顶膜片段中核苷酸与荧光蛋白结合的基本实验设置(图2A,B)。使用两种不同的方法来获得无屋顶的膜,直接在聚-L-赖氨酸涂层的盖玻片上培养细胞或在未经处理的玻璃上培养细胞,并在揭开盖子之前将它们短暂暴露于聚-L-赖氨酸(0.1%的水溶液)。图2C描述了来自HEK-293T细胞的典型无顶膜片段,该细胞表达用橙色荧光蛋白(OFP)标记的KATP通道。无顶膜在明场图像中几乎不可见,并通过标记膜蛋白的荧光或通过用十八烷基罗丹明B13等膜染料复染来识别。除了无顶膜外,HEK-293T细胞的超声处理还产生部分无顶细胞片段(图2D)10,17。这些碎片在明场中可见。这可能是褶皱质膜的结果,这些质膜仅对盖玻片的粘附性差。或者,这些片段可能含有来自细胞内细胞器的囊泡和膜。因此,最好仅从"真正的"无顶膜中获取图像,因为与细胞内膜相关的标记靶蛋白可能反映翻译后处理和组装的中间阶段。建议在聚-L-赖氨酸涂层玻璃上培养细胞,因为这会导致超声处理时"真正的"无顶膜的产量更高。
将微量灌注系统应用于荧光核苷酸,以最大限度地减少典型实验中所需的量(图2B)。在我们的灌注设置中,提供的聚酰亚胺涂层玻璃尖端被手拉式硼硅酸盐玻璃尖端取代,从而降低了荧光背景。为了尽量减少被成像的无顶膜周围的核苷酸积累,整个浴室被缓冲液缓慢灌注。因此,我们希望测量我们的微量灌注系统的溶液变化率,并验证我们能够在感兴趣的区域中达到预期的配体浓度,即来自我们的灌注系统的配体在到达无顶膜之前没有直接稀释到沐浴介质中。为了控制这些可能性,测量了来自我们的微量灌注系统的50μM四甲基罗丹明-5-马来酰亚胺(TMRM)溶液的冲洗和冲洗,该溶液直接指向注入水的盖玻底培养皿的表面(图2E)。溶液交换动力学是可重现的,并且通过单个指数衰减很好地描述了冲洗和冲洗的时间常数小于1 s。这样的溶液交换时间限制了我们在当前设置中测量配体结合和解结合动力学的能力。为了验证我们能够在盖玻片表面达到所需的配体浓度,我们将通过我们的微量灌注系统输送到盖玻片的 50 μM TMRM 的荧光强度与静止浴中的 50 μM TMRM 进行了比较(图 2F)。没有观察到强度的差异,验证了使用我们的微量灌注系统可以在盖玻片表面达到适当的配体浓度,即使浴液被灌注。
图3A 显示了从暴露于5μM TNP-ATP-ATP的HEK-239T细胞的无顶膜中的ANAP标记的KATP 通道获得的光谱图像。为了获得这样的图像,来自无屋顶膜的发射光通过与CCD相机串联的光谱仪。发射的荧光从光栅上衍射并投射到相机芯片上,产生光谱。生成的图像保留 了 y 维的空间信息,但 x 维被替换为波长。与无顶膜相对应的感兴趣区域(ROI)以橙色勾勒。图像中有两个高强度区域,对应于ANAP和TNP-ATP的峰值发射。 这在图3B所示的逐波长平均(整个ROI)光谱中得到了最好的理解。峰~470 nm对应于掺入KATP的ANAP;峰值~535 nm对应于TNP-ATP。为了校正溶液中TNP-ATP的背景荧光和直接激发,从每个图像中选择一个背景区域(图3A,灰色)。平均背景光谱如图 3B所示。通过从平均ROI光谱中减去平均背景光谱来获得最终光谱(图3C)。
ANAP容易出现光漂白伪影。 图3D 显示了多次曝光后ANAP峰值荧光的降低。在没有TNP-ATP(或TNP-ATP浓度之间的洗涤)下多次曝光的峰值荧光拟合为单指数衰减,这用于校正光漂白伪影(图3E)。建议从低到高和高到低的核苷酸浓度进行浓度反应实验。如果漂白校正没有引入任何额外的伪影,则结果应具有可比性11。
图5A 显示了在不存在和存在TNP-ATP的情况下,从表达ANAP标记的KATP 通道的细胞获得的无顶膜的代表性光谱图像。校正后的光谱如图 5B所示。观察发射光谱,供体和受体荧光发射之间存在明显的分离。由于观察到TNP-ATP与来自未转染的HEK-293T细胞的幼稚质膜的一些非特异性结合,建议将FRET量化为供体(ANAP)荧光的减少10,11。该峰对标记的受体具有特异性。
对于诱导其受体构象变化的配体,孤立的结合研究不能提供有关配体结合过程的直接的、机械上有意义的信息18。配体结合的浓度-反应关系不仅取决于内在结合亲和力,还取决于配体结合诱导的构象变化,以及受体在没有配体的情况下改变构象的内在倾向。为了更好地了解强调配体-受体相互作用的过程,结合测量可以与提供蛋白质功能读数的实验配对。为此,离子通道是一个理想的模型系统,因为它们的电流可以使用电压钳以亚毫秒级的时间分辨率测量到单分子水平。从历史上看,配对电流和荧光测量为电压和配体门控离子通道的打开和关闭(门控)提供了重要的见解19,20,21。已经进行了实验以同时测量离子电流和荧光环核苷酸与各种环核苷酸调节通道的结合22,23,24。这些研究采用了一种配体,该配体在结合时增加了其量子产率。通过使用共聚焦显微镜22,23对贴片进行成像,可以减去贴片附近溶液体积中未结合配体的荧光。在我们的研究中,使用减少ANAP荧光来测量结合。由于该信号特定于通道,并且ANAP和TNP-ATP之间的FRET具有很强的距离依赖性(~43 Å时为半最大值),因此避免了非特异性结合和未结合的核苷酸污染我们的信号。
图4A 显示了一个典型的膜片钳荧光(PCF)实验。在充满盐水的硼硅酸盐玻璃移液管(连接到电压钳位放大器)和表达ANAP标记的KATP的细胞之间形成高电阻(GΩ)密封。密封形成后,移液器从细胞中拉开,允许进入细胞内核苷酸结合位点。然后将移液器定位在显微镜物镜上,以光谱仪面罩的狭缝为中心,并将微量灌注系统(用硼硅酸盐玻璃尖端修饰)的流出靠近移液器(图4D)。控制电压,并从贴片中的通道测量电流。来自ANAP标记的KATP 通道的代表性电流和频谱如图 4B所示,颜色编码以将频谱与电流相匹配。对无顶膜的背景和漂白进行了校正的发射光谱。
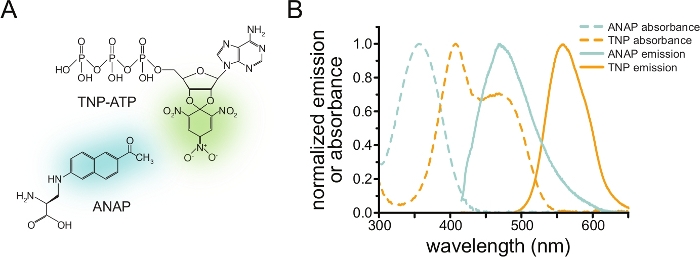
图 1:ANAP 和 TNP-ATP 组成合适的 FRET 对。 (a) ANAP和TNP-ATP的结构。荧光部分突出显示。(B)ANAP和TNP-ATP的吸光度和荧光发射光谱。FRET需要ANAP发射和TNP-ATP吸光度之间的重叠。改编自Puljung et al.(根据知识共享署名许可出版,https://creativecommons.org/licenses/by/4.0/)10。 请点击此处查看此图的大图。
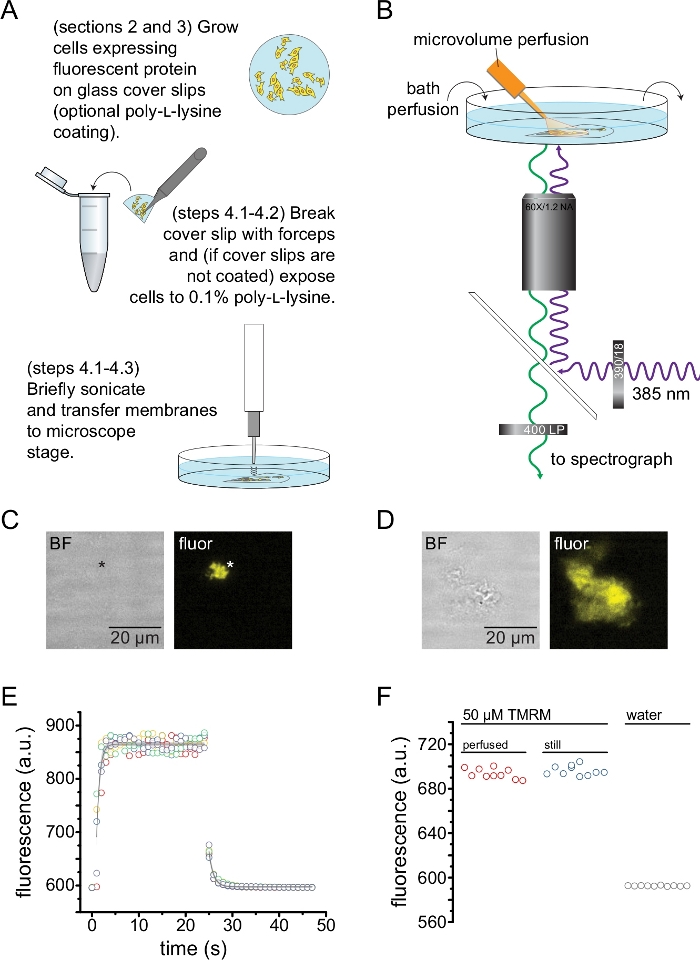
图 2:测量无顶质膜中的核苷酸结合。 (A)从表达荧光膜蛋白的贴壁细胞制备无顶质膜的示意图。为在聚-L-赖氨酸包衣或未经处理的盖玻片上生长的细胞提供说明。(B)测量无顶膜中核苷酸结合的实验装置。(C)来自表达橙色荧光蛋白(OFP)标记的KATP 通道的细胞的完全无顶质膜的明场和荧光图像。星号标记膜的位置,在明场图像中几乎不可见。OFP通过531/40 nm带通滤光片激发565 nm宽LED和562 nm边缘二向色性,并通过593/40 nm带通滤光片收集发射光。(D)来自表达橙色荧光蛋白(OFP)标记的KATP 通道的细胞的部分无顶膜片段的明场和荧光图像。(E)使用B中描述的设置获得的溶液交换时间过程,显示了五个技术重复。微量灌注系统加载50 μM四甲基罗丹明-5-马来酰亚胺(TMRM)。浴液以~0.5mL / min的速度注入水。来自冲洗(增加荧光)和冲洗(减少荧光)时间过程的数据与形式 为 F = A*exp(-x/τ) + y0 的单个指数衰减拟合。冲洗的时间常数(τ)为~0.6秒。冲洗的时间常数为~1.0 s.TMRM通过540/25 nm带通滤光片用565 nm LED激发,565 nm边缘二向色性,发射光通过605/55 nm带通滤光片收集。(F)使用微量灌注系统(如B)和含有50μM TMRM的静止浴施加的50μMTMRM溶液的荧光强度比较。 请点击此处查看此图的大图。
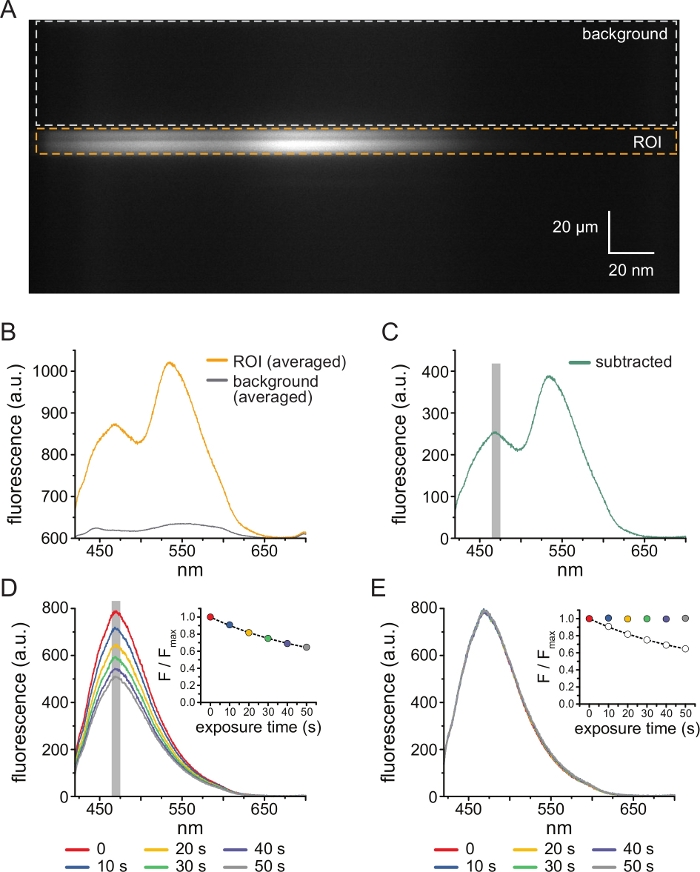
图 3:背景减法和漂白校正。 (A)来自表达ANAP标记的KATP通道的细胞的无顶质膜的光谱图像(y维的空间信息,x维的波长)。使用图2B中描述的设置施加5μM TNP-ATP。橙色框表示感兴趣区域(ROI),对应于无顶膜。灰色框表示用于校正光谱的背景区域。(B) 从 A 中 ROI 和背景区域的逐波长平均值得出的发射光谱。 (C) 从 B 中的平均 ROI 光谱中减去平均背景光谱得出的光谱。用于确定平均强度的ANAP峰周围的5 nm窗口显示为灰色阴影区域。(D) 从表达 ANAP 标记的 KATP 通道的细胞连续 10 秒暴露于无顶质膜的六次连续 10 秒获得的光谱。注意光漂白引起的荧光减少。插图显示了归一化峰值荧光拟合,具有单一指数衰减的形式,形式为 F/Fmax = A*exp(-t/τ) + (1-A)。插图中的符号经过颜色编码以匹配光谱。(E)与D中相同的光谱校正了光漂白。插图显示D的归一化峰值荧光为开圈,校正后的峰荧光使用填充圆圈显示。请点击此处查看此图的大图。

图 4:使用膜片钳荧光测定法 (PCF) 同时测量核苷酸结合和通道电流。 (A)显示测量核苷酸结合和离子电流的实验装置的示意图。(B)从表达ANAP标记的KATP 通道的细胞切除的膜贴片中获得的示例电流(左)和光谱(右)。在-60 mV的保持电位下记录电流,在20 kHz下数字化,并以5 kHz滤波。灰色阴影区域对应于量化ANAP强度的波长范围。改编自Usher等人(根据知识共享署名许可出版,https://creativecommons.org/licenses/by/4.0/)11。(C)从表达暴露于1mM TNP-ATP的表达ANAP标记的KATP 通道的细胞中切除的膜贴片中获得的光谱。注意对应于观察到TNP-ATP荧光的波长范围的负峰值。灰色阴影区域表示用于量化ANAP荧光的波长范围,如B.改编自Usher等人(根据知识共享署名许可发表,https://creativecommons.org/licenses/by/4.0/)11。(D)暴露于1mM TNP-ATP的贴片移液器的明场和荧光图像。星号标记移液器的尖端。(E) 1 mM TNP-ATP 中同一贴片移液器的光谱图像。星号标记移液器的位置。 请点击此处查看此图的大图。
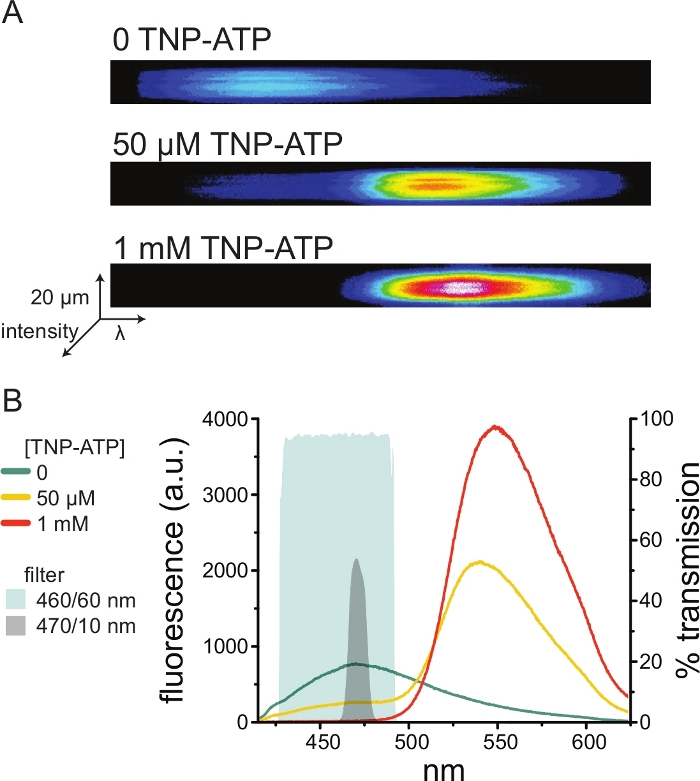
图5:TNP-ATP与ANAP标记的KATP 通道结合。(A)在没有TNP-ATP或存在50μM或1mM TNP-ATP的情况下表达ANAP标记的KATP 通道的细胞的无顶质膜的光谱图像。强度显示为热图。(B)来自A中图像的逐波长平均光谱,显示TNP-ATP对ANAP荧光的淬灭。阴影区域代表两种不同的带通滤光片,如果没有光谱仪,它们可用于测量ANAP淬灭。 请点击此处查看此图的大图。
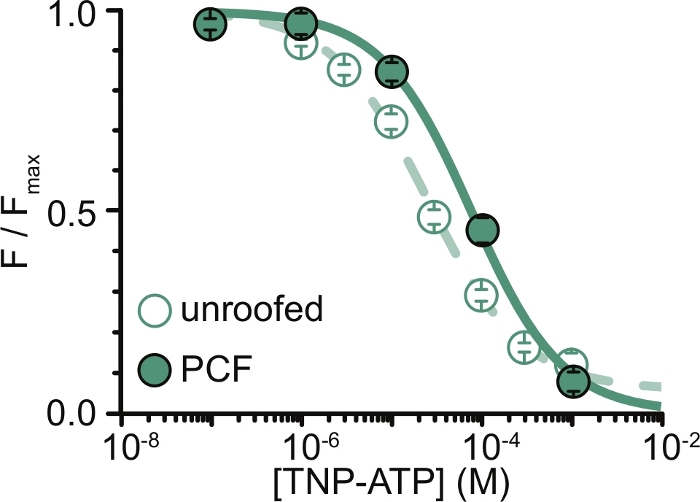
图 6:TNP-ATP 在无顶膜和 PCF 中淬灭 ANAP 标记的 KATP 通道。来自 Usher 等人的数据叠加(根据知识共享署名许可发布,https://creativecommons.org/licenses/by/4.0/)11。数据拟合到希尔方程:F / F max = E max + (1 – E max) / (1+10(EC50 –[TNP-ATP])*h)。F是测得的荧光,F max是无核苷酸时的最大荧光,Emax是饱和核苷酸浓度下的最大猝灭,h是希尔斜率。EC50(淬灭为半最大值的核苷酸浓度)和[TNP-ATP]是对数值。无屋顶膜:EC50 = -4.59 (25.7 μM),h = 0.82,Emax = 0.93。PCF:EC50 = -4.11 (77.6 μM),h = 0.87,Emax = 1.00。请点击此处查看此图的大图。
讨论
我们开发了一种实时测量腺嘌呤核苷酸与完整膜蛋白结合的方法。我们的方法建立在其他几种已建立的技术之上,包括使用琥珀色终止密码子抑制12,细胞揭开14和电压钳形荧光测定/ PCF19,20,21,22,23,24,25用ANAP标记蛋白质.这些方法的合成允许以高空间和时间分辨率测量核苷酸结合。事实上,在我们以前的工作中,我们能够使用这种方法区分同一蛋白质复合物上的不同结合位点10,11。重要的是,该技术可以在保留蛋白质功能的条件下直接应用于细胞环境中的少量蛋白质。将我们的结合方法与离子通道电流的直接电生理读数结合使用,使我们能够获得对通道门控11的分子基础的丰富见解。
由于光谱仪是一种非标准的实验室设备,因此也可以使用带通滤波器在相对隔离的情况下监测ANAP强度。 图5B 描述了两个这样的滤光片的光谱特性。470/10 nm带通滤光片可有效筛选TNP-ATP的荧光信号,并与峰值ANAP荧光很好地重叠。然而,该滤波器的峰值透射率仅为50%左右,这可能使得难以从昏暗的膜(或在电压钳下的切除膜贴片)获得良好的信号。另一种选择是460/60 nm带通滤光片。与470/10 nm滤光片相比,460/60 nm滤光片与TNP-ATP发射峰的脚之间的重叠略多。然而,460/60 nm带通在很宽的ANAP峰范围内具有90-95%的透射率,这有望增强荧光发射信号。
ANAP是一种对环境敏感的荧光基团12,26,27。峰值发射和量子产率根据目标蛋白质上的掺入位点而变化,并且可能随着蛋白质构象的变化而变化。这种变化从发射光谱中可以立即显现出来,但当使用滤光片测量ANAP强度时,这种变化就不那么明显了。在任何情况下,都需要适当的对照来证明荧光信号不会因为核苷酸结合后ANAP周围局部环境的变化而变化。使用未标记核苷酸的对照实验可以帮助验证ANAP强度的任何变化都是ANAP和TNP核苷酸之间FRET的结果。TNP-核苷酸可以非特异性地结合来自未转染细胞的膜(与质膜或天然膜蛋白)10。我们将结合量化为供体荧光的减少,因为该信号特定于标记的通道。然而,我们建议对每个激动剂/受体对进行额外的对照实验,例如突变核苷酸结合位点(如果已知),以验证供体荧光的变化是否确实是与标记的受体11直接结合的结果。最后,建议使用除ANAP标记外还包含荧光蛋白标签的构建体。这有助于区分标记的受体荧光与背景/自发荧光。背景荧光可以通过发射光谱10的峰值和形状与ANAP区分开来,但是当仅使用滤光片组时,这种测定可能非常困难。此外,表达荧光受体的细胞和无顶膜可以使用荧光蛋白标签进行鉴定,而不必激发ANAP并冒过度光漂白的风险。
在我们的许多PCF记录中,我们在高TNP-ATP浓度下观察到光谱中有一个强烈的负峰(图4C)。这个负峰值是我们的背景减法协议的伪影。 图4D 显示了暴露于1 mM TNP-ATP的贴片移液器的明场和荧光图像。移液器吸头处的阴影很明显,这是由于从移液器壁的体积中排除了TNP-ATP,这在焦点平面内最为明显。 图4E 中的光谱图像显示了与该阴影相对应的暗带。当该暗带上方或下方的区域用于背景减法时,会产生负峰值。重要的是,该峰值发生在对应于TNP-ATP发射的波长范围内,并且不会影响我们对ANAP淬灭的测量。
我们实验的主要局限性在于获得足够的ANAP标记构建体的质膜表达来测量荧光。与PCF相比,从无顶膜中获取高质量光谱通常更容易,因为它们的尺寸更大,并且我们能够快速扫描整个无顶膜的盘子,这与PCF不同,PCF一次只能获得一个贴片。在我们的实验中,来自无顶膜和PCF实验的数据相似但不等效(图6)11。然而,没有先验的理由说明为什么这应该是一个普遍的观察结果,因为贴片移液器中的蛋白质可能处于与无顶膜中的蛋白质不同的功能状态。
在这里,已经尝试最大限度地表达我们的ANAP标记的构建体,特别是将细胞培养温度降低到33°C10,11,16。根据我们的经验,试图识别蛋白质中ANAP作为保守替代的位点并不一定导致表达良好的构建体。我们更成功地系统地扫描了整个蛋白质区域的ANAP掺入位点,并筛选了表面表达的候选物10。ANAP标记系统也适用于非洲爪蟾卵母细胞,允许切除更大的膜贴片,从而增加信噪比26,27,28。
虽然较高的表达水平有望产生更亮的信号,但测量荧光所需的最小通道数取决于几个因素,包括荧光团的亮度、光漂白程度、激发光的强度和聚焦平面。理论上,可以通过关联荧光强度和通道电流来估计,如前所述28,29。然而,这种估计的可靠性需要对单通道电导和通道的开放概率有一定的了解。除了上面列出的因素外,荧光信号还会受到与粘附在移液器玻璃上的囊泡或质膜部分相关的通道的影响,这些通道没有处于电压钳位下。
该方法很容易适用于其他核苷酸敏感离子通道的研究。CFTR在结构上类似于KATP30,31的辅助磺酰脲受体亚基。像KATP CFTR门控一样,由核苷酸结合控制,使其成为我们方法7的明显未来目标。嘌呤能P2X受体是由细胞外ATP9设控的离子通道。TNP-ATP作为P2X受体32,33的拮抗剂。因此,它对研究P2X激活没有用,尽管它可以用于与P2X激动剂的竞争测定。或者,与ANAP发射具有足够光谱重叠的其他荧光ATP衍生物可用于研究激活。Alexa-647-ATP是一种荧光P2X激动剂34。Alexa-647和ANAP之间计算出的R0 为~85 Å,这意味着与P2X的直接结合应该会导致掺入通道中的ANAP发生实质性猝灭。然而,如此长的R0 也会导致Alexa-647-ATP与相邻亚基结合的猝灭,并增加非特异性核苷酸结合导致FRET的可能性。由于P2X受体中的配体结合位点是细胞外的,因此将在完整细胞,全细胞电压钳或由外的膜贴片中进行结合测量。我们的方法还可以扩展到研究电原和非电转运蛋白和泵的结合和活化,这些转运蛋白和泵依赖于ATP的反应周期以及G蛋白偶联的P2Y受体。最后,尽管我们已经开发了这种方法来测量腺嘌呤核苷酸结合(TNP-ATP,TNP-ADP,TNP-AMP),但相同的方法可用于研究与几乎任何已鉴定出合适荧光配体的受体的结合。
披露声明
作者声明不存在利益冲突。
致谢
我们要感谢Raul Terron Exposito提供的出色技术援助。这项工作由生物技术和生物科学研究理事会资助(BB/R002517/1;MCP和FMA)和威康信托基金(203731/Z/16/A;SGU)
材料
| Name | Company | Catalog Number | Comments |
| T75 tissue-culture treated flask | StarLab | CC7682-4875 | |
| 0.1% w/v poly-L-lysine | Sigma-Aldrich | P8920 | |
| 30 mm borosilicate cover glass slips | VWR | 631-0174 | |
| 35 mm non-treated sterile dishes | CytoOne | CC7672-3340 | |
| 35 mm cover glass bottom dish | WPI | FD35-PDL-100 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 31966021 | |
| Foetal bovine serum (FBS) | Gibco | 10500-064 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| TrypLE select (tryosin) | Gibco | 12563-011 | Trypsin/EDTA reagent |
| Phosphate buffered saline (PBS) | Gibco | 14040-091 | |
| UltraPure distilled water | Invitrogen | 10977-035 | |
| HEK293T cells | ATTC | CRL-3216 | Used between passages 5-30 |
| ANAP-TFA | AsisChem | ASIS-0014 | Reconstituted in 30 mM NaOH to a final concentration of 1 mM |
| pANAP expression plasmid | Addgene | Plasmid #48696 | Encodes tRNA/tRNA synthetase pair for expression of ANAP-tagged protein |
| peRF1-E55D | Chin Lab (MRC Laboratory of Molecular Biology, Cambridge, UK) | Jason Chin: DOI: 10.1021/ja5069728 | Encodes dominant-negative eukaryotic ribosomal release factor |
| TransIT-LT1 | Mirus Bio | MIR 2300 | Lipopolyplex transfection reagent |
| Thick-walled borosilicate glass capillaries | Harvard Apparatus | GC150F-15 | |
| Tetramethylrhodamine-5-maleimide | Sigma-Aldrich | 94506 | |
| TNP-ATP | Jena Bioscience | NU-221L | Delivered at 10 mM in water |
| Nikon Eclipse TE2000-U inverted microscope microscope | Nikon | ||
| 60x water immersion objective (1.4 NA) | Nikon | MRD07602 | |
| 4-Wavelength High-Power LED Head | ThorLabs | LED4D245 | 385/490/565/625 nm LEDs |
| Four-Channel LED Driver | ThorLabs | DC4100 | |
| 390/18 nm band-pass excitation filter | ThorLabs | MF390-18 | For ANAP excitation |
| 400 nm long-pass emission filter | ThorLabs | FEL0400 | For imaging ANAP spectra |
| 416 nm edge dichroic | ThorLabs | MD416 | For imaging ANAP spectra |
| 460/60 nm band-pass emission filter | ThorLabs | MF460-60 | Suggested wide band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 470/10 nm band-pass emission filter | ThorLabs | FB470-10 | Suggested narrow band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 531/40 band-pass excitation filter | Brightline | FF01-531/40-25 | For orange fluorescent protein (OFP) excitation |
| 540/25 nm band-pass excitation filter | Chroma | D540/25X | For tetramethylrhodamine-5-maleimide (TMRM) excitation |
| 562 nm edge dichroic | Semrock | FF562-Di03 | For imaging OFP fluorescence |
| 565 nm edge dichroic | Chroma | 565DC | For imaging TMRM fluorescence |
| 593/40 nm band-pass excitation filter | Brightline | FF01-387/11-25 | For imaging OFP fluorescence |
| 605/55 nm band-pass emission filter | Chroma | D605/55M | For imaging TMRM fluorescence |
| IsoPlane-160 Imaging Spectrometer | Princeton Instruments | IsoPlane-160 | |
| PIXIS 400BR_eXcelon Camera | Princeton Instruments | PIXIS: 400BR_eXcelon | |
| Axopatch 200B amplifier | Molecular Devices | Axopatch 200B-2 | |
| Digidata 1440A digitizer | Molecular Devices | Digidata 1440A | |
| Probe sonicator | Sonics & Materials | VC-50 | For unroofing |
| REGLO digital peristaltic pump | Ismatec | ISM 832 | For bath perfusion |
| Microvolume perfusion system | ALA Scientific Instruments | ALA μFlow-8 | For TNP-ATP perfusion |
| pClamp 10.6.2 | Molecular Devices | Recording and analysing currents | |
| Lightfield 5.20.1507 | Princeton Instruments | Acquisition software for images and spectra | |
| Matlab | Mathworks | For data analysis | |
| Python 3.8.1 | Python Software Foundation | For data analysis |
参考文献
- Garcia, M. L., Kaczorowski, G. J. Ion channels find a pathway for therapeutic success. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5472-5474 (2016).
- Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B., Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nature Reviews Drug Discovery. 16 (12), 829-842 (2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Higgins, C. F., Linton, K. J. The ATP switch model for ABC transporters. Nature Structural & Molecular Biology. 11 (10), 918-926 (2004).
- Toyoshima, C., Cornelius, F. New crystal structures of PII-type ATPases: excitement continues. Current Opinion in Structural Biology. 23 (4), 507-514 (2013).
- Craven, K. B., Zagotta, W. N. CNG and HCN channels: two peas, one pod. Annual Review of Physiology. 68, 375-401 (2006).
- Csanady, L., Vergani, P., Gadsby, D. C. Strict coupling between CFTR's catalytic cycle and gating of its Cl- ion pore revealed by distributions of open channel burst durations. Proceedings of the National Academy of Sciences of the United States of America. 107 (3), 1241-1246 (2010).
- Vedovato, N., Ashcroft, F. M., Puljung, M. C. The Nucleotide-Binding Sites of SUR1: A Mechanistic Model. Biophysical Journal. 109 (12), 2452-2460 (2015).
- Burnstock, G. Introduction to the Special Issue on Purinergic Receptors. Advances in Experimental Medicine and Biology. 1051, 1-6 (2017).
- Puljung, M., Vedovato, N., Usher, S., Ashcroft, F. Activation mechanism of ATP-sensitive K(+) channels explored with real-time nucleotide binding. Elife. 8, 41103(2019).
- Usher, S. G., Ashcroft, F. M., Puljung, M. C. Nucleotide inhibition of the pancreatic ATP-sensitive K+ channel explored with patch-clamp fluorometry. Elife. 9, 52775(2020).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. Journal of the American Chemical Society. 135 (34), 12540-12543 (2013).
- Gordon, S. E., Senning, E. N., Aman, T. K., Zagotta, W. N. Transition metal ion FRET to measure short-range distances at the intracellular surface of the plasma membrane. Journal of General Physiology. 147 (2), 189-200 (2016).
- Heuser, J. The production of 'cell cortices' for light and electron microscopy. Traffic. 1 (7), 545-552 (2000).
- Schmied, W. H., Elsasser, S. J., Uttamapinant, C., Chin, J. W. Efficient multisite unnatural amino acid incorporation in mammalian cells via optimized pyrrolysyl tRNA synthetase/tRNA expression and engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Lin, C. Y., et al. Enhancing Protein Expression in HEK-293 Cells by Lowering Culture Temperature. PloS One. 10 (4), 0123562(2015).
- Usukura, J., et al. Use of the unroofing technique for atomic force microscopic imaging of the intra-cellular cytoskeleton under aqueous conditions. Journal of Electron Microscopy. 61 (5), 321-326 (2012).
- Colquhoun, D. Binding, gating, affinity and efficacy: the interpretation of structure-activity relationships for agonists and of the effects of mutating receptors. British Journal of Pharmacology. 125 (5), 924-947 (1998).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Science's STKE. 2003 (176), 7(2003).
- Biskup, C., et al. Relating ligand binding to activation gating in CNGA2 channels. Nature. 446 (7134), 440-443 (2007).
- Kusch, J., et al. Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron. 67 (1), 75-85 (2010).
- Wu, S., et al. State-dependent cAMP binding to functioning HCN channels studied by patch-clamp fluorometry. Biophysical Journal. 100 (5), 1226-1232 (2011).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proceedings of the National Academy of Sciences of the United States of America. 110 (20), 8272-8277 (2013).
- Kalstrup, T., Blunck, R. S4-S5 linker movement during activation and inactivation in voltage-gated K(+) channels. Proceedings of the National Academy of Sciences of the United States of America. 115 (29), 6751-6759 (2018).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nature Structural & Molecular Biology. 26 (8), 686-694 (2019).
- Liu, C., et al. Patch-clamp fluorometry-based channel counting to determine HCN channel conductance. Journal of General Physiology. 148 (1), 65-76 (2016).
- Hwang, T. C., et al. Structural mechanisms of CFTR function and dysfunction. Journal of General Physiology. 150 (4), 539-570 (2018).
- Puljung, M. C. Cryo-electron microscopy structures and progress toward a dynamic understanding of KATP channels. Journal of General Physiology. 150 (5), 653-669 (2018).
- Kasuya, G., et al. Structural insights into the competitive inhibition of the ATP-gated P2X receptor channel. Nature Communications. 8 (1), 876(2017).
- Virginio, C., Robertson, G., Surprenant, A., North, R. A. Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1, P2X3, and heteromeric P2X2/3 receptors. Molecular Pharmacology. 53 (6), 969-973 (1998).
- Bhargava, Y., Nicke, A., Rettinger, J. Validation of Alexa-647-ATP as a powerful tool to study P2X receptor ligand binding and desensitization. Biochemical and Biophysical Research Communications. 438 (2), 295-300 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。