Method Article
用于液相电子显微镜的化学固定哺乳动物细胞的石墨烯外壳
摘要
此处介绍的是一种协议,用于标记哺乳动物细胞中的膜蛋白,并涂上石墨烯进行液相扫描传输电子显微镜。样品对辐射损伤的稳定性也可以通过本协议研究。
摘要
介绍了一种利用扫描传输电子显微镜(STEM)研究乳腺癌细胞完整血浆膜中人类表皮生长因子受体2(HER2)的协议。哺乳动物乳腺癌细胞系SKBR3的细胞生长在硅微芯片上,带氮化硅(SiN)窗口。细胞是化学固定的,HER2蛋白被标记为量子点纳米粒子(QDs),使用两步生物素-链球菌素结合协议。这些细胞被涂上多层石墨烯,以保持水合状态,并保护它们免受STEM期间电子束损伤。为了检查电子束照射下样品的稳定性,进行了剂量序列实验。比较了石墨烯涂层和非涂层样品。光束诱导损伤,以明亮的伪影的形式出现,一些非涂层样品在增加电子剂量 D,而没有伪影出现在涂层样品。
引言
膜蛋白功能分析对细胞生物学研究和药物开发至关重要。一类重要的实验涉及检查细胞中的膜蛋白位置。此信息可用于推断有关蛋白质复合物中蛋白质的组装及其在血浆膜中的特定位置的结论,通过动态组装和分解,驱动各种细胞功能。除其他技术外,光显微镜(LM)和电子显微镜(EM)用于研究细胞中的蛋白质功能。LM允许对液体中整个细胞进行分析;然而,分辨率限制在200-300纳米常规和高达20纳米的超分辨率荧光显微镜在实际条件下1,1,2。EM 提供约 1 +分辨率 3,但传统的样品制备需要脱水,金属染色,以提高图像对比度,并嵌入安装物质,如树脂,用于传输电子显微镜 (TEM)4。为了在更原生环境中保存生物样品,可以使用5、6的低温EM技术。样品被迅速冷冻成无定形冰,如果需要,被分切。另一种选择是冻结压裂EM7。
在过去十年中,EM技术已经出现了研究膜蛋白在完整的细胞中,其原生,液体状态已经出现8,8,9,10,11。9,10,11量子点(QD)在SiN膜上生长并由一层石墨烯9包围的整个细胞中实现了2纳米的空间分辨率。
在这里,蛋白质标签和石墨烯涂层9,12,的协议的细节被描述。该协议的目标是分析 HER2 在全固定细胞膜中的空间分布,同时将细胞保持水合状态。用石墨烯涂层可防止细胞在真空中干燥,还可以减少辐射损伤13。此方法提供有关完整血浆膜内标记膜蛋白的信息,但该方法对研究细胞超结构没有用处,就像通常使用 EM 一样。
石墨烯是已知的最薄的纳米材料,由一块碳原子厚的晶体片组成,排列在蜂窝晶格14中。它具有独特的性能,包括高灵活性和机械强度。最近的研究表明,无缺陷石墨烯对气体和液体不渗透,但缺陷允许氢渗透15。通过使用多层石墨烯,可以减少这种泄漏。与只有不均匀层形成16的氧化石墨烯相比,双层石墨烯最近被证明对低温-EM样品具有支持性,提高了薄层的同源性。石墨烯还被证明在液相传输电子显微镜13,17期间减少生物样品的光束损伤。作为一个示范性实验,在哺乳动物乳腺癌细胞系SKBR3中表达的 HER2 标有QDs18,并使用STEM记录其空间分布。细胞被播种在具有电子透明SiN膜19的Si微芯片上。微芯片被选为支持,因为它们是健壮的,与LM和EM兼容,整个标记过程可以直接在微芯片19上执行。在细胞附件之后,HER2被标记为两步标记协议20。首先,一种生物素化抗 HER2 抗体仿生化合物21附着在 HER2 上。然后对细胞进行化学固定,以防止标签诱导的受体聚类,并增加细胞超结构的稳定性。随后,与 HER2 抗体模仿复合物相关。在链球菌涂层的 QD 中。明亮的荧光信号和QD的电子密集核心允许相关的荧光和电子显微镜(CLEM)20。CLEM 特别有用,因为 STEM 分析感兴趣的细胞区域可以从荧光显微镜图像的概述中选择,突出显示 HER2 在细胞上的定位。通过荧光显微镜分析细胞,以识别具有高 HER2 水平的细胞区域。此后,一块3-5层厚的石墨烯被转移到细胞上,用于涂装,9,22。随后,样品安装在 EM 试样支架中。STEM 数据是使用环形暗场 (ADF) 探测器获得的,提供有关细胞表面与细胞表面位置相关的 HER2 的空间分布信息,但没有提供有关细胞超结构的信息。为了确定电子束照射下样品的稳定性,在图像序列中以增加剂量(D)对样品进行了检测。调查了石墨烯涂层样品和非涂层样品的区别。评估了几种辐射损伤。
此处描述的协议使用 HER2 过度表达哺乳动物乳腺癌细胞系 SKBR3 作为针对 HER223 的模型系统。该协议包括制备一个石墨烯涂层样品,以及一个类似的样品,但没有石墨烯涂层进行比较。实验是重复准备的,因为 SiN 窗口可能每隔一段时间中断一次,并且在大多数情况下获得实验重复。该方法的总体产量很高,这意味着具有石墨烯覆盖细胞的微芯片通常获得异常误差,即使并非所有 SiN 窗口在所有情况下都覆盖石墨烯。协议中未描述重复项。
标记协议(步骤1-5)可与COS7成纤维细胞中表皮生长因子受体的标记方案相媲美;该论文中有关微芯片的处理和井板的使用的详细信息。以下协议经过优化,用于标记 HER2、石墨烯涂层 9,并检查样品的辐射公差。
研究方案
1. 用聚L-裂明(PLL)和纤维素类蛋白(FLP)清洁微芯片和涂层
- 将两个带 SiN 膜(2.0 x 2.6 mm)的微芯片放在 50 mL 的丙酮中。小心处理微芯片,平端朝上。使用平嘴钳子避免断裂边缘。使用钳子操作时,避免接触微芯片的顶部表面,以防止 SiN 窗口损坏。
注:也可以使用聚四氟乙烯涂层或碳尖端钳子,以防止微芯片的损坏。 - 小心摇动烧杯,将芯片洗涤 2 分钟,观察微芯片不要翻转。
- 将微芯片转移到50 mL乙醇中,通过小心摇动烧杯洗涤2分钟。确保传输快速,使多余的丙酮不会干中。
- 用50 mL水清洗微芯片10分钟。
- 将微芯片浸入新鲜准备的20 mL乙醇烧杯中。
- 将微芯片放在洁净室组织上进行干燥。
- 等离子体在 70 mTorr 时用 11.5 sccm O2 和 35 sccm Ar 清洁微芯片,射频 (RF) 目标为 50 W,为 5 分钟。
- 将微芯片放在层流罩中,用于无菌细胞工作。
- 准备水中 0.01% PLL 的溶液。在磷酸盐缓冲盐水 (PBS) 中制备 15 μg/mL FLP 溶液。
- 在层流罩下准备一个24孔板,按以下顺序单独填充5个井,用1 mL的溶液填充:井1 =PLL;井 2 = 水;井 3 = 水;以及 4 = Flp;井 5 = Pbs 和井 6 = Pbs 。
注:使用钳子将微芯片浸入指示的 24 或 96 井中几秒钟,执行洗涤步骤。通过将微芯片孵育为指示的时间和温度,在指示溶液中孵育24或96井,执行孵育步骤。在几秒钟内将微芯片转移到另一个井中。 - 在PLL溶液中孵育微芯片5分钟。然后在水中清洗两次微芯片。
- 在FLP中孵育微芯片5分钟。然后在PBS中清洗两次微芯片。
- 将两个微芯片转移到新 96 井板的孔(每个微芯片一个),预填充 50 μL 的无血清培养基,用于细胞播种。
- 在37°C和5%CO2下孵育微芯片, 直到细胞悬浮液准备好。
2. 在SiN膜微芯片上播种细胞
- 在层流罩中设置所有耗材和设备,以确保无菌工作。
- 在具有生长介质的细胞培养瓶中清洗乳腺癌细胞系SKBR3。使用Dulbecco的改良鹰介质(DMEM)含有10%的胎儿小牛血清(FCS)和1%的非必需氨基酸(NEAAs)作为生长介质。
- 用1mL的细胞分离溶液孵育细胞,直到细胞从烧瓶分离。
- 向烧瓶中的分离细胞添加5 mL的生长介质。将此悬架转移到离心管。
- 移液20μL的细胞悬浮液进入血细胞计,以获得细胞浓度。使用以下公式。
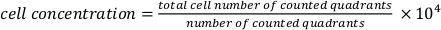 .
. - 准备 2.5 x 105 细胞/mL 的 分散细胞悬浮液。计算所需的准备细胞悬浮量:
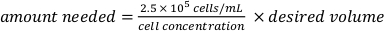
并填充生长介质到所需的体积。 - 将100μL的细胞悬浮液加入含有PLL和FLP涂层微芯片的96孔板的两口井中,该孔的SiN膜朝上,50μL的血清培养基,使每口井含有25,000个细胞。
- 在37°C和5%CO2下孵育 板5分钟,等待细胞附着在微芯片上。
注:此时,细胞可以从微芯片分离,因为它们尚未粘附。 - 用倒置显微镜检查微芯片上的细胞密度。确保单元格覆盖窗口时有足够的空间来压平并粘附(参见图 1A)。
注:如有必要,此时可以添加更多单元格。 - 将微芯片转移到含有200μL生长介质的新井中,并在37°C和5%CO2下孵 育过夜。
- 在第二天下午,将两个微芯片转移到无血清介质(血清饥饿介质),如果细胞已经变平并粘附在视觉检查的汇合(即被细胞覆盖的窗口区域的分数)约2/3(见图1B)。根据需要更换无血清介质,使细胞处于定义的起始状态,以便比较不同的实验25。
- 在37°C和5%CO2过夜孵 育。
注意:请注意,细胞量可能因其他细胞系的生长速率和细胞形态而不同。
3. HER2 标签和固定
- 准备补充表 1 中所述的解决方案。
- 在层流罩下工作,确保无菌工作。使用称为标签板 I 的 96 孔板,用 200 μL 的标签板 I 溶液填充每个微芯片 6 孔:PBS/BSA、PBS/BSA/GS、抗体模仿、PBS/BSA、PBS/BSA、PBS/BSA。使用每微芯片井板的一行(每行一个字母,例如 A1 到 A6)。将标签板加热至37°C。
- 在烟气罩下,准备一个称为固定板的24孔板,用500μL的固定板溶液填充8孔:CB、FA、CB、PBS、PBS、PBS、PBS、PBS、PBS、PBS/甘氨酸、PBS/BSA。
注意:CB 因吸入或口服而具有剧毒性,对水有害。在烟气罩下工作,提供适当的保护,并根据安全数据表 (SDS) 处置 CB。FA 具有腐蚀性,对皮肤和健康有害。在烟罩下工作,并参考 SDS 了解处理和处置信息。 - 准备一个称为标签板II的96孔板,用200μL的标签板II溶液填充4孔,即QD、PBS/BSA、PBS/BSA、PBS/BSA、PBS/BSA。
注:在这里,24孔板用于更好地看到井中的微芯片。要少使用抗体模仿(步骤3.2)和QD(步骤3.4),请使用96孔板执行这些步骤。
- 在单元格中标记 HER2。
- 准备好这些板后,通过将微芯片放入标签板 1 的第一排孔中开始标记。
- 用标有标签板 I 的 96 井板中的 PBS/BSA 清洗微芯片。
- 通过用PBS/BSA/GS在37°C和5%CO2下孵育5分钟,阻断非特异性位点,防止抗体模仿的不特异性结合。
- 在37°C和5%CO2下用200 nM抗体模仿孵育10分钟。
- 在PBS/BSA中清洗微芯片三次。
- 修复单元格。
- 将微芯片转移到烟罩中的 24 个井固定板。
注:这里不需要无菌工作。 - 用 CB 洗一次几秒钟。
- 用 3% FA 修复单元格 10 分钟。
- 用 CB 洗一次,用 PBS 洗三次。
- 使用 PBS-甘氨酸孵育 2 分钟,阻止无醛组 FA。
- 用 PBS-BSA 清洗一次微芯片。
- 将微芯片转移到烟罩中的 24 个井固定板。
- 附加 QD。
- 将微芯片移动到 96 井标板 II。
- 用 20 nM QD 孵育 12 分钟。
- 用 PBS/BSA 清洗微芯片两次。
- 将微芯片存放在含有 PBS/BSA 的井中。
4. 固定细胞的光显微镜
- 使用 2 mL PBS/BSA 溶液准备一个直径为 3.5 厘米的玻璃底盘。
- 拿第一个微芯片,倒置(朝下细胞)放入玻璃底盘,将盘子放入荧光显微镜中。将微芯片慢慢放入液体中,以防止对细胞造成损害。
- 通过 40 倍的目标和适当的荧光通道获取每个微芯片的差分干扰对比度 (DIC) 和荧光图像。
注:此处,激发波长为 540-580 nm,发射波长为 607-683 nm,用于检测 QD655。 - 对第二个微芯片重复此过程。
5. 固定后
- 在烟罩下执行所有步骤。
- 用 200 μL 的固定后溶液填充 96 孔板每微芯片 6 孔:
CB, GA, CB, PBS, PBS, PBS.
注意:GA对水有害,对皮肤、呼吸系统和眼睛有害。在烟罩下工作,并参考 SDS 了解处理和处置信息。 - 将两个微芯片放在各自的孔中,细胞朝上。
- 用 Cb 洗一次。
- 用 2% GA 修复单元格 10 分钟。
- 用 Cb 洗一次。
- 使用 PBS/BSA 清洗三次。
注:FA的第一个固定步骤已经固定了生物结构,但膜蛋白扩散水平可能仍然降低,可能导致标签诱导聚类,因为存在多个链球菌蛋白每个QD。因此,尽可能缩短实验步骤从FA固定到GA的时间,以尽量减少膜中蛋白质的扩散。 - 储存在PBS/BSA中,以防止渗透冲击和0.02%的阿齐德钠(NaN3),以防止细菌在4°C生长,直到石墨烯涂层在一个新的井板。用石蜡膜密封井板,防止干燥。微芯片和细胞在4°C下储存时稳定长达2周。
注意:NaN3 对水有危害,对皮肤和呼吸系统有口服严重毒性。在烟罩下工作,并参考 SDS 了解处理和处置信息。
6. 清洁石墨烯并将盐晶体转移到盐晶体上
- 从聚合物上的PMMA-石墨烯(图2A)中去除聚(甲基甲基丙烯酸酯)石墨烯(图2A)。
- 在PMMA-石墨烯周围的聚合物上滴几滴水。
注:确保PMMA-石墨烯漂浮在水面上时,很容易从支撑聚合物上脱落。 - 将PMMA-石墨烯浸入水中,角度为30-45°,释放PMMA-石墨烯。
注:聚合物应仅稍微湿润。在聚合物上移液太多水会提升并可能折叠PMMA-石墨烯。
- 在PMMA-石墨烯周围的聚合物上滴几滴水。
- 使用硫酸钠溶液的蚀刻铜基污染物(图2B)。
注:在铜箔上生长的商业石墨烯通常含有亚微米铜残留物,可用铜蚀刻溶液去除22。- 准备 50 mL 溶液中的 0.42 M 硫酸钠。
- 使用标准玻璃幻灯片将PMMA-石墨烯与石墨烯侧向下转移至硫酸钠溶液中。PMMA-石墨烯将浮在溶液顶部。
- 将PMMA石墨烯留在硫酸钠溶液中过夜。
- 从硫酸钠溶液中去除 PMMA-石墨烯,并使用玻璃滑梯将其放在净水的顶部。让它在水面上漂浮半小时。
- 重复上一步共三次,以去除PMMA-石墨烯中所有硫酸钠残留物。
- 将 PMMA-石墨烯转移到氯化钠 (NaCl) 晶体上。
- 在培养皿中在水中准备 NaCl 的饱和溶液。
- 使用玻璃滑梯将 NaCl 溶液顶部的 PMMA 石墨烯与石墨烯侧向下传输。
- 用钳子拿着一个 NaCl 水晶, 拿起漂浮的 PMMA 石墨烯。
注:NaCl晶体的大小应略大于PMMA石墨烯的大小,以避免折叠盐边缘突出的石墨烯或用钳子接触石墨烯。在这些实验中,12 mm x 12 mm x 0.5 mm 的 NaCl 晶体用于拾取 10 mm x 10 mm 石墨烯片并随后支撑它。 - 将 PMMA-石墨烯垂直保持盐上 2 分钟,让多余的水流出。
- 让PMMA-石墨烯在室温下干燥30分钟,在100°C的烤箱中烘烤20分钟,以完全去除水。
- 使用丙酮洗涤去除PMMA(图2C)。
- 在玻璃培养皿中预热丙酮至烟罩中的热板上 +50°C。仔细观察温度,避免着火。
- 将PMMA-石墨烯浸入装满丙酮的培养皿中,让其溶解PMMA30分钟。
- 使用新的清洁丙酮共重复上一步三次。
- 在样品制备之前,让盐上的石墨烯彻底干燥。
7. 石墨烯涂层
注:图3A中图中显示了石墨 烯涂层工艺。
- 用固定细胞清洗一个微芯片,并在纯水中标记 HER2,以清除缓冲液中残留的盐。将微芯片放在滤纸上。这些细胞以黑点可见(图3B)。
- 使用剃须刀将 NaCl 晶体上的多层石墨烯切成适合微芯片的 SiN 窗口的一块。
- 准备纯水烧杯,将晶体与水面倾斜约 45° 角并接触水,从 NaCl 晶体中去除石墨烯。石墨烯将漂浮在水面上(图3C)。
- 用金属环从水面捕捉石墨烯。石墨烯将漂浮在循环下方的液滴内(图3D)。
- 用下环表面触摸微芯片的上表面。微芯片将粘在金属环上。石墨烯可以在微芯片的顶部看到(图3E)。
- 在立体显微镜下,使用滤纸从微芯片中去除剩余的水,使石墨烯覆盖SiN窗口上的所有细胞。
注:石墨烯在被污污时会移动。只需用滤纸边缘触摸微芯片,即可确保石墨烯停留在窗口顶部。 - 使用钳子从金属环中取出微芯片并将其放在滤纸上。石墨烯在微芯片上以紫色微光可见(图3F)。
- 将微芯片从纸张转移到隔间培养皿中。
- 将一滴水滴入其中一个自由隔间,然后合上盖子,以提供水饱和的大气。
- 如果需要进一步测量,用石蜡薄膜密封隔间,并在 4°C 时存放在冰箱中。
8. 茎
- 通过调整冷凝器透镜、探针电流 I = 180 pA( 制造商在 5% 精度范围内提供不同显微镜设置的探针电流信息)和通过插入孔径提供的 13.2 mrad 的光束收敛半角,使用至少 0.2 nm 的探针尺寸调整 200 kV 光束能量的 STEM。通过调整投影仪镜头设置,将 ADF STEM 探测器的半角度范围(内角和外角)打开范围设置为 68-280 mrad。将 STEM 图像大小设置为 2048 x 2048 像素,像素停留时间 t = 6 μs。
- 将微芯片与石墨烯涂层的电池装载到 TEM 的标准试样支架中,使细胞朝上。
- 将支架加载到电子显微镜中。
- 使用步骤 8.1 中的设置以放大倍率 ( M ) = 800x (图 4) 获取概览图片。
- 标识单元格上感兴趣的区域。
- 使用 ADF 探测器在M = 80,000x 以像素大小d = 1.3 nm (图 4 ) 使用步骤 8.1 中的设置对 QD 进行图像。Figure 4
- 以较低的放大倍率(此处 ,M = 50,000x)获得曝光后的区域图像,以显示暴露区域(图4)。
- 计算电子剂量
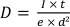
其中 e 是基本费用。以上设置后,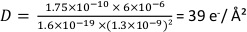
和5%的错误。 - 获得20个图像的剂量系列具有相同的设置,但与 t = 60 μs导致累积剂量
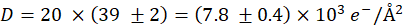 .
. - 要确认石墨烯的存在,请将显微镜切换到 M = 1,200 倍的 TEM,选择细胞附近的区域,然后切换到衍射模式。在曝光时间为 0.5 s、2048 x 2048 x 3 像素以及所选区域光圈 50 μm 时记录衍射模式(图 4)。
- 在会议结束时,从显微镜中取出样品,将微芯片放回隔间中,用石蜡膜密封盘子,如果需要进一步测量,将其储存在冰箱中,温度为 4°C。
- 选择第二个微芯片,其准备方式与第一个微芯片相同,但无石墨烯涂层。
- 重复步骤 8.2-8.11,但现在对于此示例。将与上述设置相同的衍射模式记录为比较(图 4)。
9. 分析
注:对于STEM图像中的QD位置的自动检测,分析使用了 ImageJ(NIH)的本地设计的插件,如其他地方所述20。插件可应要求提供。
- 该软件会自动应用以下步骤来检测 STEM 图像中的粒子:
- 应用高斯滤镜以降低像素噪音。
- 应用快速四叶变换 (FFT) 带通滤波器,仅获取纳米粒子。
- 设置将图像二进制化的阈值。
- 使用容差系数为 2 的 10 nm 的粒子直径进行粒子检测。
- 检测粒子位置。
- 测量每个系列 10 对 QD 之间的中心到中心距离。在这里,每个系列测量了 10 个大小不同的距离。
- 通过使用以下方法比较每个粒子距离与第一个图像中的距离,计算粒子距离的相对变化:
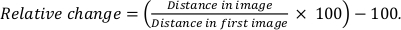 .
.
结果
图1A 显示细胞的播种方式,窗口被覆盖,但有足够的空间,使它们变平和粘附,导致约2/3第 (图1B) 的汇合。万一在微芯片上播种的细胞太多(图1C),则没有足够的空间让所有细胞粘附在微芯片上。 图 1D 显示了 24 小时后相同的微芯片。一半以上的细胞没有变平。另一方面,如果种子的细胞太少(图1E),SiN窗口将在24小时后出现较大的空白空间,如图 1F所示。 图1G 显示了图 1A和图1B中 细胞的 DIC图像。 图 1H 显示相应的荧光图像假彩色黄色表示 HER2 标记成功。
代表性 STEM 数据如图4 所示。对石墨烯涂层(左柱)和非涂层(右柱)SKBR3细胞进行了调查。图 4A,B显示窗口上单元格的M = 800x 概览图像。在剂量系列中,显示为内集的区域以M = 80,000x 的图像,参见图 4C,D。QD 在这里作为亮点可见。图 4E 和图 4F显示了在图4C中矩形位置采集的 M = 50,000 倍放大图像,D. 这两个图像是在获得具有 D = (7.8 = 0.4) x 103 e-/=2的剂量系列后记录的。剂量系列记录在M = 80,000x。公开区域可以识别为矩形,因此对于非涂层样品,矩形清晰可见(图 4F)。
为了验证石墨烯的存在,获得了无细胞区域的衍射模式,但 SiN 窗口上没有或没有石墨烯。在石墨烯涂层样品的衍射模式(图4G)中观察到石墨烯的六边形结构,而非涂层样品则不存在(图4H)。单晶石墨烯的衍射模式由于石墨烯高度有序的六边形结构,具有六倍对称性。因此,六边形结构表示样品上存在石墨烯。
为了研究电子束照明对样品的影响,在电子剂量累积的图像序列中获取了STEM图像。非涂层和石墨烯涂层样品的代表性结果分别如图5 Figure 5A-D和图5E-G所示。所有数据都是在细胞边缘获得的,其中细胞是最平坦的,因此观察到的结构最接近SiN膜。暴露非涂层样品导致在D =(1.9 = D 0.1)x103 e-/=2(图5B)的细胞表面出现明亮的结构。这些结构在高剂量下变大,因此在D = (7.8 = 0.4) x 103 e-/=2 (图5C,D) 系列的最后一幅图像中清晰可见。这些斑点没有出现在任何石墨烯涂层样品上(图5E-G)。
使用上述协议编写和检查了其他微芯片。共调查了6个涂布样品和7个非涂层样品。七个非涂层样品中,有两个显示了这些伪影。涂层样品中没有任何其他亮点。
作为辐射损伤的另一个测量标准,对QD之间的距离进行了检查。如果发生结构性损坏,人们预计QD之间的距离会发生变化。测量了不同 QD 对的距离变化,而累积 D 的对距离范围为一系列。 图5H 显示,非涂层样品颗粒的相对变化平均保持在1.3%以下,而涂层样品的平均相对距离保持在0.8%以下。因此,可以得出结论,石墨烯涂层稳定了样品,但无石墨烯涂层的干中样品也非常稳定。

图1:在硅微芯片和 HER2 的 SiN 窗口上进行细胞播种。(A) 在微芯片上播种后 5 分钟,具有 SKBR3 细胞的 SiN 窗口区域的模拟图像。(B) 相同的细胞在播种后 24 小时 ( C )SKBR3细胞在 Si 微芯片上 5 分钟后在同一 SiN 窗口上传播。(D) 24小时后(C)中的细胞相同。细胞没有正确扁平化,因为种子片上的细胞太多。(E) 播种后5分钟在微芯片上的细胞。(F) 窗口上只可见的细胞很少,因为微芯片上播种的细胞太少。(G) HER2 QD标记后同一SKBR3细胞的DIC图像。(H) DIC 的叠加图像和标记的 SKBR3 细胞的相应荧光图像与 HER2-QD655(假彩色黄色)。 请单击此处查看此图的较大版本。
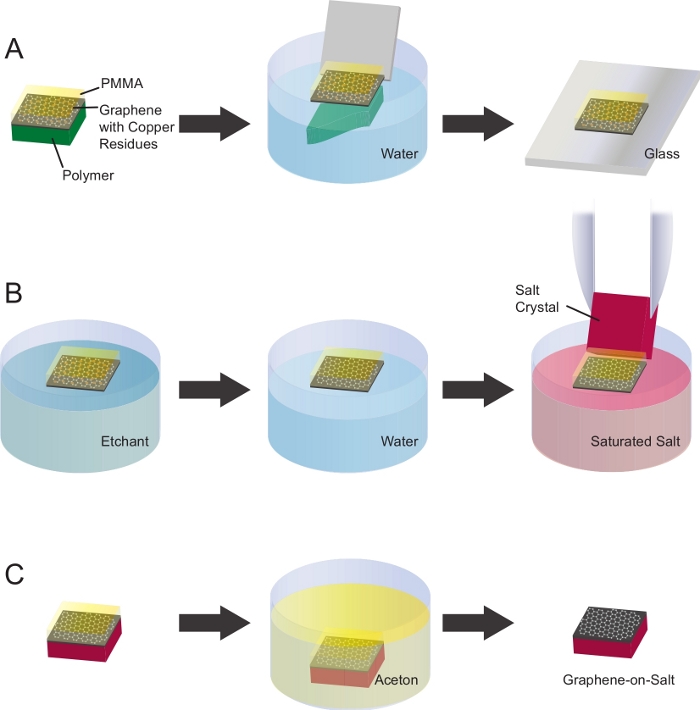
图2:将石墨烯清洗并转移到NaCl晶体上。(A) PMMA-石墨烯对聚合物浸入纯净水中释放PMMA石墨烯。PMMA 石墨烯可以用玻璃滑梯抓住。(B) 铜基污染是使用硫酸钠溶液蚀刻的。为了清洁石墨烯,它被转移到一个烧杯中含有去维化水。这些步骤重复了 3 次。然后,PMMA-石墨烯被转移到纯水中的NaCl饱和溶液中。NaCl晶体被用来从盐溶液中拾取石墨烯。(C) NaCl晶体上的PMMA石墨烯在室温下干燥了30分钟。Pmma 被用丙酮孵育 30 分钟 , 请点击这里查看这个数字的较大版本。
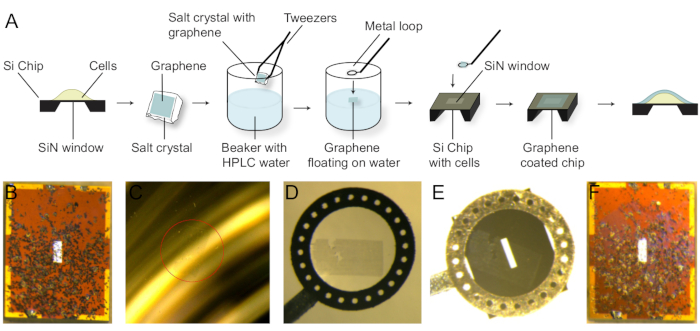
图3:在Si微芯片上播种的细胞的石墨烯涂层。(A) 石墨烯涂层程序。NaCl晶体上的石墨烯被释放到水面上。然后用金属环捕获石墨烯片,并转移到Si微芯片上。(B) 微芯片 (2.0 x 2.6 mm),尺寸为 400 x 160 μm,无石墨烯。SKBR3细胞是可见的黑点。(C) 石墨烯(红圈)漂浮在装满水的烧杯表面。(D) 石墨烯被金属环捕获。(E) 附着在水滴上的微芯片,使石墨烯在SiN窗口的顶部。(F) 石墨烯涂层后微芯片。石墨烯是可见的紫色微光。 请单击此处查看此图的较大版本。

图4:SiN窗口上石墨烯涂层和非涂层SKBR3细胞的STEM。(A) 在 M = 800x. (B)在 M = 800x. ( C ) M C= 80,000x 图像时在 A. 黄线中蓝色矩形的位置记录的未涂涂样品的 STEM 图像。(D) M = 80,000x 图像记录在 B 中的蓝色矩形位置。(E) M = 50,000x 图像的相同区域 C 暴露在D = (7.8±0.4) x 103 e-/=2。(F) M = 50,000x 图像,与 D 相同,并暴露在D = (7.8±0.4) x 103 e-/=2。 D暴露的区域清晰可见。(G) 石墨烯涂层样品的衍射模式,来自无细胞区域。石墨烯的六倍对称性是可见的亮点。(H) 样品的衍射模式,无石墨烯,无6倍亮点。请单击此处查看此图的较大版本。
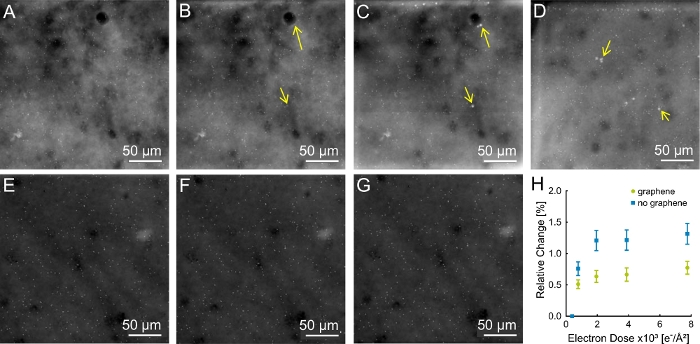
图5:样品上没有石墨烯涂层的伪影。(A) 样品上无石墨烯涂层的第一图像,在 M = 80,000x 时获得,并暴露在D = (0.39 = 0.02) x 102 e-/=2。(B) 具有 D = (1.94 = 0.1) x 103 e-/=2(黄色箭头)中出现的第一个伪影的图像。 D(C, D)该系列的最后一张图像是D = (7.8 = 0.4) x 103 e- /=2。文物是可见的亮点。(E-G)石墨烯涂层样品,无产生伪影。(2E) D D = (0.39 = 0.02) x 102 e-/=2 (F) D = (1.94 = 0.1) x 103 -e-3 /=2 。(H) 石墨烯涂层和非涂层样品的颗粒距离相对变化。分析了两个显示伪像的非涂层样品,其中一个显示在 (A-C) 中,最后一个样品在 D 中的最后一个图像,以及三个涂层样品(一个显示在 E-G 中)。总共对每个样本检查了10个QD对,距离在250纳米和3μm之间。相对变化反映一个组中所有测量值的平均值。请单击此处查看此图的较大版本。
补充表1:解决方案和缓冲区的配方。请点击这里下载此表。
讨论
为了更好地了解蛋白质功能,获得有关完整细胞血浆膜中蛋白质位置的信息非常重要。获取此信息的方法包括超分辨率荧光显微镜1,2。1,虽然超分辨率显微镜在过去几年中进一步发展,但其分辨率仍限制在20纳米(用于细胞实验的实际条件下),而典型的受体蛋白的尺寸在1-10纳米之间。在单细胞和单分子水平上对蛋白质进行成像,具有足够的分辨率来可视化蛋白质,这一点在EM中是可能的。但由于分段,传统的EM方法通常不会使细胞完好无损,这导致血浆膜中蛋白质的上下文和空间分布的重要信息丢失。研制出全细胞低温-TEM方法,将蛋白质标签与低温-EM27相结合是可行的,也证明了冷冻-STEM28。27然而,低温EM工作流程是为研究细胞超结构和蛋白质结构而优化的,而对于分析膜蛋白空间分布则不至于如此。临界点干燥是另一种整芯制备方法,但样品要经过几个干燥步骤,而且技术非常耗时。膜蛋白也通过冻结断裂7进行了检查。在此方法中,细胞是固定的、冻结的和断裂的。断裂部分由碳层和铂层复制,生物样品被移除。然后可以使用 EM30 分析副本。全细胞分析不可能与冻结分数,因为有关蛋白质在膜中整个细胞的上下文中分布的信息丢失。
这里介绍的方法允许研究细胞膜,而无需薄片标本9,9,31。细胞完好无损,因此膜蛋白的定位从荧光图像中可见,荧光图像与EM图像相关。使用这种石墨烯外壳方法9,使用QD标记蛋白的STEM,在水合状态下完整细胞内的单细胞和单分子水平上研究蛋白质是可能的。保持细胞处于原生状态至关重要,因为它保留了膜蛋白的空间分布,因此在单细胞和单分子水平上可以进行分析,这对理解蛋白质功能和开发治疗新方法非常重要。
使用EM成像生物样品的另一个关键方面是电子束对样品的辐射损伤。解决方案通常包括尽可能减少电子剂量或各种涂层方法,例如将样品封装在薄层碳32之间。我们的方法表明,石墨烯涂层可减少非涂层样品在细胞表面出现的光束诱导伪影。在电子束照射下,可检测化学固定的石墨烯涂层生物样品,在200 keV光束能量高达D=(7.8±0.4)x 103 e- D /=2下,样品上出现无辐射损伤,如亮点。与其他涉及精细样品制备的 EM 方法(例如染色、嵌入、(低温)切节、压裂等)相比,此处描述的方法不太耗时。蛋白质的标签在几个小时内完成,而石墨烯涂层只需要大约15分钟的训练有素的研究人员。样品制备与荧光显微镜所需的程序相当。
可以通过某些步骤修改协议。微芯片上的石墨烯也可以风干,以确保石墨烯在用滤纸擦去时不会移动。如果石墨烯被盐污染,可以让它漂浮在水面上约一个小时,溶解盐,从而尽量减少污染。通过延长协议中的相应蚀刻步骤,可减少石墨烯上发生的铜或PMMA污染。其他石墨烯涂层方法已经描述,例如,石墨烯-PMMA直接沉积在细胞上,PMMA被去除后用丙酮洗涤33。在我们的方法中,PMMA 在涂装前被去除,以避免额外的丙酮洗涤步骤对细胞造成任何可能的损坏。NaCl之所以被选为基材,是因为它是平的,所以它不会使石墨烯起皱,它溶解在水中释放石墨烯9。此外,它可以切成所需的尺寸,石墨烯上没有残留的基板残留物。但考虑到这些标准,其他基质,如氯化钾也可以使用。
为了减少潜在的标签诱导聚类的机会,GA固定步骤可以在FA固定后直接实施,之后所有膜蛋白都固定。FA的第一个固定步骤已经固定了生物结构,但膜蛋白扩散水平可能仍然降低34,可能导致标签诱导聚类,由于存在多个Streptavidin每个QD。与GA的固定可能导致在LM期间出现自荧光信号,因此,在所述协议中的LM之后完成,但可以像其他地方描述的那样减少。仙人掌缓冲液是相当有毒的,和其他固定剂也可以使用,但卡迪酸酯是在这里使用,因为它是一个常用的缓冲器的EM协议,避免沉淀,防止细菌和真菌的生长,并兼容钙离子,需要保持脂质膜的超结构完整性35。如果需要,可用作稳定脂质的附加固定剂。这将有助于增强细胞结构的对比度,但也为系统添加另一种金属,并减少在QD上获得的对比度。
此处描述的协议包含许多需要良好指令的步骤。在操作微芯片之前需要进行一些培训,以避免刮伤微芯片的 SiN 表面并防止破损。如前所述,建议在重复项中准备微芯片,因为 SiN 窗口可能会不时中断。在微芯片上获得所需数量的细胞也需要一些经验。用石墨烯涂覆细胞需要一些训练,因为很难找到合适的倾斜角度将石墨烯漂浮在水面上。当从水中捕获石墨烯时,可能也很难看到薄石墨烯。一旦石墨烯在微芯片上,多余的水需要用滤纸来抹掉。这只能用滤纸的尖端完成,以避免从微芯片上去除石墨烯。
石墨烯涂层防止伪影出现在样品上。但对于 D < 4 x 102 e-/=2, 非涂层样品也没有出现伪影,并且只出现 2 个非涂层样品的伪影。因此,检查非涂层细胞似乎也是可能的,虽然最好使用石墨烯,避免神器形成的风险。这些工件的组成可以在未来进行分析,以给出如何防止其形成的提示。关于细胞的结构稳定性,只观察到石墨烯涂层的轻微改善。固定细胞显然稳定在检查的薄区域,其结构靠近SiN膜。然而,我们在这里没有检查的是干燥工件,已知在接触真空4时,细胞样本会发生。细胞干燥会导致细胞收缩,因此 QD 距离也会因此而变化。对于此处使用的电子剂量,石墨烯涂层和非涂层样品的QD距离保持稳定。需要进一步研究石墨烯涂层对EM细胞的影响。
这种方法的一个局限性是,细胞的化学固定是必要的;因此,不能进行活细胞实验。但是,在不需要标记和具有较高结构稳定性的细胞,例如细菌,然后未固定细胞可以封闭在石墨烯EM36, 尽管具有不同的电子剂量耐受性。此外,蛋白质是不能直接检测的,因此需要QD来可视化蛋白质。该方法将受益于较小的标签。讨论的一个点是,超结构不能清晰可见是好是坏。我们的方法类似于荧光显微镜,只有选定的蛋白质是可见的37。增加超结构的可见性也会为图像添加更多信息,然后在某些时候阻止检测各个标签位置。此外,这里描述的方法是一个蛋白质物种,并且需要增加协议,以便能够标记多种蛋白质。最后,当一个小的高亲和力特异性特异性分子,如抗体模仿21 或纳米体38 可用时,该方法有效。常用的抗体要大得多,会阻止蛋白质亚基进入寡聚物的功能状态检测。
我们的方法可用于使用EM研究整个细胞的蛋白质功能,同时保持细胞处于水合状态。检查一系列细胞是很容易的。其他类型的细胞和蛋白质也可以研究。如果不需要蛋白质标记,协议的子集可用于各种生物标本的石墨烯涂层。研究整个细胞的能力与细胞研究有关,以理解分子水平上膜蛋白功能的相关性。
披露声明
作者没有什么可透露的。
致谢
我们感谢D.B.佩基斯对细胞培养协议的帮助,F.温伯格审阅手稿,T.Trampert帮助实验和数字,S.斯莫尔卡帮助的数字,和E.Arzt通过INM的支持。这项研究由埃塞·克雷纳-弗雷塞纽斯-斯蒂夫通资助。
材料
| Name | Company | Catalog Number | Comments |
| Acetone for HPLC (min. 99.8 %) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 2626-1L | |
| AL54 analytical balance | Mettler-Toledo GmbH, Giessen, Germany | 30029077 | |
| Albumin Fraction V, biotin-free, ≥ 98 %, for molecular biology | Carl Roth GmbH + Co KG, Karlsruhe, Germany | 0163.2 | |
| Anti-HER2 Affibody Molecule, biotin conjugated 20 µM | Affibody, Solna, Sweden | 10.0817.02.0001 | |
| atomic resolution analytical microscope JEM-ARM200F | JEOL (Germany) GmbH, Freising, Germany | ||
| Boric Acid | Sigma-Aldrich, Merck, Darmstadt, Germany | B6768-500G | |
| Cacodylic acid sodium salt trihydrate ≥ 98 % | Carl Roth GmbH + Co KG, Karlsruhe, Germany | 5169.1 | |
| Cell Culture Flasks, PS, treated, sterile, Filter screw cap 50ml | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696781 | |
| Cell Culture Flasks, PS, treated, sterile, Filter screw cap 250ml | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696782 | |
| Cell Culture Multiwell plates, treated, 24-well | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696792 | |
| Cell Culture Multiwell plates, treated, 96-well | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696794 | |
| CELLSTAR Cell Culture Flasks TC treated, 250 ml | Greiner Bio-One GmbH, Frickenhausen, Germany | 658170 | |
| CELLSTAR Cell Culture Multiwell Plates 96-well | Greiner Bio-One GmbH, Frickenhausen, Germany | 655180 | |
| CELLSTAR Centrifuge Tubes 15 ml sterile | Greiner Bio-One GmbH, Frickenhausen, Germany | 188271 | |
| CELLview cell culture dish, PS, 35/10mm, glass bottom, 1 compartment | Greiner Bio-One GmbH, Frickenhausen, Germany | 627861 | |
| Centrifuge 5418 | Eppendorf, Wesseling-Berzdorf, Germany | 5401000010 | |
| Centrifuge Tubes 50 ml sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696705 | |
| Corning CellStripper non-enzymatic cell dissociation solution | Corning, NY, USA | 25-056-CI | |
| D(+)-Saccharose min. 99,7 %, powdered | Th. Geyer GmbH + Co. KG, Renningen, Germany | 9286.1 | |
| Disposable Hemocytometer C-Chip Neubauer improved | Carl Roth GmbH + Co KG, Karlsruhe, Germany | PK36.1 | |
| Easypet | Eppendorf, Wesseling-Berzdorf, Germany | 4430000018 | |
| Eppendorf Research plus pipettes variable, 0.1 - 2.5 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000012 | |
| Eppendorf Research plus pipette variable, 2 -20 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000039 | |
| Eppendorf Research plus pipette variable, 10 - 100 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000047 | |
| Eppendorf Research plus pipette variable, 100 - 1000 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000063 | |
| Ethanol absolute for HPLC (min. 99.9 %) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 2222-1L | |
| Fibronectin-like engineered protein*poly mer-plus | Th. Geyer GmbH + Co. KG, Renningen, Germany | F8141 | |
| Fluorescence Microscope Leica DMI6000 | Leica Microsystems GmbH, Wetzlar, Germany | ||
| Gibco Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | FisherScientific, Hampton, NH, USA | 31966021 | |
| Gibco Fetal Calf Serum (FCS) | FisherScientific, Hampton, NH, USA | 10099141 | lot number: 1751893 |
| Gibco Goat Serum, New Zealand origin | FisherScientific, Hampton, NH, USA | 16210064 | lot number: 1788320 |
| Gibco Phosphate buffered saline (PBS), pH 7.4 | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Galaxy 48R CO2 Incubator | New Brunswick, Eppendorf, Wesseling-Berzdorf, Germany | CO48310001 | |
| Gatan Model 950 Solarus— Plasma Cleaner | Gatan GmbH, München, Germany | ||
| Glutaraldehyde solution Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative | Sigma-Aldrich, Merck, Darmstadt, Germany | G5882 | |
| Glycine ≥ 98.5 % Ph.Eur., USP, BP | Carl Roth GmbH + Co KG, Karlsruhe, Germany | T873.1 | |
| Inverted Laboratory Microscope Leica DM IL LED | Leica Microsystems GmbH, Wetzlar, Germany | DM IL LED | |
| Hot plate | Heidolph Instruments GmbH & CO. KG, Schwabach, Germany | MR 3002 | |
| MEM non-essential Aminoacids (NEAAs) 100x W/O L-Glutamine | Biowest, Nuaillé, France | X0557-100 | |
| Microscope glass slides 76 mm x 26 mm | DWK Life Sciences GmbH, Wertheim/Main | ||
| micro tubes (1.5 ml, 2 ml) non-sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 1.5 ml: 7696751, 2 ml: 7696752 | |
| MSc-Advantage— Class II Biological Safety Cabinet | ThermoFisher Scientific, Waltham, USA | ||
| Ocean Microchips SiN window 400x150 µm, 200 nm spacer | DENSsolutions, Delft, The Netherlands | ||
| Omnifix Single-use syringe Luer Lock Solo (10 ml, 20 ml, 50 ml) | B. Braun Melsungen AG, Melsungen, Germany | 10 mL: C542.1 20 ml: T550.1 | purchased via Carl Roth GmbH&Co. KG, Karlsruhe |
| Oven | Memmert GmbH + Co. KG, Schwabach, Germany | VO 200 | |
| Parafilm | VWR, Darmstadt, Germany | #291-0057 | |
| Paraformaldehyde 16 % solution, EM grade | Electron Microscopy Sciences, Hatfield, PA, USA | 15710 | |
| Perfekt-Kescher with handle | Plano GmbH, Wetzlar, Germany | T5112 | |
| Pipette tips with aerosol barrier in racks, non-sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 2-200µl: 7695892 | |
| Pipette tips with aerosol barrier in racks, sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 0.1-10 µl: 7695880 2-100 µl: 7695883 100-1000 µl: 7695886 1250 µl XL: 7695887 | |
| Poly-L-Lysine 0.01 % solution mol.WT.70.000 - 150.000 | Th. Geyer GmbH + Co. KG, Renningen, Germany | P4707 | |
| Qdot 655 Streptavidin Conjugate 1 µM | Invitrogen, ThermoFisher Scientific, Waltham, MA, USA | Q10121MP | |
| Razor blade, Gem Uncoated 3 Facet, Steel Back, Degreased | Personna, AccuTec Blades, Verona, VA, USA | 94-0451 | |
| round filter paper, ashless, Grade 589/3 blue ribbon, diam. 150mm | Schleicher & Schuell, Dassel, Germany | 300212 | |
| Routine stereo Microscope Leica M60 | Leica Microsystems GmbH, Wetzlar, Germany | M60 | |
| Serological ROTILABO pipettes, sterile (1 ml, 2 ml, 10 ml) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 1 ml: N231.1 2 ml: N236.1 10 ml: ET30.1 | |
| Serological pipettes, sterile, (1 ml, 2 ml, 10ml) | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 1ml: 7695550 2ml: 7695551 10ml: 7695553 | |
| Serological pipettes, sterile, (5 ml, 25 ml, 50 ml) | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 5 mL: 7695552 25ml: 7695554 50ml: 7695555 | |
| Shaking water bath SW22 | Julabo GmbH, Seelbach, Germany | 9550322 | |
| Sodium chloride | Carl Roth GmbH + Co KG, Karlsruhe, Germany | HN00.1 | |
| Sodium chloride crystals, cleaved 12 mm x 12 mm x 0.5-1 mm | International Crystal Laboratories, Garfield, NJ, USA | 9750 | |
| Sodium tetraborate decahydrate, ACS reagent, ≥ 99.5 % | Sigma-Aldrich, Merck, Darmstadt, Germany | S9640-500G | |
| Sodium persulfate | carl Roth GmbH + Co KG, Karlsruhe, Germany | 4365.2 | |
| syringe filters ROTILABO PES, sterile 0.22 µm | Carl Roth GmbH + Co KG, Karlsruhe, Germany | P668.1 | |
| Trivial Transfer Graphene 3-5layers, 1 cm x 1 cm | ACS material, Pasadena, CA, USA | TTG30011 | |
| Tweezers Dumoxel 03 | Manufactures D’Outils Dumont SA, Montignez, Switzerland | 0103-7-PO | |
| Tweezers Inox 02 | Manufactures D’Outils Dumont SA, Montignez, Switzerland | 0102-7-PO | |
| Tweezers, plastic replaceable tip | Ideal-tek SA, Balerna, Switzerland | 5SVR.SA | |
| Water ROTISOLV HPLC gradient grade | Carl Roth GmbH + Co KG, Karlsruhe, Germany | A511.2 |
参考文献
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Williams, D. B., Carter, C. B. The Transmission Electron Microscope. , Springer. (2009).
- Bozzola, J. J., Russell, L. D. Electron Microscopy Principles and Techniques for Biologists. , Jones and Barlett Publishers. (1999).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Lucic, V., Leis, A., Baumeister, W. Cryo-electron tomography of cells: connecting structure and function. Histochemistry and Cell Biology. 130 (2), 185-196 (2008).
- Carson, J. L. Fundamental technical elements of freeze-fracture/freeze-etch in biological electron microscopy. Journal of Visualized Experiments. (91), e51694(2014).
- Nishiyama, H., et al. Atmospheric scanning electron microscope observes cells and tissues in open medium through silicon nitride film. Journal of Structural Biology. 169 (3), 438-449 (2010).
- Dahmke, I. N., et al. Graphene Liquid Enclosure for Single-Molecule Analysis of Membrane Proteins in Whole Cells Using Electron Microscopy. ACS Nano. 11 (11), 11108-11117 (2017).
- Maruyama, Y., Ebihara, T., Nishiyama, H., Suga, M., Sato, C. Immuno EM-OM correlative microscopy in solution by atmospheric scanning electron microscopy (ASEM). Journal of Structural Biology. 180 (2), 259-270 (2012).
- Kinoshita, T., et al. Immuno-electron microscopy of primary cell cultures from genetically modified animals in liquid by atmospheric scanning electron microscopy. Microscopy and Microanalysis. 20 (2), 469-483 (2014).
- Hauwiller, M. R., Ondry, J. C., Alivisatos, A. P. Using graphene liquid cell transmission electron microscopy to study in situ nanocrystal etching. Journal of Visualized Experiments. (135), e57665(2018).
- Cho, H., et al. The Use of Graphene and Its Derivatives for Liquid-Phase Transmission Electron Microscopy of Radiation-Sensitive Specimens. Nano Letters. 17 (1), 414-420 (2017).
- Meng, F., et al. Graphene-Based Fibers: A Review. Advanced Materials. 27 (35), 5113-5131 (2015).
- Sun, P. Z., et al. Limits on gas impermeability of graphene. Nature. 579 (7798), 229-232 (2020).
- Kato, R., et al. High-precision thickness control of ice layer on CVD grown bilayer graphene for cryo-TEM. Carbon. 160, 107-112 (2020).
- Keskin, S., de Jonge, N. Reduced Radiation Damage in Transmission Electron Microscopy of Proteins in Graphene Liquid Cells. Nano Letters. 18 (12), 7435-7440 (2018).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nature Methods. 2, 743-749 (2005).
- Ring, E. A., Peckys, D. B., Dukes, M. J., Baudoin, J. P., de Jonge, N. Silicon nitride windows for electron microscopy of whole cells. Journal of Microscopy. 243 (3), 273-283 (2011).
- Peckys, D. B., Korf, U., de Jonge, N. Local variations of HER2 dimerization in breast cancer cells discovered by correlative fluorescence and liquid electron microscopy. Science Advances. 1 (6), 1500165(2015).
- Eigenbrot, C., Ultsch, M., Dubnovitsky, A., Abrahmsen, L., Hard, T. Structural basis for high-affinity HER2 receptor binding by an engineered protein. Proceedings of the National Academy of Sciences of the United States of America. 107 (34), 15039-15044 (2010).
- Textor, M., de Jonge, N. Strategies for Preparing Graphene Liquid Cells for Transmission Electron Microscopy. Nano Letters. 18, 3313-3321 (2018).
- Henjes, F., et al. Strong EGFR signaling in cell line models of ERBB2-amplified breast cancer attenuates response towards ERBB2-targeting drugs. Oncogenesis. 1, 16(2012).
- Peckys, D. B., de Jonge, N. Studying the Stoichiometry of Epidermal Growth Factor Receptor in Intact Cells using Correlative Microscopy. Journal of Visualized Experiments. (103), e53186(2015).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology. Cell Physiology. 301 (2), 272-279 (2011).
- Kohl, H., Reimer, L. Transmission electron microscopy: physics of image formation. , Springer. (2008).
- Yi, H., et al. Native immunogold labeling of cell surface proteins and viral glycoproteins for cryo-electron microscopy and cryo-electron tomography applications. Journal of Histochemistry and Cytochemistry. 63 (10), 780-792 (2015).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of vitrified cells. Nature Methods. 11 (4), 423-428 (2014).
- Dukes, M. J., Ramachandra, R., Baudoin, J. P., Jerome, W. G., de Jonge, N. Three-dimensional locations of gold-labeled proteins in a whole mount eukaryotic cell obtained with 3 nm precision using aberration-corrected scanning transmission electron microscopy. Journal of Structural Biology. 174, 552-562 (2011).
- Meier, C., Beckmann, A. Freeze fracture: new avenues for the ultrastructural analysis of cells in vitro. Histochemistry and Cell Biology. 149 (1), 3-13 (2018).
- Peckys, D. B., de Jonge, N. Liquid scanning transmission electron microscopy: imaging protein complexes in their native environment in whole eukaryotic cells. Microscopy and Microanalysis. 20 (2), 346-365 (2014).
- Egerton, R. F. Control of radiation damage in the TEM. Ultramicroscopy. 127, 100-108 (2013).
- Wojcik, M., Hauser, M., Li, W., Moon, S., Xu, K. Graphene-enabled electron microscopy and correlated super-resolution microscopy of wet cells. Nature Communications. 6, 7384(2015).
- Huebinger, J., Spindler, J., Holl, K. J., Koos, B. Quantification of protein mobility and associated reshuffling of cytoplasm during chemical fixation. Scientific Reports. 8 (1), 17756(2018).
- Glauert, A. M., Lewis, P. R. Biological specimen preparation for transmission electron microscopy. , Princeton University Press. (2014).
- Koo, K., Dae, K. S., Hahn, Y. K., Yuk, J. M. Live Cell Electron Microscopy Using Graphene Veils. Nano Letters. 20 (6), 4708-4713 (2020).
- Pawley, J. B. Handbook of biological confocal microscopy, 2 edn. , Springer. (1995).
- Chung, I., et al. Spatial control of EGF receptor activation by reversible dimerization on living cells. Nature. 464 (7289), 783-787 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。