Method Article
Sıvı Fazlı Elektron Mikroskobu için Kimyasal Olarak Sabit Memeli Hücrelerinin Grafen Muhafazası
Bu Makalede
Özet
Burada sunulan memeli hücrelerde membran proteinleri etiketleme ve sıvı faz lı iletim elektron mikroskopisi için grafen ile örnek kaplama için bir protokoldür. Örneklerin radyasyonun neden olduğu hasara karşı stabilitesi de bu protokol ile incelenebilir.
Özet
Taramalı iletim elektron mikroskobu (STEM) kullanılarak meme kanseri hücrelerinin bozulmamış plazma zarında insan epidermal büyüme faktörü reseptörü 2 (HER2) araştırmak için bir protokol tanımlanmıştır. Memeli meme kanseri hücre hattı SKBR3 hücreleri silikon nitrür (SiN) pencereler ile silikon mikroçipler üzerinde büyüdü. Hücreler kimyasal olarak sabitlendi ve HER2 proteinleri iki aşamalı biotin-streptavidin bağlama protokolü kullanılarak kuantum nokta nano partikülleri (QDs) ile etiketlendi. Hücreler sulu bir durumu korumak ve STEM sırasında elektron ışını hasarından korumak için çok katmanlı grafen ile kaplandı. Elektron ışını ışınlaması altındaki örneklerin stabilitesini incelemek için bir doz serisi deney yapıldı. Grafen kaplamalı ve kaplamasız numuneler karşılaştırıldı. Işın kaynaklı hasar, parlak eserler şeklinde, artan elektron dozu Dbazı kaplamasız örnekler için ortaya çıktı , hiçbir eserler kaplamalı örnekler üzerinde ortaya çıkarken.
Giriş
Membran protein fonksiyonunun analizi hücre biyolojik araştırmaları ve ilaç gelişimi için gereklidir. Önemli deneyler sınıfı hücrelerdeki membran protein pozisyonlarının incelenmesini içerir. Bu bilgiler, protein komplekslerindeki proteinlerin biraraya gelip plazma zarındaki belirli konumları hakkında sonuçlar elde etmek için kullanılabilir, bu da dinamik montaj ve sökme yoluyla çok çeşitli hücresel fonksiyonları yönlendirir. Diğer tekniklerin yanı sıra, hücrelerdeki protein fonksiyonlarının incelenmesinde ışık mikroskobu (LM) ve elektron mikroskobu (EM) kullanılmaktadır. LM sıvı tüm hücrelerin analizini sağlar; ancak, çözünürlük 200-300 nm konvansiyonel ve 20 nm kadar pratik koşullar altında süper çözünürlüklü floresan mikroskopi için sınırlıdır1,2. EM yaklaşık 1 şçözünürlükleri 3sağlar, ancak geleneksel numune hazırlama dehidratasyon gerektirir, görüntü kontrastı artırmak için metal boyama, ve reçin gibi bir montaj maddesi gömme, iletim elektron mikroskobu için (TEM)4. Biyolojik numuneleri daha yerli benzeri bir ortamda korumak için kriyo-EM teknikleri5,6olarak kullanılabilir. Örnekler hızla amorf buza dondurulur ve gerekirse kesitlenir. Başka bir seçenek donma-em7kırma olduğunu.
Kendi yerli, sıvı durumda bozulmamış hücreler içinde membran proteinleri incelenmesi için EM teknikleri son on yılda ortaya çıkmıştır8,9,10,11. Bir SiN membran üzerinde yetişen ve grafen9tabakası ile çevrili tüm hücrelerde kuantum nokta (QD) etiketli membran proteinleri üzerinde 2 nm'lik bir mekansal çözünürlük elde edilmiştir.
Burada protein etiketleme ve grafen kaplama protokolünün ayrıntıları9,12 açıklanmıştır. Bu protokolün amacı, her2'nin bütün, sabit hücrelerin zarındaki mekansal dağılımını analiz etmek ve hücreleri sulu bir durumda korumaktır. Grafen ile kaplama vakum hücrelerinin kurumasını önler, ve aynı zamanda radyasyon hasarı azaltır13. Bu yöntem bozulmamış plazma membran içinde etiketli membran proteinleri hakkında bilgi sağlar, ancak bu yöntem genellikle EM ile yapıldığı gibi hücresel ultrayapının incelenmesinde yararlı değildir.
Grafen bilinen en ince nanomalzeme, ve tek bir karbon atomu kalın kristal levha bir petek kafes14düzenlenmiş oluşur. Yüksek esneklik ve mekanik mukavemet gibi benzersiz özelliklere sahiptir. Son araştırmalar, hatasız grafenin gazlar ve sıvılar için geçirimsiz olduğunu göstermiştir, ancak kusurlar hidrojen geçirgenliği15sağlar. Bu sızıntı burada kullanıldığı gibi çok katmanlı grafen kullanılarak azaltılabilir. Bilayer grafen son zamanlarda kriyo-EM örnekleri için bir destek olarak yararlı olduğu gösterilmiştir, sadece tekdüze olmayan katmanları oluşturulabilir grafen oksit ile karşılaştırıldığında ince buz tabakasının homojenliğini artırmak16. Grafen de sıvı faz iletim elektron mikroskobu 13 sırasında biyolojik örneklerin ışın hasarı azaltmak için gösterilmiştir13,17. Örnek bir deney olarak, HER2 memeli meme kanseri hücre hattı SKBR3 ifade QDs18 ile etiketlendi ve mekansal dağılımı STEM kullanılarak kaydedildi. Hücreler elektron şeffaf SiN membran19ile bir Si mikroçip üzerinde tohumlu edildi. Mikroçipler sağlam, LM ve EM ile uyumlu olduğu için destek olarak seçilmiştir ve tüm etiketleme işlemi doğrudan mikroçip19üzerinde gerçekleştirilebilir. Hücre eki sonra, HER2 iki adımlı etiketleme protokolü20ile etiketlendi. İlk olarak, bir biyotinylated anti-HER2 antikor mimetik bileşik21 HER2 bağlıydı. Hücreler daha sonra kimyasal etiket kaynaklı reseptör kümelenmeönlemek için sabit, ve hücresel ultrayapının istikrarını artırmak için. Streptavidin kaplı QD'lar daha sonra HER2 antikor mimetik kompleksine bağlandı. Parlak floresan sinyali ve QD'lerin elektron yoğun çekirdeği, korgöreceli floresan ve elektron mikroskobu (CLEM) 20.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.00020 KÖK analizi için hücresel ilgi bölgeleri hücrelerde HER2 lokalizasyonunu vurgulayan genel floresan mikroskopi görüntülerinden seçilebildiği için CLEM özellikle yararlıdır. Hücreler floresan mikroskopi ile yüksek HER2 düzeylerine sahip hücresel bölgeleri belirlemek için analiz edildi. Bundan sonra, grafen 3-5 kat kalınlığında levha kaplama için hücrelere transfer edildi9,22. Daha sonra, numune bir EM numune tutucuya monte edildi. KÖK verileri, her2'nin hücre yüzeyindeki mekansal dağılımı hakkında bilgi veren, ancak hücrenin ultrayapısı hakkında bilgi veren anüler karanlık alan (ADF) dedektörü kullanılarak elde edildi. Elektron ışını ışınlaması altında numunenin stabilitesini belirlemek için, örnekler bir görüntü serisinde artan dozda(D)incelenmiştir. Grafen kaplı ve kaplamasız numuneler arasındaki fark araştırıldı. Çeşitli radyasyon hasarı değerlendirildi.
Burada açıklanan protokol HER2 her2 aşırı ifade memeli meme kanseri hücre hattı SKBR3 HER223hedeflemek için bir model sistemi olarak kullanır. Protokol, grafen kaplı bir numunenin hazırlanmasını ve benzer bir numunenin ancak karşılaştırma için grafen kaplama içermeyen bir numunenin hazırlanmasını içerir. SiN penceresi her zaman bir kez kırılabileceğinden ve çoğu durumda deneysel bir yineleme elde edebileceğinden, deneme yinelenen olarak hazırlanır. Yöntemin genel verimi yüksektir, grafen kaplı hücrelere sahip mikroçipler genellikle istisnai bir hata ile elde edilir, ancak tüm SiN penceresi her durumda grafen ile kapsanabilir. Yinelenenler protokolde açıklanmaz.
Etiketleme protokolü (adım 1-5) daha önce24yayınlanan COS7 fibroblast hücrelerinde epidermal büyüme faktörü reseptörünün etiketleme protokolü ile karşılaştırılabilir; bu kağıttaki ayrıntılar mikroçiplerin işlenmesi ve kuyu plakalarının kullanımı ile ilgili olarak adlandırılır. Aşağıdaki protokol HER2, grafen kaplama9ve numunenin radyasyon toleransını incelemek için optimize edilmiştir.
Protokol
1. Poli-L-l-lizin (PLL) ve fibronektin benzeri protein (FLP) ile mikroçip lerin ve kaplamaların temizlenmesi
- 50 mL aseton içine SiN membranlı (2,0 x 2,6 mm) iki mikroçip yerleştirin. Mikroçipleri düz tarafı yukarı bakacak şekilde dikkatlice kullanın. Düz gagalı cımbız kullanarak kenarları kırmaktan kaçının. SiN penceresinin kırılmasını önlemek için cımbızla çalışırken mikroçiplerin üst yüzeyine dokunmaktan kaçının.
NOT: Mikroçiplerin zarar görmesini önlemek için politetrafloroetilen kaplamalı veya karbon ucu cımbızı da kullanılabilir. - Fişleri 2 dk boyunca dikkatlice sallayarak, mikroçiplerin takla atmasını izleyerek yıkayın.
- Mikroçipleri 50 mL etanol'a aktarın ve kabı dikkatlice sallayarak 2 dakika yıkayın. Aşırı aseton kurumaması için transferin hızlı olduğundan emin olun.
- Mikroçipleri 10 dakika boyunca 50 mL su ile yıkayın.
- Mikroçipleri 20 mL etanollük taze hazırlanmış bir kabın içine batırın.
- Mikroçipleri kurutmak için temiz oda dokusuna yerleştirin.
- Plazma 70 mTorr 11,5 sccm O2 ve 35 sccm Ar ve radyo frekansı (RF) 50 W hedef 5 dakika için mikroçipleri temizleyin.
- Steril hücre çalışması için mikroçipleri laminar akış kaputuna yerleştirin.
- Suda %0,01 PLL çözeltisi hazırlayın. Fosfat tamponlu salinde (PBS) 15 μg/mL FLP çözeltisi hazırlayın.
- Laminar akış kaputunun altında 24 kuyu luk bir plaka hazırlayın ve 5 kuyuyu aşağıdaki sırayla 1 mL'lik çözeltilerle ayrı ayrı doldurun: iyi 1 – PLL; iyi 2 – su; kuyu 3 – su; iyi 4 - FLP; iyi 5 - PBS ve iyi 6 - PBS.
NOT: Bir mikroçipi belirtilen 24 veya 96'ya cımbızla birkaç saniye liğine iyice batırarak yıkama adımlarını atın. Belirtilen zaman ve sıcaklık için belirtilen çözeltide 24 veya 96'daki mikroçipleri kuluçkaya yatırarak kuluçka adımlarını atın. Mikroçipleri birkaç saniye içinde başka bir kuyuya aktarın. - Mikroçipleri PLL çözeltisinde 5 dk kuluçkaya yatırın. Sonra iki kez suda mikroçipleri yıkayın.
- 5 dakika FLP mikroçipleri kuluçkaya yatırın. Daha sonra mikroçipleri Iki kez PBS'de yıkayın.
- Hücre tohumlama için 50 μL serumsuz ortamla doldurulmuş yeni bir 96 kuyu plakasının her iki mikroçipini de (her mikroçip için bir tane) kuyulara aktarın.
- Hücre süspansiyonu hazırlanana kadar mikroçipleri 37 °C ve %5 CO2'de kuluçkaya yatırın.
2. SiN membran mikroçipleri üzerinde tohumlama hücreleri
- Steril çalışmayı sağlamak için tüm malzeme ve ekipmanları laminar akış başlığında kurun.
- Bir kez büyüme ortamı ile bir hücre kültürü şişesinde meme kanseri hücre hattı, SKBR3 yıkayın. Büyüme aracı olarak %10 fetal buzağı serumu (FCS) ve %1 esansiyel olmayan amino asitler (NEA) içeren Dulbecco'nun modifiye kartal ortamını (DMEM) kullanın.
- Hücreler şişeden ayrılana kadar hücre ayırma çözeltisinin 1 mL'si ile hücreleri kuluçkaya yatırın.
- Şişedeki müstakil hücrelere 5 mL büyüme ortamı ekleyin. Bu süspansiyonu bir santrifüj tüpüne aktarın.
- Pipet 20 μL hücre süspansiyonu bir hemositometre içine hücre konsantrasyonu elde etmek için. Aşağıdaki formülü kullanın.
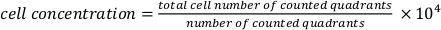 .
. - 2,5 x 105 hücre/mL'lik dağınık bir hücre süspansiyonu hazırlayın. Hazırlanan hücre süspansiyonunun gerekli miktarını şu şekilde hesaplayın:
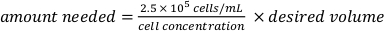
ve istenilen hacimde büyüme ortamı ile doldurun. - Her kuyuda 25.000 hücre içermesi için SiN membranı yukarı bakan PLL ve FLP kaplı mikroçipleri içeren 96 kuyunun iki kuyuya hücre süspansiyonunun 100 μL'sini ekleyin ve 50 μL serumsuz ortam ekleyin.
- Hücrelerin mikroçipe bağlanmasını beklemek için plakayı 37 °C ve %5 CO2'de 5 dakika kuluçkaya yatırın.
NOT: Bu noktada, hücreler henüz yapışmadıkları için mikroçipten ayırabilirler. - Ters mikroskopla mikroçipteki hücrelerin yoğunluğunu kontrol edin. Hücrelerin pencereyi düzleştirmek ve yapıştırmak için yeterli alana sahip olduğundan emin olun (Bkz. Şekil 1A).
NOT: Gerekirse bu noktada daha fazla hücre eklenebilir. - Mikroçipleri 200 μL büyüme ortamı içeren yeni kuyulara aktarın ve bir gecede 37 °C ve %5 CO2'de kuluçkaya yatırın.
- Ertesi günün öğleden sonra, hücreler düzleştirilmiş ve görsel olarak denetlenmiş bir kesişme (yani, hücrelerle kaplı pencere alanının fraksiyonu) yaklaşık 2 /3 (Şekil 1Bbakınız) bağlı varsa, serum içermeyen orta (serum açlık orta) her iki mikroçip aktarın. Farklı deneyler arasında karşılaştırma için gerekli olan hücreleri tanımlanmış bir başlangıç durumuna getirmek için gerektiği gibi serumsuz ortama geçiş25.
- Bir gecede 37 °C ve %5 CO2'de kuluçkaya yatırın.
NOT: Hücre miktarlarının diğer hücre hatları için büyüme hızlarına ve hücre morfolojisine göre farklılık olabileceğini unutmayın.
3. HER2 etiketleme ve fiksasyon
- Çözümleri Ek Tablo 1'deaçıklandığı şekilde hazırlayın.
- Steril çalışmayı sağlamak için laminar akış başlığıaltında çalışın. PBS/BSA, PBS/BSA/GS, antikor mimetik, PBS/BSA, PBS/BSA, PBS/BSA: Etiketleme plakası I çözümlerinin 200 μL'si ile mikroçip başına 6 kuyu doldurun. Mikroçip başına kuyu plakasının bir satırını (örneğin, A1'den A6'ya kadar) kullanın. Etiketleme plakasını 37 °C'ye ısıtın.
- Bir duman kaputunun altında, fiksasyon plakası olarak adlandırılan 24 kuyulu bir plaka hazırlayın ve mikroçip başına 8 kuyuyu fiksasyon plakası çözümlerinin 500 μL'si ile doldurun: CB, FA, CB, PBS, PBS, PBS/glisin, PBS/BSA.
DİkKAT: CB inhalasyon veya oral yutma ile akut toksik ve sular için tehlikelidir. Uygun koruma ile duman kaputu altında çalışın ve cb'yi güvenlik veri sayfasına (SDS) göre atın. FA aşındırıcı ve cilt ve sağlık için zararlıdır. Duman başlığı altında çalışın ve işleme ve bertaraf hakkında bilgi için SDS bakın. - II etiketi olarak adlandırılan 96 kuyuplakası hazırlayın ve mikroçip başına 4 kuyuyu, etiket plakası II çözeltilerinin 200 μL'si ile doldurun: QDs, PBS/BSA, PBS/BSA, PBS/BSA.
NOT: Burada, kuyularda mikroçipleri daha iyi görmek için 24 kuyu plakası kullanılır. Daha az antikor mimetik (adım 3.2) ve QDs (adım 3.4) kullanmak için, bu adımlar için 96 kuyu plakası kullanın.
- Hücrelerde HER2 etiketi.
- Bu plakalar hazır olduktan sonra, mikroçipleri plaka 1'in ilk sırasının kuyularına yerleştirerek etiketlemeye başlayın.
- Mikroçipleri PBS/BSA ile yıkayın.
- 37 °C'de 5 dakika pbs/BSA/GS ile kuluçkaya yatarak antikor mimetik spesifik olmayan bağlanmasını önlemek için spesifik olmayan bölgeleri engelleyin ve %5 CO2.
- 37 °C'de 10 dakika ve %5 CO2için 200 nM antikor mimtik ile inkübat.
- Mikroçipi PBS/BSA'da üç kez yıkayın.
- Hücreleri düzeltin.
- Mikroçipleri duman kaputundaki 24 kuyu fiksasyon plakasına aktarın.
NOT: Buradan steril bir çalışmaya gerek yoktur. - CB ile bir kez birkaç saniye yıkayın.
- Hücreleri 10 dakika boyunca %3 FA ile düzeltin.
- CB ile bir kez ve PBS ile üç kez yıkayın.
- 2 dakika pbs-glisin ile kuluçka tarafından FA blok ücretsiz aldehit grupları.
- Mikroçipleri PBS-BSA ile bir kez yıkayın.
- Mikroçipleri duman kaputundaki 24 kuyu fiksasyon plakasına aktarın.
- QD'leri takın.
- Mikroçipleri 96 kuyu etiketleme plakası II'ye taşıyın.
- 12 dakika boyunca 20 nM QDs ile kuluçka.
- Mikroçipleri PBS/BSA ile iki kez yıkayın.
- Mikroçipleri PBS/BSA içeren bir kuyuda saklayın.
4. Sabit hücrelerin ışık mikroskobu
- 2 mL PBS/BSA çözeltisi ile 3,5 cm çapında cam alt çanak hazırlayın.
- İlk mikroçipleri alın, baş aşağı (aşağı bakan hücreler) cam alt çanağa yerleştirin ve kabı floresan mikroskobuna yerleştirin. Hücrelerde hasar görmesini önlemek için mikroçipi sıvıya yavaşça indirin.
- 40x hedefi ve uygun floresan kanalı ile her mikroçipin diferansiyel girişim kontrastı (DIC) ve floresan görüntülerini edinin.
NOT: Burada QD655'i tespit etmek için 540-580 nm ve 607-683 nm dalga boyu bir uyarma dalga boyu kullanılır. - İkinci mikroçip için prosedürü tekrarlayın.
5. Fiksasyon sonrası
- Duman başlığı altında tüm adımları gerçekleştirin.
- 96 kuyu plakasının mikroçipi başına 6 kuyuyu fiksasyon sonrası çözümlerin 200 μL'si ile doldurun:
CB, GA, CB, PBS, PBS, PBS.
DİkKAT: GA sular için tehlikelidir, cilt, solunum sistemi ve gözler için zararlıdır. Duman başlığı altında çalışın ve işleme ve bertaraf hakkında bilgi için SDS bakın. - Her iki mikroçipi de kendi kuyularına yerleştirin.
- CB ile bir kez yıkayın.
- Hücreleri %2 GA ile 10 dakika boyunca düzeltin.
- CB ile bir kez yıkayın.
- PBS/BSA ile üç kez yıkayın.
NOT: FA ile ilk fiksasyon adımı biyolojik yapıyı düzeltir ancak zar protein difüzyonunun azaldığı bir düzey hala oluşabilir, bu da muhtemelen QD başına birden fazla streptavidin varlığı nedeniyle etiket indüklenen kümelenmeye yol açabilir. Bu nedenle, membrandaki proteinlerin yayılmasını en aza indirmek için FA fiksasyonundan GA'ya kadar deneysel adımların zamanını mümkün olduğunca kısa tutun. - Yeni bir kuyu plakasında grafen kaplama kadar 4 °C bakteri büyümesini önlemek için ozmotik şoklar ve% 0.02 sodyum azid (NaN3)önlemek için PBS / BSA saklayın. Kurumasını önlemek için parafin film ile iyi plaka mühür. Mikroçipler ve hücreler 4 °C'de depolandığında 2 haftaya kadar stabildir.
DİkKAT: NaN3 sular için tehlikeli dir ve oral yutma ile akut toksik, cilt ve solunum sistemi için. Duman başlığı altında çalışın ve işleme ve bertaraf hakkında bilgi için SDS bakın.
6. Grafenin tuz kristallerine aktarılması ve temizlenmesi
- PMMA-grafen-on-polimerden poli (metil metakrilat) (PMMA)-grafeni çıkarın(Şekil 2A).
- Pipet PMMA-grafen etrafında polimer üzerinde su damlacıkları.
NOT: PMMA-grafenin su yüzeyinde yüzerken destekleyici polimerden kolayca çıktığından emin olun. - PMMA-grafeni serbest bırakmak için PMMA-grafen-on-polimeri 30-45° açıyla suya daldırın.
NOT: Polimer sadece biraz ıslak olmalıdır. Polimer üzerinde çok fazla su pipetleme yukarı kaldıracak ve muhtemelen PMMA-grafen katlayın.
- Pipet PMMA-grafen etrafında polimer üzerinde su damlacıkları.
- Sodyum persülfat çözeltisi kullanan etch bakır bazlı kirleticiler (Şekil 2B).
NOT: Bakır folyo üzerinde yetiştirilen ticari grafen genellikle bakır etchant çözeltisi22ile çıkarılabilir alt mikrometre bakır artıkları içerir.- Suda 0,42 M sodyum persülfat50 mL çözelti hazırlayın.
- PMMA-grafeni standart bir cam kaydırak kullanarak grafen tarafı aşağı ile sodyum persülfat çözeltisine aktarın. PMMA-grafen çözeltinin üzerine yüzer.
- PMMA-grafeni bir gecede sodyum persülfat çözeltisinde bırakın.
- PMMA-grafeni sodyum persülfat çözeltisinden çıkarın ve cam bir kaydırak kullanarak temiz suyun üzerine yerleştirin. Yarım saat suda yüzsün.
- PMMA-grafentüm sodyum persülfat kalıntıları kaldırmak için önceki adımı üç kez toplam tekrarlayın.
- PMMA-grafeni sodyum klorür (NaCl) kristaline aktarın.
- Bir Petri kabında suda NaCl doymuş bir çözelti hazırlayın.
- NaCl çözeltisinin üstüne PMMA-grafeni grafen tarafı yla cam bir slayt kullanarak aşağı aktarın.
- Cımbızlı bir NaCl kristali tutun ve yüzen PMMA-grafeni toplayıp.
NOT: NaCl kristalinin boyutu, tuzun kenarındaki çıkıntılı grafenin katlanmasından veya grafenin cımbızla temas etmesini önlemek için PMMA-grafenin boyutundan biraz daha büyük olmalıdır. Bu deneylerde 12 mm x 12 mm x 0,5 mm'lik NaCl kristali 10 mm x 10 mm grafen levhanın toplanması ve daha sonra desteklenmesi için kullanılır. - PmMA-grafen-on-tuz dikey olarak 2 dakika için fazla su akışını sağlamak için tutun.
- PMMA-grafen-on-tuz oda sıcaklığında 30 dakika kuru ve tamamen su kaldırmak için 20 dakika 100 °C'de bir fırında pişirin.
- Aseton yıkama(Şekil 2C)kullanarak PMMA'yı çıkarın.
- Bir cam Petri kabında aseton önceden ısıtın ~ 50 ° C duman kaputunda bir ocak üzerinde. Yangından kaçınmak için sıcaklığı dikkatle izleyin.
- PMMA-grafen-on-tuz petri kabına aseton dolu batırın ve 30 dakika PMMA eritmek için bırakın.
- Önceki adımı yeni, temiz aseton ile toplam üç kez tekrarlayın.
- Numune hazırlama için kullanmadan önce grafen-on-salt hava-kuru izin verin.
7. Grafen Kaplama
NOT: Grafen kaplama prosedürü şematik olarak Şekil 3A'dagösterilmiştir.
- Sabit hücrelerle hazırlanan ve her2 etiketli bir mikroçipi tampondan tuz artıklarını temizlemek için saf suda yıkayın. Mikroçipi filtre kağıdına yerleştirin. Hücreler koyu noktalar olarak görülebilir (Şekil 3B).
- NaCl kristalindeki çok katmanlı grafeni jilet kullanarak mikroçipin SiN penceresine uyan bir parça ya da jilet le kesin.
- Saf su kabı hazırlayın ve su yüzeyine göre kristali yaklaşık 45° açıyla yatırarak ve suya dokunarak grafeni NaCl kristalinden çıkarın. Grafen su yüzeyine yüzer (Şekil 3C).
- Su yüzeyinden metal bir döngü ile grafen yakalamak. Grafen, döngünün altındaki damlacık içinde yüzer (Şekil 3D).
- Mikroçipin üst yüzeyine alt döngü yüzeyiyle dokunun. Mikroçip metal halkaya yapışacak. Grafen mikroçipin üstünde görülebilir (Şekil 3E).
- Stereomikroskop altında, grafenin SiN penceresindeki tüm hücreleri kapsayabilmesi için mikroçipten kalan suyu çıkarmak için filtre kağıdı kullanın.
NOT: Grafen lekeli zaman hareket edecektir. Grafenin filtre kağıdının kenarı ile mikroçipe dokunarak pencerenin üst kısmında kaldığından emin olun. - Mikroçipi metal döngüden çıkarmak ve filtre kağıdına yerleştirmek için cımbız kullanın. Grafen mikroçip üzerinde mor bir Parıltı olarak görülebilir (Şekil 3F).
- Mikroçipi kağıttan bir bölme Petri kabına aktarın.
- Pipet serbest bölmelerinden birine bir damlacık su damlatın ve su doymuş bir atmosfer sağlamak için kapağı kapatın.
- Bölme çanamı parafin filmile kapatın ve daha fazla ölçüm için gerekirse buzdolabında 4 °C'de saklayın.
8. KÖK
- Kondenser lensleri, bir sonda akımı I = 180 pA (farklı mikroskop ayarları için prob akımı hakkında bilgi üretici tarafından %5 doğrulukta sağlanır) ve bir diyafram açıklığı ekleyerek 13,2 mrad'lık bir ışın yakınsama yarı açısını ayarlayarak en az 0,2 nm'lik bir sonda boyutu için bir hiza/test numunesi kullanarak STEM'i 200 kV'luk ışın enerjisinde ayarlayın. Projektör lens ayarlarını ayarlayarak ADF STEM dedektörü açma yarı açı aralığını (iç ve dış) 68-280 mrad'a ayarlayın. STEM görüntü boyutunu 2048 x 2048 piksele, piksel çalışma süresini t = 6 μs olarak ayarlayın.
- Mikroçipi grafen kaplı hücrelerle TEM için standart bir numune tutucuya, hücrelerin karşı karşıya olduğu şekilde yükleyin.
- Tutucuyu elektron mikroskobuna yükleyin.
- 8.1 adımdaki ayarları kullanarak büyütme (M) = 800x(Şekil 4)ile genel bir resim edinin.
- Bir hücrede ilgi çekici bir bölge belirleyin.
- Adım 8.1'deki ayarları kullanarak QD'leri M = 80.000x piksel boyutunda d = 1,3 nm(Şekil 4)boyutunda bir ADF dedektörüyle görüntüleyin.
- Maruz kalan alanı göstermek için daha düşük büyütme (burada, M = 50.000x) ile maruz kaldıktan sonra alanın bir görüntüsünü eldeedin (Şekil 4).
- Elektron dozuna hesapla
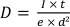
nerede e temel ücrettir. Yukarıda verilen ayarlarla,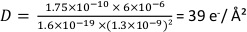
ve% 5 bir hata. - Aynı ayarlara sahip bir doz serisi için 20 görüntü edinin, ancak t = 60 μs ile birikmiş doz ile sonuçlanan
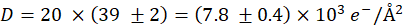 .
. - Grafenin varlığını doğrulamak için mikroskobu M = 1200x'te TEM'e geçirin, hücrenin yakınında bir bölge seçin ve kırınım moduna geçin. 0,5 s, 2048 x 2048 x 3 piksel ve 50 μm'lik seçili alan diyafram açıklığına bir kırılma desenikaydedin( Şekil 4).
- Seansın sonunda, numuneyi mikroskoptan çıkarın, mikroçipi bölme kabına geri yerleştirin, yemeği parafin filmle kapatın ve daha fazla ölçüm için gerekirse buzdolabında 4 °C'de saklayın.
- İlk mikroçiple aynı şekilde hazırlanmış ancak grafen kaplama olmadan hazırlanan ikinci mikroçipi seçin.
- Adımları 8.2-8.11 ama şimdi bu örnek için tekrarlayın. Yukarıdaki ayarlarla aynı ayarlara sahip bir kırınım deseni, karşılaştırma olarakkaydedin( Şekil 4 ).
9. Analiz
NOT: STEM görüntüsündeki QD konumlarının otomatik olarak algılanması için analiz, başka bir yerde açıklandığı gibi ImageJ (NIH) için yerel tasarımın eklentisini kullanır20. Eklenti istek üzerine kullanılabilir.
- Yazılım, STEM görüntüsündeki parçacıkları algılamak için aşağıdaki adımları otomatik olarak uygular:
- Piksel gürültüsünü azaltmak için Gaussian filtresi uygulayın.
- Yalnızca nano partikülleri elde etmek için Hızlı Fourier Transform (FFT) bandpass filtresi uygulayın.
- Görüntüyü ayarlamak için bir eşik ayarlayın.
- Parçacık algılaması için tolerans faktörü 2 olan 10 nm'lik bir parçacık çapı kullanın.
- Parçacık konumlarını algıla.
- Her seri de on çift QD arasındaki merkezden merkeze mesafeyi ölçün. Burada, seri başına değişen boyutlara sahip 10 mesafe ölçüldü.
- Her parçacık uzaklığı ile ilk görüntüdeki uzaklık karşılaştırarak parçacık uzaklığındaki göreli değişimi hesaplayın:
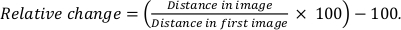 .
.
Sonuçlar
Şekil 1A, pencerenin kapalı olduğu şekilde tohumlanmış hücreleri gösterir, ancak düzleşmesine ve yapışmasına izin verecek yeterlird alana sahip olur, bu da yaklaşık 2/3'lük bir kesişmeye yol açarak(Şekil 1B). Bir mikroçipüzerinde çok fazla hücre nin tohumlanmış olması durumunda(Şekil 1C),tüm hücrelerin mikroçipe yapışması için yeterli alan yoktur. Şekil 1D 24 saat sonra aynı mikroçip gösterir. Hücrelerin yarısından fazlası düzolmadı. Öte yandan, çok az hücre tohumlu ise(Şekil 1E),SiN penceresi Şekil 1F'degörüldüğü gibi 24 saat sonra büyük bir boş alanla son bulur. Şekil 1G, Şekil 1A ve Şekil 1B'dekihücrelerin DIC görüntüsünü gösterir. Şekil 1H, HER2'nin başarılı bir şekilde etiketlendiğini gösteren sarı renkte sahte renkte karşılık gelen floresan görüntüsünü gösterir.
Temsili STEM verileri Şekil 4'tegösterilmiştir. Grafen kaplı (sol kolon) ve kaplamasız (sağ kolon) SKBR3 hücreleri araştırıldı. Şekil 4A,B penceredeki hücrelerin M = 800x genel bakış görüntülerini gösterir. Insets olarak gösterilen alanlar doz serisi sırasında M = 80.000x olarak görüntülendi, Bkz. Şekil 4C,D. QD'ler burada parlak noktalar kadar görünür. Şekil 4E ve Şekil 4F, Şekil 4C'dekidikdörtgenlerin konumlarında elde edilen M = 50.000x büyütülmüş görüntülerin D = (7.8 ± 0.4) x 103 e-/ş2ile bir doz serisi nin elde edilmesinden sonra kaydedildi.D. Doz serisi M = 80.000x olarak kaydedildi. Açıkta kalan alanlar dikdörtgen olarak tanınabilir ve dikdörtgen kaplamasız örnek için açıkça görülebilir (Şekil 4F).
Grafenin varlığını doğrulamak için, hücresi olmayan, ancak Grafenli veya Grafensiz alanların kırınım desenleri elde edildi. Grafenin altıgen yapısı, grafen kaplı numunenin kırınım deseninde(Şekil 4G)gözlenirken, kaplamasız numunede bulunmamaktadır (Şekil 4H). Tek kristal grafenin kırınım deseni grafenin yüksek sıralı altıgen yapısı nedeniyle altı kat simetriye sahip olacaktır. Altıgen yapı örneklerde grafen in varlığını gösteriyor.
Elektron ışını aydınlatmasının numune üzerindeki etkisini araştırmak için STEM görüntüleri biriken elektron dozu ile bir görüntü serisinde elde edilebildi. Kaplamalı olmayan ve grafen kaplamalı numuneler için temsilsonuçları sırasıyla Şekil 5A-D ve Şekil 5E-G'degösterilmiştir. Tüm veriler hücrenin en düz olduğu hücrenin kenarında elde edildi ve gözlenen yapı böylece SiN zarına en yakın olan yapıdır. Kaplamasız örneklerin maruz ilerledilmesi, Hücre yüzeylerinde D = (1,9 ± 0,1) x 103 e-/ş2 (Şekil 5B)parlak yapılara yol açmıştır. Bu yapılar daha yüksek dozlarda büyüdü, bu nedenle serinin son görüntüsünde D = (7.8 ± 0.4) x 103 e-/ş2 (Şekil 5C,D)olarak açıkça görülebildi. Bu lekeler grafen kaplı örneklerin hiçbirinde görünmedi(Şekil 5E-G).
Yukarıda açıklanan protokol kullanılarak ek mikroçipler hazırlandı ve incelendi. Toplam altı kaplamalı ve yedi kaplamasız örnek araştırıldı. Kaplamasız yedi örnekten ikisi bu eserleri gösterdi. Kaplamalı örneklerin hiçbiri ek parlak noktalar göstermedi.
Radyasyon hasarının bir başka ölçüsü olarak, QD'ler arasındaki mesafe incelendi. Yapısal hasar meydana olsaydı, bir QDs arasındaki mesafelerdeğiştirmek için beklenebilir. Mesafelerdeki değişiklikler farklı QD çiftleri için ölçüldü ve çift mesafeler için D birikti. Şekil 5H, kaplamalı olmayan numuneler için parçacıkların göreceli değişiminin ortalama %1,3'ün altında kaldığını, kaplanmış numuneler için ise ortalama göreceli mesafenin %0,8'in altında kaldığını göstermektedir. Bu nedenle grafen kaplamanın numuneyi stabilize ettiği, ancak grafen kaplama içermeyen kurutulmuş numunelerin de son derece kararlı olduğu sonucuna varılabilir.

Şekil 1: Silikon mikroçip ve HER2 etiketli bir SiN penceresinde hücre tohumlama. (A) Mikroçip üzerinde tohumlama sonra SKBR3 hücreleri 5 dk ile bir SiN pencere bölgesi örnek görüntü. (B) Aynı hücreler tohumlamadan sonra si mikroçip 5 dk üzerinde 24 saat. (C) SKBR3 hücrelerinden sonra aynı SiN penceresine yayılır. (D) 24 saat sonra (C) ile aynı hücreler. Tohumlama üzerine cips üzerinde çok fazla hücre olduğu gibi hücreler düzgün düzleştirmek değildi. (E) Bir mikroçip üzerindeki hücreler 5 dk sonra tohumlama. (F) Pencerede çok az hücre görülebiliyordu çünkü mikroçipte çok az hücre vardı. (G) HER2'nin QD etiketlemesi sonrasında aynı SKBR3 hücrelerinin DIC görüntüsü. (H) DIC'nin yer kaplaması görüntüsü ve her2-QD655 etiketli SKBR3 hücrelerinin ilgili floresan görüntüsü (sarı renkte yanlış renkli). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
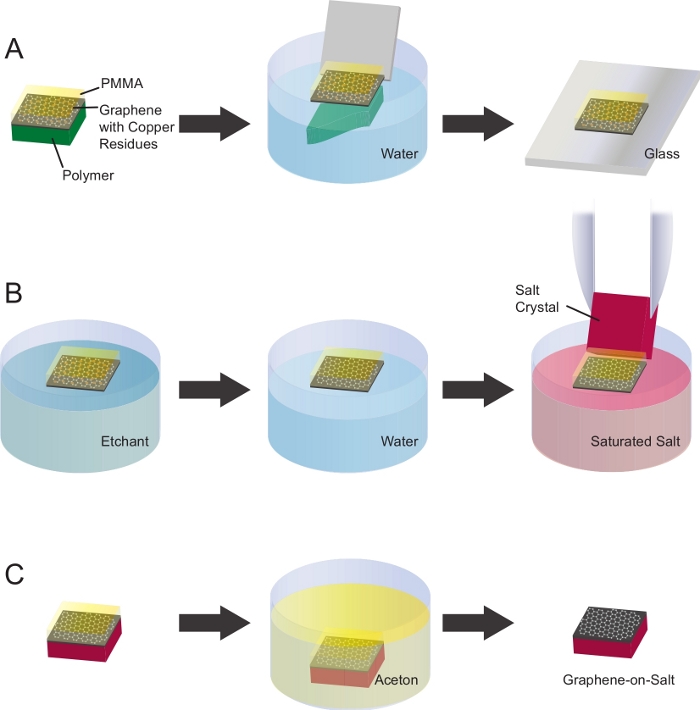
Şekil 2: Grafenin NaCl kristallerine temizlenmesi ve aktarılması. (A) PMMA-grafen-on-polimer PMMA grafen serbest bırakmak için saf suya batırılır. PMMA-grafen cam bir slayt ile yakalanabilir. (B) Bakır bazlı kontaminasyonlar sodyum persülfat çözeltisi kullanılarak kazındı. Grafeni temizlemek için, deiyonize su içeren bir kabına aktarıldı. Bu adımlar 3 kez tekrarlandı. PMMA-grafen daha sonra saf suda NaCl doymuş çözeltisine aktarıldı. Tuz çözeltisinden grafenalmak için bir NaCl kristali kullanıldı. (C) NaCl kristalüzerindeki PMMA-grafen oda sıcaklığında 30 dakika boyunca kurutuldu. PMMA 30 dakika için aseton blok kuluçka ile kaldırıldı.
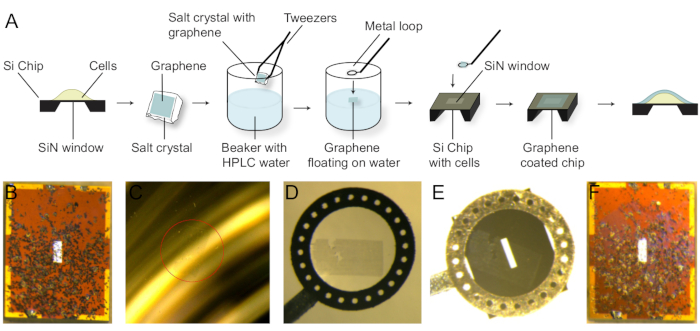
Şekil 3: Si mikroçipi üzerine tohumlanmış hücrelerin grafen kaplaması. (A) Grafen kaplama prosedürü. NaCl kristalüzerinde grafen su yüzeyine serbest bırakılır. Grafen parçası daha sonra metal bir döngü ile yakalanır ve Si mikroçip üzerine aktarılır. (B) Grafen içermeyen 400 x 160 μm boyutlarında SiN penceresi olan mikroçip (2,0 x 2,6 mm). SKBR3 hücreleri koyu noktalar olarak görülebilir. (C) Grafen (kırmızı daire) su dolu bir kabın yüzeyinde yüzen. (D) Grafen metal bir döngü ile yakalandı. (E) Su damlacılığa bağlı mikroçip, grafenin SiN penceresinin üstünde olması için. (F) Grafen kaplama dan sonra mikroçip. Grafen mor bir parıltı olarak görülüyordu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: SiN penceresinde grafen kaplı ve kaplamasız SKBR3 hücrelerinin GÖVDESI. (A) M = 800x. (B) M = 800x. (C) M = 80.000x görüntüde elde edilen kaplamasız bir numunenin grafen kaplı bir numunenin STEM görüntüsü, A. Sarı çizgilerdeki mavi dikdörtgenin konumunda kaydedilen örneklerin parçacık içinde ölçülen mesafeyi temsil eder. (D) M = B. Sarı çizgideki mavi dikdörtgenin konumunda kaydedilen 80.000x görüntü, parçacıklar içinde ölçülen örneklerin uzaklıklarını temsil eder. (E) M = 50.000x aynı bölgenin D = (7.8±0.4) x 103 e-/ş2'yemaruz kalan görüntüsü . (F) M = D ile aynı bölgenin 50.000x görüntü ve D = (7.8±0.4) x 103 e-/ ş2maruz . Maruz kalan alan açıkça görüldü. (G) Hücreleri olmayan bir bölgeden grafen kaplı bir numunenin kırınım deseni. Grafenin altı kat simetrisi parlak noktalar olarak görülebilir. (H) Grafen içermeyen bir numunenin kırınım deseni 6 kat parlak noktalar göstermez. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
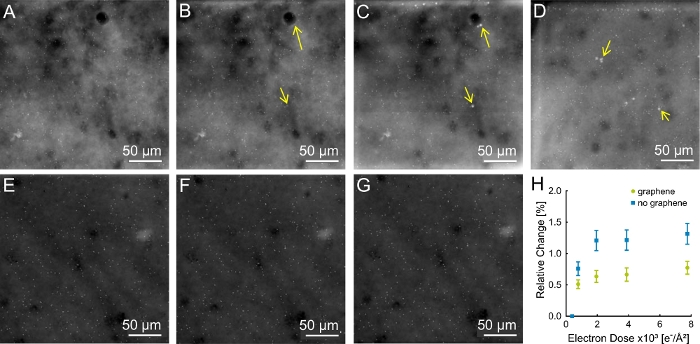
Şekil 5: Grafen kaplama içermeyen numunelerden doğan eserler. (A) Grafen kaplaması olmayan ve D = (0,39 ± 0,02) x 102 e-ş2'yemaruz kalan grafen kaplaması olmayan numunelerin ilk görüntüleri . (B) D = (1,94 ± 0,1) x 103 e-/ş2 (sarı ok) ile ortaya çıkan ilk eserlerle görüntüler. (C, D) D = (7.8 ± 0.4) x 103 e-/ş2ile elde edilen serinin son görüntüsü . Eserler parlak noktalar olarak görülüyordu. (E-G) Grafen kaplamalı örnekler ortaya çıkan eserler olmadan. (E) D = (0,39 ± 0,02) x 102 e-/ş2 (F) D = (1,94 ± 0,1) x 103 e-/ş2 (G) D = (7,8 ± 0,4) x 103 e-/ş2. (H) Grafen kaplamalı ve kaplamasız numuneler için parçacık mesafelerinde göreceli değişim. Biri (A-C)'de gösterilen eserler, d'deki ikinci numunenin son görüntüsü ve üç kaplamalı örnek incelenmiştir (biri E-G ile gösterilmiştir). Toplam da numune başına 250 nm ile 3 μm arasında değişen mesafelerde on QD çifti incelenmiştir. Göreceli değişiklik, bir gruptaki tüm ölçümlerin ortalamasını yansıtır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Tablo 1: Çözümler ve tamponlar için tarifler. Bu tabloyu indirmek için lütfen buraya tıklayınız.
Tartışmalar
Protein fonksiyonunu daha iyi anlamak için, bozulmamış hücrelerin plazma zarındaki protein konumları hakkında bilgi almak önemlidir. Bu bilgileri elde etmek için yöntemler süper çözünürlüklü floresan mikroskopi1,2içerir. Süper çözünürlüklü mikroskopi son yıllarda daha da gelişmiş olmasına rağmen, çözünürlüğü hücre deneylerinin pratik koşulları için hala yaklaşık 20 nm ile sınırlı iken, tipik reseptör proteinleri 1-10 nm aralığında boyutlara sahiptir. Proteinlerin tek hücreli ve tek molekül düzeyinde proteinlerin görselleştirilmesi için yeterli çözünürlüğe sahip olarak görüntülenmesi EM ile mümkündür. Ama kesit nedeniyle, konvansiyonel EM yöntemleri genellikle hücre bozulmadan bırakmayın26, hangi bağlam ve plazma zarında proteinlerin mekansal dağılımı hakkında önemli bilgilerin kaybına yol açar. Kriyo-TEM ile tüm hücreler için yöntemler geliştirilmiştir6, bu kriyo-EM27ile protein etiketleme birleştirmek mümkün, ayrıca kriyo-STEMgösterilmiştir 28. Ancak, kriyo-EM iş akışları hücresel ultrayapı ve protein yapısını incelemek için optimize edilmiştir ve membran protein uzamsal dağılımlarını analiz etmek için çok fazla değildir. Kritik nokta kurutma başka bir bütün hücre hazırlama yöntemidir ancak numuneler birkaç kurutma adımına tabi tutulur ve teknik son derece zaman alıcıdır 29. Membran proteinleri de donma kırığı7ile incelenmiştir. Bu yöntemde hücreler sabitlenir, donar ve kırılır. Kırık parçalar karbon ve platin tabakaları tarafından çoğaltılır ve biyolojik örnek çıkarılır. Kopyaları daha sonra EM30ile analiz edilebilir. Tüm hücre analizi donma fraksiyonu ile mümkün değildir, çünkü tüm hücre bağlamında membrandaki proteinlerin dağılımı hakkında bilgi kaybolur.
Burada sunulan yöntem hücre zarının numuneyi ince dilimlemeye gerek kalmadan incelenmesini sağlar9,31. Hücreler, membran proteinlerinin lokalizasyonunun EM görüntüleriyle ilişkili floresan görüntülerden görülebilmesi için bozulmadan tutulur. Sulu durumda bozulmamış hücreler içinde tek hücreli ve tek molekül düzeyinde proteinlerin incelenmesi bu grafen muhafaza yöntemi9kullanarak QD etiketli proteinlerin STEM kullanılarak 2 nm çözünürlüğü ile mümkün olduğu gösterilmiştir . Proteinleri doğal hallerinde tutmak çok önemlidir, çünkü membran proteinlerinin mekansal dağılımını korur, bu da protein fonksiyonlarını anlamak ve tedavi yaklaşımları için yeni ilaçlar geliştirmek için önemli olan tek hücre ve tek molekül düzeyinde analizler mümkündür.
Biyolojik numunelerin EM ile görüntülenmesinin bir diğer kritik yönü de elektron ışınının neden olduğu örneklerin radyasyon hasarıdır. Çözeltiler genellikle mümkün olduğunca elektron dozu veya karbon32ince katmanları arasında örnek kapsülleme gibi çeşitli kaplama yöntemleri, azaltılması içerir. Yöntemimiz grafen kaplamanın, kaplamasız numuneler için hücre yüzeyinde ortaya çıkan ışınkaynaklı objeleri azalttığını göstermektedir. Kimyasal olarak sabitlenen ve grafen kaplı biyolojik numunelerin, numunede parlak noktalar gibi radyasyon hasarı olmadan 200 keV ışın enerjisinde 200 keV ışın lama altında incelenmesi mümkündür = (7.8±0.4) x 103 e-ş2 radyasyon hasarı olmadan. Ayrıntılı numune hazırlama içeren diğer EM yöntemleri ile karşılaştırıldığında, örneğin, boyama, katıştırma, (kriyo-) kesit, kırma, vb. burada açıklanan yöntem daha az zaman alır. Proteinlerin etiketlemi birkaç saat içinde yapılır ve grafen kaplama eğitimli araştırmacılar için sadece yaklaşık 15 dakika gerektirir. Numune hazırlama floresan mikroskopisi için gerekli prosedürlerle karşılaştırılabilir.
Protokol bazı adımlarda değiştirilebilir. Mikroçip üzerindeki grafen, bir filtre kağıdıyla lekelendiğinde grafenin hareket etmediğinden emin olmak için havayla kurutulabilir. Grafen tuzla kirlenmişse, tuzu eritmek ve böylece kontaminasyonu en aza indirmek için yaklaşık bir saat boyunca su yüzeyinde yüzdürülmesini sağlamak mümkündür. Grafende meydana gelen bakır veya PMMA kontaminasyonu protokoldeki ilgili gravür adımlarını uzatarak azaltılabilir. Diğer grafen kaplama yöntemleri, örneğin, grafen-PMMA doğrudan hücrelere yatırıldı ve PMMA daha sonra aseton yıkanarak kaldırıldı tarif edilmiştir33. Yöntemimizde, ek aseton yıkama adımlarından kaynaklanan hücrelerde olası hasarları önlemek için kaplamadan önce PMMA çıkarıldı. NaCl düz olduğu için burada bir substrat olarak seçildi, bu yüzden grafen kırışıklık yok, ve grafen serbest bırakmak için suda çözünür9. Ayrıca istenilen boyutta kesilebilir ve grafende substrat kalıntısı bırakılmaz. Ama dikkate bu kriterleri göz önünde bulundurarak, potasyum klorür gibi diğer substratlar muhtemelen de kullanılabilir.
Potansiyel etiket kaynaklı kümelenme olasılığını azaltmak için, GA fiksasyon adımı FA fiksasyonundan hemen sonra uygulanabilir ve bundan sonra tüm membran proteinleri hareketsiz hale getirilmiştir. FA ile ilk fiksasyon adım zaten biyolojik yapıyı düzeltir ama membran protein difüzyon azaltılmış düzeyde hala oluşabilir34, muhtemelen qd başına birden fazla Streptavidin varlığı nedeniyle etiket indüklenen kümelenme yol açan. GA ile fiksasyon LM sırasında bir otofloresan sinyaline yol açabilir ve bu nedenle, açıklanan protokolde LM sonra yapılır, ancak başka bir yerde açıklandığı gibi azaltılabilir34. Cacodylate tampon oldukça toksik, ve diğer fiksatifler de kullanılabilir, ama cacodylate em protokolleri için yaygın olarak kullanılan bir tampon olarak burada kullanılır, çökelti önler, bakteriyel ve mantar büyümesini önler, ve lipid membranların ultrayapısal bütünlüğünü korumak için gerekli olan kalsiyum iyonları ile uyumludur35. Gerekirse, osmiyum tetroksit lipidler stabilize etmek için ek fiksasyon olarak kullanılabilir. Bu hücre yapısının kontrast geliştirmek için yardımcı olur, ama aynı zamanda sisteme başka bir metal eklemek ve QDs elde edilen kontrastı azaltmak.
Burada açıklanan protokol, iyi bir yönerge gerektiren birçok adım içerir. Mikroçiplerin SiN yüzeyinin çizilmesini önlemek ve kırılmayı önlemek için mikroçipleri kullanmadan önce bazı eğitimler gereklidir. Daha önce de belirtildiği gibi, SiN penceresi zaman zaman kırılabilir gibi yinelenen mikroçipler hazırlamak için tavsiye edilir. Bir mikroçip üzerinde gerekli sayıda hücre elde etmek de bazı deneyim gerektirir. Grafen ile hücreleri kaplama su üzerinde grafen float doğru eğim açısı bulmak zor olabilir gibi bazı eğitim ihtiyacı var. Sudan grafen yakalarken, aynı zamanda ince grafen görmek zor olabilir. Grafen mikroçipin üzerinde olur olmaz, fazla suyun bir filtre kağıdıyla silinmesi gerekir. Bu sadece mikroçipgrafen çıkarmadan önlemek için bir filtre kağıdı ucu ile yapılmalıdır.
Grafen kaplama, örneklerde yer alan eserlerin görünmesini engelledi. Ancak D < 4 x 102 e-/ş2 için de kaplamasız numune için hiçbir eser ortaya çıkmamış ve sadece 2 kaplamasız örnek için eserler ortaya çıkmıştır. Böylece, kaplamasız hücrelerin incelenmesi de mümkün görünse de, grafen kullanmak ve artifakı oluşma riskini önlemek daha iyi olacaktır. Bu eserlerin bileşimi gelecekte nasıl oluşumunu önlemek için ipuçları vermek için analiz edilebilir. Hücrelerin yapısal stabilitesi ile ilgili olarak grafen kaplamada sadece küçük bir iyileşme gözlenmiştir. Sabit hücreler görünüşe göre incelenen ince alanlarda stabilize edildi, onların yapısı SiN membran yakın olduğu. Ancak burada incelemediğimiz şey, vakum4'emaruz kaldığında hücresel numuneler için oluştuğu bilinen objeleri kurutmaktı. Hücrelerin kurutulması hücrelerin küçülmesine yol açar, böylece QD mesafeleri de bunun sonucu olarak değişir. Burada kullanılan elektron dozu için grafen kaplı ve kaplamasız örneklerin QD'lerinin uzaklığı sabit kalmıştır. Grafen kaplamanın EM hücreleri üzerindeki etkisini incelemek için daha ileri çalışmalara ihtiyaç vardır.
Bu yöntemin bir sınırlama hücrelerin kimyasal fiksasyon gerekli olmasıdır; bu nedenle, hiçbir canlı hücre deneyleri yapılabilir. Ancak etiketleme gerekli değildir ve daha yüksek bir yapısal kararlılık ile hücreler kullanılır, örneğin bakteri, daha sonra sabitlenmemiş hücreler farklı bir elektron doz toleransı ile de olsa EM36 için grafen eklenebilir. Ayrıca, proteinler doğrudan tespit edilemez, bu yüzden qds proteinleri görselleştirmek için gereklidir. Yöntem, daha küçük etiketlerden yararlanacaktır. Tartışma konusu, ultrayapının net bir şekilde görülememesi iyi mi kötü mü? Yöntemimiz sadece seçilmiş proteinlerin görülebildiği floresan mikroskobuna benzer37. Ultrayapının görünürlüğünü artırmak da görüntüye çok daha fazla bilgi ekler ve bir noktada tek tek etiket konumlarının algılanmasını engeller. Ayrıca, burada açıklanan yöntem bir protein türü içindir ve birden fazla proteini etiketleyebilmek için protokol eklemeleri gerekmektedir. Son olarak, yöntem, antikor mimetik21 veya nanobody38 gibi küçük bir yüksek afinite özellikle bağlayıcı molekül mevcut olduğunda çalışır. Yaygın olarak kullanılan antikorlar çok daha büyüktür ve protein alt birimlerinin oligomerlere işlevsel durumunun saptanmasını önler.
Yöntemimiz, hücreleri sulu durumda tutarken EM kullanarak tüm hücrelerde protein fonksiyonunu incelemek için yararlıdır. Hücre serilerini incelemek kolayca mümkündür. Diğer hücre ve protein ler de incelenebilir. Protein etiketleme gerekli değilse, protokolün bir alt kümesi biyolojik örneklerin çok çeşitli grafen kaplama için kullanılabilir. Tüm hücreleri inceleme yeteneği moleküler düzeyde membran protein fonksiyonunun korelasyonları anlamak için hücresel araştırma da ilgilidir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Hücre kültürü protokolüne yardım ettiği için D. B. Peckys'e, f. Weinberg'e el yazmasını gözden geçirdiği için, T. Trampert'a deneylerve rakamlarla ilgili yardımları için, S. Smolka'ya rakamlarla yardım ları için ve E. Arzt'a INM aracılığıyla verdiği destek için teşekkür ederiz. Bu araştırma Else Kröner-Fresenius-Stiftung tarafından finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetone for HPLC (min. 99.8 %) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 2626-1L | |
| AL54 analytical balance | Mettler-Toledo GmbH, Giessen, Germany | 30029077 | |
| Albumin Fraction V, biotin-free, ≥ 98 %, for molecular biology | Carl Roth GmbH + Co KG, Karlsruhe, Germany | 0163.2 | |
| Anti-HER2 Affibody Molecule, biotin conjugated 20 µM | Affibody, Solna, Sweden | 10.0817.02.0001 | |
| atomic resolution analytical microscope JEM-ARM200F | JEOL (Germany) GmbH, Freising, Germany | ||
| Boric Acid | Sigma-Aldrich, Merck, Darmstadt, Germany | B6768-500G | |
| Cacodylic acid sodium salt trihydrate ≥ 98 % | Carl Roth GmbH + Co KG, Karlsruhe, Germany | 5169.1 | |
| Cell Culture Flasks, PS, treated, sterile, Filter screw cap 50ml | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696781 | |
| Cell Culture Flasks, PS, treated, sterile, Filter screw cap 250ml | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696782 | |
| Cell Culture Multiwell plates, treated, 24-well | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696792 | |
| Cell Culture Multiwell plates, treated, 96-well | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696794 | |
| CELLSTAR Cell Culture Flasks TC treated, 250 ml | Greiner Bio-One GmbH, Frickenhausen, Germany | 658170 | |
| CELLSTAR Cell Culture Multiwell Plates 96-well | Greiner Bio-One GmbH, Frickenhausen, Germany | 655180 | |
| CELLSTAR Centrifuge Tubes 15 ml sterile | Greiner Bio-One GmbH, Frickenhausen, Germany | 188271 | |
| CELLview cell culture dish, PS, 35/10mm, glass bottom, 1 compartment | Greiner Bio-One GmbH, Frickenhausen, Germany | 627861 | |
| Centrifuge 5418 | Eppendorf, Wesseling-Berzdorf, Germany | 5401000010 | |
| Centrifuge Tubes 50 ml sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 7696705 | |
| Corning CellStripper non-enzymatic cell dissociation solution | Corning, NY, USA | 25-056-CI | |
| D(+)-Saccharose min. 99,7 %, powdered | Th. Geyer GmbH + Co. KG, Renningen, Germany | 9286.1 | |
| Disposable Hemocytometer C-Chip Neubauer improved | Carl Roth GmbH + Co KG, Karlsruhe, Germany | PK36.1 | |
| Easypet | Eppendorf, Wesseling-Berzdorf, Germany | 4430000018 | |
| Eppendorf Research plus pipettes variable, 0.1 - 2.5 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000012 | |
| Eppendorf Research plus pipette variable, 2 -20 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000039 | |
| Eppendorf Research plus pipette variable, 10 - 100 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000047 | |
| Eppendorf Research plus pipette variable, 100 - 1000 µl | Eppendorf, Wesseling-Berzdorf, Germany | 3123000063 | |
| Ethanol absolute for HPLC (min. 99.9 %) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 2222-1L | |
| Fibronectin-like engineered protein*poly mer-plus | Th. Geyer GmbH + Co. KG, Renningen, Germany | F8141 | |
| Fluorescence Microscope Leica DMI6000 | Leica Microsystems GmbH, Wetzlar, Germany | ||
| Gibco Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | FisherScientific, Hampton, NH, USA | 31966021 | |
| Gibco Fetal Calf Serum (FCS) | FisherScientific, Hampton, NH, USA | 10099141 | lot number: 1751893 |
| Gibco Goat Serum, New Zealand origin | FisherScientific, Hampton, NH, USA | 16210064 | lot number: 1788320 |
| Gibco Phosphate buffered saline (PBS), pH 7.4 | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Galaxy 48R CO2 Incubator | New Brunswick, Eppendorf, Wesseling-Berzdorf, Germany | CO48310001 | |
| Gatan Model 950 Solarus— Plasma Cleaner | Gatan GmbH, München, Germany | ||
| Glutaraldehyde solution Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative | Sigma-Aldrich, Merck, Darmstadt, Germany | G5882 | |
| Glycine ≥ 98.5 % Ph.Eur., USP, BP | Carl Roth GmbH + Co KG, Karlsruhe, Germany | T873.1 | |
| Inverted Laboratory Microscope Leica DM IL LED | Leica Microsystems GmbH, Wetzlar, Germany | DM IL LED | |
| Hot plate | Heidolph Instruments GmbH & CO. KG, Schwabach, Germany | MR 3002 | |
| MEM non-essential Aminoacids (NEAAs) 100x W/O L-Glutamine | Biowest, Nuaillé, France | X0557-100 | |
| Microscope glass slides 76 mm x 26 mm | DWK Life Sciences GmbH, Wertheim/Main | ||
| micro tubes (1.5 ml, 2 ml) non-sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 1.5 ml: 7696751, 2 ml: 7696752 | |
| MSc-Advantage— Class II Biological Safety Cabinet | ThermoFisher Scientific, Waltham, USA | ||
| Ocean Microchips SiN window 400x150 µm, 200 nm spacer | DENSsolutions, Delft, The Netherlands | ||
| Omnifix Single-use syringe Luer Lock Solo (10 ml, 20 ml, 50 ml) | B. Braun Melsungen AG, Melsungen, Germany | 10 mL: C542.1 20 ml: T550.1 | purchased via Carl Roth GmbH&Co. KG, Karlsruhe |
| Oven | Memmert GmbH + Co. KG, Schwabach, Germany | VO 200 | |
| Parafilm | VWR, Darmstadt, Germany | #291-0057 | |
| Paraformaldehyde 16 % solution, EM grade | Electron Microscopy Sciences, Hatfield, PA, USA | 15710 | |
| Perfekt-Kescher with handle | Plano GmbH, Wetzlar, Germany | T5112 | |
| Pipette tips with aerosol barrier in racks, non-sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 2-200µl: 7695892 | |
| Pipette tips with aerosol barrier in racks, sterile | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 0.1-10 µl: 7695880 2-100 µl: 7695883 100-1000 µl: 7695886 1250 µl XL: 7695887 | |
| Poly-L-Lysine 0.01 % solution mol.WT.70.000 - 150.000 | Th. Geyer GmbH + Co. KG, Renningen, Germany | P4707 | |
| Qdot 655 Streptavidin Conjugate 1 µM | Invitrogen, ThermoFisher Scientific, Waltham, MA, USA | Q10121MP | |
| Razor blade, Gem Uncoated 3 Facet, Steel Back, Degreased | Personna, AccuTec Blades, Verona, VA, USA | 94-0451 | |
| round filter paper, ashless, Grade 589/3 blue ribbon, diam. 150mm | Schleicher & Schuell, Dassel, Germany | 300212 | |
| Routine stereo Microscope Leica M60 | Leica Microsystems GmbH, Wetzlar, Germany | M60 | |
| Serological ROTILABO pipettes, sterile (1 ml, 2 ml, 10 ml) | Th. Geyer GmbH + Co. KG, Renningen, Germany | 1 ml: N231.1 2 ml: N236.1 10 ml: ET30.1 | |
| Serological pipettes, sterile, (1 ml, 2 ml, 10ml) | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 1ml: 7695550 2ml: 7695551 10ml: 7695553 | |
| Serological pipettes, sterile, (5 ml, 25 ml, 50 ml) | Labsolute, Th. Geyer GmbH + Co. KG, Renningen, Germany | 5 mL: 7695552 25ml: 7695554 50ml: 7695555 | |
| Shaking water bath SW22 | Julabo GmbH, Seelbach, Germany | 9550322 | |
| Sodium chloride | Carl Roth GmbH + Co KG, Karlsruhe, Germany | HN00.1 | |
| Sodium chloride crystals, cleaved 12 mm x 12 mm x 0.5-1 mm | International Crystal Laboratories, Garfield, NJ, USA | 9750 | |
| Sodium tetraborate decahydrate, ACS reagent, ≥ 99.5 % | Sigma-Aldrich, Merck, Darmstadt, Germany | S9640-500G | |
| Sodium persulfate | carl Roth GmbH + Co KG, Karlsruhe, Germany | 4365.2 | |
| syringe filters ROTILABO PES, sterile 0.22 µm | Carl Roth GmbH + Co KG, Karlsruhe, Germany | P668.1 | |
| Trivial Transfer Graphene 3-5layers, 1 cm x 1 cm | ACS material, Pasadena, CA, USA | TTG30011 | |
| Tweezers Dumoxel 03 | Manufactures D’Outils Dumont SA, Montignez, Switzerland | 0103-7-PO | |
| Tweezers Inox 02 | Manufactures D’Outils Dumont SA, Montignez, Switzerland | 0102-7-PO | |
| Tweezers, plastic replaceable tip | Ideal-tek SA, Balerna, Switzerland | 5SVR.SA | |
| Water ROTISOLV HPLC gradient grade | Carl Roth GmbH + Co KG, Karlsruhe, Germany | A511.2 |
Referanslar
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Williams, D. B., Carter, C. B. The Transmission Electron Microscope. , Springer. (2009).
- Bozzola, J. J., Russell, L. D. Electron Microscopy Principles and Techniques for Biologists. , Jones and Barlett Publishers. (1999).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Lucic, V., Leis, A., Baumeister, W. Cryo-electron tomography of cells: connecting structure and function. Histochemistry and Cell Biology. 130 (2), 185-196 (2008).
- Carson, J. L. Fundamental technical elements of freeze-fracture/freeze-etch in biological electron microscopy. Journal of Visualized Experiments. (91), e51694(2014).
- Nishiyama, H., et al. Atmospheric scanning electron microscope observes cells and tissues in open medium through silicon nitride film. Journal of Structural Biology. 169 (3), 438-449 (2010).
- Dahmke, I. N., et al. Graphene Liquid Enclosure for Single-Molecule Analysis of Membrane Proteins in Whole Cells Using Electron Microscopy. ACS Nano. 11 (11), 11108-11117 (2017).
- Maruyama, Y., Ebihara, T., Nishiyama, H., Suga, M., Sato, C. Immuno EM-OM correlative microscopy in solution by atmospheric scanning electron microscopy (ASEM). Journal of Structural Biology. 180 (2), 259-270 (2012).
- Kinoshita, T., et al. Immuno-electron microscopy of primary cell cultures from genetically modified animals in liquid by atmospheric scanning electron microscopy. Microscopy and Microanalysis. 20 (2), 469-483 (2014).
- Hauwiller, M. R., Ondry, J. C., Alivisatos, A. P. Using graphene liquid cell transmission electron microscopy to study in situ nanocrystal etching. Journal of Visualized Experiments. (135), e57665(2018).
- Cho, H., et al. The Use of Graphene and Its Derivatives for Liquid-Phase Transmission Electron Microscopy of Radiation-Sensitive Specimens. Nano Letters. 17 (1), 414-420 (2017).
- Meng, F., et al. Graphene-Based Fibers: A Review. Advanced Materials. 27 (35), 5113-5131 (2015).
- Sun, P. Z., et al. Limits on gas impermeability of graphene. Nature. 579 (7798), 229-232 (2020).
- Kato, R., et al. High-precision thickness control of ice layer on CVD grown bilayer graphene for cryo-TEM. Carbon. 160, 107-112 (2020).
- Keskin, S., de Jonge, N. Reduced Radiation Damage in Transmission Electron Microscopy of Proteins in Graphene Liquid Cells. Nano Letters. 18 (12), 7435-7440 (2018).
- Giepmans, B. N., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nature Methods. 2, 743-749 (2005).
- Ring, E. A., Peckys, D. B., Dukes, M. J., Baudoin, J. P., de Jonge, N. Silicon nitride windows for electron microscopy of whole cells. Journal of Microscopy. 243 (3), 273-283 (2011).
- Peckys, D. B., Korf, U., de Jonge, N. Local variations of HER2 dimerization in breast cancer cells discovered by correlative fluorescence and liquid electron microscopy. Science Advances. 1 (6), 1500165(2015).
- Eigenbrot, C., Ultsch, M., Dubnovitsky, A., Abrahmsen, L., Hard, T. Structural basis for high-affinity HER2 receptor binding by an engineered protein. Proceedings of the National Academy of Sciences of the United States of America. 107 (34), 15039-15044 (2010).
- Textor, M., de Jonge, N. Strategies for Preparing Graphene Liquid Cells for Transmission Electron Microscopy. Nano Letters. 18, 3313-3321 (2018).
- Henjes, F., et al. Strong EGFR signaling in cell line models of ERBB2-amplified breast cancer attenuates response towards ERBB2-targeting drugs. Oncogenesis. 1, 16(2012).
- Peckys, D. B., de Jonge, N. Studying the Stoichiometry of Epidermal Growth Factor Receptor in Intact Cells using Correlative Microscopy. Journal of Visualized Experiments. (103), e53186(2015).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology. Cell Physiology. 301 (2), 272-279 (2011).
- Kohl, H., Reimer, L. Transmission electron microscopy: physics of image formation. , Springer. (2008).
- Yi, H., et al. Native immunogold labeling of cell surface proteins and viral glycoproteins for cryo-electron microscopy and cryo-electron tomography applications. Journal of Histochemistry and Cytochemistry. 63 (10), 780-792 (2015).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of vitrified cells. Nature Methods. 11 (4), 423-428 (2014).
- Dukes, M. J., Ramachandra, R., Baudoin, J. P., Jerome, W. G., de Jonge, N. Three-dimensional locations of gold-labeled proteins in a whole mount eukaryotic cell obtained with 3 nm precision using aberration-corrected scanning transmission electron microscopy. Journal of Structural Biology. 174, 552-562 (2011).
- Meier, C., Beckmann, A. Freeze fracture: new avenues for the ultrastructural analysis of cells in vitro. Histochemistry and Cell Biology. 149 (1), 3-13 (2018).
- Peckys, D. B., de Jonge, N. Liquid scanning transmission electron microscopy: imaging protein complexes in their native environment in whole eukaryotic cells. Microscopy and Microanalysis. 20 (2), 346-365 (2014).
- Egerton, R. F. Control of radiation damage in the TEM. Ultramicroscopy. 127, 100-108 (2013).
- Wojcik, M., Hauser, M., Li, W., Moon, S., Xu, K. Graphene-enabled electron microscopy and correlated super-resolution microscopy of wet cells. Nature Communications. 6, 7384(2015).
- Huebinger, J., Spindler, J., Holl, K. J., Koos, B. Quantification of protein mobility and associated reshuffling of cytoplasm during chemical fixation. Scientific Reports. 8 (1), 17756(2018).
- Glauert, A. M., Lewis, P. R. Biological specimen preparation for transmission electron microscopy. , Princeton University Press. (2014).
- Koo, K., Dae, K. S., Hahn, Y. K., Yuk, J. M. Live Cell Electron Microscopy Using Graphene Veils. Nano Letters. 20 (6), 4708-4713 (2020).
- Pawley, J. B. Handbook of biological confocal microscopy, 2 edn. , Springer. (1995).
- Chung, I., et al. Spatial control of EGF receptor activation by reversible dimerization on living cells. Nature. 464 (7289), 783-787 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır