Method Article
Na+/K+ 泵对节奏爆裂的贡献,通过建模和动态夹紧分析探索
Erratum Notice
摘要
这里介绍了一种使用动态夹子在水痘心脏内膜中研究 Na+/K+ 泵和持久 Na+ 电流的作用的方法。
摘要
Na+/K+泵通常被认为是神经元活动的背景功能,它贡献了一个向外电流(I泵), 对 Na= ([Na]i)的内部浓度做出响应。在突发神经元中,如在产生节奏运动的中央模式发生器 (CPG) 神经元网络中发现的神经元中,[Na]i,因此 I泵,可以预期在整个爆发周期中会有所不同。这种对电活动的响应,加上独立于膜电位,赋予I泵具有基于通道电流(例如电压或发射器门控或泄漏通道)所不常见的动态特性。此外,在许多神经元中,泵的活动由各种调制剂调节,进一步扩大了I泵在有节奏的爆裂活动中的潜在作用。本文展示了如何使用建模和动态夹合方法的组合来确定我如何泵及其与持久 Na 的相互作用–电流影响 CPG 中的节奏活动。具体来说,本文将重点研究药用水痘心脏内膜的动态夹紧协议和计算建模方法。
引言
水痘的心跳是由一个CPG驱动的,由9对双边心脏内膜(HNs)组成,分布在尽可能多的中体段性结节中。CPG 的核心是位于第 3 和第 4段的内窥孔相互抑制对,它们形成半中心振荡器 (HCOs) (图 1A)。这些神经元继续爆裂时,突触分离药理使用双胆碱1。其他的,如第7段结节(本协议的重点)中的对,也是爆裂器,能够在突触隔离时产生爆裂活动。它们不是相互连接的,只接收下降输入,因此很容易通过切断神经线的其余部分来隔离结石。这种独立的爆裂活动是敏感的引入泄漏电流造成的渗透与尖锐的微电极记录,但大力爆裂时,记录与松散的补丁方法1。
单个HN神经元和HNHCO都经过了建模(霍奇金-赫克斯利基于HN神经元的单等能隔间模型,包含所有实验确定的电压门和突触电流),并且已经成功地捕获了活系统的所有爆发特征2。肌霉素是水痘中的内源性神经肽,可显著降低分离的HN神经元和HNHCOs的爆发节律的周期(T)。这种调制剂的作用是增加H电流(超极化激活的内电流,Ih)和减少我泵3。这一观察导致探索我泵如何与Ih相互作用,以及它们的相互调制如何有助于HN神经元的节奏活动。通过增加[Na]i (使用离子酚莫宁辛) 来激活泵,在 HN HCOs 和分离的 HN 神经元4中加快 HN 爆发节律。这种加速取决于我h.当我h被阻塞 (2 mM Cs+),爆裂期没有改变这种泵激活方法:然而,爆发持续时间(BD)被缩短,在HNHCOs和分离的HN神经元4的爆发间隔(IBI)增加。
对于此协议,活HN(7)神经元的所有电流,包括泵电流 ,I泵,都纳入HN模型如下:
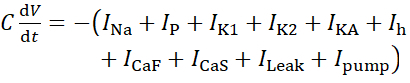 (1)
(1)
其中C是膜电容(在nF),V是膜电位(在V),t是时间(在s)。详细的离子电流描述和方程已经描述了其他地方2,4。完整的HN模型神经元实时运行(图2)。该软件将在GitHub上发布,并适合在材料表中描述的数字信号处理板上运行。在这里,查询的焦点是 Na+/K+泵电流(I泵) 和电压门电流贡献显著的 Na+通量: 快速纳+电流(INa) 和持久纳+电流(IP)。这些电流的最大导电性 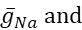
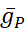 分别为。Na=/K=泵交换三个细胞内 Na=离子,交换两个细胞外 K=离子,从而产生净外流。重要的是,它泵出的神经元是当前指示的3倍,这对计算细胞内Na的浓度很重要。
分别为。Na=/K=泵交换三个细胞内 Na=离子,交换两个细胞外 K=离子,从而产生净外流。重要的是,它泵出的神经元是当前指示的3倍,这对计算细胞内Na的浓度很重要。
Na+/K= 泵电流取决于细胞内 Na= 浓度,并通过以下阴性函数表示:
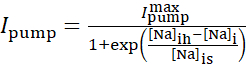 (2)
(2)
其中[Na]i 是细胞内 Na=浓度,  是最大 Na=/K=泵电流, [Na]ih是细胞内 Na=浓度为 Na+/K=泵的半激活, [Na]是Na=/K=泵对[Na]i的敏感性。[Na]i 生成由于IP和INa携带的 Na+流入, 并被 Na+ /K+泵的 Na+efflux 减少。Ih和我泄漏对总 Na+通量的贡献很小,在实时模型中不考虑。
是最大 Na=/K=泵电流, [Na]ih是细胞内 Na=浓度为 Na+/K=泵的半激活, [Na]是Na=/K=泵对[Na]i的敏感性。[Na]i 生成由于IP和INa携带的 Na+流入, 并被 Na+ /K+泵的 Na+efflux 减少。Ih和我泄漏对总 Na+通量的贡献很小,在实时模型中不考虑。
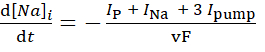 (3)
(3)
其中,v 是细胞内 Na+ 水库的体积 (+6.7 pL),F 是法拉第的常数,细胞外 Na= 浓度保持不变。
电压门和泄漏导电已区分 - 这些对膜电位的反应 - 从泵电流,这是由计算的细胞内 Na=浓度 ([Na]i)调节。[娜]我通过 Na+条目通过快速 Na+电流(iNa)建立起来, 产生行动潜力 (尖峰) 和持久的 Na+电流(IP),提供去极化, 以支持尖峰。[娜]反过来,我通过Na的挤出,泵的动作减少了。已假设基线活HN值  (5nS) 和
(5nS) 和 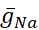 (150 nS), 我们考虑任何添加的动态夹
(150 nS), 我们考虑任何添加的动态夹  。
。
此处描述的协议的目标是实时精确和可逆地操作I泵,以发现它如何与电压门电流(当前协议中的持久 Na+电流)相互作用,以控制单个 HN 中的节奏爆裂。为了实现这一目标,使用了动态夹子,在命令下人为地引入任何电流的精确量,这些电流可以根据模型运行情况进行计算。这种方法比影响整个组织的泵的药理操作具有优势,具有偏离目标的效果,通常难以逆转,而且无法精确操纵。动态夹子5,6实时读取记录神经元的电压 (图 1B),并实时计算和注入任何电流的量基于模型方程和任何 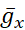 或
或  .类似的方法可以很容易地应用于任何神经元,可以记录在细胞内。但是,参数必须重新缩放到所选的神经元,并且神经元应从突触输入中分离出来,例如,在药理学上。
.类似的方法可以很容易地应用于任何神经元,可以记录在细胞内。但是,参数必须重新缩放到所选的神经元,并且神经元应从突触输入中分离出来,例如,在药理学上。
研究方案
注:无脊椎动物实验科目不受NIH或埃默里和佐治亚州立大学的监管。尽管如此,我们还是采取了所有措施,尽量减少这项工作中使用的水痘的痛苦。
1. 从水痘神经线准备孤立的结石 7
- 在 12:12 光暗循环中以 16 °C 在去电离水中稀释的人工池塘水中(含 0.05% w/v 的海盐)中保持水痘Hirudo verbana。
- 将水痘冷麻醉在碎冰床上>10分钟,直到不动,为解剖做好准备。
- 将一个黑色树脂衬里解剖盘填充到 ±1 厘米的深度,在去电离水中含有 115 mM NaCl、4 mM KCl、1.7 mM CaCl2、10mM D-葡萄糖和 10 mM HEPES 的冷藏盐水;ph 调整为 7.4 与 1 M Naoh 。将水痘背侧固定在黑色树脂衬里室(至少 20 厘米 x 10 厘米,深度至少比树脂高 2 厘米,至少 2 厘米厚)。
- 在20倍放大的体质显微镜下,用斜光引导照明,用5毫米弹簧剪刀穿过身体1/3部分 的体壁,使纵向切割至少3厘米长。使用别针拉开身体壁,暴露内部器官。
注:任何储存的血餐都可以通过用火抛光巴斯德移液器吸走。 - 孤立单个中体结节7(第七个自由段结节烧结到大脑)。
- 使用 5 mm 弹簧剪刀打开神经线所在所在鼻窦。一定要将鼻窦以圆周方式分裂,并通风留下两条鼻窦。使用锋利的 #5 钳子帮助引导切割和保持鼻窦。
- 将鼻窦附着在结石中产生的两个双边神经根(它紧紧粘附于每个根部)上,用这些鼻窦条固定结石。
- 通过切割连接结肠(尽可能远离第 7束结石)和鼻窦条的结肠和结肠结扎神经束,从体内取出结石,然后横向切开根部,直线切至从鼻窦中浮出的位置。
- 用缩短的细小昆虫针固定结石(使用旧钝化 #5 钳),在透明树脂衬里培养皿中将腹腔向上。将针脚插入鼻窦条和松散组织,粘附在根部以及椎骨和花椰菜结缔上,尽可能远离结石。
注:如果在录制过程中要从下面获得良好的照明,树脂的厚度不得小于 3 毫米。确保结石是绷紧的,无论是纵向还是横向 - 将立体显微镜的放大倍数提高到40倍或更高,并调整倾斜照明,使神经元细胞体在腹膜正下方的结石的腹腔表面上很容易看到。
- 用微丝器去除结石(去皮)的内膜。
- 开始除套,在一侧的根部之间切割松动的护套,然后横向切开另一侧,确保剪刀刀片表面,不会直接伤害护套下方的神经元细胞体。
- 从中线的横切中做出类似的表面切口。
- 现在用细#5钳子抓住护套的腹腔皮瓣,把它从结石上拉开,然后用微丝刀切断它。
- 在另一侧重复;此过程暴露了两个HN(7)神经元,用于用微电极进行记录。
- 将制备盘放在录制设置中,并在室温下以 5 mL/min 的流量超盐水。
2. 用锋利的微电极识别和记录水痘心脏内膜
- 在 HN(7) 神经元(记录持续 30 到 60 分钟)期间,通过数字数据采集(模拟到数字、A 到 D)和刺激(数字到模拟、D 到 A)系统,以 5 kHz 的速度从神经生理电流采样中获取和数字化细胞内电流和电压痕迹, 并在计算机屏幕上显示。
注:任何商业或定制软件和 A 到 D/D 到 A 板可用于数据采集(A 到 D)。动态夹具需要 D 到 A 和自定义软件。 - 在50-100x的恒河镜下,从下面暗场照明,初步确定一个HN(7)神经元的双边对的规范位置,在后体结石七的后部位置。
- 现在的目标是使用微操纵器,用充满2M醋酸钾和20mM KCl的锐利微电极穿透假定的HN(7)神经元。
- 将微电极放置在目标细胞体附近。
- 持续观察电表记录的电位,并在穿透神经元之前将该电位设置为 0 mV。
- 通过微电极慢慢地将电极沿着其长轴与操纵器一起驱动,从而穿透神经元。使用电表嗡嗡声功能,设置为 100 ms 嗡嗡声持续时间,直到观察到膜电位的负变化和剧烈的尖刺活动。
- 将电表设置在不连续电流夹模式 (DCC) ≥ 3 kHz,以同时记录膜电位并通过电流与单微电极(容量补偿设置为略低于振铃,然后拨回 10%)。
- 在示波器上监视 DCC 期间电极的沉降。
- 用电表稳定电流喷油器注入 -0.1 nA 的稳定电流一两分钟,以稳定记录。
- 通过其特有的尖峰形状和弱爆裂活动(图1Ci)确定HN(7)神经元。
- 实验完成后,在离线执行任何数据分析,并将所有数据保存在磁盘上。
3. 构建实时HN或其他模型神经元
- 使用数字信号处理板 (DSB) 构建自定义软件:D 到 A 和 A 到 D) 在桌面计算机中实时实现2、4或其他神经元或实验中描述的模型电流。
- 使用霍奇金-赫克斯利风格方程,因为它们是代表模型电流的通常首选方法。
- 请参阅7, 详细描述在添加泵电流之前实时 HN 模型和动态夹具的实现情况。请参阅介绍部分,介绍 HN 模型中活HN (7) 神经元的电流、细胞内 Na+ 浓度和导电。
4. 实现和改变动态夹导电导电/电流
- 使用 DSB 定制的动态夹紧软件,实时实现和更改任何图形用户界面 (图 3)(GUI) 可访问的 HN(7) 神经元 HN 实时模型的编程导电和电流。
注:作为提醒,
 是持久纳电 流(IP)和最大泵电流(I泵)的最大传导率。
是持久纳电 流(IP)和最大泵电流(I泵)的最大传导率。 - 使用软件中的 GUI 输入框在模型运行时,在
 (PumpMaxL 框)和
(PumpMaxL 框)和  (GpinHNLive 框) (图 3)中进行更改。
(GpinHNLive 框) (图 3)中进行更改。
注:GUI 输入框接受键入值,建议使用 0.1 nA 的步骤,并建议 1 nS 的步骤。
的步骤,并建议 1 nS 的步骤。 
- 添加少量
 和
和  动态夹子,以稳定HN(7)神经元的爆裂,该神经元被微电极引起的泄漏削弱,如图 1Cii所示。
动态夹子,以稳定HN(7)神经元的爆裂,该神经元被微电极引起的泄漏削弱,如图 1Cii所示。
注:锐利的微电极渗透会导致膜损伤,表现为泄漏传导性增加或输入电阻降低。 - 首先添加
 0.1-0.2 nA 值,它弥补了微电极诱发的泄漏,但抑制了兴奋性,然后逐渐增加
0.1-0.2 nA 值,它弥补了微电极诱发的泄漏,但抑制了兴奋性,然后逐渐增加  ,这增加了兴奋性,直到定期爆裂,通常在
,这增加了兴奋性,直到定期爆裂,通常在  +1-4 nS (图 4A)。
+1-4 nS (图 4A)。
- 添加少量
- 系统地将这些电流(增量为0.1 nA
 表示,1 nS为
表示,1 nS为  )与动态夹子记录的HN(7)神经元(图3)共同变化,并评估它们对爆裂特性的影响:峰值频率(f:爆发期间间尖峰间隔平均值的对等)、爆发间隔(IBI:一次爆发中最后一个峰值到下一次爆发中第一个峰值之间的时间), 爆裂持续时间(BD:在突发中的第一个峰值和在突发中的最后一个峰值之间的时间)和爆发周期(T:在突发中的第一个峰值和随后的爆发中第一个峰值之间的时间)。
)与动态夹子记录的HN(7)神经元(图3)共同变化,并评估它们对爆裂特性的影响:峰值频率(f:爆发期间间尖峰间隔平均值的对等)、爆发间隔(IBI:一次爆发中最后一个峰值到下一次爆发中第一个峰值之间的时间), 爆裂持续时间(BD:在突发中的第一个峰值和在突发中的最后一个峰值之间的时间)和爆发周期(T:在突发中的第一个峰值和随后的爆发中第一个峰值之间的时间)。- 改变价值

 ,像视频演示一样,熟悉技术,然后冒险出去。
,像视频演示一样,熟悉技术,然后冒险出去。 以特定的固定值保持,并在一系列
以特定的固定值保持,并在一系列  支持定期爆裂活动时以 1 nS 增量扫描。
支持定期爆裂活动时以 1 nS 增量扫描。- 现在将固定值增加
 0.1 nA,并再次扫过一系列
0.1 nA,并再次扫过一系列  支持常规爆裂活动。
支持常规爆裂活动。 - 对于每个实施的参数对,收集包含至少 8 次突发的数据,以便制定可靠的平均测量值 f、IBI、BD 和 T。
- 继续扫荡,只要神经元仍然可行,通过强尖刺和稳定的振荡基线潜力来评估。
- 从几个神经元(来自不同的动物)收集数据,生成复合图(图5)。
- 改变价值
结果
随着I泵4的加入,模型使介绍部分的实验结果更加突出,并开始解释泵辅助爆裂机制。此处演示的实时模型已经过调整( 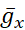 和
和  选择参数),以便它产生属于实验中观察到的正常活动范围(f、IBI、BD、T)的常规节奏活动,并在模型中肌霉素调节参数
选择参数),以便它产生属于实验中观察到的正常活动范围(f、IBI、BD、T)的常规节奏活动,并在模型中肌霉素调节参数  (最大泵电流)和
(最大泵电流)和 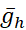 (h 电流最大传导性)变化或共变时继续产生此类活动。确定的参数值可用作建模实验的基准或规范设置。在这些模型实例中,我泵振荡整个爆裂周期为 [Na]i围绕基线水平。I泵有助于在爆发阶段终止,它产生的超极化在 IBI 期间激活Ih: 注意到Ih接近爆裂启动的最大水平(图2)。
(h 电流最大传导性)变化或共变时继续产生此类活动。确定的参数值可用作建模实验的基准或规范设置。在这些模型实例中,我泵振荡整个爆裂周期为 [Na]i围绕基线水平。I泵有助于在爆发阶段终止,它产生的超极化在 IBI 期间激活Ih: 注意到Ih接近爆裂启动的最大水平(图2)。
虽然实时HN模型已全部实现电流2,4可用于动态夹紧,这里的重点是  和
和  ,这是可用于变化,而模型运行在动态夹桂(图3)。动态夹子允许实验者将(或减去负电
,这是可用于变化,而模型运行在动态夹桂(图3)。动态夹子允许实验者将(或减去负电 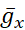 路或
路或  )任何电导或电流人工添加到模拟真实传导或电流的电压和离子依赖性的神经元中。因此,可以充分探讨特定导电/电流如何与细胞内的内源导电/电流相互作用(图1)。实时HN模型表明,持续的Na+电流(IP)在HN神经元中贡献了大部分 Na+条目强烈影响 [Na]i(图 2),因此,我泵。因为我P是活跃在相对负膜潜力, 它反对我泵, 即使在 Ibi 期间。
)任何电导或电流人工添加到模拟真实传导或电流的电压和离子依赖性的神经元中。因此,可以充分探讨特定导电/电流如何与细胞内的内源导电/电流相互作用(图1)。实时HN模型表明,持续的Na+电流(IP)在HN神经元中贡献了大部分 Na+条目强烈影响 [Na]i(图 2),因此,我泵。因为我P是活跃在相对负膜潜力, 它反对我泵, 即使在 Ibi 期间。
这些观察表明,它具有启发性,探索与 
 动态夹的分离HN神经元之间的相互作用,如前所述的8,9,10。这些实验(正在进行中)是用单个突触分离的HN(7)神经元(从神经线分离的第七个结节)中用尖锐的微电极记录进行的。迄今为止,这些实验表明,通过与动态夹子(图4)共同添加IP和I泵,在具有活力的HN神经元(由于微电极渗透引入泄漏)中恢复了强爆。这是一个重要的观察表明,这些神经元(即使泄漏被破坏)中存在爆裂机制,这是由I泵和IP相互作用的结果。初步结果表明,它们具有很强的复杂相互作用,可以在模型和实验中探索(图5)。
动态夹的分离HN神经元之间的相互作用,如前所述的8,9,10。这些实验(正在进行中)是用单个突触分离的HN(7)神经元(从神经线分离的第七个结节)中用尖锐的微电极记录进行的。迄今为止,这些实验表明,通过与动态夹子(图4)共同添加IP和I泵,在具有活力的HN神经元(由于微电极渗透引入泄漏)中恢复了强爆。这是一个重要的观察表明,这些神经元(即使泄漏被破坏)中存在爆裂机制,这是由I泵和IP相互作用的结果。初步结果表明,它们具有很强的复杂相互作用,可以在模型和实验中探索(图5)。
最后,我泵响应 [Na]i在爆裂活动期间的周期性增加有助于通过爆裂终止(减少 BD)的爆发节奏。IP和I泵的相互作用构成了一个足以支持内源性爆裂活动的机制:这种机制可以恢复在 HN 内周记录在结石 7 中记录的强力爆裂。IP和我之间的相互作用通过[Na]i影响 HN 爆发周期非单调,并确保自主爆裂的稳健性。这些结论符合脊椎动物系统11、12的实验和建模。
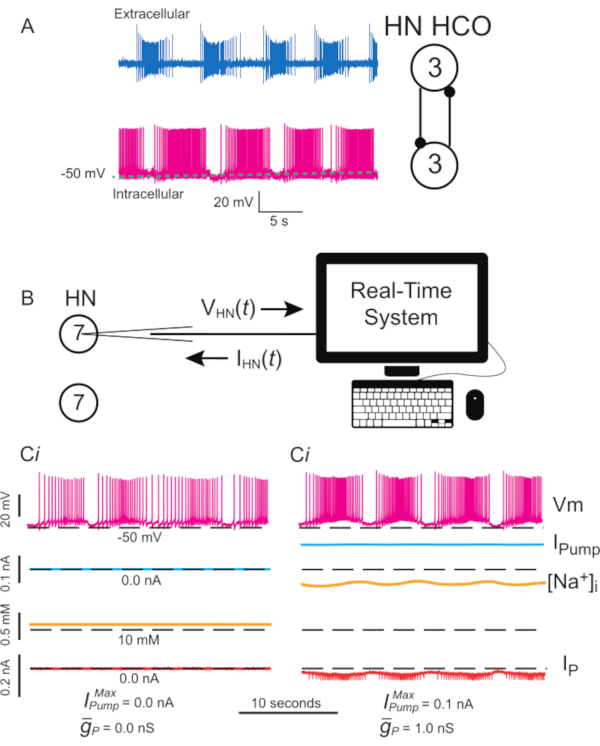
图1:利奇心脏内膜电活动及实施I泵与IP带动态夹。 (A) 正常爆裂活动同时记录,细胞外(顶部)和细胞内(下),从第三个结节,记录神经元及其相互抑制的突触连接在右侧的水痘心跳HCO。(B) 动态夹示意图,当记录HN(7)内窥镜在一个孤立的结节7:请注意,两个HN(7)内窥孔之间没有突触相互作用。(Ci)爆裂在泄漏泄漏的HN(7)内窥孔。(Cii)通过添加动态夹I泵  (= 0.1 nA), 可以产生更坚固的爆裂,这弥补了微电极诱导泄漏,但抑制了兴奋性
(= 0.1 nA), 可以产生更坚固的爆裂,这弥补了微电极诱导泄漏,但抑制了兴奋性  ,(1 nS),这增加了兴奋性。黑色虚线表示基线值。缩写: HN = 心脏内窥欧;HCO = 半中心振荡器;我泵=向外电流;IP =持久纳+电流;
,(1 nS),这增加了兴奋性。黑色虚线表示基线值。缩写: HN = 心脏内窥欧;HCO = 半中心振荡器;我泵=向外电流;IP =持久纳+电流; • 最大 Na=/K=泵电流;
• 最大 Na=/K=泵电流;  • 持久 Na+电流的最大传导;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
• 持久 Na+电流的最大传导;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
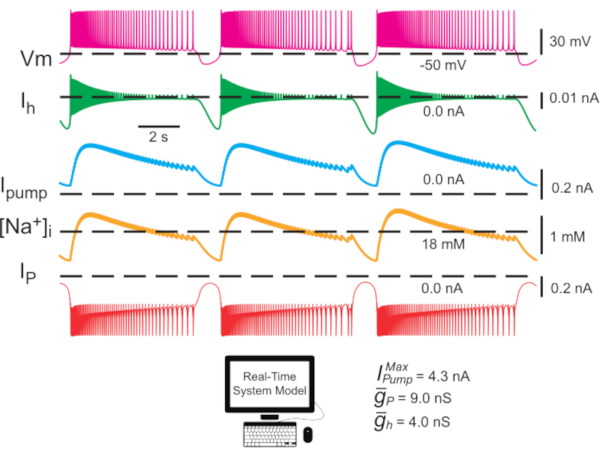
图2:单HN内膜模型显示膜电位(Vm),I h,我泵,[Na]i,和IP的痕迹。向外超极化电流为负数,向内去极化电流为正极。黑色虚线表示基线值。缩写: HN = 心脏内窥欧;我泵=向外电流;IP =持久纳+电流; • 最大 Na=/K=泵电流;i h =超极化激活的内电流;
• 最大 Na=/K=泵电流;i h =超极化激活的内电流; • 持久 Na+电流的最大传导;
• 持久 Na+电流的最大传导; 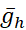 • 超极化激活的内电流的最大传导性;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
• 超极化激活的内电流的最大传导性;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
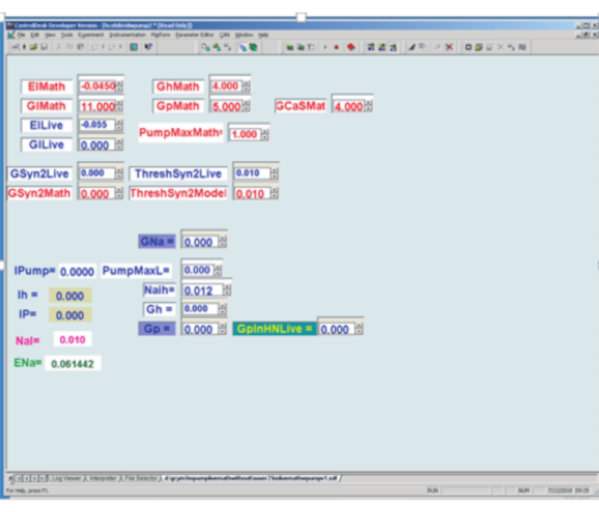
图3:数字信号处理板上实现实时心脏内膜(HN)模型和动态夹具的图形用户界面。左上角:红色数学框是实时模型的用户确定参数框,而蓝色实时框是动态夹子中使用的用户确定参数框。El = 泄漏电流的反转潜力;Gl = 泄漏传导;Gh = h 电流最大传导;Gp = P 当前最大传导;GCAS = 慢钙电流最大传导;泵最大电流= 泵最大电流;•GSyn2 对各自神经元的最大突触传导;ThreshSyn2 峰值跨过阈值以介导突触电位 - 这些阈值用于制造混合(活/模型)半中心振荡器,此处未图示。左下部用于动态夹紧。最左边是动态夹变量的 5 个计算值:我泵= 泵电流注入;Ih = 注入 h 电流 (此处未使用);IP = 注入 P 电流;奈 = 计算内部 Na=浓度;ENa = 计算钠逆转潜力。左下部用于动态夹紧。计算变量的右侧是 6 个用户确定的参数框:GNa = 假定内源性快速钠最大传导使用来计算 Na=与行动电位相关的通量;泵最大磁性泵电流,由动态夹子注入;奈见方程 (2);Gh = 最大传导性,以确定由动态夹子注入的 h 电流;Gp = 假定内源 P 电流最大传导使用来计算 Na=与内源 P 电流相关的通量;GpinHNLive = 最大传导性,以确定要通过动态夹子注入的 P 电流。请单击此处查看此图的较大版本。
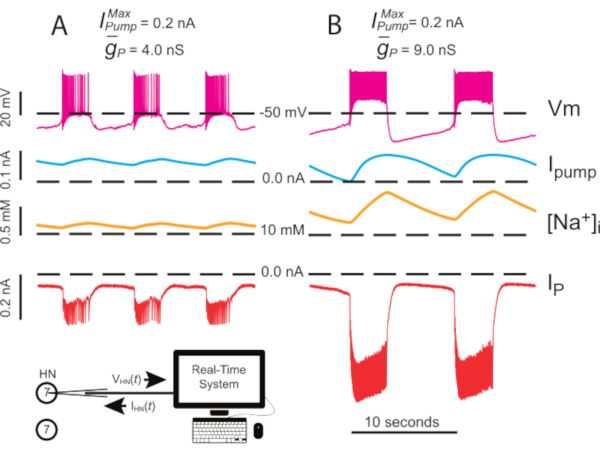
图4:独立HN(7)爆裂的动态夹紧分析。 从(A) 4.0 nS 到(B) 9.0 nS 的调高减慢了独立的 HN 爆发节奏。实验痕迹显示有节奏的爆发在孤立的HN(7)神经元与动态夹。[Na] i 和Vm 的振荡范围随着监管的增加而增加
从(A) 4.0 nS 到(B) 9.0 nS 的调高减慢了独立的 HN 爆发节奏。实验痕迹显示有节奏的爆发在孤立的HN(7)神经元与动态夹。[Na] i 和Vm 的振荡范围随着监管的增加而增加  。从上到下的痕迹:记录Vm,注射我泵,计算[Na]i,并注射IP。黑色虚线表示基线值。缩写: HN = 心脏内窥欧;我泵=向外电流;IP =持久纳+电流;
。从上到下的痕迹:记录Vm,注射我泵,计算[Na]i,并注射IP。黑色虚线表示基线值。缩写: HN = 心脏内窥欧;我泵=向外电流;IP =持久纳+电流; • 最大 Na=/K=泵电流;
• 最大 Na=/K=泵电流;  • 持久 Na+电流的最大传导;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
• 持久 Na+电流的最大传导;Vm = 膜电位;[娜]i = Na 的内部浓度=。请单击此处查看此图的较大版本。
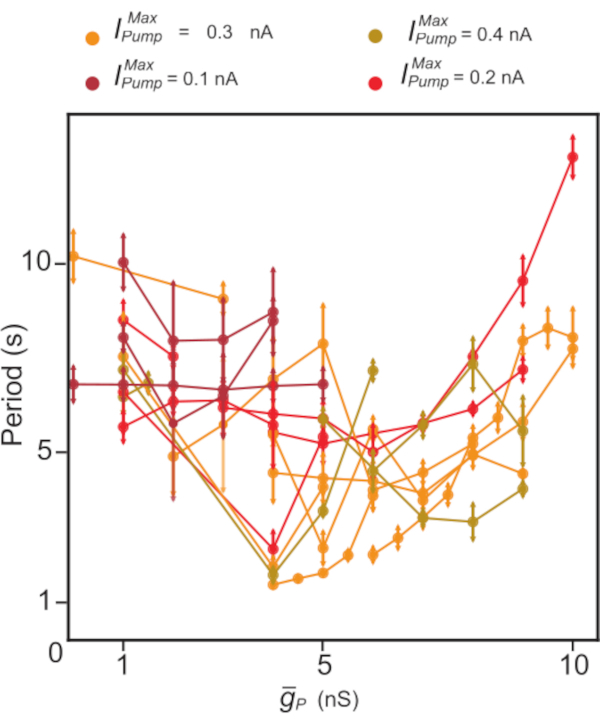
图5:独立HN(7)爆裂的动态夹紧分析。 上调  趋于减少,其次是增加的HN爆发期。在使用动态夹子的单个实验(按线连接的点)
趋于减少,其次是增加的HN爆发期。在使用动态夹子的单个实验(按线连接的点)  中,值
中,值  在保持恒定值时被扫过。颜色表示不同
在保持恒定值时被扫过。颜色表示不同  实验中使用的不同恒定添加水平。缩写: HN = 心脏内窥欧;
实验中使用的不同恒定添加水平。缩写: HN = 心脏内窥欧;  • 最大 Na=/K= 泵电流;
• 最大 Na=/K= 泵电流;  • 持久 Na+ 电流的最大传导性。 请单击此处查看此图的较大版本。
• 持久 Na+ 电流的最大传导性。 请单击此处查看此图的较大版本。
讨论
建模、动态夹子以及由此产生的分析是探索离子传导/电流个体和组对神经元电活动的有用技术(图1、图2、图4和图5)。这些技术的使用显示了 Na+/K+泵电流(I泵) 如何与电压门电流(尤其是持久 Na+电流(IP)相互作用,以促进水痘心跳模式发生器核心 HN 的强力爆裂。通过结合动态夹子实验和建模,可以比普通电压记录和电流夹技术更直接地测试模型。从动态夹子实验(图5)中收集的结果将用于进一步完善HN模型。如果可以通过电压夹实验确定神经元电流的数学模型,可以定制此处演示的动态夹紧的基本方法,以反映所研究的任何神经元的特性。
成功完成此处显示的类型实验需要在使用锐利的微电极时小心刺穿HN或其他神经元,因为电极穿透1会抑制强爆裂。(全细胞贴片记录技术,尽量减少引入泄漏,也适用于其他神经元,但对水痘神经元效果不好。至关重要的是,HN神经元的刺穿对神经元(增加泄漏)造成的损害最小,输入电阻应进行监测,并且必须在60-100 MOhms范围内才能成功进行实验4。
动态夹子是一种强大的技术,但它有神经元几何学施加的限制,因为人工传导是在记录电极的部位(通常是细胞体)实施的,而不是在节奏生成电流通常局部化为 5、6、10的部位。在水痘HN神经元中,细胞体在电学上接近神经元的整合区(主神经质),其中大多数活性电流被定位,并且尖峰被启动。
披露声明
没有
致谢
我们感谢克里斯蒂安·埃尔克斯莱本对HN(7)神经元的初步动态夹子实验,这些神经元展示了它们的爆发能力。安吉拉·温宁在专家建议下协助实验。我们感谢 NIH 通过向 GSC 和 RLC 提供赠款 1 R21 NS111355 为这项工作提供资金。
材料
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
参考文献
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。