Method Article
Contribution de la pompe Na+/K+ à l’éclatement rythmique, explorée avec la modélisation et les analyses de pince dynamique
Dans cet article
Erratum Notice
Résumé
Présenté ici est une méthode d’étude des rôles de la pompe Na+/ K+ et du courant Na+ persistant dans les interneurones cardiaques de sangsue à l’aide d’une pince dynamique.
Résumé
La pompe Na+/K+, souvent considérée comme une fonction de fond dans l’activité neuronale, contribue à un courant extérieur(pompeI)qui répond à la concentration interne de Na+ ([Na+]i). Dans les neurones en éclatement, tels que ceux trouvés dans les réseaux neuronaux du générateur de motifs centraux (CPG) qui produisent des mouvements rythmiques, on peuts’attendre à ce que la pompe [Na+] i et donc la pompeI varient tout au long du cycle de rafale. Cette réactivité à l’activité électrique, combinée à l’indépendance par rapport au potentiel membranaire, confère à lapompe I des propriétés dynamiques qui ne sont pas communes aux courants basés sur des canaux (par exemple, des canaux à tension ou à émetteur ou de fuite). De plus, dans de nombreux neurones, l’activité de la pompe est modulée par une variété de modulateurs, ce qui élargit encore le rôle potentiel de la pompe I dans l’activité d’éclatement rythmique. Cet article montre comment utiliser une combinaison de méthodes de modélisation et de pince dynamique pour déterminer comment jepompe et son interaction avec le courant Na+ persistant influencent l’activité rythmique dans un CPG. Plus précisément, cet article se concentrera sur un protocole de serrage dynamique et des méthodes de modélisation informatique dans les interneurones cardiaques des sangsues médicinales.
Introduction
Le rythme cardiaque dans les sangsues est entraîné par un CPG composé de 9 paires bilatérales d’interneurones cardiaques (HN) répartis sur autant de ganglions segmentaires du milieu du corps. Au cœur du CPG se trouvent des paires mutuellement inhibitrices d’interneurones situés dans les ganglions3e et4 e segmentaires qui forment des oscillateurs demi-centraux (HCO)(Figure 1A). Ces neurones continuent d’éclater lorsqu’ils sont isolés pharmacologiquement synaptiquement à l’aide de la bicuculline1. D’autres, comme la paire dans les ganglions du 7e segment (le centre de ce protocole), sont également des éclateurs, capables de produire une activité d’éclatement lorsqu’ils sont isolés synaptiquement. Ils ne sont pas mutuellement connectés et ne reçoivent que des entrées descendantes, et sont donc facilement isolés en coupant le ganglion du reste du cordon nerveux. Cette activité d’éclatement indépendante est sensible au courant de fuite introduit causé par la pénétration avec des microélectrodes pointues pour l’enregistrement, mais éclate vigoureusement lorsqu’il est enregistré avec des méthodes de patch lâche1.
Les neurones HN individuels et les HPO HN ont été modélisés (modèles de compartiment isopotentiel unique basés sur Hodgkin-Huxley de neurones HN contenant tous les courants voltage-gated et synaptiques identifiés expérimentalement), et toutes les caractéristiques de sursaut du système vivant ont été capturées avec succès2. La myomoduline, un neuropeptide endogène dans les sangsues, diminue considérablement la période (T) du rythme d’éclatement des neurones HN isolés et des HPO HN. Ce modulateur agit pour augmenter le courant h (courant intérieur activé par hyperpolarisation, Ih)et pour diminuer lapompeI3. Cette observation a conduit à l’exploration de la façon dont Ipump interagit avec Ih,et comment leur co-modulation contribue à l’activité rythmique des neurones HN. L’activation de la pompe en augmentant [Na+]i (à l’aide de l’ionophore monensine) accélère le rythme de l’éclatement HN dans les HCO HN et les neurones HN isolés4. Cette accélération dépendait de Ih. Lorsque Ih était bloqué (2 mM Cs+),la période d’éclatement n’était pas altérée par cette méthode d’activation de la pompe; cependant, la durée de l’éclatement (BD) a été réduite et l’intervalle d’interrafale (IBI) a augmenté à la fois dans les HPO HPO et les neurones HN isolés4.
Pour ce protocole, tous les courants d’un neurone HN(7) vivant, y compris le courant de pompe, pompeI,sont incorporés dans le modèle HN comme suit :
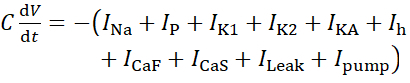 (1)
(1)
où C est la capacité membranaire (en nF), V est le potentiel membranaire (en V), t est le temps (en s). Des descriptions et des équations détaillées du courant ionique ont été décritesailleurs 2,4. Le neurone du modèle HN complet fonctionne en temps réel (Figure 2). Le logiciel sera disponible sur GitHub dès sa publication et pourra fonctionner sur la carte de traitement du signal numérique décrite dans la Table des matériaux. Ici, l’objet de la recherche est le courant de pompe Na+/ K+ (pompeI)et les courants voltage-fermés contribuant à un flux Na+ significatif: un courant Na+ rapide (INa) et un courant Na+ persistant (IP). Les conductances maximales de ces courants sont 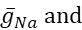
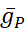 respectivement. La pompe Na+/K+ échange trois ions Na+ intracellulaires contre deux ions K+ extracellulaires, produisant ainsi un courant net vers l’extérieur. Il est important de souligner qu’il pompe 3 fois plus de Na+ hors du neurone que ce courant l’indique, ce qui est important pour calculer laconcentration intracellulaire de Na +.
respectivement. La pompe Na+/K+ échange trois ions Na+ intracellulaires contre deux ions K+ extracellulaires, produisant ainsi un courant net vers l’extérieur. Il est important de souligner qu’il pompe 3 fois plus de Na+ hors du neurone que ce courant l’indique, ce qui est important pour calculer laconcentration intracellulaire de Na +.
Le courant de pompe Na+/K+ dépend des concentrations intracellulaires de Na+ et est exprimé par la fonction sigmoïdale suivante:
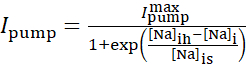 (2)
(2)
où [Na]i est la concentration intracellulaire de Na+,  est le courant maximal de la pompe Na+/K +, [Na]ih est la concentration intracellulaire de Na+ pour la demi-activation de la pompe Na+/K+, et [Na]est la sensibilité de la pompe Na+/K+ à [Na]i. [Na]i se construit à la suite des apports Na+ transportés par IP et INa et est diminué par l’efflux Na+ de la pompe Na+/K+. La contribution de Ih et ILeak au flux total de Na+ est faible et n’est pas prise en compte dans le modèle en temps réel.
est le courant maximal de la pompe Na+/K +, [Na]ih est la concentration intracellulaire de Na+ pour la demi-activation de la pompe Na+/K+, et [Na]est la sensibilité de la pompe Na+/K+ à [Na]i. [Na]i se construit à la suite des apports Na+ transportés par IP et INa et est diminué par l’efflux Na+ de la pompe Na+/K+. La contribution de Ih et ILeak au flux total de Na+ est faible et n’est pas prise en compte dans le modèle en temps réel.
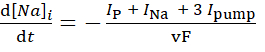 (3)
(3)
où, v est le volume (~6,7 pL) du réservoir intracellulaire Na+, F est la constante de Faraday et la concentration extracellulaire Na+ est maintenue constante.
Les conductances voltage-fermées et les conductances de fuite ont été différenciées - elles répondent au potentiel membranaire - à partir du courant de la pompe, qui est régulé par la concentration intracellulaire Na+ calculée ([Na+]i). [Na+] i est construit par l’entrée Na+ via le courant rapide Na+ (INa)qui produit des potentiels d’action (pics) et le courant Persistant Na+ (IP) qui fournit la dépolarisation pour soutenir le pic. [Na+] i est, à son tour, réduit par l’action de la pompe par l’extrusion de Na+. Des valeurs de HN vivantes de base de  (5nS) et
(5nS) et 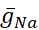 (150 nS) ont été supposées, et nous tenons compte de toute pince dynamique
(150 nS) ont été supposées, et nous tenons compte de toute pince dynamique  ajoutée.
ajoutée.
Le but du protocole décrit ici est de manipuler lapompe I de manière précise et réversible en temps réel pour découvrir comment elle interagit avec les courants voltage-fermés (courant Na+ persistant dans le protocole actuel) pour contrôler l’éclatement rythmique dans les HNs simples. Pour atteindre cet objectif, une pince dynamique a été utilisée, qui introduit artificiellement, sur commande, une quantité précise de tout courant pouvant être calculé au fur et à mesure que le modèle est en cours d’exécution. Cette méthode présente des avantages par rapport à la manipulation pharmacologique de la pompe, qui affecte l’ensemble du tissu, peut avoir des effets hors cible qui sont souvent difficiles à inverser et ne peut pas être manipulée avec précision. La pince dynamique5,6 lit la tension d’un neurone enregistré en temps réel(Figure 1B)et calcule et injecte, en temps réel, la quantité de tout courant en fonction des équations du modèle et des valeurs définies de tout ou 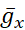
 . Des méthodes similaires peuvent facilement être appliquées à n’importe quel neurone qui peut être enregistré intracellulairement. Cependant, les paramètres devront être redimensionnés en fonction du neurone choisi et le neurone devra être isolé des entrées synaptiques, par exemple pharmacologiquement.
. Des méthodes similaires peuvent facilement être appliquées à n’importe quel neurone qui peut être enregistré intracellulairement. Cependant, les paramètres devront être redimensionnés en fonction du neurone choisi et le neurone devra être isolé des entrées synaptiques, par exemple pharmacologiquement.
Protocole
NOTE: Les sujets expérimentaux d’animaux invertébrés ne sont pas réglementés par les NIH ou les universités d’État d’Emory et de Géorgie. Toutes les mesures ont néanmoins été prises pour minimiser la souffrance des sangsues utilisées dans ce travail.
1. Préparer le ganglion isolé 7 à partir du cordon nerveux de la sangsue
- Maintenir les sangsues Hirudo verbana dans l’eau artificielle de l’étang (contenant 0,05 % p/v de sel de mer) diluée dans de l’eau désionisée à 16 °C sur un cycle lumière-obscurité de 12:12.
- Préparez les sangsues pour la dissection en les anesthésiant à froid dans un lit de glace pilée pendant >10 min jusqu’à ce qu’elles soient immobiles.
- Remplir un plat à dissection noir recouvert de résine à une profondeur d’environ 1 cm avec une solution saline réfrigérée contenant 115 mM de NaCl, 4 mM de KCl, 1,7 mM de CaCl2,10 mM de D-glucose et 10 mM d’HEPES dans de l’eau désionisée; pH ajusté à 7,4 avec 1 M NaOH. Épinglez la paroi dorsale de la sangsue dans la chambre revêtue de résine noire (au moins 20 cm x 10 cm avec une profondeur d’au moins 2 cm au-dessus de la résine d’au moins 2 cm d’épaisseur).
- Sous un steromicroscope à grossissement de 20x avec éclairage oblique du guide de lumière, faites une coupe longitudinale d’au moins 3 cm de long avec des ciseaux à ressort de 5 mm à travers la paroi du corps dans lapartie rostrale 1/3 du corps. Utilisez des épingles pour écarter la paroi du corps et exposer les organes internes.
REMARQUE: Toute farine de sang stockée peut être éliminée par aspiration avec une pipette Pasteur polie au feu. - Isoler un ganglion individuel du milieu du corps 7 (septième ganglion segmentaire libre caudal au cerveau).
- Ouvrez le sinus dans lequel réside le cordon nerveux à l’aide des ciseaux à ressort de 5 mm. Assurez-vous de fendre le sinus dorsalement et ventralement en laissant deux bandes de sinus. Utilisez des pinces pointues #5 pour aider à guider la coupe et à maintenir le sinus.
- Gardez le sinus attaché à chacune des deux racines nerveuses bilatérales qui émergent du ganglion (il adhère étroitement à chaque racine) pour utiliser ces bandes de sinus pour épingler le ganglion.
- Retirez le ganglion du corps en coupant les faisceaux de nerfs conjonctifs rostraux et caudals qui relient les ganglions (aussi loin que possible du 7e ganglion) et les bandes sinusales, puis coupez les racines latérales à l’endroit où elles émergent du sinus.
- Épinglez le ganglion (à l’aide de vieilles pinces émoussées #5) avec des épingles à insectes minuten raccourcies, côté ventral vers le haut, dans des boîtes de Petri transparentes et doublées de résine. Insérez des broches dans les bandes de sinus et de tissu lâche adhérant aux racines et aux conjonctifs rostral et caudal, aussi loin que possible du ganglion.
REMARQUE: La résine ne doit pas être plus épaisse que 3 mm si l’on veut obtenir un bon éclairage par le bas pendant l’enregistrement. Assurez-vous que le ganglion est tendu, à la fois longitudinalement et latéralement - Augmentez le grossissement du stéréomicroscope à 40x ou plus, et ajustez l’éclairage oblique afin que les corps cellulaires neuronaux puissent être facilement vus sur la surface ventrale du ganglion juste en dessous du périneurium.
- Retirer le périneurium du ganglion (desheath) avec des microcisseurs.
- Commencez le deschauffage en coupant la gaine lâche entre les racines d’un côté et continuez la coupe latéralement de l’autre côté, en veillant à garder les lames de ciseaux superficielles et à ne pas endommager les corps cellulaires neuronaux directement sous la gaine.
- Faites une coupe superficielle similaire caudalement à partir de la coupe latérale le long de la ligne médiane.
- Maintenant, attrapez le lambeau caudolatéral de la gaine d’un côté avec la fine pince n ° 5, éloignez-le du ganglion et coupez-le avec les microcisseurs.
- Répétez de l’autre côté; cette procédure expose les deux neurones HN(7) pour l’enregistrement avec des microélectrodes.
- Placez la boîte de préparation dans la configuration d’enregistrement et superamorcez-la avec une solution saline à un débit de 5 mL / min à température ambiante.
2. Identifier et enregistrer les interneurones cardiaques de sangsue avec des microélectrodes pointues
- Pendant la durée de l’enregistrement du neurone HN(7) (les enregistrements durent entre 30 et 60 min), acquérir et numériser les traces de courant et de tension intracellulaires d’un électromètre neurophysiologique échantillonnant à une vitesse de 5 kHz avec un système d’acquisition de données numériques (analogique à numérique, A à D) et de stimulation (numérique à analogique, D à A), et s’afficher sur un écran d’ordinateur.
REMARQUE: Tout logiciel commercial ou personnalisé et la carte A à D / D à A peuvent être utilisés pour l’acquisition de données (A à D). D à A et un logiciel sur mesure sont nécessaires pour la pince dynamique. - Sous un steromicroscope à 50-100x avec un éclairage en champ sombre par le bas, identifiez provisoirement un neurone HN(7) de la paire bilatérale par son emplacement canonique à la position postriolatérale dans le ganglion du milieu du corps sept.
- Maintenant, visez à pénétrer le neurone putatif HN(7) avec une microélectrure pointue remplie d’acétate de potassium 2 M et de KCl 20 mM à l’aide d’un micromanipulateur.
- Placez la microélectrographe très près du corps cellulaire cible.
- Observez en permanence le potentiel enregistré avec l’électromètre et réglez ce potentiel à zéro mV avant de pénétrer dans le neurone.
- Pénètrez dans le neurone avec la microélectrographe, en entraînant lentement l’électrode le long de son long axe avec le manipulateur. À l’aide de la fonction de bourdonnement de l’électromètre, réglée sur une durée de bourdonnement de 100 ms, jusqu’à ce qu’un changement négatif du potentiel membranaire et une activité de pic vigoureuse soient observés.
- Réglez l’électromètre en mode de serrage de courant discontinu (DCC) ≥ 3 kHz pour enregistrer simultanément le potentiel de la membrane et transmettre le courant avec la microélectrographe unique (compensation de capacité réglée juste en dessous de la sonnerie, puis recomposée à 10%).
- Surveillez la décantation de l’électrode pendant le DCC sur un oscilloscope.
- Injectez un courant constant de -0,1 nA avec l’injecteur de courant constant de l’électromètre pendant une minute ou deux pour stabiliser l’enregistrement.
- Identifier définitivement le neurone HN(7) par sa forme de pointe caractéristique et sa faible activité d’éclatement(Figure 1Ci).
- Effectuez toute analyse de données hors connexion une fois l’expérience terminée et enregistrez toutes les données sur un disque.
3. Construire un HN en temps réel ou un autre neurone modèle
- Créez un logiciel personnalisé à l’aide d’une carte de traitement du signal numérique (DSB; D à A et A à D) dans un ordinateur de bureau pour implémenter en temps réel les courants de modèle décrits en2,4 ou des courants de modèle différents pour d’autres neurones ou expériences.
- Utilisez des équations de style Hodgkin-Huxley car elles constituent la méthode généralement préférée pour représenter les courants du modèle.
- Voir7 pour une description détaillée de la mise en œuvre du modèle HN en temps réel et de la pince dynamique avant l’ajout du courant de la pompe. Reportez-vous à la section d’introduction pour la description des courants, de la concentration intracellulaire de Na+ et des conductances du neurone HN(7) vivant dans le modèle HN.
4. Mettre en œuvre et faire varier les conductances/courants de serrage dynamiques
- Utilisez le logiciel de pince dynamique sur mesure pour le DSB pour implémenter et modifier en temps réel la pince dynamique de l’interface utilisateur graphique(Figure 3)(GUI) des conductances et des courants programmés accessibles du modèle HN en temps réel du neurone HN (7).
REMARQUE: Pour rappel, et
et  sont la conductance maximale du courant persistant Na+ (IP) et du courant maximal de la pompe (Ipompe), respectivement.
sont la conductance maximale du courant persistant Na+ (IP) et du courant maximal de la pompe (Ipompe), respectivement. - Utilisez les zones de saisie gui dans le logiciel pour apporter des modifications, au fur et à mesure que le modèle est en cours d’exécution, dans la
 boîte (PumpMaxL) et
boîte (PumpMaxL) et  (boîte GpinHNLive) (Figure 3).
(boîte GpinHNLive) (Figure 3).
REMARQUE : Les zones de saisie de l’interface graphique acceptent les valeurs typées, et les étapes de 0,1 nA sont recommandées pour et les étapes de 1 nS sont recommandées pour
et les étapes de 1 nS sont recommandées pour  .
.- Ajouter de petites quantités de
 et avec une pince dynamique pour stabiliser
et avec une pince dynamique pour stabiliser  l’éclatement du neurone HN(7), qui est affaibli par une fuite induite par une microélectronique, comme le montre la figure 1Cii.
l’éclatement du neurone HN(7), qui est affaibli par une fuite induite par une microélectronique, comme le montre la figure 1Cii.
REMARQUE: Une forte pénétration de la microélectronique provoque des dommages à la membrane qui se font par une augmentation de la conductance de fuite ou une diminution de la résistance d’entrée. - Commencez par ajouter une valeur
 de 0,1-0,2 nA, ce qui compense la fuite induite par la microélectrode, mais déprime l’excitabilité, puis augmente progressivement
de 0,1-0,2 nA, ce qui compense la fuite induite par la microélectrode, mais déprime l’excitabilité, puis augmente progressivement  , ce qui augmente l’excitabilité, jusqu’à ce qu’un éclatement régulier s’ensuive, généralement à
, ce qui augmente l’excitabilité, jusqu’à ce qu’un éclatement régulier s’ensuive, généralement à  ~1-4 nS(Figure 4A).
~1-4 nS(Figure 4A).
- Ajouter de petites quantités de
- Faire systématiquement varier ces courants (incréments de 0,1 nA pour
 et 1 nS pour
et 1 nS pour  ) au neurone HN(7) enregistré avec une pince dynamique (Figure 3), et évaluer leurs effets sur les caractéristiques du sursaut : fréquence du pic (f : la réciproque de la moyenne de l’intervalle interspike lors d’un burst), intervalle d’interburst (IBI : le temps entre le dernier pic d’un burst et le premier pic du sursaut suivant), durée de rafale (BD : le temps entre le premier pic d’une rafale et le dernier pic d’une rafale), et période de rafale (T : le temps entre le premier pic d’une rafale et le premier pic de la rafale suivante).
) au neurone HN(7) enregistré avec une pince dynamique (Figure 3), et évaluer leurs effets sur les caractéristiques du sursaut : fréquence du pic (f : la réciproque de la moyenne de l’intervalle interspike lors d’un burst), intervalle d’interburst (IBI : le temps entre le dernier pic d’un burst et le premier pic du sursaut suivant), durée de rafale (BD : le temps entre le premier pic d’une rafale et le dernier pic d’une rafale), et période de rafale (T : le temps entre le premier pic d’une rafale et le premier pic de la rafale suivante).- Changez les valeurs de
 et , comme dans la démonstration
et , comme dans la démonstration  vidéo, pour vous familiariser avec la technique, puis aventurez-vous.
vidéo, pour vous familiariser avec la technique, puis aventurez-vous.- Maintenez
 à une valeur fixe spécifique et balayez par incréments de 1 nS sur une plage d’activité d’éclatement
à une valeur fixe spécifique et balayez par incréments de 1 nS sur une plage d’activité d’éclatement  régulière.
régulière. - Maintenant, augmentez la valeur fixe de
 0,1 nA et balayez à nouveau une plage
0,1 nA et balayez à nouveau une plage  d’activité d’éclatement régulière de soutien.
d’activité d’éclatement régulière de soutien. - Pour chaque paire de paramètres implémentée, collectez des données contenant au moins 8 rafales afin de pouvoir effectuer des mesures moyennes fiables de f, IBI, BD et T.
- Continuez avec les balayages aussi longtemps que le neurone reste viable, tel qu’évalué par un fort pic et un potentiel d’oscillation de base stable.
- Collecter des données à partir de plusieurs neurones (de différents animaux) pour générer un graphique composite (Figure 5).
- Maintenez
- Changez les valeurs de
Résultats
La modélisation avec l’ajout de la pompeI4 a mis en évidence les résultats expérimentaux présentés dans la section d’introduction et a commencé à expliquer le mécanisme d’éclatement assisté par pompe. Le modèle en temps réel démontré ici a été réglé 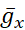 (et
(et  les paramètres choisis) de sorte qu’il produise une activité rythmique régulière entrant dans les limites de l’activité normale observée dans les expériences - f, IBI, BD, T - et continue à produire une telle activité lorsque les paramètres modulés par la myomoduline
les paramètres choisis) de sorte qu’il produise une activité rythmique régulière entrant dans les limites de l’activité normale observée dans les expériences - f, IBI, BD, T - et continue à produire une telle activité lorsque les paramètres modulés par la myomoduline  (le courant maximal de la pompe) et
(le courant maximal de la pompe) et 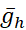 (la conductance maximale du courant h) sont variés ou co-variés dans le modèle. Les valeurs de paramètres déterminées peuvent être utilisées comme référence ou ensemble canonique pour les expériences de modélisation. Dans ces instances de modèle, jepompe oscille tout au long du cycle de rafale comme [Na+] i autourd’un niveau de base. Lapompe I contribue à la terminaison de l’éclatement pendant la phase d’éclatement, et l’hyperpolarisation qu’elle produit active I h pendant l’IBI; remarquez le niveau maximal de Ih près de l’amorçage de l’éclatement (Figure 2).
(la conductance maximale du courant h) sont variés ou co-variés dans le modèle. Les valeurs de paramètres déterminées peuvent être utilisées comme référence ou ensemble canonique pour les expériences de modélisation. Dans ces instances de modèle, jepompe oscille tout au long du cycle de rafale comme [Na+] i autourd’un niveau de base. Lapompe I contribue à la terminaison de l’éclatement pendant la phase d’éclatement, et l’hyperpolarisation qu’elle produit active I h pendant l’IBI; remarquez le niveau maximal de Ih près de l’amorçage de l’éclatement (Figure 2).
Bien que le modèle HN en temps réel ait tous implémenté les courants2,4 disponibles pour le serrage dynamique, l’accent a été mis ici sur  et , qui sont disponibles pour les
et , qui sont disponibles pour les  modifications pendant que le modèle est en cours d’exécution dans l’interface graphique de serrage dynamique ( Figure3). La pince dynamique permet à l’expérimentateur d’ajouter (ou de soustraire avec un négatif
modifications pendant que le modèle est en cours d’exécution dans l’interface graphique de serrage dynamique ( Figure3). La pince dynamique permet à l’expérimentateur d’ajouter (ou de soustraire avec un négatif 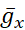 ou
ou  ) toute conductance ou tout courant dans un neurone artificiellement qui imite la tension et la dépendance ionique d’une conductance ou d’un courant réel. Ainsi, il est possible d’explorer pleinement comment une conductance/un courant particulier interagit avec les conductances/courants endogènes à l’intérieur des cellules (Figure 1). Le modèle HN en temps réel indique que le courant Persistant Na+ (IP)dans les neurones HN contribue une grande partie de l’entrée Na+ affectant fortement [Na+]i (Figure 2) et donc, jepompe. Parce que IP est actif à des potentiels membranaires relativement négatifs, il s’oppose à ce que jepompe même pendant l’IBI.
) toute conductance ou tout courant dans un neurone artificiellement qui imite la tension et la dépendance ionique d’une conductance ou d’un courant réel. Ainsi, il est possible d’explorer pleinement comment une conductance/un courant particulier interagit avec les conductances/courants endogènes à l’intérieur des cellules (Figure 1). Le modèle HN en temps réel indique que le courant Persistant Na+ (IP)dans les neurones HN contribue une grande partie de l’entrée Na+ affectant fortement [Na+]i (Figure 2) et donc, jepompe. Parce que IP est actif à des potentiels membranaires relativement négatifs, il s’oppose à ce que jepompe même pendant l’IBI.
Ces observations indiquent qu’il est instructif d’explorer les interactions entre  et dans les
et dans les  neurones HN isolés avec une pince dynamique comme discuté précédemment8,9,10. Ces expériences (en cours) sont réalisées avec des enregistrements de microélectrodes pointus dans des neurones HN(7) isolés synaptiquement (septième ganglion sectionné du cordon nerveux). À ce jour, ces expériences montrent que l’éclatement robuste est restauré dans les neurones HN tonalement actifs (en raison de la fuite de pénétration de microélectrode introduite) par co-addition de la pompe IP et I avec pince dynamique(Figure 4). C’est une observation importante indiquant qu’un mécanisme d’éclatement est disponible dans ces neurones (même lorsque la fuite est compromise) qui résulte de l’interaction de lapompe I et de lapompeI. Les résultats préliminaires indiquent leur forte interaction compliquée, qui peut être explorée dans le modèle et les expériences (Figure 5).
neurones HN isolés avec une pince dynamique comme discuté précédemment8,9,10. Ces expériences (en cours) sont réalisées avec des enregistrements de microélectrodes pointus dans des neurones HN(7) isolés synaptiquement (septième ganglion sectionné du cordon nerveux). À ce jour, ces expériences montrent que l’éclatement robuste est restauré dans les neurones HN tonalement actifs (en raison de la fuite de pénétration de microélectrode introduite) par co-addition de la pompe IP et I avec pince dynamique(Figure 4). C’est une observation importante indiquant qu’un mécanisme d’éclatement est disponible dans ces neurones (même lorsque la fuite est compromise) qui résulte de l’interaction de lapompe I et de lapompeI. Les résultats préliminaires indiquent leur forte interaction compliquée, qui peut être explorée dans le modèle et les expériences (Figure 5).
En conclusion, jepompe en réponse à des augmentations périodiques de [Na+] i pendantl’activité d’éclatement contribue au rythme de rafale par la terminaison de rafale (BD décroissante). L’interaction de la pompe IP et I constitue un mécanisme suffisant pour soutenir l’activité d’éclatement endogène; ce mécanisme peut rétablir un éclatement robuste dans les interneurones HN enregistrés intracellulairement dans le ganglion 7. L’interaction entre IP et Ipompe à travers [Na+]i affecte la période de sursaut HN de manière non monotone et assure la robustesse de l’éclatement autonome. Ces conclusions sont conformes aux expériences et à la modélisation dans les systèmes de vertébrés11,12.
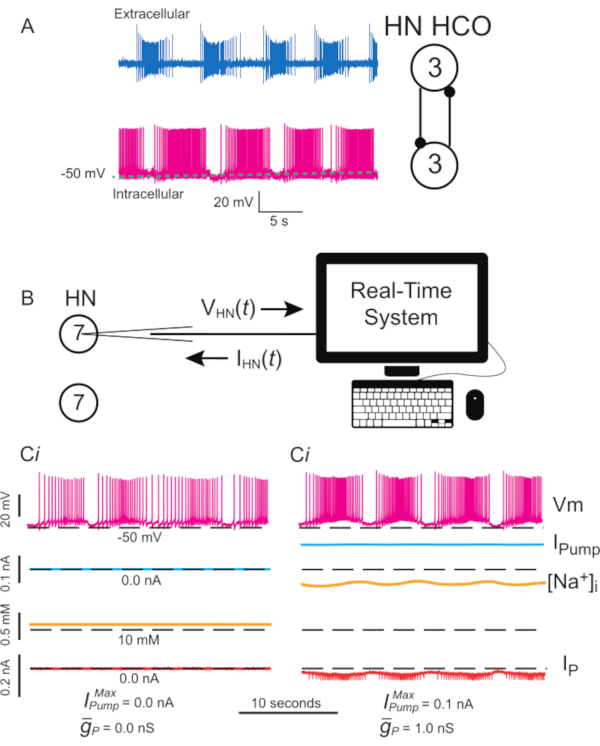
Figure 1: Activité électrique de l’interneuron cardiaque de la sangsue et mise en œuvre de la pompe I et de la pompe I P avec pince dynamique. (A) Activité normale d’éclatement enregistrée simultanément, extracellulairement (en haut) et intracellulaire (en bas), dans un battement de cœur HCO de sangsue à partir d’un troisième ganglion, schéma des neurones enregistrés et de leurs connexions synaptiques mutuellement inhibitrices à droite. (B) Schéma de pince dynamique lors de l’enregistrement d’un interneuroone HN(7) dans un ganglion isolé 7; notez qu’il n’y a pas d’interaction synaptique entre les deux interneurones HN(7). (Ci) Éclatement dans un interneuroon HN(7) compromis par fuite. (Cii) Un éclatement plus robuste peut être produit en ajoutant une pompe dynamique à pince I (  = 0,1 nA), qui compense la fuite induite par la microélectrode, mais déprime l’excitabilité, et
= 0,1 nA), qui compense la fuite induite par la microélectrode, mais déprime l’excitabilité, et  (1 nS), ce qui augmente l’excitabilité. Les lignes pointillées noires indiquent les valeurs de référence. Abréviations : HN = interneuron cardiaque ; HCO = oscillateur demi-centre; Ipompe = courant sortant; IP = Na persistant+ courant;
(1 nS), ce qui augmente l’excitabilité. Les lignes pointillées noires indiquent les valeurs de référence. Abréviations : HN = interneuron cardiaque ; HCO = oscillateur demi-centre; Ipompe = courant sortant; IP = Na persistant+ courant;  = Na maximum+/K+ courant de pompe;
= Na maximum+/K+ courant de pompe;  = conductance maximale du courant Persistant Na+ ; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
= conductance maximale du courant Persistant Na+ ; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
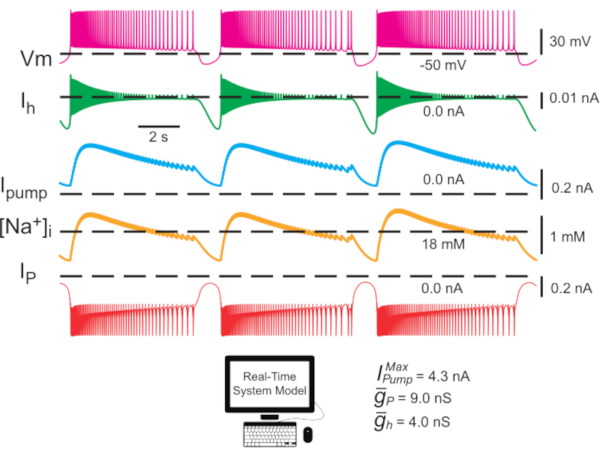
Figure 2: Modèle d’interneuronon HN unique montrant des traces de potentiel membranaire (Vm), I h, Ipompe,[Na+]i, et IP. Les courants hyperpolarisants vers l’extérieur sont négatifs et les courants dépolarisants vers l’intérieur sont positifs. Les lignes pointillées noires indiquent les valeurs de référence. Abréviations : HN = interneuron cardiaque ; Ipompe = courant sortant; IP = Na persistant+ courant;  = Na maximum+/K+ courant de pompe; Ih = courant intérieur activé par l’hyperpolarisation;
= Na maximum+/K+ courant de pompe; Ih = courant intérieur activé par l’hyperpolarisation;  = conductance maximale du courant Persistant Na+ ;
= conductance maximale du courant Persistant Na+ ; 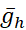 = conductance maximale du courant intérieur activé par l’hyperpolarisation; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
= conductance maximale du courant intérieur activé par l’hyperpolarisation; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
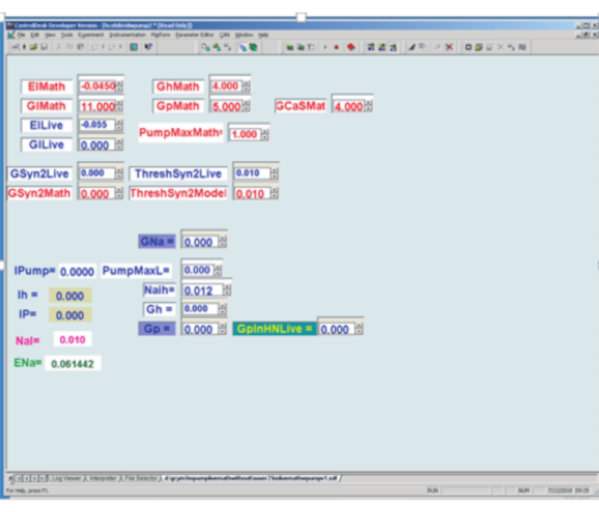
Figure 3: Interface utilisateur graphique du modèle d’interneuron cardiaque en temps réel (HN) et de la pince dynamique implémentée sur une carte de traitement du signal numérique. En haut à gauche : Les boîtes mathématiques rouges sont des boîtes de paramètres déterminées par l’utilisateur pour le modèle en temps réel, tandis que les boîtes blue Live sont des boîtes de paramètres déterminées par l’utilisateur utilisées dans la pince dynamique. El = le potentiel d’inversion du courant de fuite; Gl = conductance de fuite; Gh = conductance maximale du courant h; Gp = Conductance maximale du courant P; GCaS = conductance maximale lente du courant calcique; PumpMax = courant maximal de la pompe; [Conductance synaptique maximale GSyn2 vers le neurone respectif; Seuil de franchissement de pic ThreshSyn2 pour la médiation d’un potentiel synaptique - ceux-ci utilisés pour fabriquer un oscillateur semi-central hybride (vivant / modèle) non illustré ici.]. En bas à gauche pour dynamic clamp. Tout à gauche se trouvent 5 valeurs calculées de variables de serrage dynamiques: Ipompe = courant de pompe injecté; Ih = h-courant injecté (non utilisé ici); IP = P courant injecté; NaI = Na interne calculé+ concentration; ENa = potentiel d’inversion du sodium calculé. En bas à gauche pour dynamic clamp. À droite des variables calculées se trouvent 6 boîtes de paramètres déterminées par l’utilisateur : GNa = utilisation supposée de la conductance maximale de sodium rapide endogène pour calculer le flux Na+ associé aux potentiels d’action ; PumpMaxL = courant maximal de la pompe à injecter par pince dynamique; Naih voir équation (2); Gh = conductance maximale pour déterminer le courant h à injecter par pince dynamique; Gp = utilisation supposée de la conductance maximale du courant P endogène pour calculer le flux Na+ associé au courant P endogène; GpinHNLive = conductance maximale pour déterminer le courant P à injecter par pince dynamique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
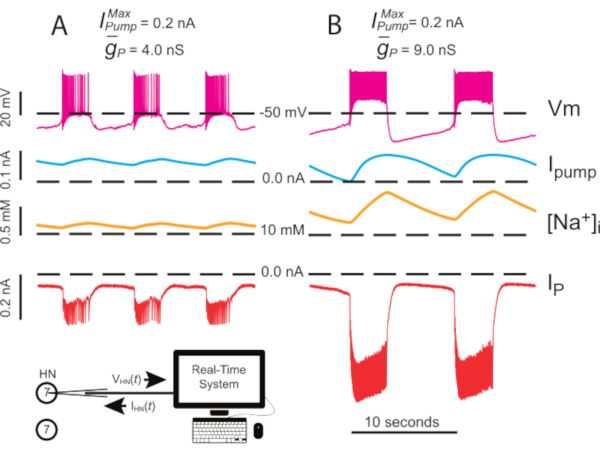
Figure 4: Analyse dynamique de la pince de l’éclatement indépendant HN(7). La régulation à la  hausse de (A) 4,0 nS à (B) 9,0 nS ralentit le rythme indépendant des rafales HN. Des traces expérimentales montrent un éclatement rythmique dans le neurone HN(7) isolé avec pince dynamique. Les plages d’oscillation de [Na+]i et Vm augmentent avec la régularitée à la
hausse de (A) 4,0 nS à (B) 9,0 nS ralentit le rythme indépendant des rafales HN. Des traces expérimentales montrent un éclatement rythmique dans le neurone HN(7) isolé avec pince dynamique. Les plages d’oscillation de [Na+]i et Vm augmentent avec la régularitée à la  hausse. Traces de haut en bas : Vm enregistrée, pompeIinjectée, calculée [Na+]i, et injectée IP. Les lignes pointillées noires indiquent les valeurs de référence. Abréviations : HN = interneuron cardiaque ; Ipompe = courant sortant; IP = Na persistant+ courant;
hausse. Traces de haut en bas : Vm enregistrée, pompeIinjectée, calculée [Na+]i, et injectée IP. Les lignes pointillées noires indiquent les valeurs de référence. Abréviations : HN = interneuron cardiaque ; Ipompe = courant sortant; IP = Na persistant+ courant;  = Na maximum+/K+ courant de pompe;
= Na maximum+/K+ courant de pompe;  = conductance maximale du courant Persistant Na+ ; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
= conductance maximale du courant Persistant Na+ ; Vm = potentiel membranaire; [Na+] i = concentration interne de Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
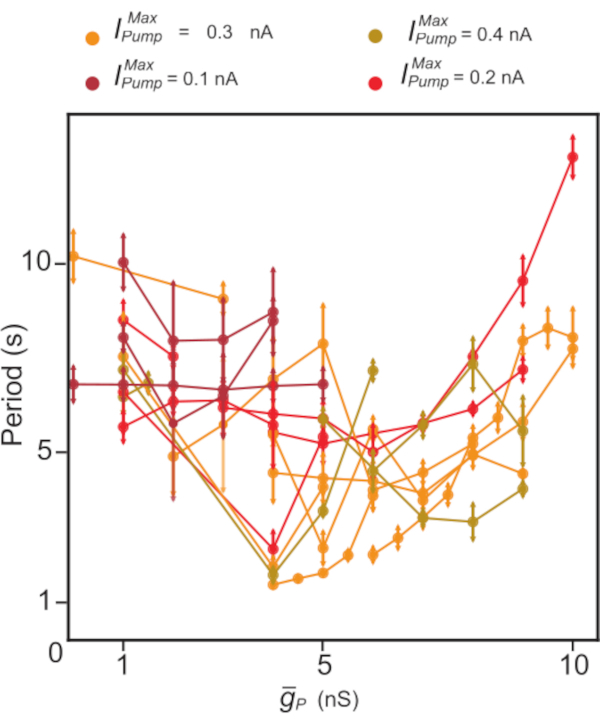
Figure 5: Analyse dynamique de la pince de l’éclatement indépendant HN(7). La régulation à la hausse de  tend à diminuer, suivie d’une période d’éclatement de HN accrue. Dans des expériences individuelles (points reliés par des lignes) à l’aide d’une pince dynamique, les
tend à diminuer, suivie d’une période d’éclatement de HN accrue. Dans des expériences individuelles (points reliés par des lignes) à l’aide d’une pince dynamique, les  valeurs ont été balayées tout en
valeurs ont été balayées tout en  faisant l’expérience constantes. Les couleurs représentent différents niveaux constants d’ajout
faisant l’expérience constantes. Les couleurs représentent différents niveaux constants d’ajout  utilisés dans différentes expériences. Abréviations : HN = interneuron cardiaque ;
utilisés dans différentes expériences. Abréviations : HN = interneuron cardiaque ;  = Na maximum+/K+ courant de pompe;
= Na maximum+/K+ courant de pompe;  = conductance maximale du courant Persistant Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
= conductance maximale du courant Persistant Na+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La modélisation, la pince dynamique et les analyses qui en résultent sont des techniques utiles pour explorer comment les conducteurs/courants ioniques individuels et les groupes contribuent à l’activité électrique des neurones(Figure 1, Figure 2,Figure 4et Figure 5). L’utilisation de ces techniques montre comment le courant de pompe Na+/ K+ (pompeI)interagit avec les courants voltage-fermés, en particulier le courant Persistant Na+ (IP),pour favoriser un éclatement robuste dans les HNs de base du générateur de pulsation de sangsue. En combinant des expériences de serrage dynamique et de modélisation, il est possible de tester des modèles plus directement qu’avec des techniques ordinaires d’enregistrement de tension et de pince de courant. Les résultats obtenus à partir des expériences de serrage dynamique(figure 5) serontutilisés pour affiner davantage le modèle HN. La méthode de base de serrage dynamique démontrée ici peut être personnalisée pour refléter les propriétés de n’importe quel neurone étudié si un modèle mathématique des courants neuronaux peut être déterminé avec des expériences de pince de tension.
La réussite des expériences du type montré ici nécessite un empalement minutieux d’un HN ou d’un autre neurone lors de l’utilisation d’une microélectrode pointue, car un fort éclatement est réduit par la pénétration de l’électrode1. (Les techniques d’enregistrement de patch de cellules entières, qui minimisent les fuites introduites, sont également applicables à d’autres neurones, mais ne fonctionnent pas bien sur les neurones de sangsue.) Il est essentiel que l’empalement du neurone HN cause un minimum de dommages au neurone (fuite supplémentaire), et la résistance d’entrée doit être surveillée et doit être comprise entre 60 et 100 MOhms pour des expériences réussies4.
La pince dynamique est une technique puissante, mais elle a des limites imposées par la géométrie neuronale car les conductances artificielles sont mises en œuvre sur le site de l’électrode d’enregistrement - généralement le corps cellulaire - et non sur le site où les courants générateurs de rythme sont généralement localisés5,6,10. Dans les neurones HN de sangsue, le corps cellulaire est électriquement proche de la zone d’intégration (neurite principale) du neurone où la plupart des courants actifs sont localisés et où des pics sont initiés.
Déclarations de divulgation
Aucun
Remerciements
Nous remercions Christian Erxleben pour les premières expériences de serrage dynamique sur les neurones HN(7) qui ont démontré leurs capacités d’éclatement. Angela Wenning a aidé les expériences avec des conseils d’experts. Nous reconnaissons les NIH pour le financement de ce travail par le biais de la subvention 1 R21 NS111355 à GSC et RLC.
matériels
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
Références
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon