Method Article
成人斑马鱼中西斯铂诱导的急性肾损伤模型
* 这些作者具有相同的贡献
摘要
本协议描述了使用西斯铂作为肾毒剂在成年斑马鱼中诱导急性肾损伤 (AKI) 的程序。我们详细介绍了评估该技术和两种技术的可重复性,分别分析肾脏组织、流动细胞学和TUNEL中的炎症和细胞死亡。
摘要
西斯铂通常用作化疗。虽然它对癌症治疗的个人有积极的影响,但西斯铂由于分子量低,很容易在肾脏中积累。这种积累导致管状细胞死亡,并可诱发急性肾损伤(AKI)的发展,其特点是肾功能迅速减少、组织损伤和免疫细胞渗透。如果以特定剂量施用西斯铂,则作为动物模型中的AKI诱导剂可以是一个有用的工具。斑马鱼作为研究肾功能、肾脏再生和损伤的有趣模型出现,因为肾脏结构保存了与哺乳动物的功能相似性。注射西斯铂的成年斑马鱼在注射后24小时(hpi)后存活率下降,肾细胞死亡,炎症标记增加。在这个模型中,免疫细胞渗透和细胞死亡可以通过流动细胞测量和TUNEL检测来评估。本协议描述了通过肾内静脉注射诱导成年斑马鱼中的AKI的程序,并随后演示了如何收集肾脏组织用于流动细胞处理和细胞死亡TUNEL检测。这些技术将有助于了解西斯铂作为肾毒剂的影响,并将有助于成人斑马鱼的AKI模型的扩展。该模型还可用于研究肾脏再生,寻找治疗或预防肾脏损伤的化合物,并研究AKI中的炎症。此外,本协议中使用的方法将改善组织损伤和炎症的特征,这是肾脏相关合并症的治疗目标。
引言
肾脏负责维持平衡的几个重要生理功能,如血液过滤,去除多余的残留物,以及调节离子浓度1。肾脏组织的损伤可导致一种称为急性肾损伤(AKI)的异质性疾病,临床上被描述为由管状上皮细胞破坏和死亡、内皮细胞损伤和白细胞渗透2、3引起的肾功能迅速下降。AKI是一种疾病,预计在8-16%的住院4,与高死亡率范围从20至50%的重症监护病房(ICU)5。这种疾病与住院时间增加和大量使用财政资源有关。病因包括脱水、休克、感染、败血症、心血管疾病和肾毒药物6。肾毒性被定义为药物诱发的肾损伤,引起AKI、管状病变和球状动脉病7的效果。肾毒性影响三分之二的ICU患者,因为ICU中约20%的药物被认为是肾毒性8,9,这包括非类固醇抗炎药物(NSAIDs),抗生素,如万康霉素和氨基糖苷,化疗剂,如甲氨蝶酯和西斯铂7。Cisplatin是最有效和最常见的化疗药物之一,用于治疗实体肿瘤,如头部和颈部,睾丸,卵巢和膀胱10。在肾脏中,cisplatin通过有机血缘运输器2(OCT-2)在近部错综复杂的管(PCT)内化,高浓度与DNA结合触发细胞死亡途径7,10,11,12。这种药物在肾脏的积累有助于肾毒性与死亡和炎症13。这种有害的副作用极大地影响三分之一接受西斯铂治疗的癌症患者的生命和预后,因此迫切需要研究新的疗法,可以降低肾毒性,而不会失去对癌细胞的杀灭作用10。
由于这种肾毒性作用,西斯铂在实验动物模型中通常用作AKI的电感器,如前所述。在啮齿动物中,第一个由西斯铂诱导的AKI模型于1971年14年被报道,但目前,许多不同的协议已经出现使用剂量依赖和累积效应的西斯铂15。因此,根据申请的剂量和数量,肾损伤的严重程度可诱发16、17、18、19、20、21。最常见的方法包括注射一剂西斯铂,然后在接下来的几天内安乐死。在这个经典的协议中,单个高肾毒剂量的西斯铂(小鼠10-13毫克/千克和/或3-8毫克/千克大鼠)诱发严重的组织学变化,如管状流明内的刷边界和细胞碎片损失,在西铂注射几天后。病理变化的严重程度取决于剂量,在西斯铂注射16、17后7天观察到再生迹象。
虽然啮齿动物模型已经建立,但我们决定利用另一种脊椎动物的特性,将研究重点放在斑马鱼(Danio rerio)上。这种鱼由于体积小、外受精多、繁殖率高、发育迅速、胚胎和幼虫透明度高、维护成本低、解剖与哺乳动物相似(有些例外)、组织再生能力高、社会行为等原因,70%的基因与人类相似,84%与人类疾病相关的基因22。斯特里辛格等人于23日、24日、25日开始对斑马鱼进行研究,证实了利用这种模型生物体进行脊椎动物发育基因分析的可行性。在肾脏研究中,斑马鱼不仅出现在发育研究中,而且作为寻找与肾脏疾病有关的新基因的基因工具。此外,没有疤痕形成的再生能力,以及通过它们的生命产生肾上腺素的能力,称为肾生成,使斑马鱼成为再生研究的关键动物模型27,28。此外,不同肾脏疾病的实验模型,包括急性和慢性肾损伤,证明了这种实验生物体26,29的多功能性。与哺乳动物一样,斑马鱼的肾祖源来自中间中皮。这种肾祖辈产生容易发炎,以后会发展成梅松磷,这将保持作为一个成熟的器官,直到成年29,30。
成年斑马鱼肾位于身体的后壁上,在游泳膀胱和骨干29之间。从腹腔看,斑马鱼可以分为三个区域(图1A):头(H)、树干(Tr)和尾部(Ta)29。与哺乳动物一样,斑马鱼有肾作为肾脏的功能单位,分为管状部分(图1A):肾骨(RC)、近侧错综复杂的管状管(PCT)、近直管(PST)、早(DE)、晚分体(DL)和收集管(CD)29。斑马鱼与人类肾上腺(图1B)有遗传保护和结构相似性,但缺乏一些构象,如中间管状物,也被称为母鸡(LH)29,31的循环。淡水鱼,如斑马鱼,通常被一个非常低的渗透性介质包围,因此,它们往往是超渗透的,并依赖于刺,皮肤在早期阶段,和肾脏来调节渗透和水排泄32。从主动脉的血液过滤开始约48小时后施肥(hpf)33,34。斑马鱼的肾脏不仅是一种代谢废物排泄器官,而且从受精后4天(dpf)到成年,它相当于哺乳动物35的骨髓。在发育过程中,造血干细胞(HSCs)将播种肾脏,自我改造,并产生骨髓、红细胞和淋巴细胞系,维持转录因子、信号分子和高度保存的遗传程序与哺乳动物36,37。研究表明,人类免疫系统中大多数红斑、血栓、骨髓和淋巴细胞都存在于斑马鱼37、38中。这种动物的独特特征和人类肾脏的保存特征使这种模型有机体在肾功能、损伤和再生研究方面具有优势。
虽然斑马鱼的肾脏研究得当,一些型号的AKI已经可用于幼虫和成年斑马鱼28,但在制定本协议时,没有证据表明成年斑马鱼中有化学诱发的非抗生素AKI模型。除此之外,我们的实验室还专注于测试益生菌和微生物衍生化合物,以研究再生和肾脏损伤,因此我们集中力量在成年鱼类中创建一个新的西斯铂诱导的AKI模型。本手稿中的视频文章演示了AKI感应新模型的程序,该模式使用每克动物(120微克/克)注射120微克西斯铂(图2A)。这种剂量最初是基于研究AKI诱导的血清素在穆林模型,去约10毫克/千克(相当于10微克/克)14,15,16,17,然而,这种剂量不足以诱导肾脏损伤相关的肾毒性(数据未显示)。因此,我们增加了剂量,在这项研究中使用的 (图2B) 。我们的工作揭示了西斯铂在注射后存活率的剂量依赖效应,诱导肾脏组织损伤24hpi,如管状结构丧失、炎症渗透增加和细胞死亡率高所示。在这里,我们描述了两种技术来分析西斯铂诱导AKI的发展:流动细胞测量,分析细胞渗透,和TUNETL,以测量细胞死亡。流动细胞测量是测量细胞的物理(大小和粒度)和化学(荧光化合物)特性的技术。在细胞计内,细胞悬架通过一个护套流体,将细胞组织成一条线,允许它们一次通过一个细胞的激光束(图3A)。光束前的探测器将测量与细胞大小相关的前散射(FSC),侧面的探测器将测量与细胞粒度相关的侧散射(SSC)。其他探测器将测量粒子、荧光蛋白或抗体标记细胞39、40的荧光。由于目前斑马鱼的商业抗体很少,使用动物记者和荧光生物标志物可以改进这一分析,并识别不同的细胞种群41,42,43。此协议中使用的另一个工具是终端脱氧核苷酸转移酶 (TdT) dUTP 尼克端标签 (TUNEL) 检测。TUNEL检测是一种晚期凋亡检测方法,依靠TdT识别碎片DNA的能力,并将其贴上带有荧光标记的脱氧核苷酸标签,然后可以通过显微镜44(图3B)进行可视化和量化。考虑到AKI最引人注目的特征之一是管状肾细胞3中凋亡的诱导,这种技术是非常有利的,因为它可以通过流动细胞学和/或显微镜进行分析。
本文中介绍的方法允许观察AKI状态,并提供一个新的急性模型来研究AKI疾病,可用于研究与西斯铂相关的AKI中的新治疗目标。
研究方案
圣保罗大学生物医学研究所动物使用伦理委员会先前已批准本议定书中描述的程序用于斑马鱼模型。
1. 西斯铂内静脉注射的AKI感应
- 通过将库存溶液稀释到 0.9% NaCl 中的 850 μg/mL 来准备 cisplatin 工作解决方案 。保持室温,不受光线照射。
注意:制造者建议使用个人防护装备(PPE)(包括护目镜、手套和实验室外套)操纵西斯铂。在室温下存放库存溶液,防止光线照射。 - 在系统水中准备150毫克/L MS-222(三卡因)麻醉剂45。麻醉成年斑马鱼(5-9个月)浸泡约1-2分钟。
注意:有效的麻醉鱼应该对触摸不负责任。要测试有效的麻醉,轻轻按下腹鳍观察反应。
注意:三叶草是皮肤和眼睛的刺激物,使用PPE来操纵。 - 使用塑料勺将鱼转移到吸水面,如纸巾,以去除身体周围的多余的水。然后,用塑料勺子将鱼转移到一个规模的培养皿中,并称量鱼。注意鱼的重量,因为剂量计算是必要的。
注意:从鱼身上吸收多余的水可以防止高估动物的体重,不要过干,因为对鱼有损害。 - 为了达到 120微克/克体重的最终剂量 , 将 最终剂量 (120 μg) 除以 cisplatin 工作解决方案 (850 μg) 的 μg,并将此数字转换为微升 (μL),乘以 1000,以获得 120μg 的西斯铂 (141.2 μL) 的体积。然后将此数字 (141.2 μL) 乘以鱼的重量 (g), 以获得注射的最终体积。
- 用塑料勺子,将鱼转移到湿海绵上,用一点切口来支撑它,把腹腔侧向上。海绵应在系统水中用麻醉剂湿。
- 用计算的 cisplatin 工作解决方案的体积填充 31 G 1.0 mL 胰岛素注射器。
- 将针头插入靠近骨盆鳍的动物腹腔内部分,以浅角避免穿刺内脏(图2A)。然后慢慢注入溶液。
- 注射后将鱼放在鱼缸中,以从麻醉中恢复过来。观察鱼的正常恢复迹象(如 游泳运动,手术动作)。
注意:动物应该在接下来的3-5分钟内恢复。如有必要,用塑料勺子、巴斯德塑料移液器或将其靠近有气泡的软管来刺激鱼。 - 对于控制鱼,通过注射 0.9% NaCl 的溶液执行相同的程序。在体重比例之后使用相同的计算:注射的体积将乘以鱼的重量(g)141 μL。
- 在接下来的几天里,每天至少监测两次鱼类的生存情况(图2B)。
2. 免疫细胞流动细胞的肾脏隔离和组织处理
- 对于此程序,使用具有免疫细胞荧光标记的转基因动物(例如Tg(mpo:GFP))。
- 在24hpi的120微克/克西斯铂后,通过低热休克(快速冷却)对动物实施安乐死。
注:与MS-222过量相比,热低震作为安乐死方法更有效。与MS-222相比,低热休克对人员的压力更小、快速、一致、更安全,此前曾描述过46,47。 - 在外交叉槽中,将冰水与系统水的比例为 5:1,将带屏幕的内水箱放在冰上,等待水达到 2-4 °C。
注意:鱼不应该与冰直接接触,因为这可能导致热灼伤和疼痛。 - 将动物转移到冰水中,等待至少10分钟,直到失去方向,没有手术运动。
- 用塑料勺子将鱼放在纸巾上,以干燥多余的水。
- 将鱼转移到3%的糖体解剖板,并将其在带上光的立体镜下。用剪刀斩首鱼,在眼睛后面快速切开,并取出头部。
- 用细剪刀从开侧切开到木块,用细钳切除内脏。
- 使用昆虫针捏身体墙壁的两侧,打开尸体,并暴露肾脏连接到骨干。
- 用细钳分离肾脏,将器官放在6个井板中,冷溶液为1倍PBS/2%FBS。继续冰上
- 用巴斯德塑料移液器拾取组织,将组织通过 40μm 细胞过滤器通过 50 mL 管,用注射器柱塞轻轻搅拌。
- 用 1mL 的 1 倍 PBS/2% FBS 洗两次,并将细胞收集到 50 毫升管中。
- 离心机在400×克5分钟在4°C。
- 小心地拿起所有超自然人与1 mL微皮,并丢弃它。加入 500 μL 的冷 1x PBS 以补充细胞并将其放置在 5 mL 流动细胞测量管中。继续冰上
- 计算在Neubauer室的细胞在Trypan Blue中稀释1:10(例如,取10μL的样本,并与90μL的特里潘蓝混合)。将混合物的 10μL 添加到 Neubauer 腔室中,并在显微镜下计数细胞。
注:最佳结果预计为 1-5 x 106 细胞/mL,>80% 的生存能力。
注意:尝试蓝是致癌剂,使用PPP处理。 - 取细胞通过细胞仪读取。然后分析选择感兴趣人群的结果。
3. 处理成年斑马鱼肾脏组织进行调子检测
- 对于此程序,使用野生类型的动物(如AB、Töbingen 等)或与 TUNEL 套件具有不同荧光颜色的转基因动物,因为类似的荧光会干扰 TUNEL 的分析。
- 在24hpi的120微克/克西斯铂后,通过低热休克(快速冷却)对动物实施安乐死。请参阅 2.3-2.4。
- 解剖2.5-2.6中描述的鱼:在固定过程中,肾脏必须保持附着在骨干上(如下所示)。
- 使用昆虫针,捏身体墙壁的两侧,打开尸体,并固定在软木表面,以保持肾脏暴露。
注意:此过程可确保肾脏保持正确的位置,以便以后分析。 - 然后将软木表面与肾脏朝下放在6井板上,放在4%副甲醛(PFA)的新鲜溶液上。保持在4°C过夜。
注意:PFA对皮肤和粘液表面具有致癌性和刺激性。使用 PPE(包括眼部保护设备)在化学罩下准备 PFA 解决方案。 - 第二天,解剖肾脏就像在2.8。将肾脏放在一个60毫米的培养皿中,1倍PBS,在1倍PBS中冲洗两次。
- 准备2%的阿加罗斯,为组织生成支撑矩阵。
- 从培养皿中丢弃所有剩余的 1 倍 PBS,然后慢慢倒入 2% 的糖,以覆盖整个器官。然后使用细钳将肾脏放置在立体显微镜下,以防止肾脏折叠。让阿加罗斯在室温下凝固。
注:此程序将通过组织处理保持器官的方向和形状,因为器官的叶状形状如果不在支撑基质内,则会导致折叠倾向。 - 凝固后,使用手术刀切割组织周围的糖,形成小立方体,并去除组织周围多余的糖。
- 将阿加罗斯立方体放在适合听病处理的盒式磁带中。
注意:以下步骤可以手动操作或在自动组织处理器中完成。 - 首先,在室温下,按照下一步步骤处理盒中的组织45分钟:一个沐浴50%乙醇,一个浴场70%乙醇,两个连续浴95%乙醇,以及三个连续浴100%乙醇。之后,连续两次沐浴二甲苯和三次石蜡浴处理组织:后者在60°C时各持续1小时。
注意:在化学罩下进行改变,乙醇和二甲苯的蒸汽具有刺激性和毒性。 - 要准备石蜡块,将石蜡扁豆融化至 60 °C。
- 打开里面有纸巾的塑料盒,放在一个温暖的盘子里。石蜡的热金属模具。
- 用钳子将组织放在金属模具上,使肾脏长度与模具基座平行。加入石蜡,必要时重新分配组织。
- 用盒式磁带的底座盖住模具,并加入石蜡,直到网格被覆盖。让凝固在室温下,然后放置在-20°C,以加快凝固过程。
- 大约 20-30 分钟后从金属模具中释放石蜡块。
- 用微原子将嵌入石蜡中的组织分割至 5 μm 厚度。使用硅化或正电荷玻璃滑梯收集组织。
4. 图切尔测定
注:下列协议使用原位细胞死亡检测套件(材料表)。
- Dewax 组织滑梯将它们连续两次沐浴在二甲苯中 5 分钟。然后通过分级的乙醇系列补充组织水分:100%-95%-70%-50%,每次5分钟。
- 将幻灯片放在运行冷的自来水中,以冲洗乙醇。将滑梯保存在蒸馏水中。
- 准备一个黑暗的孵化室。在底部添加湿纸巾,以在孵化步骤中保持水分。
注:在缺少孵化器室时,可以使用底部有湿纸和两个牙签的培养皿放置幻灯片。 - 准备新鲜 蛋白酶 K 工作解决方案: 10μg/mL 在 10 mM 特里斯/HCl, pH 7.4-8.
注:蛋白质酶 K 是作为渗透剂,由织物建议。 - 将幻灯片放在黑暗的孵化室中,并添加 蛋白酶 K 工作解决方案 ,直到覆盖样品。在37°C孵育30分钟。
- 当样品正在孵化时,准备 TunenL反应混合物:将50μL的酶溶液添加到450μL标签溶液中。防止光线照射。
注:要准备的卷可以按相同的 1:10 比例调整。计算出每个部分的混合物体积为 50μL;这可以根据样本的大小而改变。 - 拿起暗室,用1倍PBS洗两次幻灯片。
- 接下来,使用吸纳纸干燥样品周围的区域,并在每个组织滑梯上加入 50 μL 的 TUNEL 反应混合物 ,将溶液铺开,以便覆盖整个样品。在37°C孵育2小时。防止光线照射。
- 孵化后,用 1 倍 PBS 冲洗滑梯三次,并用纸巾干燥样品周围的区域。
- 在样品中加入 50μL DAPI 1:1000,用于核计数器着污,并在室温下孵育 5 分钟。防止光线照射。
- 再次用 1 倍 PBS 冲洗三次,并干燥样品周围的区域。
- 使用防褪色亲水介质安装滑梯,放置盖子,并密封指甲油。水平存储滑梯,在 4 °C 时免受光线的保护。
注意:安装介质的防褪色特性是保持样品的荧光,但可以使用任何可用的亲水介质。指甲油的最后密封步骤对于避免脱水至关重要。 - 在荧光显微镜下可视化样品。对于此类荧光颜料,请使用 520-560 nm(绿色)范围内的激发波长和 570-620 nm(红色)范围内的检测。
结果
斑马鱼的肾脏是位于背壁上的扁平色素器官,其基本功能单元,肾,由哺乳动物保存(图1)。只有一个肾具有高再生能力的特殊性,使这个模型有机体成为模型肾损伤的一个很好的选择。本作品中提出的协议旨在通过成年斑马鱼(图2)的腹膜内注射西斯铂来诱导AKI,随后通过之前详细的两种技术进行分析:流细胞测量(图3A)和TUNEL(图3B)。图4中描绘了整个过程的流程图。西斯铂的剂量最初基于小鼠模型15、16、17中描述的剂量,其中所用标准为每公斤动物10-13毫克的西斯铂(毫克/千克)。然而,斑马鱼表现出比小鼠更耐西斯铂(数据未显示),最终剂量增加。当我们评估动物的存活率时,实验显示了西斯铂(图5A)的剂量依赖效应。因此,我们建议按照本协议中完全解释的说明,在收集任何材料之前,不断监测动物的存活率,作为可重复性的衡量标准。注射120微克/克西斯铂(图5A,红线)后,在前24小时内观察到约30%的动物存活率下降,存活率逐渐下降,直到注射后第5天达到20%左右的活体动物,然后稳定下来(图5A)。Cisplatin毒性不受动物性别的影响,因为雄性与雌性有相似的生存曲线(图5B)。
对西斯铂诱发的AKI的动力学分析显示,肾24hpi的炎症和细胞死亡增加。评估炎症的最快和定量的方法之一是流动细胞测量,但鉴于缺乏针对斑马鱼抗原的抗体,这种技术在商业上是必要的,使用具有免疫标记的转基因线。如今,许多标有免疫细胞标签的斑马鱼线是可访问的(表1)。这些线可以单独使用或组合,给足够的剧目分析48,49,50,51,52,53,54,55,56,57,58,59,60。这大大简化了技术,因为没有必要任何抗体孵化步骤,相反,通过机械分离细胞分离后,细胞仪上的直接读数是可能的。
如前所述,斑马鱼的肾脏不仅是具有静态功能的血液过滤器官,而且是成人造血的解剖部位,相当于哺乳动物33、34、35的骨髓。这样,当我们通过流动细胞学来分析它时,就可以区分与人类血液61、62(图6A)相媲美的细胞群,这使我们能够初步按大小和粒度来识别细胞群,并排除碎片。在这种情况下,我们使用了一种名为Tg(mpo:GFP)52的转基因线,该线表示绿色荧光蛋白(GFP)与中性粒细胞中存在的酶骨髓酶。知道这一点,我们的门战略是基于初步分离的颗粒细胞的人口(图6B)。在此之后,双细胞被排除,因为它们可以显著改变分析并导致不准确的结论。双倍是一个由 2 个独立粒子组成的单个事件,可以通过选择前向散射高度 (FSC-H) 与前向散射区域 (FSC-A) 密度图 (图 6C)来排除。在此步骤之后,识别并选择了表达荧光标记的细胞(图6D)。最后,从分析中提取了人口统计数据,并绘制了细胞百分比(图6E)。
cisplatin肾毒性最突出的特点之一是管状细胞死亡10,为了轻松地可视化这一点,我们使用TUNIL检测凋亡检测。这种方法建议使用缺乏荧光标记的野生类型细胞和组织,因为平行荧光会干扰分析,在斑马鱼的情况下,建议使用野生类型的线,如AB,Töbingen,TAB,或与荧光蛋白不干扰TUNEL荧光颜色的转基因线。TUNEL 技术允许通过流动细胞测量或显微镜进行分析。显微镜具有保存组织结构的优点,可以观察哪些细胞正在死亡。在荧光显微镜下,凋亡细胞的明亮细胞核可以很容易地从背景中分离。注射西斯铂(图7B)的动物的死细胞比控制(图7A)在24hpi。最后的量化是使用FIJI软件的细胞计数器选项进行的,从统计学上讲,在西斯铂治疗的肾脏中,死细胞比对照组(图7C)中多
本手稿中描述的协议展示了如何在成年斑马鱼中使用 cisplatin 作为 AKI 的诱因,该诱因是剂量响应、快速和可靠的。根据从存活率获得的数据和西斯铂肾毒性迹象的测量,包括炎症(通过流动细胞测量检测)和细胞死亡(由TUNETL检测检测检测),我们提出这个模型用于研究西司铂肾毒性以及AKI相关疾病的未来治疗。
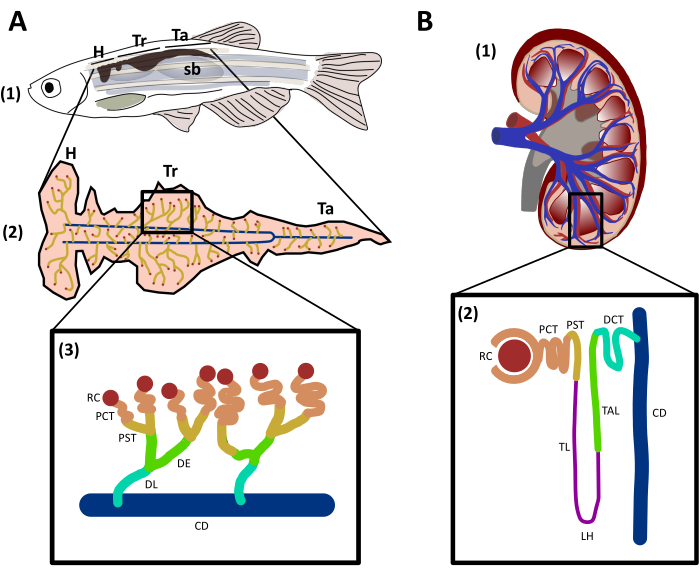
图1:斑马鱼和人类肾脏的结构和比较。A. (1) 在鱼的后壁、游泳膀胱 (sb) 和骨干之间,可以看到一条成年斑马鱼的横向视图,其肾脏以深棕色表示。(2) 肾脏的文特尔视图显示与收集管道(蓝色)相连的肾(黄色)。肾脏的不同区域被标记:头部(H)、躯干(Tr)和尾部(Ta)。(3) 示意图代表斑马鱼肾上腺素及其标记和着色的片段,以匹配遗传保存区域与人类肾上腺素。 B. (1) 人类肾脏的射手座视图。(2) 示意图描绘一个带有标记和彩色段的人类肾上腺素。RC:肾下士:PCT:近邻错综复杂的管状:PST:近直管:TL:肢体薄:LH:母鸡的循环:塔尔:厚升肢:德:早解散:DL:延迟:DCT:分解错综复杂的管子:CD:收集管道。 请单击此处查看此图的较大版本。
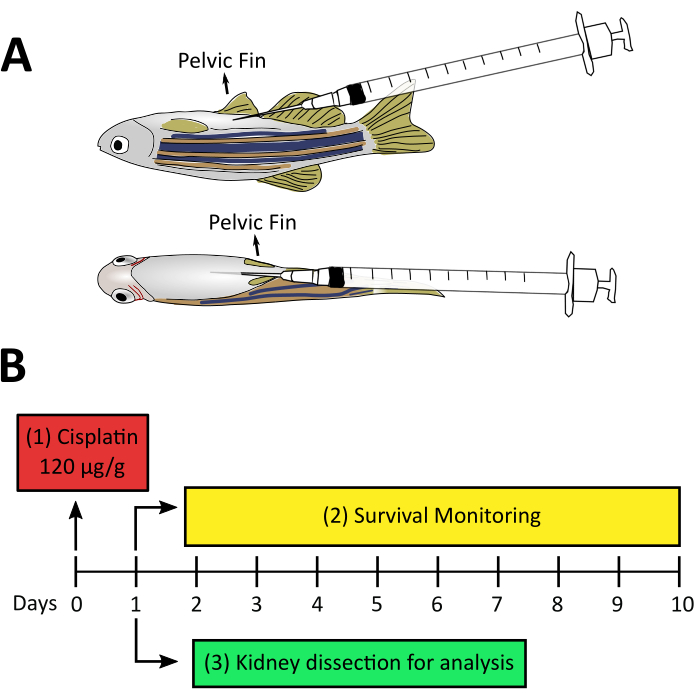
图2:西斯铂诱导AKI的实验设计。A. 成人斑马鱼在注射过程中指向针头位置的横向和腹视图。针头从腹部以 20-30° 角穿透,并缓慢地与心室壁平行插入,避免穿刺内脏。 B. 西斯铂诱导AKI的实验设计:(1)在零日给每只动物注射西铂120微克/克。(2) 在尝试第3步之前,建议从第一天到第十天对注射后的鱼类进行生存监测。(3) 在西斯铂注射一天后进行肾脏解剖,以进行进一步加工技术。 请单击此处查看此图的较大版本。
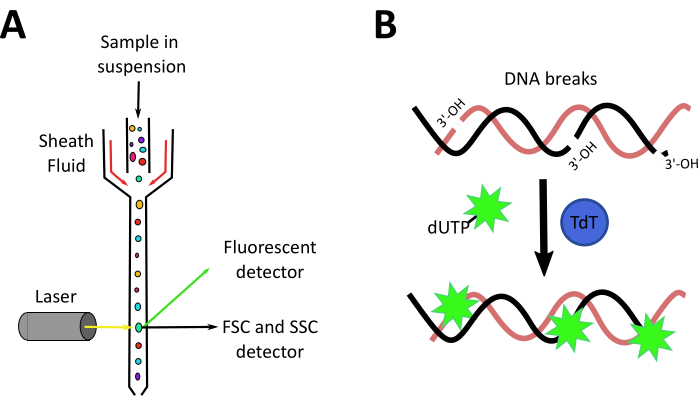
图3:流动细胞测量和调谐技术的机制。A. 流光圈仪概述:细胞的悬浮通过护套流体在水动力学上聚焦在单行线上,导致细胞在激光束前一个接一个地通过。前部和侧面的探测器测量前向散射 (FSC)、侧散射 (SSC) 和细胞的荧光。 B. 图纳泰分析的原则。终端脱氧核苷酸转移酶 (TdT) 调解在支离破碎的 DNA 的 3'-OH 末端添加荧光标记的 dUTP。 请单击此处查看此图的较大版本。
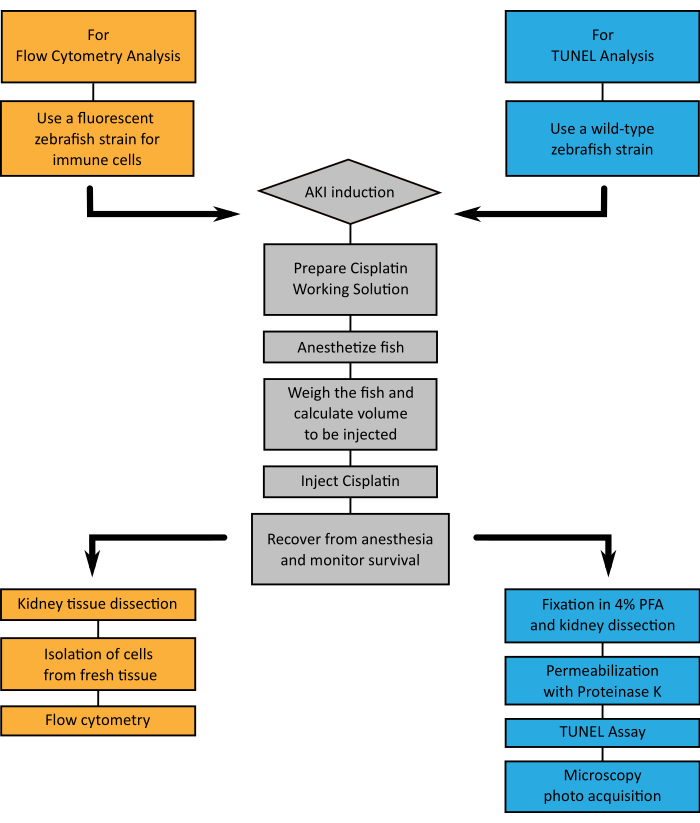
图4:表示技术的流程图。A. 当选择通过流动细胞测量(橙色)或TUNEL(蓝色)分析肾脏组织时,通过西斯铂注射(灰色)诱导AKI时,显示要遵循的步骤的流程图。 请单击此处查看此图的较大版本。
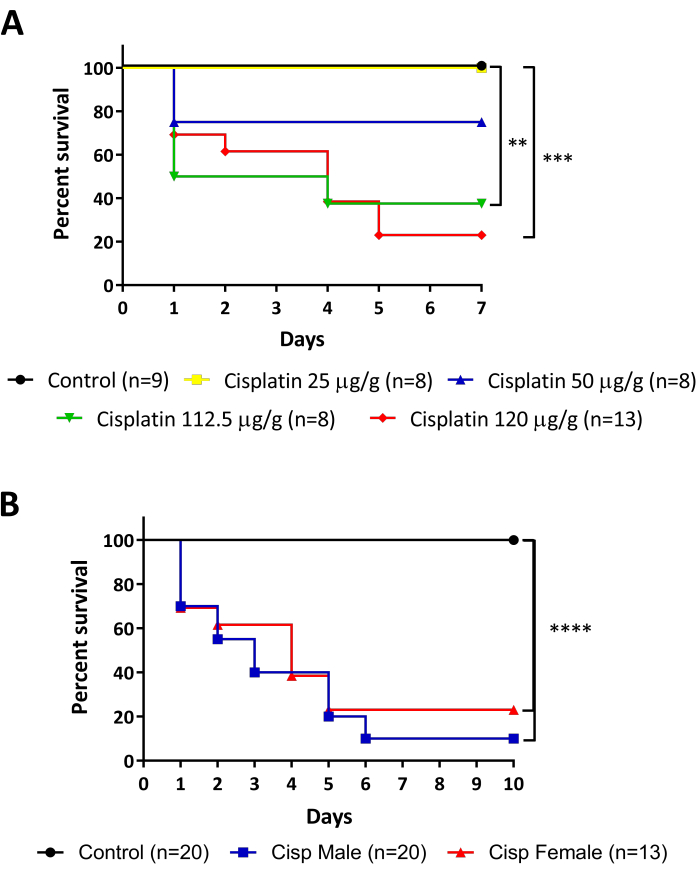
图5:西斯铂注射鱼的生存监测。A. 不同剂量的西斯铂注射的存活率 (25 - 50 - 112.5 - 120 微克/克)。日志排名 (曼特尔 - 考克斯) 测试, ** p < 0.01 。 B. 注射120微克/克西斯铂的男性与女性的存活率。日志排名 (曼特尔考克斯) 测试, *** p < 0.001. 请单击此处查看此图的较大版本。
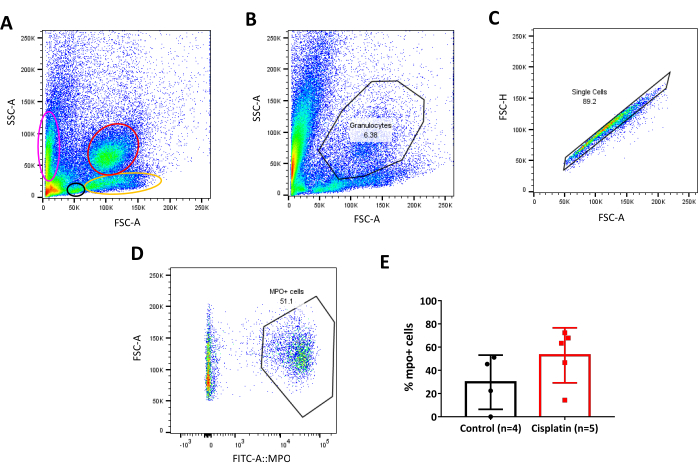
图6:转基因斑马鱼线门策略。A. 斑马鱼成年肾细胞的密度图,种群按大小(FSC-A)和粒度(SSC-A)分开。不同的人群由彩色椭圆形/圆形选择。粉红色:红土:黑色:淋巴机器人;黄色:前体:红色:颗粒细胞。 B. 侧散射区域 (SSC-A) 和前向散射区域 (FSC-A) 的密度图,用于选择肾脏中的颗粒细胞种群。 C. 前散射高(FSC-H)和前散射区域(FSC-A)的密度图,用于选择颗粒细胞门内的单体种群。 D. 前向散射区域 (FSC-A) 和 FITC-A:MPO 的密度图,用于选择肾脏中的 mpo:GFP 正细胞(嗜中性粒细胞)。阳性人群被认为是大约103 上,荧光强度。 E. mpo的百分比图表 :GFP 正细胞(嗜中性粒细胞)在控制与西斯铂动物,24hpi。未修复的 t测试。 请单击此处查看此图的较大版本。
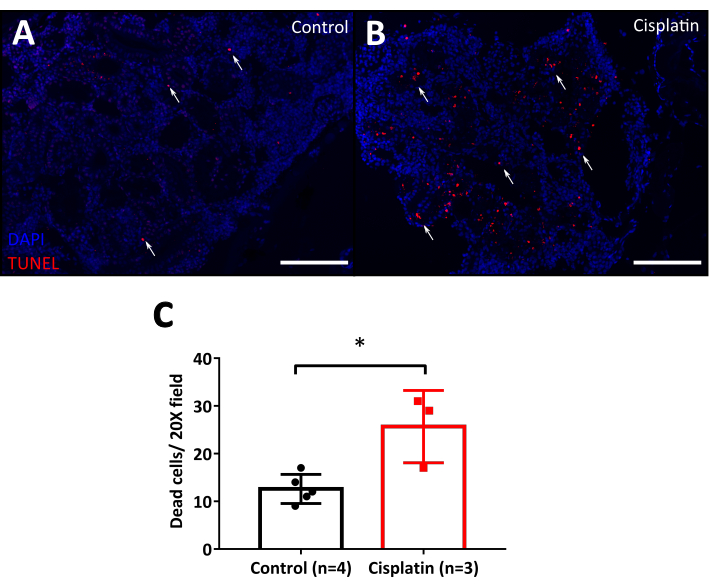
图7:图9:图纳对西斯铂注射鱼的检测。A. 120μg/g 西斯铂注射后固定成人肾脏的显微照片 24 h。控件注入 0.9% NaCl。TUNEL正细胞(凋亡细胞)染成红色(白色箭头)。DAPI(蓝色)用作核制剂。比例尺:50μm.20倍放大。 B. 显示肾脏中死细胞数量的量化图为 20 倍。未修复的 t测试, *p < 0.05 。 请单击此处查看此图的较大版本。
| 转基因线 | 标记的单元格类型 | 引用 |
| Tg(斯皮1:EGFP)pA301 | 骨髓细胞 | 沃德 等人 200348 |
| Tg (zpu1:GFP) | 骨髓细胞 | 徐 等人 200449 |
| Tg (mhc2dab: Gfp) sd6 | 单 核 细胞 | 维塔默 等人 201150 |
| Tg (莱西:德瑞德2) | 中性 粒 细胞 | 霍尔 等人 200751 |
| Tg(姆波:格夫普) | 中性 粒 细胞 | 马蒂亚斯 等人 200652 |
| Tg (mpeg1:姆切里) | 巨噬细胞 | 埃莱特 等人 201153 |
| Tg (mpeg1:登德拉2) | 巨噬细胞 | 哈维 等人 201354 |
| 特克:格夫普) | T细胞 | 兰格瑙 等人 200455 |
| 特格巴奇(伊卡罗斯:埃格夫普) | T细胞 | 巴乔格利 等人 200956 |
| Tg (拉格 1:GFP) | T细胞 | 杰森 等人 199957 |
| Tg (拉格2:格夫普) | T细胞 | 杰森 等人 200158 |
| Tg (CD79:GFP) | B细胞 | 刘 等人 201759 |
| Tg (CD45:德瑞德) | 白 | 贝特朗 等人 200860 |
表1:斑马鱼免疫细胞的转基因线。 表恢复斑马鱼记者行的名称,并标注了各自类型的免疫细胞和它们构建的参考文章。这些斑马鱼系的组合可以通过流动细胞学提供细胞选择的新的可能性。
讨论
肾脏疾病的流行率在全世界持续上升,成为影响数百万人的全球公共卫生问题。找到治疗肾伤者的方法至关重要,也最重要的是了解他们病因和进展。一些研究一直在使用动物模型来了解肾脏损伤。斑马鱼肾(图1)由于其自我再生能力和遗传相似性,多年来一直在发育生物学和损伤研究中研究。在这里,我们介绍了一个新的AKI模型在成年斑马鱼使用西斯铂作为肾毒剂的特性,详细说明了完成快速和急性反应的步骤,损害可见,只要24hpi(图2)。此外,在这里我们解释两种技术,这将有助于评估后,西斯铂注射,流动细胞测量和TUNEL(图3)的组织损伤。
目前成年斑马鱼的AKI模型包括注射根酰胺素,在肾上腺素和管状物破坏中引起广泛损害,肾生成事件从第5天开始,在注射后21天完成再生65天。另一方面, 败血症相关急性肾损伤(S-AKI)模型是由爱德华西拉塔达感染建立的,因为显著增加了AKI标记物的表达,如胰岛素样生长因子结合蛋白-7(IGFBP7),金属蛋白酶2(TIMP-2)的组织抑制剂,以及幼虫和成年斑马鱼66中的肾损伤分子-1(KIM-1)的表达。斑马鱼是众所周知的高通量动物寻找治疗剂,这包括使用益生菌和微生物源代谢物研究肾功能和再生67。然而,现有的模型可能直接影响到这些治疗的结果。因此,我们建立了一种不同的方法来诱导成年斑马鱼的AKI(图4),使用西斯铂作为已知的肾毒剂,不会直接已知对鱼微生物群的影响,就像根塔霉素模型是抗生素,或感染E.tarda,作为败血症模型。然而,在我们开发我们的西斯铂协议的同时,另一组人也探索了成年斑马鱼中西铂的肾毒性作用,将剂量简化为每只动物10-20-30微克68。虽然它们在生存中也显示出西斯铂剂量依赖效应,但我们建议谨慎使用单量的西斯铂为所有鱼类,因为斑马鱼从同龄可以有很大的不同大小和重量,这可能会诱导结果的变化69,70。我们认为重要的是调整剂量到相应的重量的动物,如在小鼠和这项研究。
在我们对成年斑马鱼的实验中,西斯铂显示出剂量反应效果。这是通过监测西斯铂注射后动物的存活率(图5)来实现的。我们用生存作为估计西斯铂剂量强度的一种方式,而不是作为肾毒性的测量方法,因为在监测期间看不到其他物理迹象。这可以与啮齿动物相媲美,其中肾损伤的严重程度可以通过西斯铂注射15的剂量和频率来调节,达到致命剂量,浓度较高的西斯铂71。在接下来的几天里,在西斯普拉廷72的幼虫模型中也出现了死亡。由于我们的目标是在几天内诱发急性损伤,我们选择了120微克/克剂量的西斯铂,以观察注射后24小时肾脏损伤,但是,这可以根据研究的目标进行调整。
在人类中,AKI通过降低球状过滤率(GFR)、血清肌酸升高和血尿素氮3进行临床诊断。在斑马鱼中,AKI模型的剧目包括一些遗传条件模型73、74和一些与药物相关的模型65、72,但由于一些AKI功能参数由于技术困难(如采血)而无法测量斑马鱼,大多数研究采用形态学和视觉技术来观察AKI1、75等特征,如我们的研究。
在啮齿动物中,cisplatin进入近端和分离管中的上皮细胞,细胞内进行代谢活化,对细胞细胞细胞产生高度反应作用,并诱导细胞结构的变化。这些变化可以诱发凋亡和自噬,甚至坏死,在非常高的剂量。为了应对这种损害,许多细胞因子被释放和白细胞被招募导致炎症和影响器官功能15。这突出了评估在受伤的肾脏中可以发现哪些类型的细胞的重要性,作为居民或渗透的免疫细胞。在这里,我们展示了如何评估流细胞测量,使用转基因免疫记者线可用现在(表1)。注射后24小时,西斯铂增加了肾脏中嗜中性粒细胞(mpo:GFP 正细胞)的百分比(图6)。就斑马鱼而言,肾脏是产生不同血细胞类型的HSC的利基。尽管如此,许多颗粒和巨噬细胞通常在血液中循环。在我们的例子中,我们使用了 mpo:GFP 转基因线,在中微子52的骨髓酶的促进下表达GFP。 mpo:GFP 转基因线的原始研究表明,在中性粒细胞成熟76 的不同状态下,骨髓酶的表达,但我们的门策略侧重于由来自血液52的成熟细胞组成的粒细胞分,这样我们的分析包括渗透细胞,而不是常驻细胞。在隔离所需细胞群时,必须考虑这一点。
如上所述,凋亡是与西斯铂相关的AKI的最经典标记。在这里,我们演示了一个简单的协议,通过TUNYL检测使死细胞本地化。西斯铂注射增加了凋亡细胞的数量24hpi(图7)。这可以通过直接计算组织中的死细胞来轻松量化。然而,为了识别细胞特异性死亡,使用抗体对抗所需的细胞(如 管状细胞),或使用转基因报告线可以与此技术一起使用。与AKI的根塔米辛诱导模型相比,cisplatin似乎是一个更严重的模型,因为在注射65后的第三天,根他汀凋亡率更高。
尽管有各种副作用,cisplatin仍然广泛用于癌症治疗,因为它对各种类型的癌症,包括癌变,生殖细胞肿瘤,淋巴瘤和肉瘤77有效。肾毒性发生在三分之一的患者在治疗与西斯铂10,因此寻找策略,可以减少这种影响,增加再保护是势在必行的。我们相信,本手稿中介绍的方法和技术将有助于阐明肾损伤的机制,并找到治疗目标,这些靶点对于提高肾并发症患者的生活质量至关重要,主要是与使用西斯铂相关的治疗目标。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了安帕罗基金会的支持 – 圣保罗埃斯奎萨 - FAPESP (2015/21644-9; 2017/05264-7; 2017/05687-5;2018/20722-4),国家德森沃尔维门托·科蒂菲科·特克诺莱吉科(CNPq)和库德纳奥·德·阿佩菲奥门托·德佩索阿尔·德尼维尔高级(CAPES),财务代码001。我们感谢在圣保罗大学生物科学研究所的玛丽亚·丽塔·多斯桑托斯·帕索斯-布埃诺实验室和遗传学和进化生物学系斑马鱼设施的合作者。我们衷心感谢克里斯蒂亚娜·纳法·德苏扎·布雷达和特蕾莎·拉克尔·德奥利维拉·拉马略对手稿的意见和建议。我们非常感谢生物医学研究所多媒体团队的马西奥·维拉尔·马丁斯录制、编辑和制作这段视频。
材料
| Name | Company | Catalog Number | Comments |
| 1x PBS | Made by diluting 10 X PBS (prepared in lab) in distilled water | ||
| 31 G 1.0 cc insulin syringe | BD Plastipak | 990256 | Needle: BD Precision Glide 300110 |
| 3.5 L Fish tank | Tecniplast | Part of the aquactic system | |
| 6 well plate | Corning | 351146 | |
| 10 mM Tris/HCl | Prepared from solid Tris Base (Promega, H5135), adjusted to pH 7.4-8 with HCl (Merck, 1003171000) | ||
| 50 ml Falcon tube | Corning | 352070 | |
| 2-3% Agarose | Invitrogen | 16500-500 | Dissolve 2 or 3% agarose (w/v) in 1x PBS, warm until dissolve. |
| 2% FBS | Gibco | 12657-09 | Dilute 2% (w/v) directly in 1x PBS |
| 4% Paraformaldehyde | Sigma-Aldrich | P6148-500G | Dissolve 4% PFA (w/v) in warm 1x PBS, mix until dissolve in a hot plate in a fume hood. Aliquot and store at -20 °C |
| 50% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 70% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 90% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 100% Ethanol | Synth | 00A1115.01.BJ | |
| 100% Xylene | Synth | 00X1001.11.BJ | |
| Cell strainer 40 µm | Corning | 431750 | |
| Cisplatin | Blau Farmacêutica | 16020227 | C-PLATIN 1 mg/mL. Store at room temperature. |
| Cork board sheet | Obtained from local stationary store | ||
| DAPI | Sigma-Aldrich | D9542 | Stock solution 20 mg/ml dissolved in water |
| Fine forceps | Fine Science Tools | 11254-20 | |
| Flow cytometry tubes | Corning | 352052 | |
| Glass slide | Thermo-Fisher | 4445 | |
| Histology cassette | Ciencor | 2921 | |
| Immuno stain chamber | Ciencor | EP-51-05022 | |
| Incubator | NAPCO | 5400 | Set to 37 °C |
| Insect pins | Papillon | Model micro15x20 | |
| In Situ Cell Death Detection Kit | Roche Diagnostics | 12156792910 | |
| Metal mold | Leica Biosystems | 3803081 | |
| Micropipette 200-1000 µL | Eppendorf | Use 1 mL tips | |
| MS-222 (Tricaine) | Fluka Analytical | A5040-25G | |
| NaCl 0.9% | Synth | C1060.01.AG | Dissolve 0.9% NaCl (w/v) in distilled water |
| Nail polish | Prefer transparent | ||
| Neubauer chamber | Precicolor HGB | ||
| Pasteur plastic pipet | United Scientific Supplies | P31201 | |
| Paraplast | Sigma-Aldrich | P3558 | |
| Petri dish | J.ProLab | 0307-1/6 | 60 and 100 mm |
| Plastic spoon | Obtained from local store | ||
| Proteinase K | New England BioLabs | P8102 | Diluite from stock 20 mg/ml |
| Scissors | Fine Science Tools | 14060-09 | |
| Scalpel blade | Solidor | ||
| Sponge | Obtained from local store | ||
| Trypan Blue | Cromoline | 10621/07 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000-10 | |
| Centrifuge | Eppendorf | 5810R | |
| Cytometer | BD Biosciences | FACSCanto II | |
| Fluorescence Stereoscope | Zeiss | Axio Zoom.V16 | |
| Fluorescence Microscope | Zeiss | AxioVert.A1 | |
| Microtome | Leica | Jung Supercut | |
| Scale | Ohaus Corporation | AR2140 |
参考文献
- McKee, R. A., Wingert, R. A. Zebrafish Renal Pathology: Emerging Models of Acute Kidney Injury. Current Pathobiology Reports. 3 (2), 171-181 (2015).
- Guo, C., Dong, G., Liang, X., Dong, Z. Epigenetic regulation in AKI and kidney repair: mechanisms and therapeutic implications. Nature Reviews Nephrology. 15 (4), 220-239 (2019).
- Makris, K., Spanou, L. Acute Kidney Injury: Definition, Pathophysiology and Clinical Phenotypes. Clinical Biochemist Reviews. 37 (2), 85-98 (2016).
- Sawhney, S., et al. Intermediate and Long-term Outcomes of Survivors of Acute Kidney Injury Episodes: A Large Population-Based Cohort Study. American Journal of Kidney Diseases. 69 (1), 18-28 (2017).
- Saxena, A., Meshram, S. V. Predictors of Mortality in Acute Kidney Injury Patients Admitted to Medicine Intensive Care Unit in a Rural Tertiary Care Hospital. Indian Journal of Critical Care Medicine. 22 (4), 231-237 (2018).
- Sawhney, S., Fraser, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in Chronic Kidney Disease. 24 (4), 194-204 (2017).
- Sales, G. T. M., Foresto, R. D. Drug-induced nephrotoxicity. Revista da Associação Médica Brasileira. 66, 82-90 (2020).
- Perazella, M. A. Drug use and nephrotoxicity in the intensive care unit. Kidney International. 81 (12), 1172-1178 (2012).
- Taber, S. S., Mueller, B. A. Drug-associated renal dysfunction. Critical Care Clinics. 22 (2), 357-374 (2006).
- Pabla, N., Dong, Z. Cisplatin nephrotoxicity: mechanisms and renoprotective strategies. Kidney International. 73 (9), 994-1007 (2008).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4 (4), 307-320 (2005).
- Shirmanova, M. V., et al. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Scientific Reports. 7 (1), 8911 (2017).
- Xu, Y., et al. A Role for Tubular Necroptosis in Cisplatin-Induced AKI. Journal of the American Society of Nephrology. 26 (11), 2647-2658 (2015).
- Kociba, R. J., Sleight, S. D. Acute toxicologic and pathologic effects of cis-diamminedichloroplatinum (NSC-119875) in the male rat. Cancer Chemotherapy Reports. 55 (1), 1-8 (1971).
- Perše, M., Večerić-Haler, &. #. 3. 8. 1. ;. Cisplatin-Induced Rodent Model of Kidney Injury: Characteristics and Challenges. BioMed Research International. 2018, 1462802 (2018).
- Dobyan, D. C., Levi, J., Jacobs, C., Kosek, J., Weiner, M. W. Mechanism of cis-platinum nephrotoxicity: II. Morphologic observations. Journal of Pharmacology and Experimental Therapeutics. 213 (3), 551-556 (1980).
- Singh, G. A possible cellular mechanism of cisplatin-induced nephrotoxicity. Toxicology. 58 (1), 71-80 (1989).
- Jodrell, D. I., et al. The renal effects of N10-propargyl-5,8-dideazafolic acid (CB3717) and a non-nephrotoxic analogue ICI D1694, in mice. British Journal of Cancer. 64 (5), 833-838 (1991).
- McKeage, M. J., et al. Lack of nephrotoxicity of oral ammine/amine platinum (IV) dicarboxylate complexes in rodents. British Journal of Cancer. 67 (5), 996-1000 (1993).
- Gautier, J. C., et al. Evaluation of novel biomarkers of nephrotoxicity in two strains of rat treated with Cisplatin. Toxicologic Pathology. 38 (6), 943-956 (2010).
- Vinken, P., et al. Tissue Kim-1 and urinary clusterin as early indicators of cisplatin-induced acute kidney injury in rats. Toxicologic Pathology. 40 (7), 1049-1062 (2012).
- Zorzetto, R., Guimarães, M. Um peixe modelo. Pesquisa FAPESP. 209, 16-21 (2013).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Chakrabarti, S., Streisinger, G., Singer, F., Walker, C. Frequency of gamma-Ray Induced Specific Locus and Recessive Lethal Mutations in Mature Germ Cells of the Zebrafish, BRACHYDANIO RERIO. Genetics. 103 (1), 109-123 (1983).
- Walker, C., Streisinger, G. Induction of Mutations by gamma-Rays in Pregonial Germ Cells of Zebrafish Embryos. Genetics. 103 (1), 125-136 (1983).
- Morales, E. E., Wingert, R. A. Zebrafish as a Model of Kidney Disease. Results and Problems in Cell Differentiation. 60, 55-75 (2017).
- Poureetezadi, S. J., Wingert, R. A. Little fish, big catch: zebrafish as a model for kidney disease. Kidney International. 89 (6), 1204-1210 (2016).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Translational Research. 163 (2), 109-122 (2014).
- Drummond, I. A., Davidson, A. J. Zebrafish kidney development. Methods in Cell Biology. 100, 233-260 (2010).
- Saxén, L., Sariola, H. Early organogenesis of the kidney. Pediatric Nephrology. 1 (3), 385-392 (1987).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470 (7332), 95-100 (2011).
- Hill, A. J., Bello, S. M., Prasch, A. L., Peterson, R. E., Heideman, W. Water permeability and TCDD-induced edema in zebrafish early-life stages. Toxicological Sciences. 78 (1), 78-87 (2004).
- Drummond, I. A., et al. Early development of the zebrafish pronephros and analysis of mutations affecting pronephric function. Development. 125 (23), 4655-4667 (1998).
- Majumdar, A., Drummond, I. A. Podocyte differentiation in the absence of endothelial cells as revealed in the zebrafish avascular mutant, cloche. Developmental Genetics. 24 (3-4), 220-229 (1999).
- Song, H. D., et al. Hematopoietic gene expression profile in zebrafish kidney marrow. Proceedings of the National Academy of Sciences of the United States of America. 101 (46), 16240-16245 (2004).
- Gore, A. V., Pillay, L. M., Venero Galanternik, M., Weinstein, B. M. The zebrafish: A fintastic model for hematopoietic development and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 7 (3), 312 (2018).
- Paik, E. J., Zon, L. I. Hematopoietic development in the zebrafish. The International Journal of Developmental Biology. 54 (6-7), 1127-1137 (2010).
- Palis, J., Yoder, M. C. Yolk-sac hematopoiesis: the first blood cells of mouse and man. Experimental Hematology. 29 (8), 927-936 (2001).
- O'Donnell, E. A., Ernst, D. N., Hingorani, R. Multiparameter flow cytometry: advances in high resolution analysis. Immune Network. 13 (2), 43-54 (2013).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews Immunology. 4 (8), 648-655 (2004).
- Ma, D., Zhang, J., Lin, H. F., Italiano, J., Handin, R. I. The identification and characterization of zebrafish hematopoietic stem cells. Blood. 118 (2), 289-297 (2011).
- Kulkeaw, K., et al. Purification of zebrafish erythrocytes as a means of identifying a novel regulator of haematopoiesis. British Journal of Haematology. 180 (3), 420-431 (2018).
- Ratnayake, D., Currie, P. D. Fluorescence-Activated Cell Sorting of Larval Zebrafish Muscle Stem/Progenitor Cells Following Skeletal Muscle Injury. Methods in Molecular Biology. 1889, 245-254 (2019).
- Kyrylkova, K., Kyryachenko, S., Leid, M., Kioussi, C. Detection of apoptosis by TUNEL assay. Methods in Molecular Biology. 887, 41-47 (2012).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Wilson, J. M., Bunte, R. M., Carty, A. J. Evaluation of rapid cooling and tricaine methanesulfonate (MS222) as methods of euthanasia in zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 48 (6), 785-789 (2009).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Institute for Laboratory Animal Research Journal. 53 (2), 192-204 (2012).
- Ward, A. C., et al. The zebrafish spi1 promoter drives myeloid-specific expression in stable transgenic fish. Blood. 102 (9), 3238-3240 (2003).
- Hsu, K., et al. The pu.1 promoter drives myeloid gene expression in zebrafish. Blood. 104 (5), 1291-1297 (2004).
- Wittamer, V., Bertrand, J. Y., Gutschow, P. W., Traver, D. Characterization of the mononuclear phagocyte system in zebrafish. Blood. 117 (26), 7126-7135 (2011).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7, 42 (2007).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. Journal of Leukocyte Biology. 80 (6), 1281-1288 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Harvie, E. A., Green, J. M., Neely, M. N., Huttenlocher, A. Innate immune response to Streptococcus iniae infection in zebrafish larvae. Infection and Immunity. 81 (1), 110-121 (2013).
- Langenau, D. M., et al. In vivo tracking of T cell development, ablation, and engraftment in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 101 (19), 7369-7374 (2004).
- Bajoghli, B., et al. Evolution of genetic networks underlying the emergence of thymopoiesis in vertebrates. Cell. 138 (1), 186-197 (2009).
- Jessen, J. R., Willett, C. E., Lin, S. Artificial chromosome transgenesis reveals long-distance negative regulation of rag1 in zebrafish. Nature Genetics. 23 (1), 15-16 (1999).
- Jessen, J. R., Jessen, T. N., Vogel, S. S., Lin, S. Concurrent expression of recombination activating genes 1 and 2 in zebrafish olfactory sensory neurons. Genesis. 29 (4), 156-162 (2001).
- Liu, X., et al. Zebrafish B Cell Development without a Pre-B Cell Stage, Revealed by CD79 Fluorescence Reporter Transgenes. Journal of Immunology. 199 (5), 1706-1715 (2017).
- Bertrand, J. Y., Kim, A. D., Teng, S., Traver, D. CD41+ cmyb+ precursors colonize the zebrafish pronephros by a novel migration route to initiate adult hematopoiesis. Development. 135 (10), 1853-1862 (2008).
- de Jong, J. L., Zon, L. I. Histocompatibility and hematopoietic transplantation in the zebrafish. Advances in Hematology. 2012, 282318 (2012).
- Ossowski, P., et al. Differentiation of morphotic elements in human blood using optical coherence tomography and a microfluidic setup. Optics Express. 23 (21), 27724-27738 (2015).
- McCullough, K., et al. Measuring the population burden of chronic kidney disease: a systematic literature review of the estimated prevalence of impaired kidney function. Nephrology Dialysis Transplantation. 27 (5), 1812-1821 (2012).
- Drummond, B. E., Wingert, R. A. Insights into kidney stem cell development and regeneration using zebrafish. World Journal of Stem Cells. 8 (2), 22-31 (2016).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Atlas of Cellular Dynamics during Zebrafish Adult Kidney Regeneration. Stem Cells International. 2015, 547636 (2015).
- Wen, X., et al. A zebrafish model of infection-associated acute kidney injury. American Journal of Physiology-Renal Physiology. 315 (2), 291-299 (2018).
- Gong, J., Noel, S., Pluznick, J. L., Hamad, A. R. A., Rabb, H. Gut Microbiota-Kidney Cross-Talk in Acute Kidney Injury. Seminars in Nephrology. 39 (1), 107-116 (2019).
- Kim, M. J., Moon, D., Jung, S., Lee, J., Kim, J. Cisplatin nephrotoxicity is induced via poly(ADP-ribose) polymerase activation in adult zebrafish and mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 318 (5), 843-854 (2020).
- Parichy, D. M., Elizondo, M. R., Mills, M. G., Gordon, T. N., Engeszer, R. E. Normal table of postembryonic zebrafish development: staging by externally visible anatomy of the living fish. Developmental Dynamics. 238 (12), 2975-3015 (2009).
- Singleman, C., Holtzman, N. G. Growth and maturation in the zebrafish, Danio rerio: a staging tool for teaching and research. Zebrafish. 11 (4), 396-406 (2014).
- Wagner, T., Kreft, B., Bohlmann, G., Schwieder, G. Effects of fosfomycin, mesna, and sodium thiosulfate on the toxicity and antitumor activity of cisplatin. Journal of Cancer Research and Clinical Oncology. 114 (5), 497-501 (1988).
- Hentschel, D. M., et al. Acute renal failure in zebrafish: a novel system to study a complex disease. American Journal of Physiology-Renal Physiology. 288 (5), 923-929 (2005).
- Zhou, W., Hildebrandt, F. Inducible podocyte injury and proteinuria in transgenic zebrafish. Journal of the American Society of Nephrology. 23 (6), 1039-1047 (2012).
- Huang, J., et al. A zebrafish model of conditional targeted podocyte ablation and regeneration. Kidney International. 83 (6), 1193-1200 (2013).
- Christou-Savina, S., Beales, P. L., Osborn, D. P. Evaluation of zebrafish kidney function using a fluorescent clearance assay. Journal of Visualized Experiments. (96), e52540 (2015).
- Lieschke, G. J., Oates, A. C., Crowhurst, M. O., Ward, A. C., Layton, J. E. Morphologic and functional characterization of granulocytes and macrophages in embryonic and adult zebrafish. Blood. 98 (10), 3087-3096 (2001).
- Dasari, S., Tchounwou, P. B. Cisplatin in cancer therapy: molecular mechanisms of action. European Journal of Pharmacology. 740, 364-378 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。