Method Article
心肌梗塞穆林模型中的 3D 生物打印贴片移植
摘要
该协议旨在移植一个3D生物打印补丁到梗死小鼠的史诗建模心力衰竭。它包括有关麻醉、手术胸腔开口、左前降(LAD)冠状动脉的永久结扎以及将生物打印的贴片应用到心脏梗塞区域的详细信息。
摘要
通过永久性左前下降 (LAD) 结扎测试体内 3D 生物打印心脏贴片的再生特性是一个具有挑战性的过程,由于其性质,其死亡率很高。我们开发了一种方法,将生物打印的细胞和水凝胶斑块持续移植到梗死小鼠心脏的史诗上,以稳健可行的方式测试其再生特性。首先,深度麻醉的小鼠被仔细插管和通风。左部胸腔切除术(胸部手术开放)后,暴露的LAD被永久连接,生物打印的补丁移植到史诗上。鼠标在胸部闭合后迅速从手术中恢复。这种稳健和快速的方法的优点包括预测28天的死亡率高达30%(低于其他研究使用类似的小鼠永久LAD结扎模型报告的44%)。此外,本协议中描述的方法用途广泛,可采用不同细胞类型或水凝胶测试生物打印斑块,其中需要大量动物进行最佳功率研究。总的来说,我们提出这是一种有利的方法,它可能改变临床前测试在未来的研究,心脏再生和组织工程领域。
引言
心脏移植是治疗最终心力衰竭患者的黄金标准,但捐赠器官短缺。它需要免疫系统抑制,以防止移植排斥和一年死亡率是15%的全球1。因此,有一个长期的动机,再生临床前动物模型的心肌,以期转化为人体试验2,3,4,5,6,7,8,9。3,4,5,6,7,8,92干细胞或干细胞衍生心脏细胞的3D生物打印技术的最新进展,作为再生心肌2、3、9、10、11、12,3,9,10,11的一种有希望的方法,已引起人们的关注。
据报道,首次进行了应用贴片来再生心脏的人体安全试验,在胶原蛋白或纤维蛋白中悬浮在原蛋白或胚胎干细胞衍生心脏祖细胞中,移植到7、8、13,8,13的史诗中。然而,对于一个更精确,可伸缩,自动化和可重复的方法,3D生物打印优化水凝胶补丁应用于心脏的史诗表面是一个有希望的方法,再生的心肌,否则需要心脏移植2,10,11,12,11,的患者。2,
在进行人体试验之前,需要进行临床前动物研究。在猪65、羊14、老鼠6和老鼠4只中,有研究心肌再生的活体前模型。小鼠心肌梗塞(MI)的常见模型使用左前降(LAD)冠状动脉15,16的永久结扎。在使用的不同小鼠中,C57BL6小鼠的永久LAD结扎具有可接受的存活率,通常呈现MI16后一致的重塑和心脏变化。在啮齿动物模型中,已经描述了几种方法,其中心脏组织已被应用到心脏,以追求受损的心肌4,6,176,的有效再生。4虽然大型动物仍然代表一个更临床相关的模型来测试心脏再生特性5,5,14,鼠标模型的多功能性和可行性适合这个快速移动的领域的研究。这可能避免一些大型动物研究的典型陷阱,包括(但不限于):1)高动物死亡率(除非对角冠状动脉连接导致不可预知的分段梗塞14,或LAD的远端被遮挡后,再灌注,而不是永久结扎5);2) 伦理问题与小鼠相比,大型动物协议造成的危害相对增加;3) 成本和/或可行性问题增加,例如大型动物设备(如 MRI 扫描仪14)相对不可用。同样重要的是要考虑,鉴于大型动物研究的典型持续时间和承诺广泛,它们有可能在它们完成之前过时,特别是随着这一领域的典型快速发展。例如,直到最近,炎症细胞和调停器在调节心脏再生方面所起关键作用才出现19,20。19,此外,《柳叶刀》委员会强调,临床前研究的关键作用,如小动物模型,是进入人体试验之前获得可靠知识的重要步骤。
为了促进在理解基于补丁的心脏再生方法体内的机制和优化条件方面的进展,我们提出了一种新的方法,描述了一种"勺子和窗帘"方法,将3D生物打印的藻酸盐/凝胶水凝胶贴片应用于C57BL6小鼠的梗塞心脏表面。这种方法的目的是提供一个多功能的体内模型,以测试3D生物打印的补丁,在广泛的研究背景下,对于心脏再生的迅速演变领域2是可行的。这种方法可以适应测试由非生物打印方法、不同水凝胶和体内斑块中的自体或全源干细胞衍生细胞产生的贴片。然而,对生物印刷、水凝胶或细胞类型的详细考虑超出了本研究的范围,该研究的重点是手术移植方法。
该协议的优点包括,心肌梗死和生物打印贴片的应用在一个外科手术中进行,可以快速进行,具有现成的、具有成本效益的实验室工具,死亡率相对较低。它通常允许在更小的空间内允许比大型动物模型更多的动物,这允许对多个实验组进行可靠的比较,对于体内的多个组比较特别有用。另一方面,该协议的缺点是:1)小鼠模型比大型动物模型更远离人类心脏大小、解剖学和生理学,并且不直接转化为人类;2) 近近的 murine LAD 分支,个体小鼠之间具有显著变异性,导致梗死大小变异(与大型动物模型共享的问题);3) 贴片必须应用于整个前心脏表面,比在特定梗塞区域涂抹更精确;和 4) 补丁立即应用在 MI 时 (对于人类使用, 它很可能更临床上有用的开发补丁应用于长期梗死的心脏几个月后, 最初的 MI14) 。
然而,如果根据所测试的假设进行适当选择,该协议可以快速提供关键体内数据,具有高 n 数字,其方式与大多数实验室提供的材料、预算和专业知识一致。与大型动物模型相比,它是一种内部模型,其通用性足以适应新兴的 3D 生物打印技术(例如,在迁移到大型动物模型之前,通过相对容易进行试验性研究以测试可行性和安全性)。对于希望高效、廉价地生成体内数据的研究人员来说,它非常适合进行多次比较,比较具有不同生物打印参数、细胞或斑块中的水凝胶的 3D 生物打印贴片。它对于测试干细胞和干细胞衍生细胞的不同混合物与体内水凝胶的相互作用特别有用,而不会过度浪费昂贵的细胞系系或其他材料,如果使用大规模贴片,可能会发生这种相互作用。使用小鼠模型还有助于测试含有与物种相容的小鼠衍生细胞和干细胞系或具有特定免疫缺陷的统一小鼠的人类衍生细胞的补丁。此外,在转基因小鼠菌株中进行测试,研究人员可以分离出特定基因对信号通路和与心血管疾病相关的特定细胞类型的影响,而目前在大型动物模型中,这种影响是不可能的。
研究方案
本实验中描述的所有程序都经过澳大利亚新南威尔士州北悉尼地方卫生区动物伦理委员会的批准(项目编号 RESP17/55)。
1. 麻醉和插管
注:打开并设置立体显微镜、热垫(用吸收剂片覆盖)和呼吸机系统。
- 清洁手套、手术区域以及使用 70% 乙醇的工具。
- 称量小鼠计算内丙酮途径注射的麻醉剂量(氯胺酮40毫克/千克,Xylazine 5mg/kg,阿托平0.15毫克/千克),并给予注射。
- 一旦鼠标到达麻醉的深平面,用修剪器剃光胸的左侧。
- 将鼠标放在含有 2% 异氟的腔室中(确保室内有足够的萃取通风)。
注:相对较低剂量的氯胺酮/异氟烷注射以及2%的异氟烷吸入可降低小鼠死亡的风险,同时允许在不唤醒小鼠的情况下实现最佳插管。 - 如图所示,将鼠标与上切口咬住,用 3.0 缝合线贴在长凳上。通过执行捏到手趾来确认其使用。在鼠标颈部上方放置高强度照明器,以便可以可视化口咽。
注:或者,鼠标可以从插管套件(例如,肯特鼠标插管套件)放置在支架上,在顶部切口下固定一个弹性带,以张开嘴以识别气管。 - 使用弯曲的铲子打开下颚和另一对铲子/钝钳,轻轻地将舌头抬出。与鼠标主体一起定位在或略低于眼睛水平时,请务必插管。
- 可视化声带的打开和关闭。打开时,插入随插管套件随附的 20 G 塑料导管。
- 小心地将插管鼠标转移到配备加热垫的操作表面。将鼠标连接到根据鼠标重量自动设置目标音量的呼吸机(例如 MouseVent)。
- 用氧气输送 1.5-2% 异氟兰(由呼吸机自动调节:确保从氧气瓶到自动呼吸机的流量为 1-2 L/min 与呼吸机的连接)。通过检查双边胸部上升来验证插管。通过执行捏到手趾来验证麻醉。
- 在两只眼睛上涂抹视光膏(例如,Puralube Vet Opthalmic 软膏),以防止它们干燥。
2. 准备手术场
- 在呼吸机和呼吸管/导管之间的连接点用胶带固定插管。
- 切割一块较长的胶带,将其左前脚固定到工作表面上,位置稍高。也磁带下来的其他四肢。
- 用无菌的70%异丙醇和波维酮碘溶液清洁胸部,以从中心到外围的圆形运动进行清洁。
- 用手趾捏再次验证麻醉。
- 通过皮下注射在0.1 mL的0.9%盐水中管理0.08毫克/千克Temvet(丁丙诺啡)。
3. 左横向胸腔切除术
- 使用细尖钳在突出的西腓软骨左侧约 5 mm 的点轻轻抬起皮肤。使用手术剪刀在皮肤上创建一个超肿瘤切口,从这个点向上和朝中线,到马努红的水平。
- 使用弯曲的钳子轻轻地分离皮肤和肌肉层。打开肌肉层,在皮肤切口之后。
- 按照肋骨的自然角度,在第三个成本间空间中识别并切口。
- 使用缩回器轻轻地分开第 3 排和第 4 根肋骨。
- 用钳子轻轻去除薄薄的佩里卡。
- 如果未可视化 LAD,请轻轻将左尿道(参见补充图 1)向上推,并定位下方的冠状动脉。
4. 左前下降 (LAD) 永久冠状动脉结扎
- 切割一个 +3 毫米长的 3-0 丝缝合线,把这个增强的 3-0 丝缝合片放在 LAD 的顶部,方向与 LAD 相同(如时间点 02:12 ~ 02:20 的视频中所示)。
- 识别 LAD 并在 LAD 下通过 7-0 的丝绸缝合线。如果LAD没有清晰可视化,插入针头1毫米低劣和中插到最低于最低于的点到达左尿头在心脏的动态运动。
注:此结构是较浅的红色到心脏的心室,但比相邻的肺暗,最好在时间点 01:54 – 01:55 的视频中可视化,其可见度低于缩回器的上级手臂,优于左肺(有关带注释的视频静止图像,请参阅附加图1)。 - 完成两个投掷与 7 - 0 丝绸缝合, 并关闭它紧紧传递在支持 3 - 0 丝绸缝合的顶部, 以确保拉德。如果结扎成功,与连结的前部心室区域远出将发白。
- 用相反方向的第三次投掷完成结,以确保其安全,确保没有向上的牵引力传输到缝合线。额外的投掷不需要额外的投掷,以减少损坏的风险,通过缝合切线损坏的心肌或LAD。
5. 将生物印补丁移植到史诗上
- 使用打开的手术手术刀包的无菌内表面,小心地将生物打印的补丁从六井板移动到梗塞区域。
- 小心地将生物打印的斑块放在前体表面,在那里它应覆盖整个表面,并覆盖在低劣和侧边上,覆盖左心室和梗塞区(漂白区)。
- 轻轻关闭并拆下缩回器,而不将锋利的边缘引向心脏。
- 在简单的中断图案中使用 6-0 丙烯缝合线,以关闭肋骨和肌肉层。
- 使用叹息呼吸功能,同时用 6-0 丙烯缝合关闭胸部,膨胀肺部以去除胸腔中多余的空气,否则,胸腔中会陷入胸腔,导致肺气管。
- 确保胸部被紧紧密封。
- 将异氟兰减至 1.0%。以简单的中断图案用 6-0 丙烯缝合线关闭皮肤。关闭异氟蒸发器。
6. 鼠标恢复
- 在0.9%的盐水中,将2毫克/mL的布利瓦卡因用在切口上。管理也: i) 抗西丹(阿提帕梅索莱) 1毫克/千克;ii) 拉西克斯(氟化)8毫克/千克;iii) 600 μL 的 0.9% 盐水溶液通过皮下注射。
注:抗西丹是扭转麻醉更快;氟化剂是卸载多余的液体,由于心脏输出妥协和额外的液体施用药物注射。 - 监测鼠标,等待,直到观察到独立的呼吸,从插管中删除鼠标。
- 当鼠标表现出足够的双边呼吸速率和深度,并响应脚趾捏,将鼠标放在放在热垫上的清洁恢复笼中。
- 为小鼠提供保湿食品(湿润的咀嚼性)、水瓶和营养/保湿凝胶。监测呼吸过度、出血过多或其他可能危及生命的并发症。
- 在未来三天内,通过皮下或内皮注射,在0.1 mL的0.1 mL中施用0.08毫克/千克Temvet(丁丙诺啡),每天两次,然后每天服用一次,至手术后的第五天。
- 用笼子分隔器对地将小鼠隔开,以防止隔离,同时防止战斗行为。每天监测小鼠,直到实验结束(28天),密切关注它们的健康状况,如果有任何顾虑,监测频率增加。
结果
在移植时,贴片在室温下粘度(无需应用额外的交联器)允许其"覆盖"心脏的轮廓(图1),并随着心脏循环动态移动。手术后,我们离开的补丁在体内28天,因为研究发现这是一个合适的时间段,允许对宿主心脏功能33,4的贴片作用(虽然据报道,完全的功能效果可能直到移植后三个月才看到)22。图1中鼠标心脏上原位显示的贴片照片显示,该贴片在移植时立即拍摄,显示了贴片在心脏上覆盖的能力。这个代表性的结果表明,水凝胶允许补丁模塑到心脏的轮廓和过度张力发生的地方,水凝胶能够分裂,如图1中裸露的(无水凝胶)三角形区域所示(由图像中的黑星表示)。生存数据(卡普兰-迈尔生存曲线)如图2所示,与进行假手术的小鼠相比(在LAD下通过针头和缝合针,无需结扎,然后关闭小鼠胸部)。
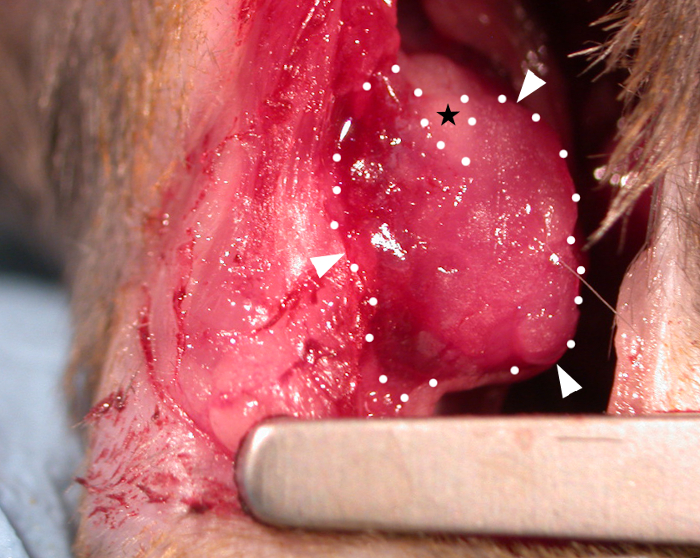
图1:一个生物打印的心脏贴片应用于C57BL6小鼠心脏的史诗。一个 10 毫米 x 10 毫米 x 0.4 毫米生物打印贴片(移植后立即)含有水凝胶(凝胶 4% (w/v)/凝胶素 8% (w/v) 在介质中)显示在梗塞区域,并附着在史诗般的表面(白色箭头和虚线 = 贴片的边界)。贴片粘度允许它模塑到心脏的轮廓,在上一侧发生过度张力的地方,贴片已分裂成三角形裸露区域,不被水凝胶覆盖(黑星)。 请单击此处查看此图的较大版本。
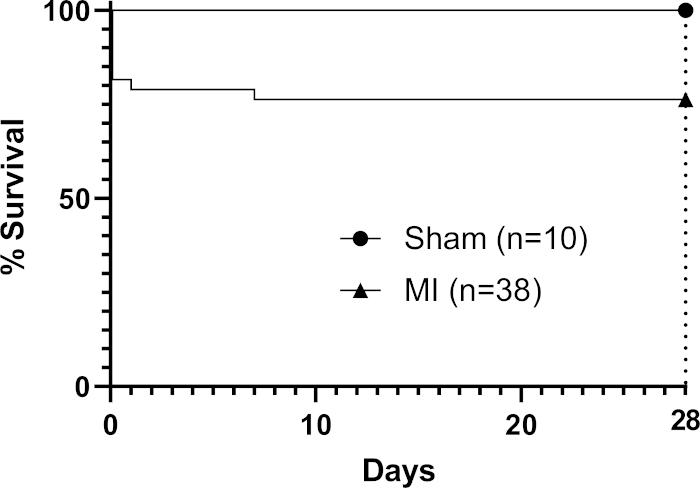
图2:卡普兰-迈尔生存分析通过28天后MI。程序组的9只小鼠死亡(n=38),总体死亡率为24%。 请单击此处查看此图的较大版本。
补充图1:视频静止图像(视频时间点01:54 = 01:55)显示左尿(左心房附属物)。 箭头指向左尿道的推断尖端,在心脏的上边缘以三角形结构可见。如果LAD没有清晰可视化,左尿尖的尖端可用作针头进入通过LAD下缝合的里程碑。入口点为 1 mm 低等,在心脏动态运动期间,左尿尖的尖端达到的最劣点(黑色箭头显示左尿道的推断尖端)。 请点击这里下载此图。
讨论
该方法通过将生物印片应用于永久LAD结扎后梗塞小鼠心脏的史诗表面,帮助操作者有效地移植生物印片。在这个以可行性为中心的方法中,我们能够每个工作日对八只小鼠执行此程序(包括之前和之后的房间准备)。生物印刷运行产生8个1厘米2 补丁在六孔板井需要2-3小时(包括准备时间之前和之后)。我们使用手术手术手术刀包内的无菌作为我们的补丁勺子,这是容易获得的,通常增加了最小的成本,利用藻酸盐/凝胶水凝胶补丁的自然粘合特性,将补丁覆盖在心脏的前部梗塞表面。根据我们的经验,小鼠的LAD结扎协议取决于操作者,28天的死亡率可以通过一个模型的经验丰富的操作者实现。Van den Borne等人16日 报告说,C57BL6小鼠在没有应用贴片的情况下,在28天永久LAD结扎后,死亡率为44%,高于我们用这种方法观察到的30%的上限。
插管步骤至关重要,除非由熟练的操作者执行,否则自身可能是小鼠的死亡源。由于气管的体积很小,因此很难操作者为此步骤佩戴放大镜。我们使用注射氯胺酮/异氟烷以及吸入的异氟素诱导麻醉剂,使小鼠在每种药物的相对较低剂量下进行深度麻醉。因此,在插管过程中,小鼠没有醒来的风险,但避免了与高单药剂量相关的高死亡率。也给予阿托平抵消副作用,如心动过速和过度兴奋。使用施加在喉咙上的聚光灯会照亮气管内部,因此它更明显,并且声带必须与小鼠的呼吸速率(通常每分钟约 120 次呼吸)一起可视化打开和关闭声带。将鼠标完美定位(这就是为什么本步骤的硬表面是首选的,而不是鼠标下方的加热垫)至关重要,两个切口牙齿由一个循环螺纹保持,舌头用钝钳/一对铲子非常轻轻地缩回,以打开嘴巴并可视化气管。插管完成后,操作员必须小心不要将插管从插管区域转移到操作床(操作台下面确实有热垫以防止体温过低)。将呼吸管连接到呼吸机设备时,用一只手稳定呼吸管,另一只手连接呼吸机回路至关重要,这样呼吸管的运动中最小,例如在连接管的呼吸机部分时将其推入气管。
在这项研究中,我们在杜尔贝科的改性鹰介质(DMEM)中使用了藻酸盐4%(w/v)/凝胶8%(w/v)。藻酸盐/明胶水凝胶以其生物相容性、低成本和生物力学特性而广为人知,因此它们可用于3D组织工程策略23。这些水凝胶可以通过添加钙离子通过温和的凝胶交联,从而允许改变粘度。生物印刷后,我们在磷酸盐缓冲盐水(PBS)中应用氯化钙(CaCl 2)2%(w/v),然后在6个井板中培养,在6个井板中培养7-14天,然后移植它们。2这是控制心脏细胞的斑块开始在培养中跳动,但在斑块开始分解之前的最佳窗口。虽然CaCl2可以定期添加在整个生物打印后阶段,以减少补丁分解,我们发现,水凝胶的内在粘度是足够的补丁,以保持其结构移植只有一个初始剂量的CaCl2。
该方法允许成功移植没有缝合线(可能损害心脏)或胶水(可能会阻断贴片和心脏之间的界面)。未来的研究可能证实一个假设,即无缝合和无胶移植不会对小鼠的移植产生负面影响,因为贴片不会从心脏滑落或干扰肺部至关重要。评估永久LAD结扎模型中基于补丁的修复3中的斑块的移植的其他研究已经测量了与时间24一起剩余的灌区面积(mm2),移植的补丁24厚度(μm)与时间25重新接,量化 通过聚合酶链反应(PCR)26或标记活体供体细胞的生物发光光子26发射通量(一种光子/秒发射量,可以量化在活体动物中存活的标记移植细胞)27。未来的研究可能使用这些方法进一步评估无缝合和无胶移植是否影响贴片移植(以及结构和功能对宿主心肌的影响)。尽管如此,在免疫功能小鼠体内28天后,前部介质呈现了可变的纤维材料和粘附。基于补丁的心脏再生的机制可能是从刺激宿主巨噬细胞炎症反应19或分泌免疫因子20,而不是数值细胞补充。如果炎症起着积极的作用,则异物水凝胶材料的存在可能是有益的。或者,为了减少异物的存在,如果水凝胶成分随着时间的推移而分解,可能是有益的。事实上,有些方法使用生物材料,支持细胞最初,然后分解,只留下组织28,29。28,未来的研究,以充分分析补丁包,并更好地了解基于补丁的心脏再生背后的机制,可能会导致优化的实验设计之前,翻译成人体试验2。
总体而言,该协议可能广泛可行,也适合测试多组3D生物打印补丁,例如具有不同的细胞内容。这种方法的未来方向包括生物打印含有以前未在体内测试过的先进水凝胶的斑块,或测试不同自体或同源干细胞衍生细胞的效果,以进行优化,然后再进行大型动物模型。
披露声明
没有。
融资说明:
Christopher D. Roche 获得 2019 年约翰·洛文塔尔爵士奖学金(悉尼大学)、新西兰勒格罗斯遗产基金 (PhD012019) 和心脏研究澳大利亚博士奖学金 (2019-02) 的支持。Carmine Gentile 得到了悉尼大学启动赠款、悉尼大学校长博士奖励计划赠款、UTS 种子资助、悉尼天主教大主教区成人干细胞研究赠款和悉尼医学院假心胸外科研究资助。
致谢
感谢娜塔莉·约翰斯顿录制的非手术镜头和所有视频编辑。
材料
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
参考文献
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。