Method Article
Trasplante de un parche bioimpreso 3D en un modelo murino de infarto de miocardio
En este artículo
Resumen
Este protocolo tiene como objetivo trasplantar un parche bioimpreso 3D en el epicardio de ratones infartos modelando insuficiencia cardíaca. Incluye detalles sobre la anestesia, la abertura quirúrgica del pecho, la ligadura permanente de la arteria coronaria descendente anterior izquierda (LAD) y la aplicación de un parche bioimpreso en la zona infarta del corazón.
Resumen
La prueba de las propiedades regenerativas de los parches cardíacos bioimpresos en 3D in vivo utilizando modelos muriados de insuficiencia cardíaca a través de la ligadura descendente anterior izquierda permanente (LAD) es un procedimiento desafiante y tiene una alta tasa de mortalidad debido a su naturaleza. Desarrollamos un método para trasplantar constantemente parches bioimpresos de células e hidrogeles en el epicardio de un corazón de ratón infarto para probar sus propiedades regenerativas de una manera robusta y factible. En primer lugar, un ratón profundamente anestesiado es cuidadosamente intubado y ventilado. Después de la toracotomía lateral izquierda (apertura quirúrgica del tórax), el LAD expuesto se liga permanentemente y el parche bioimpreso trasplantado en el epicario. El ratón se recupera rápidamente del procedimiento después del cierre del pecho. Las ventajas de este enfoque robusto y rápido incluyen una tasa de mortalidad prevista de 28 días de hasta el 30% (inferior al 44% reportado por otros estudios utilizando un modelo similar de ligadura laD permanente en ratones). Además, el enfoque descrito en este protocolo es versátil y podría adaptarse para probar parches bioimpresos utilizando diferentes tipos de células o hidrogeles donde se necesita un gran número de animales para realizar estudios de potencia de forma óptima. En general, presentamos esto como un enfoque ventajoso que puede cambiar las pruebas preclínicas en estudios futuros para el campo de la regeneración cardíaca y la ingeniería de tejidos.
Introducción
Un trasplante de corazón es el tratamiento estándar de oro para pacientes con insuficiencia cardíaca terminal, pero hay escasez de órganos de donantes. Requiere supresión del sistema inmunitario para prevenir el rechazo del injerto y la tasa de mortalidad de un año es del 15% en todo el mundo1. Por lo tanto, existe un incentivo de larga data para regenerar el miocardio en modelos animales preclínicos con el fin de traducir a ensayos humanos2,,3,4,5,6,7,8,9. Los recientes avances en la bioimpresión 3D de células madre o células cardíacas derivadas de células madre han ganado atención como un enfoque prometedor para regenerar el miocardio2,,3,9,10,11,12.
Se han notificado los primeros ensayos de seguridad en humanos que aplican parches para regenerar el corazón, con células mononucleares de médula ósea autólogas suspendidas en colágeno o células progenitoras derivadas de células madre embrionarias en fibrin, trasplantadas al epicardio7,,8,,13. Sin embargo, para un método más preciso, escalable, automatizable y reproducible, la bioimpresión 3D de parches de hidrogel optimizados que se aplicará a la superficie epicardial del corazón es un enfoque prometedor para regenerar el miocardio para pacientes que de otro modo necesitarían un trasplante de corazón2,,10,,11,,12.
Antes de que se puedan producir ensayos en humanos, se necesitan estudios preclínicos en animales. Se han notificado modelos preclínicos in vivo que persiguen la regeneración del miocardio en cerdos5,ovejas14,ratas6 y ratones4. Un modelo común de infarto de miocardio (MI) en ratones utiliza ligadura permanente de la arteria coronaria descendente anterior izquierda (LAD)15,16. Entre las diferentes cepas de ratones utilizadas, la ligadura laD permanente en ratones C57BL6 tiene una tasa de supervivencia aceptable y normalmente presenta remodelaciones consistentes y cambios cardíacos después de MI16. En los modelos de roedores, se han descrito varios enfoques en los que se ha aplicado tejido cardíaco al corazón en busca de una regeneración efectiva del miocardio dañado4,,6,,17. Mientras que los animales grandes todavía representan un modelo más relevante clínicamente para probar las propiedades regenerativas cardíacas5,14, la versatilidad y viabilidad del modelo de ratón se presta a esta área de estudio de movimiento rápido. Esto puede evitar algunos de los escollos típicos de grandes estudios en animales, incluyendo (pero no limitado a): 1) alta mortalidad animal (a menos que las arterias coronarias diagonales estén ligadas que conducen a infartos segmentarios impredecibles14,o el extremo distal del LAD se ocluye seguido de la reperfusión en lugar de la ligadura permanente5); 2) cuestiones éticas con el daño relativamente mayor causado por los grandes protocolos de animales en comparación con los ratones18; 3) aumento de los costos y/o problemas de viabilidad, por ejemplo, la relativa indisponibilidad de grandes equipos animales, como los escáneres de RMN14. También es importante tener en cuenta que dada la extensa duración y el compromiso típico de los grandes estudios en animales, tienen el potencial de quedar obsoletos antes de que terminen, especialmente con los rápidos desarrollos típicos de este campo. Por ejemplo, es sólo recientemente que el papel crítico desempeñado por las células inflamatorias y mediadores en la regulación de la regeneración cardíaca ha surgido19,,20. Además, el papel fundamental de los estudios preclínicos, como los modelos de animales pequeños, ha sido destacado por una Comisión Lancet como un paso esencial para obtener conocimientos sólidos antes de pasar a los ensayos en humanos21.
Para facilitar el progreso en la comprensión de los mecanismos y la optimización de las condiciones para los enfoques de regeneración cardíaca basados en parches in vivo, presentamos un enfoque novedoso que describe un método de "cuchara y cortina" para aplicar un parche de hidrogel de alginato/gelatina bioimpreso 3D a la superficie de los corazones infartos en ratones C57BL6. El objetivo de este enfoque es proporcionar un modelo in vivo versátil para probar parches bioimpresos 3D que probablemente sean factibles en amplios contextos de investigación para el campo de regeneración cardíaca en rápida evolución2. Este método podría adaptarse a los parches de prueba generados por métodos no bioimpresores, diferentes hidrogeles y células derivadas de células madre autóloticas o alogénicas dentro de parches in vivo. Sin embargo, la consideración detallada de la bioimpresión, hidrogeles o tipos de células está fuera del alcance de este estudio que se centra en el método de trasplante quirúrgico.
Las ventajas del protocolo incluyen que el infarto de miocardio y la aplicación de un parche bioimpreso se realizan en un procedimiento quirúrgico que se puede realizar rápidamente, con herramientas de laboratorio fácilmente disponibles y rentables y con una tasa de mortalidad relativamente baja. También suele permitir un mayor número de animales que los modelos animales grandes en un espacio más pequeño, lo que permite una comparación robusta de múltiples grupos experimentales, particularmente útiles para la comparación de múltiples grupos in vivo. Por otro lado, este protocolo tiene las desventajas de que: 1) el modelo de ratón está más alejado del tamaño del corazón humano, la anatomía y la fisiología que en los modelos animales grandes y no se traduce directamente en seres humanos; 2) las ramas laD murinas proximally, con una variabilidad significativa entre ratones individuales, lo que conduce a la variabilidad del tamaño del infarto (un problema compartido con modelos animales grandes); 3) el parche debe aplicarse sobre toda la superficie anterior del corazón, que es menos precisa que la aplicación sobre una zona específica del infarto; y 4) el parche se aplica inmediatamente en el momento de la MI (para uso humano es probable que sea más clínicamente útil para desarrollar un parche para su aplicación a los meses cardíacos en contra crónicamente infartos después del MI14inicial).
No obstante, si se elige adecuadamente de acuerdo con la hipótesis que se está probando, este protocolo puede proporcionar datos críticos in vivo rápidamente, con números altos, de una manera que sea consistente con los materiales, presupuesto y experiencia disponibles en la mayoría de los laboratorios. En comparación con los modelos animales grandes, es un modelo in vivo que es lo suficientemente versátil como para adaptarse a las tecnologías emergentes de bioimpresión 3D (por ejemplo, por la relativa facilidad de realizar estudios piloto para probar la viabilidad y la seguridad antes de pasar a modelos animales más grandes). Sería adecuado para los investigadores que quieren generar datos in vivo de manera eficiente y económica, tal vez ejecutando múltiples comparaciones de parches bioimpresos 3D con diferentes parámetros de bioimpresión, células o hidrogeles en los parches. Sería especialmente útil para probar las interacciones de diferentes mezclas de células madre y células derivadas de células madre con hidrogeles in vivo sin exceso de desperdicio de linajes celulares caros u otros materiales que podrían ocurrir si se utilizan parches a gran escala. El uso de un modelo de ratón también facilitaría la prueba de parches que contienen linajes de células y células madre derivados de ratones compatibles con especies o células derivadas del ser humano donde los ratones uniformes con una deficiencia inmunitaria específica son deseables. Además, las pruebas en cepas de ratón modificadas genéticamente podrían permitir a los investigadores aislar los efectos de genes específicos en las vías de señalización y en tipos celulares específicos relevantes para las enfermedades cardiovasculares, que actualmente no serían posibles en un modelo animal grande.
Protocolo
Todos los procedimientos descritos en este experimento fueron aprobados por el Comité de ética animal en el Distrito de Salud Local del Norte de Sídney, NSW, Australia (número de proyecto RESP17/55).
1. Anestesia e intubación
NOTA: Encienda y configure el estereomicroscopio, la almohadilla de calor (cubierta con una hoja absorbente) y el sistema de ventilación.
- Limpie los guantes, el área quirúrgica y las herramientas con 70% de etanol.
- Pesar el ratón para calcular la dosis de anestesia inyectada por la vía intraperitoneal (ketamina 40 mg/kg, xilazina 5 mg/kg, atropina 0,15 mg/kg) y dar la inyección.
- Una vez que el ratón alcanza un plano profundo de anestesia, afeite el lado izquierdo ventral del tórax con una recortadora.
- Coloque el ratón en una cámara que contenga 2% de isoflurano (garantizando una ventilación de extracción adecuada en la habitación).
NOTA: La dosis relativamente baja de inyección de ketamina/xilazina junto con una inhalación de isoflurano al 2% reduce el riesgo de muerte del ratón al tiempo que permite una intubación óptima sin despertar el ratón. - Coloque el ratón supino y reténelo de sus dientes incisivos superiores con una sutura 3.0 pegada al banco, como se muestra en el video. Confirme la sedación realizando un pellizco del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo Coloque un iluminador de alta intensidad por encima del cuello del ratón para que se pueda visualizar la orofaringe.
NOTA: Alternativamente, el ratón se puede colocar en el soporte desde el kit de intubación (por ejemplo, Kent Mouse Intubation Kit) con una banda elástica asegurada debajo de los incisivos superiores para mantener la boca abierta para identificar la tráquea. - Utilice una espátula curva para abrir la mandíbula y otro par de espátulas / fórceps contundentes para levantar la lengua suavemente fuera del camino. Asegúrese de intubar mientras esté colocado en o ligeramente por debajo del nivel de los ojos con el cuerpo del ratón.
- Visualice la apertura y el cierre de las cuerdas vocales. Cuando esté abierto, inserte el catéter de plástico de 20 G suministrado con el kit de intubación.
- Transfiera cuidadosamente el ratón intubado a una superficie de funcionamiento equipada con una almohadilla calefactora. Conecte el ratón al ventilador (por ejemplo, MouseVent) que establece automáticamente el volumen de destino en función del peso del ratón.
- Entregar 1.5-2% isoflurano con oxígeno (que está regulado automáticamente por el ventilador: asegúrese de que hay una conexión de un cilindro de oxígeno al ventilador automático a un caudal de 1-2 L/min al respirador). Verifique la intubación comprobando si hay un aumento bilateral del pecho. Verifique la anestesia realizando un pellizco en la dedo del dedo del dedo del dedo del dedo del dedo del dedo del
- Aplique pomada opthalmic (p. ej., Puralube Vet Opthalmic Ointment) en ambos ojos para evitar que se sequen.
2. Preparación del campo quirúrgico
- Asegure el tubo de intubación con cinta adhesiva en el lugar de conexión entre el respirador y el tubo/catéter respiratorio.
- Corte una pieza más larga de cinta y fije su pie delantero izquierdo a la superficie de operación en una posición ligeramente elevada. También cinta adhesiva por las otras extremidades.
- Limpie el pecho con solución estéril de yodo isopropanol y povidona, limpiando en un movimiento circular moviéndose de centro a periferia.
- Verifique la anestesia una vez más con un pellizco en la dedo del dedo del dedo del dedo del dedo del dedo del de
- Administrar 0,08 mg/kg de Temvet (buprenorfina) en 0,1 ml de solución salina al 0,9% mediante inyección subcutánea.
3. Toracotomía lateral izquierda
- Utilice fórceps de punta fina para levantar suavemente la piel en un punto aproximadamente 5 mm a la izquierda del cartílago xifoide prominente. Utilice tijeras quirúrgicas para crear una incisión superomedial en la piel desde este punto hacia arriba y hacia la línea media, hasta el nivel del manubrio.
- Usa fórceps curvos para separar suavemente la piel y las capas musculares. Abra la capa muscular, después de la incisión de la piel.
- Identificar y hacer una incisión en el tercer espacio intercostal, siguiendo el ángulo natural de la caja torácica.
- Utilice un retractor para separar suavemente las costillas 3a y 4a.
- Retire suavemente el pericardio delgado con fórceps.
- Si el LAD no se visualiza, empuje suavemente la aurícula izquierda (ver Figura Suplementaria 1) hacia arriba y localice las arterias coronarias debajo.
4. Ligadura arterial coronaria permanente descendente anterior izquierda (LAD)
- Corte una sutura de seda de 3 mm de largo y coloque esta pieza de sutura de seda de refuerzo de 3-0 en la parte superior del LAD en la misma dirección que la LAD (como se muestra en el vídeo en el punto de espera 02:12 – 02:20).
- Identifique el LAD y pase una sutura de seda 7-0 bajo el LAD. Si el LAD no se visualiza claramente, inserte la aguja 1 mm inferior y medial al punto inferior alcanzado por la punta de la aurícula izquierda durante el movimiento dinámico del corazón.
NOTA: Esta estructura es de un color rojo más claro a las cámaras ventriculares del corazón pero más oscuro que el pulmón adyacente y se visualiza mejor en el video en el punto de tiempo 01:54 – 01:55 donde es visible simplemente inferior al brazo superior del retractor, superior al pulmón izquierdo (ver Figura suplementaria 1 para la imagen fija de vídeo anotado). - Completa dos tiros con la sutura de seda 7-0 y ciérrala firmemente pasando encima de la sutura de seda 3-0 de apoyo para asegurar el LAD. Si la ligadura es exitosa, el área ventricular anterior distal de la ligadura blanqueará.
- Completa el nudo con un tercer tiro en la dirección opuesta para asegurarlo, asegurando que no se transmita ninguna fuerza de tracción hacia arriba a la sutura. No se requieren lanzamientos adicionales para reducir el riesgo de daños en el miocardio o LAD mediante el corte de sutura.
5. Trasplante del parche bioimpreso en el epicardio
- Mueva cuidadosamente el parche bioimpreso de una placa de seis pozos al área del infarto utilizando la superficie interior estéril de un paquete de bisturí quirúrgico abierto.
- Coloque cuidadosamente el parche bioimpreso sobre la superficie epicardial anterior, donde debe cubrir toda la superficie y cubrir los bordes inferiores y laterales, cubriendo el ventrículo izquierdo y la zona del infarto (área blanqueada).
- Cierre suavemente y retire el retractor sin dirigir los bordes afilados hacia el corazón.
- Utilice 6-0 suturas de proleno en un patrón interrumpido simple para cerrar la caja torácica y las capas musculares.
- Con la función Aliento de suspiro mientras se cierra el pecho con las suturas de proleno 6-0, inflar los pulmones para eliminar el exceso de aire en la cavidad pleural, que de lo contrario quedaría atrapado en la cavidad torácica y resultaría en un neumotórax.
- Asegúrese de que el pecho esté herméticamente sellado.
- Disminuya el isoflurano a 1,0%. Cierre la piel con suturas de proleno 6-0 en un patrón simple interrumpido. Apague el vaporizador de isoflurano.
6. Recuperación del ratón
- Aplicar tópicamente 2 mg/ml de bupivacaína en 0,9% de solución salina a la incisión. Administrar también: i) Antisedan (atipamezol) 1 mg/kg; ii) Lasix (furosemida) 8 mg/kg; iii) 600 l de solución salina al 0,9% mediante inyección subcutánea.
NOTA: Antisedan es invertir el anestésico más rápidamente; furosemida es descargar el exceso de líquido debido al compromiso de salida cardíaca y líquido adicional administrado con inyecciones de drogas. - Monitoree el ratón y espere hasta que se observe respiración independiente para extraer el ratón del tubo de intubación.
- Cuando el ratón demuestre una frecuencia de respiración y profundidad bilaterales adecuadas y responda a un pellizco del dedo del dedo del dedo del dedo del otro, coloque el ratón en una jaula de recuperación limpia colocada en una almohadilla de calor.
- Proporcione al ratón alimentos húmedos (humedecidos para masticabilidad), una botella de agua y gel nutritivo/hidratante. Supervise si hay un esfuerzo respiratorio exagerado, sangrado excesivo u otras complicaciones potencialmente mortales.
- Durante los próximos tres días, administrar 0,08 mg/kg de Temvet (buprenorfina) en 0,1 ml de 0,9% de solución salina mediante inyección subcutánea o intraperitoneal, dos veces al día, y luego una al día hasta el quinto día siguiente al procedimiento.
- Ratones domésticos en parejas separados por divisores de jaula para prevenir el aislamiento mientras se evitan comportamientos de lucha. Monitoree ratones al menos diariamente hasta el final de los experimentos (28 días) con mucha atención a su bienestar y mayor frecuencia de monitoreo si hay alguna preocupación.
Resultados
En el trasplante, la viscosidad del parche a temperatura ambiente (sin aplicar un reticulante adicional) le permitió 'cubrirse' sobre los contornos del corazón (Figura 1) y moverse dinámicamente con el ciclo cardíaco. Después de la cirugía, dejamos los parches durante 28 días in vivo, ya que los estudios han encontrado que este es un período de tiempo adecuado que permite efectos de parche en la función cardíaca del huésped3,4 (aunque se ha informado de que los efectos funcionales completos pueden no ser vistos hasta tres meses después del trasplante)22. La fotografía de un parche que se muestra in situ en el corazón del ratón en la Figura 1 se tomó inmediatamente después de la aplicación, mostrando la capacidad del parche para cubrir el corazón en el trasplante. Este resultado representativo muestra que el hidrogel permite que el parche se moldee a los contornos del corazón y donde se produjo una tensión excesiva el hidrogel fue capaz de dividirse como se muestra en el área triangular desnuda (libre de hidrogeles) en la Figura 1 (indicada por una estrella negra en la imagen). Los datos de supervivencia (curvas de supervivencia de Kaplan-Meier) se muestran en la Figura 2 en comparación con los ratones sometidos a un procedimiento falso (paso de una aguja y sutura bajo el LAD sin ligadura seguido de cierre del pecho del ratón).
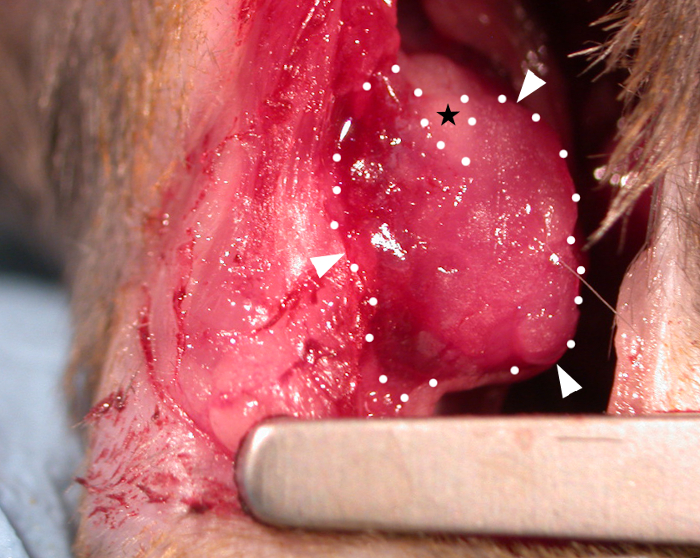
Figura 1: Un parche cardíaco bioimpreso aplicado en el epicario de un corazón de ratón C57BL6. Un parche bioimpreso de 10 mm x 10 mm x 0,4 mm (inmediatamente después del trasplante) que contiene hidrogel (alginato 4% (p/v)/gelatina 8% (p/v) en medios) se muestra cubierto sobre el área infarta y adherido a la superficie epicardial (puntos de flecha blancos y líneas punteadas - borde del parche). La viscosidad del parche le permite moldear los contornos del corazón y donde se produjo una tensión excesiva en el aspecto superior el parche se ha dividido para hacer una zona desnuda triangular no cubierta por hidrogel (estrella negra). Haga clic aquí para ver una versión más grande de esta figura.
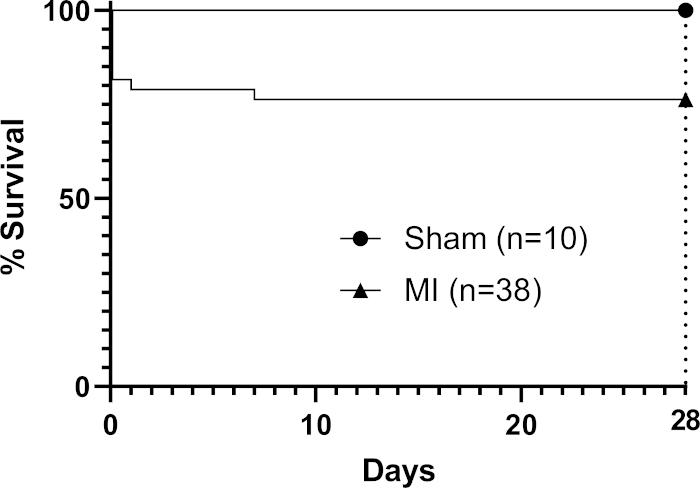
Figura 2: Análisis de supervivencia de Kaplan-Meier a través de 28 días después de MI. Nueve ratones del grupo procesal murieron (n-38) para dar una tasa global de mortalidad del 24%. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Imagen fija de vídeo (punto de tiempo de vídeo 01:54 – 01:55) que muestra la aurícula izquierda (apéndice auricular izquierdo). La flecha apunta a la punta inferomedial de la aurícula izquierda que es visible como una estructura triangular en el borde superior izquierdo del corazón. En caso de que el LAD no se visualice claramente, la punta de la aurícula izquierda se puede utilizar como un punto de referencia para la entrada de la aguja para pasar una sutura debajo del LAD. El punto de entrada es 1 mm inferior y medial al punto inferior que la punta de la aurícula izquierda alcanza durante los movimientos dinámicos del corazón (la flecha negra muestra la punta inferomedial de la aurícula izquierda). Haga clic aquí para descargar esta figura.
Discusión
El método facilita al operador trasplantar eficientemente un parche bioimpreso aplicándolo a la superficie epicardial de un corazón de ratón infarto después de la ligadura laD permanente. En este método centrado en la viabilidad, podemos realizar este procedimiento en ocho ratones por día de trabajo (incluida la preparación de la sala antes y después). Una bioimpresión que produce ocho parchesde 1 cm 2 en pozos de placas de seis pozos toma 2-3 horas (incluyendo el tiempo de preparación antes y después). Usamos el interior estéril de un paquete de bisturí quirúrgico como la primicia de nuestro parche, que es fácilmente accesible y generalmente agrega un costo mínimo, utilizando las propiedades adhesivas naturales del parche de hidrogel de alginato/gelatina para cubrir el parche a través de la superficie anterior infarto del corazón. En nuestra experiencia, el protocolo de ligadura LAD en ratones depende del operador y se puede lograr una menor tasa de mortalidad en 28 días con operadores experimentados especializados en un solo modelo. 16 informaron que los ratones C57BL6 presentan una mortalidad del 44% después de la ligadura laD permanente a los 28 días sin la aplicación de un parche, que es superior al límite superior del 30% que observamos con el método.
El paso de intubación es crítico y dentro y por sí mismo puede ser una fuente de mortalidad para ratones a menos que sea realizado por un operador calificado. Se hace difícil debido al pequeño tamaño de la tráquea, por lo que las lupas son usadas por el operador para este paso. Utilizamos ketamina inyectada/xilazina, así como isofluorano inhalado para la inducción de anestésicos para que el ratón esté profundamente anestesiado a dosis relativamente bajas de cada medicamento. Por lo tanto, no hay riesgo de que el ratón se despierte durante este paso de intubación, pero se evita la alta mortalidad asociada con altas dosis de un solo fármaco. Atropina también se dio para contrarrestar los efectos secundarios como bradicardia e hipersalivación. El uso de un foco aplicado a la garganta externamente ilumina la tráquea internamente por lo que es más visible y las cuerdas vocales deben visualizarse abriendo y cerrando con la frecuencia respiratoria del ratón (generalmente 120 respiraciones por minuto). Es fundamental posicionar el ratón perfectamente (por lo que se prefiere una superficie dura en lugar de una estera de calentamiento debajo del ratón para este paso) con los dos dientes incisivos sostenidos por un hilo en bucle y la lengua retraída extremadamente suavemente con fórceps / par de espátulas para abrir la boca y visualizar la tráquea. Una vez completada la intubación, el operador debe tener cuidado de no desalojar el tubo en la transferencia desde el área de intubación al lecho de operación (que tiene una estera de calor debajo de ella para evitar la hipotermia). Al conectar el tubo de respiración al aparato de ventilación, es fundamental estabilizar el tubo con una mano y conectar el circuito del ventilador con la otra, de modo que haya un movimiento mínimo del tubo de respiración, como empujarlo más profundamente en la tráquea al conectar el segmento del ventilador del tubo.
En este estudio, utilizamos alginato 4% (p/v)/gelatine 8% (p/v) en el Medio de águila modificada de Dulbecco (DMEM). Los hidrogeles de alginato/gelatina son conocidos por su biocompatibilidad, bajo costo y propiedades biomecánicas, por lo que son útiles para estrategias de ingeniería de tejidos 3D23. Estos hidrogeles pueden ser reticulados por gelización leve mediante la adición de iones de calcio, lo que permite alterar la viscosidad. Después de la bioimpresión, aplicamos cloruro de calcio (CaCl2) 2% (p/v) en solución salina tamponada con fosfato (PBS) en parches y luego los cultivamos en DMEM en seis placas de pozo durante 7-14 días antes de trasplantarlos. Esta era la ventana óptima después de que los parches que contenían células cardíacas comenzaron a latir en el cultivo, pero antes de que los parches comenzaran a desintegrarse. Mientras que CaCl2 podría añadirse regularmente a lo largo de la fase posterior a la bioimpresión para reducir la desintegración de parches, encontramos que la viscosidad intrínseca del hidrogel era suficiente para que los parches mantuvieran su estructura hasta el trasplante con una sola dosis inicial de CaCl2.
El método permitió un trasplante exitoso sin suturas (que pueden dañar el corazón) o pegamento (que puede bloquear la interfaz entre el parche y el corazón). Estudios futuros pueden confirmar la hipótesis de que el trasplante sin sutura y sin pegamento no afecta negativamente el injerto en ratones, ya que es fundamental que el parche no se deslice del corazón ni interfiera con los pulmones. Otros estudios de evaluación del injerto de parches en modelos de ligadura laD permanente con reparación basada enparches 3 han medido el área injertada (mm2) restante con el tiempo24,el espesor del parche injertado (m) reminándose con el tiempo25,la cuantificación de células trasplantadas por reacción en cadena de la polimerasa (PCR)26 o flujo de emisión de fotones bioluminiscencia de células donantes vivos etiquetadas (una medida de fotones emitidos por segundo que puede cuantificar las células injertadas etiquetadas que sobreviven en animales vivos con el tiempo)27. Estudios futuros pueden utilizar estos métodos para evaluar aún más si el trasplante sin sutura y sin pegamento afecta al injerto de parches (así como los efectos estructurales y funcionales en el miocardio del huésped). Sin embargo, macroscópicamente después de 28 días in vivo en nuestros ratones inmunocompetentes, el mediastino anterior presentó material fibginoso variable y adherencias. El mecanismo de regeneración cardíaca basada en parches puede deberse a la estimulación de las respuestas inflamatorias de los macrófagos del huésped19 o a los factores inmunológicos secretos20 en lugar de la reposición numérica de células. Si la inflamación juega un papel positivo, la presencia de material de hidrogel extraño puede ser beneficiosa. Alternativamente, para reducir la presencia de material extraño puede ser beneficioso si el componente hidrogel se desintegra con el tiempo. De hecho, algunos enfoques utilizan biomateriales que apoyan las células inicialmente y luego se desintegran, dejando sólo el tejido28,,29. Estudios futuros para analizar completamente el enjerto de parches y comprender mejor los mecanismos detrás de la regeneración cardíaca basada en parches pueden conducir a diseños experimentales optimizados antes de la traducción a ensayos en humanos2.
En general, es probable que este protocolo sea ampliamente factible y también adecuado para probar múltiples grupos de parches bioimpresos 3D, por ejemplo con diferentes contenidos celulares. Las instrucciones futuras para este método incluyen la bioimpresión de parches que contienen hidrogeles avanzados no probados previamente in vivo o pruebas de los efectos de diferentes células madre autóloticas o alogénicas derivadas de células madre, para su optimización antes de proceder a modelos animales grandes.
Divulgaciones
Ninguno.
DECLARACION DE FUNDING:
Christopher D. Roche fue apoyado por una Beca Sir John Loewenthal 2019 (Universidad de Sídney), el Le Gros Legacy Fund New Zealand (PhD012019) y una Beca de Doctorado De Investigación del Corazón Australia (2019-02). Carmine Gentile fue apoyado por una beca Kick-Start de la Universidad de Sídney, la Beca de Incentivo Al Doctoral del Canciller de la Universidad de Sídney, UTS Seed Funding, la Beca de la Arquidiócesis Católica de Sídney para la Investigación de Células Madre para Adultos y una Beca de Investigación de Investigación en Cirugía Cardiotorácica De Foudation de la Escuela De Medicina de La Universidad de Sídney.
Agradecimientos
Gracias a Natalie Johnston por la grabación de las imágenes no quirúrgicas y toda la edición de vídeo.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
Referencias
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados