Method Article
鸡卵外胚胎和脉络膜尿囊血管的制备作为体内模型,用于对比增强超声成像和微泡介导的药物递送研究
摘要
该协议描述了有关如何获得和使用5至8天大的鸡胚胎及其脉络膜尿囊膜(CAM)作为体内模型的三种方法,以研究对比增强超声成像和微泡介导的药物递送。
摘要
鸡胚和富含血管的脉络膜尿囊膜(CAM)是一种有价值的 体内 模型,用于研究生物医学过程,新的超声脉冲方案或用于对比增强超声成像和微泡介导的药物递送的新型换能器。其原因是CAM的胚胎和血管网络的可访问性以及模型的低成本。进入胚胎和CAM血管的一个重要步骤是将蛋内容物从蛋壳中取出。在该协议中,描述了在孵育的第5天和第8天之间将内容物从蛋壳中取出的三种方法,从而使胚胎在这些天内在蛋壳内发育。所描述的方法只需要简单的工具和设备,与卵外培养胚胎(~50%)相比,5天存活成功率更高,6天存活成功率为90%,6天存活成功率为75%,7天存活成功率为50%,8天龄孵化 卵 存活成功率为60%。该协议还描述了如何将空化核(例如微气泡)注入CAM血管系统,如何将含有胚胎和CAM的膜与其余的鸡蛋内容物分离以进行光学透明研究,以及如何在各种短期超声实验中使用鸡胚和CAM。 体内鸡胚和CAM模型与研究用于对比增强超声成像的新型成像方案,超声造影剂和超声脉冲方案以及揭示超声介导的药物递送机制非常相关。
引言
卵外鸡胚胎和富含血管的脉络膜尿囊膜(CAM)已被证明是研究各种生物和生物医学过程(如胚胎发生,肿瘤学和药物递送)的合适模型1,2,3,4。超声已被用于胚胎心脏发育的成像4,5和用于在注射时激活空化核,例如微泡,用于血管药物输送6,7。与其他动物模型相比,鸡胚价格低廉,需要的基础设施和设备更少,并且立法不那么严格8.打开鸡蛋后,鸡胚胎和CAM容器很容易进入,而对于哺乳动物胚胎和容器来说,这要困难得多。除此之外,鸡胚和CAM血管提供心跳和脉动的血流。CAM在血管解剖学上与哺乳动物相似,可用于药物筛选8,9,10。由于这些特性,CAM血管也被证明是研究对比增强超声成像(CEUS)的合适模型11,12,13,14,15,16。此外,该模型可用于使用超高速相机光学研究超声造影剂在超声场中的行为,以及声辐射力对药物7,17,18,19的推进,结合和外渗的影响。虽然鸡胚和CAM不太适合长期实验,但它们对短期体内实验是有益的。
为了在实验过程中提高鸡胚和CAM的可见性和可控性,重要的是将含有胚胎和CAM的鸡蛋内容物从蛋壳中取出18。以前涉及超声造影剂的鸡胚胎研究使用了5至6天大的胚胎7,11,12,17,19和14至18天大的胚胎13,14,15,16。已经详细描述了将蛋内容物从壳中取出的多种方法18,20,21。然而,据我们所知,先前发表的方法侧重于在孵化3天后(即汉堡和汉密尔顿(HH)阶段19-2022)将鸡蛋含量从蛋壳中取出,并继续卵外培养。这种卵外培养方法具有多种缺点,包括培养过程中死亡风险增加(~50%)1,18,抗生素的使用18,20,以及与卵内生长相比,总血管长度减少23。由于在蛋壳内培养胚胎提供了最自然的环境,因此最简单的方法是将胚胎在蛋壳内孵育直到实验当天。出于这个原因,在孵化 5 到 8 天时将鸡蛋内容物从蛋壳中取出的方法对于 5 到 8 天大的胚胎的实验尤其有益。
在该协议中,我们描述了三种方法,当胚胎处于发育的第5至8天(HH 26-3522)时,将卵内容物从蛋壳中取出,允许胚胎在蛋壳内发育直到实验当天。CAM容器的直径范围从8天大胚胎24的较小毛细血管中的直径为10-15μm,到6天和8天大的胚胎24,25的较大容器中的直径为115-136μm。所描述的三种方法只需要基本的实验室工具,并在实验开始之前降低并发症的风险,从而减少不必要的成本和劳动力。我们还详细介绍了一种将含有胚胎和CAM的膜与卵黄袋分离的方法,使CAM在显微镜研究中具有光学透明性。由于包含胚胎和CAM的膜可以固定在例如带有声膜的支架上,因此该设置也可以使声学透明26,当光路将受到卵黄的影响时,允许显微镜和超声研究相结合。最后,我们描述了其他几种可用于超声或CEUS成像的超声设置。
研究方案
所有动物实验均根据《荷兰动物实验法》和欧洲理事会(2010/63/EU)关于保护动物用于科学目的的规定进行。
1 .胚胎制备方案
- 受精鸡蛋的孵化
- 将新鲜受精的鸡蛋在15°C下储存长达一周。
- 要孵育受精卵,将它们垂直放置,尖头朝下放入37°C加湿的培养箱中。在孵化期间无需转动种蛋。
注意:使用永久性记号笔写下种蛋顶部孵化的开始日期。
- 准备长达 5 天(120 小时)的胚胎(HH 阶段 26-28)22
- 工作区的准备
- 将加热板加热至37°C。
- 将金属蛋架(图1A,B),金属称量舟架(图1C,D)和填充有PBS的10 mL锥形叶机放在加热板上。
- 用 10 mm 超声凝胶层填充称重舟(85 mm × 85 mm × 25 mm),并将填充的称重舟放入预热的金属称重舟支架中。
注意:用超声凝胶填充称量舟将提升胚胎和 CAM。这可能有利于胚胎和CAM的注射或成像,但对于将胚胎和CAM从蛋壳中取出不是必需的。 - 准备几张胶带(约 3 厘米长),一端的一部分折叠起来,这样就不会再粘住。
- 从蛋壳中取出鸡蛋内容物
- 取一个5天大的孵化受精卵并将其转移到预热的金属蛋架上(图1A,B)。确保鸡蛋保持相同的方向(即顶部的日期)。
注意:重要的是将卵子保持在相同的方向,以使气囊和胚胎和CAM保持在鸡蛋顶部的相同位置。 - 使用镊子的尖背(或类似; 图1E)在鸡蛋的最顶部(写日期的地方)做一个小凹痕(图2A)。
- 使用镊子的尖背在鸡蛋的侧面向下 2/3 处进行第二个缩进(图 2B)。
注意:注意不要使缩进太大并形成孔洞。如果意外地形成了一个孔,请用胶带密封该孔,不要再压痕。 - 使用较大的镊子(图1E),从鸡蛋顶部的缩进区域取出一小块蛋壳(带有书面日期)。确保蛋壳顶部的气囊与蛋外的空气接触,但不要穿透蛋壳太深。
注意:如果在制作顶部凹痕时外壳穿透得太深,胚胎和 CAM 可能会损坏,并且胚胎将无法从外壳中取出后存活下来。重要的是,顶部的小孔在鸡蛋的内部和外部之间建立空气接触。如果不这样做,将在程序的后续步骤中产生真空,这将导致大气泡被困在CAM下,使胚胎和CAM无用。为了检查鸡蛋内气囊的位置,可以使用光源,因为它的位置并不总是完全在顶部,也可以更靠边。 - 使用 5 mL 注射器和 19 G 针头通过鸡蛋下方 2/3 侧的第二个压痕穿透蛋壳并取出 ~2 mL 蛋清(图 2C)。
注意:确保针头朝下指向鸡蛋的底部,以防止损坏胚胎和CAM的机会。此步骤在鸡蛋顶部形成一个更大的气穴,以去除鸡蛋内容物。如果在步骤1.2.2.3中意外地形成了一个孔而不是缩进,则用针刺穿胶带以取出蛋清。用另一块胶带重新密封穿孔。 - 取出针头并使用胶带密封侧面的间隙(图2D)。
注意:为防止蛋清从鸡蛋中泄漏出来,在取出针头之前,可以用手指关闭顶孔。如果蛋清在胶带已经就位的情况下不断泄漏,请先用纸巾取出蛋清,以确保胶带正确粘住。 - 通过将蛋清添加到称重舟中来清空注射器。
- 使用大镊子(图1E)扩大鸡蛋顶部的小开口(图2E)。当通过顶部的开口观察卵子内部时,胚胎和CAM是可见的。继续定位胚胎和CAM,同时尽可能多地带走蛋壳(图2F)。
注意:继续移动鸡蛋以保持胚胎和CAM在壳内位置的最大可见性。确保外壳中开口的边缘不低于 CAM。除此之外,不要穿透内膜并防止锋利的边缘。 - 创建开口后,将鸡蛋旋转 180°,然后将鸡蛋放回鸡蛋架中,以使鸡蛋顶部创建的开口现在朝向底部。胚胎将漂浮起来,从底部变得不可见(图2G),这需要1-2分钟。在继续下一步之前,确保整个胚胎和CAM(包括所有血管)消失并且只有蛋黄可见(图2H)。
注意:如果2分钟后胚胎仍然从底部可见,请顺时针转动鸡蛋1-2分钟。这将有助于胚胎和CAM漂浮起来。 - 从侧开口取下胶带。看看鸡蛋的内部现在是否从底部开口中凸出。如果是这种情况,请继续执行下一步。如果没有,请使用注射器上的针头再次刺穿侧面的开口以释放鸡蛋中的真空。确保用针头向上指向,以防止刺穿蛋黄袋的机会。继续直到鸡蛋从底部开口中凸出。
- 在金属称重舟架(图1C,D)中将鸡蛋底部靠近称重舟时,使用小镊子的尖点之一(图1F)在开口的整个宽度上轻轻但快速地在膜上划痕,然后轻轻地将鸡蛋内容物放入称重舟中(图2I)。
注意:如果鸡蛋内容物没有出来,请使用注射器上的针头再次刺穿侧面开口,针头朝上。 - 如果胚胎侧身在称重船上,它通常会自行上升。如果没有发生这种情况,请使用一张薄纸重新定位胚胎。将薄纸的一面放在胚胎上,将薄纸拖到另一端,然后使用塑料巴斯德移液管用几滴~30μLPBS(37°C)释放薄纸。
- 目视检查胚胎是否还活着,确保心跳仍然存在,CAM血管完好无损,没有出血,没有蛋黄泄漏。如果这些事情之一不正确,请丢弃胚胎和CAM,因为它将无法存活。
- 确保胚胎和CAM保持在37°C并且不要变干,因为这会使CAM血管恶化,最终胚胎会死亡。为防止这种情况,请定期在胚胎和CAM上滴入~30μL的37°C PBS的小滴剂。
- 取一个5天大的孵化受精卵并将其转移到预热的金属蛋架上(图1A,B)。确保鸡蛋保持相同的方向(即顶部的日期)。
- 工作区的准备
- 准备 6 至 7 天(144-168 小时)的旧胚胎(HH 阶段 28-32)22
- 工作区的准备
- 按照第 1.2.1 节中所述准备阶段。
- 从蛋壳中取出鸡蛋内容物
- 在实验前两小时,取一个 6 到 7 天大的孵化蛋,在孵化器内将鸡蛋旋转 180°,使鸡蛋的顶部朝向底部。1小时后,将鸡蛋旋转回其原始位置并再放置1小时。
注意:在实验前 2 小时旋转鸡蛋将更容易将鸡蛋内容物从壳中取出。 - 旋转后,从孵化器中取出鸡蛋。
- 执行步骤 1.2.2.2,直到步骤 1.2.2.4。
- 使用 5 mL 注射器和 19 G 针头通过鸡蛋下方 2/3 侧的第二个压痕穿透蛋壳,并在 5-6 mL 蛋清之间抽出。确保针头向下指向鸡蛋的底部。
注意:使用我们使用的 5 mL 注射器,最多可以抽出 6 mL,因此只需要一次穿透。 - 取出针头并使用胶带密封侧面的间隙(图2D)。
- 通过将蛋清添加到称量舟中的超声凝胶中来清空注射器。
- 使用大镊子(图1E)扩大鸡蛋顶部的小开口(图2E)。尽量使开口尽可能大,但要确保外壳中开口的边缘不低于 CAM。除此之外,不要穿透内膜并尽量防止锋利的边缘。
- 在步骤1.3.2.4中,用比抽出体积多~1mL的37°C PBS填充注射器。
- 从侧缝中取下胶带,用填充的注射器穿透缝隙,然后将其倒入外壳中。确保针头向下指向鸡蛋的底部。
注意:由于蛋清的粘度(~160 cP)27高于PBS(~1 cP),因此用PBS代替蛋清可以减少胚胎和CAM上的张力和压力,同时将鸡蛋内容物从壳中取出。 - 取出针头并用胶带快速重新密封间隙(图2D)。
- 将鸡蛋转动 180°,然后将鸡蛋放回鸡蛋架中,使鸡蛋顶部创建的开口现在朝向底部。顺时针转动鸡蛋,直到整个胚胎和CAM(包括所有血管)消失,只有蛋黄可见。
- 执行步骤 1.2.2.10 直到步骤 1.2.2.14。
- 在实验前两小时,取一个 6 到 7 天大的孵化蛋,在孵化器内将鸡蛋旋转 180°,使鸡蛋的顶部朝向底部。1小时后,将鸡蛋旋转回其原始位置并再放置1小时。
- 工作区的准备
- 准备8天(192小时)的胚胎(HH阶段32-35)22
- 工作区的准备
- 将加热板加热至37°C。
- 将金属称量舟架(图1C,D)和填充有PBS的10 mL锥形瓶放在加热板上。
- 取一个170 x 110 x 70毫米或类似的浅容器,并用1升37°C PBS填充容器。
- 将称重舟(85×85×25毫米)放入直径为90毫米的培养皿中。将培养皿和称重船放在容器底部,并确保它们完全浸没。
- 从蛋壳中取出鸡蛋内容物
- 在实验前两小时,取一个 8 天大的孵化蛋,在孵化器内将鸡蛋旋转 180°,使鸡蛋的顶部朝向底部。1小时后,将鸡蛋旋转回其原始位置并再放置1小时。
注意:在实验前 2 小时旋转鸡蛋将更容易将鸡蛋内容物从壳中取出。 - 从孵化器中取出一个 8 天大的孵化蛋。
- 水平握住鸡蛋,并使用大镊子的尖背(图1E)在鸡蛋上向下缩进1/2。继续在蛋壳周围 360° 以环形图案制作小凹痕。在缩进之间使用 ~10 mm 的间距。
注意:在此过程中,压痕之间可能会开始形成小裂缝。 - 在外壳周围创建小凹痕后,使用大镊子的尖背在两个小凹痕之间裂开外壳,从而打一个更大的孔。
- 将鸡蛋完全浸没在37°C PBS中并保持浸没5分钟。5分钟后,将鸡蛋靠近容器内的称重船。将两个拇指的顶部放入大孔中,轻轻打开鸡蛋。鸡蛋会沿着小凹痕破裂。
- 当蛋壳周围形成裂缝时,轻轻尝试将两个蛋壳块拉开,并继续轻轻地来回移动两块,直到蛋内容物与蛋壳分离。然后,轻轻地将鸡蛋内容物放入称重舟中。
注意:通过来回移动两块蛋壳,更多的PBS将流入蛋壳,这将有助于将蛋内容物与蛋壳分离。有时,一点蛋清会粘在蛋壳内部。发生这种情况时,用镊子将蛋清与去壳分开。 - 慢慢提起含有称量舟和PBS鸡蛋内容物的培养皿。从 PBS 中取出时,稍微倾斜称量舟以去除多余的 PBS。
- 将含有鸡蛋内容物的称量舟放入金属称量舟架中,然后移至所需的实验设置。
- 在实验前两小时,取一个 8 天大的孵化蛋,在孵化器内将鸡蛋旋转 180°,使鸡蛋的顶部朝向底部。1小时后,将鸡蛋旋转回其原始位置并再放置1小时。
- 工作区的准备
2. 部分应用
- 将微气泡和/或其他溶液注入CAM容器中
- 准备注射设置
- 使用微锻件从玻璃毛细管中拉出玻璃针(图3A)或购买拉动玻璃毛细管针。
- 如果玻璃毛细管针的尖端没有倾斜,请折断针尖的一小部分。用矿物油填充玻璃针并将其放入微注射系统中。确保玻璃针中的矿物油中没有气泡。
注意:矿物油是根据我们使用的注射系统制造商的说明添加的。 - 在微注射系统允许的范围内清空拉动玻璃毛细管针,并部分用空气重新填充玻璃针。
注意:少量空气将防止矿物油和待注射溶液的混合物。 - 将10μL所需溶液,在该协议微泡中,放在一块蜡质薄膜上(图3B)。如果需要多种溶液,可以在移液前混合溶液7。
注意:在用微气泡填充针头之前,将微气泡液滴留在蜡膜上~1分钟,以便微泡漂浮到液滴的顶部并浓缩。对于F型定制的超声造影剂28,该浓缩步骤将把待注射的微泡浓度提高~30%。5日龄胚胎注射后鸡胚血液中的浓度在32 x 103微泡/μL之间,6日龄胚胎为19 x 103微泡/μL。 - 通过将玻璃针尖放入蜡膜上的液滴中,用微气泡和/或其他溶液填充玻璃针。吸入微气泡时,请确保将针尖放置在液滴的顶部以吸出富含微气泡的溶液。
注意:在注入微气泡之前,将玻璃针的尖端抬高到最高点并等待~2分钟。这将确保微气泡将集中在玻璃针尖。
- 准备注射设置
- 注入凸轮容器
- 注射前,在体视显微镜下观察CAM,然后选择最佳注射容器。始终注射到 胚胎的静脉 之一中。这些是血流向胚胎的血管。由于含氧血液,静脉的颜色比动脉浅29。此外,静脉始终位于动脉顶部,但有两个例外,即前静脉和后卵黄线静脉(即分支较少的静脉,在 图 6A,B 中用星号表示),它们周围没有动脉。
注意:注射到其中一个分支将限制注射过程中血流的阻塞。良好的注射部位已用图 6A,B中的箭头表示。注射到静脉中至关重要,因为这将迫使注射的物质流向胚胎。除此之外,注射到动脉中会导致在取出玻璃针时大量出血,从而杀死胚胎。 - 将玻璃针和胚胎定位为玻璃针尖和所选静脉位于同一焦平面和同一方向上。尝试将针头尽可能水平地平行于所选静脉。针尖应接触血管壁。
注意:通过将玻璃针尽可能水平放置,刺穿整个容器的机会会降低。 - 定位后,慢慢前进并用玻璃针穿透血管壁。在穿透过程中,CAM 将首先被玻璃针的运动推开。继续推进玻璃针,直到穿透血管壁。
注意:如果意外地将血管刺穿,请慢慢缩回针头以回到管腔中。当回到管腔内时,稍微向上提起针头并沿血管向前移动以重新定位针头。 - 穿透后,稍微缩回玻璃针,以更好地将尖端定位在血管腔内,并将玻璃针侧向移动以检查它没有附着在血管壁上。缓慢注入少量溶液以确认尖端位于血管腔内(图3C)。
- 确保注射的溶液跟随血流。如果没有,请稍微移动玻璃针并继续少量注射,直到玻璃针正确定位17.
- 当注射所需量时,将玻璃针留在血管中~15秒以防止大量出血。然后,将玻璃针稍微侧向移动一点,上下移动,来回移动几次,以轻轻地缩回玻璃针。
注意:有些出血是正常的。每次注射都使用新的玻璃针,因为玻璃针很容易被蛋清堵塞并变钝。
- 注射前,在体视显微镜下观察CAM,然后选择最佳注射容器。始终注射到 胚胎的静脉 之一中。这些是血流向胚胎的血管。由于含氧血液,静脉的颜色比动脉浅29。此外,静脉始终位于动脉顶部,但有两个例外,即前静脉和后卵黄线静脉(即分支较少的静脉,在 图 6A,B 中用星号表示),它们周围没有动脉。
- 胚胎和/或CAM血管的显微镜成像
- 带声学膜的准备支架
- 取一个由方形塑料支架组成的细胞培养室,该支架与两个平行的50μm厚的透声聚碳酸酯膜26组成,进一步称为带声膜的支架。用盖子关闭两个端口。
- 使用手术刀从带有声膜的支架上取下两膜中的一层。
注意:要去除膜,请切开塑料上胶线旁边的膜。小心不要从边缘滑落,以防止损坏另一层膜。 - 通过在小玻璃烧杯中加热至80-95°C,在demi水溶液中制备~15mL的2%琼脂糖。在流动的冷水龙头下用溶解的琼脂糖溶液冷却玻璃烧杯。
注意:如果琼脂糖太热,它会融化声膜,从而产生不平坦的表面。 - 当溶液冷却到37°C左右时,用隔音膜缓慢地将溶液倒入支架中,直到它充满整个支架。用隔音膜稍微倾斜支架,使琼脂糖层均匀分布在塑料框架内(图 4A)。确保琼脂糖层平坦,让琼脂糖在室温下凝固。
- 从卵黄袋中取出胚胎和 CAM 并放在带有隔音膜的支架上
- 按照第 1.2、1.3 或 1.4 节所述从鸡蛋中取出鸡蛋内容物。
- 如果需要,按照第 2.1.2 节所述,在 CAM 中注入微气泡和/或其他溶液。
- 用~500mL的37°C PBS填充1L培养皿,并将带有琼脂糖的声学膜的支架放在培养皿的底部。确保琼脂糖层朝上。
- 当鸡蛋内容物在称重舟中时,使用小剪刀 快速切入 整个 CAM 周围的蛋黄袋(也称为 Vitellus 膜)的膜(图 4B)。将剪刀保持在相同位置,并在切割时旋转称重船,以获得更高的精度和更快的速度。
注意:从第一次切割的那一刻起,蛋黄就会开始泄漏。这降低了胚胎和CAM的可见性。尝试在 6-7 次切割内在 CAM 周围一直切割。这不应该超过 20 秒。小镊子(图1F)可用于固定玻璃膜的边缘并防止切入CAM。 - 使用汤匙从称量舟中舀起含有胚胎和CAM的切口膜。从称量船上慢慢提起勺子,目视检查含有胚胎和CAM的切口膜是否仍附着在剩余的卵黄袋膜上。在这种情况下,使用剪刀进行额外的剪裁。舀勺时,稍微倾斜勺子以去除尽可能多的蛋黄,但不要让它变干。将含有胚胎和CAM的切口膜转移到1L培养皿中,浸入37°C PBS中,然后取出勺子。
- 当含有胚胎和CAM的膜浸没在37°C PBS中时,使用小镊子(图1F)抓住膜的一个边缘并轻轻地围绕膜旋转以去除仍然附着的蛋黄。
- 去除所有蛋黄后,使用小镊子移动包含胚胎和CAM的膜,并将其放置在带有声膜的支架上方。
- 使用一个昆虫标本别针将包含胚胎和CAM的膜固定在一个角落。避免刺穿CAM中的血管,只固定膜。
- 使用第二个昆虫标本销将包含胚胎和CAM的膜固定在对角线相对的角上。
- 用含有胚胎和CAM的声膜从37°C PBS中缓慢提起支架。稍微倾斜支架以摆脱大部分 PBS。
- 使用小镊子(图1F)将含有胚胎和CAM的膜拉伸并均匀分布在带有声膜的支架上,并固定膜的其余部分。确保包含胚胎和CAM的膜略微拉伸以确保其平坦(图4C)。
- 将带有声膜的支架与包含胚胎和CAM的固定膜放入保持在37°C的显微镜设置中。
- 将盖玻片或声学和光学透明的膜(取决于所需的物镜以及是否使用超声波)放在胚胎或CAM上感兴趣区域的顶部(图4D),以实现光学可视化。
- 带声学膜的准备支架
- 鸡胚和/或CAM血管的超声成像
- 鸡胚和CAM血管侧面的超声成像
- 按照第 1.2、1.3 或 1.4 节所述取出鸡蛋内容物。但是,请勿使用标准称重舟。相反,请使用带有一个声学透明壁的定制称重船。
注意:标准称量舟的调整方法是切断称量舟的一侧,并用聚酯箔窗口代替,该窗口使用环氧胶粘合在一起。 - 将首选超声换能器浸入37°C水浴中,并以所需的间距放置在所需位置。
- 将称量舟放入水浴中,使透明壁朝向传感器。确保称量舟的深度足以与传感器齐平,但避免水进入称量舟(图 5A)。
- 如果需要,在胚胎或CAM血管的顶部添加另一个设置,如显微镜或激光(图5A)。
- 按照第 1.2、1.3 或 1.4 节所述取出鸡蛋内容物。但是,请勿使用标准称重舟。相反,请使用带有一个声学透明壁的定制称重船。
- 从胚胎和CAM血管顶部进行超声成像,无声干扰
- 用37°C PBS填充2L烧杯玻璃杯。将 500 mL 烧杯玻璃倒置在 2 L 烧杯玻璃杯的底部。避免空气进入 500 mL 烧杯玻璃杯。
注意: 500 mL 烧杯杯用于将装有鸡蛋内容的称量舟抬近 PBS 表面。通过用烧杯代替其他尺寸的物体,可以改变换能器和鸡蛋内容物之间的距离。 - 将装满 2 L 烧杯玻璃杯和 500 mL 烧杯玻璃放入 37 °C 水浴中。
- 按照第 1.2、1.3 或 1.4 节所述取出鸡蛋内容物。
- 用37°C PBS润湿鸡蛋内容物,并用透明的保鲜膜覆盖胚胎。这可以使胚胎保持在同一位置并防止其旋转或漂浮。
注意:通过用PBS润湿鸡蛋内容物,它会变得不那么粘稠,这使得更容易用透明的保鲜膜覆盖鸡蛋内容物。 - 将装有蛋内容物的称量舟放入直径为90毫米的培养皿中,然后将培养皿缓慢浸入PBS中(图5B)。
注意:在培养皿的侧面使用两个彼此相对的夹子可以更容易地浸没培养皿。 - 将超声换能器定位在所需的远距离上。
- 用37°C PBS填充2L烧杯玻璃杯。将 500 mL 烧杯玻璃倒置在 2 L 烧杯玻璃杯的底部。避免空气进入 500 mL 烧杯玻璃杯。
- 使用可移动换能器对鸡胚和CAM血管进行超声成像
- 按照第 1.2、1.3 或 1.4 节所述取出鸡蛋内容物。
- 通过在小玻璃烧杯中将溶液加热至80-95°C,在demi水中制备2%琼脂糖溶液。在流动的冷水片下用溶解的琼脂糖溶液冷却玻璃烧杯。
- 将琼脂糖溶液倒入扁平容器中,形成约1毫米厚的琼脂糖垫。完全冷却并凝固后,使用手术刀将琼脂糖垫切割成所需大小。
注意:琼脂糖垫的厚度可以改变,以获得超声换能器正常工作所需的所需焦距。 - 将琼脂糖垫放在胚胎和CAM的顶部(图5C)。在琼脂糖垫的顶部加入几滴~30 μL 37 °C PBS,在琼脂糖垫和换能器之间形成薄的PBS层。
注意:使用PBS可以防止换能器粘在琼脂糖垫上。例如,当使用电机机械移动二维换能器以进行三维扫描时,这是有益的(图9B)11。当换能器不需要移动时,PBS也可以用超声凝胶代替。 - 放置所需的超声换能器。
- 鸡胚和CAM血管侧面的超声成像
结果
在该协议中,我们描述了三种在孵化第5-8天(HH 26-3522)将蛋内容物从壳中取出的方法。图6显示了称重船从壳中取出后的蛋含量。使用第1.2节中描述的方法取出5天大的胚胎和CAM(图6A)。使用第1.3节中描述的方法取出6天和7天大的胚胎和CAM(图6B,C)。使用第1.4节中描述的方法取出8天大的胚胎和CAM(图6D)。没有观察到胚胎或CAM出血或损坏,表明这些方法可用于安全地将卵内容物从壳中取出,而不会伤害胚胎或CAM血管。如果正确执行,5天大胚胎的方法将在90%的程序中提供可行的胚胎和完整的CAM。存活率基于从蛋壳中成功提取的受精卵总数。使用第二种方法,对于 6 天和 7 天的孵化鸡蛋,6 天大的活胚胎和完整 CAM 的几率约为 75%,7 天大的几率约为 50%。使用针对 8 天大的胚胎描述的第三种方法,存活胚胎和完整 CAM 的几率约为 60%。可以观察到5天和8天大的胚胎之间的发育阶段差异,这与Hamburger和Hamilton22一致。胚胎的大小和CAM血管的复杂性在发育过程中都会增加(图6A-D)。 图6C显示了蛋内容物顶部的琼脂糖薄片,可以使用图5C所示的超声设置对胚胎和CAM进行成像。将卵子内容物从壳中取出后,肉眼可以看到胚胎的心跳。这些卵外胚胎的心率与卵胚胎相似,在第5天为每分钟183次(bpm),在第830天达到~208 bpm。当保持加湿并在37°C时,胚胎将在实验超声设置中保持该心率~5小时。
在前面描述的三种方法中可能发生多种并发症。 图7A 显示了CAM下的滞留空气,这使得胚胎不适合超声成像,气泡的压力也会损坏胚胎和/或CAM。当将蛋内容物从壳中取出时,当蛋壳内的气囊不与壳外的空气接触时,就会出现此问题。 图7B 显示了图像右上角蛋黄袋中的少量蛋黄泄漏。当蛋黄袋被蛋壳的锋利边缘损坏或蛋黄袋被镊子穿透时,可能会发生这种情况。卵黄的泄漏会影响胚胎和CAM血管的可见性。 图7C 显示了一个胚胎,其中气泡被困在CAM下。这有时会发生在胚胎发育中。可能发生的另一个并发症是血管损坏。当将鸡蛋内容物从壳中取出或进行注射时,可能会产生这种损害(图7D)。除此之外,胚胎和血管也会随着时间的推移而变干(图7E)。当鸡蛋内容物没有洒上PBS时,就会发生这种情况。胚胎干燥会导致大量毛细血管阻塞(图7F),从而影响胚胎的活力。巨大的毛细血管阻塞也可能发生在发育过程中或胚胎的心跳不稳定时。
在将卵子内容物从壳中取出而没有任何并发症后,可以向胚胎注射例如微泡等超声造影剂(图3C)。图8显示了注射时血管腔中的循环微气泡。这些微气泡随着血流携带,并在血液循环中停留数小时(补充视频1)。循环中这些微气泡的存在创造了进行不同类型的CEUS和药物输送实验的可能性7,11,12。CAM是研究新型超声对比检测方法的理想选择,我们展示了三个示例。图9A显示了微泡注射前后B模式和CEUS下6日龄鸡胚的高频超声次谐波成像。在这里,向CAM血管注射5μL超声造影剂,并使用带有MS250探针(30 MHz发射和15 MHz接收频率,10%功率)的临床前动物超声机进行成像。在微泡注射之前,在B模式图像中已经可以看到胚胎心脏内的对比(图9A-I)。这种现象是由于禽红细胞中存在细胞核,这增加了超声成像中血液的对比度5,31。微气泡的添加增加了胚胎在B模式和CEUS成像中的对比度和可见性。图9B显示了6天大的胚胎和周围血管的光学和高频3D次谐波图像。向CAM注射5 μL超声造影剂,并使用带有MS550s探针的临床前动物超声机(传输频率为40 MHz,峰值负压~300 kPa)进行成像。这些结果表明,CEUS成像与造影剂相结合也可用于创建高频3D次谐波图像和胚胎外血管成像。图9C显示了使用6天大胚胎的CAM微血管定制探针(26 MHz发射频率和39和65 MHz接收频率)制作的光学图像和超谐波血管内超声(IVUS)图像。将CAM血管注射4±1μL超声造影剂。光学图像和IVUS图像来自相同的胚胎和相同的感兴趣区域,显示了相应的血管网络。
鸡胚和CAM血管也可用于研究超声介导的药物递送,我们展示了一个例子。由于卵黄在成像过程中会阻塞光路,因此需要去除蛋黄袋以光学研究胚胎和CAM血管中的药物递送。在本研究中,通过将含有胚胎和CAM的膜从卵黄袋中分离出来,如第2.2节所述,准备胚胎和CAM进行显微镜成像(图4C)。在这些胚胎中,心率稳定在80 bpm左右,当保持在37°C时,胚胎可存活长达2小时7。图10显示了CAM血管内皮细胞中的超声和微泡介导的药物递送研究。将脂质包被的微气泡注射到CAM血管中,使用αvβ 3抗体靶向血管壁并用荧光染料DiI7染色(图10A,C)。用Hoechst 33342(图10B)对CAM血管内皮细胞核进行染色,并使用模型药物碘化丙啶(PI)来可视化超声7。这两种染料与微泡同时注入。超声处理(1 MHz,200 kPa峰值负压,1000 次循环的单次爆发)后,在最接近目标微泡的细胞核中观察到 PI 摄取(图 10D)。这表明靶向微泡的超声诱导振荡能够在内皮细胞膜上产生孔。
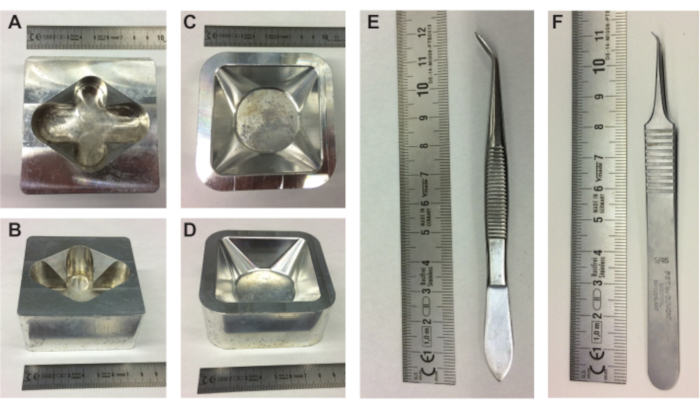
图 1.胚胎制备设备。(A-B) 金属蛋架的顶视图和侧视图以及金属称重船架的 (C-D) 顶视图和侧视图。 (E-F) 镊子需要将鸡蛋内容物从壳中取出。 请点击此处查看此图的大图。
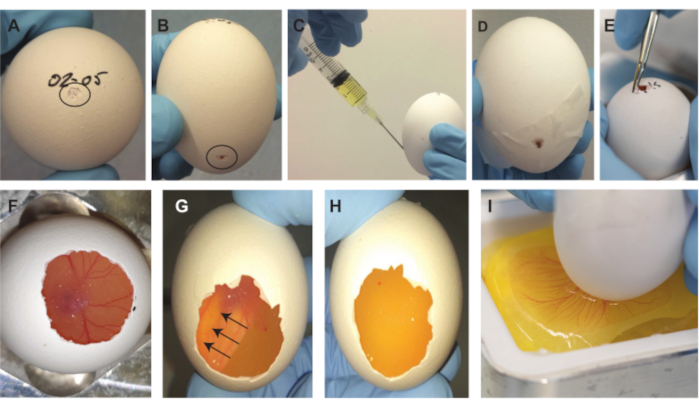
图 2.胚胎取出程序。(A) 鸡蛋顶部的小凹痕,由黑色圆圈表示。 (B) 在鸡蛋下方2/3处有小缩进,由黑色圆圈表示。 (C) 取出~2毫升蛋清。 (D) 用胶带密封侧面的间隙。 (E) 扩大鸡蛋顶部的小开口。 (F) 去除部分外壳后,胚胎变得可见。 (G-H) 将卵子旋转180°后,胚胎漂浮起来,变得不可见(箭头表示胚胎的移动方向)。1-2分钟后,胚胎从底部看不见。 (I) 刮擦膜后,蛋内容物滴入称量舟中。请点击此处查看此图的大图。
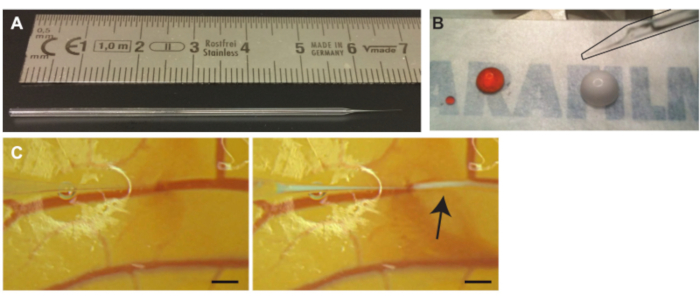
图 3.将微气泡注入CAM容器中。(一) 玻璃毛细管针。(B)注射前抽吸前的碘化丙啶(PI)溶液(左滴)和微气泡(右滴 ) 以厘米为单位。针头(黑色轮廓)可以在右上角 (C) 微泡注射中看到。毛细管针尖位于其中一条静脉的管腔内(左)。微气泡,即用箭头表示的白云,被注入并随着血流扩散(右)。比例尺代表 1 毫米。请点击此处查看此图的大图。
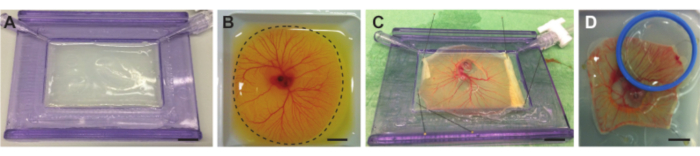
图 4.从卵黄袋中取出胚胎和CAM,并放在带有隔音膜的支架上。(A) 带有充满琼脂糖层的声膜的支架。 (B) 鸡胚和CAM容器在切割前在称重舟中。虚线表示CAM周围的切割线。 (C) 鸡胚和CAM从蛋黄中分离并固定在声学膜上。(D)将鸡胚固定在放置在CAM顶部的支架 (蓝色) 中,具有声学和光学透明膜。支架可以装满半水,因此可以使用浸水物镜。所有比例尺代表 1 厘米。请点击此处查看此图的大图。

图 5.鸡胚和CAM超声成像的不同设置。(A) 从侧面进行超声成像的设置。将鸡胚置于具有一个声学透明壁的定制调整称重舟中,并置于37°C水浴中。超声换能器位于声学透明壁旁边的左侧(a),用于光声成像的激光(b)位于顶部。 (B) 从顶部进行超声成像的设置。将胚胎和CAM浸没在置于37°C水浴中的PBS烧杯中。虚线轮廓显示 2 L 玻璃烧杯 (a) 和内部 500 mL 玻璃烧杯 (b)。 (C) 使用可移动换能器从顶部进行超声成像的设置。将薄琼脂糖垫(虚线)放置在胚胎顶部,薄薄的PBS层作为换能器和琼脂糖表面之间的耦合。请点击此处查看此图的大图。
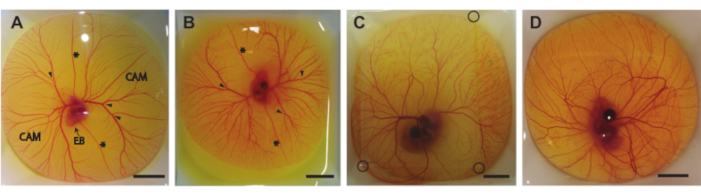
图 6.蛋壳外的鸡蛋含量。(A) 孵化5天后取出的蛋内容物。提示脉络膜尿囊膜 (CAM)、胚胎体 (EB)、前静脉和后卵黄静脉 (*) 以及适当的注射部位(箭头)。 (B) 孵化6天后取出的蛋内容物。指示前静脉和后卵黄静脉(*)和适当的注射部位(箭头)。 (C) 孵化7天后从壳中取出的蛋内容物。将琼脂糖贴在顶部以允许超声成像。琼脂糖斑块的角用黑色圆圈表示。 (D) 孵化8天后从壳中取出的蛋内容物。所有比例尺代表 1 厘米。请点击此处查看此图的大图。
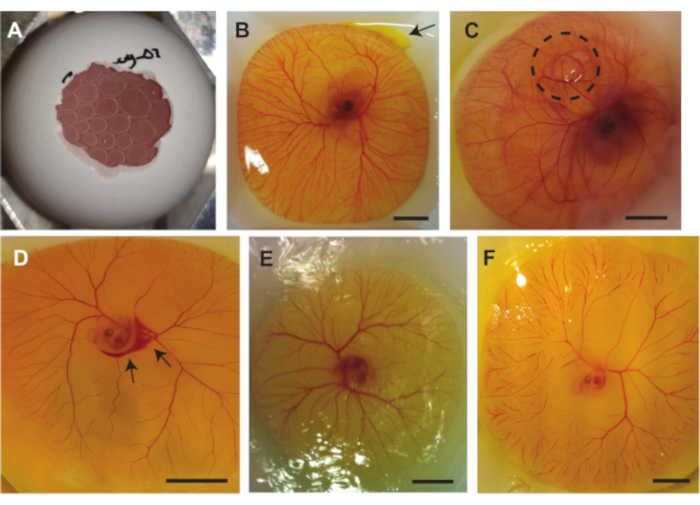
图 7.鸡胚和CAM模型在手术过程中可能发生的并发症。(A )使用方法1.2(5天大的胚胎)或1.3(6至7天大的胚胎)将蛋内容物从壳中取出时,CAM下捕获的气泡。( B) 蛋黄的小泄漏,右上方用箭头表示(6天大的胚胎)。 (C )被困在CAM下的空气,由黑色虚线圆圈(7天大的胚胎)表示。( D) 出血,用黑色箭头表示(5天大的胚胎。 (E) 干燥的胚胎和CAM(5天大的胚胎)。( F) 巨大的毛细血管阻塞(5天大的胚胎)。所有比例尺代表 1 厘米。请点击此处查看此图的大图。
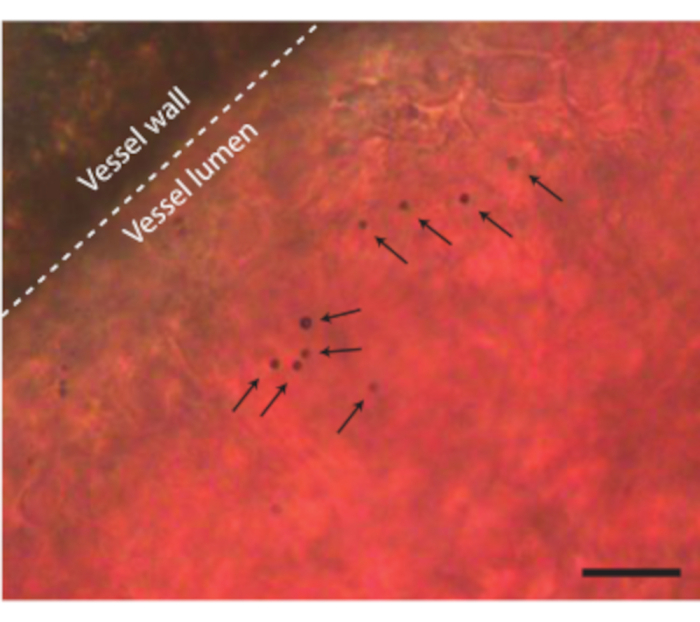
图 8.CAM血管中的微气泡。 容器壁用虚线表示,单个微气泡用箭头表示。比例尺代表 20 μm。相应的显微镜记录可以在补充视频1中找到。请点击此处查看此图的大图。
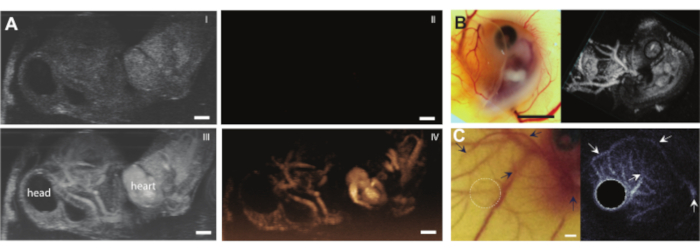
图9.鸡胚胎和CAM血管中的对比增强超声成像。(A)B型(I,III)和实时次谐波(II,IV)图像(带有MS250探针的临床前动物超声机,30 MHz发射和15 MHz接收频率,10%功率)的最大强度投影6天大的胚胎,顶部有一片琼脂糖。顶部图像(I,II)显示了注射5μL超声造影剂之前和底部(III,IV)的结果。比例尺代表 1 毫米。此图像已获得Daeichin等人的许可进行了修改,201511(B)光学(左)和3D次谐波成像(右)的6天大的鸡胚胎,顶部有一块琼脂糖。向CAM血管注射5μL超声造影剂,并用高频探针进行成像(带MS550s探针的临床前动物超声机,传输频率为40 MHz,峰值负压~300 kPa,在临床前动物超声机3-D模式下呈现)。比例尺代表 5 毫米。本图像经Daeichin et al. 201511许可修改。(C) 6 天龄胚胎 CAM 微脉管系统的光学图像(左)和超谐波血管内超声 (IVUS)(右)的平均强度投影。向CAM血管注射4±1μL造影剂。使用定制的IVUS探头(传输频率35 MHz,峰值负压600 kPa)进行超谐波IVUS成像。两幅图像均由相同的胚胎和感兴趣区域制成。箭头表示两个图像中的相应船只。比例尺代表 1 毫米。本图像经Maresca等人许可修改,201412。请点击此处查看此图的大图。
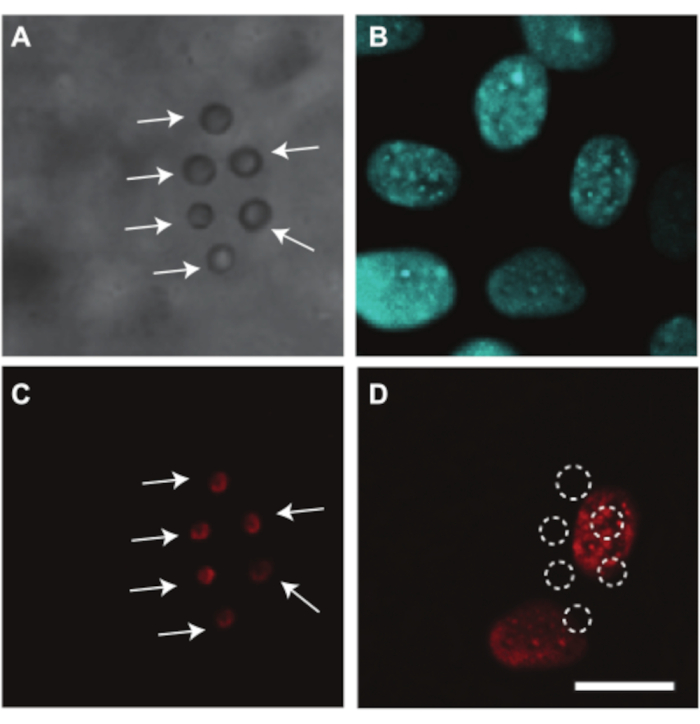
图 10.药物递送到 6 天龄胚胎中的 CAM 血管内皮细胞。 (A) 超声治疗前粘附在血管壁上的六个α v β3 靶向微气泡的明场图像,用白色箭头表示。(B)超声治疗前荧光染色的内皮细胞核。(C)超声处理前染色的目标微泡的荧光图像,用白色箭头表示。(D)超声处理后将模型药物碘化丙啶(PI)摄取到靶向微泡下方的细胞核中(1 MHz,200 kPa峰值负压,单次爆发1000次循环)。比例尺代表 10 μm,适用于所有图像。此图像经 Skachkov 等人许可修改,20147.请点击此处查看此图的大图。
补充文件
补充视频 1. CAM血管中的微气泡。 比例尺代表 20 μm。 请点击此处下载此视频。
讨论
该协议描述了有关如何获得和使用5至8天大的鸡胚胎及其CAM作为 体内模型的三种方法,以研究造影剂增强超声成像和微泡介导的药物递送。将5天大的胚胎(第1.2节)和6至7天大的胚胎(第1.3节)取出蛋的最关键步骤是:1)在取出蛋清之前,在鸡蛋顶部打一个小孔,穿过整个蛋壳进入气囊;2)为外壳中的大开口创建光滑的边缘。对于将8天大的胚胎从壳中取出的方法(第1.4节),最关键的步骤是:1)制作足够数量的压痕以沿着鸡蛋产生漂亮的裂缝;2)将鸡蛋浸没在PBS中。为了确保所有方法的胚胎活力,重要的是将卵子及其内容物保持在37°C。 此外,避免注射到CAM动脉。建议在研究期间目视监测胚胎的心率,以确保胚胎活力。为了确认胚胎的确切发育阶段,可以使用Hamburger&Hamilton22的指示。
重要的是要防止损坏胚胎、CAM 和卵黄袋。这种损伤会影响胚胎和CAM的活力,血流和可见性。此外,对卵黄袋的损坏以及因此膜的低刚性使得无法注射到CAM容器中。一个5天大的胚胎有一个相对较小的气囊,因此为了能够在壳上开一个足够大的孔,通过这个孔可以去除卵子内容物,需要取出2毫升的蛋清。结果,蛋壳和胚胎之间创造了更多的空间。取出蛋清后,需要用胶带封闭针头进入的孔。如果蛋清仍然泄漏,请再贴一块胶带。除此之外,在侧面的孔上涂上胶带会在鸡蛋内部产生真空,当在步骤1.2.2.8中创建大孔时,可以防止鸡蛋内容物因其自身重量而脱落。当蛋壳的边缘太锋利或鸡蛋内容物落入称重舟太严格时,也会发生胚胎或 CAM 损坏,因此蛋壳应保持非常靠近称重船。在发育的第5天和第6天之间,CAM开始附着在壳膜32上。当将鸡蛋内容物从蛋壳中取出时,这种附着会增加损坏胚胎和 CAM 的风险。通过在将PBS注射到鸡蛋中以用于6至7天的孵化蛋或按照8天孵化蛋的描述在PBS填充的容器中打开鸡蛋,可以降低损坏的风险。关于注射到CAM静脉:如果第一次注射失败,如果损伤轻微或另一个CAM静脉,可以在同一静脉的上游进行第二次注射。胚胎和CAM与蛋黄分离使胚胎和CAM血管光学透明。结果,胚胎失去了营养的主要来源33。这种营养损失可能是观察到的心率降低80 bpm的原因,而6天大的胚胎仍与蛋黄30接触的6天大胚胎的~190,以及在此分离程序后2小时的存活时间减少。另一个可以在降低心率和存活时间方面发挥作用的因素是将蛋黄分离的胚胎和CAM血管保持在37°C的挑战。 显微镜载物台培养箱可能会有所帮助。除此之外,CAM与蛋黄的分离可能会导致组织的机械变化,因为膜张力变小。较低的膜张力可能导致血管内剪切速率增加,从而导致心率降低。
卵外鸡胚和CAM血管与体内模型一样具有一些局限性,包括仅短时间观察,用于对比增强超声成像和微泡介导的药物递送研究。由于第 5 天血容量小,第 5 天为 100±23 μL,第 634 天血容量为 171±23 μL,因此可以注射的最大血容量为 ~5 μL。在发育的后期阶段(第7天及以上),血管刚度增加,蛋黄弹性降低。这可能会使老年胚胎的成功注射复杂化。一旦注射微泡,它们就会循环数小时,因为鸡胚在这个阶段没有完全发育的免疫系统35。因此,微泡不能像人类36,37那样在~6分钟内清除,使得典型的超声分子成像研究需要5-10分钟的等待期才能清除非结合靶向微泡38不可行。为了靶向微气泡,需要使用能够与禽内皮细胞结合的合适配体,如前面描述的血管生成标志物αvβ 37。该模型需要考虑的其他方面是,与人类相比,在较老的胚胎(>8天)中将胚胎和CAM血管与卵黄分离的难度增加,以及血细胞比额降低~20%39。后者可能影响微气泡振荡,因为已知微气泡振荡在更粘稠的环境中被阻尼40。CAM 动脉的氧合量低于CAM 静脉 41,42。例如,在研究血液氧合的光声成像时,应考虑到这种差异。
这里描述的方法允许在超声成像或药物递送研究当天(通常在孵化的第5至8天)将蛋内容物从蛋壳中取出。这与现有方法不同,在现有方法中,鸡蛋内容物在孵育3天后从壳中取出并进一步发展为卵外培养物18,20,21。优点是5天孵化卵的存活率为90%,6天存活率为75%,7天存活率为50%,8天龄孵化种蛋存活率为60%,而从蛋壳中取出并进一步孵育的3天龄胚胎存活率为~50% 1,18 在培养过程中避免使用抗生素18,20和大型无菌培养箱用于Ex 卵子培养。6至8天大的胚胎的存活率较低,因为CAM开始附着在壳21上,这使得CAM膜在提取时更容易破裂。还描述了胚胎与CAM形式的蛋黄分离,使胚胎和CAM光学透明。
通过将鸡蛋内容物置于不同的设置中,鸡胚和CAM可用于多种超声成像研究,如IVUS,光声,不使用或与2D和3D超声造影剂一起使用。重点可以是开发新的超声脉冲方案或测试新型换能器。除此之外,该模型还可用于研究新型超声造影剂及其在流动下血管中的行为。由于微气泡介导的药物递送的机制仍然未知43,因此使用体内CAM模型可能有助于通过研究与细胞反应相关的微泡行为来阐明其机制。最后,CAM血管已被证明是研究异种移植肿瘤移植的合适系统44。这就有可能使用CAM血管作为模型,使用超声波研究肿瘤成像,并使用CEUS研究肿瘤内的血流。肿瘤通常移植在8或9天大的胚胎1,14,45的CAM血管上,在孵育的第3天将胚胎从蛋壳中取出并在卵外进一步发育。该协议中描述的方法可用于在卵中培养胚胎,直到肿瘤移植的那一天。
作者相信,本文将对希望使用鸡胚胎及其脉络膜尿囊膜(CAM)作为造影剂和流动研究应用的 体内模型的研究人员有所帮助。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NWO的一部分应用和工程科学(TTW)(Vidi项目17543)的支持。作者要感谢生物医学工程系的Robert Beurskens,Luxi Wei和Reza Pakdaman Zangabad以及实验医学仪器系的Michiel Manten和Geert Springeling的技术援助,他们都来自荷兰鹿特丹伊拉斯谟MC大学医学中心。
材料
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
参考文献
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。