Method Article
A preparação de embriões de frango ex ovo e vasos de membrana corioalantóica como modelo in vivo para imagens de ultrassom com contraste e estudos de liberação de drogas mediados por microbolhas
Neste Artigo
Resumo
Este protocolo descreve três métodos sobre como obter e usar embriões de frango de 5 a 8 dias de idade e sua membrana corioalantóica (CAM) como um modelo in vivo para estudar imagens de ultrassom com contraste e entrega de drogas mediadas por microbolhas.
Resumo
O embrião de galinha e a membrana corioalantóica rica em vasos sanguíneos (CAM) são um valioso modelo in vivo para investigar processos biomédicos, novos esquemas de pulsação por ultrassom ou novos transdutores para imagens de ultrassom com contraste e entrega de medicamentos mediados por microbolhas. As razões para isso são a acessibilidade da rede de embriões e vasos do CAM, bem como os baixos custos do modelo. Um passo importante para obter acesso ao embrião e aos vasos CAM é tirar o conteúdo do ovo da casca do ovo. Neste protocolo, são descritos três métodos para retirar o conteúdo da casca do ovo entre os dias 5 e 8 de incubação, permitindo assim que os embriões se desenvolvam dentro da casca do ovo até estes dias. Os métodos descritos requerem apenas ferramentas e equipamentos simples e produzem uma maior taxa de sucesso de sobrevivência de 90% para 5 dias, 75% para 6 dias, 50% para 7 dias e 60% para ovos incubados de 8 dias de idade em comparação com embriões ex-ovocultivados (~ 50%). O protocolo também descreve como injetar núcleos de cavitação, como microbolhas, no sistema vascular CAM, como separar a membrana contendo o embrião e o CAM do resto do conteúdo de ovos para estudos opticamente transparentes e como usar o embrião de galinha e o CAM em uma variedade de experimentos de ultrassom de curto prazo. O modelo in vivo de embrião de galinha e CAM é extremamente relevante para investigar novos protocolos de imagem, agentes de contraste ultrassonográficos e esquemas pulsantes de ultrassom para imagens de ultrassom com contraste e para desvendar os mecanismos de entrega de medicamentos mediados por ultrassom.
Introdução
Os embriões de galinha Ex ovo e a membrana corioalantóica (CAM) rica em vasos sanguíneos têm se mostrado um modelo adequado para investigar diversos processos biológicos e biomédicos, como embriogênese, oncologia e liberação de fármacos 1,2,3,4. A ultrassonografia tem sido utilizada para imagens do desenvolvimento cardíaco embrionário 4,5 e para ativação de núcleos de cavitação após injeção, como microbolhas, para liberação de fármacos vasculares 6,7. Os embriões de galinha são baratos, requerem menos infraestrutura e equipamentos e têm legislação menos rigorosa em comparação com outros modelos animais8. O embrião de galinha e os vasos CAM são facilmente acessíveis após a abertura do ovo, enquanto isso se mostra muito mais difícil com embriões e vasos de mamíferos. Além disso, o embrião de galinha e os vasos CAM fornecem um batimento cardíaco e um fluxo sanguíneo pulsante. A MAC apresenta semelhanças na anatomia dos vasos com mamíferos e pode ser utilizada para triagemmedicamentosa 8,9,10. Devido a essas características, os vasos CAM também têm se mostrado um modelo adequado para investigar a ultrassonografia com contraste (USCE)11,12,13,14,15,16. Além disso, o modelo pode ser utilizado para investigar opticamente o comportamento de agentes de contraste ultrassonográficos em um campo ultrassonográfico utilizando uma câmera de ultra-alta velocidade e o efeito da força de radiação acústica na propulsão, ligação e extravasamento de fármacos 7,17,18,19. Embora o embrião de galinha e o CAM sejam menos adequados para experimentos de longo prazo, eles podem ser benéficos para experimentos in vivo de curto prazo.
Para aumentar a visibilidade e a controlabilidade sobre o embrião de galinha e a MAC durante os experimentos, é importante retirar o teor de ovos contendo o embrião e a MAC da casca do ovo18. Estudos prévios de embriões de galinha envolvendo agentes de contraste ultrassonográficos utilizaram embriões de 5 a 6 dias de idade7,11,12,17,19 e embriões de 14 a 18 dias de idade13,14,15,16. Múltiplas abordagens têm sido descritas em detalhes para tirar o teor de ovos da casca 18,20,21. No entanto, até onde sabemos, as abordagens publicadas anteriormente se concentram em tirar o teor de ovos da casca do ovo após 3 dias de incubação (ou seja, Hamburger & Hamilton (HH) estágio 19-2022) e continuar a cultura ex ovo. Essa abordagem da cultura ex ovo apresenta múltiplas desvantagens, incluindo aumento do risco de fatalidades durante a cultura (~50%)1,18, uso deantibióticos18,20 e diminuição do comprimento total dos vasos em comparação com o crescimento do ovo 23. Como a cultura do embrião dentro da casca do ovo está fornecendo o ambiente mais natural, é mais fácil incubar o embrião dentro da casca do ovo até o dia do experimento. Por esta razão, uma abordagem em que o teor de ovos é retirado da casca do ovo em 5 a 8 dias de incubação seria benéfica especialmente para experimentos em embriões de 5 a 8 dias de idade.
Neste protocolo, descrevemos três métodos para retirar o teor de ovos da casca do ovo quando o embrião está no dia 5 a 8 de desenvolvimento (HH 26-3522), permitindo que o embrião se desenvolva dentro da casca do ovo até o dia do experimento. O tamanho do vaso CAM varia de 10-15 μm de diâmetro, nos capilares menores de um embrião de 8 dias de idade 24, a 115-136 μm de diâmetro no vaso maior de embriões de 6 e 8 dias de idade24,25. Os três métodos descritos requerem apenas ferramentas básicas de laboratório e reduzem o risco de complicações antes do início do experimento, reduzindo assim custos e mão-de-obra desnecessários. Também detalhamos um método para separar a membrana contendo o embrião e a CAM do saco vitelino tornando a CAM opticamente transparente para estudos de microscopia. Como a membrana que contém o embrião e a CAM pode ser presa, por exemplo, em um suporte com uma membrana acústica, a configuração também pode ser feita acusticamente transparente26, permitindo a combinação de exames de microscopia e ultrassom quando o caminho da luz será afetado pela gema. Finalmente, descrevemos várias outras configurações de ultrassom que podem ser usadas para ultrassom ou imagem CEUS.
Protocolo
Todas as experiências com animais foram conduzidas em conformidade com a Lei Neerlandesa relativa às experiências com animais e em conformidade com o Conselho Europeu (2010/63/UE) sobre a proteção da utilização de animais para fins científicos.
1 . Protocolo de preparação de embriões
- Incubação dos ovos de galinha fertilizados
- Conservar os ovos de galinha acabados de fertilizar a 15 °C durante um período máximo de uma semana.
- Para incubar os ovos fertilizados, coloque-os verticalmente com o lado pontiagudo para baixo em uma incubadora umidificada a 37 °C. Girar os ovos durante a incubação não é necessário.
NOTA: Escreva a data de início da incubação da parte superior do ovo usando um marcador permanente.
- Preparação de embriões de 5 dias (120 h) de idade (estágio HH 26-28)22
- Elaboração da área de trabalho
- Aqueça uma placa de aquecimento a 37 °C.
- Coloque um suporte de ovos de metal (Figura 1A,B), um suporte de barco de pesagem de metal (Figura 1C,D) e um Erlenmeyer de 10 mL preenchido com PBS na placa de aquecimento.
- Encha um barco de pesagem (85 mm × 85 mm × 25 mm) com uma camada de 10 mm de gel de ultrassom e coloque o barco de pesagem de enchimento no suporte do barco de pesagem de metal pré-aquecido.
NOTA: Encher o barco de pesagem com gel de ultrassom irá elevar o embrião e CAM. Isso pode ser benéfico para a injeção ou imagem do embrião e CAM, mas não é necessário para tirar o embrião e CAM da casca do ovo. - Prepare alguns pedaços de fita adesiva (cerca de 3 cm de comprimento) com parte de uma extremidade dobrada para trás sobre si mesma para que não grude mais.
- Retirar o teor de ovos da casca do ovo
- Pegue um óvulo fertilizado incubado de 5 dias de idade e transfira-o para o suporte de ovos de metal pré-aquecido (Figura 1A,B). Certifique-se de manter o ovo na mesma orientação (ou seja, data no topo).
NOTA: É importante manter o óvulo na mesma orientação para manter o saco de ar e o embrião e CAM na mesma posição no topo do óvulo. - Use as costas pontiagudas de uma pinça (ou similar; Figura 1E) para fazer um pequeno recuo na parte superior do ovo (onde a data está escrita) (Figura 2A).
- Use a parte de trás pontiaguda da pinça para fazer um segundo recuo na lateral do ovo em torno de 2/3 abaixo do ovo (Figura 2B).
NOTA: Tenha cuidado para não fazer o recuo muito grande e criar um furo. Se por acidente um buraco for criado, sele o buraco com fita adesiva e não faça outro recuo. - Usando a pinça maior (Figura 1E), retire um pequeno pedaço de casca de ovo da área recuada em cima do ovo (com data escrita). Certifique-se de que o saco de ar no topo da casca do ovo faça contato com o ar fora do ovo, mas não penetre na casca muito profundamente.
NOTA: Se a concha for penetrada muito profundamente ao fazer o recuo superior, o embrião e a CAM podem ser danificados e o embrião não sobreviverá à remoção da casca. É importante que o pequeno orifício na parte superior crie contato com o ar entre o interior e o exterior do ovo. Se isso não for feito, um vácuo será criado nas próximas etapas do procedimento, o que resultará em grandes bolhas de ar presas sob o CAM, tornando o embrião e o CAM inúteis. Para verificar a posição do saco de ar dentro do ovo, uma fonte de luz pode ser usada, uma vez que sua posição nem sempre é exatamente no topo e também pode ser mais para o lado. - Use uma seringa de 5 mL e uma agulha de 19 G para penetrar na casca através do segundo recuo no lado 2/3 abaixo do ovo e retirar ~2 mL de clara de ovo (Figura 2C).
NOTA: Certifique-se de que a agulha está apontando para o fundo do ovo para evitar a chance de danificar o embrião e o CAM. Esta etapa cria uma bolsa de ar maior na parte superior do ovo necessária para a remoção do conteúdo do ovo. Se um orifício for criado acidentalmente em vez de um travessão na etapa 1.2.2.3, perfure a fita com a agulha para a retirada da clara de ovo. Feche novamente a punção com outro pedaço de fita adesiva. - Retire a agulha e use fita adesiva para selar o espaço lateral (Figura 2D).
NOTA: Para evitar que a clara do ovo vaze para fora do ovo, o orifício superior pode ser fechado usando um dedo antes de tirar a agulha. Se a clara de ovo continuar vazando com a fita já no lugar, primeiro remova a clara de ovo com um pedaço de tecido para garantir que a fita grude corretamente. - Esvazie a seringa adicionando a clara de ovo ao barco de pesagem.
- Use a pinça grande (Figura 1E) para ampliar a pequena abertura na parte superior do ovo (Figura 2E). Ao olhar dentro do ovo através da abertura no topo, o embrião e a CAM são visíveis. Continue localizando o embrião e a MAC enquanto retira o máximo possível da casca do ovo (Figura 2F).
NOTA: Continue movendo o ovo para manter a máxima visibilidade sobre a posição do embrião e CAM dentro da casca. Certifique-se de que a borda da abertura no shell não fique mais baixa que o CAM. Além disso, não penetre na membrana interna e evite bordas afiadas. - Depois de criar a abertura, gire o ovo 180 ° e coloque o ovo de volta no suporte do ovo de tal forma que a abertura criada na parte superior do ovo esteja agora voltada para o fundo. O embrião flutuará para cima e se tornará invisível do fundo (Figura 2G), o que leva de 1 a 2 minutos. Certifique-se de que todo o embrião e CAM (incluindo todos os vasos) desapareceram e apenas a gema é visível antes de prosseguir para a próxima etapa (Figura 2H).
NOTA: Se o embrião ainda estiver visível do fundo após 2 min, gire o ovo no sentido horário por 1-2 min. Isso ajudará o embrião e a CAM a flutuar. - Remova a fita da abertura lateral. Veja se o interior do ovo agora se projeta para fora da abertura inferior. Se este for o caso, prossiga para a próxima etapa. Caso contrário, use a agulha na seringa para perfurar a abertura do lado mais uma vez para liberar o vácuo no ovo. Certifique-se de apontar para cima com a agulha para evitar a chance de perfurar o saco de gema. Continue até que o ovo se projete para fora da abertura inferior.
- Ao segurar o fundo do ovo perto do barco de pesagem no suporte do barco de pesagem de metal (Figura 1C,D), faça um arranhão horizontal suave mas rápido na membrana em toda a largura da abertura usando um dos pontos afiados da pequena pinça (Figura 1F) e solte suavemente o teor de ovos no barco de pesagem (Figura 2I).
NOTA: Se o teor de ovo não sair, use a agulha na seringa para perfurar a abertura lateral novamente com a agulha apontada para cima. - Se o embrião estiver no barco de pesagem lateralmente, ele geralmente subirá sozinho. Se isso não acontecer, use um pedaço de papel de seda para reposicionar o embrião. Coloque um lado do papel de seda no embrião, arraste o papel de seda para a outra extremidade e solte o papel de seda com algumas gotas de ~30 μL de PBS (37 °C) usando um pipete Pasteur de plástico.
- Verifique visualmente se o embrião está vivo, garantindo que os batimentos cardíacos ainda estejam presentes, os vasos CAM estejam intactos e não haja sangramento e não haja vazamento de gema. Se uma dessas coisas não estiver correta, descarte o embrião e a MAC porque não será viável.
- Certifique-se de que o embrião e a CAM são mantidos a 37 °C e não secam, pois isso fará com que os vasos CAM se deteriorem e, eventualmente, o embrião morra. Para evitar isso, coloque regularmente pequenas gotas de ~30 μL de 37 °C PBS no embrião e CAM.
- Pegue um óvulo fertilizado incubado de 5 dias de idade e transfira-o para o suporte de ovos de metal pré-aquecido (Figura 1A,B). Certifique-se de manter o ovo na mesma orientação (ou seja, data no topo).
- Elaboração da área de trabalho
- Preparação de embriões velhos de 6 a 7 dias (144-168 h) (estádio HH 28-32)22
- Elaboração da área de trabalho
- Preparar a fase conforme descrito no ponto 1.2.1.
- Retirar o teor de ovos da casca do ovo
- Duas horas antes do experimento, pegue um ovo incubado de 6 a 7 dias de idade e gire o ovo 180 ° dentro da incubadora para que a parte superior do ovo esteja voltada para o fundo. Após 1 h, gire o ovo de volta à sua posição original e deixe por mais 1 h.
NOTA: Girar o ovo 2 h antes do experimento facilitará a retirada do conteúdo do ovo da casca. - Depois de girar, retire o ovo da incubadora.
- Execute a etapa 1.2.2.2 até a etapa 1.2.2.4.
- Use uma seringa de 5 mL e uma agulha de 19 G para penetrar na casca através do segundo recuo no lado 2/3 abaixo do ovo e retirar entre 5-6 mL de clara de ovo. Certifique-se de que a agulha está apontando para o fundo do ovo.
NOTA: Com a seringa de 5 mL que usamos, é possível retirar até 6 mL para que apenas uma penetração seja necessária. - Retire a agulha e use um pedaço de fita adesiva para selar o espaço lateral (Figura 2D).
- Esvazie a seringa adicionando a clara de ovo ao gel de ultrassom no barco de pesagem.
- Use a pinça grande (Figura 1E) para ampliar a pequena abertura na parte superior do ovo (Figura 2E). Tente tornar a abertura o maior possível, mas certifique-se de que a borda da abertura na concha não fique mais baixa do que a CAM. Além disso, não penetre na membrana interna e tente evitar bordas afiadas.
- Encher uma seringa com ~1 ml a mais de 37 °C PBS do que o volume retirado durante o passo 1.3.2.4.
- Retire a fita do espaço lateral, penetre no espaço com a seringa cheia e esvazie-o na concha. Certifique-se de que a agulha está apontando para o fundo do ovo.
NOTA: Como a clara de ovo tem uma viscosidade mais alta (~160 cP)27 do que a PBS (~1 cP), a substituição da clara de ovo por PBS reduz a tensão e o estresse no embrião e na MAC, ao mesmo tempo em que retira o conteúdo de ovos da casca. - Retire a agulha e volte a selar rapidamente o espaço com um pedaço de fita adesiva (Figura 2D).
- Gire o ovo 180 ° e coloque-o de volta no suporte do ovo de tal forma que a abertura criada na parte superior do ovo esteja agora voltada para o fundo. Gire o ovo no sentido horário até que todo o embrião e CAM (incluindo todos os vasos) tenham desaparecido e apenas a gema seja visível.
- Execute a etapa 1.2.2.10 até a etapa 1.2.2.14.
- Duas horas antes do experimento, pegue um ovo incubado de 6 a 7 dias de idade e gire o ovo 180 ° dentro da incubadora para que a parte superior do ovo esteja voltada para o fundo. Após 1 h, gire o ovo de volta à sua posição original e deixe por mais 1 h.
- Elaboração da área de trabalho
- Preparação de embriões de 8 dias (192 h) de idade (estádio 32-35)22
- Elaboração da área de trabalho
- Aqueça uma placa de aquecimento a 37 °C.
- Coloque um suporte de pesagem de metal (Figura 1C,D) e um Erlenmeyer de 10 mL preenchido com PBS na placa de aquecimento.
- Pegue um recipiente raso de 170 x 110 x 70 mm, ou similar, e encha o recipiente com 1 L de PBS de 37 °C.
- Coloque um barco de pesagem (85 × 85 × 25 mm) em uma placa de Petri de 90 mm de diâmetro. Coloque a placa de Petri e o barco de pesagem no fundo do recipiente e certifique-se de que estão completamente submersos.
- Retirar o teor de ovos da casca do ovo
- Duas horas antes do experimento, pegue um ovo incubado de 8 dias de idade e gire o ovo 180 ° dentro da incubadora para que a parte superior do ovo esteja voltada para o fundo. Após 1 h, gire o ovo de volta à sua posição original e deixe por mais 1 h.
NOTA: Girar o ovo 2 h antes do experimento facilitará a retirada do conteúdo do ovo da casca. - Pegue um ovo incubado de 8 dias de idade da incubadora.
- Segure o ovo horizontalmente e use a parte de trás pontiaguda da pinça grande (Figura 1E) para fazer um pequeno recuo 1/2 para baixo do ovo. Continue fazendo pequenos recuos em um padrão de anel de 360° ao redor da casca do ovo. Use um espaçamento de ~10 mm entre os recuos.
Observação : durante este procedimento, pequenas rachaduras podem começar a se formar entre os recuos. - Depois de criar os pequenos recuos ao redor da concha, faça um buraco maior quebrando a casca entre dois pequenos recuos usando a parte traseira pontiaguda do grande tweezer.
- Submergir completamente o ovo no PBS de 37 °C e mantê-lo submerso durante 5 minutos. Após 5 minutos, mantenha o ovo perto do barco de pesagem dentro do recipiente. Coloque a parte superior de ambos os polegares no buraco grande e abra suavemente o ovo. O ovo vai rachar ao longo dos pequenos recuos.
- Quando a rachadura for formada ao redor da casca do ovo, tente gentilmente separar os dois pedaços de casca de ovo e continue movendo suavemente os dois pedaços para frente e para trás até que o conteúdo do ovo seja separado da casca. Em seguida, solte suavemente o teor de ovos no barco de pesagem.
NOTA: Ao mover os dois pedaços de casca de ovo para frente e para trás, mais PBS fluirá para a casca do ovo, o que ajudará a separar o conteúdo de ovos da casca. Às vezes, um pouco de clara de ovo vai grudar no interior da casca do ovo. Quando isso acontecer, use a pinça para separar a clara de ovo da casca. - Levante lentamente a placa de Petri contendo o barco de pesagem e o teor de ovos do PBS. Quando estiver fora do PBS, incline ligeiramente o barco de pesagem para remover o excesso de PBS.
- Coloque o barco de pesagem contendo o teor de ovos no suporte do barco de pesagem de metal e mova-se para a configuração experimental desejada.
- Duas horas antes do experimento, pegue um ovo incubado de 8 dias de idade e gire o ovo 180 ° dentro da incubadora para que a parte superior do ovo esteja voltada para o fundo. Após 1 h, gire o ovo de volta à sua posição original e deixe por mais 1 h.
- Elaboração da área de trabalho
2. Aplicações Selecionadas
- Injetar microbolhas e/ou outras soluções nos vasos CAM
- Preparando a configuração de injeção
- Puxe agulhas de vidro de tubos capilares de vidro usando uma microforja (Figura 3A) ou compre agulhas capilares de vidro puxadas.
- Caso a ponta da agulha capilar de vidro não esteja chanfrada, quebre uma pequena parte da ponta da agulha. Encha a agulha de vidro com óleo mineral e coloque-a em um sistema de micro-injeção. Certifique-se de que não há bolhas de ar no óleo mineral na agulha de vidro.
NOTA: O óleo mineral é adicionado de acordo com as instruções do fabricante do sistema de injeção que usamos. - Esvazie a agulha capilar de vidro puxado até onde o sistema de microinjeção o permitir e reabasteça parcialmente a agulha de vidro com ar.
NOTA: O pequeno pedaço de ar impedirá a mistura do óleo mineral e da solução a ser injetada. - Coloque 10 μL da solução desejada, neste protocolo de microbolhas, sobre um pedaço de filme ceroso (Figura 3B). Se for necessária mais do que uma solução, as soluções podem ser misturadas antes da pipetagem7.
NOTA: Antes de encher a agulha com microbolhas, deixe a gota de microbolha no filme ceroso por ~1 min para que as microbolhas flutuem até o topo da gota e se concentrem. Para o agente de contraste de ultrassom personalizado do tipo F28, essa etapa de concentração aumentará a concentração de microbolhas a ser injetada em ~30%. A concentração pós-injeção no sangue do embrião de galinha será entre 32 x 10 3 microbolhas/μL para embriões de 5 dias de idade e 19 x 103 microbolhas/μL para embriões de 6 dias de idade. - Encha a agulha de vidro com a microbolha e/ou outra solução, posicionando a ponta da agulha de vidro na gota da película cerosa. Ao aspirar microbolhas, certifique-se de posicionar a ponta da agulha na parte superior da gota líquida para aspirar a solução enriquecida com microbolhas.
NOTA: Antes de injetar microbolhas, levante a ponta da agulha de vidro até o seu ponto mais alto e aguarde ~2 min. Isso garantirá que as microbolhas se concentrem na ponta da agulha de vidro.
- Preparando a configuração de injeção
- Injeção nos vasos CAM
- Antes da injeção, olhe para o CAM sob um microscópio estéreo e selecione o melhor recipiente para injetar. Sempre injete em uma das veias do embrião. Estes são os vasos nos quais o fluxo sanguíneo se move em direção ao embrião. As veias são de cor mais clara do que as artérias devido ao sangue oxigenado29. Além disso, as veias estão sempre no topo da artéria, com duas exceções, a saber, as veias vitelinas anterior e posterior (ou seja, as veias menos ramificadas, indicadas com asteriscos na Figura 6A,B) que não possuem uma artéria em seu entorno.
NOTA: A injeção em um dos ramos limitará a obstrução do fluxo sanguíneo durante a injeção. Bons locais de injeções foram indicados com pontas de seta na Figura 6A,B. É crucial injetar na veia, uma vez que isso forçará a substância injetada a fluir em direção ao embrião. Além disso, a injeção na artéria resultará em um sangramento maciço ao remover a agulha de vidro que matará o embrião. - Posicione a agulha de vidro e o embrião de modo a que a ponta da agulha de vidro e a veia selecionada estejam no mesmo plano focal e na mesma linha de direção. Tente posicionar a agulha o mais horizontal possível paralela à veia selecionada. A ponta da agulha deve tocar a parede do vaso.
NOTA: Ao posicionar a agulha de vidro o mais horizontal possível, a chance de perfurar todo o vaso é menor. - Após o posicionamento, avance lentamente e penetre na parede do vaso com a agulha de vidro. Durante a penetração, o CAM será primeiro afastado pelo movimento da agulha de vidro. Continue avançando a agulha de vidro até que a parede do vaso seja penetrada.
NOTA: Se, por acidente, o recipiente for perfurado, retraia lentamente a agulha para voltar ao lúmen. Quando voltar para dentro do lúmen, levante ligeiramente a agulha e mova-se para a frente ao longo do vaso para reposicionar a agulha. - Após a penetração, retraia ligeiramente a agulha de vidro para posicionar melhor a ponta dentro do lúmen do vaso e mova a agulha de vidro para os lados para verificar se ela não está presa à parede do vaso. Injetar lentamente uma pequena quantidade da solução para confirmar que a ponta está posicionada dentro do lúmen do vaso (Figura 3C).
- Certifique-se de que a solução injetada segue o fluxo sanguíneo. Caso contrário, mova ligeiramente a agulha de vidro e continue injetando pequenas quantidades até que a agulha de vidro esteja posicionada corretamente17.
- Quando a quantidade desejada for injetada, deixe a agulha de vidro no vaso por ~ 15 s para evitar um sangramento maciço. Em seguida, mova a agulha de vidro um pouco para os lados, para cima e para baixo, e para frente e para trás algumas vezes para permitir uma retração suave da agulha de vidro.
NOTA: Algum sangramento é normal. Para cada injeção, use uma nova agulha de vidro, porque a agulha de vidro fica facilmente entupida e contundente da clara de ovo.
- Antes da injeção, olhe para o CAM sob um microscópio estéreo e selecione o melhor recipiente para injetar. Sempre injete em uma das veias do embrião. Estes são os vasos nos quais o fluxo sanguíneo se move em direção ao embrião. As veias são de cor mais clara do que as artérias devido ao sangue oxigenado29. Além disso, as veias estão sempre no topo da artéria, com duas exceções, a saber, as veias vitelinas anterior e posterior (ou seja, as veias menos ramificadas, indicadas com asteriscos na Figura 6A,B) que não possuem uma artéria em seu entorno.
- Imagem por microscopia do embrião e/ou vasos CAM
- Suporte de preparação com membrana acústica
- Pegue uma câmara de cultura celular que consiste em um suporte de plástico quadrado com duas membranas paralelas de policarbonato acusticamente transparentes de 50 μmde espessura 26, ainda referidas como suporte com membrana acústica. Feche ambas as portas com uma tampa.
- Use um bisturi para remover uma das duas membranas do suporte com membrana acústica.
NOTA: Para remover a membrana, corte-a ao lado da linha de cola no plástico. Tenha cuidado para não escorregar da borda para evitar danos à outra membrana. - Prepare ~15 mL de agarose a 2% em solução de demi água aquecendo entre 80-95 °C em um copo de vidro pequeno. Arrefecer o copo de vidro com a solução de agarose dissolvida sob uma torneira de água fria corrente.
NOTA: Se a agarose estiver muito quente, ela derreterá a membrana acústica, o que criará uma superfície irregular. - Quando a solução estiver arrefecida a cerca de 37 °C, deitar lentamente a solução no suporte com membrana acústica até encher todo o suporte. Incline ligeiramente o suporte com membrana acústica para que a camada de agarose se distribua uniformemente dentro da estrutura de plástico (Figura 4A). Certifique-se de que a camada de agarose é plana e deixe a agarose ajustada à temperatura ambiente.
- Remoção do embrião e CAM do saco vitelino e colocação no suporte com membrana acústica
- Retire o teor de ovos do ovo conforme descrito nas secções 1.2, 1.3 ou 1.4.
- Se necessário, injete o CAM com microbolhas e/ou outra(s) solução(ões), conforme descrito na secção 2.1.2.
- Encha uma placa de Petri de 1 L com ~500 mL de PBS de 37 °C e coloque o suporte com membrana acústica com agarose no fundo do prato. Certifique-se de que a camada de agarose está voltada para cima.
- Use uma tesoura pequena para cortar rapidamente a membrana do saco vitelino, também chamada de membrana Vitellus, ao redor de toda a MAC enquanto o teor de ovos estiver no barco de pesagem (Figura 4B). Mantenha a tesoura na mesma posição e gire o barco de pesagem enquanto corta para melhor precisão e mais velocidade.
NOTA: A partir do momento em que o primeiro corte é feito, a gema começará a vazar. Isso reduz a visibilidade do embrião e do CAM. Tente cortar todo o caminho ao redor do CAM dentro de 6-7 cortes. Isso não deve levar muito mais do que 20 s. As pequenas pinças (Figura 1F) podem ser usadas para segurar a borda da membrana vitelina e evitar o corte no CAM. - Use uma colher de sopa para colher a membrana recortada contendo o embrião e o CAM do barco de pesagem. Levante lentamente a colher do barco de pesagem e inspecione visualmente se a membrana recortada que contém o embrião e a CAM ainda estão ligadas à membrana restante do saco de gema. Quando este for o caso, use a tesoura para fazer um corte extra. Durante a colher, incline ligeiramente a colher para se livrar do máximo de gema possível, mas não deixe secar. Transferir a membrana recortada contendo o embrião e a MAC para a placa de Petri de 1 L, submergir no PBS de 37 °C e retirar a colher.
- Quando a membrana que contém o embrião e a CAM estiver submersa no PBS de 37 °C, use a pequena pinça (Figura 1F) para agarrar uma borda da membrana e gire suavemente em torno da membrana para se livrar da gema que ainda está ligada.
- Quando toda a gema for removida, use a pequena pinça para mover a membrana que contém o embrião e a CAM e posicione-a acima do suporte com membrana acústica.
- Use um pino de amostra de inseto para fixar a membrana que contém o embrião e CAM em um canto. Evite perfurar os vasos na CAM e apenas fixe a membrana.
- Use um segundo pino de amostra de inseto para fixar a membrana que contém o embrião e a CAM no canto diagonalmente oposto.
- Levantar lentamente o suporte com a membrana acústica que contém o embrião e a CAM a partir do PBS a 37 °C. Incline ligeiramente o suporte para se livrar da maior parte do PBS.
- Use as pinças pequenas (Figura 1F) para esticar e distribuir uniformemente a membrana que contém o embrião e a CAM sobre o suporte com membrana acústica e fixar o resto da membrana. Certifique-se de que a membrana que contém o embrião e a CAM esteja ligeiramente esticada para garantir que seja plana (Figura 4C).
- Colocar o suporte com membrana acústica com a membrana fixada que contém o embrião e a CAM numa configuração de microscopia que seja mantida a 37 °C.
- Coloque uma tampa ou uma membrana acústica e opticamente transparente (dependendo do objetivo desejado e do uso de ultrassom ou não) sobre a região de interesse no embrião ou CAM (Figura 4D) para permitir a visualização óptica.
- Suporte de preparação com membrana acústica
- Imagem ultrassonográfica do embrião de galinha e/ou vasos CAM
- Imagem de ultrassom do lado do embrião de galinha e vasos CAM
- Retirar o teor de ovos conforme descrito nas secções 1.2, 1.3 ou 1.4. No entanto, não use um barco de pesagem padrão. Em vez disso, use um barco de pesagem personalizado com uma parede acusticamente transparente.
NOTA: O barco de pesagem padrão foi ajustado cortando um lado do barco de pesagem e substituindo-o por uma janela de folha de poliéster que foi colada usando cola epóxi. - Submerja o transdutor de ultrassom preferido em banho-maria de 37 °C e posicione-o no local desejado com a distância de isolamento necessária.
- Coloque o barco de pesagem no banho de água de tal forma que a parede transparente esteja voltada para o transdutor. Certifique-se de que o barco de pesagem seja profundo o suficiente para ficar nivelado com o transdutor, mas evite que a água entre no barco de pesagem (Figura 5A).
- Se desejar, adicione outra configuração à parte superior do embrião ou dos vasos CAM, como um microscópio ou um laser (Figura 5A).
- Retirar o teor de ovos conforme descrito nas secções 1.2, 1.3 ou 1.4. No entanto, não use um barco de pesagem padrão. Em vez disso, use um barco de pesagem personalizado com uma parede acusticamente transparente.
- Ultrassonografia do topo do embrião e dos vasos CAM sem interferência acústica
- Encha um copo de béquer de 2 L com PBS de 37 °C. Coloque um copo de béquer de 500 mL de cabeça para baixo na parte inferior do copo de 2 L. Evite ar dentro do copo de 500 mL.
NOTA: O copo de 500 mL destina-se a elevar o barco de pesagem contendo o teor de ovos para mais perto da superfície do PBS. Ao substituir o copo por objetos por outros tamanhos, a distância entre o transdutor e o teor de ovos pode ser variada. - Colocar o copo de copo de 2 L cheio com o copo de copo de 500 ml no interior num banho de água a 37 °C.
- Retirar o teor de ovos conforme descrito nas secções 1.2, 1.3 ou 1.4.
- Molhe o teor de ovos com PBS de 37 °C e cubra o embrião com uma película de aderência transparente. Isso pode ser feito para manter o embrião na mesma posição e evitar que ele gire ou flutue.
NOTA: Ao molhar o teor de ovo com PBS, ele se tornará menos pegajoso, o que facilita a cobertura do conteúdo de ovos com filme aderente transparente. - Colocar o barco de pesagem com o teor de ovos numa placa de Petri de 90 mm de diâmetro e submergir lentamente a placa de Petri no PBS (Figura 5B).
NOTA: O uso de dois grampos nas laterais da placa de Petri opostos um ao outro facilita a submersão da placa de Petri. - Posicione o transdutor de ultrassom com a distância de impasse desejada.
- Encha um copo de béquer de 2 L com PBS de 37 °C. Coloque um copo de béquer de 500 mL de cabeça para baixo na parte inferior do copo de 2 L. Evite ar dentro do copo de 500 mL.
- Imagem de ultrassonografia do embrião de galinha e vasos CAM com um transdutor móvel
- Retirar o teor de ovos conforme descrito nas secções 1.2, 1.3 ou 1.4.
- Preparar uma solução de agarose a 2% em água demi, aquecendo a solução até entre 80-95 °C num copo de vidro pequeno. Arrefecer o copo de vidro com a solução de agarose dissolvida sob uma aba de água fria corrente.
- Despeje a solução de agarose em um recipiente plano para criar uma almofada de agarose de cerca de 1 mm de espessura. Quando completamente esfriada e definida, corte a almofada de agarose para o tamanho desejado usando um bisturi.
NOTA: A espessura da almofada de agarose pode ser alterada para obter a distância focal desejada necessária para o funcionamento correto do transdutor de ultrassom. - Coloque a almofada de agarose em cima do embrião e CAM (Figura 5C). Adicione algumas gotas de ~30 μL de 37 °C PBS na parte superior da almofada de agarose para criar uma fina camada de PBS entre a almofada de agarose e o transdutor.
NOTA: O uso do PBS impedirá que o transdutor grude na almofada de agarose. Isso é benéfico quando, por exemplo, se utiliza um motor para mover mecanicamente um transdutor bidimensional para fazer uma varredura tridimensional (Figura 9B)11. Quando o transdutor não precisa ser movido, o PBS também pode ser substituído por gel de ultrassom. - Posicione o transdutor de ultrassom desejado.
- Imagem de ultrassom do lado do embrião de galinha e vasos CAM
Resultados
Neste protocolo, descrevemos três métodos para retirar o teor de ovos da casca no dia 5-8 de incubação (HH 26-3522). A Figura 6 mostra o teor de ovos nos barcos de pesagem depois de retirado da casca. O embrião de 5 dias de idade e a MAC (Figura 6A) foram retirados pelo método descrito na secção 1.2. Os embriões de 6 e 7 dias de idade e a MAC (Figura 6B,C) foram retirados pelo método descrito na secção 1.3. O embrião de 8 dias de idade e a MAC (Figura 6D) foram retirados pelo método descrito na secção 1.4. Nenhum sangramento ou dano ao embrião ou CAM pode ser observado, indicando que esses métodos podem ser usados para obter com segurança o conteúdo de ovos da casca sem prejudicar o embrião ou os vasos CAM. Quando executado corretamente, o método para os embriões de 5 dias de idade fornecerá um embrião viável e CAM intacto em 90% de todos os procedimentos. A taxa de viabilidade é baseada no número total de ovos fertilizados extraídos com sucesso da casca do ovo. Com o segundo método, para ovos incubados de 6 e 7 dias, a chance de um embrião viável e CAM intacto é de cerca de 75% para 6 dias de idade e cerca de 50% para 7 dias de idade. Com o terceiro método descrito para embriões de 8 dias de idade, a chance de um embrião viável e CAM intacta é de cerca de 60%. Diferenças nos estágios de desenvolvimento entre os embriões de 5 e 8 dias de idade podem ser observadas, o que concorda com Hamburger e Hamilton22. Tanto o tamanho do embrião quanto a complexidade dos vasos CAM aumentam durante o desenvolvimento (Figura 6A-D). A Figura 6C mostra uma fina mancha de agarose sobre o conteúdo do óvulo que permite que o embrião e a CAM sejam fotografados usando a configuração de ultrassom mostrada na Figura 5C. Depois que o conteúdo do ovo é retirado da casca, o batimento cardíaco do embrião é visível a olho nu. A frequência cardíaca destes embriões ex ovo é semelhante à dos embriões de ovo a 183 batimentos por minuto (bpm) no dia 5 até ~208 bpm no dia 830. Quando mantido umidificado e a 37 °C, o embrião manterá essa frequência cardíaca por ~ 5 h nas configurações experimentais de ultrassom.
Múltiplas complicações podem ocorrer durante os três métodos descritos anteriormente. A Figura 7A mostra o ar preso sob a CAM, o que torna o embrião inadequado para imagens de ultrassom e a pressão da(s) bolha(s) de ar também pode danificar o embrião e/ou a CAM. Este problema surge quando o saco de ar dentro da casca não faz contato com o ar fora da casca ao tirar o conteúdo do ovo da casca. A Figura 7B mostra um pequeno vazamento de gema do saco vitelino no canto superior direito da imagem. Isso pode ocorrer ao tirar o teor de ovos da casca quando o saco de gema é danificado por bordas afiadas da casca ou quando o saco de gema é penetrado pelas pinças. O vazamento da gema pode afetar a visibilidade do embrião e dos vasos CAM. A Figura 7C mostra um embrião no qual uma bolha de ar está presa sob o CAM. Isso às vezes ocorre no desenvolvimento embrionário. Outra complicação que pode ocorrer é o dano aos vasos. Esse dano pode ser criado ao tirar o conteúdo de ovos da casca ou ao realizar uma injeção (Figura 7D). Além disso, o embrião e os vasos também podem secar com o tempo (Figura 7E). Isso ocorre quando o teor de ovos não é polvilhado com PBS. A secagem do embrião pode resultar em obstruções capilares maciças (Figura 7F), o que afeta a viabilidade do embrião. As obstruções capilares maciças também podem ocorrer durante o desenvolvimento ou quando o batimento cardíaco do embrião não é estável.
Depois que o conteúdo do ovo é retirado da casca sem qualquer complicação, o embrião pode ser injetado com, por exemplo, agentes de contraste ultrassonográficos, como microbolhas (Figura 3C). A Figura 8 mostra microbolhas circulantes no lúmen do vaso sanguíneo após a injeção. Essas microbolhas são transportadas junto com o fluxo sanguíneo e permanecem presentes na circulação sanguínea por várias horas (Vídeo Suplementar 1). A presença dessas microbolhas na circulação cria a possibilidade de realizar diferentes tipos de ECUS e experimentos de liberação de fármacos 7,11,12. O CAM é ideal para investigar novos métodos de detecção de contraste por ultrassom para os quais mostramos três exemplos. A Figura 9A mostra imagens subharmônicas ultrassonográficas de alta frequência de um embrião de galinha de 6 dias de idade no modo B e no CEUS antes e após a injeção de microbolhas. Aqui, os vasos CAM foram injetados com 5 μL de contraste ultrassonográfico e a imagem foi realizada com uma máquina de ultrassom animal pré-clínica com sonda MS250 (frequência de transmissão de 30 MHz e frequência de recepção de 15 MHz, potência de 10%). Antes da injeção de microbolhas, o contraste já pode ser visto dentro do coração embrionário nas imagens do modo B (Figura 9A-I). Esse fenômeno deve-se à presença de um núcleo no glóbulo vermelho aviário que aumenta o contraste do sangue na ultrassonografia 5,31. A adição das microbolhas aumentou o contraste e a visibilidade do embrião, tanto no modo B quanto na imagem CEUS. A Figura 9B mostra uma imagem óptica e uma imagem subharmônica 3D de alta frequência de um embrião de 6 dias de idade e dos vasos circundantes. O CAM foi injetado com 5 μL de contraste ultrassonográfico e a imagem foi realizada com uma máquina de ultrassom animal pré-clínica com sonda MS550s (frequência de transmissão de 40 MHz, pico de pressão negativa ~ 300 kPa). Esses resultados mostram que a imagem CEUS combinada com um agente de contraste também pode ser usada para criar imagens subharmônicas 3D de alta frequência e para visualizar os vasos sanguíneos fora do embrião. A Figura 9C mostra uma imagem óptica e uma imagem de ultrassom intravascular ultraharmônico (USIV) feita com uma sonda personalizada de microvasos CAM de um embrião de 6 dias de idade (26 MHz de transmissão e 39 e 65 MHz de frequência de recepção). Os vasos CAM foram injetados com um contraste ultrassonográfico de 4 ± 1 μL. A imagem óptica e a imagem IVUS são do mesmo embrião e da mesma região de interesse, mostrando as redes de vasos correspondentes.
O embrião de galinha e os vasos CAM também podem ser usados para investigar a entrega de medicamentos mediados por ultrassom, para os quais mostramos um exemplo. Como a gema obstrui o caminho da luz durante a imagem, a remoção do saco vitelino é necessária para investigar opticamente a entrega de drogas nos vasos embrionários e CAM. Para este estudo, o embrião e a CAM foram preparados para imagens microscópicas, conforme explicado na seção 2.2, separando a membrana contendo o embrião e a CAM do saco vitelino (Figura 4C). Nestes embriões, a frequência cardíaca é estável em torno de 80 bpm e os embriões permanecem vivos por até 2 h quando mantidos a 37 °C7. A Figura 10 mostra um estudo de liberação de drogas mediado por ultrassonografia e microbolhas em células endoteliais dos vasos da CAM. Microbolhas revestidas de lipídios, direcionadas à parede do vaso utilizando αvβ3-anticorpos e coradas com o corante fluorescente DiI7, foram injetadas nos vasos CAM (Figura 10A,C). Os núcleos das células endoteliais dos vasos CAM foram corados com Hoechst 33342 (Figura 10B) e o fármaco modelo Propidium Iodide (PI) foi utilizado para visualizar a sonoporação7. Ambos os corantes foram injetados simultaneamente com as microbolhas. Após o tratamento ultrassonográfico (1 MHz, pressão negativa de pico de 200 kPa, explosão única de 1000 ciclos), observou-se captação de IP nos núcleos mais próximos das microbolhas alvo (Figura 10D). Isso mostra que as oscilações induzidas por ultrassom das microbolhas alvo foram capazes de criar um poro na membrana celular endotelial.
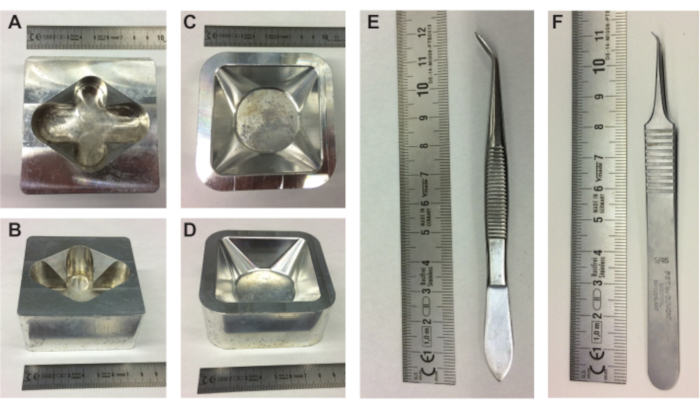
Figura 1. Equipamento de preparação de embriões. (A-B) vista superior e lateral do suporte de ovos de metal e (C-D) vista superior e lateral do suporte de pesagem de metal do barco. Pinças (E-F) necessárias para tirar o teor de ovos da casca. Escala em cm. Clique aqui para ver uma versão maior desta figura.
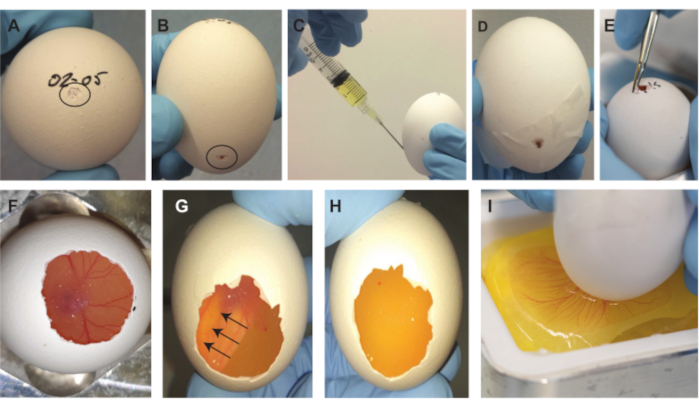
Figura 2. Procedimento de remoção de embriões. (A) Pequeno travessão no topo do ovo, indicado pelo círculo preto. (B) Pequeno travessão 2/3 abaixo do ovo, indicado pelo círculo preto. (C) Retirada ~2 mL de clara de ovo. (D) Folga selada na lateral com fita adesiva. (E) Ampliar a pequena abertura na parte superior do ovo. (F) O embrião torna-se visível após a remoção de parte da casca. (G-H) Depois de girar o ovo 180°, o embrião flutua para cima e se tornará invisível (as setas indicam a direção em movimento do embrião). Após 1-2 min, o embrião é invisível do fundo. (I) Depois de arranhar a membrana, o teor de ovos cai no barco de pesagem. Por favor, clique aqui para ver uma versão maior desta figura.
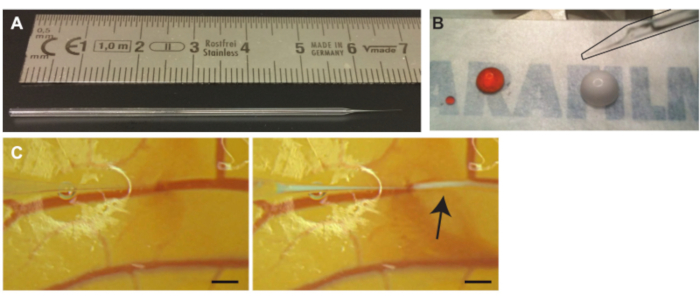
Figura 3. Injeção de microbolhas nos vasos CAM. (A) Agulha capilar de vidro. Escala em cm. ( B ) Solução de iodeto de propídio (PI) (gota esquerda) e microbolhas (gota direita) antes da aspiração antes da injeção. A agulha (delineada em preto) pode ser vista no canto superior direito (C) Injeção de microbolhas. A ponta da agulha capilar é posicionada dentro do lúmen de uma das veias (esquerda). Microbolhas, a nuvem branca indicada com uma seta, são injetadas e se dispersam seguindo a corrente sanguínea (à direita). A barra de escala representa 1 mm. Clique aqui para ver uma versão maior desta figura.
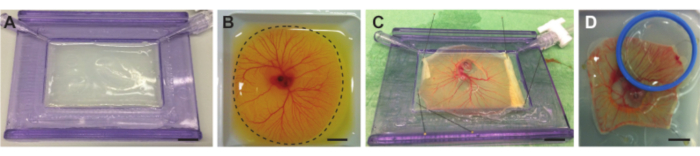
Figura 4. Remoção do embrião e CAM do saco vitelino e colocação no suporte com membrana acústica. (A) Suporte com membrana acústica preenchida com camada de agarose. B) Embrião de galinha e navio CAM no barco de pesagem antes do corte. Linha pontilhada indica a linha de corte ao redor do CAM. (C) Embrião de galinha e CAM separados da gema e fixados na membrana acústica. (D ) Embrião de galinha preso com uma membrana acústica e opticamente transparente num suporte (azul) colocado em cima do CAM. O suporte pode ser preenchido com demi water para que uma objetiva de imersão de água possa ser usada. Todas as barras de escala representam 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 5. Diferentes configurações para embrião de galinha e imagens de ultrassom CAM. (A) Configuração para imagens de ultrassom do lado. O embrião de galinha foi colocado em um barco de pesagem personalizado com uma parede acusticamente transparente e colocado em banho-maria de 37 °C. O transdutor de ultrassom foi posicionado no lado esquerdo (a) ao lado da parede acusticamente transparente e o laser (b) para imagem fotoacústica no topo. (B) Configuração para imagens de ultrassom a partir do topo. Embrião e CAM foram submersos em um copo de PBS que foi colocado em banho-maria de 37 °C. O contorno tracejado mostra o copo de vidro de 2 L (a) com o copo de vidro de 500 mL (b) dentro. (C) Configuração para imagens de ultrassom a partir do topo com um transdutor móvel. Uma fina almofada de agarose (linha pontilhada) foi colocada no topo do embrião com uma fina camada de PBS como acoplamento entre o transdutor e a superfície da agarose. Por favor, clique aqui para ver uma versão maior desta figura.
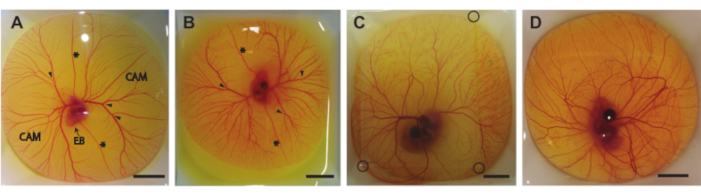
Figura 6. Teor de ovos fora da casca. A) Teor de ovos retirado da casca após 5 dias de incubação. A membrana corioalantóica (CAM), o corpo embrionário (EB), as veias vitelinas anterior e posterior (*) e os locais apropriados para injeção (cabeças de seta) são indicados. B) Teor de ovos retirado da casca após 6 dias de incubação. As veias vitelinas anterior e posterior (*) e os locais apropriados para injeção (pontas de seta) são indicados. (C) Teor de ovos retirado da casca após 7 dias de incubação. Um remendo de agarose é colocado em cima para permitir imagens de ultrassom. Os cantos da mancha de agarose são indicados com círculos pretos. D) Teor de ovos retirado da casca após 8 dias de incubação. Todas as barras de escala representam 1 cm. Clique aqui para ver uma versão maior desta figura.
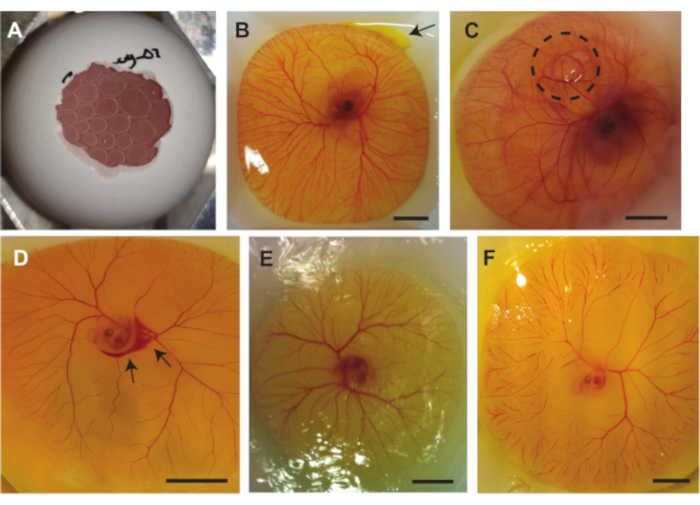
Figura 7. Complicações que podem ocorrer durante os procedimentos com o embrião de galinha e o modelo CAM. (A ) Bolhas de ar presas sob o CAM ao retirar o conteúdo de ovos da casca usando o método 1.2 (embrião de 5 dias de idade) ou 1.3 (embrião de 6 a 7 dias de idade). (B) Pequeno vazamento de gema indicado com uma seta no canto superior direito (embrião de 6 dias de idade). (C) Ar preso sob o CAM, indicado pelo círculo pontilhado preto (embrião de 7 dias de idade). (D) Sangramento, indicado com as setas pretas (embrião de 5 dias de idade. (E) Embrião seco e CAM (embrião de 5 dias de idade). (F) Obstruções capilares maciças (embrião de 5 dias de idade). Todas as barras de escala representam 1 cm. Clique aqui para ver uma versão maior desta figura.
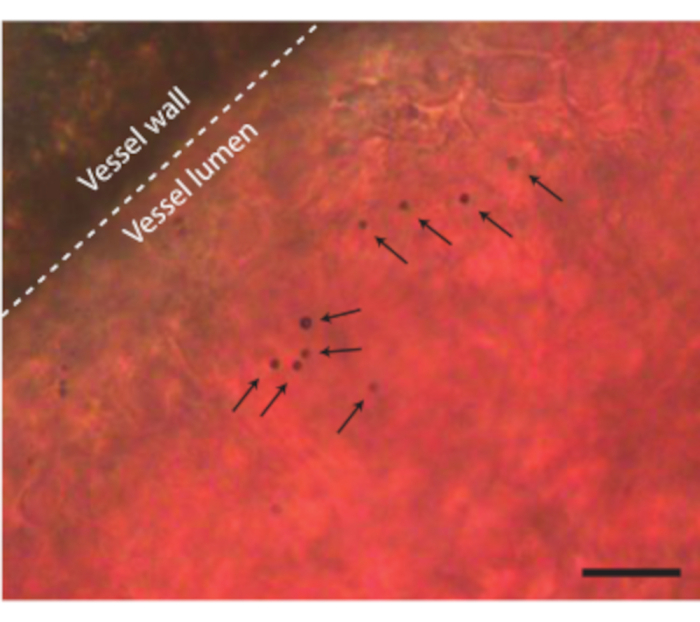
Figura 8. Microbolhas no vaso sanguíneo CAM. A parede do vaso é indicada com uma linha pontilhada e microbolhas únicas são indicadas com setas. A barra de escala representa 20 μm. A gravação microscópica correspondente pode ser encontrada no Vídeo Suplementar 1. Por favor, clique aqui para ver uma versão maior desta figura.
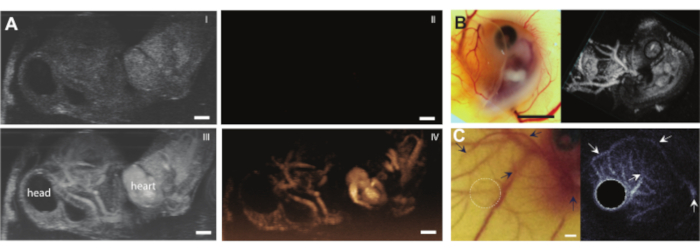
Figura 9. Ultrassonografia com contraste em embriões de galinha e vasos CAM. (A) Projeção de intensidade máxima de imagens de modo B (I, III) e subharmônicas em tempo real (II, IV) (máquina de ultrassom animal pré-clínica com sonda MS250, 30 MHz de transmissão e 15 MHz de frequência de recepção, 10% de potência) de um embrião de 6 dias de idade com um remendo de agarose no topo. As imagens superiores (I, II) mostram os resultados antes e abaixo (III, IV) após a injeção do agente de contraste ultrassonográfico de 5 μL. A barra de escala representa 1 mm. Esta imagem foi modificada com permissão de Daeichin et al. 201511 (B) Imagem óptica (esquerda) e subharmônica 3D (direita) de um embrião de galinha de 6 dias de idade com um pedaço de agarose no topo. Os vasos CAM foram injetados com meio de contraste ultrassonográfico de 5 μL e a imagem foi realizada com sonda de alta frequência (máquina de ultrassom animal pré-clínica com sonda MS550s, frequência de transmissão de 40 MHz, pressão negativa de pico ~ 300 kPa, renderizada em modo 3-D de máquina de ultrassom animal pré-clínica). A barra de escala representa 5 mm. Esta imagem foi modificada com permissão de Daeichin et al. 201511. (C) Imagem óptica (esquerda) e projeção de intensidade média da ultrassonografia intravascular ultraharmônica (USIV) (direita) da microvasculatura CAM de um embrião de 6 dias de idade. Os vasos CAM foram injetados com contraste de 4 ± 1 μL. A imagem ultraharmônica do USIC foi realizada com sonda IVUS personalizada (frequência de transmissão 35 MHz, pico de pressão negativa 600 kPa). Ambas as imagens são feitas a partir do mesmo embrião e região de interesse. As setas indicam os vasos correspondentes nas duas imagens. A barra de escala representa 1 mm. Esta imagem foi modificada com permissão de Maresca et al. 201412. Por favor, clique aqui para ver uma versão maior desta figura.
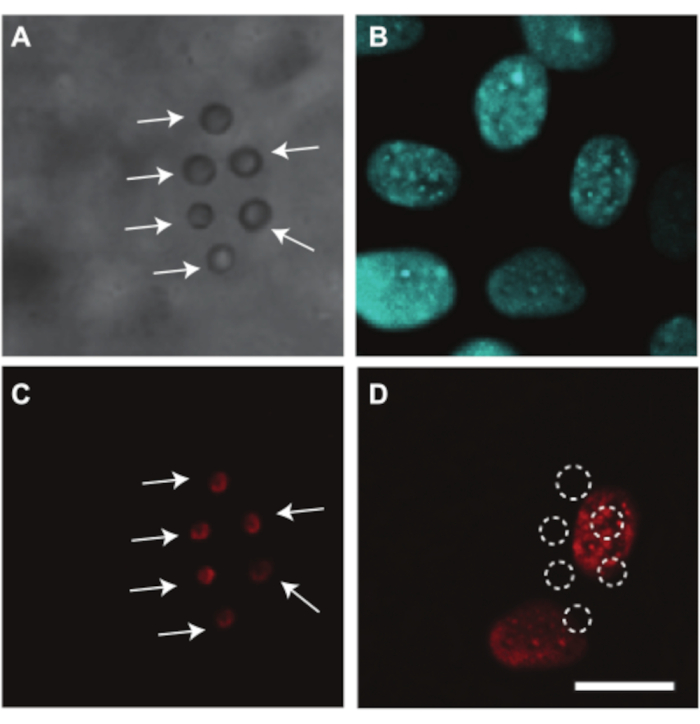
Figura 10. Entrega de fármacos às células endoteliais dos vasos CAM em embrião de 6 dias de idade. (A) Imagem de campo brilhante de seis microbolhas αvβ3-alvo, indicadas com setas brancas, aderindo à parede do vaso antes do tratamento ultrassonográfico. (B) Núcleos de células endoteliais corados fluorescentemente antes do tratamento ultrassonográfico. (C) Imagem fluorescente das microbolhas alvo coradas, indicadas com setas brancas, antes do tratamento ultrassonográfico. (D) Absorção do iodeto de propídio (IP) da droga modelo nos núcleos celulares sob as microbolhas alvo após o tratamento de ultrassom (1 MHz, pressão negativa de pico de 200 kPa, explosão única de 1000 ciclos). A barra de escala representa 10 μm e se aplica a todas as imagens. Esta imagem foi modificada com permissão de Skachkov et al. 20147. Por favor, clique aqui para ver uma versão maior desta figura.
ARQUIVOS COMPLEMENTARES
Vídeo Suplementar 1. Microbolhas no vaso sanguíneo CAM. A barra de escala representa 20 μm. Clique aqui para baixar este vídeo.
Discussão
Este protocolo descreve três métodos sobre como obter e usar embriões de galinha de 5 a 8 dias de idade e sua CAM como um modelo in vivo para estudar imagens de ultrassom com contraste e entrega de medicamentos mediados por microbolhas. As medidas mais críticas para tirar da casca embriões de 5 dias de idade (secção 1.2) e 6 a 7 dias de idade (secção 1.3) são: 1) fazer com que o pequeno orifício na parte superior do ovo passe por toda a casca do ovo para o saco de ar antes de retirar a clara do ovo; 2) criar bordas lisas para a grande abertura na casca. Para o método de retirada de embriões de 8 dias de idade da casca (secção 1.4), os passos mais críticos são: 1) Fazer um número suficiente de recuos para criar uma boa rachadura ao longo do ovo; 2) Mantenha o ovo submerso em PBS. Para garantir a viabilidade embrionária para todos os métodos, é importante manter o ovo e o seu conteúdo a 37 °C. Além disso, evite injetar em uma artéria CAM. Recomenda-se monitorar visualmente a frequência cardíaca do embrião durante os estudos para garantir a vitalidade do embrião. Para confirmar o estágio exato de desenvolvimento do embrião, a indicação de Hamburger & Hamilton22 pode ser usada.
É importante evitar danos ao embrião, CAM e saco de gema. Esse dano pode afetar a viabilidade, o fluxo sanguíneo e a visibilidade do embrião e da CAM. Além disso, danos ao saco vitelino e, consequentemente, uma baixa rigidez da membrana tornam impossível uma injeção nos vasos CAM. Um embrião de 5 dias de idade tem um saco de ar relativamente pequeno, de modo que, para ser capaz de fazer um buraco suficientemente grande na casca através do qual o conteúdo do ovo pode ser removido, 2 mL de clara de ovo precisam ser retirados. Como resultado, mais espaço entre a casca do ovo e o embrião é criado. Após a retirada da clara de ovo, um pedaço de fita adesiva precisa fechar o buraco onde a agulha entrou. Se a clara de ovo ainda vazar, aplique outro pedaço de fita adesiva. Além disso, a aplicação de fita adesiva no orifício lateral cria um vácuo no interior do ovo, o que impede que o teor de ovos caia devido ao seu próprio peso quando o grande orifício é criado na etapa 1.2.2.8. Danos ao embrião ou CAM também podem ocorrer quando a borda da casca do ovo estava muito afiada ou quando o conteúdo do ovo é jogado no barco de pesagem com muito rigor, de modo que a casca do ovo deve ser mantida muito perto do barco de pesagem. Entre os dias 5 e 6 de desenvolvimento, a CAM começa a se ligar à membrana da casca32. Esta ligação aumenta o risco de danificar o embrião e CAM ao tirar o conteúdo de ovos da casca do ovo. Ao abrir o ovo após a injeção de PBS nele por um ovo incubado de 6 a 7 dias ou em um recipiente cheio de PBS, conforme descrito para um ovo incubado de 8 dias, o risco de danos é reduzido. Em relação a uma injeção em uma veia CAM: se a primeira injeção falhar, uma segunda injeção pode ser feita mais a montante na mesma veia se o dano foi menor ou em outra veia CAM. A separação do embrião e da CAM da gema torna o embrião e os vasos CAM opticamente transparentes. Como consequência, o embrião perde sua principal fonte de nutrientes33. Essa perda de nutrientes poderia ser uma explicação para a menor frequência cardíaca observada de 80 bpm em comparação com ~190 para um embrião de 6 dias de idade que ainda está em contato com a gema30 e o tempo de sobrevivência reduzido de 2 h após esse procedimento de separação. Outro fator que pode desempenhar um papel na redução da frequência cardíaca e do tempo de sobrevivência é o desafio de manter o embrião separado da gema e os vasos CAM a 37 °C. Uma incubadora de estágio de microscópio pode ser de ajuda. Além disso, o descolamento da CAM da gema provavelmente leva a mudanças mecânicas no tecido, uma vez que a tensão da membrana se torna menor. A tensão mais baixa da membrana pode causar um aumento da taxa de cisalhamento do vaso interno, o que leva a uma frequência cardíaca mais baixa.
O embrião ex ovo de galinha e os vasos CAM têm algumas limitações como modelo in vivo, incluindo apenas observações de curto prazo, para imagens de ultrassom com contraste e estudos de liberação de drogas mediados por microbolhas. Devido ao pequeno volume sanguíneo de 100±23 μL no dia 5 e 171±23 μL no dia 634, um volume máximo de ~5 μL pode ser injetado. Nos estágios posteriores de desenvolvimento (dia 7 e mais velhos), a rigidez do vaso aumenta e a elasticidade da gema diminui. Isso pode complicar uma injeção bem-sucedida em embriões mais velhos. Uma vez que as microbolhas são injetadas, elas circulam por horas porque o embrião de galinha não possui um sistema imunológico totalmente desenvolvido nesta fase35. Portanto, as microbolhas não são eliminadas dentro de ~ 6 minutos como em humanos 36,37, tornando os estudos típicos de imagem molecular de ultrassom com um período de espera de 5-10 minutos para microbolhas direcionadas não ligadas a serem limpas38 inviáveis. Para atingir as microbolhas, é necessário utilizar ligantes adequados capazes de se ligar às células endoteliais aviárias, como descrito anteriormente para o marcador de angiogênese αvβ37. Outros aspectos a serem considerados para este modelo são o aumento da dificuldade de separação dos vasos embrionários e CAM da gema em embriões mais velhos (> 8 dias) e hematócrito inferior de ~20%39 em comparação com humanos. Esta última pode afetar as oscilações das microbolhas, pois sabe-se que as oscilações das microbolhas são amortecidas em um ambiente mais viscoso40. As artérias MAC são menos oxigenadas que as veias MAC41,42. Esta diferença deve ser tida em conta quando, por exemplo, se estuda imagens fotoacústicas da oxigenação sanguínea.
Os métodos descritos aqui permitem que o conteúdo do ovo seja retirado da casca do ovo no dia do estudo de ultrassonografia ou administração de medicamentos, normalmente nos dias 5 a 8 da incubação. Isso é diferente dos métodos existentes, em que o teor de ovos é retirado da casca após uma incubação de 3 dias e desenvolvido como cultura ex ovo 18,20,21. As vantagens são uma maior taxa de sobrevivência de 90% para 5 dias, 75% para 6 dias, 50% para 7 dias e 60% para ovos incubados de 8 dias de idade, em comparação com ~50% para embriões de 3 dias de idade retirados da casca do ovo e posteriormente incubados ex ovo1,18 a evitar antibióticos durante a cultura18, 20 e grande incubadora estéril para a cultura ex ovo. A sobrevivência dos embriões de 6 a 8 dias de idade é menor porque a MAC começa a se fixar à casca21, o que deixa a membrana CAM mais propensa à ruptura após a extração. A separação do embrião com a CAM forma a gema também é descrita tornando o embrião e CAM opticamente transparentes.
Ao colocar o conteúdo do ovo em diferentes configurações, o embrião de galinha e o CAM podem ser usados para uma infinidade de estudos de imagem de ultrassom, como IVUS, fotoacústico, sem ou com agentes de contraste de ultrassom em 2D e 3D. O foco pode ser o desenvolvimento de novos esquemas de pulsação de ultrassom ou o teste de novos transdutores. Além disso, o modelo também pode ser usado para investigar novos agentes de contraste ultrassonográficos e seu comportamento nos vasos sanguíneos sob fluxo. Como o mecanismo de liberação de fármacos mediados por microbolhas ainda é desconhecido43, o uso do modelo CAM in vivo pode auxiliar na elucidação do mecanismo, estudando o comportamento das microbolhas em relação à resposta celular. Finalmente, os vasos CAM têm se mostrado um sistema adequado para investigar o transplante tumoral de xenoenxerto44. Isso cria a possibilidade de usar o vaso CAM como um modelo para investigar imagens tumorais usando ultrassom e para investigar o fluxo sanguíneo dentro do tumor usando CEUS. Os tumores são tipicamente enxertados nos vasos CAM de embriões de 8 ou 9 dias de idade 1,14,45, para os quais o embrião é retirado da casca do ovo no dia 3de incubação e desenvolvido ex ovo. Os métodos descritos neste protocolo poderiam ser utilizados para o crescimento de embriões em ovo, até o dia da enxertia tumoral.
Os autores confiam que este artigo será útil para pesquisadores que desejam usar embriões de galinha e sua membrana corioalantóica (CAM) como um modelo in vivo para aplicações de agentes de contraste e estudos de fluxo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Applied and Engineering Sciences (TTW) (Vidi-project 17543), parte da NWO. Os autores gostariam de agradecer a Robert Beurskens, Luxi Wei e Reza Pakdaman Zangabad do Departamento de Engenharia Biomédica e Michiel Manten e Geert Springeling do Departamento de Instrumentação Médica Experimental pela assistência técnica, todos do Erasmus MC University Medical Center Rotterdam, Holanda.
Materiais
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
Referências
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados