Method Article
Kontrastlı Ultrason Görüntüleme ve Mikrokabarcık Aracılı İlaç Dağıtım Çalışmaları için Tavuk Ex Ovo Embriyolarının ve Korioallantoik Membran Damarlarının In Vivo Model Olarak Hazırlanması
Bu Makalede
Özet
Bu protokol, kontrastlı ultrason görüntüleme ve mikrokabarcık aracılı ilaç dağıtımını incelemek için 5 ila 8 günlük tavuk embriyolarının ve bunların koryoallantoik membranının (CAM) in vivo bir model olarak nasıl elde edileceği ve kullanılacağına dair üç yöntemi açıklamaktadır.
Özet
Tavuk embriyosu ve kan damarından zengin koryoalantoik membran (CAM), biyomedikal süreçleri, yeni ultrason nabız şemalarını veya kontrastlı ultrason görüntüleme ve mikrokabarcık aracılı ilaç dağıtımı için yeni transdüserleri araştırmak için değerli bir in vivo modeldir. Bunun nedenleri, TAT embriyo ve damar ağının erişilebilirliğinin yanı sıra modelin düşük maliyetleridir. Embriyo ve CAM damarlarına ulaşmak için önemli bir adım, yumurta içeriğini yumurta kabuğundan çıkarmaktır. Bu protokolde, inkübasyonun 5. ve 8. günleri arasında içeriği yumurta kabuğundan çıkarmak için üç yöntem tanımlanmıştır, böylece embriyoların bu günlere kadar yumurta kabuğunun içinde gelişmesine izin verilmektedir. Tarif edilen yöntemler sadece basit alet ve ekipman gerektirir ve ex ovo kültürlü embriyolara kıyasla (~% 50) 5 gün için% 90, 6 gün için% 75, 7 gün için% 50 ve 8 günlük inkübe yumurtalar için% 60 daha yüksek bir hayatta kalma başarı oranı sağlar. Protokol ayrıca, mikrokabarcıklar gibi kavitasyon çekirdeklerinin CAM vasküler sistemine nasıl enjekte edileceğini, embriyo ve TAT içeren zarın optik olarak şeffaf çalışmalar için yumurta içeriğinin geri kalanından nasıl ayrılacağını ve tavuk embriyosu ve TAT'ın çeşitli kısa süreli ultrason deneylerinde nasıl kullanılacağını açıklar. İn vivo tavuk embriyosu ve CAM modeli, kontrastlı ultrason görüntüleme için yeni görüntüleme protokollerini, ultrason kontrast maddelerini ve ultrason nabız şemalarını araştırmak ve ultrason aracılı ilaç dağıtımının mekanizmalarını çözmek için son derece önemlidir.
Giriş
Ex ovo tavuk embriyoları ve kan damarından zengin koryoallantoik membranın (CAM), embriyogenez, onkoloji ve ilaç dağıtımı gibi çeşitli biyolojik ve biyomedikal süreçleri araştırmak için uygun bir model olduğu kanıtlanmıştır 1,2,3,4. Ultrason, embriyonik kalp gelişiminingörüntülenmesi için 4,5 ve mikrokabarcıklar gibi enjeksiyon üzerine kavitasyon çekirdeklerinin aktive edilmesinde, vasküler ilaç dağıtımıiçin kullanılmıştır 6,7. Tavuk embriyoları ucuzdur, daha az altyapı ve ekipman gerektirir ve diğer hayvan modellerine kıyasla daha az katı mevzuata sahiptir8. Tavuk embriyosu ve CAM damarlarına yumurtayı açtıktan sonra kolayca erişilebilirken, memeli embriyoları ve damarları ile bunun çok daha zor olduğu kanıtlanmıştır. Bunun yanı sıra, tavuk embriyosu ve CAM damarları kalp atışı ve titreşen bir kan akışı sağlar. TAT damar anatomisinde memelilerle benzerlikler gösterir ve 8,9,10 ilaç taraması için kullanılabilir. Bu özelliklerden dolayı, CAM damarlarının kontrastlı ultrason görüntülemeyi (CEUS) araştırmak için uygun bir model olduğu kanıtlanmıştır (CEUS)11,12,13,14,15,16. Ek olarak, model, ultra yüksek hızlı bir kamera kullanarak ultrason kontrast maddelerinin bir ultrason alanındaki davranışını ve akustik radyasyon kuvvetinin ilaçların itilmesi, bağlanması ve ekstravazasyonu üzerindeki etkisinioptik olarak araştırmak için kullanılabilir 7,17,18,19. Tavuk embriyosu ve TAT uzun süreli deneyler için daha az uygun olmasına rağmen, kısa süreli in vivo deneyler için faydalı olabilirler.
Deneyler sırasında tavuk embriyosu ve TAT üzerindeki görünürlüğü ve kontrol edilebilirliği artırmak için, embriyoyu ve TAT'ı içeren yumurta içeriğinin yumurta kabuğu18'den çıkarılması önemlidir. Ultrason kontrast maddelerini içeren önceki tavuk embriyosu çalışmalarında 5-6 günlük embriyolar 7,11,12,17,19 ve 14-18 günlük embriyolar13,14,15,16 kullanılmıştır. Yumurta içeriğinikabuktan çıkarmak için çoklu yaklaşımlar ayrıntılı olarak açıklanmıştır 18,20,21. Bununla birlikte, bildiğimiz kadarıyla, daha önce yayınlanmış yaklaşımlar, 3 günlük inkübasyondan sonra yumurta içeriğini yumurta kabuğundan çıkarmaya odaklanmaktadır (yani, Hamburger & Hamilton (HH) aşama 19-2022) ve kültürü ex ovo'ya devam ettirmektedir. Bu ex ovo kültürü yaklaşımının, kültür sırasında ölüm riskinin artması (~% 50) 1,18, antibiyotik kullanımının 18,20 ve ovo büyümesine kıyasla toplam damar uzunluğunun azalması gibi birçok dezavantajı vardır 23. Embriyonun yumurta kabuğu içinde kültürlenmesi en doğal ortamı sağladığından, embriyonun deney gününe kadar yumurta kabuğu içinde kuluçkaya yatırılması en kolay yoldur. Bu nedenle 5-8 günlük inkübasyonda yumurta içeriğinin yumurta kabuğundan çıkarıldığı bir yaklaşım, özellikle 5 ila 8 günlük embriyolar üzerinde yapılan deneyler için faydalı olacaktır.
Bu protokolde, embriyo gelişimin 5 ila 8. günündeyken (HH 26-3522) yumurta içeriğini yumurta kabuğundan çıkarmak için üç yöntem tanımladık ve embriyonun deney gününe kadar yumurta kabuğu içinde gelişmesine izin verdik. CAM damar büyüklüğü, 8 günlük embriyo 24'ün daha küçük kılcal damarlarında çapı 10-15 μm'den, 6 ve 8 günlük embriyoların daha büyük damarındaçapı 24,25'e kadar 115-136 μm arasında değişmektedir. Açıklanan üç yöntem sadece temel laboratuvar araçlarını gerektirir ve deney başlamadan önce komplikasyon riskini azaltır, böylece gereksiz maliyetleri ve işçiliği azaltır. Ayrıca, embriyo ve TAT'ı içeren zarı yumurta sarısı çuvalından ayırmak için bir yöntem detaylandırıyoruz ve CAM'ı mikroskopi çalışmaları için optik olarak şeffaf hale getiriyoruz. Embriyo ve CAM'ı içeren zar, örneğin akustik membranlı bir tutucuya sabitlenebildiğinden, kurulum akustik olarak şeffaf26 yapılabilir ve ışık yolu yumurta sarısından etkilendiğinde mikroskopi ve ultrason çalışmalarının kombinasyonuna izin verir. Son olarak, ultrason veya CEUS görüntüleme için kullanılabilecek diğer birkaç ultrason kurulumunu açıklıyoruz.
Protokol
Tüm hayvan deneyleri, Hollanda Hayvan Deneyleri Yasası ve bilimsel amaçlar için hayvan kullanımının korunmasına ilişkin Avrupa Konseyi (2010/63/EU) uyarınca gerçekleştirilmiştir.
1 . Embriyo hazırlama protokolü
- Döllenmiş tavuk yumurtasının kuluçkalanması
- Taze döllenmiş tavuk yumurtalarını 15 ° C'de bir haftaya kadar saklayın.
- Döllenmiş yumurtaları inkübe etmek için, sivri uçlu tarafı aşağı doğru dikey olarak 37 ° C, nemlendirilmiş bir inkübatöre yerleştirin. Kuluçka sırasında yumurtaların döndürülmesi gerekli değildir.
NOT: Kalıcı bir işaretleyici kullanarak yumurtanın üst kısmının kuluçka başlangıç tarihini yazın.
- 5 güne kadar (120 saat) yaşlı embriyonun hazırlanması (HH evre 26-28)22
- Çalışma alanının hazırlanması
- Bir ısıtma plakasını 37 ° C'ye ısıtın.
- Isıtma plakasına metal bir yumurta tutucu (Şekil 1A,B), metal bir tartım teknesi tutucusu (Şekil 1C,D) ve PBS ile doldurulmuş 10 mL'lik bir Erlenmeyer yerleştirin.
- Bir tartım teknesini (85 mm × 85 mm × 25 mm) 10 mm'lik bir ultrason jeli tabakasıyla doldurun ve doldurulmuş tartım teknesini önceden ısıtılmış metal tartım teknesi tutucusuna yerleştirin.
NOT: Tartım teknesini ultrason jeli ile doldurmak embriyoyu ve CAM'ı yükseltecektir. Bu, embriyo ve TAT'ın enjeksiyonu veya görüntülenmesi için faydalı olabilir, ancak embriyo ve TAT'ı yumurta kabuğundan çıkarmak için gerekli değildir. - Bir ucun bir kısmı kendi üzerine katlanmış, birkaç parça bant (yaklaşık 3 cm uzunluğunda) hazırlayın, böylece artık yapışmaz.
- Yumurta içeriğinin yumurta kabuğundan çıkarılması
- 5 günlük inkübe döllenmiş bir yumurta alın ve önceden ısıtılmış metal yumurta tutucuya aktarın (Şekil 1A, B). Yumurtayı aynı yönde tuttuğunuzdan emin olun (yani, üstteki tarih).
NOT: Hava kesesini ve embriyoyu ve CAM'ı yumurtanın üstünde aynı konumda tutmak için yumurtayı aynı yönde tutmak önemlidir. - Bir cımbızın sivri arkasını kullanın (veya benzeri; Şekil 1E) yumurtanın en üstünde küçük bir girinti yapmak için (tarihin yazıldığı yer) (Şekil 2A).
- Cımbızın sivri arkasını kullanarak yumurtanın yan tarafında yumurtanın yaklaşık 2/3 aşağısında ikinci bir girinti yapın (Şekil 2B).
NOT: Girintiyi çok büyük yapmamaya ve bir delik oluşturmamaya dikkat edin. Kazara bir delik oluşursa, deliği bantla kapatın ve başka bir girinti yapmayın. - Daha büyük cımbızları kullanarak (Şekil 1E), yumurtanın üstündeki girintili alandan küçük bir parça yumurta kabuğu çıkarın (yazılı tarihli). Yumurta kabuğunun üstündeki hava kesesinin yumurtanın dışındaki hava ile temas ettiğinden emin olun, ancak kabuğa çok derin nüfuz etmeyin.
NOT: Üst girinti yapılırken kabuğa çok derin nüfuz edilirse, embriyo ve CAM hasar görebilir ve embriyo kabuktan çıkarıldıktan sonra hayatta kalamaz. Üstteki küçük deliğin yumurtanın içi ve dışı arasında hava teması oluşturması önemlidir. Bu yapılmazsa, prosedürün sonraki adımlarında bir vakum oluşturulacak ve bu da büyük hava kabarcıklarının CAM altında sıkışıp kalmasına neden olacak ve embriyoyu ve TAT'ı işe yaramaz hale getirecektir. Yumurtanın içindeki hava kesesinin konumunu kontrol etmek için, konumu her zaman tam olarak üstte olmadığından ve aynı zamanda yana doğru daha fazla olabileceğinden bir ışık kaynağı kullanılabilir. - Kabuğu yumurtanın 2/3 aşağısındaki ikinci girintiden delmek ve ~2 mL yumurta akı çekmek için 5 mL'lik bir şırınga ve 19 G iğne kullanın (Şekil 2C).
NOT: Embriyoya ve CAM'a zarar verme olasılığını önlemek için iğnenin yumurtanın dibine doğru baktığından emin olun. Bu adım, yumurta içeriğinin çıkarılması için gereken yumurtanın üstünde daha büyük bir hava cebi oluşturur. Adım 1.2.2.3'te girinti yerine yanlışlıkla bir delik oluşturulursa, yumurta akının çekilmesi için bandı iğneyle delin. Delinmeyi başka bir bant parçasıyla yeniden kapatın. - İğneyi çıkarın ve yandaki boşluğu kapatmak için bant kullanın (Şekil 2D).
NOT: Yumurta akının yumurtadan sızmasını önlemek için, iğneyi çıkarmadan önce üst delik bir parmak kullanılarak kapatılabilir. Yumurta akı, bant zaten yerinde iken sızmaya devam ederse, bandın düzgün bir şekilde yapıştığından emin olmak için önce yumurta akını bir parça doku ile çıkarın. - Tartım teknesine yumurta akı ekleyerek şırıngayı boşaltın.
- Yumurtanın üstündeki küçük açıklığı büyütmek için büyük cımbızı kullanın (Şekil 1E) (Şekil 2E). Yumurtanın içine üstteki açıklıktan bakıldığında, embriyo ve TAT görülebilir. Yumurta kabuğunun mümkün olduğunca çoğunu alırken embriyoyu ve TAT'ı bulmaya devam edin (Şekil 2F).
NOT: Embriyonun pozisyonunda maksimum görünürlüğü korumak için yumurtayı hareket ettirmeye devam edin ve kabuğun içindeki CAM. Kabuktaki açıklığın kenarının CAM'den daha alçak olmadığından emin olun. Bunun yanı sıra, iç zara nüfuz etmeyin ve keskin kenarları önleyin. - Açıklığı oluşturduktan sonra, yumurtayı 180 ° çevirin ve yumurtayı, yumurtanın üstündeki oluşturulan açıklık şimdi tabana bakacak şekilde yumurta tutucuya geri yerleştirin. Embriyo yukarı doğru yüzecek ve 1-2 dakika süren alttan görünmez hale gelecektir (Şekil 2G). Bir sonraki adıma geçmeden önce tüm embriyonun ve TAT'ın (tüm damarlar dahil) kaybolduğundan ve sadece yumurta sarısının görülebildiğinden emin olun (Şekil 2H).
NOT: Embriyo 2 dakika sonra hala alttan görülebiliyorsa, yumurtayı 1-2 dakika boyunca saat yönünde çevirin. Bu, embriyonun ve TAT'ın yüzmesine yardımcı olacaktır. - Bandı yan açıklıktan çıkarın. Yumurtanın içinin şimdi alt açıklıktan şişip şişmediğine bakın. Bu durumda, sonraki adıma geçin. Değilse, yumurtadaki vakumu serbest bırakmak için yandaki açıklığı bir kez daha delmek için şırınga üzerindeki iğneyi kullanın. Yumurta sarısı çuvalını delme şansını önlemek için iğne ile yukarı doğru işaret ettiğinizden emin olun. Yumurta alt açıklıktan çıkıntı yapana kadar devam edin.
- Metal tartım teknesi tutucusunda yumurtanın tabanını tartım teknesine yakın tutarken (Şekil 1C,D), küçük cımbızın keskin noktalarından birini kullanarak açıklığın tüm genişliği boyunca zarda nazikçe ama hızlı bir şekilde yatay bir çizik çizik yapın (Şekil 1F) ve yumurta içeriğini yavaşça tartım teknesine bırakın (Şekil 2I).
NOT: Yumurta içeriği dışarı çıkmazsa, şırınga üzerindeki iğneyi kullanarak yan açıklığı tekrar delin ve iğne yukarı bakacak şekilde tekrar delin. - Embriyo tartım teknesinde yana doğru ise, genellikle kendi kendine yukarı çıkar. Bu olmazsa, embriyoyu yeniden konumlandırmak için bir parça kağıt mendil kullanın. Doku kağıdının bir tarafını embriyonun üzerine koyun, kağıt mendil kağıdını diğer uca sürükleyin ve plastik bir Pasteur pipet kullanarak birkaç damla ~ 30 μL PBS (37 ° C) ile doku kağıdını serbest bırakın.
- Kalp atışının hala mevcut olduğundan, CAM damarlarının sağlam olduğundan ve kanama olmadığından ve yumurta sarısı sızıntısı olmadığından emin olarak embriyonun canlı olup olmadığını görsel olarak kontrol edin. Bunlardan biri doğru değilse, embriyoyu ve TAT'ı atın, çünkü uygulanabilir olmayacaktır.
- Embriyo ve TAT'ın 37 ° C'de tutulduğundan ve kurumadığından emin olun, çünkü bu CAM damarlarının bozulmasına neden olur ve sonunda embriyo ölür. Bunu önlemek için, embriyo ve CAM üzerine düzenli olarak ~ 30 μL 37 ° C PBS'lik küçük damlalar koyun.
- 5 günlük inkübe döllenmiş bir yumurta alın ve önceden ısıtılmış metal yumurta tutucuya aktarın (Şekil 1A, B). Yumurtayı aynı yönde tuttuğunuzdan emin olun (yani, üstteki tarih).
- Çalışma alanının hazırlanması
- 6-7 günlük (144-168 saat) yaşlı embriyoların hazırlanması (HH evre 28-32)22
- Çalışma alanının hazırlanması
- Aşamayı bölüm 1.2.1'de açıklandığı şekilde hazırlayın.
- Yumurta içeriğinin yumurta kabuğundan çıkarılması
- Deneyden iki saat önce, 6 ila 7 günlük bir kuluçka yumurtası alın ve yumurtayı inkübatörün içinde 180 ° döndürün, böylece yumurtanın üstü tabana doğru bakacak şekilde döndürülür. 1 saat sonra, yumurtayı orijinal konumuna geri döndürün ve 1 saat daha bekletin.
NOT: Deneyden 2 saat önce yumurtanın döndürülmesi, yumurta içeriğinin kabuktan çıkarılmasını kolaylaştıracaktır. - Döndükten sonra, yumurtayı inkübatörden alın.
- Adım 1.2.2.2'den adım 1.2.2.4'e kadar gerçekleştirin.
- Yumurtanın 2/3 aşağısındaki ikinci girintiden kabuğa nüfuz etmek için 5 mL'lik bir şırınga ve 19 G iğne kullanın ve 5-6 mL yumurta akı arasında geri çekin. İğnenin yumurtanın dibine doğru baktığından emin olun.
NOT: Kullandığımız 5 mL şırınga ile 6 mL'ye kadar geri çekilmek mümkündür, böylece sadece bir penetrasyon gerekir. - İğneyi çıkarın ve yandaki boşluğu kapatmak için bir bant parçası kullanın (Şekil 2D).
- Tartım teknesindeki ultrason jeline yumurta akı ekleyerek şırıngayı boşaltın.
- Yumurtanın üstündeki küçük açıklığı büyütmek için büyük cımbızı kullanın (Şekil 1E) (Şekil 2E). Açıklığı mümkün olduğunca büyütmeye çalışın, ancak kabuktaki açıklığın kenarının CAM'den daha düşük olmadığından emin olun. Bunun yanı sıra, iç zara nüfuz etmeyin ve keskin kenarları önlemeye çalışın.
- Bir şırıngayı, adım 1.3.2.4 sırasında çekilen hacimden ~ 1 mL daha fazla 37 ° C PBS ile doldurun.
- Bandı yan boşluktan çıkarın, doldurulmuş şırınga ile boşluğa nüfuz edin ve kabuğa boşaltın. İğnenin yumurtanın dibine doğru baktığından emin olun.
NOT: Yumurta akı, PBS'den (~1 cP) daha yüksek bir viskoziteye (~ 160 cP) sahip olduğundan, yumurta akının PBS ile değiştirilmesi, yumurta içeriğini kabuktan çıkarırken embriyo ve TAT üzerindeki hem gerginliği hem de stresi azaltır. - İğneyi çıkarın ve boşluğu bir bant parçasıyla hızlı bir şekilde yeniden kapatın (Şekil 2D).
- Yumurtayı 180° çevirin ve yumurtayı, yumurtanın üstündeki oluşturulan açıklık şimdi tabana bakacak şekilde yumurta tutucuya geri yerleştirin. Tüm embriyo ve CAM (tüm damarlar dahil) kaybolana ve sadece yumurta sarısı görünene kadar yumurtayı saat yönünde çevirin.
- Adım 1.2.2.10'u adım 1.2.2.14'e kadar gerçekleştirin.
- Deneyden iki saat önce, 6 ila 7 günlük bir kuluçka yumurtası alın ve yumurtayı inkübatörün içinde 180 ° döndürün, böylece yumurtanın üstü tabana doğru bakacak şekilde döndürülür. 1 saat sonra, yumurtayı orijinal konumuna geri döndürün ve 1 saat daha bekletin.
- Çalışma alanının hazırlanması
- 8 günlük (192 saat) yaşlı embriyoların hazırlanması (HH evre 32-35)22
- Çalışma alanının hazırlanması
- Bir ısıtma plakasını 37 ° C'ye ısıtın.
- Isıtma plakasına metal bir tartım teknesi tutucusu (Şekil 1C,D) ve PBS ile doldurulmuş 10 mL'lik bir Erlenmeyer yerleştirin.
- 170 x 110 x 70 mm veya benzeri sığ bir kap alın ve kabı 1 L 37 ° C PBS ile doldurun.
- Bir tartım teknesini (85 × 85 × 25 mm) 90 mm çapında bir Petri kabına yerleştirin. Petri kabını ve tartım teknesini kabın altına yerleştirin ve tamamen suya batırıldığından emin olun.
- Yumurta içeriğinin yumurta kabuğundan çıkarılması
- Deneyden iki saat önce, 8 günlük bir kuluçka yumurtası alın ve yumurtayı inkübatörün içinde 180 ° döndürün, böylece yumurtanın üstü tabana doğru bakacak şekilde döndürülür. 1 saat sonra, yumurtayı orijinal konumuna geri döndürün ve 1 saat daha bekletin.
NOT: Deneyden 2 saat önce yumurtanın döndürülmesi, yumurta içeriğinin kabuktan çıkarılmasını kolaylaştıracaktır. - Kuluçka makinesinden 8 günlük inkübe edilmiş bir yumurta alın.
- Yumurtayı yatay olarak tutun ve yumurtanın 1/2 aşağısında küçük bir girinti yapmak için büyük cımbızın sivri arkasını kullanın (Şekil 1E). Yumurta kabuğunun etrafında 360° yuvarlak halka deseninde küçük girintiler yapmaya devam edin. Girintiler arasında ~10 mm'lik bir boşluk kullanın.
NOT: Bu işlem sırasında, girintiler arasında küçük çatlaklar oluşmaya başlayabilir. - Kabuğun etrafındaki küçük girintileri oluşturduktan sonra, büyük cımbızın sivri sırtını kullanarak kabuğu iki küçük girinti arasında kırarak daha büyük bir delik açın.
- Yumurtayı 37 °C PBS'ye tamamen batırın ve 5 dakika suya batırın. 5 dakika sonra, yumurtayı kabın içindeki tartım teknesine yakın tutun. Her iki başparmağın üstünü büyük deliğe koyun ve yumurtayı yavaşça açın. Yumurta küçük girintiler boyunca çatlayacaktır.
- Çatlak yumurta kabuğunun etrafında tamamen oluştuğunda, iki yumurta kabuğu parçasını yavaşça ayırmaya çalışın ve yumurta içeriği kabuktan ayrılana kadar iki parçayı hafifçe ileri geri hareket ettirmeye devam edin. Ardından, yumurta içeriğini yavaşça tartım teknesine bırakın.
NOT: İki parça yumurta kabuğunu ileri geri hareket ettirerek, yumurta kabuğuna daha fazla PBS akacak ve bu da yumurta içeriğinin kabuktan ayrılmasına yardımcı olacaktır. Bazen, biraz yumurta akı yumurta kabuğunun içine yapışır. Bu olduğunda, yumurta akını kabuktan ayırmak için cımbızı kullanın. - PBS'den tartım teknesini ve yumurta içeriğini içeren Petri kabını yavaşça kaldırın. PBS'nin dışındayken, fazla PBS'yi çıkarmak için tartım teknesini hafifçe eğin.
- Yumurta içeriğini içeren tartım teknesini metal tartım teknesi tutucusuna yerleştirin ve istediğiniz deney düzeneğine geçin.
- Deneyden iki saat önce, 8 günlük bir kuluçka yumurtası alın ve yumurtayı inkübatörün içinde 180 ° döndürün, böylece yumurtanın üstü tabana doğru bakacak şekilde döndürülür. 1 saat sonra, yumurtayı orijinal konumuna geri döndürün ve 1 saat daha bekletin.
- Çalışma alanının hazırlanması
2. Seçilmiş Uygulamalar
- CAM kaplarına mikrokabarcıkların ve/veya diğer çözeltilerin enjekte edilmesi
- Enjeksiyon kurulumunun hazırlanması
- Bir mikro dövme kullanarak cam kılcal tüplerden cam iğneler çekin (Şekil 3A) veya çekilmiş cam kılcal iğneler satın alın.
- Cam kılcal iğnenin ucu eğimli değilse, iğnenin ucunun küçük bir kısmını kesin. Cam iğneyi mineral yağ ile doldurun ve bir mikro enjeksiyon sistemine yerleştirin. Cam iğnedeki mineral yağda hava kabarcığı olmadığından emin olun.
NOT: Mineral yağ, kullandığımız enjeksiyon sisteminin üreticisinin talimatına göre eklenir. - Çekilen cam kılcal iğneyi mikro enjeksiyon sisteminin izin verdiği ölçüde boşaltın ve cam iğneyi kısmen hava ile doldurun.
NOT: Küçük hava parçası, mineral yağ ve enjekte edilecek çözeltinin karışımını önleyecektir. - İstenilen çözeltinin 10 μL'sini, bu protokol mikrokabarcıklarında, bir parça mumsu film üzerine koyun (Şekil 3B). Birden fazla çözeltiye ihtiyaç duyulursa, pipetleme7'den önce çözeltiler karıştırılabilir.
NOT: İğneyi mikro kabarcıklarla doldurmadan önce, mikro kabarcık damlasını balmumu filmi üzerinde ~ 1 dakika bekletin, böylece mikro kabarcıklar damlanın üstüne yüzer ve konsantre olur. F tipi ısmarlama ultrason kontrast maddesi28 için, bu konsantrasyon adımı, enjekte edilecek mikrokabarcık konsantrasyonunu ~% 30 ile artıracaktır. Tavuk embriyosu kanındaki enjeksiyon sonrası konsantrasyon, 5 günlük embriyolar için 32 x 10 3 mikrokabarcık / μL ve 6 günlük embriyolar için 19 x 103 mikrokabarcık / μL arasında olacaktır. - Cam iğne ucunu mumsu film üzerindeki damlaya yerleştirerek cam iğneyi mikrokabarcık ve / veya başka bir çözelti ile doldurun. Mikro kabarcıkları aspire ederken, mikrokabarcıkla zenginleştirilmiş çözeltiyi aspire etmek için iğne ucunu sıvı damlasının üstüne yerleştirdiğinizden emin olun.
NOT: Mikro kabarcıkları enjekte etmeden önce, cam iğnenin ucunu en yüksek noktasına kaldırın ve ~ 2 dakika bekleyin. Bu, mikro kabarcıkların cam iğnenin ucuna konsantre olmasını sağlayacaktır.
- Enjeksiyon kurulumunun hazırlanması
- CAM kaplarına enjeksiyon
- Enjeksiyondan önce, stereo mikroskop altında CAM'a bakın ve enjekte edilecek en iyi kabı seçin. Her zaman embriyonun damarlarından birine enjekte edin. Bunlar kan akışının embriyoya doğru hareket ettiği damarlardır. Damarlar, oksijenli kan nedeniyle arterlerden daha açık renklidir29. Ek olarak, damarlar, çevresinde arter bulunmayan anterior ve posterior vitelline damarları (yani, Şekil 6A, B'de yıldız işaretleriyle belirtilen daha az dallanmış damarlar) olmak üzere iki istisna dışında her zaman arterin üstündedir.
NOT: Dallardan birine enjekte etmek, enjeksiyon sırasında kan akışının tıkanmasını sınırlayacaktır. İyi enjeksiyon bölgeleri Şekil 6A,B'de ok uçları ile belirtilmiştir. Damar içine enjekte etmek çok önemlidir, çünkü bu, enjekte edilen maddeyi embriyoya doğru akmaya zorlayacaktır. Bunun yanı sıra, artere enjekte etmek, embriyoyu öldürecek cam iğneyi çıkarırken büyük bir kanamaya neden olacaktır. - Cam iğneyi ve embriyoyu, cam iğne ucu ve seçilen damar aynı odak düzleminde ve aynı yön çizgisinde olacak şekilde konumlandırın. İğneyi seçilen damara paralel olarak mümkün olduğunca yatay konumlandırmaya çalışın. İğne ucu damar duvarına temas etmelidir.
NOT: Cam iğneyi mümkün olduğunca yatay konumlandırarak, tüm kabı delme şansı daha düşüktür. - Konumlandırdıktan sonra, yavaşça ilerleyin ve cam iğne ile damar duvarına nüfuz edin. Penetrasyon sırasında, CAM ilk önce cam iğnenin hareketi ile itilecektir. Damar duvarına nüfuz edene kadar cam iğneyi ilerletmeye devam edin.
NOT: Kazara gemi içinden ve içinden delinirse, lümene geri dönmek için iğneyi yavaşça geri çekin. Lümenin içine geri döndüğünde, iğneyi hafifçe yukarı kaldırın ve iğneyi yeniden konumlandırmak için damar boyunca ilerleyin. - Delindikten sonra, ucu kap lümeninin içine daha iyi konumlandırmak için cam iğneyi hafifçe geri çekin ve kap duvarına bağlı olmadığını kontrol etmek için cam iğneyi yana doğru hareket ettirin. Ucun damar lümeninin içine yerleştirildiğini doğrulamak için çözeltinin az bir miktarını yavaşça enjekte edin (Şekil 3C).
- Enjekte edilen çözeltinin kan akışını takip ettiğinden emin olun. Olmazsa, cam iğneyi hafifçe hareket ettirin ve cam iğne doğru şekilde yerleştirilene kadar küçük miktarlarda enjekte etmeye devam edin17.
- İstenilen miktar enjekte edildiğinde, büyük bir kanamayı önlemek için cam iğneyi kapta ~ 15 s bırakın. Ardından, cam iğnenin hafifçe geri çekilmesini sağlamak için cam iğneyi biraz yanlara, yukarı ve aşağı ve birkaç kez ileri geri hareket ettirin.
NOT: Bazı kanamalar normaldir. Her enjeksiyon için yeni bir cam iğne kullanın, çünkü cam iğne kolayca tıkanır ve yumurta akından körelir.
- Enjeksiyondan önce, stereo mikroskop altında CAM'a bakın ve enjekte edilecek en iyi kabı seçin. Her zaman embriyonun damarlarından birine enjekte edin. Bunlar kan akışının embriyoya doğru hareket ettiği damarlardır. Damarlar, oksijenli kan nedeniyle arterlerden daha açık renklidir29. Ek olarak, damarlar, çevresinde arter bulunmayan anterior ve posterior vitelline damarları (yani, Şekil 6A, B'de yıldız işaretleriyle belirtilen daha az dallanmış damarlar) olmak üzere iki istisna dışında her zaman arterin üstündedir.
- Embriyo ve/veya CAM damarlarının mikroskopi ile görüntülenmesi
- Akustik membranlı tutucu hazırlama
- İki paralel 50 μm kalınlığında akustik olarak şeffaf polikarbonat membran26 ile kare plastik bir tutucudan oluşan bir hücre kültürü odasını ele alalım, ayrıca akustik membranlı tutucu olarak da adlandırılır. Her iki bağlantı noktasını da kapakla kapatın.
- İki membrandan birini tutucudan akustik membranla çıkarmak için bir neşter kullanın.
NOT: Membranı çıkarmak için, membranı plastik üzerindeki tutkal çizgisinin hemen yanında kesin. Diğer membranın zarar görmesini önlemek için kenardan kaymamaya dikkat edin. - Küçük bir cam beherde 80-95 °C arasında ısıtarak yarı su çözeltisinde ~15 mL% 2 agaroz hazırlayın. Cam kabı, akan bir soğuk su musluğu altında çözünmüş agaroz çözeltisi ile soğutun.
NOT: Agaroz çok sıcaksa, akustik membranı eritecek ve bu da düz olmayan bir yüzey oluşturacaktır. - Çözelti yaklaşık 37 °C'ye kadar soğutulduğunda, çözeltiyi tutucunun tamamını doldurana kadar akustik membranlı tutucuya yavaşça dökün. Tutucuyu akustik membranla hafifçe eğin, böylece agaroz tabakası plastik çerçevenin içine eşit olarak dağılacaktır (Şekil 4A). Agaroz tabakasının düz olduğundan emin olun ve agarozun oda sıcaklığına ayarlanmasına izin verin.
- Embriyo ve CAM'ın yumurta sarısı çuvalından çıkarılması ve akustik membranlı tutucuya yerleştirilmesi
- Yumurta içeriğini bölüm 1.2, 1.3 veya 1.4'te açıklandığı gibi yumurtadan çıkarın.
- Gerekirse, CAM'a bölüm 2.1.2'de açıklandığı gibi mikro kabarcıklar ve/veya diğer çözelti(ler) enjekte edin.
- 1 L'lik bir Petri kabını ~500 mL 37 °C PBS ile doldurun ve tutucuyu tabağın altına agarozlu akustik membranla yerleştirin. Agaroz tabakasının yukarı baktığından emin olun.
- Yumurta içeriği tartım teknesindeyken, Vitellus membranı olarak da adlandırılan yumurta sarısı çuvalının zarını, tüm CAM'ın etrafına hızlı bir şekilde kesmek için küçük makas kullanın (Şekil 4B). Makası aynı konumda tutun ve daha iyi hassasiyet ve daha fazla hız için kesim yaparken tartım teknesini döndürün.
NOT: İlk kesim yapıldığı andan itibaren yumurta sarısı sızmaya başlayacaktır. Bu, embriyonun ve CAM'ın görünürlüğünü azaltır. CAM'in etrafını 6-7 kesim içinde kesmeye çalışın. Bu 20 saniyeden fazla sürmemelidir. Küçük cımbızlar (Şekil 1F), vitelin membranın kenarını tutmak ve CAM'ın kesilmesini önlemek için kullanılabilir. - Embriyoyu ve CAM'i içeren kesme zarını tartım teknesinden çıkarmak için bir çorba kaşığı kullanın. Kaşığı tartım teknesinden yavaşça kaldırın ve embriyo ve CAM'ı içeren kesme zarının hala kalan yumurta sarısı çuval zarına bağlı olup olmadığını görsel olarak kontrol edin. Bu durumda, ekstra bir kesim yapmak için makası kullanın. Kepçe yaparken, mümkün olduğunca fazla yumurta sarısından kurtulmak için kaşığı hafifçe eğin, ancak kurumasına izin vermeyin. Embriyoyu ve TAT'ı içeren kesme zarını 1 L Petri kabına aktarın, 37 ° C PBS'ye batırın ve kaşığı çıkarın.
- Embriyoyu ve CAM'ı içeren zar 37 ° C PBS'ye batırıldığında, zarın bir kenarını tutmak için küçük cımbızları (Şekil 1F) kullanın ve hala bağlı olan yumurta sarısından kurtulmak için zarın etrafında yavaşça dönün.
- Tüm yumurta sarısı çıkarıldığında, embriyoyu ve CAM'ı içeren zarı hareket ettirmek için küçük cımbızları kullanın ve akustik membranla tutucunun üzerine yerleştirin.
- Embriyoyu ve CAM'i içeren zarı bir köşeye sabitlemek için bir böcek örneği pimi kullanın. CAM'deki damarları delmekten kaçının ve sadece zarı sabitleyin.
- Çapraz olarak zıt köşedeki embriyo ve CAM'ı içeren zarı sabitlemek için ikinci bir böcek örneği pimi kullanın.
- Tutucuyu, embriyoyu ve CAM'ı içeren akustik membranla 37 ° C PBS'den yavaşça kaldırın. PBS'nin çoğundan kurtulmak için tutucuyu hafifçe eğin.
- Embriyoyu ve CAM'i içeren zarı akustik membranlı tutucunun üzerine germek ve eşit olarak dağıtmak için küçük cımbızları kullanın (Şekil 1F) ve zarın geri kalanını sabitleyin. Embriyoyu ve TAT'ı içeren zarın düz olduğundan emin olmak için hafifçe gerildiğinden emin olun (Şekil 4C).
- Akustik membranlı tutucuyu, embriyo ve CAM'ı içeren sabitlenmiş membran ile 37 ° C'de tutulan bir mikroskopi kurulumuna yerleştirin.
- Optik görselleştirmeye izin vermek için embriyo veya TAT üzerindeki ilgili bölgenin üzerine bir kapak kapağı veya akustik ve optik olarak şeffaf bir zar (istenen hedefe ve ultrason kullanımına bağlı olarak veya kullanılmamasına bağlı olarak) yerleştirin (Şekil 4D).
- Akustik membranlı tutucu hazırlama
- Tavuk embriyosunun ve/veya TAT damarlarının ultrasonla görüntülenmesi
- Tavuk embriyosu ve CAM damarlarının yanından ultrason görüntüleme
- Yumurta içeriğini bölüm 1.2, 1.3 veya 1.4'te açıklandığı gibi çıkarın. Ancak, standart bir tartım teknesi kullanmayın. Bunun yerine, akustik olarak şeffaf bir duvara sahip özel yapım bir tartım teknesi kullanın.
NOT: Standart tartım teknesi, tartım teknesinin bir tarafının kesilmesi ve yerine epoksi yapıştırıcı kullanılarak yapıştırılmış polyester folyo bir pencere ile değiştirilerek ayarlanmıştır. - Tercih edilen ultrason dönüştürücüsünü 37 °C'lik bir su banyosuna batırın ve istenen noktada gerekli bekleme mesafesi ile konumlandırın.
- Tartım teknesini su banyosuna, şeffaf duvar dönüştürücüye bakacak şekilde yerleştirin. Tartım teknesinin transdüserle aynı seviyede olacak kadar derin olduğundan emin olun, ancak tartım teknesine su girmesini önleyin (Şekil 5A).
- İstenirse, embriyonun veya CAM damarlarının tepesine mikroskop veya lazer gibi başka bir kurulum ekleyin (Şekil 5A).
- Yumurta içeriğini bölüm 1.2, 1.3 veya 1.4'te açıklandığı gibi çıkarın. Ancak, standart bir tartım teknesi kullanmayın. Bunun yerine, akustik olarak şeffaf bir duvara sahip özel yapım bir tartım teknesi kullanın.
- Akustik girişim olmadan embriyo ve CAM damarlarının üstünden ultrason görüntüleme
- 2 L'lik bir beher bardağını 37 °C PBS ile doldurun. 2 L beher camının altına 500 mL'lik bir beher camı baş aşağı yerleştirin. 500 mL beher camının içinde havayı önleyin.
NOT: 500 mL beher camı, yumurta içeriğini içeren tartım teknesini PBS yüzeyine yaklaştırmak içindir. Beheri diğer boyutlardaki nesnelerle değiştirerek, dönüştürücü ile yumurta içeriği arasındaki mesafe değiştirilebilir. - Doldurulmuş 2 L beher bardağını 500 mL beher bardağı ile 37 °C su banyosuna yerleştirin.
- Yumurta içeriğini bölüm 1.2, 1.3 veya 1.4'te açıklandığı gibi çıkarın.
- Yumurta içeriğini 37 °C PBS ile ıslatın ve embriyoyu şeffaf sarılma filmi ile örtün. Bu, embriyoyu aynı pozisyonda tutmak ve dönmesini veya yüzmesini önlemek için yapılabilir.
NOT: Yumurta içeriğini PBS ile ıslatarak, daha az yapışkan hale gelir ve bu da yumurta içeriğinin şeffaf sarılma filmi ile kaplanmasını kolaylaştırır. - Tartım teknesini yumurta içeriğiyle birlikte 90 mm çapında bir Petri kabına yerleştirin ve Petri kabını yavaşça PBS'ye batırın (Şekil 5B).
NOT: Petri kabının yan taraflarında birbirine zıt iki kelepçe kullanmak, Petri kabının suya batırılmasını kolaylaştırır. - Ultrason dönüştürücüsünü istenen bekleme mesafesi ile konumlandırın.
- 2 L'lik bir beher bardağını 37 °C PBS ile doldurun. 2 L beher camının altına 500 mL'lik bir beher camı baş aşağı yerleştirin. 500 mL beher camının içinde havayı önleyin.
- Hareketli bir dönüştürücü ile tavuk embriyosunun ve CAM damarlarının ultrason görüntülemesi
- Yumurta içeriğini bölüm 1.2, 1.3 veya 1.4'te açıklandığı gibi çıkarın.
- Çözeltiyi küçük bir cam beherde 80-95 ° C arasında ısıtarak yarı suda% 2'lik bir agaroz çözeltisi hazırlayın. Cam kabı, akan soğuk su tırnağının altında çözünmüş agaroz çözeltisi ile soğutun.
- Yaklaşık 1 mm kalınlığında bir agaroz pedi oluşturmak için agaroz çözeltisini düz bir kaba dökün. Tamamen soğutulup ayarlandığında, agarose pedini bir neşter kullanarak istenen boyuta kesin.
NOT: Ultrason dönüştürücüsünün doğru çalışması için gerekli olan istenen odak mesafesini elde etmek için agaroz pedinin kalınlığı değiştirilebilir. - Agaroz pedi embriyonun ve TAT üzerine yerleştirin (Şekil 5C). Agaroz pedi ile dönüştürücü arasında ince bir PBS tabakası oluşturmak için agaroz pedinin üstüne ~ 30 μL 37 °C PBS'lik birkaç damla ekleyin.
NOT: PBS kullanmak, dönüştürücünün agaroz pedine yapışmasını önleyecektir. Bu, örneğin, üç boyutlu bir tarama yapmak için iki boyutlu bir dönüştürücüyü mekanik olarak hareket ettirmek için bir motor kullanıldığında faydalıdır (Şekil 9B)11. Transdüserin taşınması gerekmediğinde, PBS ayrıca ultrason jeli ile değiştirilebilir. - İstediğiniz ultrason dönüştürücüsünü konumlandırın.
- Tavuk embriyosu ve CAM damarlarının yanından ultrason görüntüleme
Sonuçlar
Bu protokolde, kuluçkanın 5-8. günlerinde yumurta içeriğini kabuktan çıkarmak için üç yöntem tarif ediyoruz (HH 26-3522). Şekil 6, kabuktan çıkarıldıktan sonra tartım teknelerindeki yumurta içeriğini göstermektedir. 5 günlük embriyo ve TAT (Şekil 6A) bölüm 1.2'de açıklanan yöntem kullanılarak çıkarıldı. 6 ve 7 günlük embriyolar ve TAT (Şekil 6B,C) bölüm 1.3'te açıklanan yöntem kullanılarak çıkarıldı. 8 günlük embriyo ve TAT (Şekil 6D) bölüm 1.4'te açıklanan yöntem kullanılarak çıkarıldı. Embriyo veya TAT üzerinde herhangi bir kanama veya hasar gözlenemez, bu da bu yöntemlerin embriyoya veya CAM damarlarına zarar vermeden yumurta içeriğini kabuktan güvenli bir şekilde çıkarmak için kullanılabileceğini gösterir. Doğru uygulandığında, 5 günlük embriyolar için yöntem, tüm prosedürlerin% 90'ında canlı bir embriyo ve sağlam bir TAT sağlayacaktır. Canlılık oranı, yumurta kabuğundan başarıyla çıkarılan toplam döllenmiş yumurta sayısına dayanmaktadır. İkinci yöntemle, 6 ve 7 günlük inkübe yumurtalar için, canlı bir embriyo ve bozulmamış CAM şansı 6 günlük için yaklaşık% 75 ve 7 günlük için yaklaşık% 50'dir. 8 günlük embriyolar için tanımlanan üçüncü yöntemle, canlı bir embriyo ve sağlam bir TAT şansı %60 civarındadır. 5 ve 8 günlük embriyolar arasındaki gelişim aşamalarındaki farklılıklar, Hamburger ve Hamilton22 ile aynı fikirde olduğu gözlemlenebilir. Hem embriyonun büyüklüğü hem de CAM damarlarının karmaşıklığı gelişim sırasında artar (Şekil 6A-D). Şekil 6C, yumurta içeriğinin üstünde, embriyo ve TAT'ın Şekil 5C'de gösterilen ultrason kurulumu kullanılarak görüntülenmesini sağlayan ince bir agaroz yamasını göstermektedir. Yumurta içeriği kabuktan çıkarıldıktan sonra embriyonun kalp atışı çıplak gözle görülebilir. Bu ex ovo embriyolarının kalp atış hızı, 5. günde dakikada 183 atımda (bpm) ovo embriyolarında, 8. günde ~ 208 bpm'ye kadarbenzerdir. Nemlendirildiğinde ve 37 ° C'de tutulduğunda, embriyo deneysel ultrason kurulumlarında bu kalp atış hızını ~ 5 saat koruyacaktır.
Daha önce tarif edilen üç yöntem sırasında çoklu komplikasyonlar ortaya çıkabilir. Şekil 7A, embriyoyu ultrason görüntüleme için uygun hale getirmeyen TAT altında sıkışmış havayı göstermektedir ve hava kabarcıklarının basıncı da embriyoya ve / veya CAM'a zarar verebilir. Bu sorun, yumurta içeriğini kabuktan çıkarırken kabuğun içindeki hava kesesi kabuğun dışındaki hava ile temas etmediğinde ortaya çıkar. Şekil 7B, görüntünün sağ üst köşesindeki yumurta sarısı çuvalından küçük bir yumurta sarısı sızıntısını göstermektedir. Bu, yumurta sarısı çuvalı kabuğun keskin kenarlarından zarar gördüğünde veya yumurta sarısı çuvalı cımbız tarafından delindiğinde yumurta içeriğini kabuktan çıkarırken ortaya çıkabilir. Yumurta sarısının sızması, embriyonun ve CAM damarlarının görünürlüğünü etkileyebilir. Şekil 7C, bir hava kabarcığının CAM altında sıkıştığı bir embriyoyu göstermektedir. Bu bazen embriyonik gelişimde ortaya çıkar. Oluşabilecek bir diğer komplikasyon ise damarların zarar görmesidir. Bu hasar, yumurta içeriği kabuktan çıkarılırken veya bir enjeksiyon yapılırken oluşturulabilir (Şekil 7D). Bunun yanı sıra, embriyo ve damarlar da zamanla kuruyabilir (Şekil 7E). Bu, yumurta içeriği PBS ile serpilmediğinde ortaya çıkar. Embriyonun kuruması, embriyonun yaşayabilirliğini etkileyen masif kılcal tıkanıklıklara neden olabilir (Şekil 7F). Masif kılcal tıkanıklıklar, gelişim sırasında veya embriyonun kalp atışı stabil olmadığında da ortaya çıkabilir.
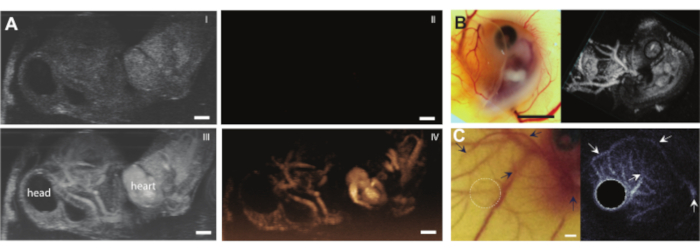
Yumurta içeriği herhangi bir komplikasyon olmadan kabuktan çıkarıldıktan sonra, embriyoya, örneğin mikrokabarcıklar gibi ultrason kontrast maddeleri enjekte edilebilir (Şekil 3C). Şekil 8, enjeksiyon sırasında kan damarının lümeninde dolaşan mikro kabarcıkları göstermektedir. Bu mikro kabarcıklar kan akışıyla birlikte taşınır ve birkaç saat boyunca kan dolaşımında kalır (Ek Video 1). Bu mikrokabarcıkların dolaşımdaki varlığı, farklı tipte CEUS ve ilaç dağıtım deneyleriyapma imkanı yaratır 7,11,12. CAM, üç örnek gösterdiğimiz yeni ultrason kontrast algılama yöntemlerini araştırmak için idealdir. Şekil 9A, mikrokabarcık enjeksiyonundan önce ve sonra B-Mode ve CEUS'ta 6 günlük bir tavuk embriyosunun yüksek frekanslı ultrason subharmonik görüntülemesini göstermektedir. Burada, CAM damarlarına 5 μL ultrason kontrast maddesi enjekte edildi ve MS250 problu (30 MHz iletim ve 15 MHz alma frekansı,% 10 güç) klinik öncesi bir hayvan ultrason makinesi ile görüntüleme yapıldı. Mikrokabarcık enjeksiyonundan önce, B-Mode görüntülerinde embriyonik kalbin içinde kontrast zaten görülebilir (Şekil 9A-I). Bu fenomen, kuş kırmızı kan hücresinde ultrason görüntülemede kanın kontrastını artıran bir çekirdeğin varlığından kaynaklanmaktadır 5,31. Mikrokabarcıkların eklenmesi, hem B-Mode hem de CEUS görüntülemede embriyonun kontrastını ve görünürlüğünü arttırdı. Şekil 9B, 6 günlük bir embriyonun ve çevresindeki damarların optik ve yüksek frekanslı 3D subharmonik görüntüsünü göstermektedir. TAT 5 μL ultrason kontrast maddesi ile enjekte edildi ve görüntüleme MS550s problu (iletim frekansı 40 MHz, pik negatif basınç ~ 300 kPa) bir preklinik hayvan ultrason makinesi ile gerçekleştirildi. Bu sonuçlar, bir kontrast madde ile kombine edilen CEUS görüntülemenin, yüksek frekanslı 3D subharmonik görüntüler oluşturmak ve embriyonun dışındaki kan damarlarını görüntülemek için de kullanılabileceğini göstermektedir. Şekil 9C, 6 günlük bir embriyonun CAM mikrodamarlarının özel bir probu ile yapılan optik bir görüntü ve ultraharmonik bir intravasküler ultrason (IVUS) görüntüsünü göstermektedir (26 MHz iletim ve 39 ve 65 MHz alma frekansı). CAM damarlarına 4 ± 1 μL ultrason kontrast maddesi enjekte edildi. Optik görüntü ve IVUS görüntüsü, aynı embriyodan ve karşılık gelen damar ağlarını gösteren aynı ilgi bölgesinden gelmektedir.
Tavuk embriyosu ve CAM damarları, bir örnek gösterdiğimiz ultrason aracılı ilaç dağıtımını araştırmak için de kullanılabilir. Yumurta sarısı görüntüleme sırasında ışık yolunu tıkadığından, embriyo ve CAM damarlarındaki ilaç dağıtımını optik olarak araştırmak için yumurta sarısı çuvalının çıkarılması gerekir. Bu çalışma için embriyo ve TAT bölüm 2.2'de açıklandığı gibi embriyo ve TAT içeren zar yumurta sarısı çuvalından ayrılarak mikroskobik görüntüleme için hazırlanmıştır (Şekil 4C). Bu embriyolarda, kalp atış hızı 80 bpm civarında sabittir ve embriyolar 37 ° C7'de tutulduğunda 2 saate kadar canlı kalır. Şekil 10, TAT damarlarının endotel hücrelerinde ultrason ve mikrokabarcık aracılı ilaç dağıtım çalışmasını göstermektedir. αvβ 3-antikorları kullanılarak damar duvarına hedeflenen ve floresan boya DiI 7 ile boyanan lipit kaplı mikrokabarcıklar CAM damarlarına enjekte edildi (Şekil 10A, C). CAM damar endotel hücre çekirdekleri Hoechst 33342 (Şekil 10B) ile boyandı ve sonoporasyonu görselleştirmek için model ilaç Propidium İyodür (PI) kullanıldı7. Her iki boya da mikro kabarcıklarla aynı anda enjekte edildi. Ultrason tedavisi sonrasında (1 MHz, 200 kPa pik negatif basınç, 1000 döngülük tek patlama), hedeflenen mikrokabarcıklara en yakın çekirdeklerde PI alımı gözlendi (Şekil 10D). Bu, hedeflenen mikrokabarcıkların ultrason kaynaklı salınımlarının endotel hücre zarında bir gözenek oluşturabildiğini göstermektedir.
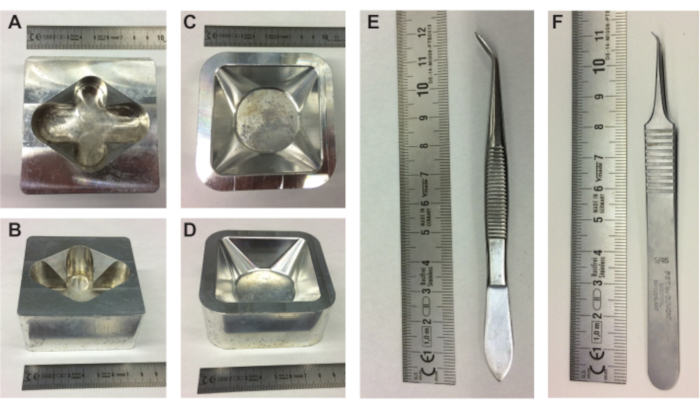
Şekil 1. Embriyo hazırlama ekipmanları. (A-B) metal yumurta tutucunun üstten ve yandan görünümü ve (C-D) metal tartım teknesi tutucusunun üstten ve yandan görünümü. (E-F) cımbızın yumurta içeriğini kabuktan çıkarması gerekiyordu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
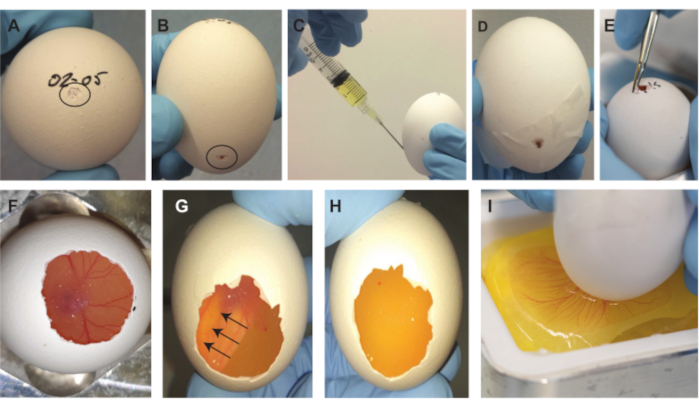
Şekil 2. Embriyo çıkarma prosedürü. (A) Yumurtanın üstünde, siyah daire ile gösterilen küçük girinti. (B) Siyah daire ile gösterilen, yumurtanın 2/3 aşağısında küçük girinti. (C) ~2 mL yumurta akının çekilmesi. (D) Yan tarafta bant ile kapatılmış boşluk. (E) Yumurtanın üstündeki küçük açıklığın büyütülmesi. (F) Embriyo, kabuğun bir kısmı çıkarıldıktan sonra görünür hale gelir. (G-H) Yumurtayı 180 ° döndürdükten sonra, embriyo yukarı doğru yüzer ve görünmez hale gelir (oklar embriyonun hareket yönünü gösterir). 1-2 dakika sonra, embriyo alttan görünmez. (I) Membran çizildikten sonra, yumurta içeriği tartım teknesine düşer. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
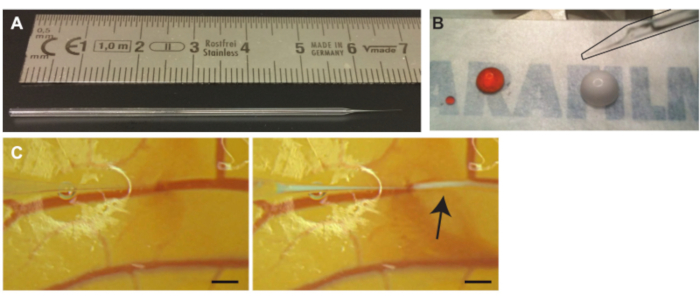
Şekil 3. CAM kaplarına mikrokabarcıkların enjeksiyonu. (A) Cam kılcal iğne. Enjeksiyondan önce aspirasyondan önce cm. (B) Propidium iyodür (PI) çözeltisi (sol damla) ve mikrokabarcıklar (sağ damla ) cinsinden ölçek. İğne (siyah renkle özetlenmiş) sağ üst köşede (C) Mikrokabarcık enjeksiyonunda görülebilir. Kılcal iğne ucu, damarlardan birinin lümeninin içine yerleştirilir (solda). Bir okla gösterilen beyaz bulut olan mikro kabarcıklar enjekte edilir ve kan dolaşımını takiben dağılır (sağda). Ölçek çubuğu 1 mm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
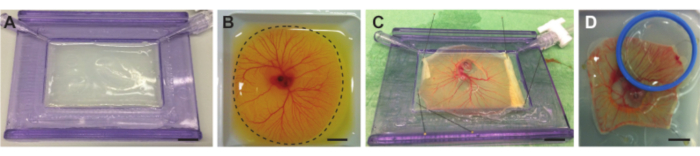
Şekil 4. Embriyo ve TAT'ın yumurta sarısı çuvalından çıkarılması ve akustik membranlı tutucuya yerleştirilmesi. (A) Agaroz tabakası ile doldurulmuş akustik membranlı tutucu. (B) Tavuk embriyosu ve CAM kabı, kesimden önce tartım teknesinde. Noktalı çizgi, CAM'ın etrafındaki kesme çizgisini gösterir. (C) Tavuk embriyosu ve TAT, yumurta sarısından ayrılır ve akustik membran üzerine sabitlenir. (D ) CAM'ın üzerine yerleştirilmiş bir tutucuda (mavi) akustik ve optik olarak şeffaf bir zar ile sabitlenmiş tavuk embriyosu. Tutucu yarı su ile doldurulabilir, böylece bir su daldırma hedefi kullanılabilir. Tüm ölçek çubukları 1 cm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5. Tavuk embriyosu ve CAM ultrason görüntüleme için farklı kurulumlar. (A) Yandan ultrason görüntüleme için kurulum. Tavuk embriyosu, akustik olarak şeffaf bir duvara sahip özel olarak ayarlanmış bir tartım teknesine yerleştirildi ve 37 ° C'lik bir su banyosuna yerleştirildi. Ultrason transdüseri sol (a) tarafta, akustik olarak şeffaf duvarın yanında ve lazer (b) fotoakustik görüntüleme için üstte konumlandırıldı. (B) Üstten ultrason görüntüleme için kurulum. Embriyo ve CAM, 37 ° C'lik bir su banyosuna yerleştirilen bir PBS kabına batırıldı. Kesikli anahat, içinde 500 mL cam beher (b) bulunan 2 L cam beheri (a) gösterir. (C) Hareketli bir dönüştürücü ile üstten ultrason görüntüleme için kurulum. Transdüser ve agaroz yüzeyi arasında bağlantı olarak ince bir PBS tabakası ile embriyonun üzerine ince bir agaroz pedi (noktalı çizgi) yerleştirildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
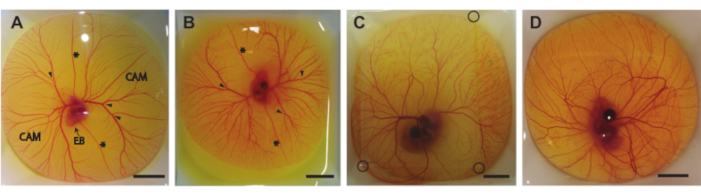
Şekil 6. Kabuğun dışındaki yumurta içeriği. (A) 5 günlük inkübasyondan sonra kabuktan alınan yumurta içeriği. Korioalantoik membran (CAM), embriyo gövdesi (EB), ön ve arka vitelin damarlar (*) ve enjeksiyon için uygun bölgeler (ok uçları) belirtilir. (B) 6 günlük inkübasyondan sonra kabuktan alınan yumurta içeriği. Ön ve arka vitelin damarlar (*) ve enjeksiyon için uygun bölgeler (ok uçları) belirtilir. (C) 7 günlük inkübasyondan sonra kabuktan alınan yumurta içeriği. Ultrason görüntülemeye izin vermek için üstüne bir agaroz yaması yerleştirilir. Agaroz yamasının köşeleri siyah dairelerle gösterilir. (D) 8 günlük inkübasyondan sonra kabuktan alınan yumurta içeriği. Tüm ölçek çubukları 1 cm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
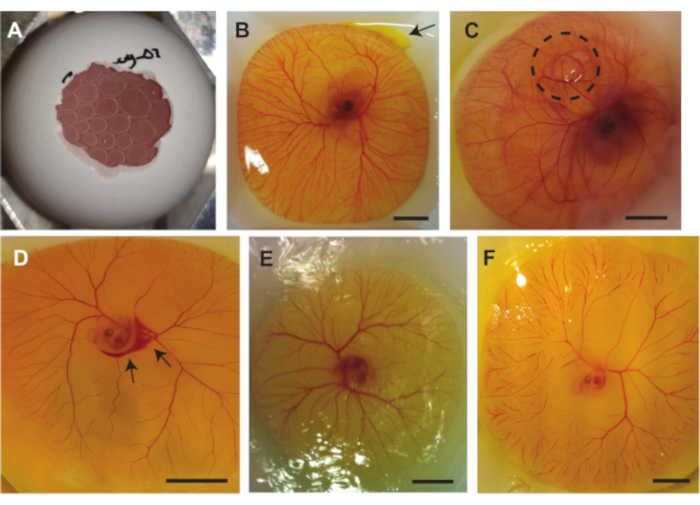
Şekil 7. Tavuk embriyosu ve TAT modeli ile yapılan işlemler sırasında oluşabilecek komplikasyonlar. (A ) Yöntem 1.2 (5 günlük embriyo) veya 1.3 (6 ila 7 günlük embriyo) kullanılarak yumurta içeriğini kabuktan çıkarırken TAT altında sıkışan hava kabarcıkları. (B) Sağ üstte bir okla belirtilen küçük yumurta sarısı sızıntısı (6 günlük embriyo). (C ) CAM altında sıkışıp kalmış, siyah noktalı daire (7 günlük embriyo) ile gösterilen hava. (D) Siyah oklarla belirtilen kanama (5 günlük embriyo. (E) Kurutulmuş embriyo ve TAT (5 günlük embriyo). (F) Masif kılcal tıkanıklıklar (5 günlük embriyo). Tüm ölçek çubukları 1 cm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
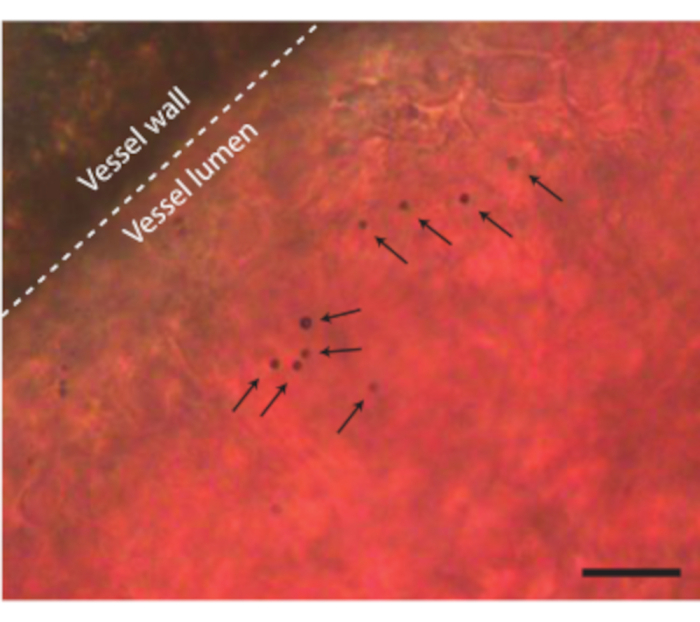
Şekil 8. CAM kan damarındaki mikrokabarcıklar. Damar duvarı noktalı bir çizgi ile gösterilir ve tek mikro kabarcıklar oklarla gösterilir. Ölçek çubuğu 20 μm'yi temsil eder. İlgili mikroskopi kaydı Ek Video 1'de bulunabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Şekil 9. Tavuk embriyolarında ve CAM damarlarında kontrastlı ultrason görüntüleme. (A) Üstünde bir agaroz yaması bulunan 6 günlük bir embriyonun B-Mode (I, III) ve gerçek zamanlı subharmonik (II, IV) görüntülerinin (MS250 problu klinik öncesi hayvan ultrason makinesi, 30 MHz iletim ve 15 MHz alma frekansı,% 10 güç) maksimum yoğunlukta projeksiyonu. Üst görüntüler (I, II), 5 μL ultrason kontrast maddesi enjeksiyonundan önce ve sonra alt (III, IV) sonuçları gösterir. Ölçek çubuğu 1 mm'yi temsil eder. Bu görüntü, Daeichin ve ark. 201511 (B) Optik (solda) ve üstte bir agaroz yaması bulunan 6 günlük bir tavuk embriyosunun 3D subharmonik görüntülemesinin (sağda) izniyle değiştirilmiştir. CAM damarlarına 5 μL ultrason kontrast maddesi enjekte edildi ve görüntüleme yüksek frekanslı bir prob ile gerçekleştirildi (MS550s problu preklinik hayvan ultrason makinesi, iletim frekansı 40 MHz, pik negatif basınç ~ 300 kPa, preklinik hayvan ultrason makinesi 3-D modunda işlendi). Ölçek çubuğu 5 mm'yi temsil eder. Bu görüntü Daeichin et al. 201511'in izniyle değiştirilmiştir. (C) 6 günlük embriyonun TAT mikrovaskülatürünün ultraharmonik intravasküler ultrasonunun (IVUS) (sağda) optik görüntüsü (solda) ve ortalama yoğunluk projeksiyonu. CAM damarlarına 4 ± 1 μL kontrast madde enjekte edildi. Ultraharmonik IVUS görüntüleme özel bir IVUS probu ile yapıldı (iletim frekansı 35 MHz, pik negatif basınç 600 kPa). Her iki görüntü de aynı embriyodan ve ilgi alanından yapılmıştır. Oklar, iki görüntüdeki karşılık gelen gemileri gösterir. Ölçek çubuğu 1 mm'yi temsil eder. Bu görüntü Maresca et al. 201412'nin izniyle değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
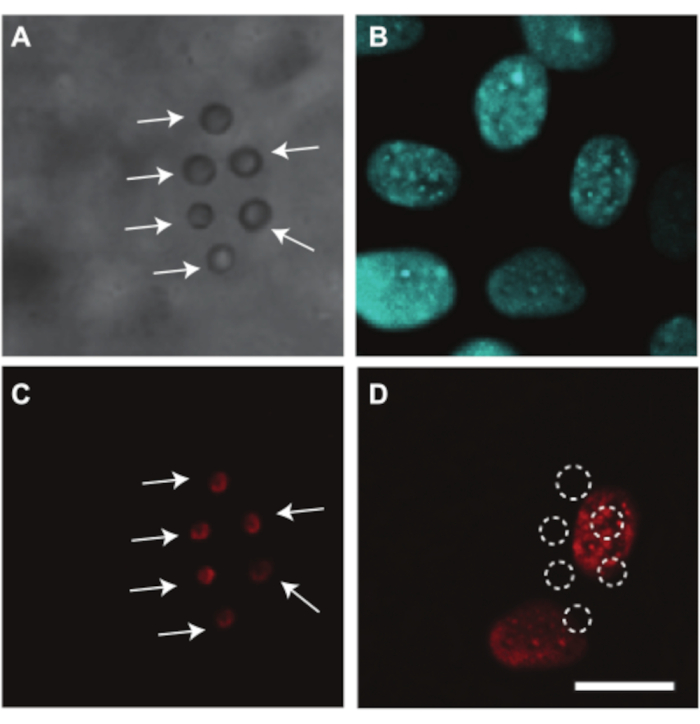
Şekil 10. 6 günlük embriyoda TAT damarı endotel hücrelerine ilaç verilmesi. (A) Ultrason tedavisinden önce damar duvarına yapışan beyaz oklarla gösterilen altı αvβ3 hedefli mikro kabarcığın parlak alan görüntüsü. (B) Endotel hücre çekirdekleri ultrason tedavisinden önce floresan olarak boyanmıştır. (C) Ultrason tedavisinden önce beyaz oklarla gösterilen lekeli hedefli mikro kabarcıkların floresan görüntüsü. (D) Ultrason tedavisinden sonra model ilaç propidium iyodürünün (PI) hedeflenen mikrokabarcıkların altındaki hücre çekirdeklerine alımı (1 MHz, 200 kPa tepe negatif basınç, 1000 döngülük tek patlama). Ölçek çubuğu 10 μm'yi temsil eder ve tüm görüntülere uygulanır. Bu görüntü Skachkov et al. 20147'nin izniyle değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
EK DOSYALAR
Ek Video 1. CAM kan damarındaki mikrokabarcıklar. Ölçek çubuğu 20 μm'yi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, kontrastlı ultrason görüntüleme ve mikrokabarcık aracılı ilaç dağıtımını incelemek için 5 ila 8 günlük tavuk embriyolarının ve bunların TAT'ının in vivo bir model olarak nasıl elde edileceği ve kullanılacağına dair üç yöntemi açıklamaktadır. 5 günlük (bölüm 1.2) ve 6 ila 7 günlük (bölüm 1.3) embriyoları kabuktan çıkarmak için en kritik adımlar şunlardır: 1) yumurta akını çekmeden önce yumurtanın üstündeki küçük deliğin tüm yumurta kabuğundan hava kesesine girmesini sağlayın; 2) kabuktaki büyük açıklık için pürüzsüz kenarlar oluşturun. 8 günlük embriyoları kabuktan çıkarma yöntemi için (bölüm 1.4) en kritik adımlar şunlardır: 1) Yumurta boyunca güzel bir çatlak oluşturmak için yeterli sayıda girinti yapın; 2) Yumurtayı PBS'ye batırılmış halde tutun. Tüm yöntemlerde embriyo canlılığını sağlamak için yumurtayı ve içeriğini 37 °C'de tutmak önemlidir. Ek olarak, bir CAM arterine enjekte etmekten kaçının. Çalışmalar sırasında embriyonun kalp atış hızının görsel olarak izlenmesi, embriyonun canlılığını sağlamak için önerilir. Embriyonun kesin gelişim aşamasını doğrulamak için, Hamburger & Hamilton22 endikasyonu kullanılabilir.
Embriyo, CAM ve yumurta sarısı çuvalının zarar görmesini önlemek önemlidir. Bu hasar, embriyo ve CAM'ın yaşayabilirliğini, kan akışını ve görünürlüğünü etkileyebilir. Ek olarak, yumurta sarısı çuvalının hasar görmesi ve sonuç olarak membranın düşük sertliği, CAM kaplarına enjeksiyonu imkansız hale getirir. 5 günlük bir embriyonun nispeten küçük bir hava kesesi vardır, bu nedenle kabukta yumurta içeriğinin çıkarılabileceği yeterince büyük bir delik açabilmek için 2 mL yumurta akının çekilmesi gerekir. Sonuç olarak, yumurta kabuğu ve embriyo arasında daha fazla boşluk yaratılır. Yumurta akının çekilmesinden sonra, bir bant parçasının iğnenin girdiği deliği kapatması gerekir. Yumurta akı hala dışarı sızıyorsa, başka bir bant parçası uygulayın. Bunun yanı sıra, yan taraftaki deliğe bant uygulanması, 1.2.2.8 adımında büyük delik oluşturulduğunda yumurta içeriğinin kendi ağırlığı nedeniyle düşmesini önleyen yumurtanın içinde bir vakum oluşturur. Embriyo veya CAM'a verilen hasar, yumurta kabuğunun kenarı çok keskin olduğunda veya yumurta içeriği tartım teknesine çok titizlikle düştüğünde de ortaya çıkabilir, bu nedenle yumurta kabuğu tartım teknesine çok yakın tutulmalıdır. Gelişimin 5. ve 6. günleri arasında, CAM kabuk zarı32'ye bağlanmaya başlar. Bu ataşman, yumurta içeriğini yumurta kabuğundan çıkarırken embriyoya ve TAT'a zarar verme riskini artırır. PBS enjeksiyonundan sonra yumurtayı 6 ila 7 günlük bir kuluçka yumurtası için veya 8 günlük inkübe edilmiş bir yumurta için tarif edildiği gibi PBS dolu bir kapta açarak, hasar riski azaltılır. Bir CAM damarına enjeksiyon ile ilgili olarak: ilk enjeksiyon başarısız olursa, hasar küçükse veya başka bir CAM damarındaysa, aynı damarda daha yukarı yönde ikinci bir enjeksiyon yapılabilir. Embriyo ve TAT'ın yumurta sarısından ayrılması, embriyoyu ve CAM damarlarını optik olarak şeffaf hale getirir. Sonuç olarak, embriyo birincil besin kaynağını kaybeder33. Bu besin kaybı, hala yumurta sarısı30 ile temas halinde olan 6 günlük bir embriyo için ~ 190'a kıyasla 80 bpm'lik gözlemlenen düşük kalp atış hızı ve bu ayırma prosedüründen sonra 2 saatlik azalmış hayatta kalma süresi için bir açıklama olabilir. Azalan kalp atış hızında ve hayatta kalma süresinde rol oynayabilecek bir diğer faktör, yumurta sarısı ile ayrılmış embriyo ve CAM damarlarını 37 ° C'de tutmanın zorluğudur. Bir mikroskop aşaması inkübatörü yardımcı olabilir. Buna ek olarak, CAM'ın yumurta sarısından ayrılması muhtemelen membran gerginliği azaldığı için dokuda mekanik değişikliklere yol açar. Düşük membran gerginliği, daha düşük bir kalp atış hızına yol açan artan bir iç damar kesme hızına neden olabilir.
Exovo tavuk embriyosu ve CAM damarları, kontrastlı ultrason görüntüleme ve mikrokabarcık aracılı ilaç dağıtım çalışmaları için sadece kısa süreli gözlemler de dahil olmak üzere in vivo model gibi bazı sınırlamalara sahiptir. 5. günde 100±23 μL ve 6. günde 171±23 μL'lik küçük kan hacminedeniyle, maksimum ~5 μL hacim enjekte edilebilir. Gelişimin sonraki aşamalarında (7. gün ve üstü), damar sertliği artar ve yumurta sarısı elastikiyeti azalır. Bu, yaşlı embriyolarda başarılı bir enjeksiyonu zorlaştırabilir. Mikrokabarcıklar enjekte edildikten sonra, saatlerce dolaşırlar, çünkü tavuk embriyosu bu aşamada tam olarak gelişmiş bir bağışıklık sistemine sahip değildir35. Bu nedenle, mikrokabarcıklar insanlarda olduğu gibi ~ 6 dakika içinde temizlenmez 36,37 bağlanmamış hedefli mikro kabarcıkların temizlenmesi için 5-10 dakikalık bir bekleme süresi ile tipik ultrason moleküler görüntüleme çalışmaları yapılır 38 mümkün değildir. Mikrokabarcıkları hedeflemek için, kuş endotel hücrelerine bağlanabilen uygun ligandların, anjiyogenez belirteci için daha önce tarif edildiği gibi kullanılması gerekir αvβ37. Bu model için göz önünde bulundurulması gereken diğer hususlar, yaşlı embriyolarda embriyo ve CAM damarlarını yumurta sarısından ayırmanın zorluğunun artması (> 8 gün) ve insanlara kıyasla ~% 20 39'luk daha düşük hematokrittir. İkincisi, mikro kabarcık salınımlarını etkileyebilir, çünkü mikrokabarcık salınımlarının daha viskoz bir ortamda sönümlendiği bilinmektedir40. CAM arterleri CAM damarlarından daha az oksijenlidir41,42. Bu fark, örneğin kan oksijenasyonunun fotoakustik görüntülemesini incelerken dikkate alınmalıdır.
Burada açıklanan yöntemler, yumurta içeriğinin, ultrason görüntüleme veya ilaç dağıtım çalışmasının yapıldığı gün, tipik olarak inkübasyonun 5 ila 8. günlerinde yumurta kabuğundan çıkarılmasına izin verir. Bu, yumurta içeriğinin 3 günlük bir inkübasyondan sonra kabuktan çıkarıldığı ve ex ovo kültürü 18,20,21 olarak daha da geliştirildiği mevcut yöntemlerden farklıdır. Avantajları, yumurta kabuğundan çıkarılan 3 günlük embriyolar için ~% 50'ye kıyasla 5 günlük için% 90, 6 gün için% 75, 7 günlük için% 50 ve 8 günlük inkübe yumurtalar için% 60'lık daha yüksek bir hayatta kalma oranıdır ve ayrıca inkübe edilmiş ex ovo1,18 kültür sırasında antibiyotiklerden kaçınma 18, ex ovo kültürü için 20 ve büyük steril inkübatör. 6-8 günlük embriyoların hayatta kalması daha düşüktür, çünkü TAT kendisini kabuk21'e bağlamaya başlar ve bu da CAM zarını ekstraksiyon sırasında yırtılmaya daha yatkın hale getirir. Embriyonun CAM formu ile ayrılması, yumurta sarısı ve CAM'ın optik olarak şeffaf hale getirilmesi de açıklanmaktadır.
Yumurta içeriğini farklı kurulumlara yerleştirerek, tavuk embriyosu ve TAT, IVUS, fotoakustik, 2D ve 3D'de ultrason kontrast maddeleri olmadan veya bunlarla birlikte çok sayıda ultrason görüntüleme çalışması için kullanılabilir. Odak noktası, yeni ultrason darbe şemaları geliştirmek veya yeni dönüştürücüleri test etmek olabilir. Bunun yanı sıra, model yeni ultrason kontrast maddelerini ve akış altındaki kan damarlarındaki davranışlarını araştırmak için de kullanılabilir. Mikrokabarcık aracılı ilaç verme mekanizmasıhala bilinmediğinden, in vivo CAM modelinin kullanımı, hücresel yanıtla ilgili olarak mikrokabarcık davranışını inceleyerek mekanizmanın aydınlatılmasına yardımcı olabilir. Son olarak, TAT damarlarının ksenograft tümör transplantasyonunu araştırmak için uygun bir sistem olduğu kanıtlanmıştır44. Bu, CAM damarını ultrason kullanarak tümör görüntülemeyi araştırmak ve CEUS kullanarak tümör içindeki kan akışını araştırmak için bir model olarak kullanma imkanı yaratır. Tümörler tipik olarak 8 veya 9 günlük embriyoların 1,14,45 numaralı CAM damarlarına aşılanır, bunun için embriyo inkübasyonun 3. gününde yumurta kabuğundan çıkarılır ve ex ovo daha da gelişir. Bu protokolde açıklanan yöntemler, tümör aşılama gününe kadar ovo'da embriyo yetiştirmek için kullanılabilir.
Yazarlar, bu makalenin tavuk embriyolarını ve bunların koryoallantoik membranını (CAM) kontrast maddelerin uygulamaları ve akış çalışmaları için in vivo bir model olarak kullanmak isteyen araştırmacılar için yararlı olacağına güvenmektedir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, NWO'nun bir parçası olan Uygulamalı ve Mühendislik Bilimleri (TTW) (Vidi-proje 17543) tarafından desteklenmiştir. Yazarlar, Biyomedikal Mühendisliği Bölümü'nden Robert Beurskens, Luxi Wei ve Reza Pakdaman Zangabad'a ve Hollanda'daki Erasmus MC Üniversitesi Tıp Merkezi Rotterdam'dan teknik yardım için Deneysel Tıbbi Enstrümantasyon Bölümü'nden Michiel Manten ve Geert Springeling'e teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
Referanslar
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır