Method Article
使用支撑浮块在透射电子显微镜中制备样品支撑膜
摘要
冷冻电子显微镜(cryo-EM)的样品制备是该方法结构测定工作流程中的一个重大瓶颈。在这里,我们提供了使用易于使用的三维打印块制备支撑膜的详细方法,以稳定样品以进行透射EM研究。
摘要
通过冷冻电子显微镜(cryo-EM)进行结构测定在过去十年中发展迅速;然而,样品制备仍然是一个重大瓶颈。理想情况下,大分子样品直接从玻璃体冰层中的随机取向进行成像。然而,许多样品对此是难治性的,空气 - 水界面处的蛋白质变性是一个常见问题。为了克服这些问题,可以将支持膜(包括无定形碳,石墨烯和氧化石墨烯)应用于网格,以提供样品可以填充的表面,从而降低颗粒经历空气 - 水界面有害影响的可能性。然而,将这些精密支撑应用于网格需要小心处理,以防止破损,空气污染或广泛的洗涤和清洁步骤。最近的一份报告描述了一种易于使用的浮选块的开发,该浮块有助于将支撑膜直接润湿地转移到样品上。使用该块可最大限度地减少所需的手动处理步骤的数量,从而保持支撑膜的物理完整性以及疏水性污染可能累积的时间,从而确保仍然可以产生一层薄冰。本文为EM研究制备碳、石墨烯和氧化石墨烯载体提供了分步方案。
引言
在过去十年中,主要在探测器技术以及其他技术领域的突破促进了通过透射电子显微镜(TEM)对生物相关系统进行成像的分辨率的连续大幅提高1,2。尽管冷冻电镜已经允许通过单颗粒分析(SPA)从低至50μg蛋白质的高分辨率结构中分离出来,但冷冻电镜样品和网格制备仍然是主要瓶颈3,4,5。SPA样品由大分子组成,大分子大约随机分布在玻璃体冰层内。冰必须尽可能薄,以最大化颗粒和溶剂之间的对比度差异。生物大分子在较厚的冰中更稳定(即不太可能 失去其天然结构),因为它们保持更好的溶解。此外,在比粒径厚得多的冰中,颗粒通常分布在视野中要好得多, 并且通常根本不可能在碳膜的孔内发现。
此外,由于表面与体积比较高,较厚的冰层降低了分子靠近空气 - 水界面的可能性,并且据估计,使用标准的冷冻-冷冻方法进行冷冻电镜研究会导致约90%的颗粒吸附到空气 - 水界面7。较厚的冰导致由于溶剂内的散射事件增加以及伴随的信号衰减而导致不希望的高背景6,7。因此,有必要实现尽可能薄的玻璃体冰层;理想情况下,该层仅比颗粒略厚。对于应用于网格的每个不同样品,研究人员面临的挑战是准备足够薄的样品以进行高对比度成像,同时保持样品中颗粒的结构完整性。蛋白质吸附到空气 - 水界面伴随着几个通常有害的影响。
首先,蛋白质与这种疏水界面的结合通常诱导蛋白质变性,其迅速进行并且通常是不可逆的8,9。使用酵母脂肪酸合酶进行的一项研究表明,高达90%的吸附颗粒是变性的10。其次,一项研究比较了在无定形碳11 或没有支持的情况下收集的80S核糖体数据集的方向分布的 研究表明,空气 - 水界面会导致严重的优先方向,从而影响体积的3D重建13。减少颗粒与空气 - 水界面相互作用的方法包括用表面活性剂(例如洗涤剂)补充冷冻缓冲液,使用支撑膜,基质的亲和捕获或脚手架以及加速暴跌时间。表面活性剂的使用与其自身的问题有关,因为一些蛋白质样品在它们的存在下可能表现得不理想,而亲和捕获和脚手架基板通常需要工程定制的网格表面和捕获策略。最后,尽管对快速跳水装置的发展有很多研究14,15,16,但这些都需要通常不广泛使用的装置。
尽管用于生物冷冻电镜的标准TEM网格已经具有穿孔无定形碳箔17,但有许多协议可用于生成额外的支撑膜并将其传输到TEM网格。使用这些薄膜是一种长期建立的样品稳定方法18。无定形碳载体是通过蒸发和沉积在结晶云母片上而产生的19,从中可以将层漂浮到网格上,浮载载体的效用是先前报告中建立的有用工具20。氧化石墨烯薄片通常使用悍马方法的改良版本21制备,已被用作非晶碳的优选支撑结构,因为它们的背景信号降低以及固定和稳定大分子的能力22。最近,由于其机械稳定性,高导电性,对背景噪声的贡献极低23,以及用于产生宏观大面积单层石墨烯并将其转移到TEM网格的可重复方法的出现, 人们对使用石墨烯作为TEM支持膜的兴趣重新燃起25.与无定形碳相比,石墨烯的束诱导运动与缺乏支撑膜的冰相似或更糟,11,12,17,石墨烯显示出冷冻电镜图像的光束诱导运动显着减少12。
然而,虽然亲水石墨烯保护脂肪酸合酶免受空气 - 水界面变性的影响,但本研究的作者指出,石墨烯在标本制备过程中受到污染,可能是由于大气碳氢化合物污染和用于亲水网格的试剂的组合10。事实上,尽管石墨烯具有许多优越的品质,但其广泛使用仍然受到降低其疏水性所需的衍生化的阻碍12,这最终在化学上是困难的,需要专业设备。本文报告了使用三维(3D)打印样品浮选块27 将支撑膜从产生它们的基板直接转移到TEM网格的无定形碳,氧化石墨烯和石墨烯样品载体的制备方案(图1)。使用这种设备的一个关键优点是薄膜的润湿转移,最大限度地减少了支撑物的疏水性污染,因此需要进一步处理,并减少了可能有害的手动处理步骤的数量。这些方法的实施成本低廉,因此广泛可及,适用于需要样品支持的冷冻电镜研究。
研究方案
1. TEM格栅预支撑转移的一般准备
- 使用一对干净、细的镊子,将TEM网格依次提升并浸入双蒸馏水(ddH2O)或超纯水中10-15秒,然后用乙酸乙酯浸泡10-15秒。
注意:这里使用了负作用,斜尖镊子。 - 将镊子放在一侧,网格仍然握住,风干约5分钟。
- 等离子清洗网格,以去除表面通过空气或洗涤步骤产生的任何污染物。
注意:在这里,等离子体清洁在空气中进行了10-15秒,射频功率为25 W。
2. 试剂溶液的一般制备
- 乙酸铀酰(UAc)溶液(2%w / v)
- 将 50 mL 试管包裹在铝箔中,加入 50 mL 超纯水,加入 1 克 UAc 粉末。
注意:UAc 对光敏感,暴露时会随时间而沉淀。由于UAc具有放射性和毒性,因此请保持高水平的清洁度。由于吸入或摄入引起的危害最严重,应格外小心,以防止吸入细颗粒物的可能性。在处理或称量铀盐时,必须始终戴手套。强烈建议使用口罩和护目镜。铀盐必须根据该州内针对放射性危害规定的法律要求进行处置。 - 将溶液搅拌1小时,以使所有UAc溶解。储存于4°C。
- 使用前,使用0.22μm过滤器将1mL染色液过滤到小瓶中,以除去任何剩余的醋酸盐晶体。
- 将 50 mL 试管包裹在铝箔中,加入 50 mL 超纯水,加入 1 克 UAc 粉末。
- 氧化石墨烯(GrOx)悬浮液
- 将2.5μLGrOx移入1.5mL管中(1%终浓度)。将2.5μL10%(w / v) 正十二烷基β-D-麦芽糖苷(DDM)洗涤剂移入GrOx中,并轻轻混合(0.1%(w / v)最终浓度)。
- 向GrOx-DDM混合物中加入245μL超纯水,并立即剧烈涡旋5分钟,在制备后1小时内使用GrOx悬浮液,在立即使用前剧烈涡旋至少1分钟。
- 氯化铁(III)溶液(FeCl3)溶液(10%w / v)
- 在称重艇中小心称量 5 克 FeCl3 。转移到含有 35 mL ddH2O 和磁搅拌棒的 100 mL 测量池中。
- 置于磁力搅拌板上,溶解FeCl3,加入ddH 2 O至最终体积50 mL。通过0.8μm注射器过滤器过滤FeCl3 溶液到干净的瓶子中进行储存。
注意:FeCl3 具有腐蚀性和刺激性;在进食、饮用或吸烟前以及下班时,用温和的肥皂和水洗手和其他暴露部位。在加工区域提供良好的通风,以防止形成蒸汽。不要吸入雾气,蒸气,喷雾。处理或称量盐时必须始终佩戴手套。强烈建议在使用时佩戴口罩和护目镜。
3. 云母上碳载体膜的缓冲液交换,以使用载体浮选块制备负染色样品
- 清洗和等离子清洗透射电镜栅格。
注:此处使用了300目多孔碳铜网格,如上文第1节所述。 - 将10-12μL样品移液到浮选块的缓冲液交换孔(具有小通道)和10-12μL2%UAc溶液(见第2.1节)中,用于将负染色到相邻的非缓冲液交换孔中。
注:孔的体积为10μL;但是,调整样品体积,以便在液体表面形成凸面半月板,以允许适当的薄膜漂浮。样品量少可能会导致薄膜破损。 - 小心地切下两小块云母,上面有预先沉积的碳膜。确保云母碎片足够宽以适合孔(3.4毫米宽)并且比孔长度(3.45毫米)长,以便碎片在碳漂浮时位于井上,并且有足够的空间用镊子处理碎片。
注意:要处理碳,请使用扁平负作用长头镊子。切割云母碎片时,使用单个动作进行切割,以保持碳膜的完整性。 - 将云母以近似45°的角度浸入孔中,直到云母位于孔的斜坡上,并在液体样品的表面观察到一层碳。
- 在样品上初始孵育后(通常为20秒至20分钟,具体取决于样品粘附性;根据实验需要优化此时间段),非常缓慢地取出云母片以回收碳膜并最大限度地减少残留的粘性样品保留。
- 通过用滤纸敲击下表面(非碳侧)以除去多余的液体来小心地吸印云母,然后通过施加到含有2%UAc溶液的相对孔(即,像步骤3.4中那样浸没云母)将带有样品的碳交换成负染色剂。
注意:此时应观察到碳层漂浮在污渍溶液的顶部。 - 回收漂浮的碳层,方法是使用经过清洗和等离子体清洁的EM网格的多孔碳覆盖的一侧。将网格风干,直到在TEM上成像。理想情况下,在干燥过程中覆盖网格以避免空气污染。
4. 支撑浮选块在制备氧化石墨烯涂层透射电镜网格中的应用
- 如上所述,使用300目多孔碳铜网格进行清洗和等离子清洗的TEM网格(第1节)。
- 将10-12μLGrOx悬浮液(见第2.2节)移液到沿浮选块的4个非缓冲液交换孔中。将10-12μL ddH 2 O或超纯水移入块的其余4个缓冲液交换孔中。
注意:该体积的水应足以形成略凸的半月板,高于块的高度。 - 将4个网格轻轻地滴到每个孔的GrOx悬浮液上1分钟,确保多孔碳覆盖的一侧与溶液接触。1分钟后,通过将镊子滑入每个非缓冲交换孔的镊子槽中,仔细恢复每个网格。
- 非常轻柔和地将每个网格的铜,非碳覆盖的一侧触摸到相邻孔中的ddH2O。然后,小心而轻柔地将网格,水滴面朝下,靠在一张滤纸上。
注意:吸走水将通过毛细管作用将GrOx悬浮液通过网格。避免将电网淹没在ddH2O中至关重要,因此接触应该非常简短。当网格被抬起时,一滴水应该保持在网格的下面。注意不要移动滤纸上的网格,因为这可能会扰乱GrOx薄片的沉降。 - 将网格留在镊子中风干,直到用样品制备。理想情况下,在干燥过程中覆盖网格以避免空气污染。
5. 支撑浮选块在单层石墨烯薄膜上样品制备中的应用
- 如上所述(第1节)清洗TEM网格,但省略等离子清洗。
注意:这里使用了300目多孔碳金网格,但其他非铜网格或铜合金网格也是可行的。 - 要用石墨烯沉积网格,请直接从生长在铜(Cu-石墨烯)衬底上的石墨烯转移到冷冻电镜网格中,如前所述25。
- 将四个洗涤的网格放在沉积在载玻片上的Cu-石墨烯片(10 mm×10 mm)的顶部,并用一滴异丙醇(5-10μL)覆盖每个网格,以允许单层石墨烯和网格之间紧密接触。
注意:确保将网格的多孔碳覆盖侧与石墨烯片接触。 - 当异丙醇完全蒸发(通常为2小时)时,将带有网格的Cu-石墨烯片漂浮到玻璃培养皿中的10%(w / v)FeCl3 溶液(见第2.3节)上,并在室温下蚀刻过夜。盖上培养皿以避免空气污染。
注意:蚀刻完成后,只有石墨烯单层将保持漂浮在FeCl3 溶液上 - 这应该在合适的照明下用眼睛可见。 - 使用直径大于TEM网格尺寸的环路将漂浮在石墨烯单层上的网格钓鱼,并小心地转移到含有ddH2 O的玻璃培养皿中进行洗涤。
注意:钓鱼网格时要非常小心,以免撞到培养皿的墙壁,这可能会导致石墨烯薄膜断裂或弯曲。 - 通过钓鱼网在水中再洗涤两次,然后转移到含有ddH 2 O的干净培养皿中,以除去所有残留的FeCl3。最后,将网格转移到含有样品缓冲液的培养皿中,直到样品制备和骤冻。
注意:网格的石墨烯覆盖的一侧必须始终保持湿润,以避免暴露于空气污染物中。
- 将四个洗涤的网格放在沉积在载玻片上的Cu-石墨烯片(10 mm×10 mm)的顶部,并用一滴异丙醇(5-10μL)覆盖每个网格,以允许单层石墨烯和网格之间紧密接触。
- 将样品(10-12μL)移液到浮选块的非缓冲液交换孔中。当样品在块中准备就绪时,使用一对干净的镊子从缓冲溶液中取出石墨烯涂层的网格,然后放置在含样品孔的表面上。
- 经过适当的孵育期(1-5分钟,取决于样品;根据实验需要进行优化),用一对干净的冷冻镊子选择网格,然后继续进行转印和玻璃化。
结果
用无定形碳支撑制备的TEM网格通常覆盖在整个网格表面上。虽然在某些情况下会发生碳膜的断裂以及一些褶皱(图2A),但大量的网格方块是原始的,因此广泛适用于负染色目的。影响支撑完整性的主要因素是碳厚度,这是在碳蒸发过程中确定的。同样,使用这种GrOx协议,可以在整个电网中实现良好的覆盖率(图2B)。单次施用GrOx悬浮液1分钟足以确保具有多层的区域很少,由于片状边缘,这些区域很容易看到。GrOx网格可以从原材料中快速制备,并且对样品具有高度保护性。然而,由于GrOx片的性质,与其他技术相比,GrOx网格更频繁地看到片状边缘,不完全覆盖和褶皱。
虽然石墨烯载体膜的完整性与无定形碳一样取决于沉积过程,但覆盖良好的区域显示出单层石墨烯的特征衍射图案。重要的是,通过保持石墨烯载体膜润湿,可以在孵育期后从浮选块中回收样品,并以适合单颗粒分析的方式收集数据。该方法不需要对石墨烯进行任何其他处理以进行润湿,从而消除了对昂贵的设备进行亲水性石墨烯的要求,并且最好在样品制备和网格冷冻之前不久制备支撑膜(图2C)。
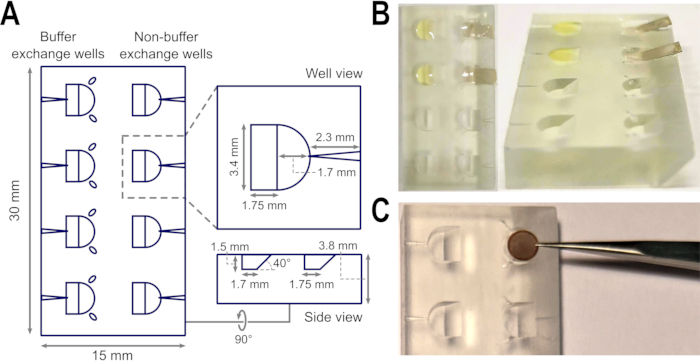
图 1:支撑膜制备过程中的样品浮选块设计和应用。 (A) 浮选块的顶部、孔和侧视图的示意图,包括形状、深度和倾斜度的测量。标明了用于放置镊子尖端的凹槽以及用于插入针的通道。(B)非晶态碳层可以很容易地漂浮在使用斜坡漂浮在浮选块孔内所含的缓冲液表面上, 即在制备负染色的TEM网格期间。(C)井的宽度适合容纳一个TEM网格,而镊子槽减少了在准备步骤中不必要地释放和拾取网格的需要,但提供了一条确定的路径来恢复网格,而不会在释放网格时有弯曲的风险。 B 中的图像是从 27 修改而来的。缩写:TEM = 透射电子显微镜。 请点击此处查看此图的放大版本。

图2:使用浮选块制备的样品支撑膜的典型示例。显示了(A)无定形碳,(B)氧化石墨烯和(C)使用浮选块制备的石墨烯载体膜的网格方(左)和图像(右)视图。无定形碳载体用于制备用于负染色的70S核糖体,而氧化石墨烯和石墨烯载体用于制备用于冷冻电镜的70S核糖体。A 和 C 中的图像是从 27 修改而来的。A网格正方形的比例尺 = 10 μm;B和C网格正方形的比例尺= 5μm;A-C 图像视图的比例尺 = 50 nm。缩写:cryo-EM = 冷冻电子显微镜。请点击此处查看此图的放大版本。
讨论
本文提出了使用样品浮选块27处理用于冷冻电镜样品制备的无定形碳和石墨烯薄膜的方案。支持块的STL文件可从公共Thingiverse存储库[www.thingiverse.com/thing:3440684]免费获得,并且可以使用合适的树脂的任何合适的立体光刻打印机进行3D打印。使用覆盖透射电镜网格的碳膜通常涉及碳漂浮到样品上28。这种制备负染色网格的方法可最大限度地减少支撑处理过程中的空气暴露,从而减少污染和蛋白质变性。在小井中使用浮动碳制备网格有利于漂浮更大的表面积, 即在水浴或培养皿中,在这种情况下,碳的机械剪切更容易发生。
由于发布时的当前健康和安全法规,UAc可能难以购买。还有许多其他常用的非放射性阴性染色试剂可用,并且之前已经描述了其制备方案29。虽然替代染色剂尚未与该支持浮选块一起使用,但除了优化样品的孵育时间(步骤3.5)之外,这些方案不太可能有任何差异,这已经固有地依赖于样品。该GrOx支持制备方案中的关键步骤是步骤4.4,由注释突出显示,以防止水和GrOx溶液在网格边缘周围接触。水和GrOx溶液的不当混合可防止GrOx薄片通过毛细管作用单向沉降。在碳箔的两侧都有GrOx薄片会导致厚层,从而否定了使用GrOx作为近乎单层支撑的优势,以及将水捕获在薄片之间,这导致可用区域被额外的冰层污染。氧化石墨烯载体的制备相对容易在柔性聚烯烃薄膜上使用溶液液滴来实现。但是,当以这种方式执行时,更容易通过错误处理错误意外污染电网的铜侧;浮充块的使用降低了这种可能性的可能性。
最后,本文提出了一种制备石墨烯覆盖网格的协议,该协议避免了任何类型的石墨烯预处理以使其亲水,从而降低了其成本并增加了其可及性。在整个试样制备过程中保持润湿膜,并在冷冻前将试样 原位涂敷 在块中,足以产生适合冷冻电镜的冰层,并具有均匀的样品分布。总体而言,此处介绍的协议最大限度地减少了样品与空气 - 水界面的接触,从而减少了样品变性并支持污染。对于这些方法中使用的三种载体膜,可以在网格上实现均匀的样品分布,同时对完整,保存完好的单个颗粒进行成像。
披露声明
作者不知道与这项工作有任何利益冲突。
致谢
作者要感谢伦敦帝国理工学院结构与合成生物学部门的所有成员,他们帮助测试了这些技术,以及帝国理工学院高级Hackspace的Harry Barnett和结构生物学中心的Paul Simpson。CHSA由Wellcome Trust和皇家学会共同资助的Henry Dale爵士奖学金(206212/ Z / 17 / Z)提供支持。
材料
| Name | Company | Catalog Number | Comments |
| Basic Plasma Cleaner (230 V) | Harrick Plasma | PDC-32G-2 | |
| Dumont tweezers N5A INOX. | Dumont Swissmade | 0302-N5A-PO | |
| Dumont tweezers NGG INOX. | Dumont Swissmade | 0102-NGG-PO | |
| Ehtylacetate | Sigma-Aldrich | 270989-250ML | |
| Fishing Loops 10 μL | VWR | 612-9353 | |
| Graphene Oxide 2 mg/mL | Sigma-Aldrich | 763705-25ML | |
| Iron (III) chloride | Sigma-Aldrich | 31232-250MG | |
| Mica Sheets 75 mm x 25 mm x 0.15 mm | Agar Scientific | AGG250-1 | We usually coat mica with a target carbon film thickness of 2 nm |
| Monolayer Graphene on Cu | Graphenea | N/A | 10 mm x 10 mm, pack of 4 |
| n-dodecyl β-D-maltoside (DDM) | GLYCON Biochemicals GmbH | D97002-C | |
| Quantifoil R1.2/1.3 300 mesh copper grids | Enzo Life Sciences | JBS-X-101-Cu300 | |
| Quantifoil R2/1 300 mesh copper grids | Enzo Life Sciences | JBS-X-102-Cu300 | |
| Quantifoil R2/1 300 mesh gold grids | Electron Microscopy Sciences | Q350AR1 | |
| Scissors | Agar Scientific | AGT577 | |
| Uranyl Acetate | TAAB Laboratories Equipment | U001 | |
| Vitrobot Mark IV | FEI | N/A | |
| Whatman filter paper 55 mm | GE Healthcare Life Sciences | 1441-055 | |
| Whatman filter paper 70 mm | GE Healthcare Life Sciences | 1441-070 |
参考文献
- Frank, J. Advances in the field of single-particle cryo-electron microscopy over the last decade. Nature Protocols. 12 (2), 209-212 (2017).
- Lyumkis, D. Challenges and Opportunities in Cryo-EM Single-Particle Analysis. Journal of Biological Chemistry. 294 (13), 5181-5197 (2019).
- Elmlund, D., Elmlund, H. Cryogenic Electron Microscopy and Single-Particle Analysis. Annual Review of Biochemistry. 84 (1), 499-517 (2015).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Arnold, S. A., et al. Miniaturizing EM Sample Preparation: Opportunities, Challenges, and "Visual Proteomics". Proteomics. 18 (5-6), 1700176 (2018).
- Wu, S., Armache, J. P., Cheng, Y. Single-particle cryo-EM data acquisition by using direct electron detection camera. Microscopy. 65 (1), 35-41 (2016).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 34257 (2018).
- Grimm, R., Typke, D., Bärmann, M., Baumeister, W. Determination of the inelastic mean free path in ice by examination of tilted vesicles and automated most probable loss imaging. Ultramicroscopy. 63 (3-4), 169-179 (1996).
- Glaeser, R. M. Proteins, interfaces, and cryo-EM grids. Current Opinion in Colloid and Interface Science. 34, 1-8 (2018).
- D'Imprima, E., Floris, D., Joppe, M., Sánchez, R., Grininger, M., Kühlbrandt, W. Protein denaturation at the water-air interface and how to prevent it. eLife. 8, 400432 (2019).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2013 (2), 00461 (2013).
- Russo, C. J., Passmore, L. A. Controlling protein adsorption on graphene for cryo-EM using low-energy hydrogen plasmas. Nature Methods. 11 (6), 649-652 (2014).
- Naydenova, K., Russo, C. J. Measuring the effects of particle orientation to improve the efficiency of electron cryomicroscopy. Nature Communications. 8 (1), 8-12 (2017).
- Jain, T., Sheehan, P., Crum, J., Carragher, B., Potter, C. S. Spotiton: A prototype for an integrated inkjet dispense and vitrification system for cryo-TEM. Journal of Structural Biology. 179 (1), 68-75 (2012).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195 (2), 190-198 (2016).
- Feng, X., et al. A Fast and Effective Microfluidic Spraying-Plunging Method for High-Resolution Single-Particle Cryo-EM. Structure. 25 (4), 663-670 (2017).
- Ermantraut, E., Wohlfart, K., Tichelaar, W. Perforated support foils with pre-defined hole size, shape and arrangement. Ultramicroscopy. 74 (1-2), 75-81 (1998).
- Adrian, M., Dubochet, J., Lepault, J., McDowall, A. W. Cryo-electron microscopy of viruses. Nature. 308 (5954), 32-36 (1984).
- Fujiyoshi, Y. The structural study of membrane proteins by electron crystallography. Advances in Biophysics. 35, 25-80 (1998).
- Koning, R. I., Oostergetel, G. T., Brisson, A. Preparation of flat carbon support films. Ultramicroscopy. 94 (34), 183 (2003).
- Hummers, W. S., Offeman, R. E. Preparation of Graphitic Oxide. Journal of the American Chemical Society. 80 (6), 1339 (1958).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Pantelic, R. S., et al. Graphene: Substrate preparation and introduction. Journal of Structural Biology. 174 (1), 234-238 (2011).
- Li, X., et al. Large-area synthesis of high-quality and uniform graphene films on copper foils. Science. 324 (5932), 1312-1314 (2009).
- Regan, W., et al. A direct transfer of layer-area graphene. Applied Physics Letters. 96 (11), 2008-2011 (2010).
- Brilot, A. F., et al. Beam-induced motion of vitrified specimen on holey carbon film. Journal of Structural Biology. 177 (3), 630-637 (2012).
- de Martín Garrido, N., et al. Direct transfer of electron microscopy samples to wetted carbon and graphene films via a support floatation block. Journal of Structural Biology. 213 (1), 107677 (2021).
- Valentine, R. C., Shapiro, B. M., Stadtman, E. R. Regulation of Glutamine Synthetase. XII. Electron Microscopy of the Enzyme from Escherichia coli. Biochemistry. 7 (6), 2143-2152 (1968).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。