Method Article
Preparazione di film di supporto campione in microscopia elettronica a trasmissione utilizzando un blocco di galleggiamento di supporto
In questo articolo
Riepilogo
La preparazione del campione per la microscopia crioelettronica (cryo-EM) è un collo di bottiglia significativo nel flusso di lavoro di determinazione della struttura di questo metodo. Qui, forniamo metodi dettagliati per l'utilizzo di un blocco stampato tridimensionale facile da usare per la preparazione di film di supporto per stabilizzare i campioni per gli studi EM di trasmissione.
Abstract
La determinazione della struttura mediante microscopia crioelettronica (cryo-EM) è cresciuta rapidamente nell'ultimo decennio; tuttavia, la preparazione dei campioni rimane un collo di bottiglia significativo. I campioni macromolecolari sono idealmente ripresi direttamente da orientamenti casuali in un sottile strato di ghiaccio vitreo. Tuttavia, molti campioni sono refrattari a questo e la denaturazione delle proteine all'interfaccia aria-acqua è un problema comune. Per superare tali problemi, i film di supporto, tra cui carbonio amorfo, grafene e ossido di grafene, possono essere applicati alla griglia per fornire una superficie che i campioni possono popolare, riducendo la probabilità che le particelle subiscano gli effetti deleteri dell'interfaccia aria-acqua. L'applicazione di questi delicati supporti alle griglie, tuttavia, richiede un'attenta manipolazione per prevenire rotture, contaminazione nell'aria o ampie fasi di lavaggio e pulizia. Un recente rapporto descrive lo sviluppo di un blocco di galleggiamento facile da usare che facilita il trasferimento bagnato delle pellicole di supporto direttamente al campione. L'uso del blocco riduce al minimo il numero di passaggi di movimentazione manuale richiesti, preservando l'integrità fisica del film di supporto e il tempo durante il quale la contaminazione idrofobica può accumularsi, garantendo che un sottile film di ghiaccio possa ancora essere generato. Questo documento fornisce protocolli passo-passo per la preparazione di carbonio, grafene e supporti di ossido di grafene per studi EM.
Introduzione
Nell'ultimo decennio, le scoperte, principalmente nella tecnologia dei rivelatori, ma anche in altri campi tecnici, hanno facilitato una successione di aumenti sostanziali della risoluzione alla quale i sistemi biologicamente rilevanti possono essere ripresi mediante microscopia elettronica a trasmissione (TEM)1,2. Nonostante il fatto che la crio-EM consenta già la risoluzione di strutture ad alta risoluzione da un minimo di 50 μg di proteine attraverso l'analisi a singola particella (SPA), il campione crio-EM e la preparazione della griglia rimangono i principali colli di bottiglia3,4,5. I campioni di SPA sono costituiti da macromolecole distribuite approssimativamente in modo casuale all'interno di uno strato di ghiaccio vitreo. Il ghiaccio deve essere il più sottile possibile per massimizzare la differenza di contrasto tra le particelle e il solvente. Le macromolecole biologiche sono più stabili (cioè, meno probabilità di perdere la loro struttura nativa) in ghiaccio più spesso, perché rimangono meglio solvate. Inoltre, le particelle sono spesso distribuite molto meglio sul campo visivo nel ghiaccio molto più spesso della dimensione delle particelle6 e spesso non possono essere trovate all'interno di buchi nei film di carbonio.
Inoltre, strati più spessi di ghiaccio riducono la probabilità che le molecole siano vicine all'interfaccia aria-acqua a causa dell'elevato rapporto superficie-volume, ed è stato stimato che l'utilizzo di metodi standard di congelamento a tuffo per gli studi crio-EM provoca l'adsorbimento di circa il 90% delle particelle all'interfaccia aria-acqua7. Il ghiaccio più spesso si traduce in uno sfondo indesiderabilmente elevato a causa dell'aumento degli eventi di scattering all'interno del solvente e della concomitante attenuazione del segnale6,7. È quindi necessario ottenere uno strato di ghiaccio vitreo il più sottile possibile; idealmente, lo strato sarebbe solo leggermente più spesso della particella. La sfida per il ricercatore, che deve essere superata per ogni diverso campione applicato a una griglia, è quella di preparare campioni abbastanza sottili per l'imaging ad alto contrasto mantenendo l'integrità strutturale delle particelle all'interno del loro campione. L'adsorbimento proteico all'interfaccia aria-acqua è accompagnato da diversi effetti, solitamente deleteri.
In primo luogo, il legame delle proteine a questa interfaccia idrofobica spesso induce la denaturazione della proteina, che procede rapidamente ed è tipicamente irreversibile8,9. Uno studio condotto utilizzando l'acido grasso sintasi del lievito ha dimostrato che fino al 90% delle particelle adsorbite sono denaturate10. In secondo luogo, le prove di uno studio che confronta la distribuzione dell'orientamento dei set di dati sui ribosomi 80S raccolti su carbonio amorfo11 o senza supporto12 hanno dimostrato che l'interfaccia aria-acqua può causare un grave orientamento preferenziale compromettendo la ricostruzione 3D del volume13. I metodi per ridurre l'interazione delle particelle con l'interfaccia aria-acqua includono l'integrazione del tampone di congelamento con tensioattivi (come i detergenti), l'uso di pellicole di supporto, la cattura di affinità o l'impalcatura dei substrati e tempi di immersione accelerati. L'uso di tensioattivi è associato a problemi propri, poiché alcuni campioni proteici possono comportarsi in modo non ideale in loro presenza, mentre i substrati di cattura dell'affinità e di impalcatura richiedono generalmente l'ingegneria di superfici a griglia su misura e strategie di cattura. Infine, sebbene ci sia molta ricerca sullo sviluppo di dispositivi a immersione rapida14,15,16, questi richiedono apparati che generalmente non sono ampiamente disponibili.
Sebbene la griglia TEM standard per crio-EM biologico presenti già un foglio di carbonio amorfo perforato17, sono disponibili numerosi protocolli per la generazione di film di supporto aggiuntivi e il loro trasferimento alle griglie TEM. L'uso di queste pellicole è un metodo consolidato da tempo per la stabilizzazione del campione18. I supporti in carbonio amorfo sono generati per evaporazione e deposizione su fogli di mica cristallina19, da cui gli strati possono essere fatti galleggiare su griglie, con l'utilità di supporti di galleggiamento come strumenti utili stabiliti in precedenti rapporti20. I fiocchi di ossido di grafene, tipicamente preparati utilizzando una versione modificata del metodo Hummers21, sono stati utilizzati come struttura di supporto preferibile al carbonio amorfo per il loro segnale di fondo diminuito e la capacità di immobilizzare e stabilizzare le macromolecole22. Più recentemente, c'è stato un crescente interesse per l'uso del grafene come pellicola di supporto TEM a causa della sua stabilità meccanica, alta conduttività, contributo estremamente basso al rumore di fondo23, nonché l'emergere di metodi riproducibili per generare macroscopicamente grandi aree di grafene monostrato24 e trasferirlo alle griglie TEM25 . Rispetto al carbonio amorfo, che subisce moti indotti dal fascio in modo simile o peggiore al ghiaccio privo di un film di supporto11,12,17, il grafene ha mostrato una significativa riduzione del movimento indotto dal fascio delle immagini crio-EM12.
Tuttavia, mentre il grafene idrofilizzato proteggeva l'acido grasso sintasi dalla denaturazione interfacciale aria-acqua, gli autori di questo studio hanno notato che il grafene è stato contaminato durante la preparazione del campione, probabilmente a causa di una combinazione di contaminazione da idrocarburi atmosferici e dal reagente utilizzato per idrofilizzare le griglie10. Infatti, nonostante molte delle qualità superiori del grafene, il suo uso diffuso è ancora ostacolato dalla derivatizzazione necessaria per diminuire la sua idrofobicità12, che alla fine è chimicamente difficile e richiede attrezzature specializzate. Questo documento riporta i protocolli per la preparazione di carbonio amorfo, ossido di grafene e supporti per campioni di grafene utilizzando un blocco di galleggiamento del campione stampato tridimensionalmente (3D)27 per trasferire direttamente i film di supporto dai substrati su cui sono stati generati alle griglie TEM (Figura 1). Un vantaggio chiave dell'utilizzo di un tale dispositivo è il trasferimento bagnato di film, riducendo al minimo la contaminazione idrofobica dei supporti e di conseguenza la necessità di ulteriori trattamenti e riducendo il numero di passaggi di movimentazione manuale potenzialmente dannosi. Questi approcci sono poco costosi da implementare e quindi ampiamente accessibili e applicabili per gli studi crio-EM in cui sono necessari supporti di campioni.
Protocollo
1. Preparazione generale delle griglie TEM pre-trasferimento di supporto
- Utilizzando una coppia di pinzette pulite e fini, sollevare e immergere le griglie TEM in sequenza in acqua a doppia distillazione (ddH2O) o acqua ultrapura per 10-15 s, seguita da acetato di etile, per 10-15 s.
NOTA: Qui sono state utilizzate pinzette ad azione negativa, a punta obliqua. - Posizionare le pinzette, con la griglia ancora in presa, su un lato per asciugare all'aria per ~ 5 minuti.
- Pulire al plasma le griglie per rimuovere la superficie di eventuali contaminanti accumulati attraverso l'aria o le fasi di lavaggio.
NOTA: Qui, la pulizia del plasma è stata effettuata per 10-15 s in aria con una potenza a radiofrequenza di 25 W.
2. Preparazione generale delle soluzioni reagenti
- Soluzione di acetato di uranile (UAc) (2% p/v)
- Avvolgere un tubo da 50 ml in un foglio, riempire con 50 ml di acqua ultrapura e aggiungere 1 g di polvere UAc.
NOTA: UAc è sensibile alla luce e precipita nel tempo se esposto. Poiché UAc è radioattivo e tossico, mantenere un alto livello di pulizia. Con il rischio più grave derivante dall'inalazione o dall'ingestione, è necessario prestare particolare attenzione per prevenire qualsiasi possibilità di inalazione di particelle fini. I guanti devono essere sempre indossati quando si maneggiano o si pesano i sali di uranio. Maschere e occhiali altamente raccomandati. I sali di uranio devono essere smaltiti secondo i requisiti legali stabiliti per i rischi radioattivi all'interno dello stato. - Lasciare la soluzione mescolando per 1 ora per consentire a tutti gli UAc di dissolversi. Conservare a 4°C.
- Prima dell'uso, filtrare 1 mL della soluzione colorante in un piccolo flaconcino utilizzando un filtro da 0,22 μm per rimuovere eventuali cristalli di acetato rimanenti.
- Avvolgere un tubo da 50 ml in un foglio, riempire con 50 ml di acqua ultrapura e aggiungere 1 g di polvere UAc.
- Sospensione di ossido di grafene (GrOx)
- Pipettare 2,5 μL di GrOx in un tubo da 1,5 mL (concentrazione finale dell'1%). Pipettare 2,5 μL di detergente n-dodecile β-D-maltoside (DDM) al 10% (p/v) nel GrOx e miscelare delicatamente (0,1% (p/v) concentrazione finale).
- Aggiungere 245 μL di acqua ultrapura alla miscela GrOx-DDM e immediatamente ruotare vigorosamente per 5 minuti. Utilizzare la sospensione GrOx entro 1 ora dalla preparazione, vortice vigorosamente per almeno 1 minuto prima dell'uso immediato.
- Soluzione di cloruro di ferro (III) (FeCl3) (10% p/v)
- Pesare attentamente 5 g di FeCl3 in una barca di pesatura. Trasferire su un cilindro di misura da 100 mL contenente 35 mL di ddH2O e una barra di agitazione magnetica.
- Posizionare su una piastra di agitazione magnetica e sciogliere FeCl3, aggiungendo ddH2O a un volume finale di 50 ml. Filtrare la soluzione di FeCl3 attraverso un filtro a siringa da 0,8 μm in un flacone pulito per la conservazione.
NOTA: FeCl3 è corrosivo e irritante; lavarsi le mani e altre aree esposte con acqua e sapone neutro prima di mangiare, bere o fumare e quando si lascia il lavoro. Fornire una buona ventilazione nell'area di processo per prevenire la formazione di vapore. Non respirare nebbia, vapori, spray. I guanti devono essere sempre indossati quando si maneggia o si pesa il sale. Maschere e occhiali altamente raccomandati ogni volta che in uso.
3. Scambio tampone per film di supporto al carbonio su mica per preparare campioni macchiati negativamente utilizzando il blocco di galleggiamento del supporto
- Reti TEM lavate e pulite al plasma.
NOTA: Qui sono state utilizzate 300 griglie di rame a maglia di carbonio e carbonio come descritto sopra nella sezione 1. - Pipettare 10-12 μL di campione nel pozzetto di scambio tampone (con i piccoli canali) del blocco di galleggiamento e 10-12 μL di soluzione UAc al 2% (vedere paragrafo 2.1) per la colorazione negativa nel pozzo di scambio non tampone adiacente.
NOTA: Il pozzo ha un volume di 10 μL; tuttavia, regolare il volume del campione in modo che si formi un menisco convesso sulla superficie del liquido per consentire il corretto galleggiamento del film. Un basso volume di campione può causare la rottura del film. - Tagliare con cura due piccoli pezzi di mica con film di carbonio predepositato sulla parte superiore. Assicurarsi che i frammenti di mica siano abbastanza larghi da adattarsi al pozzo (3,4 mm di larghezza) e più lunghi della lunghezza del pozzo (3,45 mm), in modo tale che il frammento si sieda sul pozzo mentre il carbonio galleggia e ci sia abbastanza spazio per gestire il frammento con le pinzette.
NOTA: per gestire il carbonio, utilizzare una pinzetta piatta ad azione negativa a punta lunga. Quando si tagliano i frammenti di mica, tagliare con singoli movimenti per mantenere l'integrità del film di carbonio. - Immergere la mica nel pozzo con un angolo approssimativo di 45 ° fino a quando la mica si trova sulla rampa del pozzo e si osserva uno strato di carbonio sulla superficie del campione liquido.
- Dopo l'incubazione iniziale sul campione (tipicamente da 20 s a 20 min a seconda dell'aderenza del campione; ottimizzare questo periodo in base alle esigenze sperimentali), prelevare il foglio di mica molto lentamente per recuperare il film di carbonio e ridurre al minimo la ritenzione viscosa residua del campione.
- Asciugare accuratamente la mica picchiettando la superficie inferiore (lato non carbonio) con carta da filtro per rimuovere il liquido in eccesso e successivamente scambiare il carbonio contenente il campione in una macchia negativa mediante applicazione al pozzetto opposto (cioè immergere la mica come nel passaggio 3.4) contenente la soluzione UAc al 2%.
NOTA: a questo punto si deve osservare uno strato di carbonio che galleggia sopra la soluzione di colorazione. - Recupera lo strato di carbonio galleggiante con il lato coperto di carbonio bucato di una griglia EM lavata e pulita al plasma. Lasciare asciugare le griglie all'aria fino a quando non si esegue l'imaging su un TEM. Idealmente, coprire le griglie durante il processo di essiccazione per evitare la contaminazione nell'aria.
4. Applicazione del blocco di galleggiamento di supporto per preparare griglie TEM rivestite di ossido di grafene
- Reti TEM lavate e pulite al plasma utilizzando griglie di rame a maglia 300 a maglie di carbonio come descritto sopra (sezione 1).
- Pipettare 10-12 μL di sospensione di GrOx (vedere paragrafo 2.2) nei 4 pozzetti di scambio non tampone lungo il blocco di galleggiamento. Pipetta 10-12 μL ddH2O o acqua ultrapura nei restanti 4 pozzi di scambio tampone del blocco.
NOTA: Questo volume d'acqua dovrebbe essere sufficiente a formare un leggero menisco convesso che sale sopra l'altezza del blocco. - Rilasciare delicatamente 4 griglie sulla sospensione GrOx di ciascun pozzetto per 1 minuto, assicurandosi che il lato coperto di carbonio bucato entri in contatto con la soluzione. Dopo 1 minuto, recuperare attentamente ogni griglia facendo scorrere le pinzette nella scanalatura della pinzetta di ogni pozzo di scambio non tampone.
- Toccare molto delicatamente e brevemente il lato in rame, non coperto di carbonio, di ciascuna griglia al ddH2O nel pozzo adiacente. Quindi, tenere con attenzione e delicatamente la griglia, con la goccia d'acqua verso il basso, contro un pezzo di carta da filtro.
NOTA: Il blotting dell'acqua attirerà la sospensione GrOx attraverso la griglia per azione capillare. È fondamentale evitare di immergere la griglia nel ddH2O, quindi il contatto dovrebbe essere molto breve. Quando la griglia viene sollevata, una goccia d'acqua dovrebbe tenersi nella parte inferiore della griglia. Fare attenzione a non spostare la griglia sulla carta da filtro in quanto ciò potrebbe sconvolgere l'assestamento dei fiocchi di GrOx. - Lasciare asciugare all'aria le griglie nelle pinzette fino alla preparazione con il campione. Idealmente, coprire le griglie durante il processo di essiccazione per evitare la contaminazione nell'aria.
5. Applicazione del blocco di galleggiamento di supporto per la preparazione di campioni su film monostrato-grafene
- Lavare le griglie TEM come descritto sopra (paragrafo 1), ma omettendo la pulizia al plasma.
NOTA: Qui sono state utilizzate 300 griglie in oro orzo-carbonio a rete, ma sono praticabili anche altre griglie non in rame o griglie in lega di rame. - Per depositare griglie con grafene, trasferire direttamente dal grafene coltivato su substrati di rame (Cu-grafene) a griglie crio-EM, come descritto in precedenza25.
- Posizionare quattro griglie lavate sopra un foglio di Cu-grafene (10 mm × 10 mm) depositato su un vetrino e coprire ogni griglia con una goccia di isopropanolo (5-10 μL) per consentire un contatto intimo tra il grafene monostrato e la griglia.
NOTA: Assicurarsi di posizionare il lato coperto di carbonio forato delle griglie a contatto con il foglio di grafene. - Quando l'isopropanolo è completamente evaporato (tipicamente 2 ore), far galleggiare il foglio di Cu-grafene con griglie su una soluzione di FeCl3 al 10% (p/v) (vedere paragrafo 2.3) in una capsula di Petri di vetro e lasciare incidere a temperatura ambiente durante la notte. Coprire il piatto per evitare la contaminazione nell'aria.
NOTA: Al termine dell'incisione, solo il monostrato di grafene rimarrà fluttuante sulla soluzione di FeCl3 - questo dovrebbe essere visibile a occhio con un'illuminazione adeguata. - Utilizzare un anello con diametro superiore alla dimensione della griglia TEM per pescare le griglie che galleggiano sul monostrato di grafene e trasferirle con cura in una capsula di Petri di vetro contenente ddH2O da lavare.
NOTA: Prestare molta attenzione quando si pescano le griglie per evitare di colpire le pareti della capsula di Petri, che potrebbe causare la rottura o la flessione del film di grafene. - Lavare altre due volte in acqua con griglie di pesca e trasferendolo in una capsula di Petri pulita contenente ddH2O per rimuovere tutto il FeCl3 residuo. Infine, trasferire le griglie in una capsula di Petri contenente il tampone del campione fino alla preparazione del campione e al congelamento a immersione.
NOTA: il lato coperto di grafene delle griglie deve essere tenuto bagnato in ogni momento per evitare la loro esposizione a contaminanti presenti nell'aria.
- Posizionare quattro griglie lavate sopra un foglio di Cu-grafene (10 mm × 10 mm) depositato su un vetrino e coprire ogni griglia con una goccia di isopropanolo (5-10 μL) per consentire un contatto intimo tra il grafene monostrato e la griglia.
- Pipettare il campione (10-12 μL) in un pozzo di scambio non tampone del blocco di galleggiamento. Quando il campione è pronto nel blocco, prelevare una griglia rivestita di grafene dalla soluzione tampone utilizzando un paio di pinzette pulite e posizionarla sulla superficie del pozzo contenente il campione.
- Dopo un adeguato periodo di incubazione (1-5 min a seconda del campione; ottimizzare in base alle esigenze sperimentali), prelevare la griglia con una coppia di pinzette di congelamento pulite e procedere con il blotting e la vetrificazione.
Risultati
Le griglie TEM preparate con supporti in carbonio amorfo sono in genere coperte su tutta la superficie della griglia. Sebbene la rottura del film di carbonio si verifichi in alcuni casi insieme a qualche arruffamento (Figura 2A), un gran numero di quadrati della griglia sono incontaminati e quindi ampiamente applicabili per scopi di colorazione negativa. Il fattore principale che influenza l'integrità del supporto è lo spessore del carbonio, che viene determinato durante l'evaporazione del carbonio. Allo stesso modo, con questo protocollo GrOx, si ottiene regolarmente una buona copertura su tutta la griglia (Figura 2B). Una singola applicazione di sospensione GrOx per 1 minuto è sufficiente per garantire poche aree con più strati, che sono facili da vedere a causa dei bordi dei fiocchi. Le griglie GrOx possono essere preparate rapidamente dalle materie prime e sono altamente protettive del campione. Tuttavia, i bordi dei fiocchi, la copertura incompleta e l'arruffamento sono più frequentemente visibili con le griglie GrOx rispetto alle altre tecniche a causa della natura dei fiocchi di GrOx.
Sebbene l'integrità del film di supporto al grafene, come il carbonio amorfo, dipenda dal processo di deposizione, le aree ben coperte mostrano il caratteristico modello di diffrazione del grafene a strato singolo. È importante sottolineare che, mantenendo bagnate le pellicole di supporto al grafene, i campioni possono essere recuperati dal blocco di galleggiamento dopo un periodo di incubazione e i dati raccolti in modo suscettibile di analisi a singola particella. Questo metodo non richiede alcun altro trattamento del grafene per la bagnatura, eliminando così la necessità di costose attrezzature per rendere il grafene idrofilo, ed è meglio preparare pellicole di supporto poco prima della preparazione del campione e del congelamento della griglia (Figura 2C).
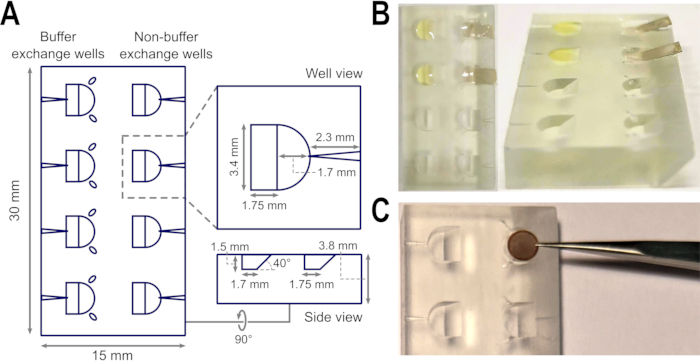
Figura 1: Progettazione e applicazione del blocco di galleggiamento del campione durante la preparazione del film di supporto. (A) Schema delle viste superiori, del pozzo e laterali del blocco di galleggiamento, comprese le misurazioni della forma, della profondità e dell'inclinazione. Sono indicati i solchi per le punte delle pinzette per riposare, così come i canali per inserire gli aghi. (B) Gli strati di carbonio amorfo possono essere facilmente fatti galleggiare sulla superficie del tampone contenuto all'interno dei pozzetti del blocco di galleggiamento utilizzando la rampa, cioè durante la preparazione di griglie TEM macchiate negativamente. (C) La larghezza dei pozzetti è adatta ad ospitare una griglia TEM, mentre le scanalature della pinzetta riducono la necessità di rilasciare e raccogliere le griglie inutilmente durante le fasi di preparazione, ma offrono un percorso definito per recuperare le griglie senza rischio di flessione se le griglie vengono rilasciate. Le immagini in B sono modificate da 27. Abbreviazione: TEM = microscopia elettronica a trasmissione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Esempi tipici di film di supporto campione preparati utilizzando il blocco di galleggiamento. Le viste quadrate della griglia (a sinistra) e dell'immagine (a destra) sono mostrate per (A) carbonio amorfo, (B) ossido di grafene e (C) film di supporto al grafene preparati utilizzando il blocco di galleggiamento. Il supporto in carbonio amorfo è stato utilizzato nella preparazione dei ribosomi 70S per la colorazione negativa, mentre i supporti di ossido di grafene e grafene sono stati utilizzati nella preparazione di ribosomi 70S per crio-EM. Le immagini in A e C sono modificate da 27. Barra di scala per un quadrato della griglia = 10 μm; barre di scala per i quadrati della griglia B e C = 5 μm; barre di scala per le viste immagine A-C = 50 nm. Abbreviazione: cryo-EM = crio-microscopia elettronica. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo documento presenta protocolli per la gestione di film di carbonio amorfo e grafene per la preparazione di campioni crio-EM utilizzando un blocco di galleggiamento del campione27. Un file STL per il blocco di supporto è disponibile gratuitamente dal repository pubblico Thingiverse [www.thingiverse.com/thing:3440684] e può essere stampato in 3D con qualsiasi stampante stereolitografica adatta da una resina adatta. L'uso di film di carbonio che coprono una griglia TEM di solito comporta la fluttuazione del carbonio sul campione28. Questo approccio alla preparazione di griglie di macchie negative riduce al minimo l'esposizione all'aria durante la manipolazione del supporto, riducendo così la contaminazione e la denaturazione delle proteine. La preparazione di griglie utilizzando carbonio galleggiante in piccoli pozzi è vantaggiosa per galleggiare su una superficie più ampia, cioè in un bagno d'acqua o in una capsula di Petri, nel qual caso la cesoiatura meccanica del carbonio avviene molto più facilmente.
UAc può essere difficile da acquistare a causa delle attuali normative in materia di salute e sicurezza al momento della pubblicazione. Sono disponibili molti altri reagenti di colorazione negativa non radioattivi di uso comune e sono stati descritti in precedenza protocolli per la loro preparazione29. Sebbene non siano state utilizzate macchie alternative con questo blocco di galleggiamento di supporto, non è probabile che ci siano differenze in questi protocolli oltre all'ottimizzazione del tempo di incubazione con il campione (passaggio 3.5), che è già intrinsecamente dipendente dal campione. Il passaggio chiave in questo protocollo di preparazione del supporto GrOx è il passaggio 4.4, evidenziato dalla nota per evitare che l'acqua e la soluzione GrOx entrino in contatto attorno al bordo della griglia. La miscelazione inappropriata dell'acqua e delle soluzioni GrOx impedisce l'assestamento unidirezionale dei fiocchi di GrOx per azione capillare. Avere fiocchi di GrOx su entrambi i lati della lamina di carbonio si traduce in strati spessi, annullando così i vantaggi dell'utilizzo di GrOx come supporto quasi a strato singolo, oltre a intrappolare l'acqua tra i fiocchi, causando la contaminazione delle aree utilizzabili con ulteriori strati di ghiaccio. La preparazione del supporto all'ossido di grafene è relativamente facile da ottenere utilizzando goccioline di soluzione su film poliolefinico flessibile. Tuttavia, se eseguito in questo modo, è più facile contaminare accidentalmente il lato rame della griglia con errori di manipolazione; l'uso del blocco di galleggiamento riduce la probabilità di questa eventualità.
Infine, questo documento presenta un protocollo per preparare griglie ricoperte di grafene che evita qualsiasi tipo di pretrattamento del grafene per renderlo idrofilo, riducendone così i costi e aumentandone l'accessibilità. Mantenere un film bagnato durante tutta la preparazione del campione e applicare il campione in situ nel blocco appena prima del congelamento è sufficiente per consentire la generazione di strati di ghiaccio adatti per crio-EM con una distribuzione omogenea del campione. Nel complesso, i protocolli qui presentati riducono al minimo il contatto del campione con l'interfaccia aria-acqua, riducendo così la denaturazione del campione e la contaminazione del supporto. Per i tre film di supporto utilizzati in questi approcci, è stato possibile ottenere distribuzioni omogenee del campione attraverso le griglie insieme all'imaging di singole particelle intatte e ben conservate.
Divulgazioni
Gli autori non sono a conoscenza di alcun conflitto di interessi rispetto a questo lavoro.
Riconoscimenti
Gli autori desiderano ringraziare tutti i membri della Sezione di Biologia Strutturale e Sintetica dell'Imperial College di Londra che hanno contribuito a testare queste tecniche, così come Harry Barnett dell'Imperial College Advanced Hackspace e Paul Simpson del Centre for Structural Biology. CHSA è supportato da una Sir Henry Dale Fellowship finanziata congiuntamente dal Wellcome Trust e dalla Royal Society (206212/Z/17/Z).
Materiali
| Name | Company | Catalog Number | Comments |
| Basic Plasma Cleaner (230 V) | Harrick Plasma | PDC-32G-2 | |
| Dumont tweezers N5A INOX. | Dumont Swissmade | 0302-N5A-PO | |
| Dumont tweezers NGG INOX. | Dumont Swissmade | 0102-NGG-PO | |
| Ehtylacetate | Sigma-Aldrich | 270989-250ML | |
| Fishing Loops 10 μL | VWR | 612-9353 | |
| Graphene Oxide 2 mg/mL | Sigma-Aldrich | 763705-25ML | |
| Iron (III) chloride | Sigma-Aldrich | 31232-250MG | |
| Mica Sheets 75 mm x 25 mm x 0.15 mm | Agar Scientific | AGG250-1 | We usually coat mica with a target carbon film thickness of 2 nm |
| Monolayer Graphene on Cu | Graphenea | N/A | 10 mm x 10 mm, pack of 4 |
| n-dodecyl β-D-maltoside (DDM) | GLYCON Biochemicals GmbH | D97002-C | |
| Quantifoil R1.2/1.3 300 mesh copper grids | Enzo Life Sciences | JBS-X-101-Cu300 | |
| Quantifoil R2/1 300 mesh copper grids | Enzo Life Sciences | JBS-X-102-Cu300 | |
| Quantifoil R2/1 300 mesh gold grids | Electron Microscopy Sciences | Q350AR1 | |
| Scissors | Agar Scientific | AGT577 | |
| Uranyl Acetate | TAAB Laboratories Equipment | U001 | |
| Vitrobot Mark IV | FEI | N/A | |
| Whatman filter paper 55 mm | GE Healthcare Life Sciences | 1441-055 | |
| Whatman filter paper 70 mm | GE Healthcare Life Sciences | 1441-070 |
Riferimenti
- Frank, J. Advances in the field of single-particle cryo-electron microscopy over the last decade. Nature Protocols. 12 (2), 209-212 (2017).
- Lyumkis, D. Challenges and Opportunities in Cryo-EM Single-Particle Analysis. Journal of Biological Chemistry. 294 (13), 5181-5197 (2019).
- Elmlund, D., Elmlund, H. Cryogenic Electron Microscopy and Single-Particle Analysis. Annual Review of Biochemistry. 84 (1), 499-517 (2015).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Arnold, S. A., et al. Miniaturizing EM Sample Preparation: Opportunities, Challenges, and "Visual Proteomics". Proteomics. 18 (5-6), 1700176(2018).
- Wu, S., Armache, J. P., Cheng, Y. Single-particle cryo-EM data acquisition by using direct electron detection camera. Microscopy. 65 (1), Oxford, England. 35-41 (2016).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 34257(2018).
- Grimm, R., Typke, D., Bärmann, M., Baumeister, W. Determination of the inelastic mean free path in ice by examination of tilted vesicles and automated most probable loss imaging. Ultramicroscopy. 63 (3-4), 169-179 (1996).
- Glaeser, R. M. Proteins, interfaces, and cryo-EM grids. Current Opinion in Colloid and Interface Science. 34, 1-8 (2018).
- D'Imprima, E., Floris, D., Joppe, M., Sánchez, R., Grininger, M., Kühlbrandt, W. Protein denaturation at the water-air interface and how to prevent it. eLife. 8, 400432(2019).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2013 (2), 00461(2013).
- Russo, C. J., Passmore, L. A. Controlling protein adsorption on graphene for cryo-EM using low-energy hydrogen plasmas. Nature Methods. 11 (6), 649-652 (2014).
- Naydenova, K., Russo, C. J. Measuring the effects of particle orientation to improve the efficiency of electron cryomicroscopy. Nature Communications. 8 (1), 8-12 (2017).
- Jain, T., Sheehan, P., Crum, J., Carragher, B., Potter, C. S. Spotiton: A prototype for an integrated inkjet dispense and vitrification system for cryo-TEM. Journal of Structural Biology. 179 (1), 68-75 (2012).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195 (2), 190-198 (2016).
- Feng, X., et al. A Fast and Effective Microfluidic Spraying-Plunging Method for High-Resolution Single-Particle Cryo-EM. Structure. 25 (4), 663-670 (2017).
- Ermantraut, E., Wohlfart, K., Tichelaar, W. Perforated support foils with pre-defined hole size, shape and arrangement. Ultramicroscopy. 74 (1-2), 75-81 (1998).
- Adrian, M., Dubochet, J., Lepault, J., McDowall, A. W. Cryo-electron microscopy of viruses. Nature. 308 (5954), 32-36 (1984).
- Fujiyoshi, Y. The structural study of membrane proteins by electron crystallography. Advances in Biophysics. 35, 25-80 (1998).
- Koning, R. I., Oostergetel, G. T., Brisson, A. Preparation of flat carbon support films. Ultramicroscopy. 94 (34), 183(2003).
- Hummers, W. S., Offeman, R. E. Preparation of Graphitic Oxide. Journal of the American Chemical Society. 80 (6), 1339(1958).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Pantelic, R. S., et al. Graphene: Substrate preparation and introduction. Journal of Structural Biology. 174 (1), 234-238 (2011).
- Li, X., et al. Large-area synthesis of high-quality and uniform graphene films on copper foils. Science. 324 (5932), 1312-1314 (2009).
- Regan, W., et al. A direct transfer of layer-area graphene. Applied Physics Letters. 96 (11), 2008-2011 (2010).
- Brilot, A. F., et al. Beam-induced motion of vitrified specimen on holey carbon film. Journal of Structural Biology. 177 (3), 630-637 (2012).
- de Martín Garrido, N., et al. Direct transfer of electron microscopy samples to wetted carbon and graphene films via a support floatation block. Journal of Structural Biology. 213 (1), 107677(2021).
- Valentine, R. C., Shapiro, B. M., Stadtman, E. R. Regulation of Glutamine Synthetase. XII. Electron Microscopy of the Enzyme from Escherichia coli. Biochemistry. 7 (6), 2143-2152 (1968).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199(2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon