Method Article
从组织和尿液中产生人类肾脏结核
摘要
人类肾结肠培养物是研究肾脏生理学和疾病的宝贵 体外 模型。甲状腺素可以从肾脏组织(健康和患病)以及尿液中建立,后者代表一种容易获得和侵入性较小的研究材料来源。
摘要
成人干细胞(ASC)衍生的人类肾脏上皮器官,或管状体,可以建立从健康和患病的肾脏上皮与高效率。正常的肾管状体可以概括其原产组织的许多方面。它们代表不同的肾上腺部分 - 最明显的近体管,亨勒环,基座管,和收集管道 - 并可用于研究正常的肾脏生理学。此外,管状技术还有助于疾病建模, 例如传染病和癌症。然而,获得管状体生成的肾上皮细胞取决于剩余的手术材料(如部分)肾切除术或针头活检。从尿液中培养管状体的能力将提供一种替代的、侵入性较小的健康肾脏上皮细胞来源。此前已经表明,管状培养物只能从几毫升新鲜收集的尿液中成功生成。本文描述了从组织和尿液样本中生成和传播ASC衍生的人类肾管培养物的程序。
引言
肾脏执行系统控制体液平衡的功能。其生理机能的损伤可能由不同的因素引起,包括糖尿病、高血压和药物引起的毒性1。为了更好地了解正常的肾脏生理学以及肾脏疾病的发展,使用具有代表性的临床前模型至关重要。近年来,根据所谓的器官技术2,产生了几个体外肾脏模型。器官是三维的多细胞结构,类似于它们起源的组织的形态和生理学(正常或患病)。它们可以由多能干细胞(PSCs)或成人干细胞(ASC)产生,每个干细胞都有自己的特性和应用。
PSC衍生的肾脏器官模仿肾生成3,4,5。它们也可以通过强制分化(诱导多能性或iPSC)从患者衍生的致病细胞中建立。iPSC随后可以通过及时接触特定的生长因子鸡尾酒,区分成肾上腺素的不同细胞类型,肾功能单元。虽然在菜中创建一个相当完整的迷你器官,它们的建立仍然耗时,由于重新编程协议,iPSC可能容易受到不受欢迎的遗传不稳定6。此外,iPSC器官不能完全成熟成成人肾细胞,揭示出一个转录体配置文件,类似于胎儿肾脏在早期发育阶段7。
ASC衍生的人类肾管状体已被证明可以概括成人肾上皮的更新。它们主要代表近丘,亨勒环,异形管,和收集管道,通过不同运输蛋白的表达确认8,9,10。管状培养方案允许患者衍生肾脏组织的快速扩张,同时保持稳定的基因组。研究应用包括研究正常的肾脏生理学,肾毒性,药物测试,以及疾病建模8,10,11,12。建立患者衍生的器官培养物(包括管状体)的一个潜在局限性是新鲜组织的可用性。然而,一些报告表明,尿液可以作为肾脏上皮细胞的来源,从而提供了一个更简单,侵入性较小的策略,以获得患者材料的管状培养8,13,14。事实上,最近已经表明,管状体可以从尿液8生长。本文描述了从肾脏组织和尿液建立和维持管状培养物。
研究方案
注:此处描述的实验已获得伊拉斯谟医疗中心(荷兰鹿特丹)医学伦理委员会和墨西哥公主儿科肿瘤中心(荷兰乌得勒支)的批准。
1. 从组织中产生人类肾管
- 材料
- 预温多井组织培养板(6,12和24井)在37°C过夜。
- 准备基底介质 (AdDF++) 通过添加 1x L-丙氨酸/L-谷氨酰胺补充剂, 1% w/v 4-(2-羟基乙酰) -1 - 管道拉青素乙醇酸 (HEPES, 10 mM), 和 1% 青霉素/链霉素抗生素高级 DMEM/F12.
- 准备培养介质通过添加 1.5% B27 补充, 10% R 海绵丁条件介质, 表皮生长因子(50 ng/mL)、成纤维细胞生长因子-10(100 ng/mL)、N-乙酰半胱氨酸(1.25 mM)、罗基纳斯 抑制剂 Y-27632 (10 μM)、广谱抗生素 (0.1 毫克/毫升) 和 A83-01 (5 μM) 至 AdDF++ 。 使用前加热至 37 °C。
- 在 4 °C 下隔夜解冻,准备地下室膜提取物 (BME)。 在手术过程中将 BME 放在冰上。
- 通过将拼贴剂稀释至 AdDF+®中最终浓度为 1 毫克/mL,并添加 10 μM Y-27632 来准备拼贴剂溶液。预热至 37 °C。
- 准备 10 厘米的佩特里菜、手术刀和钳子。使用紫外线灯对器皿进行20分钟的消毒,然后用消毒剂、demi水和70%v/v乙醇清洗。空气干燥的器皿。
- 将水平摇床预温至 37 °C。
- 程序
- 在充满 30-40 mL AdDF++介质的 50 mL 管中收集肾脏组织。将组织片放在 10 厘米的培养皿中,中间为 ±1 mL。用手术刀将组织切成+1毫米3大小的碎片(图1A)。
- 使用钳子和手术刀将切碎的组织转移到 15 mL 管中。在培养皿中加入 5 mL 的 AdDF++,用 10 mL 无菌移液器清洗和收集介质。将所有这些内容转移到同一管中。
- 离心机在室温下300× 克 5分钟,并取出超高线。在 15 mL 管中加入 3-4 mL 拼贴液解决方案。将管子移到 37 °C 水平摇床,转速为 250 rpm。
- 孵化前15分钟后,检查样品并大力摇动管子。重复,直到悬浮是同质的,大多数组织片已经消失,最大潜伏时间为45-60分钟(图1B)。
- 将管子装满AdDF++,通过倒置管子5-10倍进行混合。离心机在 300 × g 5 分钟在 4 °C, 并删除超高。如果颗粒为红色,则继续执行步骤 1.2.6。否则,请前往第 1.2.8 步。
- 在细胞颗粒上添加1mL的红细胞裂解缓冲器(见 材料表)。轻轻敲击管子以重新悬念颗粒(不要用移液器尖端重新悬念)。在室温下孵育5分钟。
- 用AdDF++填充管子。离心机在 300 × g 5 分钟在 4 °C, 并删除超高。如果血细胞仍然可见,从第 1.2.6 步开始,再次重复该过程。否则,继续执行第 1.2.8 步。
- 如果在协议的这一点可见组织块,则继续执行第 1.2.8 步。否则,继续测量颗粒体积的第 1.2.9 步。在管子中加入 5 mL 的 AdDF+++,然后用 10 mL 无菌移液器重新使用。通过放置在 50 mL 管上的 100 μm 尼龙细胞过滤器过滤悬架。
- 将过滤过的悬架转移到新的 15 mL 管中。离心机在 300 × g 5 分钟在 4 °C, 并删除超高。使用设置为已知体积的 p1000 移液器测量细胞颗粒的体积。小心地上下移液器,在不产生气泡的情况下重新使用。将管子转移到冰上1分钟。
- 在颗粒中加入 70-75% 的 BME 体积。使用 p1000 或 p200 移液器进行重复, 和板 15 μL 液滴在预温, 多井细胞培养板 (6, 12, 或 24 井, 基于总电镀体积 (< 100 μL, 24 井; 100-200 μL, 12 井; >200 μL, 6 井)) 。
- 将盘子倒置,让盘子在37°C(图1C)下在孵化器中休息15-20分钟。添加预温文化媒介,并检查文化(图1C,D)。
2. 尿液中人类肾管的生成
注:尿液是细胞的敌对环境。要成功地执行此协议,必须尽快处理尿样,最好是在排泄后 4 小时内处理。同时,尿样应储存在4°C。
- 材料
- 预温多井组织培养板(6,12和24井)在37°C过夜。
- 准备洗涤介质:AdDF++补充广谱抗生素(0.1毫克/毫升)和10μM Y-27632。
- 准备上面所述的文化媒介。使用前在 37 °C 处预热。
- 准备 BME 矩阵。在手术过程中保持冰上。
- 程序
- 收集尿液样本,并将其平均分成50 mL管(图2A-I)。在每个管子中加入 10-20 mL 的洗涤介质。离心机在300×克5分钟在4°C(图2A-II),并小心地删除超高。
- 在每个管子中加入 10 mL 的洗涤介质。使用 10 mL 无菌移液器小心地重新使用颗粒。离心机在300×g 5分钟在4°C(图2A-III),并小心地删除超高。
- 重新使用颗粒,并将所有管子中的内容转移到一个 15 mL 管中。用洗涤介质填充管子。离心机在300×g 5分钟在4°C(图2A-IV),并删除超高。
- 使用设置为已知体积的 p1000 移液器测量细胞颗粒的体积。小心地上下移液器,在不产生气泡的情况下重新使用。将管子转移到冰上1分钟。
- 将 BME 的 70-75% 体积添加到颗粒中。使用 p1000 或 p200 移液器进行重复, 和板 15 μL 液滴在预温, 多井细胞培养板 (6, 12, 或 24 井, 基于总电镀体积 (< 100 μL, 24 井; 100-200 μL, 12 井; >200 μL, 6 井)) 。
- 在 37 °C 下将板倒置在孵化器中 15-20 分钟。 添加预温文化媒介,并检查文化(图2B)。
3. 扩大管状文化
注:Tubuloid 培养物大约每 1-2 周可以通过一次,拆分比为 1:2-1:3。它们通常可以扩展为大约 15 个通道,并具有特定于线的变体。
- 材料
- 预温多井组织培养板(6,12和24井)在37°C过夜。
- 准备基底介质(AdDF++),并在手术过程中将其放在冰上。
- 准备如前所述的文化媒介。使用前加热至 37 °C。
- 准备 BME 矩阵,并在手术过程中保持冰上。
- 准备试丁香替代剂,在10μM浓度下加入Y-27632。 使用前加热至37°C。
- 高压灭菌器非过滤 p10 提示。
- 将离心机冷却到 4 °C。
- 程序
- 使用井中的介质,用 p1000 移液器上下管道,破坏含有管状物的液滴。使用尖端刮打井底,确保收集连接到底部的所有细胞。
- 在 15 mL 管中收集内容。添加 10 mL 的 AdDF++ 。离心机在 300 x g 5 分钟在 4 °C, 并删除超高。
- 根据颗粒的大小,添加10μM Y-27632补充的试丁香替代剂。使用 1 mL 的试丁香替代剂 200 μL 含有管状体的 BME 液滴。在 37 °C 下孵育 5 分钟。
- 使用带尖端的 p1000 移液器,并在 1000 μL 尖端上插入未过滤的无菌 p10 尖端。皮佩特上下20-30倍机械地破坏器官。
- 在显微镜下检查,看看管子中是否仍然存在许多完整的器官(图3A)。如果此时存在超过 10% 的完整器官,则重复从步骤 3.2.3 中的 5 分钟孵化到第 3.2.5 步中完整器官的微观观察。否则,继续执行第 3.2.6 步。
- 用AdDF++填充管子。离心机在 300 × g 5 分钟在 4 °C 下,并删除超高。使用设置为已知体积的 p1000 移液器测量细胞颗粒的体积。小心地上下移液器,在不产生气泡的情况下重新使用。将管子转移到冰上1分钟。
- 在颗粒中加入 70-75% 的 BME 体积。使用 p1000 或 p200 移液器进行重复, 和板 15 μL 液滴在预温, 多井细胞培养板 (6, 12, 或 24 井, 基于总电镀体积 (< 100 μL, 24 井; 100-200 μL, 12 井; >200 μL, 6 井)) 。
- 将盘子倒置,让盘子在37°C下在孵化器中休息15-20分钟。 添加预温文化媒介,并检查文化(图3B)。
结果
对于肾脏组织,管状结构通常在建立后7天内出现(图1D)。前 7 天内缺乏明显增长表明协议的结果不成功。一般来说,管状培养物需要在第一次电镀后1-2周内通过。对于尿液,细胞生长在建立后大约14-21天变得明显,在板的底部出现紧凑的管状结构和/或粘附细胞(图2B)。如果在电镀后 4 周内无法用亮场显微镜检测到生长,则培养机构很可能失败。对于尿液衍生培养物,第一次通气一般发生在 3 到 4 周之间。虽然在第一段肾脏管状培养物主要由紧凑的结构组成,但囊性上皮管状管的存在随着通道数的增加而增加(图1D和图2B)。人类肾管状培养物的成功生成可以通过对管状肾上皮表达的标记物(如配对盒基因8蛋白(PAX8)(图4A,B)的标记进行免疫组织化学染色来评估。
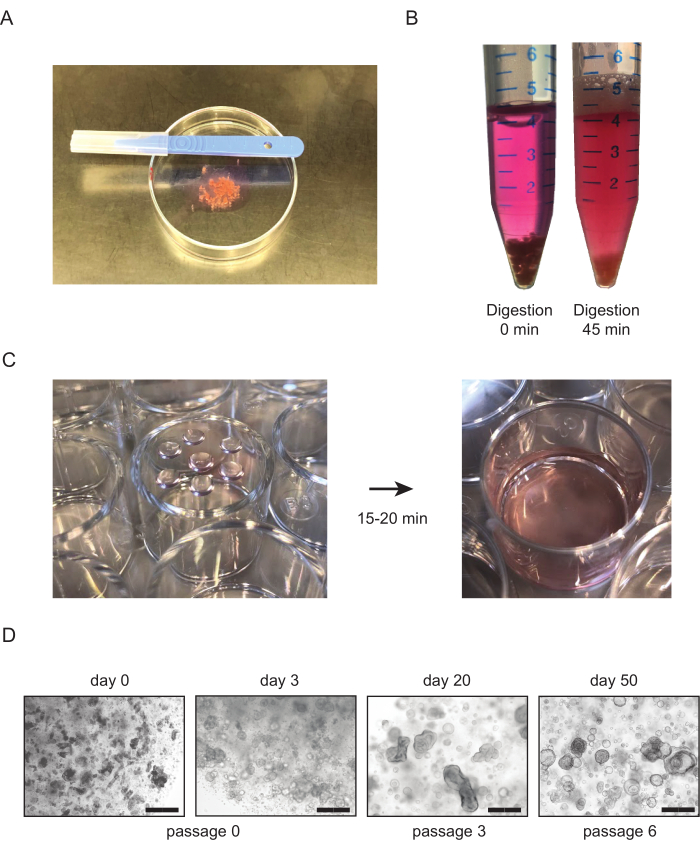
图1:组织衍生的肾管培养物。 (A) 切碎肾脏组织的程序概述。组织被切碎到+1毫米3 大小使用手术刀。(B) 健康肾脏组织正确酶消化的例子。组织显示之前(左)和后(右)45分钟的酶消化与拼贴剂。管子底部仍然可以看到少量组织,溶液应变为多云,表明悬架中存在细胞。(C) 含有加工肾脏组织的BME液滴电镀后细胞培养板的代表图像。电镀液滴后,培养板倒置(左),在 37 °C 下放置在孵化器中。 15-20分钟后,预设培养基被添加到井中(右)。(D) 组织衍生的管状体培养物的代表性明亮场图像。第一个管状结构在第一次播种后2-3天变得可见。随着通道数的增加,管状体通常会将形态改变为更囊性表型。秤杆 = 300 μm。缩写:BME = 地下室膜提取物。 请单击此处查看此图的较大版本。
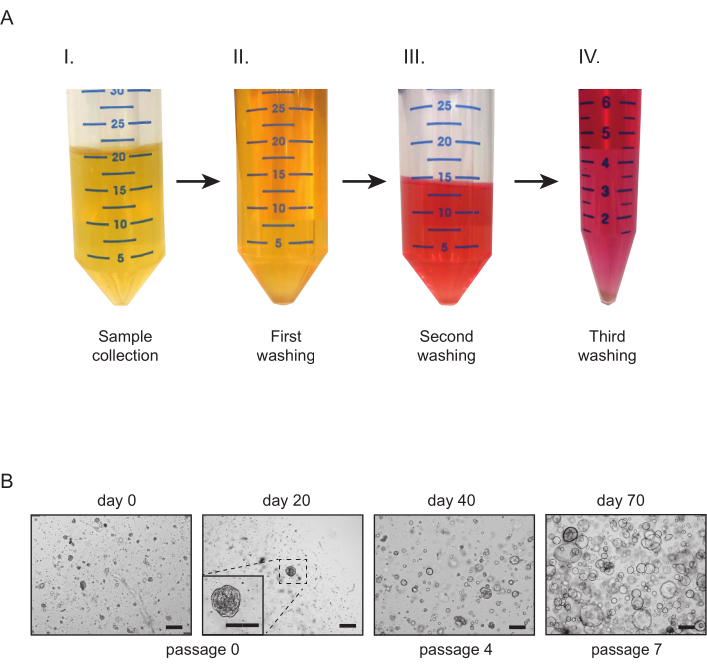
图2:尿源肾管培养物。 (A) 尿样处理概述。收集后尽快(I),尿样被分成50mL管,在洗涤介质中稀释(II)。在第二次清洗步骤(III)后,将管子的内容集中在一起,并在电镀前进行第三次也是最后一次清洗步骤(IV)。(B) 代表尿液衍生的管状体培养物的明亮场图像。第一个管状结构和粘附细胞应在第一次电镀后21天内可见。刻度条 = 300 μm. 请单击此处查看此图的较大版本。
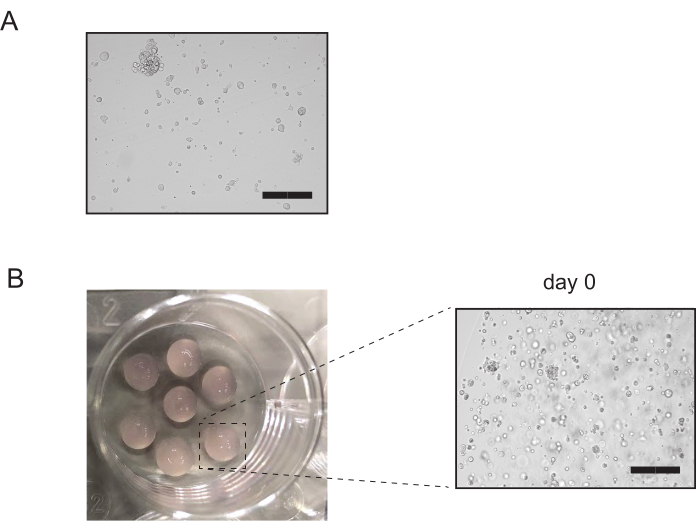
图3:肾管培养物的传递。 (A) 酶消化后肾管状培养物的代表形象。完成消化后,不应保留不超过10%的完整管状结构。比例栏 = 300μm.(B) 电镀后肾管状培养物的代表图像。对文化的检查证实,大多数的管状物已被破坏。缩放栏 = 300 μm 请单击此处查看此图的较大版本。
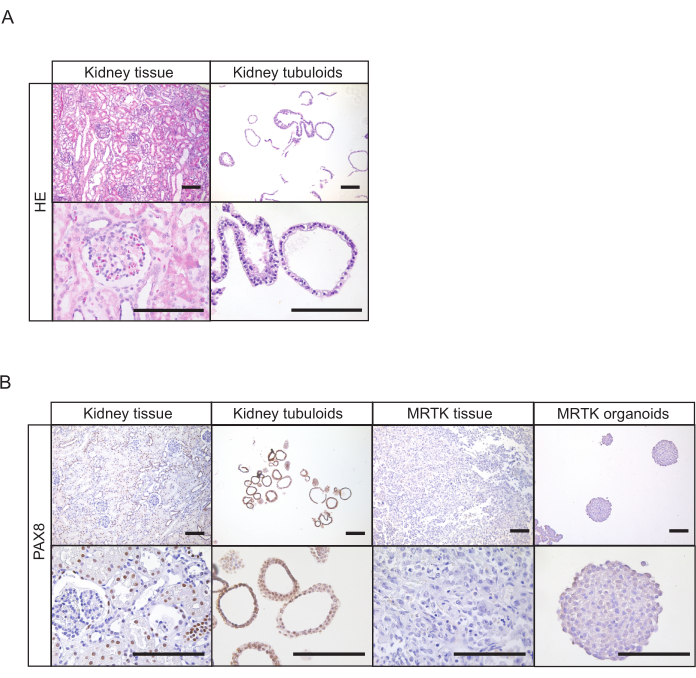
图4:管状培养物的组织特征。 (A) 健康肾脏组织和管状体的H&E染色。比例杆 = 100 μm.(B) 正常肾脏组织、管状体、MRTK 组织和 MRTK 器官中 PAX8 的免疫造血术。器官结构的PAX8积极性证实了其肾脏上皮起源。健康的肾脏组织显示阳性(结块)和负结构(球状)。MRTK 组织和器官被包括为负控制。比例条 = 100μm. 缩写: H +E = 血氧林和欧辛;PAX8 = 配对盒基因 8;MRTK = 肾脏的恶性狂犬病肿瘤。 请单击此处查看此图的较大版本。
讨论
器官被认为是从中衍生出来的组织的化身。它们允许快速扩展患者材料,同时保留原产地组织15的基因型和表型特征。器官技术最近为开发更具代表性的临床前模型打开了大门,这些模型可用作将研究结果从长凳上翻译到床边的重要工具。肾管状物是有希望的体外模型,以测试药物引起的肾毒性,许多化疗药物2,8,12常见的副作用。因此,患者衍生的肿瘤器官培养物被证明对患者对治疗的反应具有预测性。因此,在管状体上以高通量方式测试药物,有可能更好地定义治疗窗口,并降低患者因药物引起的肾毒性的风险。
常用的抗生素被描述为对肾脏产生毒性作用。虽然广谱抗生素的存在对于通过防止污染成功建立文化是必要的,但重要的是要考虑它们潜在的肾毒性。虽然没有观察到抗生素对建立管状培养物的负面影响,但需要进一步调查,以彻底评估其影响。可利用图布勒类化合物研究和建模疾病8。Ciliopathies(西莉亚病理功能障碍)以及其他影响肾脏的遗传综合征可以通过直接从受影响的受试者生成管状线来研究,或者通过使用健康培养物,通过CRISPR/Cas9基因组编辑20引入疾病特异性驱动突变。
虽然管状体是多细胞肾脏培养物,但它们缺乏几种肾细胞类型,包括卵细胞和内皮细胞8。此外,与其他一些ASC衍生的器官模型相比,管状体具有有限的复制潜力,因为它们可以培养约15个通道。然而,这种有限的寿命可以通过在文化媒介21中加入Wnt来显著延长。需要进一步优化管状培养方案,使其更具代表性的肾脏,包括更差异化的细胞类型。虽然组织样本中管状物的建立效率非常高(>95%),但在极少数情况下,它可能会失败。原因可能不同,包括:1) 起始材料质量差(例如,药物治疗导致的坏死组织),2) 组织样本消化过度,或 3) 主要样品污染。
为了确保收到的组织样本的质量足以继续执行协议,务必与进行手术后组织评估的病理工作人员保持密切联系。如果有足够的材料,其可行性必须通过组织学检查(如血氧林和青霉素染色)来确认。此外,为了防止细胞裂解在酶消化过程中,重要的是孵化过程不超过1小时。最后,为了防止污染,应在洗涤和培养介质中添加抗生素和抗真菌剂。
尿液可以含有从肾脏22中提取的去角质上皮细胞,这些细胞会污染管状培养物。例如,这些细胞包括尿素细胞,与肾管细胞相比,对肿瘤蛋白P63呈阳性,对PAX88呈阴性。因此,建议在进行后续实验(图4B)之前,测试PAX8积极培养物,以确认既定肾管状体的纯度。
尿液代表一个敌对的环境细胞由于高渗透压力和低pH值。因此,在尿液收集后尽快处理样品对于协议的成功至关重要。因此,应尽快用缓冲溶液稀释和广泛清洗收集的尿液,以确保在播种时存在可行的细胞。如果尿液在处理前储存数小时,管状物的建立成功率将显著降低。最后,尿液虽然无菌,但与收集过程相关的污染风险很高。因此,用抗生素和抗真菌剂补充洗涤和生长介质非常重要。如果将上述所有因素考虑在内,可以达到大约 50% 的成功率。
披露声明
作者声明没有利益冲突。
致谢
我们感谢所有患者及其家属参与这项研究。我们感谢为我们的研究提供便利的临床团队。我们感谢欧洲研究理事会(ERC)开始向850571(J.D.)、荷兰癌症协会(KWF)/阿尔佩·德胡泽斯·巴斯·穆德奖(第10218号,J.D.)、Oncode研究所和无儿童癌症基金会(Kika no. 292,C.C)提供资助。
材料
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939/10 | Stock of 5 mM, final concentration of 5 µM, activin receptor-like kinase 5 inhibitor |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634010 | |
| antiPAX8 antibody | LSBio | LS-B13466 | |
| B27 supplement | ThermoFisher Scientific | 17504044 | Stock of 50x, final concentration of 1x |
| BME | Trevigen | 3533-010-02 | |
| Collagenase | Sigma Aldrich | C9407 | Stock of 10 mg/mL, final concentration of 1 mg/mL |
| EGF | Peprotech | AF-100-15 | Stock of 0.5 mg/mL, final concentration of 50 ng/mL |
| FGF10 | Peprotech | 100-26 | Stock of 0.1 mg/mL, final concentration of 100 ng/mL |
| GlutaMAX - L-alanine/L-glutamine | Gibco | 35050061 | Stock of 100x, final concentration of 1x |
| Hepes | Gibco | 15630106 | Stock of 1 M, final concentration of 10 mM |
| Multiwell tissue culture plates 12 wells | CELLSTAR | 665180 | |
| Multiwell tissue culture plates 24 wells | CELLSTAR | 662160 | |
| Multiwell tissue culture plates 6 wells | CELLSTAR | 657160 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Stock of 500 mM, final concentration of 1.25 mM |
| Penicillin/Streptomycin | Gibco | 15140163 | Stock of 10.000 U/mL, final concentration of 100 U/mL |
| Primocin - broad-range antibiotics | Invivogen | ant-pm-1 | Stock of 50 mg/mL, final concentration of 0.1 mg/mL |
| Red blood cells lysis buffer | Roche | 11814389001 | |
| RhoKinase inhibitor Y-27632 | Abmole Bioscience | M1817 | Stock of 100 mM, final concentration of 10 µM |
| R-spondin conditioned medium | Produced in house with the use of stable cell lines generated by Calvin Kuo lab. Final concentration is 10% | ||
| TrypLe Express/ trypsin replacement agent | ThermoFisher Scientific | 12605010 |
参考文献
- Romagnani, P., et al. Chronic kidney disease. Nature Reviews. Disease Primers. 3, 17088 (2017).
- Ooms, A. H., Calandrini, C., de Krijger, R. R., Drost, J. Organoid models of childhood kidney tumours. Nature Reviews. Urology. 17 (6), 311-313 (2020).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Low, J. H., et al. Generation of human PSC-derived kidney organoids with patterned nephron segments and a de novo vascular network. Cell Stem Cell. 25 (3), 373-387 (2019).
- Little, M. H., Combes, A. N. Kidney organoids: accurate models or fortunate accidents. Genes & Development. 33 (19-20), 1319-1345 (2019).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Schutgens, F., et al. Tubuloids derived from human adult kidney and urine for personalized disease modeling. Nature Biotechnology. 37 (3), 303-313 (2019).
- Jun, D. Y., et al. Tubular organotypic culture model of human kidney. PLoS One. 13 (10), 0206447 (2018).
- Grassi, L., et al. Organoids as a new model for improving regenerative medicine and cancer personalized therapy in renal diseases. Cell Death & Disease. 10 (3), 1-15 (2019).
- Yousef Yengej, F. A., Jansen, J., Rookmaaker, M. B., Verhaar, M. C., Clevers, H. Kidney organoids and tubuloids. Cells. 9 (6), 1326 (2020).
- Calandrini, C., et al. An organoid biobank for childhood kidney cancers that captures disease and tissue heterogeneity. Nature Communications. 11 (1), 1310 (2020).
- Jansen, J., et al. A morphological and functional comparison of proximal tubule cell lines established from human urine and kidney tissue. Experimental Cell Research. 323 (1), 87-99 (2014).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nature Protocols. 7 (12), 2080 (2012).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Morales-Alvarez, M. C. Nephrotoxicity of antimicrobials and antibiotics. Advances in Chronic Kidney Disease. 27 (1), 31-37 (2020).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Dörrenhaus, A., et al. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system. Archives of Toxicology. 74 (10), 618-626 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。