Method Article
Geração de Tubuloides de Rim Humano a partir de tecido e urina
Neste Artigo
Resumo
As culturas tubuloides renais humanos representam um modelo in vitro valioso para estudar fisiologia renal e doenças. Os tubuloides podem ser estabelecidos a partir do tecido renal (saudável e doente), bem como da urina, este último representando uma fonte facilmente obtida e menos invasiva de material de pesquisa.
Resumo
Organoides epiteliais renais humanos derivados (ASC) derivados, ou tubuloides, podem ser estabelecidos a partir de epitélio renal saudável e doente com alta eficiência. Tubuloides renais normais recapitulam muitos aspectos de seu tecido de origem. Eles representam segmentos distintos de nefrão - mais notavelmente do túbulo proximal, laço de Henle, túbulos distais e coletor de dutos - e podem ser usados para estudar a fisiologia renal normal. Além disso, a tecnologia tubuloide facilita a modelagem de doenças, por exemplo,para doenças infecciosas e também para o câncer. A obtenção de células epiteliais renais para geração tubuloide é, no entanto, dependente de restos de material cirúrgico (como nefrectomias parciais) ou biópsias de agulhas. A capacidade de cultivar tubuloides da urina forneceria uma fonte alternativa, menos invasiva de células epiteliais renais saudáveis. Foi demonstrado anteriormente que culturas tubuloides podem ser geradas com sucesso a partir de apenas alguns mililitros de urina recém-coletada. Este artigo descreve os protocolos para gerar e propagar culturas tubuloides de rim humano derivados do ASC a partir de amostras de tecido e urina.
Introdução
Os rins desempenham a função de controlar sistemicamente o equilíbrio dos fluidos corporais. O comprometimento de sua função fisiológica pode ser causado por diferentes fatores, incluindo diabetes, hipertensão e toxicidade induzida por drogas1. Para uma melhor compreensão da fisiologia renal normal, bem como para o desenvolvimento de doenças renais, o uso de modelos pré-clínicos representativos é crucial. Nos últimos anos, vários modelos in vitro de rins foram gerados com base na chamada tecnologia organoide2. Organoides são estruturas tridimensionais e multicelulares que se assemelham à morfologia e fisiologia do tecido (normal ou doente) de onde se originam. Eles podem ser gerados a partir de células-tronco pluripotentes (PSCs) ou células-tronco adultas (ASCs), cada uma com suas próprias características e aplicações.
Organoides renais derivados do PSC imitam nefigenese3,4,5. Elas também podem ser estabelecidas a partir de células cometidas derivadas do paciente por desdiferente forçada (pluripotência induzida ou iPSC). Os iPSCs podem posteriormente ser diferenciados nos diferentes tipos celulares do nefron, a unidade funcional do rim, por exposição oportuna a coquetéis específicos de fator de crescimento. Ao criar um mini-órgão bastante completo em um prato, seu estabelecimento permanece demorado, e devido ao protocolo de reprogramação, os iPSCs podem ser suscetíveis à instabilidade genética indesejada6. Além disso, os organoides iPSC não são capazes de amadurecer totalmente em células renais adultas, revelando um perfil de transcriptome que se assemelha ao rim fetal em um estágio de desenvolvimento precoce7.
Os tubuloides renais humanos derivados do ASC mostraram-se para recapitular a renovação do epitélio renal adulto. Eles representam principalmente o túbulo proximal, laço de Henle, túbulos distais e duto de coleta, confirmado pela expressão de diferentes proteínas transportadoras8,9,10. O protocolo de cultura tubuloide permite a rápida expansão do tecido renal derivado do paciente, mantendo um genoma estável. As aplicações da pesquisa incluem o estudo da fisiologia renal normal, nefrotoxicidade, testes medicamentosos, bem como modelagem dedoenças 8,10,11,12. Uma limitação potencial do estabelecimento de culturas organoides derivadas do paciente, incluindo tubuloides, é a disponibilidade de tecido fresco. No entanto, vários relatos mostraram que a urina pode servir de fonte para células epiteliais renais, fornecendo assim uma estratégia muito mais simples e menos invasiva para obter material do paciente para culturas tubuloides8,13,14. De fato, foi recentemente mostrado que os tubuloides podem ser cultivados a partir da urina8. Este artigo descreve o estabelecimento e a manutenção de culturas tubuloides a partir de tecido renal e urina.
Protocolo
NOTA: Os experimentos aqui descritos foram aprovados pelo comitê de ética médica do Erasmus Medical Center (Roterdã, nos Países Baixos) e pelo Princess Máxima Center for Pediatric Oncology (Utrecht, nos Países Baixos).
1. Geração de tubuloides renais humanos a partir do tecido
- Materiais
- Placas de cultura de tecido multi-incauto pré-inaque (6, 12 e 24 poços) durante a noite a 37 °C.
- Prepare o meio basal (AdDF+++) adicionando 1x suplemento L-alanine/L-glutamina, 1% w/v 4-(2-hidroxitil)-1-piperazina ácido elanfonônico (HEPES, 10 mM) e 1% antibióticos penicilina/estreptomicina para DMEM/F12 avançado.
- Prepare o meio de cultura adicionando 1,5% de suplemento B27, 10% de meio-condicionado r-spondin, fator de crescimento epidérmico (50 ng/mL), fator de crescimento do fibroblasto-10 (100 ng/mL), N-acetilcisteína (1,25 mM), inibição de rho-kinase Y-27632 (10 μM), antibióticos de amplo espectro (0,1 mg/mL) e A83-01 (5 μM) para AdDF+++. Aqueça até 37 °C antes de usar.
- Prepare o extrato da membrana do porão (BME) descongelando uma alíquota durante a noite a 4 °C. Mantenha o BME no gelo durante o procedimento.
- Prepare a solução de colagenase diluindo a colagem para uma concentração final de 1 mg/mL em AdDF+++, com a adição de 10 μM Y-27632. Aqueça até 37 °C.
- Prepare pratos petri de 10 cm, bisturis e pinças. Desinfete os utensílios aplicando uma lâmpada ultravioleta por 20 minutos, seguido de lavagem com desinfetante, demi water e 70% v/v etanol. Seque os utensílios.
- Pré-aquecimento um agitador horizontal a 37 °C.
- Procedimento
- Coletar tecido renal em um tubo de 50 mL preenchido com 30-40 mL de meio AdDF+++. Coloque o pedaço de tecido em ~1 mL de meio em uma placa de Petri de 10 cm. Pique o tecido em pedaços de ~1 mm3 tamanho usando bisturis(Figura 1A).
- Transfira o tecido picado para um tubo de 15 mL usando fórceps e bisturis. Adicione 5 mL de AdDF+++ à placa de Petri, lave e colete o meio com uma pipeta estéril de 10 mL. Transfira todos esses conteúdos para o mesmo tubo.
- Centrifugar a 300 × g por 5 min à temperatura ambiente, e remover o sobrenatante. Adicione 3-4 mL de solução de colagenase ao tubo de 15 mL. Mova o tubo para um conjunto de agitação horizontal a 37 °C e uma velocidade de 250 rpm.
- Após os primeiros 15 minutos de incubação, verifique a amostra e agite vigorosamente o tubo. Repita até que a suspensão seja homogênea e a maioria dos pedaços de tecido tenham desaparecido, com um tempo máximo de incubação de 45-60 min.(Figura 1B).
- Encha o tubo com AdDF+++, e misture invertendo o tubo de 5 a 10x. Centrifugar a 300 × g por 5 min a 4 °C, e remover o sobrenatante. Se a pelota estiver vermelha, prossiga com a etapa 1.2.6. Caso contrário, vá para o passo 1.2.8.
- Adicione 1 mL de tampão de lise de glóbulos vermelhos (veja a Tabela de Materiais) em cima da pelota celular. Bata suavemente o tubo para resuspensar a pelota (não resuspend com ponta de pipeta). Incubar em temperatura ambiente por 5 minutos.
- Encha o tubo com AdDF+++. Centrifugar a 300 × g por 5 min a 4 °C, e remover o sobrenatante. Se as células sanguíneas ainda estiverem visíveis, repita o procedimento mais uma vez, a partir da etapa 1.2.6. Caso contrário, prossiga com a etapa 1.2.8.
- Se os pedaços de tecido forem visíveis neste ponto do protocolo, prossiga com a etapa 1.2.8. Caso contrário, prossiga com a medição do volume de pelotas na etapa 1.2.9. Adicione 5 mL de AdDF+++ ao tubo e resuspend com uma pipeta estéril de 10 mL. Filtre a suspensão através de um filtro de célula de nylon de 100 μm colocado em um tubo de 50 mL.
- Transfira a suspensão filtrada para um novo tubo de 15 mL. Centrifugar a 300 × g por 5 min a 4 °C, e remover o sobrenatante. Meça o volume da pelota celular usando uma pipeta p1000 definida para um volume conhecido. Pipeta cuidadosamente para cima e para baixo para resuspend sem criar bolhas de ar. Transfira o tubo para o gelo por 1 min.
- Adicione 70-75% de volume de BME à pelota. Resuspend usando uma pipeta p1000 ou p200, e placa 15 gotículas μL em uma placa de cultura celular pré-armada e multiwell (6, 12 ou 24 poços, com base no volume total de revestimento (<100 μL, 24 poços; 100-200 μL, 12 poços; >200 μL, 6 poços)).
- Vire a placa de cabeça para baixo, e deixe a placa descansar na incubadora por 15-20 min a 37 °C(Figura 1C). Adicione meio de cultura pré-armada e inspecione as culturas (Figura 1C,D).
2. Geração de tubuloides renais humanos a partir da urina
NOTA: Urina é um ambiente hostil para células. É importante para uma execução bem sucedida deste protocolo que as amostras de urina sejam processadas o mais rápido possível, de preferência dentro de 4h da excreção. Enquanto isso, as amostras de urina devem ser armazenadas a 4 °C.
- Materiais
- Placas de cultura de tecido multi-incauto pré-inaque (6, 12 e 24 poços) durante a noite a 37 °C.
- Prepare o meio de lavagem: AdDF+++ suplementado com antibióticos de amplo espectro (0,1 mg/mL) e 10 μM Y-27632.
- Prepare o meio de cultura como descrito acima. Aqueça a 37 °C antes de usar.
- Prepare a matriz BME. Mantenha-se no gelo durante o procedimento.
- Procedimento
- Colete uma amostra de urina e divida-a igualmente em tubos de 50 mL(Figura 2A-I). Adicione 10-20 mL de meio de lavagem a cada um dos tubos. Centrifugar a 300 × g por 5 min a 4 °C(Figura 2A-II),e remover o sobrenatante cuidadosamente.
- Adicione 10 mL de meio de lavagem a cada um dos tubos. Ressuspenque cuidadosamente as pelotas usando uma pipeta estéril de 10 mL. Centrifugar a 300 x g por 5 min a 4 °C(Figura 2A-III),e remover cuidadosamente o sobrenatário.
- Resuspenda as pelotas e transfira o conteúdo de todos os tubos em um tubo de 15 mL. Encha o tubo com meio de lavagem. Centrifugar a 300 x g por 5 min a 4 °C(Figura 2A-IV),e remover o sobrenatário.
- Meça o volume da pelota celular usando uma pipeta p1000 definida para um volume conhecido. Pipeta cuidadosamente para cima e para baixo para resuspend sem criar bolhas de ar. Transfira o tubo para o gelo por 1 min.
- Adicione 70-75% de volume do BME à pelota. Resuspend usando uma pipeta p1000 ou p200, e placa 15 gotículas μL em uma placa de cultura celular pré-armada e multiwell (6, 12 ou 24 poços, com base no volume total de revestimento (<100 μL, 24 poços; 100-200 μL, 12 poços; >200 μL, 6 poços)).
- Vire as placas de cabeça para baixo na incubadora por 15-20 min a 37 °C. Adicione meio de cultura pré-armada e inspecione as culturas(Figura 2B).
3. Expansão das culturas tubuloides
NOTA: As culturas tubuloides podem ser passagemdas aproximadamente a cada 1-2 semanas com uma proporção dividida de 1:2-1:3. Eles podem ser normalmente expandidos para aproximadamente 15 passagens, com variações específicas da linha.
- Materiais
- Placas de cultura de tecido multi-incauto pré-inaque (6, 12 e 24 poços) durante a noite a 37 °C.
- Prepare o meio basal (AdDF+++), e mantenha-o no gelo durante o procedimento.
- Prepare o meio de cultura como descrito anteriormente. Aqueça até 37 °C antes de usar.
- Prepare a matriz BME e mantenha o gelo durante o procedimento.
- Prepare o agente de substituição de trippsina com a adição de Y-27632 a uma concentração de 10 μM. Aqueça até 37 °C antes de usar.
- Autoclave dicas p10 não filtradas.
- Esfrie a centrífuga a 4 °C.
- Procedimento
- Interrompa as gotículas que contêm os tubuloides por pipetar para cima e para baixo com uma pipeta p1000 usando o meio presente no poço. Use a ponta para raspar a parte inferior do poço, certificando-se de coletar todas as células presas ao fundo.
- Colete o conteúdo em um tubo de 15 mL. Adicione 10 mL de AdDF+++. Centrifugar a 300 x g por 5 min a 4 °C, e remover o sobrenante.
- Com base no tamanho da pelota, adicione o agente de substituição de trippsina complementado com 10 μM Y-27632. Use 1 mL de agente de substituição de trippsina para 200 μL de gotículas BME contendo tubuloides. Incubar a 37 °C por 5 min.
- Use uma pipeta p1000 com ponta e insira uma ponta p10 não filtrada e estéril sobre a ponta de 1000 μL. Pipeta para cima e para baixo por 20-30x para interromper mecanicamente os organoides.
- Verifique sob o microscópio para ver se muitos organoides intactos ainda estão presentes no tubo(Figura 3A). Se mais de 10% dos organoides intactos estiverem presentes neste ponto, repita desde a incubação de 5 minutos na etapa 3.2.3 até a observação microscópica para organoides intactos na etapa 3.2.5 mais uma vez. Caso contrário, prossiga com a etapa 3.2.6.
- Encha o tubo com AdDF+++. Centrifugar a 300 × g por 5 min a 4 °C, e remover o sobrenatante. Meça o volume da pelota celular usando uma pipeta p1000 definida para um volume conhecido. Pipeta cuidadosamente para cima e para baixo para resuspend sem criar bolhas de ar. Transfira o tubo para o gelo por 1 min.
- Adicione 70-75% de volume de BME à pelota. Resuspend usando uma pipeta p1000 ou p200, e placa 15 gotículas μL em uma placa de cultura celular pré-armada e multiwell (6, 12 ou 24 poços, com base no volume total de revestimento (<100 μL, 24 poços; 100-200 μL, 12 poços; >200 μL, 6 poços)).
- Vire as placas de cabeça para baixo e deixe a placa descansar na incubadora por 15-20 min a 37 °C. Adicione meio de cultura pré-armada e inspecione as culturas(Figura 3B).
Resultados
Para tecido renal, estruturas tubuloides normalmente aparecem dentro de 7 dias após o estabelecimento(Figura 1D). A falta de crescimento aparente nos primeiros 7 dias indica um resultado mal sucedido do protocolo. Geralmente, as culturas tubuloides precisam ser passagemdas dentro de 1-2 semanas após o primeiro revestimento. Para urina, o crescimento celular torna-se aparente aproximadamente 14-21 dias após o estabelecimento, com o aparecimento de estruturas tubuloides compactas e/ou células aderentes na parte inferior da placa(Figura 2B). O estabelecimento cultural provavelmente falhou se nenhum crescimento pode ser detectado com um microscópio brightfield dentro de 4 semanas após o revestimento. Para culturas derivadas da urina, a primeira passagem geralmente ocorre entre 3 e 4 semanas. Enquanto nas primeiras passagens as culturas tubuloides renais consistem principalmente em estruturas compactas, a presença de tubuloides epiteliais císticos aumenta com o aumento do número de passagem(Figura 1D e Figura 2B). A geração bem sucedida de culturas tubuloides renais humanos pode ser avaliada realizando coloração imunohistoquímica para marcadores expressos em epitélio renal tubular, como a proteína gene 8 da caixa emparelhada (PAX8) (Figura 4A, B).
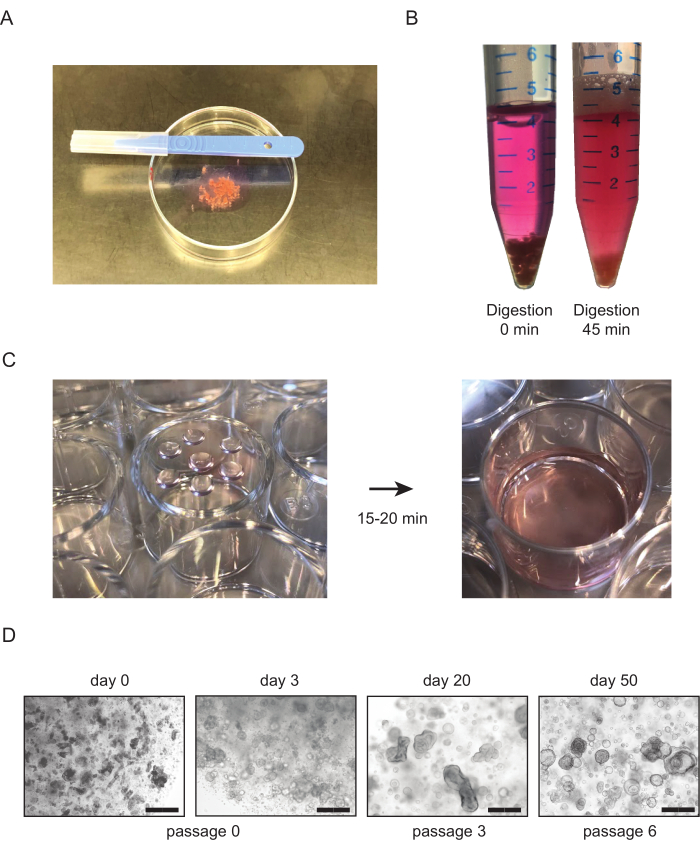
Figura 1: Culturas tubuloides renais derivadas de tecido. (A) Visão geral do procedimento para picar tecido renal. O tecido é picado a um tamanho de ~1 mm3 usando bisturis. (B) Exemplo de digestão enzimática correta do tecido renal saudável. O tecido é mostrado antes (esquerda) e depois (direita) 45 minutos de digestão enzimática com colagemnase. Poucos pedaços de tecido ainda são visíveis na parte inferior do tubo, e a solução deve ficar nublada, indicando a presença de células na suspensão. (C) Imagem representativa das placas de cultura celular após o revestimento das gotículas BME contendo o tecido renal processado. Depois de emplacar as gotículas, as placas de cultura são viradas de cabeça para baixo (esquerda) e colocadas na incubadora a 37 °C. Depois de 15-20 min, o meio de cultura pré-armado é adicionado ao poço (à direita). (D) Imagens representativas de brightfield de culturas tubuloides derivadas de tecido. As primeiras estruturas tubuloides tornam-se visíveis 2-3 dias após a primeira semeadura. Com o aumento do número de passagens, os tubuloides normalmente mudam a morfologia para um fenótipo mais cístico. Barras de escala = 300 μm. Abreviaturas: BME = extrato de membrana do porão. Clique aqui para ver uma versão maior desta figura.
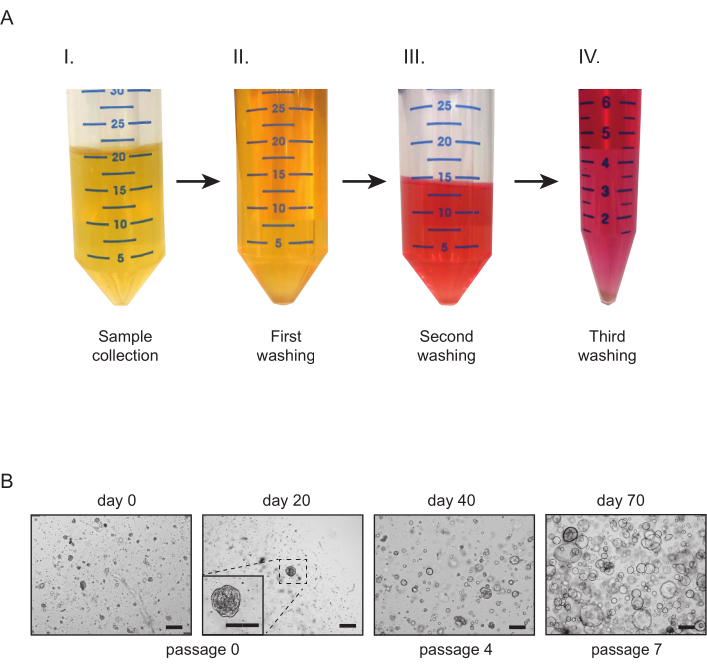
Figura 2: Culturas tubuloides renais derivadas da urina. (A) Visão geral do processamento da amostra de urina. Assim que possível após a coleta(I),as amostras de urina são divididas em tubos de 50 mL e diluídas em meio de lavagem(II). Após uma segunda etapa de lavagem (III),o conteúdo dos tubos é agrupado e uma terceira e última etapa de lavagem (IV) é realizada antes do revestimento. (B) Imagens representativas de brightfield de culturas tubuloides derivadas da urina. As primeiras estruturas tubuloides e células aderentes devem ser visíveis dentro de 21 dias após o primeiro revestimento. Barras de escala = 300 μm. Clique aqui para ver uma versão maior desta figura.
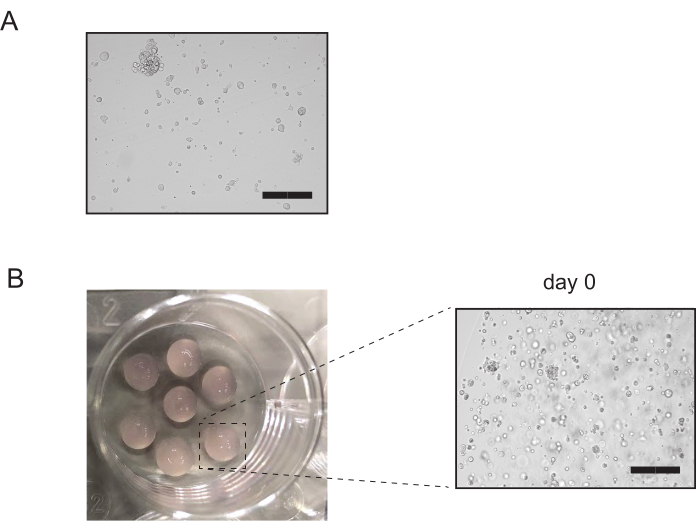
Figura 3: Passagem de culturas tubuloides renais. (A) Imagem representativa das culturas tubuloides renais após digestão enzimática. Após a conclusão da digestão, não mais de 10% das estruturas tubuloides intactas devem permanecer. Barra de escala = 300μm. (B) Imagem representativa das culturas tubuloides renais após o revestimento. A inspeção das culturas confirma que a maioria dos tubuloides foram interrompidos. Barra de escala = 300 μm Clique aqui para ver uma versão maior desta figura.
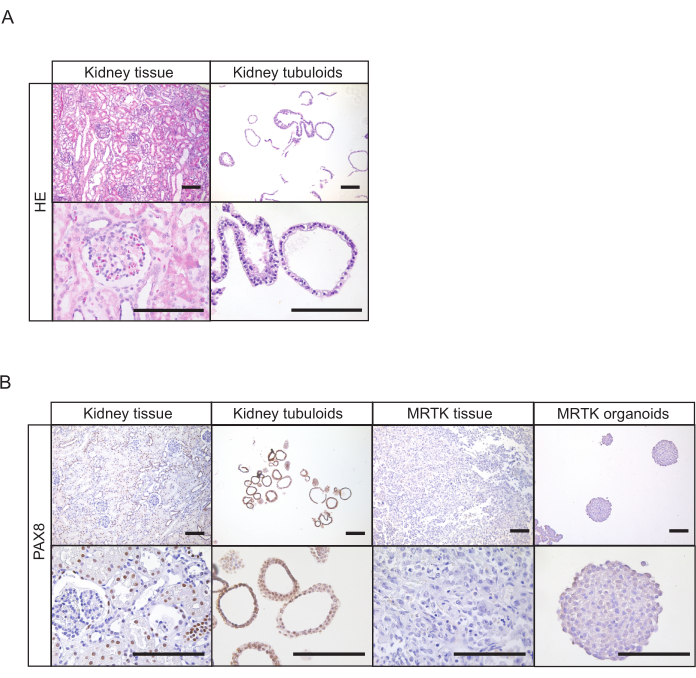
Figura 4: Caracterização histológica das culturas tubuloides. (A) Mancha de H&E de tecido renal saudável e tubuloides. Barras de escala = 100 μm. (B) Imunohistoquímica de PAX8 em tecido renal normal, tubuloides, tecido MRTK e organoides MRTK. A positividade PAX8 das estruturas organoides confirma sua origem epitelial renal. O tecido renal saudável apresenta estruturas positivas (túbulos) e negativas (glomeruli). Tecidos MRTK e organoides foram incluídos como controle negativo. Barras de escala = 100 μm. Abreviaturas: H&E = hematoxilina e eosina; PAX8 = gene da caixa emparelhada 8; MRTK = tumor rabdoide maligno do rim. Clique aqui para ver uma versão maior desta figura.
Discussão
Organoides são considerados avatares do tecido do qual são derivados. Permitem a rápida expansão do material do paciente, mantendo as características genotípicas e fenotípicas do tecido deorigem 15. A tecnologia organoide abriu recentemente as portas para o desenvolvimento de modelos pré-clínicos mais representativos, que podem ser usados como ferramentas importantes para traduzir achados do banco para a cabeceira. Os tubuloides renais estão prometendo modelos in vitro para testar nefrotoxicidade induzida por drogas, um efeito colateral comum de muitas drogas quimioterápicas2,8,12. Como tal, as culturas organoides tumorais derivadas do paciente demonstraram ser preditivas para a resposta do paciente ao tratamento16,17,18. Testar drogas de forma de alto rendimento em tubuloides, portanto, potencialmente permite uma melhor definição de janelas terapêuticas e diminui o risco de nefrotoxicidade induzida por drogas em pacientes.
Antibióticos comumente usados foram descritos para exercer um efeito tóxico nos rins19. Embora a presença de antibióticos de amplo espectro seja necessária para o sucesso do estabelecimento das culturas, prevenindo a contaminação, é importante considerar sua potencial nefrotoxicidade. Embora não tenham sido observados efeitos negativos de antibióticos no estabelecimento de culturas tubuloides, é necessária uma investigação mais aprofundada para avaliar minuciosamente seus efeitos. Os tubuloides podem ser explorados para estudar e modelar doenças8. As ciliopatias (disfunção patológica de cílios) bem como outras síndromes genéticas que afetam o rim poderiam ser estudadas por meio da geração de linhas tubuloides diretamente dos sujeitos afetados, ou pelo uso de culturas saudáveis nas quais mutações específicas do condutor da doença podem ser introduzidas através da edição do genoma CRISPR/Cas920.
Embora os tubuloides sejam culturas renais multicelulares, eles não possuem vários tipos de células renais, incluindo podocitos e células endoteliais8. Além disso, ao contrário de alguns outros modelos organoides derivados do ASC, os tubuloides têm um potencial replicativo limitado, pois podem ser cultivados por aproximadamente 15 passagens. Essa vida útil limitada pode, no entanto, ser significativamente estendida pela adição de Wnt ao meio da cultura21. Uma maior otimização do protocolo de cultura tubuloide é necessária para torná-los ainda mais representativos do rim, incluindo tipos celulares mais diferenciados. Embora a eficiência do estabelecimento tubuloide a partir de amostras de tecido seja muito alta (>95%), pode, em casos raros, falhar. Pode haver diferentes causas, incluindo: 1) má qualidade do material inicial (por exemplo,tecido necrosado como consequência do tratamento medicamentoso), 2) superdigestão da amostra de tecido, ou 3) contaminação da amostra primária.
Para garantir que a qualidade das amostras de tecido recebidas seja suficiente para prosseguir com o protocolo, é importante manter contato próximo com a equipe de patologia que realiza a avaliação do tecido após a cirurgia. Se houver material suficiente disponível, sua viabilidade deve ser confirmada por exame histológico (por exemplo,hematoxilina e manchas de eosina). Além disso, para prevenir a lise celular durante a digestão enzimática, é importante que o procedimento de incubação não seja superior a 1h. Por último, para evitar contaminação, antibióticos e agentes antifúngicos devem ser adicionados aos meios de lavagem e cultura.
A urina pode conter células epiteliais esfoliadas que não são derivadas do rim22, que pode contaminar as culturas tubuloides. Estes incluem, por exemplo, células de urotélio que são, em contraste com as células tubulares renais, positivas para a proteína tumoral P63 e negativa para PAX88. Recomenda-se, portanto, testar as culturas de positividade PAX8 para confirmar a pureza das linhas tubuloides renais estabelecidas antes de prosseguir com experimentos de acompanhamento(Figura 4B).
A urina representa um ambiente hostil para as células devido à alta pressão osmótica e ao baixo pH. Por isso, é crucial para o sucesso do protocolo que as amostras sejam processadas o mais rapidamente possível após a coleta de urina. Como tal, a urina coletada deve ser diluída e extensivamente lavada com solução tampão o mais rápido possível para garantir a presença de células viáveis no momento da semeadura. A taxa de sucesso do estabelecimento tubuloide diminuirá significativamente se a urina for armazenada por várias horas antes do processamento. Por fim, embora estéril, a urina tem alto risco de contaminação associada ao processo de coleta. Por isso, é importante complementar o meio de lavagem e crescimento com antibióticos e agentes antifúngicos. Ao levar em conta tudo isso, uma taxa de sucesso de aproximadamente 50% pode ser alcançada.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Agradecemos a todos os pacientes e suas famílias por participarem do estudo. Agradecemos à equipe clínica que facilitou nossa pesquisa. Agradecemos o apoio do Conselho Europeu de Pesquisa (ERC) iniciando a concessão 850571 (J.D.), a Sociedade Holandesa do Câncer (KWF)/Prêmio Alpe d'HuZes Bas Mulder (nº 10218, J.D.), Oncode Institute e Foundation Children Cancer Free (KiKa nº 292, C.C.)
Materiais
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939/10 | Stock of 5 mM, final concentration of 5 µM, activin receptor-like kinase 5 inhibitor |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634010 | |
| antiPAX8 antibody | LSBio | LS-B13466 | |
| B27 supplement | ThermoFisher Scientific | 17504044 | Stock of 50x, final concentration of 1x |
| BME | Trevigen | 3533-010-02 | |
| Collagenase | Sigma Aldrich | C9407 | Stock of 10 mg/mL, final concentration of 1 mg/mL |
| EGF | Peprotech | AF-100-15 | Stock of 0.5 mg/mL, final concentration of 50 ng/mL |
| FGF10 | Peprotech | 100-26 | Stock of 0.1 mg/mL, final concentration of 100 ng/mL |
| GlutaMAX - L-alanine/L-glutamine | Gibco | 35050061 | Stock of 100x, final concentration of 1x |
| Hepes | Gibco | 15630106 | Stock of 1 M, final concentration of 10 mM |
| Multiwell tissue culture plates 12 wells | CELLSTAR | 665180 | |
| Multiwell tissue culture plates 24 wells | CELLSTAR | 662160 | |
| Multiwell tissue culture plates 6 wells | CELLSTAR | 657160 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Stock of 500 mM, final concentration of 1.25 mM |
| Penicillin/Streptomycin | Gibco | 15140163 | Stock of 10.000 U/mL, final concentration of 100 U/mL |
| Primocin - broad-range antibiotics | Invivogen | ant-pm-1 | Stock of 50 mg/mL, final concentration of 0.1 mg/mL |
| Red blood cells lysis buffer | Roche | 11814389001 | |
| RhoKinase inhibitor Y-27632 | Abmole Bioscience | M1817 | Stock of 100 mM, final concentration of 10 µM |
| R-spondin conditioned medium | Produced in house with the use of stable cell lines generated by Calvin Kuo lab. Final concentration is 10% | ||
| TrypLe Express/ trypsin replacement agent | ThermoFisher Scientific | 12605010 |
Referências
- Romagnani, P., et al. Chronic kidney disease. Nature Reviews. Disease Primers. 3, 17088 (2017).
- Ooms, A. H., Calandrini, C., de Krijger, R. R., Drost, J. Organoid models of childhood kidney tumours. Nature Reviews. Urology. 17 (6), 311-313 (2020).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Low, J. H., et al. Generation of human PSC-derived kidney organoids with patterned nephron segments and a de novo vascular network. Cell Stem Cell. 25 (3), 373-387 (2019).
- Little, M. H., Combes, A. N. Kidney organoids: accurate models or fortunate accidents. Genes & Development. 33 (19-20), 1319-1345 (2019).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Schutgens, F., et al. Tubuloids derived from human adult kidney and urine for personalized disease modeling. Nature Biotechnology. 37 (3), 303-313 (2019).
- Jun, D. Y., et al. Tubular organotypic culture model of human kidney. PLoS One. 13 (10), 0206447 (2018).
- Grassi, L., et al. Organoids as a new model for improving regenerative medicine and cancer personalized therapy in renal diseases. Cell Death & Disease. 10 (3), 1-15 (2019).
- Yousef Yengej, F. A., Jansen, J., Rookmaaker, M. B., Verhaar, M. C., Clevers, H. Kidney organoids and tubuloids. Cells. 9 (6), 1326 (2020).
- Calandrini, C., et al. An organoid biobank for childhood kidney cancers that captures disease and tissue heterogeneity. Nature Communications. 11 (1), 1310 (2020).
- Jansen, J., et al. A morphological and functional comparison of proximal tubule cell lines established from human urine and kidney tissue. Experimental Cell Research. 323 (1), 87-99 (2014).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nature Protocols. 7 (12), 2080 (2012).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Morales-Alvarez, M. C. Nephrotoxicity of antimicrobials and antibiotics. Advances in Chronic Kidney Disease. 27 (1), 31-37 (2020).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Dörrenhaus, A., et al. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system. Archives of Toxicology. 74 (10), 618-626 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados