Method Article
多模相变化波菲林液滴的合成和特征
摘要
在此协议中,概述了合成和描述多模相改变球菌液滴的方法。
摘要
相变液滴是一类超声波对比剂,可在应用足够的声能 后就地 转化为回声微泡。水滴比微泡液滴更小、更稳定。然而,传统的超声波对比剂除了声学反馈测量之外无法跟踪,这使得定量对比剂生物分布或积累 前体内 变得困难。研究人员可能不得不依靠荧光或光学吸收的伴随诊断粒子来推断生物分布。此协议的目的是详细说明使用凝结方法创建多模相改变 porphyrin 液滴的步骤。Porphyrins 是具有不同吸水带的荧光分子,可结合到脂质中并结合到液滴中,以扩展液滴的多功能性,从而在保持声学特性的同时实现更坚固的生物分布。制作了七种具有不同波菲林脂质和碱脂含量的配方,以调查微泡和液滴大小分布。协议中还描述了适合含聚素结构的特征,以证明其分析在解决方案中的多功能性。尺寸显示,浓缩后的平均直径比前体小1.72至2.38倍。吸收特征显示,完整的组件的Q波段峰值为700纳米,而被破坏的样品的吸水峰值为671纳米。荧光特征显示,30%的聚苯二甲酸酯组件被荧光(>97%),荧光恢复在中断后实现。声学蒸发表明,波菲林液滴在较低压力下不具有回声性,可转化为具有足够压力的回声微泡。这些特征表明,porphyrin液滴的潜力,以消除吸收或荧光为基础的伴随诊断策略的需要,量化超声波对比剂生物分布的交付或治疗应用 在体内 或 前体内。
引言
超声成像是一种利用声波的非侵入性、非电电化的医学成像形式。虽然超声波扫描仪更便携,可以提供实时图像,但超声波成像的对比度较低,因此声像师很难可靠地区分类似的回声病理特征。为了抵消这种限制,可以将微泡注入宿主,以改善血管对比度。微泡是微米大小的气体填充对比剂,对声波具有高度的回波作用,可以增强血管对比度1,2。微泡的外壳和气体核心可以针对不同的应用量身定做,如成像、血栓溶解、细胞膜渗透或瞬态血管开口2。
微泡的缺点是它们的短循环半衰。例如,临床上可用的全氟脂质微球只有1.3分钟的半衰时间3。对于长时间的成像过程,需要多次注射微泡。微泡的另一个缺点是它们的大直径。虽然全脂微球直径约为1至3微米,小到足以在血管中循环,但它们太大,无法奢侈和被动地积聚成感兴趣的组织,如肿瘤4。克服这些限制的一个策略是将气芯微气泡凝结成更小的液芯液滴5,6。虽然液滴在液体状态下没有回声性,但在暴露于超声波时,它们可以蒸发成微气泡,并具有足够高的峰值负压,从而恢复它们提供对比的能力。这允许液滴利用小液体芯更有利的药理动力学,同时保留在不调和时提供对比度的能力,而不改变化学成分4,7。
脱氟丁烷是一种理想的全氟碳化合物,用于气态和液态5、6、7之间的相位转移。二氟丁烷允许微泡凝结成液滴,单独降低温度,而密度较低的全氟碳化合物需要额外的加压5。这种温和的方法将凝结过程中的气泡破坏降到最低。由于液芯是液体,液滴是非回声的,对超声波看不见。然而,在应用足够的声学或热能后,液体核心可以蒸发回气态,产生回声微泡8。这种蒸发可以控制何时何地产生微气泡。
虽然液滴是有用的被动积累,原位蒸发,或提高细胞渗透性4,液滴(及其碎片)不能成像或量化前体内。因此,可量化的伴随诊断剂,如荧光4、10、11、磁粒子12、光学吸水剂13等,被用作模拟物来测量液滴输送到感兴趣的组织。例如,Helfield等人使用荧光纳米珠的联合注射来组织学图像量化小鼠器官,因为不能在荧光4中检测到液滴。伴随诊断剂的缺点是可跟踪组件可能根据其单个药理动力学特征独立于液滴。
幸运的是,微泡和液滴的外壳可以定制。例如,Huynh等人用波菲林脂壳演示了超声波对比剂,产生了多模态微泡14。波菲林是一类有机化合物,具有芳香的巨细胞结构14,15。它们具有光学吸水性、荧光性,可与多种金属合合,用于放射治疗、放射性核素成像或微量金属定量14。磷酸酯的一个例子是皮洛菲奥比德(火焰兵)。通过将火焰凝结到脂质上,将火焰脂结合到微泡或液滴中,可以通过多种模式(声学、荧光和吸水14)对火焰脂进行成像和跟踪。这种多模态对比剂可用于跟踪和量化积累。这可以消除对配套诊断剂的需求,因为可量化的组件现在结合到外壳上,从而能够更准确地交付量化16。
在此,概述了创建多模相变化 porphyrin 液滴的方案。由于超声波对比剂可以用作向感兴趣的组织(如肿瘤2、4)输送药物的平台,因此将其可检测性扩展到超声波之外,对分娩疗效定量是有用的。这些液滴的目的是提供可跟踪的超声波对比剂,能够被动地积聚在体内,原位蒸发和声学,并有可能量化生物分布或积累从前体内器官不依赖于二次传感器。还概述了特征化方法,以展示猪水滴作为生物分布传感器的潜力。还讨论了壳体中火焰脂加载的影响(按摩尔比率计算为 0% 到 50%)。
研究方案
1. 脱水脂膜
- 计算所需的每个外壳组件的质量(参见补充文件"脂质公式表")。
注:对于此协议, 壳体成分为:10 摩尔 % 1,2 - 乙酰 - sn - 甘油 - 3 - 磷乙醇胺 - n - 甲氧(聚乙烯乙二醇) - 5000] 铵盐 (DSPE-PEG5K), x 摩尔 % 苯酚 比德结合了 1 - 斯蒂罗伊尔 - 2 - 羟基 - sn - 甘油 - 3 磷胆碱 (Pyro - spc), 和 (90 - x)摩尔 % 1, 2 - 迪斯蒂罗尔 - sn - 甘油 - 3 磷胆碱 (Dspc) 。Pyro-SPC 的数量将跨越 7 个外壳组成(x = 0、1、10、20、30、40、50)。检查库存瓶上DSPE-PEG5K的分子量。- 将协议缩放到任何脂质体积,最低体积为 1 mL。对于此协议,所有配方均使用总脂质量为 10 mL,总脂质浓度为 1 毫克/mL。即决解决方案是:10% 丙二醇、10% 甘油和 80% 磷酸盐缓冲盐(PBS、1X、7.4 pH)(%v/v/v)(参见步骤 2.3 和"脂质配方表")。
注:Pyro脂质的合成协议在补充文件"其他协议和数据"步骤S1到S1.19中概述,该步骤是从郑等人15所做的工作中修改的。
- 将协议缩放到任何脂质体积,最低体积为 1 mL。对于此协议,所有配方均使用总脂质量为 10 mL,总脂质浓度为 1 毫克/mL。即决解决方案是:10% 丙二醇、10% 甘油和 80% 磷酸盐缓冲盐(PBS、1X、7.4 pH)(%v/v/v)(参见步骤 2.3 和"脂质配方表")。
- 根据计算的质量(参见步骤 1.1 和"脂质配方表"),称重每个非火焰脂,并转移到一个足够大小的波罗西酸盐玻璃瓶与螺丝帽。
- 盖上小瓶盖,给盖子和小瓶贴上标签,用铝箔盖住脂质小瓶的底部和墙壁。此小瓶将被称为协议其余部分的"脂质小瓶"。将脂质瓶存放在凉爽、干燥、黑暗的区域。
- 如果配方含有火焰-SPC,将10毫克的火焰-SPC干膜(参见"其他协议和数据")溶解到1mL的氯仿中。漩涡为 5s,测量吸气量,并计算适当的体积添加到脂质瓶中。
警告: 氯仿是一种健康危害, 刺激, 和有毒.穿防护实验室外套,护眼,手套,避免呼吸烟雾。
注意:由于火焰兵-SPC 对光敏感,因此在处理 Pyro-SPC 时尽可能减少工作区域的灯光。未使用时,请保持火焰火焰兵-SPC 密封和覆盖。- 在紫外可见光谱仪上,设置它以 0.5 nm 的增量测量从 800 nm 到 300 nm 波长范围的吸收量,并测量 2000 μL 纯甲醇的基线,在兼容的 1 厘米路径长度中测量基线。
警告: 甲醇是一种健康危害, 刺激性, 有毒, 易燃.穿防护实验室外套,护眼,手套,避免呼吸烟雾。远离火花和热量。 - 在氯仿中加入 2 μL 的 Pyro-SPC 到 2000 μL 甲醇中,漩涡加入 30 微升。将其转移到一个干净、兼容的 1 厘米小面包中,并测量吸水性。如果吸收峰值为 667 nm,则调整此稀释因子,以达到紫外可见光谱仪的吸光范围。
注:每当转移氯仿或甲醇时,使用清洁的玻璃注射器或正位移移液器,而不是机械移液器,以获得更好的准确性。 - 重复步骤 1.4.2 两次,以获得三倍吸收值。
- 平均吸收峰值值为 667 nm,并使用以下方程计算脂质 Vial14、15所需的氯仿火焰-SPC 体积:
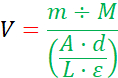
其中V是氯仿中火焰-SPC的体积,m是火焰-SPC所需的质量(见第1.1步和"脂质公式表"),M是火焰-SPC的分子量,在1040.317克-摩尔-1,A是平均吸收量在667纳米, d是基于氯仿体积中的甲醇和火焰-SPC 的稀释因子(步骤 1.4.2), L是 1 厘米的库维特路径长度,ε是 667 nm 摩尔衰减系数 Pyro-SPC 在 45000 L+mol-1+cm-1.
注:方程的分母是啤酒-兰伯特定律,它涉及分析物在溶液中的浓度与远处测量的光学吸收量有关。 - 使用清洁的玻璃注射器(图1A)将前一步氯仿中火焰-SPC的计算体积添加到脂质瓶中,然后盖住小瓶盖住。
注: 图1 仅显示 30% 的火焰脂配方。 - 如果氯仿中残留有任何火焰-SPC:在烟气罩中,从第 1.4 步拆下火焰-SPC – 氯仿小瓶,将小瓶部分倾斜到其侧面,并尽可能轻轻地将氮气流入火焰-SPC/氯仿小瓶。旋转小瓶,利用氮气流干燥氯仿,并在小瓶干燥时均匀地将火焰-SPC涂在小瓶的内壁上。确保不溅出任何飞溅,并且没有出现任何解决方案。
- 一旦火焰-SPC脂质薄膜出现干燥并涂在小瓶壁上,关闭氮气流。盖住小瓶,用蜡膜封住小瓶颈部,并将小瓶储存在-20°C和黑暗中。
- 在紫外可见光谱仪上,设置它以 0.5 nm 的增量测量从 800 nm 到 300 nm 波长范围的吸收量,并测量 2000 μL 纯甲醇的基线,在兼容的 1 厘米路径长度中测量基线。
- 准备 90% 氯仿和 10% 甲醇(%v/v)的溶液,并在脂质瓶中加入 5 mL。盖上脂质瓶,轻轻旋转,使内容均质(图1B)。
注:如果配方中含有磷酸脂(如1,2-乙酰-甘油-3-磷酸钠盐(DSPA),则添加:60%氯仿、32%甲醇和8%双离子水(%v/v/v)。可能需要更剧烈的漩涡来完全溶解脂质含量。 - 在烟气罩中,解开脂质瓶盖,将脂质瓶部分倾斜到侧面,并尽可能轻轻地将氮气流入脂质瓶中。旋转脂质瓶,使用氮气流干燥溶液,并在干燥时均匀地将脂质薄膜涂在脂质瓶的内壁上。确保不溅出任何飞溅,并且没有出现任何解决方案。
- 一旦脂质出现干燥,并涂在脂质小瓶的内壁(图1C),关闭氮气流,用铝箔覆盖脂质瓶的底部和墙壁,用铝箔盖住顶部开口,用针戳几个孔进行通风(图1D)。
- 将覆盖的脂质瓶贴在真空干燥器中,使脂质进一步干燥至少 24 小时,但不超过 72 小时。
注:协议可以在 24 至 72 小时后恢复。
2. 脂质水化
- 将浴缸声波器装满水,加热至 70 °C。 打开声波以帮助混合水。
警告:水和声波仪处于高温下。避免触摸水和声波器。佩戴眼部保护、保护性实验室外套和防护手套。 - 一旦沐浴声波器达到 70 °C,从真空干燥器中取出脂质瓶。如果可能,减少工作区域的灯光。
- 准备 10% 丙二醇、10% 甘油、80% PBS(% v/v/v)的即时溶液,并将 10 mL 添加到脂质瓶中(参见步骤 1.1.1 和"脂质配方表")。
注意:如果使用标准空气位移移液管,在处理粘性溶剂(如丙二醇和甘油)时要小心谨慎。吸气并缓慢地将音量下陷,等待剩余音量到达移液器尖端的底部。通过缓慢移动来移动体积,确保液体不会粘在移液器尖端的外部。 - 盖上脂质瓶,取下铝盖,轻轻旋转浴缸声波器中的小瓶 15 分钟,同时声波化以溶解脂质。确保脂质瓶的脖子在水面上。偶尔检查小瓶盖是否牢固关闭。
- 偶尔,从水浴中取出脂质瓶。简单地把它举到灯光下,检查内容是否完全溶解(图1E)。
- 如果脂质瓶内容不是同质化,请从沐浴声波器中取出脂质瓶。固定盖,更积极地旋转,并将其返回到浴缸声波器。
- 从沐浴声波器中取出脂质瓶,并关闭沐浴声波器。用纸巾擦干脂质瓶外墙,并重新标记脂质瓶。
- 用铝箔盖住脂质瓶,在室温下在凉爽、黑暗、干燥的区域冷却脂瓶10分钟。
- Liquot 脂质瓶内容:约 2 mL 的脂质溶液在 3 mL 玻色硅酸盐玻璃透明血清瓶(7 毫米内口直径,13 毫米外口直径)。
注:某些协议可能会在 3 mL 小瓶7中使用 1.5 mL 的脂质溶液。 - 用利血性化风格的灰色氯丁基橡胶塞(7毫米内口直径,13毫米外口直径)盖住血清瓶,用撕掉的铝封(13毫米外口直径)和压接器(图1F)固定橡胶塞。
- 真空、脱气和重新加压每个血清瓶中的脂质溶液 4、5、7(图 2)。
注:请参阅"其他协议和数据",了解如何组装气体交换器的说明和更多详细信息。- 关闭压力阀A和气瓶阀之间的每个阀门(图2)。将血清瓶连接到多管针,然后打开相应的歧管阀,然后打开真空阀 A 和真空阀 B,在 -90 kPa (-13 psi, -900 mbar) 真空 5 分钟以去除大气。不要吸出任何液体(请参阅"其他协议和数据"步骤 S3 到 S3.1.5)。
警告:如果处理不当,真空泵可能会爆裂。不要使用含有有机、酸性或基本化学物质的真空泵。 - 真空仍然打开时,拿着血清小瓶(以防止它摆动),然后用笔或标记快速敲击它以解毒。继续敲击,直到没有气泡形成,小瓶中没有气泡。不要让任何液体被吸走。如有必要,请暂停点击。所有连接的血清瓶重复上述步骤。除气所有血清瓶后, 关闭 真空阀 A 和真空阀 B 并 关闭 真空泵(参见"其他协议和数据"步骤 S3.2 到 S3.2.3)。
- 随着血清小瓶仍然连接到针和真空泵关闭,慢慢地把气瓶阀1/16到1/8(约22.5至45°完全革命)逆时针部分打开,然后打开T-Handle阀, 慢慢地 将空气调节阀顺时针转动到3 psi(20.7 kPa)仪表。然后,打开压力阀 A 和压力阀 B(参见"其他协议和数据"步骤 S3.3 到 S3.3.21)。
警告:脱氟丁烷气瓶处于压力之下,加热后可能会爆炸。远离高温和冲击。脱氧丁烷气体可能导致氧气位移和窒息。佩戴适当的眼罩,并在烟气罩中处理。如果处理不当,则有可能吸尘气缸,从而导致快速脱压和内爆。打开气瓶阀超过 1/8 转可能会损坏空气调节器。 - 加压 30s 后(仪表仍应读取 3 psi(20.7 kPa),用血清瓶关闭所有歧管阀,断开血清瓶,护套针头,并 关闭 气瓶阀。
- 通过部分打开单个歧管阀来缓解积水压力,直到空气调节器仪表针进入其休息位置。然后关闭所有之间的一切,包括歧管阀和T-Handle。
- 关闭压力阀A和气瓶阀之间的每个阀门(图2)。将血清瓶连接到多管针,然后打开相应的歧管阀,然后打开真空阀 A 和真空阀 B,在 -90 kPa (-13 psi, -900 mbar) 真空 5 分钟以去除大气。不要吸出任何液体(请参阅"其他协议和数据"步骤 S3 到 S3.1.5)。
- 标记血清瓶,并将它们存储在 4 °C 和黑暗中。确保所有气体交换阀关闭,然后关闭真空泵。
注意:血清应稳定长达4个月,在这个状态。在此步骤中,协议最多 4 个月后可以恢复。
3. 德卡夫鲁罗布坦小瓶
- 用干净、空的3毫升玻色硅酸盐玻璃透明血清瓶(7毫米内口直径,13毫米外口直径),用利血化式灰色氯丁基橡胶塞(7毫米内口直径,13毫米外口直径)盖住它们,用撕掉的铝封(13毫米外口直径)和压接器4, 7,8.
- 按照第 2.9.1 步吸尘大气(参见"其他协议和数据"步骤 S3.1 到 S3.1.5)。
- 跳过除气,按照步骤 2.9.3 到 2.9.5 重新加压小瓶(参见"其他协议和数据"步骤 S3.3 到 S3.3.21)。
- 标记十氟丁烷小瓶,并将它们储存在 4 °C 和黑暗中。确保所有气体交换阀关闭,然后关闭真空泵。
注:水滴凝结需要充满二氟丁烷气体的血清瓶。他们应该稳定长达4个月在这个状态。在此步骤中,协议最多 4 个月后可以恢复。
4. 水滴形成
- 从冰箱中取出血清瓶中的水合脂溶液(从第 2.10 步)中取出。
- 使用除尘器,取下血清瓶上的铝密封件,将 1 毫升脂质溶液转移到 1.85 mL 的硅酸盐玻璃样品瓶(带酚醛螺丝盖),让脂质溶液顺着内壁流下来。不要制造气泡。
- 如果血清瓶中有任何剩余的脂质溶液,请按照步骤 2.9 到 2.10 来脱气并重新加压血清小瓶以进行存储(参见"其他协议和数据"步骤 S3 到 S3.3.21)。
- 使用 1.85 mL 样品小瓶,使用气体交换器将十氟丁烷气体轻轻流入样品小瓶头空间(请参阅 图 2 以示特定阀门名称)。
- 确保气体交换器上的所有阀门都正确关闭,泵关闭。
警告:如果操作不当,可能会吸出气瓶,导致快速减压和内爆。 - 打开一个歧管阀,小心地从歧管上解开相应的针头。
警告: 尖锐的物体,避免接触/穿孔。 - 逆时针打开压力阀 A 和压力阀 B,将气瓶阀 1/16 转动至 1/8(约 22.5 至 45° 完全旋转),然后部分打开,然后打开 T-Handle 阀。
注意:不要打开气瓶阀超过这一点,因为它可能会对空气调节器造成损害。 - 用脂质溶液拆盖样品瓶并移动它,使歧管针高于小瓶内的液-空气接口。拿着小瓶
-
缓慢地 顺时针将空气调节阀转动,直到空气调节器仪表针从其休息位置稍微移动,全氟碳气体轻轻地从多管针中流出。让全氟碳气体轻轻流入小瓶头空间30秒。不要制造气泡。如有必要,调整空气调节阀。
注:液态空气接口应稍微受到二氟丁烷气体流的干扰。由于系统现已打开,空气调节器仪表无法正确读取压力。 - 30s 后,小心快速地盖上样品瓶,而不会移动小瓶太多。
- 关闭气瓶阀(顺时针)、T-Handle 阀、空气调节阀(逆时针)、压力阀 A、压力阀 B 和歧管阀。
- 小心地套好针头。
- 标记样品瓶,用蜡膜顺时针密封颈部(图3A和3B)。
注: 数字 3B 到 3F 仅显示 30% 的热脂配方。
- 确保气体交换器上的所有阀门都正确关闭,泵关闭。
- 将样品小瓶存放在黑暗中,在 4 °C 下至少保存 10 分钟或最高 24 小时。
注:在此步骤中,协议可以在稍后恢复,最多 24 小时。 - 将大约 100 克干冰(二氧化碳)放到绝缘容器中,并将常规冰放到另一个绝缘容器中。检索第 3 步中提到的预制的十氟丁烷血清瓶、两个 3.81 厘米(1.5 英寸)20 口径针头、一个 1 mL 塑料注射器(使用前解开柱塞)、一个 200 mL 容器、金属钳和温度计(-20 至 100 °C)。
注:如果只制造微泡,则不需要同丙醇、干冰和冰。 - 将样品小瓶与脂溶液放在机械搅拌器中,搅拌45s(图3C)。
- 机械搅拌后,站在样品小瓶右侧,屏蔽光线,并开始15分钟倒计时冷却小瓶和大小选择微泡8,17。
- 当 15 分钟倒计时达到 10 分钟(倒计时还剩 5 分钟)时,用约 200 mL 的等丙醇填充容器,然后用金属钳用干冰将其冷却到 -20 °C。
注意:目标温度为 -15 至 -17 °C,但等丙醇在处理微泡时会变暖。
警告: 伊索普罗帕诺是易燃的。远离热量和火花。干冰可导致皮肤损伤。用钳子处理。戴手套、护眼和防护实验室外套。
- 当 15 分钟倒计时达到 10 分钟(倒计时还剩 5 分钟)时,用约 200 mL 的等丙醇填充容器,然后用金属钳用干冰将其冷却到 -20 °C。
- 微泡经过15分钟的大小选择后,在样品瓶内查找大小选择的分区(图3D)。
- 保持样品小瓶右侧向上,小心地解开样品瓶盖,并提取约0.7mL的底部隔板,用1.5英寸20口径的针头连接到1mL塑料注射器。确保没有撤回顶部分区。不要轻拂注射器以去除气囊。
- 将不同的 20 量针插入十氟丁烷血清小瓶(将针头保持在血清小瓶顶部附近)以通风,然后用大小选择的微泡插入针头/注射器。
- 慢慢转移大小选择的微泡。倾斜小瓶和角度注射器,让液体滑下十氟丁烷血清小瓶的内壁。
- 一旦所有大小选择的微泡溶液被转移,用注射器取出针头,但保持发泄针,以减轻负压(图3E)。
- 如果只进行大小选择的微泡,请停在这里。将发泄针保持在顶部和顶部附近。将小瓶保持在黑暗和室温下。
- 在异丙醇浴池中加入少量干冰或室温异丙酚,以确保浴池温度在 -15 至 -17 °C 之间。
- 将20口径的排泄针插入血清小瓶顶部附近,将血清小瓶放入异丙醇浴池中,使微气泡水平低于异丙酚水平,但小肠颈部在上面,间歇性地将血清小瓶旋转2分钟,以凝结微泡。
注:此步骤是从希兰等人所做的工作中修改的- 不要在等丙醇中连续旋转血清小瓶,不要让溶液冻结。旋转约5s,将血清小瓶从同位素中取出。检查冰核,并恢复在同位素中盘旋。如果有冰的形成,在空中旋转血清小瓶,直到它消散。
- 凝结2分钟后,从同位素浴池中取出血清小瓶,取出发泄针。
注:微泡应浓缩成液滴,如半透明性变化所示(图3E 与图 3F 的30%火焰脂配方)。 - 擦拭血清小瓶,贴上标签,并将其放在一个黑暗的绝缘容器中的普通冰上,直到准备好使用。未开封(未开封的铝封)液滴应稳定在此状态长达 6 小时,只要融化的冰被根据需要更换。
- 准备使用时,用除尘器取下铝密封件。在冰上和黑暗中保持液滴(甚至打开的小瓶),同时不使用。在黑暗和室温下保持微泡。
5. 形态学和光学特征
- 准备 1% 特里顿由: 添加 5 mL 的特里顿 X-100 到 500 mL 的 PBS (1x, pH 7.4), 并搅拌与磁搅拌棒,直到同质14.
注:特里顿X-100非常粘稠。如果使用标准空气位移移移液器,则在处理时要小心。吸气并缓慢地将音量跳入,等待剩余音量到达移液器底部。通过缓慢移动来移动体积,确保液体不会粘在移液器尖端的外部。 - 准备液滴(第 4 步)。如果微泡也有特征,请在凝结前收集少量大小选择的微泡(第 4.9 步)。
- 将库尔特计数器 (CC) 上的微泡或液滴大小从 0.2 到 6 μm 大小,以获得大小分布和浓度(图 4)。
- 用 10 毫升的 CC 电解质填充干净的 20 毫升 cuvette,通过 0.2 μm 孔隙聚醚硫酮膜过滤器过滤。用三次运行在 CC 上测量它以获取基线。
- 在同一CC电解质中,加入5微泡或滴样,轻轻混合。
注:可根据样品的浓度添加 2 到 20 μL 的样品。 - 在 CC(3 次运行)上运行样本,减去平均基线,并计算大小分布和浓度(每毫升数)。
- 用紫外线-Vis光谱测量水滴吸收(图5)。
注: 图5 仅显示30%的热脂配方。- 在 UV-Vis 光谱仪上,将吸收度测量设置为 800 nm 至 300 nm 波长,增量为 0.5 nm,并启用基线校正。
- 使用填充 PBS 的干净 1 厘米路径长度的 cuvette 执行基线测量。确保音量足够高,可以相交光谱仪光束路径。
- 将火焰脂液滴稀释到 PBS 中(建议将 2 μL 至 500 μL 的液滴稀释到 2000 μL 的稀释剂中),并通过管道混合。
注意: 不要漩涡 ,否则组件将被摧毁。 - 将稀释的液滴转移到清洁的幼崽中,并测量吸水量。如有必要,更改稀释。
- 重复步骤 5.4.1 到 5.4.4,但使用 1% Triton 而不是 PBS。稀释后,将样品转移到可密封/封顶的瓶和漩涡上30s,然后测量。
- 测量微泡或液滴的荧光(图6)。
注: 图6 仅显示30%的热脂配方。- 在荧光光谱仪上,将激发波长设置为 410 nm,发射波长范围为 600 到 750 nm,增量为 1 nm。
- 测量 PBS 稀释剂的荧光度,使用与荧光光谱仪兼容的晶圆来获取基线。
- 将火焰脂微泡或液滴稀释到 PBS 中(建议将 0.5 μL 至 10 μL 的液滴稀释至 2000 μL 的稀释剂),并通过管道混合。
注意: 不要漩涡 ,否则组件将被摧毁。 - 将稀释的样品转移到清洁的基底切口,并测量荧光。如有必要,更改稀释,避免信号饱和。
- 重复步骤 5.5.1 到 5.5.4,但使用 1% Triton 而不是 PBS。在 1% Triton 中稀释后,在测量前将稀释的样品转移到可密封/封顶的瓶体和漩涡中 30s。添加足够的音量,以确保涡流产生的气泡高于激光路径。
注:由于荧光解调,特里顿样品的荧光信号将远远高于PBS(图6)。
6. 气化成像
- 将大小合适的水箱装满去离子水,让它休息24小时,使水中的气体与大气平衡。
- 准备水滴,在冰上和黑暗中保持,直到使用。
- 使一个流动幻象管从2%的阿加,如Pellow等人描述的18 淹没幻象到水箱加热到37°C。
- 将 PBS 预热至 37 °C,并通过幻象流动。
- 使用临床前的超声波系统和 21 MHz 线性阵列传感器(参见 材料表),将视图对齐到流幻象,将其设置为 B 模式成像,设置输出压力,并捕获视频或图像以获取每个压力的基线。
- 将 20 μL 的滴水稀释到 50 mL 的 37 °C PBS 中,轻轻混合。将溶液转移到 30 mL 塑料注射器中,并将溶液推入增压幻影中。
- 保持与第 6.5 步相同的对齐,增加输出压力,直到观察到蒸发(幻影中的明亮斑点,见图 7)。
注: 图7 显示了30%的火焰脂液滴样品。这种市售的 21 MHz 线性阵列传感器能够同时成像和蒸发液滴。
结果
预浓缩、大小选择的微泡样品(n = 3) 和浓缩后水滴样品(n = 3) 在具有 10 μm 光圈的库尔特计数器 (CC) 上进行。10 μm 光圈的局限性是它不能测量小于 200 nm 的颗粒,这可能会偏向平均大小和浓度。 图 4 显示了每个 Pyro 脂质含量制剂的大小数据。 表 1 显示基于大小数据的统计数据。结果表明,0%的火焰脂配方的平均直径变化最小,为1.72±0.02。50% 的火焰脂配方的平均直径最大,为 2.38 ± 0.08。1% Pyro 脂液滴样品的观测浓度最高,为 (2.71 ± 0.13) × 1010 /mL,而 40% Pyro 脂液滴样本的观察浓度最低,为 (7.36 ± 0.81) × 109/mL。 尺寸数据显示,10% 的 Pyro 脂液滴样本的峰值峰值最小,为 261 ± 13 nm,而 50% 的 Pyro 脂液滴样本的最大峰值为 390 ± 55 nm。一般来说,随着热脂含量的增加,浓度降低,平均直径增加。由于后浓缩样品基于前体微泡样品,因此这两种超声波对比剂都出现了这种趋势。随着火焰脂含量的增加,一个微泡亚人口(峰值大小约为2000μm)开始形成。这个二次峰值在0%的火焰脂微泡样本中并不存在,最明显的是40%和50%的火焰脂种群。
图5显示了30%热脂液滴样品的代表性吸收度测量。PBS 中完整样品的峰值为 700 nm,而特里顿的中断样本将峰值移至 671 nm。这表明,与单独组装的未组装脂质组件相比,完整组件具有不同的光学特性。
图 6A 显示了对预浓缩微泡样品的代表性荧光测量,而图 6B 显示了具有 30% 火焰脂的浓缩后液滴样品。PBS 中完好无损的样品的荧光峰值为 704 nm,而中断的表单的荧光峰值为 674 nm。将曲线下的中断区域与曲线下的完整区域相减,将差额除以曲线下的中断区域,则具有淬火效率,30% 的热脂微泡样品和液滴样品的淬火效率分别为 98.61% 和 98.07%。
为了演示液滴转换为微泡,用超声波系统在 37 °C 的流量幻影中对稀释的液滴进行成像和蒸发。 图7 显示了在不同压力下拍摄的30%Pyro脂质液滴样本的代表性超声波图像。在低压(图7A),只有来自气泡的背景信号从合成中卡住。这是因为液滴是非回声的,不会散射超声波。在稍高的功率下,生成了一些微泡(图7B),如明亮的斑点外观所示。随着压力的增大,产生了更多的微泡(图7C 和 7D)。这也表明,液滴不会在37°C下自发蒸发。

图1:形成30%火焰脂溶液的步骤图像。A) 脂质粉末加氯仿中的火焰-SPC。 B) 添加溶解溶液。 C) 脂膜干燥并涂在小瓶内壁上。 D) 用铝箔包裹的脂质小瓶(用于再利用的外部铝箔)。 E) 水合脂溶液。 F) 血清小瓶中的脂溶液。 请单击此处查看此图的较大版本。
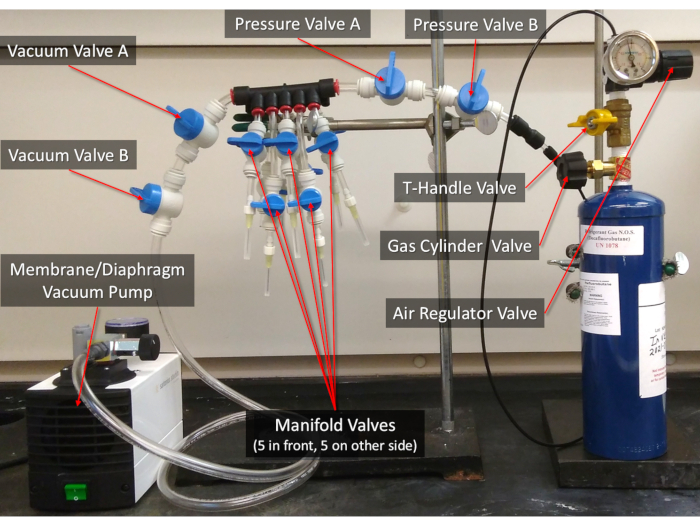
图2:10倍气体交换器。 协议中引用的阀门被标记。有关如何组装气体交换器的说明,请参阅补充文件"其他协议和数据"。 请单击此处查看此图的较大版本。

图3: A) 样品瓶中7种配方(0%至50%Pyro-SPC)的脂质溶液。 数字 B 到 D 显示为制造 30% 火焰脂液滴而采取的步骤的图像。 B) 样品瓶中 30% 的热脂溶液。 C) 后搅拌。 D) 15 分钟大小选择。 E) 底部分区转移到十氟丁烷小瓶。 D) 凝结后。 请单击此处查看此图的较大版本。
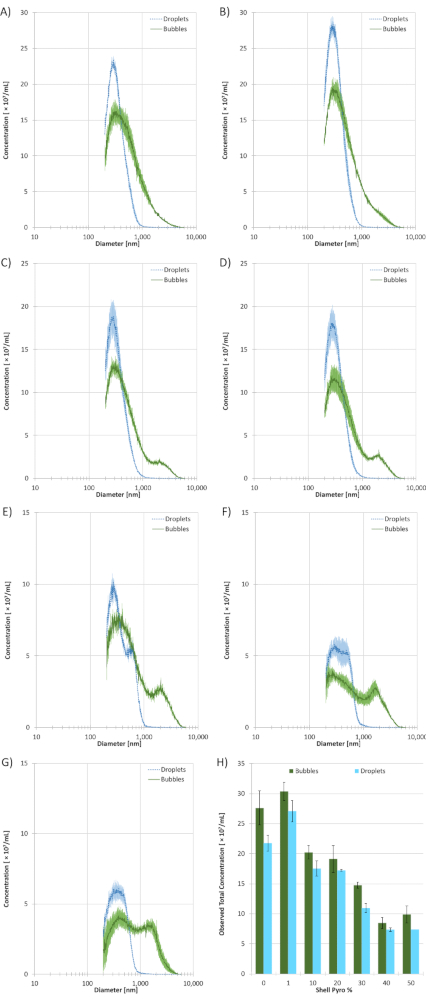
图4: 库尔特计数器 (CC) 大小选择的微泡和液滴样品与不同的火焰脂壳含量(n = 3) 的大小大小数据。 实心绿线代表微泡,点状青色线代表液滴。 A) 0% 火焰兵 - SPC。 B) 1% 火焰 - SPC。 C) 10% 火焰 - SPC。 D) 20% 火焰兵 - SPC。 E) 30% 火焰 - SPC. F) 40% 火焰兵 - SPC。 G) 50% 火焰兵-SPC。 H) 根据壳体中的火焰-SPC含量,观察到CC的微泡和水滴样本的总浓度。所有错误条表示标准偏差。所有测量均使用 10 μm 光圈进行,其大小范围为 200 纳米至 6000 nm。 请单击此处查看此图的较大版本。
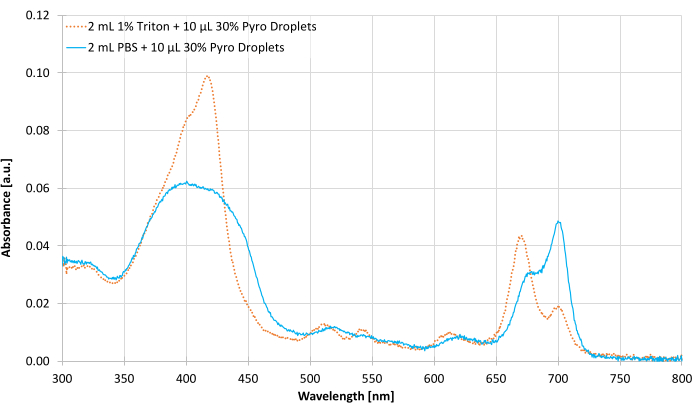
图5:代表紫外线可见度(UV-Vis)光谱吸收测量从300至800纳米后凝结30%的火焰脂液滴样品稀释在PBS和1%特里顿。请点击这里查看这个数字的更大版本。

图6:代表荧光排放从600到750纳米兴奋在410纳米。A) 大小选择,预浓缩30%热脂微泡样品在PBS和1%特里顿。 B) PBS 和 1% 特里顿的凝结后 30% 火焰脂液滴样品。 请单击此处查看此图的较大版本。
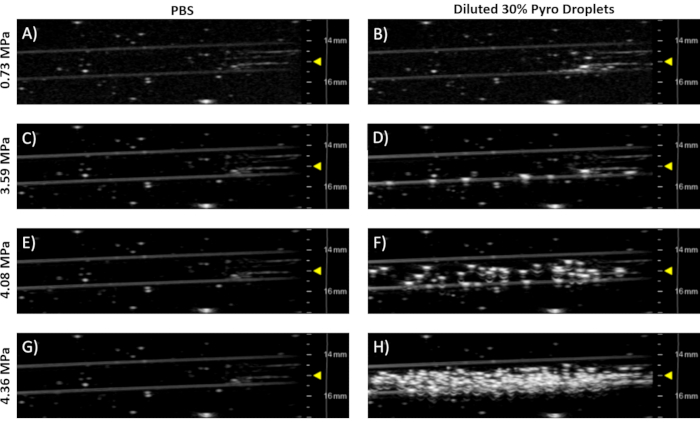
图7:用B模式的临床前21 MHz线性阵列传感器拍摄的37°C阿加流幻象的代表性超声波图像(见材料表)。左列(图A、C、E和 G)显示 PBS 控件。 右侧列(图B、D、F和 H)显示 20 μL 的浓缩后 30% 火焰脂液滴样品稀释成 50 mL 的 37 °C PBS。 每行表示自由场峰值负压力,这是根据希兰等人所做的工作估计的。请单击此处查看此图的较大版本。
| 方法 | 代理 | 火焰壳 % | 0 | 1 | 10 | 20 | 30 | 40 | 50 |
| CC | 泡沫 | 康斯 [/mL] | (2.76 ± 0.28) × 10+10 | (3.04 ± 0.15) × 10+10 | (2.02 ± 0.11) × 10+10 | (1.91 ± 0.22) × 10+10 | (1.47 ± 0.05) × 10+10 | (8.47 ± 0.95) × 10+9 | (9.89 ± 0.15) × 10+9 |
| CC | 泡沫 | 峰值 [nm] | 329 ± 6 | 297 ± 15 | 305 ± 21 | 273 ± 14 | 310 ± 40 | 266 ± 33 | 393 ± 89 |
| CC | 泡沫 | 平均 [nm] | 609 ± 2 | 603 ± 15 | 635 ± 6 | 690 ± 8 | 812 ± 1 | 935 ± 22 | 950 ± 55 |
| CC | 泡沫 | 中位数 [nm] | 450 ± 6 | 421 ± 6 | 414 ± 6 | 432 ± 5 | 490 ± 2 | 596 ± 37 | 695 ± 41 |
| CC | 液 滴 | 康斯 [/mL] | (2.18 ± 0.07) × 10+10 | (2.71 ± 0.13) × 10+10 | (1.75 ± 0.18) × 10+10 | (1.72 ± 0.13) × 10+10 | (1.09 ± 0.01) × 10+10 | (7.36 ± 0.81) × 10+9 | (7.38 ± 0.28) × 10+9 |
| CC | 液 滴 | 峰值 [nm] | 292 ± 0 | 297 ± 17 | 261 ± 13 | 280 ± 9 | 268 ± 17 | 287 ± 38 | 390 ± 55 |
| CC | 液 滴 | 平均 [nm] | 353 ± 5 | 350 ± 5 | 347 ± 1 | 347 ± 4 | 397 ± 1 | 399 ± 6 | 400 ± 7 |
| CC | 液 滴 | 中位数 [nm] | 318 ± 4 | 318 ± 4 | 310 ± 1 | 315 ± 2 | 340 ± 0 | 367 ± 5 | 370 ± 9 |
表1:对与库尔特计数器 (CC)(n = 3) 具有不同 Pyro-SPC 含量的微泡和水滴样本进行大小数据统计。所有错误都表示标准偏差。
补充信息 - 脂质公式表:请点击这里下载此文件。
补充信息 - 其他协议和数据:请点击这里下载此文件。
讨论
在添加所有脂质成分(步骤 1.2 和 1.4.5,图 1A)后,添加了氯仿和甲醇(以及水(如果存在磷酸脂(如 DSPA),以确保火焰脂和非火焰脂成分完全同质化(第 1.5 步,图 1B)。为了防止脂质囊泡形成异质脂质成分,溶解的脂质燥并涂在小瓶壁的内部作为薄膜(图 1C )。涂层(第 1.6 步)也使水化 (步骤 2.1 到 2.4) 更容易,因为它增加了干燥薄膜的表面积。干燥(第1.6步,图1C)和吸尘(第1.8步,图1D)是确保氯仿和甲醇完全蒸发,因为这些化学物质可以破坏微气泡的形成。虽然协议可以缩小,使脂质溶液体积低至1 mL,但更大的体积可以减少小瓶到小瓶的变化。虽然这可能在不使用时降低 Pyro-SPC 的降解风险,但脂质溶液的存储条件(第 2.9 至 2.10 步)旨在降低该风险。与气体交换器(第 2.9.2 步、图 1F和图 2)的脱气步骤有助于消除尽可能多的氧气以防止氧化。建议在溶液中溶解大气气体时储存含有氟化物脂质的脂溶液(图1E)。
在第2.10步中,脂质溶液位于带加压头部空间的血清瓶中,类似于临床上批准的超声波对比剂perflutren脂质微球的销售方式(类似于图1F)。内部工作表明,如果盖子是像橡胶塞一样柔软的材料,则无法通过机械搅拌产生稳定的微泡,因为存在火焰脂。因此,脂质溶液被转移到一个带非橡胶酚帽的样品瓶(步骤 4.1 到 4.4,图 3A和3B)。当脱氟丁烷气体流入样品小瓶(步骤 4.1 到 4.4)时,更稠密的二氟丁烷应取代样品小瓶头空间中的大气空气。目前,还不清楚为什么火焰脂不能形成微泡与橡胶阻塞。由于没有热脂,稳定的微泡可以直接在血清瓶与橡胶塞4,7。因此,建议使用气体交换器去气和重新加压血清小瓶,然后搅拌血清小瓶本身的非热脂配方4,5,6,7(见"其他协议和数据")。能够机械地搅拌血清小瓶的优点是头部空间可以加压,通过倒置血清小瓶8可以进行大小选择。在此协议中,0% 的 Pyro 脂质配方被转移到样品小瓶(步骤 4.1 到 4.4),以与含有 Pyro 脂质的配方保持一致。此外,由于范德瓦尔斯相互作用更好,更长的乙酰脂链长度可产生更稳定的液滴。脂壳成分是根据所有脂质类型的 18-乙酰链长度选择的。DSPE-PEG5K 被纳入所有配方(第 1.1 步),因为聚乙烯乙二醇链的存在可防止结构通过令人厌恶的石墨力19进行聚合。在脂质水化期间,沐浴声波浴缸被设置为 70 °C (步骤 2.1) 高到足以完全分散 18-乙酰链长度脂膜18.对于更长的乙酰链长度,将需要更高的温度。
更高的 Pyro 脂质加载将增加光学吸收和荧光组件的浓度,这些组件可能适合某些受益于最大化的 porphyrin 负载的应用。然而,随着热脂含量的增加,可观测到的液滴浓度降低,直径增加(图4和表1)。这说明了光学荧光和吸水特性与滴浓度和直径之间的权衡。对于必须优先考虑小直径通过小泄漏的容器在体内积累,或者如果需要注入高浓度的液滴,增加火焰脂负荷可能不值得增加液滴二分尺或降低液滴浓度。如果高液滴浓度和/或小液滴直径是最重要的,则应考虑使用大小相近的配套诊断剂,而不是火焰脂。虽然 1% 的 Pyro 脂液滴不会导致浓度降低或尺寸增加,但 1% 的 Pyro 脂质负荷可能太低,无法从组织背景荧光中合理检测。然而,porphyrin moiety 的灵活性为功能化提供了多种选择,这将提供更适合低浓度应用的替代量化方法。例如,火焰脂可以与铜-64结合,用于负星发射断层成像和伽马计数20,或用铂用于使用质谱法进行微量金属定量,或用锰进行磁共振成像14。
虽然有些实验可能只需要少量的液滴溶液,但需要 1 mL 的脂质溶液来填充 1.85 mL 样品瓶。Goertz等人证明,处理方式、头部空间压力、液气比甚至小瓶形状的变化都会影响微泡种群。搅拌和大小选择期间的瓶温也会影响大小分布。因此,对于最终用户优化的方法,在制作液滴时尽可能保持一致至关重要。未开封的液滴可能会被冻结(-20°C),并在以后解冻供将来使用,但这会影响大小种群。
将脂溶液激活到微泡中的搅拌过程不会产生形态上同质的种群(第 4.6 步):相反,样品中充满了微泡、多拉梅拉囊泡、脂质体和鼠标18、21、22。虽然微气泡大小跨越微米和纳米范围,其他结构大多低于800纳米23。所使用的尺寸技术不能区分这些不同的结构,因此,搅拌后的微泡样品(第4.6步,图3C)和凝结后的滴样(第4.14步,图3F)必须假定为混合物。超声波不敏感组件(多拉梅拉囊泡、脂质体和鼠标)很可能在凝结后保存,并且不会改变大小,因为它们没有相变内核。由于库尔特计数器无法区分这些不同的超分子组件,因此应用以下假设来解释凝结后的人口大小变化:纳米级结构的某些比例不可转换,并有助于该大小区域的观测人口。此外,这些结构有助于这些样品的光谱和荧光签名14。小鼠、脂质体/囊泡和液滴的荧光和吸水特征都相似,包括荧光淬火程度14。因此,重要的是要考虑,在图3C至3F,图4,PBS稀释样品在图5,PBS稀释样本在图6有组合体。
经过尺寸选择和冷凝(第 4.9 步)之前,可以通过离心微泡样品来消除非气泡组件,从而将浮力气泡与 Feshitan 等人描述的非浮力组件分离。然而,对此类大小隔离样品的微泡凝结实验表明,使用使用大小隔离程序选择的较大前体微气泡体积产生较大的液滴(参见"其他协议和数据"步骤 S5,用于旋转后气泡和液滴大小)。由于与微泡4、8相比,利用本协议生产的液滴是被动奢侈和积累的平台,因此需要尽可能小的液滴种群。因此,此协议使用经过搅拌的微泡样品,这些样本不是通过离心机进行大小隔离的,即使这意味着在最终解决方案中存在超声波不敏感的鼠标、脂质体和囊泡。这确实意味着生物分布的量化程序将为所有注入结构提供信号,并且不仅限于液滴。但是,由于这些大小相近的结构最有可能通过主要由大小决定的被动机制积累,因此,如果要在体内使用此平台,则不会怀疑这会改变可以做出的主要推论,尽管所有这些方面都应根据平台可能使用的上下文单独考虑。使用有超声波和无超声波的实验臂进行测试,以确保超声波敏感液滴是生物分布变化的原因,因为只有解决方案中的全氟碳核心组件才会对超声波做出响应。
搅拌后,小瓶休息15分钟,在小瓶中观察到分区(图3C对3D)。通过浮力选择大小是一个简单的方法,消除较大的结构/气泡从激活的微泡溶液8,17。在这种情况下,直径大于 5 μm 的颗粒大多在大小选择后被移除(图 4)。可以通过控制大小选择17的持续时间来调整大小选择的范围。希兰等人已经表明,不选择大小会导致产生的微气泡,包括血管8。
全氟碳化合物具有生物惰性7的优点。虽然脱氟丁烷的沸点是 -1.7 °C,高于体温,但液滴在暴露在 37 °C (图 7B)时不会立即蒸发。由于液滴在37°C下元稳定,需要额外的声能来蒸发液滴到微泡7,9。波普罗斯基等人已经通过加压22证明了波菲林液滴的浓缩。这是一个可行的,甚至必不可少的方法,当使用密度较低的全氟碳,但高压可能会破坏一些气泡的过程中。八氟丙烷 (C3F8) 的沸点为 -36.7 °C,因此滴凝结需要冷却和加压。然而,较轻的全氟碳会导致液滴不稳定。多德氟苯丙烷 (C5F12) 可导致更稳定的液滴,沸点为 28 °C。 然而,它是一种在室温下的液体,需要更强的声学能量来蒸发。因此,选择超声波对比剂的含气量,除了其制造参数外,还应考虑其预期生物应用的条件。在此协议中,用于冷凝的异丙醇浴被设置为 -15 至 -17 °C(步骤 4.7.1 和步骤 4.13),而其他协议使用 -10 °C 5,6。即使具有常见的脱氟丁烷核心,凝结温度也可能因辅料成分、总脂质浓度和脂壳成分而异。如果使用其他配方,可能需要优化以确保适当的液滴凝结,而不会导致溶液冻结。
由于液滴比其微泡前体7更小、更稳定,因此它们可以更好地利用被动积累机制向某些感兴趣的组织中扩张,例如某些肿瘤类型4、24的渗透性和保留效果增强。使用荧光、光学吸水和声学检测方法14,可以使用单一配方来量化吸收。此外,该平台可用于调查液滴的声学蒸发是否可以改善交付代理分数超过被动水平16。为了量化注射后组织和感兴趣的器官中的活体生物分布,应向动物注射已知数量的火焰脂液滴,超声波可能根据对照组进行,也可能不应用,应牺牲动物预先指定的时间点,并去除和称重器官。器官应同质化、过滤、稀释表面活性剂(洗涤剂)以去细胞化组织,并用荧光或UV-Vis光谱进行量化,以根据火焰兵信号获得每个器官质量的注射剂量百分比。对于第5.4.5步(图5)和第5.5.5步(图6),TritonX-100表面活性剂(洗涤剂)被用来破坏样品,因为它是非荧光在410纳米,其吸收波长不重叠的火焰兵的。
微泡没有紫外线吸收的特征。由于UV-Vis光谱仪的激光源与探测器平行,任何大气泡都可能使光线从探测器上散射,使它们看起来更具光学吸水性。与紫外线-Vis光谱仪不同,荧光光谱仪的探测器应与激光源垂直,以防止光源干扰探测器。UV-Vis 用于量化完整和中断的滴状样品的吸收量(第 5.4 步,图 5)。300 至 800 nm 被选为吸光波长,作为热脂的两个主要吸血带,索雷特带(340 至 500 nm)和 Q 波段(640 至 730 nm)属于此范围14。当组装成液滴(或其他超分子结构)时,火焰脂的Q波段峰值从671纳米变为700纳米(图5)。当这种外向结构被像Triton这样的表面活性剂破坏时,峰值会移回671纳米14,15。基于这种转变,可以判断火焰脂是在组装状态还是处于中断状态。两个峰值的比例可用于估计组件的衰变。
对于荧光测量(第5.5步,图6),选择了410纳米的激发波长,因为它对应索雷特带峰值为未组装的火焰脂14。600 至 800 nm 的发射波长范围被选为 PBS 中完整组件的峰值,Triton 中的火焰脂被破坏。"荧光(图6)之间的变化和增加(图6)之间的完整(704纳米在PBS)和中断(674纳米在特里顿)样品发生,因为结构诱导淬火。在组装形式中,火焰脂分子紧密地聚集在一起,因此产生的光子被附近的热脂分子吸收。这在完好无损的淬火效率中显而易见。因此,有必要稀释表面活性剂(洗涤剂)中的样品,如1%Triton X-100,以减轻淬火,并最大化信号的生物分布量化14。
对于简单性,相同的线性阵列超声传感器用于蒸发和成像(步骤 6.5 和 6.7,图 7)。这种超声波传感器(材料表)能够达到气化液滴8所需的必要峰值负压。用水龙头的去离子水填充水箱会产生溶解在水中的气体(第 6.1 步)。为了尽量减少溶解气体对水中的蒸汽化和成像的干扰,水在水箱中沉浸24小时,使水中的气体与大气平衡(第6.1步)。或者,去离子化水可以用一个足够大小的密封容器与足够强大的真空连接来除气。超声波图像显示,微气泡被成功凝结,因为低压下的液滴无法观测到/无回声(图7B)。只有在较高的输出压力下,液滴才蒸发成可观测的回波微泡(图7D、7F、7H)。虽然浓缩后液滴样品含有小鼠和脂质体/卵泡,但这些组件是非回声的,只有液滴可以蒸发成回声微泡。PBS 控制通过幻象流动,以建立基线图像 (数字7A, 7C, 7E, 7G)。随着 PBS 压力的增大,没有产生反差。这表明,来自传感器的高压不能单独在水基介质中产生自发气穴,因此所有其他产生的对比度都可归因于使用的超声波对比剂。如果输出压力过高,产生的微泡可能会被破坏。通过增量增加压力并观察生成的对比度,可以找到最佳压力8。液滴的循环半衰期可以通过蒸发液滴的一定时间间隔和观察随着时间推移产生的对比度7以类似的方式确定。
总之,使用凝结法创建具有不同火焰脂含量的多模相变化液滴。尺寸显示,火焰脂加载和微泡/滴浓度之间存在权衡。特征表明,在吸收和荧光方面,在完整和中断的形式上存在差异。超声成像显示,液滴在37°C下是非回声的,在足够的压力下可蒸发成回声微泡。特征还表明,Pyro脂液滴有可能取代用于液滴生物分布或积累测试的配套诊断剂。未来的工作将调查在溶液中的蒸发阈值,溶液内稳定性,并在 裸 鼠体内循环持续时间。
披露声明
作者没有什么可透露的。
致谢
作者要感谢布兰登·赫尔菲尔德博士帮助建立天然气交换器,以及米菲·霍克·严成博士的技术讨论。作者要感谢以下资金来源:安大略研究生奖学金、加拿大卫生研究院、特里福克斯研究所和玛格丽特公主癌症基金会。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt) | Avanti Polar Lipids | 880220 | Also known as "DSPE-PEG5K" |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 855775 | Also known as "DSPC" |
| Aluminum Foil | Any brand | ||
| Aluminum Seals, Tear-Off | VWR | 16171-840 | Standard Aluminum, 13 mm outer diameter |
| Bath Sonicator | Any brand | Capable of sonicating and heating up to 70 °C, | |
| Bio-Stor Screw Cap Vials | National Scientific | BS20NABP | Plastic, 2 mL Skirted, with O-ring |
| Borosilicate glass clear serum vials | VWR | 16171-285 | 3 mL, 7 mm inner mouth diameter, 13 mm outer mouth diameter |
| Borosilicate Glass Sample Vial with Phenolic Screw Cap | VWR | 66011-020 | 1.85 mL, Short Form Style, 12 mm outer diameter, 35 mm height, 8-425 cap size |
| Borosilicate Glass Vial with Screw-On cap | Any brand | Sizes will depend on desired volumes | |
| Chloroform | Any brand | ||
| Coulter Counter Elctrolyte Diluent | Any brand | Compatible with Coulter Counter | |
| Decafluorobutane (C4F10) | FluoroMed | 355-25-9 | |
| Deionized Water | Any brand | ||
| Dry Ice (Carbon Dioxide) | Any brand | ||
| Dynamic Light Scattering (DLS) Particle Analyzer | Any brand | Capable of temperature control | |
| E-Z Crimper, 13 mm | Wheaton | W225302 | 13 mm Standard Aluminum Seals |
| E-Z Decapper, 13 mm | Wheaton | W225352 | 13 mm Standard Aluminum Seals |
| Fluorescent Spectrophotometer | Any brand | Capable of 400 to 600 excitation and 300 to 800 nm emission detection, detector perpendicular to laser source | |
| Fluorescent Spectrophotometer Compatible Cuvette | Any brand | Can hold at least 2 mL, capable of 300 to 800 nm, all four sides are optical windows | |
| Gas Exchanger | Made in-house | Refer to Supplementary Information - "Other Protocols and Data" for assembly instructions. | |
| Glass syringes | Any brand | Sizes will depend on desired volumes | |
| GLWR Custom Aperture Tube 10 um | Beckman Coulter | B42812 | 10 µm aperture, compatible with Beckman Coulter MultiSizer 4e |
| Glycerol | Any brand | ||
| Insulated Styrofaom containers with lids | Any brand | ||
| Isopropanol | Any brand | ||
| Lyophilization-Style Rubber Stoppers | VWR | 71000-060 | 7 mm inner mouth diameter, 13 mm outer mouth diameter, 2-leg, Chlorobutyl |
| Membrane Diaphram Vacuum Pump | Sartorius Stedim | 16694-1-60-06 | Adjustable pressure |
| Metal Tongs | Any brand | ||
| Methanol | Any brand | ||
| MS250 21 MHz Linear Array Ultrasound Transducer | VisualSonics | 21 MHz, Capable of B-mode and non-linear imaging. | |
| MultiSizer 4e | Beckman Coulter | Capable of sizing from 0.2µm to 6 µm | |
| Nalgene Rapid-Flow Sterile Single Use Vacuum Filter Units | Thermo Scientific | 567-0010 | Polyethersulfone (PES) membrane, 0.1μm pore size, 1000 mL volume. As Isoton II is non-sterile, can use Filter units multiple times |
| Needles, Conventional | BD | 305176 | 20 gauge, 1.5 inch length |
| Nitrogen Gas | Any brand | Make sure there are regulator valves and tubes to direct the flow. Setup will be dependend on brand and source. | |
| Parafilm | Any brand | Called "wax film" in the protocol. | |
| Phosphate Buffered Saline (PBS) | Any brand | 1X, 7.4 pH | |
| Pipette | Any brand | Sizes will depend on desired volumes | |
| Pipette Tips | Any brand | Sizes will depend on desired volumes | |
| Plastic Syringes | Any brand | 1 mL, 3 mL, and 30 mL. With Luer Lock connections | |
| Polyethersulfone (PES) Membrane Filter | Any brand | 0.2 µm pore size | |
| Propylene Glycol | Any brand | ||
| Pyropheophorbide conjugated 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine | Made in-house | Also known as "Pyro-SPC". Refer to "Supplementary Information - Other Protocols and Data" for synthesis. | |
| Thermometer | Any brand | (-20 to 100 °C) | |
| Triton X-100 | Any brand | Also known as "2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethanol" | |
| Ultrapure Water | Any brand | Type 1 Purity | |
| Ultraviolet–Visible (UV-Vis) Spectrophotometer | Any brand | Capable of absorbance from 300 to 800 nm, at least 0.5 nm resolution | |
| Ultraviolet–Visible (UV-Vis) Spectrophotometer Compatible Cuvette, 1 cm Path Length | Any brand | Can hold at least 2 mL, capable of 300 to 800 nm | |
| Vacuum Desiccator | Any brand | ||
| Vevo 2100 Ultrasound Imaging Platform | VisualSonics | Pre-clinical ultrasound imaging system | |
| Vialmix | Bristol-Myers-Squibb | Called "mechanical agitator" in the protocol. Agitates for 45 s. | |
| Vortex Mixer | Any brand |
参考文献
- Gramiak, R., Shah, P. M. Echocardiography of the aortic root. Investigative Radiology. 3 (5), 356-366 (1968).
- Ferrara, K., Pollard, R., Borden, M. Ultrasound microbubble contrast agents: fundamentals and application to gene and drug delivery. Annual Review of Biomedical Engineering. 9, 415-447 (2007).
- Bing, K. F., Howles, G. P., Qi, Y., Palmeri, M. L., Nightingale, K. R. Blood-brain barrier (BBB) disruption using a diagnostic ultrasound scanner and Definity in mice. Ultrasound in Medicine and Biology. 35 (8), 1298-1308 (2009).
- Helfield, B. L., et al. Investigating the accumulation of submicron phase-change droplets in tumors. Ultrasound in Medicine and Biology. 49 (10), 2891 (2020).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3296 (2012).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2016).
- Yoo, K., et al. Impact of encapsulation on in vitro and in vivo performance of volatile nanoscale phase-shift perfluorocarbon droplets. Ultrasound in Medicine and Biology. 44 (8), 1836-1852 (2018).
- Sheeran, P. S., et al. Image-guided ultrasound characterization of volatile sub-micron phase-shift droplets in the 20-40 MHz frequency range. Ultrasound in Medicine and Biology. 42 (3), 795-807 (2016).
- Sheeran, P. S., et al. More than bubbles: creating phase-shift droplets from commercially available ultrasound contrast agents. Ultrasound in Medicine and Biology. 43 (2), 531-540 (2017).
- Chen, C. C., et al. Targeted drug delivery with focused ultrasound-induced blood-brain barrier opening using acoustically-activated nanodroplets. Journal of Controlled Release. 172 (3), 795-804 (2013).
- Wu, S. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Lee, J. Y., et al. Ultrasound-enhanced siRNA delivery using magnetic nanoparticle-loaded chitosan-deoxycholic acid nanodroplets. Advanced Healthcare Materials. 6 (8), 1601246 (2017).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjugate Chemistry. 25 (4), 796-801 (2014).
- Zheng, G., et al. Low-density lipoprotein reconstituted by pyropheophorbide cholesteryl oleate as target-specific photosensitizer. Bioconjugate Chemistry. 13 (3), 392-396 (2002).
- Dhaliwal, A., Zheng, G. Improving accessibility of EPR-insensitive tumor phenotypes using EPR-adaptive strategies: Designing a new perspective in nanomedicine delivery. Theranostics. 9 (26), 8091-8108 (2019).
- Goertz, D. E., de Jong, N., vander Steen, A. F. Attenuation and size distribution measurements of Definity and manipulated Definity populations. Ultrasound in Medicine and Biology. 33 (9), 1376 (2007).
- Pellow, C., Acconcia, C., Zheng, G., Goertz, D. E. Threshold-dependent nonlinear scattering from porphyrin nanobubbles for vascular and extravascular applications. Physics in Medicine and Biology. 63 (21), 215001 (2018).
- Kwan, J. J., Borden, M. A. Lipid monolayer collapse and microbubble stability. Advances in Colloid and Interface Science. 183, 82-99 (2012).
- Overchuk, M., et al. Subtherapeutic Photodynamic Treatment Facilitates Tumor Nanomedicine Delivery and Overcomes Desmoplasia. Nano Letters. 21 (1), 344-352 (2021).
- Feshitan, J., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Paproski, R. J., et al. Porphyrin nanodroplets: Sub-micrometer ultrasound and photoacoustic contrast imaging agents. Small. 12 (3), 371-380 (2016).
- Periyasamy, P. C., Leijten, J. C. H., Dijkstra, P. J., Karperien, M., Post, J. N. Nanomaterials for the local and targeted delivery of osteoarthritis drugs. Journal of Nanomaterials. 2021, 1-13 (2012).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46 (12), 6387-6392 (1986).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。