需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
海洋蛀木甲壳类动物对木材生物降解性能的快速测试
摘要
该协议提出了一种通过测量粪便颗粒产生来评估蛀木甲壳类动物 Limnoria的进食速率的方法。该方法设计用于非专业实验室,并有可能纳入标准测试协议,以评估海洋条件下增强的木材耐久性。
摘要
蛀木无脊椎动物迅速破坏海洋木材和沿海木制基础设施,每年在全球范围内造成数十亿美元的损失。由于使用广谱杀菌剂处理木材,如杂酚油和铬化砷酸铜(CCA),现在受到立法限制用于海洋用途,因此需要天然耐用的木材种类和新颖的木材保存方法。这些方法经过测试,以满足监管标准,例如针对海洋蛀虫测试木材防腐剂的欧洲标准EN 275。通过实验室测试可以快速、廉价地对耐用木材物种或木材防腐剂处理进行初步研究,这比通常成本高昂的长期海洋野外试验具有许多优势。许多种类的 Limnoria (gribble)是海洋蛀木甲壳类动物。 Limnoria 非常适合用于海洋蛀木者对木材生物降解的实验室测试,因为将它们饲养在水族箱中的实用性以及易于测量它们在木材上的进食率。在这里,我们概述了一种可标准化的实验室测试,用于使用gribble评估木材的生物降解。
引言
蛀木虫可对海洋木结构造成广泛损害,如海防、码头和水产养殖结构;更换或修复,全世界每年花费数十亿美元1,2,3。为了保护这些结构,木材通常经过处理以减少生物降解。然而,由于澳大利亚、欧盟、英国和美国在海洋环境中限制使用广谱杀菌剂,因此人们追捧对蛀虫具有天然耐久性的新型改性技术和木材种类4,5,6,7。在海洋环境中保存木材的新技术需要彻底的测试,以满足监管标准并限制任何化学防腐剂浸出等危害对环境的影响。例如,欧洲标准EN 275是1992年的现行欧洲标准,用于评估木材防腐处理对海洋蛀木器的损害8,9。该标准与其他禁止使用杀生物化合物的立法(如CCA4,5,6,7 和杂酚油10)一起,需要可持续的,无毒的木材保护方法,并使用天然耐用的木材物种来取代杀菌处理11,12.海洋试验,例如EN 275中规定的试验,需要较长的暴露期,因此成本高昂且缓慢,无法产生有意义的结果。然而,实验室测试为保护木材产品免受海洋蛀木虫攻击的测试方法提供了一种更快的替代方案,可以快速评估对处理时间表的调整13。这种快速实验室实验的结果旨在为木材的新型改性过程提供信息,并确定具有天然耐久性的木材物种,以应对蛀虫的损害。低进料速率和活力可能表明潜在产品的抗性增加,然后可以将此信息反馈给行业合作伙伴,以使他们能够改进设计。我们的方法允许灵活和快速的响应,这在工业中是可取的,一旦确定了有前途的产品,就可以用海洋试验的结果来补充。
Gribbles(Limnoria)是Limnoriidae家族中的等足甲壳类动物属。全世界有超过60种Limnoria13,14,15,在英国发现了三种常见物种,Limnoria lignorum,Limnoria tripunctata和Limnoria quadripunctata16。他们在淹没在海水中的木材表面开挖隧道,经常造成经济上的重大损害。Gribbles在英国沿海水域非常丰富,并且在实验室条件下易于维护,使其成为研究海洋蛀木无脊椎动物木材生物降解的理想生物。评估不同木材种类和木材保存方法上的进料速率和活力可以确定其抗生物降解的功效。以下协议列出了一种测量磨料速率的标准方法,该方法由Borges及其同事12,17开发而成,此外还简化了图像分析的引入,使该过程可以在非专业实验室中操作。图像分析还用于减少手动计数大量样品的实际限制。根据英国标准EN350-1:1994,长期海洋测试的耐久性根据樟子松边材18进行分级。在这里介绍的短期实验室测试中,我们使用苏格兰松(Pinus sylvestris L)边材作为测试ekki(Lophira alata Banks ex C.F Gaertn),山毛榉(Fagus sylvatica L),甜栗(Castanea sativa Mill)和松节油(Syncarpia glomulifera(Sm.)Nied)的心材的对照。使用每种木材品种八次重复的平均粪便颗粒产量和活力作为耐久性的指标。我们提供从典型评估中收集的说明性数据,使用格里布物种Limnoria quadripunctata和一系列天然耐用的木材物种。由Menzies(1951)提供的钥匙确定的Limnoria quadripunctata被选为生物降解试验的最佳物种,因为它是该家族中研究最充分的成员,并且被公认为用于生物降解试验的模型物种。该协议也适用于测试不同处理的木材,尽管使用的对照应该是未经处理的同一物种的复制。
研究方案
1. 准备测试棒
- 完成任何处理过程后,将干燥的木材切割成尺寸为2 mm x 4 mm x 20 mm的测试棒(图1)。在实验室条件下,风干粘在恒定的重量上。使用至少5个被测试木材的复制品。

图1:用于短期实验室测试的测试棒,用于评估磨料进料率。 测试木棍尺寸为 2 毫米 x 4 毫米 x 20 毫米。从左到右:ekki,松节油,甜栗子和山毛榉心材以及苏格兰松树边材。比例尺 4 mm。请单击此处查看此图的放大版本。
- 真空浸渍
- 木材制备后(即切割和处理,如果适用),将木棍放在食品安全塑料容器中的网下,放在真空干燥器内,并更换盖子,确保密封紧密,通过真空润滑脂涂层促进(图2)。
- 在连接干燥器和泵的管道之间安装一个三通阀,第三个管道通向露天(图2)。确保三通阀对空气关闭并运行泵,以在真空干燥器内达到-0.75至-1.0 bar之间的真空,并保持该真空45分钟-1小时。
- 将第三管的开口端浸入海水容器中。关闭泵并关闭通向泵的阀门,然后慢慢打开阀门,直到海水被真空吸入干燥器。让水流动,直到它填满塑料容器,高于网格的水平。
- 然后将管子从容器中的海水中抽出,让空气进入,直到干燥器恢复到大气压。将棍子浸入网眼下,直到它们沉入塑料容器的底部。

图2:用于用海水真空浸渍木棒的设备,准备在实验室进料测定期间喂入砂砾。 A) 真空干燥器;B) 泵;c) 真空干燥器压力表;d) 三通阀通向真空干燥器、泵和露天或海水(橙管)。请点击此处查看此图的放大版本。
- 浸出木材
- 将海水饱和测试棒浸入50 mL管中包含的海水中(图3)。定期补充水20天。
注意:浸出过程适用于任何被测实验木材,包括经过处理的木材或天然木材。
- 将海水饱和测试棒浸入50 mL管中包含的海水中(图3)。定期补充水20天。

图3:在实验室进料测定期间,从木棍中浸出,用于准备喂食到砂砾中。 完全浸没在50毫升Falcon管中含有的海水中的木材,定期换水(1-3天),产生明显颜色的渗滤液。从左到右从心材渗滤液;甜栗子,松节油,ekki,山毛榉和苏格兰松树边材。请点击此处查看此图的放大版本。
2. 提取格里布
- 从受感染的木块中提取单个的碎屑标本。使用一对细镊子和一支薄(尺寸000/0.4毫米或更小)画笔。用镊子小心地剥离任何覆盖砾状洞穴的木材
注意:洞穴位于木材表面,可以通过小孔识别(图4)。 - 一旦露出砂砾,使用画笔从下面轻轻地捡起个人,然后放入装满海水的培养皿中。在显微镜下检查砂砾以确定物种,并确保在提取时没有造成损害。
注意:跳动的胸足类动物是生命力的标志。- 丢弃任何雌性育雏卵,因为受孕的雌性的摄食能力降低。

图 4:带有两个典型通风孔的砾石洞穴的图像。 L. 四分枝 蜀在一根辐射松木上挖洞,尺寸为2毫米x 4毫米x 20毫米。在洞穴入口旁边可以看到两个较小的通风孔。比例尺 2 mm。请单击此处查看此图的放大版本。
- 识别四尖瓣蚴
- 在立体显微镜下,通过动物的pleotelson上的四个不同的结节,以方形图案排列,以及第五个pleonite19上的X形carina来识别Limnoria quadripunctata(图5)。

图5: 四尖吻 合体识别特征。 背表面 四尖瓣湖水肿的图像, 在x20放大倍率下在立体显微镜上拍摄。红色箭头显示的识别特征 - 表示X形的carina和蓝色箭头 - 表示pleotelson上的四个结节。比例尺 1 mm。请单击此处查看此图的放大版本。
3. 准备孔板
- 在直径为20毫米的孔的多孔板中,每孔放置一个测试棒和5毫升未过滤的海水,在32-35 PSU之间(图6)。
- 在整个孔板中系统地放置处理/木材种类,以便每种类型的木材在每个板中至少代表一次。每孔添加一个格里布。
注意: 对于L种,培养箱中的温度应保持在20°C±2°C的稳定温度。 quadripunctata, 其他种类的 Limnoria 可以使用温度调整以适应特定物种。 - 将板保持在恒定的黑暗条件下,因为光周期对磨料进给率没有影响15。

图6:用于研磨进料测定的实验设置。 用于实验室测试磨料速率的12个多孔板的示例。每个井包含5毫升海水和一根不同木材品种的测试棒(20毫米x 4毫米x 2毫米);苏格兰松树边材和ekki,山毛榉,甜栗子和松节油心材。比例尺 20 mm。请单击此处查看此图的放大版本。
4.收集和计数粪便颗粒并评估活力。
- 每周两次,从孔板中取出测试棒和每个钻孔(每孔一个),并放入新鲜预先制备的孔板中(每孔含有5mL海水[32-35 PSU,18-22°C])。
- 使用画笔轻轻刷掉棍子上的任何粪便颗粒,然后转移并将粪便颗粒保留在原始孔中。
注意:在将砂砾转移到新鲜的孔板之前,可以按1-5的等级评估活力;1=死的,2=被动的,不在木头上,3=主动游泳或跳动的胸足动物,不在木头上,4=在木头上爬行,5=钻进木头。 - 图像处理
- 使用精细的画笔分离任何团块,以便单个颗粒可见,并将颗粒从井的边缘刷开。在体视显微镜下,以x4的放大倍率拍摄详细的照片,然后上传到计算机(图7)。
注意:确保颗粒处于焦点状态,背景均匀,水面上没有阴影或光线反射。
- 使用精细的画笔分离任何团块,以便单个颗粒可见,并将颗粒从井的边缘刷开。在体视显微镜下,以x4的放大倍率拍摄详细的照片,然后上传到计算机(图7)。
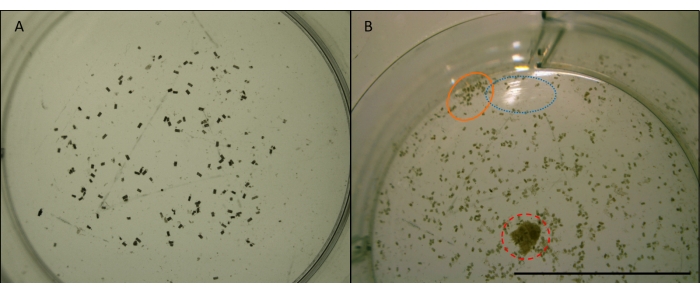
图7:咕噜咕噜的粪便颗粒的图像。 L. 四 孔粪便颗粒(小的,圆柱形的,棕色的颗粒),来自在多孔板的一个孔中喂养辐射松木。在 x4 倍率下拍摄。用于图像分析的操作之前的图像(见 图7)。A) 在 ImageJ 中用于自动计数的合适图像的示例。颗粒充分展开并远离井的边缘。井居中,没有障碍物或反射。B) 不适合图像分析的图像示例。井偏离中心,切断了下半部分。蓝色(虚线)圆圈表示水面上的光反射。橙色(实心)圆圈显示聚集在一起太近且太靠近井边缘的颗粒。红色(虚线)圆圈表示未移除的木屑。比例尺 10 mm。请单击此处查看此图的放大版本。
- 使用图像J生成粪便沉淀计数的过程。
- 从 https://imagej.nih.gov/ij/download.html 下载 ImageJ(最新版本截至 03/08/21、1.8.0_172)或从计算机浏览器运行。
- 通过拖放或选择 "文件|"上传一堆图像导入|图像序列|浏览。不要更改任何参数,然后选择" 确定"。
- 接下来,使用圆形工具选择含有粪便颗粒的井的底部。移除井边,选择编辑|外面清晰。将图像设为二进制图像,选择"处理|创建二进制。
- 通过选择 "分析|进行校准设置比例 并选择图像每毫米的像素数(例如 10 像素 = 1 毫米)。清点颗粒,选择 分析|分析颗粒。
- 在 "大小(unit2)"旁边的框中,使用前面的单位比例集选择与最小尺寸颗粒相同的下限阈值(例如,如果 10 像素 = 1 mm,最小颗粒为 0.5 mm,请选择 5 无穷大)。
- 在 "显示 "下拉框中,选择" 大纲 ",然后勾选" 摘要 "并按 "确定" (图 8)。
注:更多信息请见 https://imagej.nih.gov/ij/docs/guide/index.html

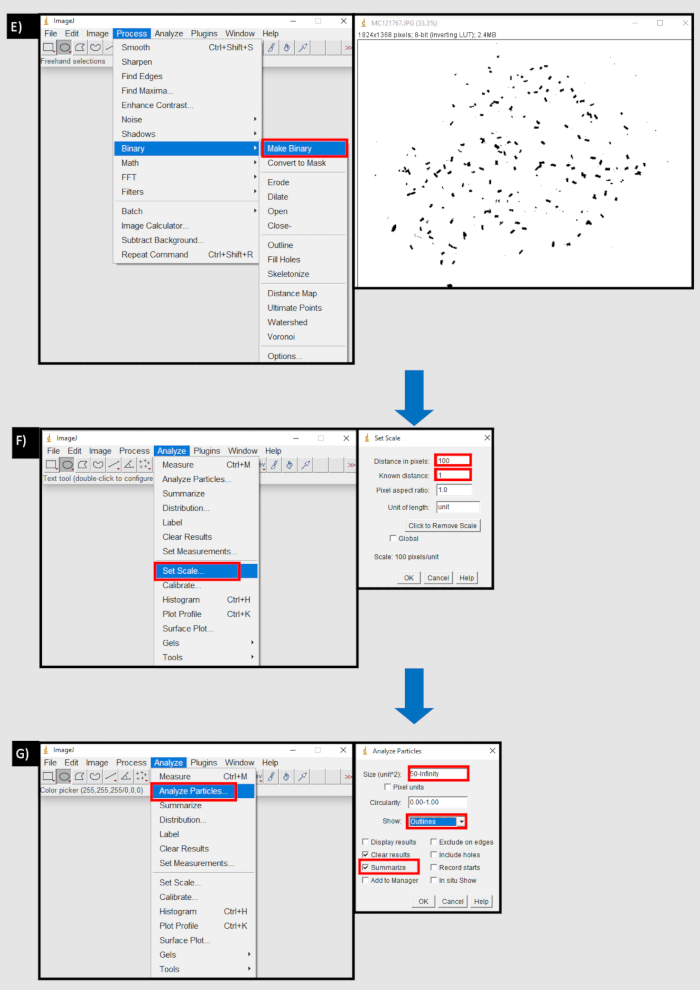
图8:ImageJ中用于计数粪便颗粒的过程的流程图。 A) 在 ImageJ 的"文件"选项卡中导入图像序列。B)"导入图像序列"对话框中的浏览按钮,用于从本地设备导入图像序列。C)使用圆圈工具选择含有粪便颗粒的区域 D)编辑选项卡区域中的"清除外部"按钮以删除所选区域的外部。E) 在"过程"选项卡中制作二进制按钮。F) 在"分析"选项卡中设置比例按钮。以像素为单位的距离相当于一个度量单位 (mm) 的像素数。G) "分析"选项卡中的"分析粒子"按钮。大小(单位^2)设置为粪便颗粒大小的下限阈值(以像素为单位)到无穷大。显示"大纲"和"摘要"被选中。请点击此处查看此图的放大版本。
-
数据分析
- 将颗粒计数转换为每天的颗粒数,从而间接测量进料速率。在蜕皮发生的日子里丢弃任何蜕皮个体的数据(图9)。
注意:蜕皮发生在1-3天内,当可以看到外骨骼完全蜕皮时可以识别。
- 将颗粒计数转换为每天的颗粒数,从而间接测量进料速率。在蜕皮发生的日子里丢弃任何蜕皮个体的数据(图9)。

图 9:蜕皮示例。 Gribble(L. quadripunctata) 蜕皮,在直径为20 mm x 4 mm x 2 mm的Radiata松木测试棒上。换羽由红色圆圈表示。比例尺 2 mm。请单击此处查看此图的放大版本。
结果
L.2020年11月,使用五种不同的木材类型(苏格兰松(Pinus sylvestris L)边材和山毛榉(Fagus sylvatica L),ekki(Lophira alata Banks ex C. F Gaertn),甜栗子(Castanea sativa Mil)和松节油(Syncarpia glomulifera (Sm.) Neid))的心材(见材料表)进行了为期20天的四分鼎目。每个木种使用八根复制棒,每根木棍喂养一个四尖瓣木的标本。所有鲷鱼都?...
讨论
在选择用于喂养实验的试样之前,应对个体进行筛选以评估其适用性。由于体型的差异,个体之间的进食速率可能存在一些差异,因此应仅选择完全生长的成年标本。Borges等人在1.5毫米和3毫米长之间的个体的进食速率之间没有显着差异,200917。雌性 Limnoria 孵化卵,在此期间喂养率降低。因此,在选择标本时,应检查并丢弃任何育雏雌性。同样,蜕皮个体的进食率也会降?...
披露声明
作者与本研究没有相关的利益冲突。
致谢
感谢挪威研究委员会(奥斯陆区域基金,Alcofur rffofjor 269707)和朴茨茅斯大学(理学院博士研究助学金)为露西·马丁的研究提供资金。此外,Gervais S. Sawyer提供了用于产生代表性结果的木材。松节油由不列颠哥伦比亚大学的Philip Evans教授提供。
材料
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
参考文献
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。