Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Schnelle Prüfung der Beständigkeit von Holz gegen den biologischen Abbau durch marine holzbohrende Krebstiere
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Methode zur Bewertung der Fütterungsrate des holzbohrenden Krebstiers Limnoria durch Messung der Fäkalpelletproduktion dar. Diese Methode ist für den Einsatz in nicht spezialisierten Labors konzipiert und bietet das Potenzial, in Standardprüfprotokolle integriert zu werden, um eine verbesserte Holzhaltbarkeit unter Marinebedingungen zu bewerten.
Zusammenfassung
Holzbohrende Wirbellose zerstören schnell Meereshölzer und hölzerne Küsteninfrastruktur und verursachen jedes Jahr Schäden in Milliardenhöhe auf der ganzen Welt. Da die Behandlung von Holz mit Breitbandbioziden wie Kreosot und chromatiertem Kupferarsenat (CCA) in der marinen Verwendung durch die Gesetzgebung eingeschränkt ist, sind natürlich haltbare Holzarten und neuartige Konservierungsmethoden für Holz erforderlich. Diese Methoden werden getestet, um regulatorische Normen wie die europäische Norm zur Prüfung von Holzschutzmitteln gegen Meeresbohrer, EN 275, zu erfüllen. Die Erstuntersuchung langlebiger Hölzerarten oder Holzschutzbehandlungen kann schnell und kostengünstig durch Labortests erreicht werden, was viele Vorteile gegenüber marinen Feldversuchen bietet, die typischerweise kostspielige, langfristige Bemühungen sind. Viele Arten von Limnoria (Gribble) sind marine holzbohrende Krebstiere. Limnoria ist ideal für den Einsatz in Labortests des biologischen Abbaus von Holz durch Marine-Holzbohrer, aufgrund der Praktikabilität der Aufzucht in Aquarien und der Leichtigkeit, ihre Fütterungsraten auf Holz zu messen. Hierin beschreiben wir einen standardisierbaren Labortest zur Beurteilung des biologischen Abbaus von Holz mit Gribble.
Einleitung
Holzbohrer können umfangreiche Schäden an marinen Holzkonstruktionen wie Seeverteidigungen, Piers und Aquakulturstrukturen verursachen. deren Ersatz oder Wiederherstellung weltweit Milliarden von Dollar pro Jahr kostet1,2,3. Um diese Strukturen zu schützen, wird Holz oft behandelt, um den biologischen Abbau zu reduzieren. Aufgrund der Beschränkung der Verwendung von Breitbandbioziden in Australien, der EU, dem Vereinigten Königreich und den USA in der Meeresumwelt werden jedoch neue Modifikationstechniken und Holzarten, die für Bohrer von Natur aus haltbar sind, gesucht4,5,6,7. Neuartige Techniken zur Erhaltung von Holz in der Meeresumwelt erfordern gründliche Tests, um die gesetzlichen Standards zu erfüllen und die Umweltauswirkungen von Gefahren wie dem Auslaugen chemischer Konservierungsmittel zu begrenzen. Beispielsweise wird die europäische Norm EN 275, die aktuelle europäische Norm von 1992, verwendet, um Holzschutzbehandlungen gegen Marine-Holzbohrerschäden zu bewerten8,9. Diese Norm erfordert zusammen mit anderen Rechtsvorschriften gegen die Verwendung von Biozidverbindungen wie CCA4,5,6,7 und Kreosot10 nachhaltige, ungiftige Methoden des Holzschutzes und die Verwendung von natürlich haltbaren Holzarten als Ersatz für Biozidbehandlungen11,12 . Marine Versuche, wie sie in EN 275 spezifiziert sind, erfordern lange Expositionszeiten und sind daher teuer und langsam, um aussagekräftige Ergebnisse zu erzielen. Laborversuche bieten jedoch eine viel schnellere Alternative zu Testmethoden zur Konservierung von Holzprodukten gegen den Angriff von Holzbohrern im Meer, was eine schnelle Bewertung von Anpassungen der Behandlungspläne ermöglicht13. Die Ergebnisse dieses schnellen Laborexperiments sollen neuartige Modifikationsprozesse von Holz informieren und Holzarten mit natürlicher Haltbarkeit für Bohrerschäden identifizieren. Eine niedrige Fütterungsrate und Vitalität kann auf eine erhöhte Resistenz in potenziellen Produkten hinweisen, und diese Informationen können dann an Industriepartner zurückgegeben werden, damit sie designs verbessern können. Unsere Methode ermöglicht eine flinke und schnelle Reaktion, die in der Industrie wünschenswert ist, und sobald vielversprechende Produkte identifiziert wurden, können die Ergebnisse mit denen aus marinen Studien ergänzt werden.
Gribbles (Limnoria) ist eine Gattung von Krebstieren aus der Familie der Limnoriidae. Es gibt über 60 Arten von Limnoria weltweit13,14,15, mit drei häufigen Arten in Großbritannien, Limnoria lignorum, Limnoria tripunctata und Limnoria quadripunctata16. Sie bohren Tunnel auf der Oberfläche von Holz, das in Meerwasser eingetaucht ist, und verursachen oft wirtschaftlich erhebliche Schäden. Gribbles sind in britischen Küstengewässern sehr häufig und unter Laborbedingungen leicht zu pflegen, was sie zu idealen Organismen für die Untersuchung des biologischen Abbaus von Holz durch marine holzbohrende Wirbellose macht. Die Bewertung der Fütterungsraten und der Vitalität von Körnern an verschiedenen Holzarten und Holzschutzmethoden kann die Wirksamkeit ihrer Beständigkeit gegen biologischen Abbau bestimmen. Das folgende Protokoll legt eine Standardmethode zur Messung der Gribble-Vorschubgeschwindigkeit fest, die aus der von Borges und Kollegen beschriebenen Methode entwickelt wurde12,17, und rationalisiert die Einführung der Bildanalyse, um den Prozess in nicht spezialisierten Labors bedienbar zu machen. Die Bildanalyse wird auch verwendet, um die praktischen Einschränkungen beim manuellen Zählen einer großen Anzahl von Proben zu reduzieren. Die Haltbarkeit bei Langzeit-Marinetests gemäß der britischen Norm EN350-1:1994 wird in Bezug auf Pinus sylvestris-Splintholz18 eingestuft. In den hier vorgestellten Kurzzeit-Labortests verwenden wir Splintholz der Waldkiefer (Pinus sylvestris L) als Kontrolle zur Prüfung von Kernholz der Arten Ekki (Lophira alata Banks ex C.F Gaertn), Buche (Fagus sylvatica L), Edelkastanie (Castanea sativa Mill) und Terpentin (Syncarpia glomulifera (Sm.) Nied). Die durchschnittliche Fäkalpelletproduktion und Vitalität von acht Replikaten pro Holzart wurde als Indikator für die Haltbarkeit verwendet. Wir liefern anschauliche Daten, die aus einer typischen Bewertung unter Verwendung der Gribble-Art Limnoria quadripunctata und einer Reihe von natürlich haltbaren Holzarten gesammelt wurden. Limnoria quadripunctata, identifiziert durch die von Menzies (1951) zur Verfügung gestellten Schlüssel, wurde als die optimale Art für biologische Abbauversuche ausgewählt, da sie das am besten untersuchte Mitglied der Familie ist und sich als Modellspezies für den Einsatz in biologischen Abbauversuchen etabliert hat. Dieses Protokoll gilt auch für die Untersuchung von Hölzern unterschiedlicher Behandlungen, obwohl die verwendete Kontrolle unbehandelte Replikationen derselben Art sein sollte.
Protokoll
1. Vorbereiten von Teststäbchen
- Nachdem alle Behandlungsprozesse abgeschlossen sind, schneiden Sie trockenes Holz in Teststäbe mit der Größe 2 mm x 4 mm x 20 mm (Abbildung 1). Lufttrocken haftet unter Laborbedingungen bei einem konstanten Gewicht. Verwenden Sie mindestens 5 Replikate jedes getesteten Holzes.

Abbildung 1: Teststäbchen, die in kurzfristigen Labortests verwendet werden, um die Gribble-Fütterungsraten zu bewerten. Testen Sie Holzstöcke mit den Abmessungen 2 mm x 4 mm x 20 mm. Von links nach rechts: Ekki, Terpentin, Edelkastanien- und Buchenkernholz und Edelkiefern-Splintholz. Maßstabsleiste 4 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Vakuumimprägnierung
- Legen Sie nach der Holzvorbereitung (d. h. schneiden und behandeln Sie die Stöcke unter einem Netz in einem lebensmittelechten Kunststoffbehälter in den Vakuum-Exsikkator und ersetzen Sie den Deckel, um eine dichte Abdichtung zu gewährleisten, die durch eine Beschichtung aus Vakuumfett erleichtert wird (Abbildung 2).
- Befestigen Sie ein Drei-Wege-Ventil zwischen dem Schlauch, der den Exsikkator und die Pumpe verbindet, wobei ein drittes Rohr ins Freie führt (Abbildung 2). Stellen Sie sicher, dass das Drei-Wege-Ventil für die Luft geschlossen ist und lassen Sie die Pumpe laufen, um ein Vakuum zwischen -0,75 und -1,0 bar innerhalb des Vakuum-Exsikkators zu erreichen und halten Sie dieses Vakuum für 45 Minuten - 1 Stunde.
- Tauchen Sie das offene Ende der dritten Röhre in einen Behälter mit Meerwasser. Schalten Sie die Pumpe aus und schließen Sie das Ventil, das zur Pumpe führt, und öffnen Sie dann langsam das Ventil, bis Meerwasser vom Vakuum in den Exsikkator gesaugt wird. Lassen Sie das Wasser fließen, bis es den Kunststoffbehälter über dem Niveau des Netzes füllt.
- Ziehen Sie dann das Rohr aus dem Meerwasser in den Behälter, so dass Luft eindringen kann, bis der Exsikkator auf atmosphärischen Druck zurückkehrt. Halten Sie die Sticks unter dem Netz, bis sie auf den Boden des Plastikbehälters sinken.

Abbildung 2: Geräte zum Vakuumieren von Holzstäbchen mit Meerwasser in Vorbereitung auf die Fütterung von Gribbles während eines Laborfütterungsassays. A) Vakuum-Exsikkator; B) Pumpe; C) Manometer für den Vakuum-Exsikkator; D) Das Drei-Wege-Ventil, das zum Vakuum-Exsikkator, zur Pumpe und zum Freien oder Meerwasser führt (orangefarbenes Rohr). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Auslaugung von Holz
- Mit Meerwasser gesättigte Teststäbchen in Meerwasser tauchen, das in 50-ml-Röhrchen enthalten ist (Abbildung 3). Ersetzen Sie regelmäßig Wasser für einen Zeitraum von 20 Tagen.
HINWEIS: Das Auslaugungsverfahren gilt für jedes zu prüfende Versuchsholz, einschließlich behandelter oder natürlicher Hölzer.
- Mit Meerwasser gesättigte Teststäbchen in Meerwasser tauchen, das in 50-ml-Röhrchen enthalten ist (Abbildung 3). Ersetzen Sie regelmäßig Wasser für einen Zeitraum von 20 Tagen.

Abbildung 3: Sickerwasser aus Holzstäbchen zur Vorbereitung für die Fütterung an Gribbles während eines Laborfütterungsassays. Holz, das vollständig in Meerwasser eingetaucht war, das in einem 50 ml Falcon-Röhrchen enthalten war, mit regelmäßigem Wasserwechsel (1-3 Tage), produzierte deutlich gefärbtes Sickerwasser. Von links nach rechts Sickerwasser aus Kernholz von; Edelkastanie, Terpentin, Ekki und Buche und Waldkiefer Splintholz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Extraktion von Gribble
- Extrahieren Sie einzelne Proben von Gribble aus einem befallenen Holzblock. Verwenden Sie eine feine Pinzette und einen dünnen Pinsel (Größe 000/0,4 mm oder kleiner). Ziehen Sie vorsichtig jedes Holz, das den Gribble-Bau bedeckt, mit der Pinzette zurück
HINWEIS: Höhlen befinden sich auf der Oberfläche von Holz und können durch kleine Löcher identifiziert werden (Abbildung 4). - Sobald gribble freigelegt wurde, verwenden Sie einen Pinsel, um vorsichtig Personen von unten aufzunehmen und in einer mit Meerwasser gefüllten Petrischale abzulegen. Überprüfen Sie Gribble unter einem Mikroskop, um Arten zu identifizieren und sicherzustellen, dass während der Extraktion keine Schäden verursacht wurden.
HINWEIS: Pleopoden schlagen sind ein Zeichen von Vitalität.- Entsorgen Sie alle Weibchen, die Eier brüten, da gravide Weibchen eine reduzierte Fütterungskapazität haben.

Abbildung 4: Bild eines Gribble-Baus mit zwei typischen Belüftungslöchern. Hrsg. quadripunctata graben auf einem Stock aus Radiata Kiefernholz, Größe 2 mm x 4 mm x 20 mm. Zwei kleinere Lüftungslöcher sind neben dem Baueingang zu sehen. Maßstabsleiste 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Identifizierung von Limnoria quadripunctata
- Identifizieren Sie Limnoria quadripunctata unter einem Stereomikroskop durch die vier verschiedenen Tuberkel, die in einem quadratischen Muster angeordnet sind, auf dem Pleotelson des Tieres zusätzlich zu einer X-förmigen Carina auf dem fünften Pleonit19 (Abbildung 5).

Abbildung 5: Limnoria quadripunctata Identifizierende Merkmale. Bild der dorsalen Oberfläche Limnoria quadripunctata, aufgenommen auf einem Stereomikroskop mit x20-Vergrößerung. Erkennungsmerkmale, die durch roten Pfeil angezeigt werden - zeigt die X-förmige Carina und den blauen Pfeil an - zeigen vier Tuberkel auf Pleotelson an. Maßstabsleiste 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Brunnenplatten vorbereiten
- In Multi-Well-Platten mit Vertiefungen mit einem Durchmesser von 20 mm wird ein Prüfstab und 5 ml ungefiltertes Meerwasser zwischen 32 und 35 Netzteil pro Vertiefung platziert (Abbildung 6).
- Platzieren Sie Behandlungen / Holzarten systematisch in der gesamten Brunnenplatte, so dass jede Holzart mindestens einmal pro Platte vertreten ist. Fügen Sie einen Gribble pro Vertiefung hinzu.
ANMERKUNG: Die Temperatur sollte in einem Inkubator bei 20 °C ± 2 °C für die Spezies L stabil gehalten werden. quadripunctata, andere Arten von Limnoria können mit Anpassungen der Temperatur verwendet werden, um der spezifischen Art zu entsprechen. - Halten Sie die Platten unter konstanten dunklen Bedingungen, da die Photoperiode keinen Einfluss auf die Mahlgeschwindigkeit hat15.

Abbildung 6: Versuchsaufbau für den Gribble Feeding Assay. Ein Beispiel für eine 12-Multi-Well-Platte, die bei der Laboruntersuchung der Gribble-Fütterungsrate verwendet wird. Jede Vertiefung enthält 5 ml Meerwasser und einen Prüfstab (20 mm x 4 mm x 2 mm) verschiedener Holzarten; Waldkiefer Splintholz und Ekki, Buche, Edelkastanie und TerpentinKernholz. Maßstabsleiste 20 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Fäkalpellets sammeln und zählen und Vitalität beurteilen.
- Zweimal pro Woche den Teststäbchen und jeden Gribble (einen pro Vertiefung) von der Bohrlochplatte entfernen und in eine frisch vorbereitete Brunnenplatte (mit 5 ml Meerwasser pro Vertiefung [32-35 PSU, 18-22 °C]) geben.
- Verwenden Sie einen Pinsel, um Fäkalienpellets vor dem Übertragen vorsichtig vom Stick abzubürsten, und bewahren Sie die Fäkalpellets im ursprünglichen Brunnen auf.
HINWEIS: Vor der Übertragung des Gribbles auf einen frischen Brunnenteller kann die Vitalität auf einer Skala von 1-5 beurteilt werden. 1= tot, 2 = passiv, nicht auf dem Holz, 3 = aktiv schwimmende oder schlagende Pleopoden, nicht auf dem Holz, 4 = Kriechen auf der Holzoberfläche, 5 = in den Wald eingegraben. - Bildverarbeitung
- Verwenden Sie einen feinen Pinsel, um Klumpen zu trennen, so dass einzelne Pellets sichtbar sind, und bürsten Sie Pellets von den Rändern des Brunnens weg. Machen Sie ein detailliertes Foto unter einem Stereomikroskop, bei vergrößerung x4 und laden Sie es auf einen Computer hoch (Abbildung 7).
HINWEIS: Stellen Sie sicher, dass die Pellets scharf sind und der Hintergrund gleichmäßig ist, ohne Schatten oder Lichtreflexionen auf der Wasseroberfläche.
- Verwenden Sie einen feinen Pinsel, um Klumpen zu trennen, so dass einzelne Pellets sichtbar sind, und bürsten Sie Pellets von den Rändern des Brunnens weg. Machen Sie ein detailliertes Foto unter einem Stereomikroskop, bei vergrößerung x4 und laden Sie es auf einen Computer hoch (Abbildung 7).
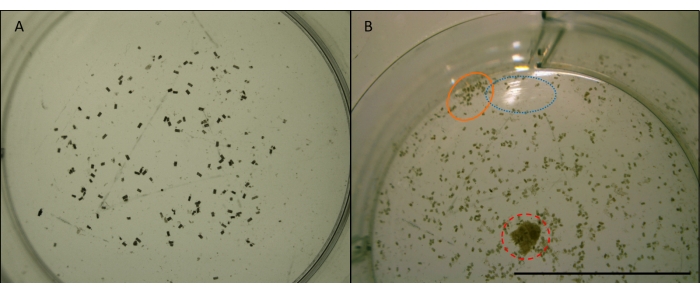
Abbildung 7: Bild von Fäkalienpellets. Hrsg. quadripunctata fäkale Pellets (kleine, zylindrische, braune Pellets) aus der Fütterung von Radiata-Kiefernholz in einem Brunnen einer Multi-Well-Platte. Aufgenommen bei x4 Vergrößerung. Bilder vor der Manipulation für die Bildanalyse (siehe Abbildung 7). A) Beispiel für ein geeignetes Bild, das für die automatisierte Zählung in ImageJ verwendet werden soll. Pellets sind ausreichend verteilt und von den Rändern des Brunnens entfernt. Der Brunnen ist zentriert und es gibt keine Hindernisse oder Reflexionen. B) Ein Beispiel für ein Bild, das für die Bildanalyse ungeeignet ist. Der Brunnen ist außerhalb der Mitte und schneidet die untere Hälfte ab. Blauer (gepunkteter) Kreis zeigt Lichtreflexion von der Wasseroberfläche. Der orangefarbene (feste) Kreis zeigt Pellets, die zu dicht beieinander und zu nahe am Rand des Brunnens verklumpt sind. Roter (gestrichelter) Kreis zeigt einen Holzspäne, der nicht entfernt wurde. Maßstabsleiste 10 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

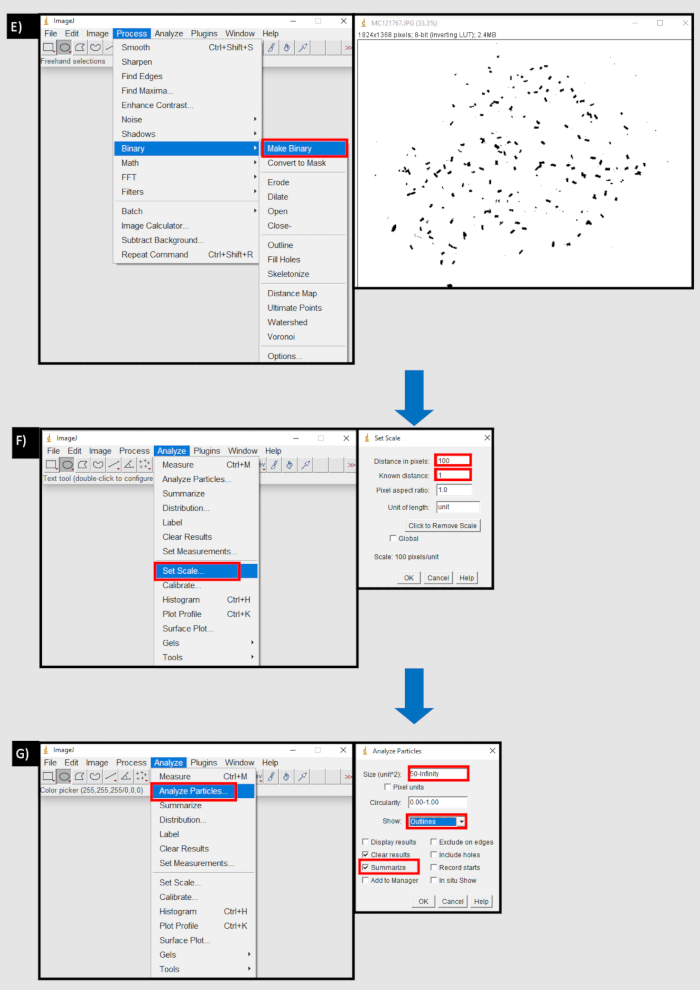
Abbildung 8: Ein Flussdiagramm des Prozesses, der in ImageJ zum Zählen von Fäkalpellets verwendet wird. A) Importieren einer Bildsequenz in die Registerkarte Datei von ImageJ. B) Die Schaltfläche "Durchsuchen" im Dialogfeld "Bildsequenz importieren", um eine Sequenz von Bildern von einem lokalen Gerät zu importieren. C) Verwenden des Kreiswerkzeugs zum Auswählen eines Bereichs mit Kotpellets D) Schaltfläche "Außen löschen" im Bereich "Bearbeiten" zum Entfernen außerhalb des ausgewählten Bereichs. E) Schaltfläche Binär in der Registerkarte Prozess erstellen. F) Schaltfläche Skalierung in der Registerkarte Analysieren festlegen. Der Abstand in Pixeln entspricht der Anzahl der Pixel zu einer Maßeinheit (mm). G) Schaltfläche Partikel analysieren auf der Registerkarte Analysieren. Größe (Einheit ^ 2) auf die untere Schwelle der Kotpelletgröße in Pixeln bis unendlich festgelegt. Show 'Outlines' und 'Summarise' sind ausgewählt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
Datenanalyse
- Konvertieren Sie die Anzahl der Pellets in Pellets pro Tag, was ein indirektes Maß für die Fütterungsrate ergibt. Verwerfen Sie Daten von mausernden Individuen an Tagen, an denen die Mauser stattgefunden hat (Abbildung 9).
HINWEIS: Die Mauser erfolgt über 1-3 Tage und kann identifiziert werden, wenn eine vollständige Häutung des Exoskeletts zu sehen ist.
- Konvertieren Sie die Anzahl der Pellets in Pellets pro Tag, was ein indirektes Maß für die Fütterungsrate ergibt. Verwerfen Sie Daten von mausernden Individuen an Tagen, an denen die Mauser stattgefunden hat (Abbildung 9).

Abbildung 9: Beispiel für eine Körnerhäutung. Gribble (L. quadripunctata) Mauser, auf einem Radiata Kiefernholz Teststab Größe 20 mm x 4 mm x 2 mm. Häutungen werden durch rote Kreise angezeigt. Maßstabsleiste 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Ein Fütterungsexperiment von L. Quadripunctata wurde über 20 Tage unter Verwendung von fünf verschiedenen Holzarten (Waldkiefer (Pinus sylvestris L) Splintholz und Kernholz von Buche (Fagus sylvatica L), Ekki (Lophira alata Banks ex C. F Gaertn), Edelkastanie (Castanea sativa Mil) und Terpentin (Syncarpia glomulifera (Sm.) Neid)) (siehe Materialtabelle) im November 2020 durchgeführt. Pro Holzart wurden acht Replikatstöcke verwendet und ...
Diskussion
Vor der Auswahl von Gribble-Proben, die im Fütterungsexperiment verwendet werden sollen, sollten Die Individuen gescreent werden, um ihre Eignung zu beurteilen. Es kann aufgrund von Größenunterschieden zu Unterschieden in der Fütterungsrate zwischen den Individuen kommen, daher sollten nur ausgewachsene erwachsene Exemplare ausgewählt werden. Borges et al., 200917, fanden keinen signifikanten Unterschied zwischen der Fütterungsrate von Individuen zwischen 1,5 mm und 3 mm Länge. Weibliche <...
Offenlegungen
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit dieser Studie.
Danksagungen
Vielen Dank an den Norwegischen Forschungsrat (Regionalfonds Oslo, Alcofur rffofjor 269707) und die Universität Portsmouth (PhD-Forschungsstipendium der Fakultät für Naturwissenschaften) für die Finanzierung der Studien von Lucy Martin. Auch an Gervais S. Sawyer, der das Holz zur Verfügung stellte, aus dem die repräsentativen Ergebnisse generiert wurden. Terpentin wurde von Prof. Philip Evans von der University of British Columbia zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Referenzen
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten