Method Article
噬菌体对食源性病原体生物防治的有效性通过高通量设置进行评估
摘要
该协议描述了一种使用高通量设置来筛选噬菌体鸡尾酒抗菌功效的强大方法。
摘要
细菌病原体不断挑战全球食品安全系统。随着人们对耐热和消毒剂细菌的出现越来越关注,迫切需要新的抗菌剂。基于噬菌体的生物控制策略是治疗使用噬菌体来控制农业环境中的细菌病原体。噬菌体生物防治越来越被接受为一种可持续技术,可有效去除食源性病原体的污染。为了确保有效的生物控制结果,在所需的环境条件下对噬菌体组合进行针对目标细菌的系统筛选至关重要。噬菌体混合物的抗菌功效可能受到噬菌体属和组合、靶向细菌菌株、感染的多样性、温度和时间的影响。为了配制出一种具有优越疗效的噬菌体混合物,所提出的方法是系统地评估单个噬菌体和噬菌体混合物在靶向条件下杀死食源性细菌病原体的有效性。通过测量所需温度和持续时间下的光密度来监测细菌杀灭功效。通过完全抑制细菌生长来确定较高的噬菌体功效。所提出的方法具有强大的,基于证据的方法,可促进配制具有卓越抗菌功效的噬菌体鸡尾酒。
引言
噬菌体(噬菌体)是自然侵入细菌细胞,破坏细菌代谢并导致细菌裂解的病毒。与传统的抗菌素(例如抗生素)相比,噬菌体宿主谱相对狭窄,只能感染一组靶向细菌物种或菌株,因此应最大限度地减少对有益于动物和人类健康的微生物群的附带影响。随着抗菌素耐药性(AMR)的上升,噬菌体及其衍生物导致替代抗菌素来控制细菌传染病,包括人类和动物的抗菌素耐药性细菌感染1,2。噬菌体已证实对>20 细菌病原体的治疗潜力,这些细菌病原体可引起浅表感染以及人类上呼吸道和胃肠道感染3。
在农业环境中,基于噬菌体的生物控制策略是治疗使用噬菌体来控制细菌病原体。噬菌体生物防治被广泛接受为一种绿色技术,可有效去除各种食品中的食源性病原体(例如,产生志贺毒素 的大肠杆菌 (STEC)、 沙门氏菌 和 李斯特菌)4,5。此外,噬菌体可用作消毒剂,对食品加工表面和动物皮毛进行消毒,这些表面和动物皮毛可集成到传统的抗菌系统(例如,化学品、蒸汽和热水巴氏杀菌)中,以增强预期结果并减少对环境的影响。使用噬菌体减少动物中的人畜共患细菌也很有希望1。然而,需要解决技术挑战,以改善噬菌体生物控制方法的结果,以广泛应用于各种食品生产系统。主要挑战是噬菌体的有效性受损,因为细菌抗性突变体的形成5 ,以及由于暴露于环境应激源而导致的细菌生理学变化6。
为了最大限度地降低噬菌体耐药性的风险,提出了噬菌体混合物(即多种噬菌体的组合),并提高了农业和水产养殖环境中的生物控制效力7。然而,从几项研究中已经证明,噬菌体鸡尾酒并不总是比单一噬菌体的施用提供更好的效果。例如,3种T4样噬菌体的混合物对大肠杆菌菌株的宿主范围较窄8。此外,尽管应用了孵育温度,但Tequintavirus的成员AKFV33在从牛肉中去除大肠杆菌O157方面比四种噬菌体的混合物具有更大的功效4。最近,据报道,单个噬菌体的有效性并不能预测噬菌体鸡尾酒控制O1579的功效,因为多个噬菌体之间的相互作用可以改变功效。最重要的是,噬菌体属和组合、靶向菌株和MOI以及孵育温度和时间等众多因素可能会影响噬菌体之间的相互作用。因此,仔细筛选噬菌体组合与特定细菌,以评估噬菌体协同作用或促进作用,或至少确保在特定环境条件下将噬菌体拮抗作用降至最低,对于获得最佳结果至关重要。在这里,描述了一种系统地评估各种噬菌体组合在一系列环境条件下对食源性病原体的功效的方法。这种方法的好处是能够筛选所有可能的生物和非生物因素,这些因素预计会影响自然环境中噬菌体的抗菌功效。在协议中,STEC O157及其感染噬菌体被用作示例。
研究方案
1. 缓冲液和试剂的制备
- 制作 500 mL 胰蛋白酶大豆汤 (TSB)(15 克 TSB 粉末和 500 mL 超纯水)并高压灭菌器。
注意:这可以在室温下储存长达3个月,或在4°C下储存长达6个月。 - 制作 500 mL 胰蛋白酶大豆琼脂 (TSA)(20 克 TSA 粉末和 500 mL 超纯水)并高压灭菌器。
注意:这可以在4°C下储存长达3个月。 - 制作500毫升磷酸盐缓冲盐水(PBS;4克NaCl,0.1克KCl,0.77克Na2HPO4和0.12克KH2PO4,500毫升超纯水),在25°C下测量并将pH值调节至7.2±0.2并高压灭菌。
注意:这可以在4°C下储存长达6个月。 - 制作200 mL 1 M MgSO4 (49.294 g和200 mL超纯水),并通过0.22μm聚醚砜过滤器灭菌。
- 用10 mM MgSO4 (mTSB;15 g TSB粉末,500 mL超纯水和5 mL 1 M MgSO4)和高压灭菌器制作500 mL TSB;让高压灭菌的培养基冷却至室温。应用无菌技术。使用血清学移液器,小心地转移5.0毫升1 M MgSO4;轻轻旋转以混合。
2. 细菌培养物的制备
- 要制备细菌研究实验室培养物(BRLC),请从冰箱库存中取出甘油储备小瓶并转移到实验室。
- 使用一次性接种环或等效物,浸入小瓶中,去除刮擦接种物(冷冻雪泥),并在TSA板或II级生物安全柜内的等效物上划线。将板在37±2°C孵育15-18小时。
- 将准备好的BRLC板装袋并储存在4°C。
注意:BRLC的一般有效期:生成后在4°C下14天。 - 从BRLC板中接种每个 大肠杆菌 O157菌株的单个菌落,在10 mL TSB中进行测试,并在37°C下静态孵育18小时以达到9 log10 CFU / mL。
- 准备连续稀释的过夜培养物(第二天早上),每个 大肠杆菌 O157菌株使用含有10mM MgSO4 的mTSB达到4-5 log10 CFU / ml(或其他所需的接种水平)。
- 混合等体积的每种菌株的过夜培养物,以达到4-5 log10 CFU / mL总量(或根据需要)以制备细菌混合物。
- 立即将稀释的细菌培养物置于4°C以备使用。
- 将接种物培养物稀释10或100倍,并在TSA板上平板0.1mL等分试样这些稀释液以获得分离的菌落。
3. 噬菌体工作溶液的制备
- 按照标准方法,为要筛选的每个噬菌体(≥108 PFU/mL)繁殖高滴度工作储备4。
注意:噬菌体储备的一般有效期为生成后在4°C的塑料瓶中3个月。 - 为了达到所需的滴度,例如,用于裂解动力学的〜108 PFU / mL,用含有10mM MgSO4的mTSB稀释单个噬菌体制剂。通过在所有可能的组合中将等体积的每种工作储备液以相同的滴度混合来制备噬菌体鸡尾酒。
4. 制备单个噬菌体和噬菌体鸡尾酒的 体外 裂解动力学
- 在无菌的96孔微孔孔板中,在色谱柱1-8中制备每个噬菌体的连续10倍稀释液,以建立微孔板测定。
注意:针对一种细菌菌株的四个噬菌体可以在每个板上的相邻柱中一式两份进行测试。其余四列用于对照,没有噬菌体,以及mTSB空白(图1)。 - 将180μLmTSB置于96孔微孔板的色谱柱1至12的孔中。
- 将20μL稀释的单个噬菌体或噬菌体混合物(〜108 PFU / mL)加入微孔板顶排的1-8孔(A排)。
- 对于无噬菌体和空白对照,将20μLmTSB加入柱9,10和11的顶部孔中。
- 用12通道移液器稀释平板。将20 μL从一行转移到另一行。通过轻柔,反复抽吸,喷射(至少五次)并在稀释液之间更换尖端来混合孔内容物。从最后一行(H行)取出20μL。
注意:建议使用带过滤器的吸头,以防止交叉污染。 - 为每个菌株设置一个储液槽,使用1 mL移液器将2-3 mL稀释的培养物转移到储液槽中。对于色谱柱1-10,使用多通道移液器向每个孔中加入20μL稀释的细菌培养物。在每次添加之间更改提示。
- 覆盖并在所需条件下孵育微孔板(例如,37°C10小时或22°C22小时)。
- 以2小时或其他所需的间隔,从培养箱中取出微孔板。
5. 光密度的测定
- 使用酶标仪检查600nm(OD 600nm)处的光密度。
注意:建议在测试板制备之前在程序中设置并保存测定方案。 - 打开酶标仪并打开程序。
- 在"启动选项"窗口中选择简单模式,然后在任务管理器中选择"创建新协议"(补充图 1a,b)。
- 从 "选择板类型" 窗口中,从下拉列表中选择 "96 孔板 "(补充图 2)。
- 为检测方法选择 "吸光度 ",为读取类型选择" 端点/动力学 "选项,为光学类型选择" 单色器 "。单击"确定"(补充图 3)。
- 对于读取步长,输入 600 nm 作为波长,然后选择 正常 作为读取速度。单击 "确定" (补充图 4)。
- 要设置测定的温度,请单击" 孵化 "复选框,然后选择" 培养箱开启"。在"温度"框中输入所需的 温度 。单击 "确定"。为防止在孵育过程中板盖上结露,请在梯度框中输入值 (1-3) 来设置温度 梯度 。单击 确定 (补充图5a)。
注:单击 "继续下一步前预热 "复选框,表示孵育温度为 37 °C。对于22°C(RT)下的测试条件,不需要此步骤。 - 接下来,单击" 动力学 "复选框以打开"动力学设置"。将运行时间设置为37°C孵育10小时或室温22小时。输入2小时作为读数间隔。单击 确定 (补充图5b)。
- 单击"过程"窗口中的"摇动"复选框,根据需要为每个动力学读取设置摇动条件(补充图 6a)。
- 为"摇动模式"选择" 线性 ",并将"持续时间"更改为 30 秒。将"线性频率"值设置为 731 cpm (2 mm),然后单击" 确定 "(补充图 6b)。
- 在"实验方案摘要对话框"窗口中,单击"板布局",然后选择"空白"、"测定对照"和"样品"。单击"下一步"(补充图 7)。
注:在阴性对照的不同对照类型数中输入1。 - 定义每个孔类型的设置后,单击" 完成"。
- 在左侧界面中选择一个 井 ID ,然后将其分配给板布局寡妇中显示的矩阵。单击 确定 (补充图 8)。
- 单击 "读取板" 按钮并将协议另存为 .prt 文件,然后单击" 保存 "(补充图 9)。
- 插入板,然后单击 确定。
- 实验完成后,将实验另存为 .xpt 文件,然后单击" 保存 "(补充图 10)。
- 通过单击消息窗口框中的" 是 "按钮将数据导出到 Excel,以进行进一步分析(补充图 11)。
- 单击 "保存是/否 "选项和 "不再询问 "复选框以保存首选项。
6. 数据分析
- 如上所述重复至少两个独立的实验。汇编所有独立试验的结果。计算每个噬菌体处理和游离培养物的OD600 的平均值和标准偏差。
- 在600nm处执行OD值的平方根,并使用每个细菌菌株和温度的适当统计模型对其进行分析。
注: 对于 SAS 软件,选择了混合模型和用于区分均值的最小二乘法(P < 0.05)。对于每种菌株,将面板A−G分配给每种噬菌体处理,其总体抗O157功效随时间和MOI不同(P <0.05)。 - 根据 OD600nm 值≤ 0.01 定义卓越的噬菌体功效,对应于不可检测的细菌生长(检测限:300 CFU/mL)。
- 使用适当的统计模型分析时间、孵育温度、 大肠杆菌 O157菌株、MOI和噬菌体类型对噬菌体功效的影响。
注意:对于 SAS 软件,请使用带有随机度量的 GLIMMIX。 - 计算优势比,以比较不同环境和生物因素的卓越功效。
- 使用适当的统计模型分析时间、孵育温度、 大肠杆菌 O157菌株、MOI和噬菌体类型对噬菌体功效的影响。
结果
在实验方案之后,对抗O157噬菌体的功效与各种噬菌体组合,温度,时间和MOI进行了比较。孵育温度和时间、MOI、噬菌体和细菌菌株对增强抗大肠杆菌O157功效的影响见表1(比值比表)9。在每种实验条件下,通过每种噬菌体制剂分析≤0.01的光学浊度测量百分比(%)。基于该分析,在22°C(P <0.001)和MOI = 1000(P <0.001)下孵育14,16或18小时后,抗O157噬菌体功效最大化,分别有75%和89%的噬菌体处理培养物的生长被完全抑制。一般来说,在11种噬菌体制剂中,T1,T4和rV5的混合物对O157最有效(P <0.05)。此外,在所测试的孵育温度、时间、MOI和噬菌体中,对噬菌体的敏感性各不相同,测试的O157菌株CO281-31N最敏感(P <0.001),3081(P <0.001)对噬菌体最不敏感。
为了了解所测试的每种细菌菌株的噬菌体杀伤动力学,根据每个孵育温度下的每次采样时间,MOI和噬菌体处理绘制OD600值。噬菌体在37°C下对大肠杆菌O157 3081的功效的代表性结果如图2所示。在评估噬菌体处理培养物的生长曲线抑制之前,确保无噬菌体对照培养物的生长曲线是正常的。根据图2,T4的加入完全抑制了细菌在37°C下的生长,在每次采样时间在MOI低至1。为了概述噬菌体如何在不同温度下随时间抑制细菌生长,无论MOI如何,根据每个采样时间和噬菌体处理绘制了所有MOI的平均OD600nm值(MOI>0)(图3)。与37°C相比,特定的噬菌体杀伤功效,例如噬菌体T4和T1 + T4,在22°C以上得到增强。 总结和比较噬菌体中总体抗O157有效性的另一种方法如表2和表39所示。从每次采样时间和MOI中取OD600值,并将噬菌体功效从最高(A)到最低(F:37°C和D:22°C)进行排名。该表有助于确定最佳噬菌体处理。例如,对于菌株3081,噬菌体T4和T5 + T4(图A)在37°C下是最有效的处理,而除噬菌体T4外,噬菌体T1 + T4,T1 + T4 + rV5和4噬菌体混合物(图A)是22°C下最有效的处理。
该协议还使我们能够将噬菌体功效与各种目标细菌菌株进行比较,并定制噬菌体制备。例如,在选择噬菌体时,在37°C下,不包括菌株3081,噬菌体T1 + T4 + rV5对所有其他菌株具有最显着的有效性,无论其噬菌体类型如何。在22°C时,4噬菌体鸡尾酒对所有测试菌株最有效。最佳MOI导致完全裂解(OD600≤0.01),这在实验条件下具有潜在的优越疗效(表2 和 表3)。
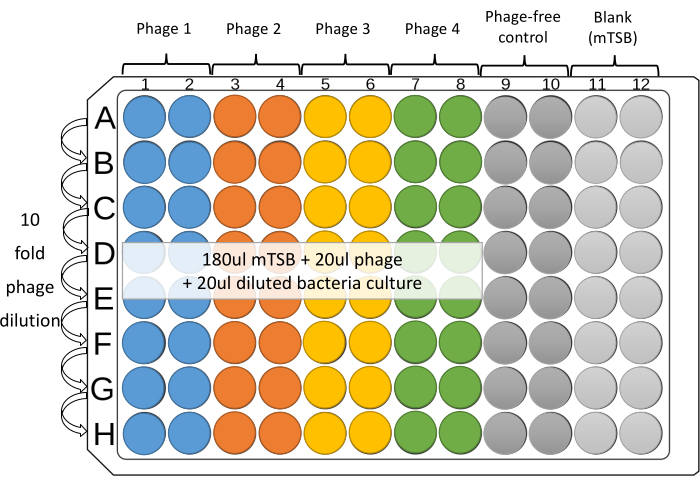
图1:建议的96孔微孔板测定布局。 在无菌96孔微孔板的柱1-8中制备每个噬菌体的连续10倍稀释液。针对一种细菌菌株的四个噬菌体可以在每个板上的相邻柱中一式两份进行测试。其余列用于控件。 请点击此处查看此图的放大版本。
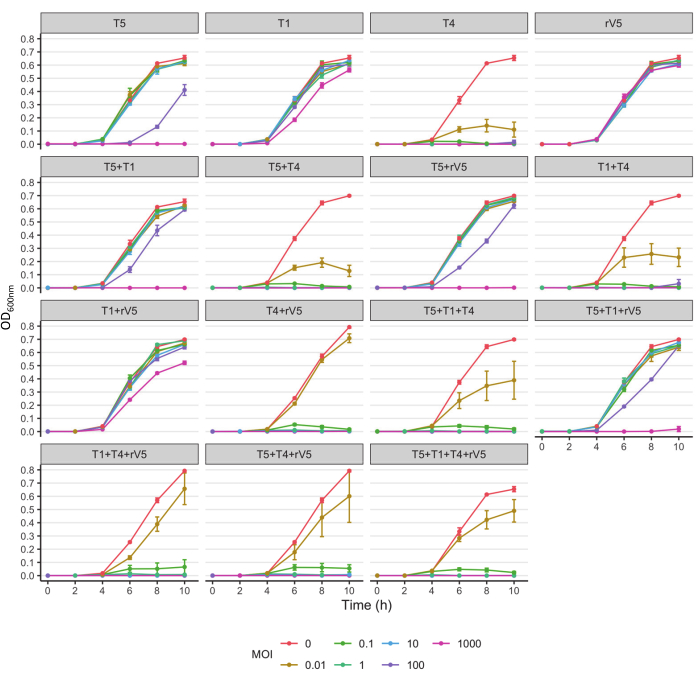
图2: 大肠杆菌 O157菌株3081在37°C下在每个MOI处处理且未用噬菌体处理的生长曲线。 数据来自两项独立试验。柱线存在标准偏差。 请点击此处查看此图的放大版本。
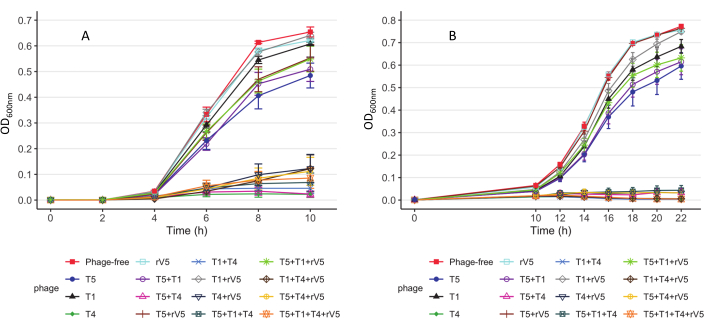
图3: 大肠杆菌 O157菌株3081菌株的 生长曲线。 (A)37°C时的生长曲线。 每条曲线代表单个和混合培养物,在MOI中用噬菌体处理和未处理。数据来自两项独立试验。柱线显示均值的标准误差(经许可改编自 Reference9 )。 请点击此处查看此图的放大版本。
表 1:在孵育温度、孵育时间、MOI、噬菌体和大肠杆菌 O157 菌株(经许可改编自参考文献9)下,与大肠杆菌 O157 相比具有卓越噬菌体功效的可能性的比值比。请单击此处下载此表。
表2: 37°C时对大肠杆菌O157的总体噬菌体功效 (经许可改编自参考文献9)。请单击此处下载此表。
表3: 22°C时对大肠杆菌 O157的总体噬菌体功效(经许可改编自参考文献9)。请单击此处下载此表。
补充图 1-11:酶标仪操作和程序的快照。请单击此处下载此文件。
讨论
该协议描述了一种系统评估噬菌体对食源性病原体(包括STEC9 和 沙门氏菌10) 的功效的强大方法。一个关键步骤是稀释细菌的过夜培养物时,建议使用预冷培养基并用冰桶操纵稀释,以尽量减少潜在的细菌生长。此外,在稀释细菌培养物之前制备噬菌体稀释液。枚举步骤2.8提供了细菌接种的实际数量,用于计算最终应用的MOI。对于噬菌体制备,通常使用通过过滤菌体制备的粗噬菌体裂解物,在细菌培养4-6小时内感染。与噬菌体感染性相关的关键步骤始终是使用在3个月内制备的噬菌体工作储备。极其精确的移液(特别是使用多通道移液器时)和方法的均匀性对于获得可比较和可解释的结果也至关重要。使用补充了10 mM Mg 2 + 的修饰TSB来稀释噬菌体,细菌培养物和碱基培养基,以优化噬菌体的吸附和感染。
由于细菌在对数阶段增殖,甚至低于培养箱温度,因此建议使用稀释的过夜培养物而不是对数期培养物,以尽量减少潜在的细菌生长。
拟议的协议有局限性。首先,由于微孔板只能容纳200μL,长时间孵育可能导致大量蒸发,因此不推荐使用。在这种情况下,该测定可能不适合生长缓慢的细菌。其次,拟议的方案无法监测噬菌体的扩增。第三,该协议无法监测噬菌体耐药性随时间的变化,这是决定噬菌体处理结果的关键因素11,12。需要后续实验来评估最具影响力的鸡尾酒在筛选中进一步的表现,以防止抗噬菌体突变体在广泛的肉汤培养系统和其他生物基质中出现。
与传统抗菌素相比,噬菌体的生物学性质会影响实际环境中生物控制和治疗用途的复杂性。传统上,噬菌体混合物的合理选择主要基于噬菌体的溶解活性和宿主范围。通常推荐使用裂解活性最强、宿主范围最广的噬菌体候选菌13,14。然而,根据目前的研究,rV5和T1等噬菌体虽然单独不如T4和T5具有毒性,但与T4和/或T5结合使用时,极大地促进了整体生物控制结果。因此,为了实现噬菌体混合物的卓越功效,建议在所需的环境条件下对潜在噬菌体组合对目标宿主菌株的抗菌活性进行全身筛选。此外,噬菌体候选受体的测定以及噬菌体与各种受体的掺杂可能会阻止宿主附着的竞争,阻碍抗噬菌体突变体的快速发展,并改善生物控制结果13。
该方法能够以高通量格式准确定量噬菌体裂解动力学。此外,它允许系统地评估各种生物和环境因素对各种噬菌体的抗菌功效的影响,从而促进噬菌体鸡尾酒的配制,并具有最佳结果。该方法的未来应用和发展假设涉及通过噬菌体的荧光标记来 原位 监测噬菌体鸡尾酒中每种噬菌体的功效。除了拟议的方案外,了解在共同感染一个宿主时促进噬菌体之间协同作用和促进作用的遗传决定因素将有助于配制具有卓越功效的适当噬菌体混合物。
披露声明
作者声明,该研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
致谢
这项研究得到了加拿大自然科学和工程研究委员会(NSERC发现补助金,RGPIN-2019-04384),加拿大创新基金会(项目#38710)和艾伯塔省主要创新基金的支持。我们感谢John Kastelic博士编辑手稿。
材料
| Name | Company | Catalog Number | Comments |
| Essential supplies, reagents, and equipment | |||
| Inoculating loops | VWR | 12000-806 | |
| Magnesium sulfate heptahydrate | Sigma | 1374361 | MgSO4.7H2O |
| Petri Dishes with Clear Lid | Fisher | FB0875713 | Diameter: 100 mm, sterile |
| Phosphate-buffered saline (PBS) | Fisher | 10010023 | |
| Pipet-Lite LTS Pipette L-1000XLS+ | METTLER TOLEDO | 17014382 | |
| Pipet-Lite LTS Pipette L-300XLS+ | METTLER TOLEDO | 17014405 | |
| Pipet-Lite Multi Pipette L12-20XLS+ | METTLER TOLEDO | 17013808 | |
| Pipet-Lite Pipette, Unv. SL-20XLS+ | METTLER TOLEDO | 17014412 | |
| Pipette Tips RT LTS 1000µL FL 768A/8-low retention | METTLER TOLEDO | 30389213 | |
| Pipette Tips SR LTS 20µL F 960A/5 | METTLER TOLEDO | 17005860 | |
| Pipette Tips SR LTS 300µL 768A/4 | METTLER TOLEDO | 17005867 | no filter |
| Reservoir | METTLER TOLEDO | 89094-662 | |
| Sterile, clear, 96-well flat-bottom polystyrene microplates with lids | Fisher | 168055 | |
| Tryptic soy agar (TSA) | Sigma | 105458-0500 | |
| Tryptic soy broth (TSB) | Sigma | 105459-0500 | |
| T-Shaped Cell Spreaders | VWR | 76299-566 | |
| Instruments | |||
| Analog Vortex Mixer | Fisher | 02-215-414 | |
| Compact Microbiological Incubators | Fisher | 50125590H | |
| Magnetic Stirrer Hotplates | FIsher | 13-889-335 | |
| Polygon Stir Bars | FIsher | 14-512-125 | length: 20 mm |
| Synergy Neo2 Hybrid Multi-Mode Reader | Fisher | BTNEO2M | |
| Software | |||
| SAS | SAS Institute | 9.4 |
参考文献
- Carvalho, C., Costa, A. R., Silva, F., Oliveira, A. Bacteriophages and their derivatives for the treatment and control of food-producing animal infections. Critical Reviews in Microbiology. 43 (5), 583-601 (2017).
- Czaplewski, L., et al. Alternatives to antibiotics-a pipeline portfolio review. The Lancet. Infectious Diseases. 16 (2), 239-251 (2016).
- Cisek, A. A., Dabrowska, I., Gregorczyk, K. P., Wyzewski, Z. Phage therapy in bacterial infections treatment: one hundred years after the discovery of bacteriophages. Current Microbiology. 74 (2), 277-283 (2017).
- Liu, H., et al. Control of Escherichia coli O157 on beef at 37, 22 and 4°C by T5-, T1-, T4-and O1-like bacteriophages. Food Microbiology. 51, 69-73 (2015).
- Moye, Z. D., Woolston, J., Sulakvelidze, A. Bacteriophage applications for food production and processing. Viruses. 10 (4), (2018).
- Ly-Chatain, M. H. The factors affecting effectiveness of treatment in phages therapy. Frontiers in Microbiololgy. 5, 51 (2014).
- Dy, R. L., Rigano, L. A., Fineran, P. C. Phage-based biocontrol strategies and their application in agriculture and aquaculture. Biochemical Society Transactions. 46 (6), 1605-1613 (2018).
- Bourdin, G., et al. Coverage of diarrhoea-associated Escherichia coli isolates from different origins with two types of phage cocktails. Microbial Biotechnology. 7 (2), 165-176 (2014).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Efficacy of individual bacteriophages does not predict efficacy of bacteriophage cocktails for control of Escherichia coli O157. Frontiers in Microbiololgy. 12, 616712 (2021).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Effect of a bacteriophage T5virus on growth of Shiga toxigenic Escherichia coli and Salmonella strains in individual and mixed cultures. Virology Journal. 17, 3 (2020).
- Brüssow, H. What is needed for phage therapy to become a reality in Western medicine. Virology. 434 (2), 138-142 (2012).
- Chan, B. K., Abedon, S. T., Loc-Carrillo, C. Phage cocktails and the future of phage therapy. Future Microbiology. 8 (6), 769-783 (2013).
- Nikolich, M. P., Filippov, A. A. Bacteriophage therapy: developments and directions. Antibiotics. 9 (3), 135 (2020).
- Niu, Y. D., et al. Host range and lytic capability of four bacteriophages against bovine and clinical human isolates of Shiga toxin-producing Escherichia coli O157:H7. Journal of Applied Microbiology. 107 (2), 646-656 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。