Method Article
Bakteriophagen-Wirksamkeit für die Biokontrolle von lebensmittelbedingten Krankheitserregern über Hochdurchsatzeinstellungen bewertet
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine robuste Methode zur Verwendung von Hochdurchsatzeinstellungen, um die antibakterielle Wirksamkeit von Bakteriophagencocktails zu überprüfen.
Zusammenfassung
Bakterielle Krankheitserreger stellen weltweit ständig Eine Herausforderung für Lebensmittelsicherheitssysteme dar. Mit zunehmender Besorgnis über das Auftreten von hitze- und desinfektionsmittelresistenten Bakterien werden neuartige antibakterielle Wirkstoffe dringend benötigt. Eine bakteriophagenbasierte Biokontrollstrategie ist der therapeutische Einsatz von Phagen zur Bekämpfung bakterieller Krankheitserreger in der Landwirtschaft. Die Phagenbiokontrolle wird zunehmend als nachhaltige Technologie akzeptiert, die bei der Dekontamination lebensmittelbedingter Krankheitserreger wirksam ist. Um effektive Biokontrollergebnisse zu gewährleisten, ist ein systematisches Screening von Phagenkombinationen gegen Zielbakterien unter den erforderlichen Umweltbedingungen von entscheidender Bedeutung. Die antibakterielle Wirksamkeit von Phagencocktails kann durch Phagengattungen und -kombinationen, gezielte Bakterienstämme, die Vielzahl von Infektionen, Temperatur und Zeit beeinflusst werden. Um einen Phagencocktail mit überlegener Wirksamkeit zu formulieren, bestand die vorgeschlagene Methode darin, die Wirksamkeit einzelner Phagen und Phagencocktails bei der Abtötung lebensmittelbedingter bakterieller Krankheitserreger unter gezielten Bedingungen systematisch zu bewerten. Die Wirksamkeit der bakteriellen Abtötung wurde durch Messung der optischen Dichte bei gewünschten Temperaturen und Dauer überwacht. Die überlegene Phagenwirksamkeit wurde durch die vollständige Hemmung des Bakterienwachstums bestimmt. Die vorgeschlagene Methode ist ein robuster, evidenzbasierter Ansatz, um die Formulierung von Phagencocktails mit überlegener antibakterieller Wirksamkeit zu erleichtern.
Einleitung
Bakteriophagen (Phagen) sind Viren, die auf natürliche Weise in Bakterienzellen eindringen, den bakteriellen Stoffwechsel stören und eine Lyse des Bakteriums verursachen. Im Gegensatz zu herkömmlichen antimikrobiellen Wirkstoffen (z. B. Antibiotika) sind die Phagenwirtsspektren relativ eng, nur in der Lage, eine gezielte Gruppe von Bakterienarten oder -stämmen zu infizieren und sollten daher Kollateraleffekte auf die Mikrobiota minimieren, die der Gesundheit von Mensch und Tier zugute kommen. Mit dem Anstieg der antimikrobiellen Resistenz (AMR) führen Phagen und ihre Derivate zu alternativen antimikrobiellen Wirkstoffen zur Bekämpfung bakterieller Infektionskrankheiten, einschließlich bakterieller Infektionen am biologischen AmR bei Mensch und Tier1,2. Phagen haben das therapeutische Potenzial gegen >20 bakterielle Erreger bestätigt, die oberflächliche Infektionen und Infektionen der oberen Atemwege und des Magen-Darm-Trakts des Menschen verursachen3.
In landwirtschaftlichen Umgebungen ist eine phagenbasierte Biokontrollstrategie der therapeutische Einsatz von Phagen zur Kontrolle bakterieller Krankheitserreger. Phagen-Biokontrolle wird als grüne Technologie anerkannt, die bei der Dekontamination lebensmittelbedingter Krankheitserreger (z. B. Shiga-Toxin produzierende Escherichia coli (STEC), Salmonellen und Listerien) in verschiedenen Lebensmitteln wirksam ist4,5. Darüber hinaus können Phagen als Desinfektionsmittel zur Desinfektion von Lebensmittelverarbeitungsoberflächen und Tierhäuten verwendet werden, die in herkömmliche antimikrobielle Systeme (z. B. Chemikalien, Dampf- und Heißwasserpasteurisierung) integriert werden können, um die gewünschten Ergebnisse zu verbessern und die Umweltauswirkungen zu reduzieren. Der Einsatz von Phagen zur Reduzierung zoonotischer Bakterien bei Tieren ist ebenfalls vielversprechend1. Es besteht jedoch die Notwendigkeit, die technischen Herausforderungen anzugehen, um die Ergebnisse des Phagen-Biokontrollansatzes zu verbessern, der in verschiedenen Lebensmittelproduktionssystemen allgemein angewendet wird. Die größte Herausforderung ist die beeinträchtigte Wirksamkeit von Phagen aufgrund der Entwicklung bakterienresistenter Mutanten5 und Veränderungen in der Bakteriellen Physiologie aufgrund der Exposition gegenüber Umweltstressoren6.
Um das Risiko einer Phagenresistenz zu minimieren, werden Phagencocktails (d. h. eine Kombination aus mehreren Phagen) vorgeschlagen, die die Biokontrollkraft in der Landwirtschaft und Aquakultur verbessern7. Aus mehreren Studien wurde jedoch bewiesen, dass Phagencocktails nicht immer eine bessere Wirksamkeit bieten als die Verabreichung eines einzelnen Phagen. Zum Beispiel hatte ein Cocktail aus 3 T4-ähnlichen Phagen einen engeren Wirtsbereich gegen E. coli-Stämme8. Darüber hinaus hatte AKFV33, ein Mitglied des Tequintavirus, eine größere Wirksamkeit als ein Cocktail aus vier Phagen bei der Entfernung von E. coli O157 aus Rindfleisch, trotz der angewandten Inkubationstemperaturen4. Kürzlich wurde berichtet, dass die Wirksamkeit einzelner Phagen die Wirksamkeit von Phagencocktails zur Kontrolle von O1579 nicht vorhersagt, da Wechselwirkungen zwischen mehreren Phagen die Wirksamkeit verändern können. Am wichtigsten ist, dass zahlreiche Faktoren wie Phagengattungen und -kombinationen, gezielte Stämme und MOIs sowie Inkubationstemperaturen und -zeiten die Wechselwirkungen zwischen Phagen beeinflussen können. Daher ist ein sorgfältiges Screening von Phagenkombinationen gegen bestimmte Bakterien, um die Phagensynergie oder -erleichterung zu bewerten oder zumindest einen minimalen Phagenantagonismus unter bestimmten Umweltbedingungen zu gewährleisten, für optimale Ergebnisse von entscheidender Bedeutung. Hier wird eine Methode beschrieben, um die Wirksamkeit verschiedener Phagenkombinationen gegen lebensmittelbedingte Erreger unter verschiedenen Umweltbedingungen systematisch zu bewerten. Der Vorteil dieses Ansatzes besteht darin, das Screening aller möglichen biotischen und abiotischen Faktoren zu ermöglichen, von denen vorhergesagt wird, dass sie die antibakterielle Wirksamkeit von Phagen in natürlichen Umgebungen beeinflussen. Im Protokoll werden STEC O157 und ihre infizierenden Phagen als Beispiel verwendet.
Protokoll
1. Herstellung von Puffern und Reagenzien
- Machen Sie 500 ml Tryptose-Sojabrühe (TSB) (15 g TSB-Pulver und 500 ml Reinstwasser) und Autoklav.
HINWEIS: Dieser kann bei Raumtemperatur bis zu 3 Monate oder bei 4 °C bis zu 6 Monate gelagert werden. - Machen Sie 500 ml tryptisches Soja-Agar (TSA) (20 g TSA-Pulver und 500 ml Reinstwasser) und Autoklav.
HINWEIS: Diese kann bei 4 °C bis zu 3 Monate gelagert werden. - Herstellen Sie 500 ml phosphatgepufferte Kochsalzlösung (PBS; 4 g NaCl, 0,1 g KCl, 0,77 g Na2HPO4 und 0,12 g KH2PO4, 500 ml Reinstwasser), messen und stellen Sie den pH-Wert auf 7,2 ± 0,2 bei 25 °C und Autoklav ein.
HINWEIS: Diese kann bei 4 °C bis zu 6 Monate gelagert werden. - Herstellen Sie 200 ml 1 M MgSO4 (49,294 g und 200 ml Reinstwasser) und sterilisieren Sie es über einen 0,22 μm Polyethersulfonfilter.
- Herstellung von 500 ml TSB mit 10 mM MgSO4 (mTSB; 15 g TSB-Pulver, 500 ml Reinstwasser und 5 ml 1 M MgSO4) und Autoklav; Lassen Sie das autoklavierte Medium auf Raumtemperatur abkühlen. Wenden Sie die aseptische Technik an. Mit einer serologischen Pipette vorsichtig 5,0 ml 1 M MgSO4 übertragen; vorsichtig schwenken, um zu mischen.
2. Vorbereitung der Bakterienkultur
- Um die Bacterial Research Laboratory Culture (BRLC) vorzubereiten, entfernen Sie Glycerin-Durchstechflasche(n) aus dem Gefrierschrankbestand und geben Sie sie ins Labor.
- Verwenden Sie eine Einweg-Impfschlaufe oder eine gleichwertige Schleife, tauchen Sie in die Durchstechflasche ein, entfernen Sie ein Abkratzen von Inokulum (gefrorener Matsch) und streifen Sie es auf eine TSA-Platte oder eine gleichwertige in einer biologischen Sicherheitswerkbank der Stufe II. Die Platte bei 37 ± 2 °C für 15−18 h inkubieren.
- Die vorbereiteten BRLC-Platten einpacken und bei 4 °C lagern.
HINWEIS: Allgemeine Ablaufzeit für BRLC: 14 Tage bei 4 °C nach Erzeugung. - Impfen sie eine einzelne Kolonie jedes E. coli O157-Stammes aus den zu prüfenden BRLC-Platten in 10 ml TSB und inkubieren sie statisch bei 37 °C für 18 h, um 9 log10 KBE/ml zu erreichen.
- Bereiten Sie eine serielle Verdünnung der Übernachtkulturen (am folgenden Morgen) vor, wobei jeder E. coli O157-Stamm unter Verwendung von mTSB, das 10 mM MgSO4 enthält, um 4-5 log10 KBE/ml (oder einen anderen gewünschten Inokulumspiegel) zu erreichen.
- Mischen Sie ein gleiches Volumen einer Übernachtkultur jedes Stammes, um insgesamt (oder wie gewünscht) 4-5 log10 KBE / ml zu erreichen, um die Bakterienmischung herzustellen.
- Legen Sie die verdünnte Bakterienkultur sofort bei 4 °C zur bevorstehenden Anwendung.
- Verdünnen Sie die Inokulumkultur 10- oder 100-fach und platten Sie 0,1 ml Aliquots dieser Verdünnungen auf den TSA-Platten, um die isolierten Kolonien zu erhalten.
3. Vorbereitung von Phagen-Arbeitslösungen
- Vermehrung von Hochtiter-Arbeitsbeständen für jeden zu screenenden Phagen (≥108 PFU/ml) nach den Standardmethoden4.
HINWEIS: Die allgemeine Verfallszeit für die Phagenbestände beträgt 3 Monate in einer Plastikflasche bei 4 °C nach der Generierung. - Um den gewünschten Titer von z.B. ~108 PFU/ml für die Lysekinetik zu erreichen, verdünnen Sie einzelne Phagenpräparate mit mTSB, das 10 mM MgSO4 enthält. Bereiten Sie Phagencocktails zu, indem Sie gleiche Mengen jedes Arbeitsstoffs mit dem gleichen Titer in allen möglichen Kombinationen mischen.
4. Vorbereitung der In-vitro-Lysekinetik für individuelle Phagen- und Phagencocktails
- Bereiten Sie serielle 10-fache Verdünnungen jeder Phage in den Spalten 1-8 in sterilen 96-Well-Mikrotiterplatten vor, um den Mikrotiterplattenassay einzurichten.
HINWEIS: Vier Phagen gegen einen Bakterienstamm können in zweifacher Form in benachbarten Spalten auf jeder Platte getestet werden. Die restlichen vier Spalten sind für Steuerelemente, die ohne Phagen sind, sowie für mTSB-Leer (Abbildung 1). - Platzieren Sie 180 μL mTSB in Vertiefungen aus den Spalten 1 bis 12 der 96-Well-Mikroplatte.
- Geben Sie 20 μL verdünnte einzelne Phagen oder Phagencocktails (~ 108 PFU / ml) zu den Vertiefungen 1-8 der oberen Reihe der Mikroplatte (Reihe A).
- Für die phagenfreie und Blanko-Kontrolle fügen Sie 20 μL mTSB in die obere Vertiefung der Spalten 9, 10 und 11 hinzu.
- Mit einer 12-Kanal-Pipette die Platte verdünnen. Übertragen Sie 20 μL von Reihe zu Reihe. Mischen Sie den Brunneninhalt durch sanftes, wiederholtes Absaugen, Auswerfen (mindestens fünfmal) und Wechseln der Spitzen zwischen den Verdünnungen. Entfernen Sie 20 μL aus der letzten Zeile (Zeile H).
HINWEIS: Die Verwendung von Spitzen mit Filtern wird empfohlen, um Kreuzkontaminationen zu vermeiden. - Richten Sie für jeden Stamm ein Reservoir ein, verwenden Sie eine 1-ml-Pipette, um 2-3 ml der verdünnten Kultur in das Reservoir zu übertragen. Verwenden Sie für die Spalten 1-10 eine Mehrkanalpipette, um 20 μL der verdünnten Bakterienkultur zu jeder Vertiefung hinzuzufügen. Ändern Sie die Tipps zwischen den einzelnen Ergänzungen.
- Abdecken und inkubieren Sie die Mikrotiterplatte unter den gewünschten Bedingungen (z. B. 37 °C für 10 h oder 22 °C für 22 h).
- Entfernen Sie in 2 h oder anderen gewünschten Intervallen die Mikrotiterplatten aus dem Inkubator.
5. Bestimmung der optischen Dichte
- Untersuchen Sie die optische Dichte bei 600 nm (OD600nm) mit einem Mikrotiterplattenleser.
HINWEIS: Es wird empfohlen, das Assay-Protokoll vor der Vorbereitung der Testplatte im Programm einzurichten und zu speichern. - Schalten Sie den Mikrotiterplattenleser ein und öffnen Sie das Programm.
- Wählen Sie im Fenster Startoptionen den einfachen Modus aus, und wählen Sie im Task-Manager neues Protokoll erstellen aus (ergänzende Abbildung 1a,b).
- Wählen Sie im Fenster Plattentyp auswählen in der Dropdown-Liste die Option 96 Well Plate aus (Ergänzende Abbildung 2).
- Wählen Sie Absorption für die Detektionsmethode, die Option Endpunkt/Kinetik für den Lesetyp und Monochromatoren für den Optiktyp. Klicken Sie auf OK (Ergänzende Abbildung 3).
- Geben Sie für Leseschritt 600 nm für Wellenlängen ein und wählen Sie Normal für die Lesegeschwindigkeit. Klicken Sie auf OK (Ergänzende Abbildung 4).
- Um die Temperatur für den Assay einzustellen, klicken Sie auf das Kontrollkästchen Inkubieren und wählen Sie Inkubator Ein. Geben Sie die gewünschte Temperatur in das Feld Temperatur ein. Klicken Sie auf OK. Um Kondensation auf dem Plattendeckel während der Inkubation zu vermeiden, legen Sie einen Temperaturgradienten fest, indem Sie einen Wert (1-3) in das Feld Farbverlauf eingeben. Klicken Sie auf OK (Ergänzende Abbildung 5a).
HINWEIS: Klicken Sie auf das Kontrollkästchen Vor dem nächsten Schritt vorheizen für die Inkubationstemperatur von 37 °C. Dieser Schritt ist für den Prüfzustand bei 22 °C (RT) nicht erforderlich. - Klicken Sie anschließend auf das Kontrollkästchen Kinetic , um das Kinetic Setup zu öffnen. Stellen Sie die Laufzeit auf 10 h für 37 °C Inkubation oder 22 h für RT ein. Geben Sie 2 h für das Leseintervall ein. Klicken Sie auf OK (Ergänzende Abbildung 5b).
- Aktivieren Sie im Fenster Prozedur das Kontrollkästchen Schütteln , um bei Bedarf die Schüttelbedingung für jeden kinetischen Lesevorgang einzurichten (Ergänzende Abbildung 6a).
- Wählen Sie "Linear " für "Shake Modes" und ändern Sie die Dauer auf 30 s. Legen Sie den Wert für die lineare Frequenz auf 731 cpm (2 mm) fest und klicken Sie dann auf OK (ergänzende Abbildung 6b).
- Klicken Sie im Dialogfenster Protokollzusammenfassung auf Plate Layout und wählen Sie Blanks, Assay Controls und Samples aus. Klicken Sie auf Weiter (Ergänzende Abbildung 7).
HINWEIS: Geben Sie 1 in Anzahl der verschiedenen Steuerungstypen für die Negativkontrolle ein. - Nachdem Sie die Einstellungen für jeden Well-Typ definiert haben, klicken Sie auf Fertig stellen.
- Wählen Sie in der linken Benutzeroberfläche eine Well-ID aus und weisen Sie sie dann der Matrix zu, die in der Plattenlayout-Witwe angezeigt wird. Klicken Sie auf OK (Ergänzende Abbildung 8).
- Klicken Sie auf die Schaltfläche Platte lesen , speichern Sie das Protokoll als .prt-Datei und klicken Sie auf Speichern (ergänzende Abbildung 9).
- Legen Sie die Platte ein und klicken Sie auf OK.
- Sobald das Experiment abgeschlossen ist, speichern Sie das Experiment als XPT-Datei und klicken Sie auf Speichern (Ergänzende Abbildung 10).
- Exportieren Sie Daten nach Excel, indem Sie zur weiteren Analyse im Meldungsfenster auf die Schaltfläche Ja klicken (Ergänzende Abbildung 11).
- Klicken Sie auf die Auswahl Ja/Nein speichern und auf das Kontrollkästchen Nicht erneut fragen , um die Einstellungen zu speichern.
6. Datenanalysen
- Wiederholen Sie mindestens zwei unabhängige Experimente wie oben beschrieben. Stellen Sie die Ergebnisse aller unabhängigen Studien zusammen. Berechnen Sie den Durchschnitt und die Standardabweichung des OD600 von jeder phagenbehandelten und -freien Kultur.
- Führen Sie die Quadratwurzel der OD-Werte bei 600 nm durch und analysieren Sie sie mit einem geeigneten statistischen Modell für jeden Bakterienstamm und jede Temperatur.
HINWEIS: Für SAS-Software werden das MIXED-Modell und die kleinsten Quadrate zur Unterscheidung der Mittelwerte (P < 0,05) ausgewählt. Weisen Sie für jeden Stamm die Panels A−G jeder Phagenbehandlung zu, deren Gesamtwirksamkeit von Anti-O157 im Laufe der Zeit und moIs unterschiedlich war (P < 0,05). - Definieren Sie eine überlegene Phagenwirksamkeit basierend auf dem OD600nm-Wert ≤ 0,01, der keinem nachweisbaren Bakterienwachstum entspricht (Nachweisgrenze: 300 KBE/ ml).
- Analysieren Sie die Auswirkungen von Zeit, Inkubationstemperatur, E. coli O157-Stämmen, MOIs und Phagentypen auf die Phageneffizienz mit einem geeigneten statistischen Modell.
HINWEIS: Verwenden Sie für SAS-Software GLIMMIX mit zufälligen Maßen. - Berechnen Sie Odds Ratios, um die überlegene Wirksamkeit für verschiedene umweltbedingte und biologische Faktoren von Interesse zu vergleichen.
- Analysieren Sie die Auswirkungen von Zeit, Inkubationstemperatur, E. coli O157-Stämmen, MOIs und Phagentypen auf die Phageneffizienz mit einem geeigneten statistischen Modell.
Ergebnisse
Im Anschluss an das Protokoll wurde ein Vergleich der Anti-O157-Phagenwirksamkeit mit verschiedenen Phagenkombinationen, Temperaturen, Zeiten und MOIs durchgeführt. Die Auswirkungen von Inkubationstemperatur und -zeiten, MOIs, Phagen und Bakterienstämmen, die zur Verbesserung der Wirksamkeit von Anti-E. coli O157 verwendet werden, sind in Tabelle 1 (Odds Ratio-Tabelle)9 dargestellt. Der Prozentsatz (%) der optischen Trübungsmessung ≤ 0,01 ergab, wurde von jedem Phagenpräparat unter jeder Versuchsbedingung analysiert. Basierend auf dieser Analyse wurde die Anti-O157-Phagenwirksamkeit nach 14, 16 oder 18 h Inkubation bei 22 °C (P < 0,001) und MOI = 1000 (P < 0,001) maximiert, wobei 75% bzw. 89% des Wachstums der phagenbehandelten Kultur vollständig gehemmt wurden. Im Allgemeinen war unter 11 Phagenpräparaten ein Cocktail aus T1, T4 und rV5 am wirksamsten (P < 0,05) gegen O157. Darüber hinaus variierte die Empfindlichkeit gegenüber Phagen über Inkubationstemperaturen, Zeiten, MOIs und getestete Phagen hinweg, wobei O157-Stämme, die getestet wurden, wobei der Stamm CO281-31N am empfindlichsten (P < 0,001) und 3081 (P < 0,001) am empfindlichsten für Phagen war.
Um die phagentötende Kinetik jedes getesteten Bakterienstamms zu verstehen, wurde der OD600-Wert gegen jede Probenahmezeit, MOIs und Phagenbehandlung bei jeder Inkubationstemperatur aufgetragen. Repräsentative Ergebnisse aus der Wirksamkeit von Phagen gegen E. coli O157 3081 bei 37 °C sind in Abbildung 2 dargestellt. Es wird sichergestellt, dass die Wachstumskurve der phagenfreien Kontrollkultur normal ist, bevor die Hemmung der Wachstumskurve der mit Phagen behandelten Kultur beurteilt wird. Gemäß Abbildung 2 hemmte die Aufnahme von T4 das Bakterienwachstum bei 37 °C vollständig, bei jedem Probenahmezeitpunkt bei einem MOI von nur 1. Um einen Überblick darüber zu erhalten, wie Phagen das Bakterienwachstum im Laufe der Zeit bei verschiedenen Temperaturen hemmten, unabhängig von MOIs, wurde der mittlere OD600nm-Wert, gemittelt aus allen MOIs (MOI > 0), gegen jede Probenahmezeit und Phagenbehandlung aufgetragen (Abbildung 3). Im Vergleich zu 37 °C war die besondere Phagenabtötungswirkung, z. B. phagen T4 und T1 + T4, über 22 °C erhöht. Ein weiterer Ansatz zur Zusammenfassung und zum Vergleich der Gesamtwirksamkeit von Anti-O157 bei Phagen ist in Tabelle 2 und Tabelle 39 dargestellt. Der OD600-Wert wurde aus jeder Probenahmezeit und jedem MOI gemittelt und die Phagenwirksamkeit von der höchsten (A) bis zur niedrigsten (F: 37 °C und D: 22 °C) eingestuft. Diese Tabelle erleichtert die Identifizierung der besten Phagenbehandlung. Beispielsweise waren für den Stamm 3081 die Phagen T4 und T5 + T4 (Panel A) bei 37 °C die wirksamste Behandlung, während neben phagen T4 die Phagen T1 + T4, T1 + T4 + rV5 und 4 Phagencocktails (Panel A) bei 22 °C die wirksamste Behandlung darstellten.
Dieses Protokoll ermöglichte es uns auch, die Wirksamkeit von Phagen mit verschiedenen Gezielten Bakterienstämmen zu vergleichen und die Phagenvorbereitung anzupassen. Zum Beispiel hatte der Phagen bei 37 °C ohne Stamm 3081 den Phagen T1 + T4 + rV5 die größte Wirksamkeit gegen alle anderen Stämme, unabhängig von ihren Phagentypen. Bei 22 °C war der 4-Phagen-Cocktail am effektivsten gegen alle getesteten Stämme. Die besten MOIs führten zu einer vollständigen Lyse (OD600 ≤ 0,01), die eine potenziell überlegene Wirksamkeit unter experimentellen Bedingungen rechtfertigte (Tabelle 2 und Tabelle 3).
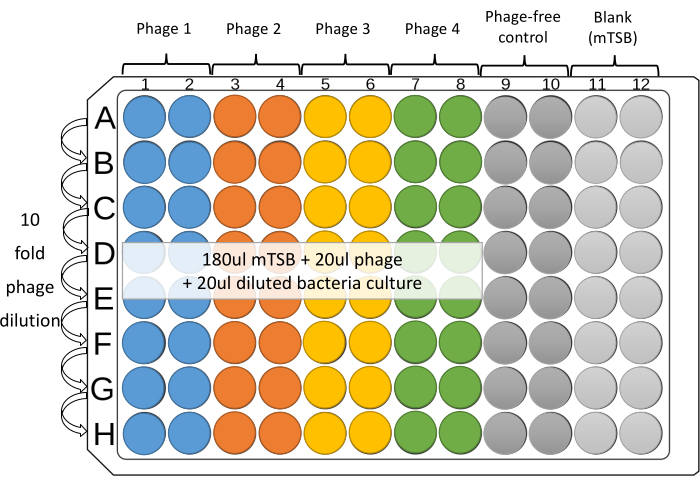
Abbildung 1: Vorgeschlagenes Layout des 96-Well-Mikroplatten-Assays. Serielle 10-fache Verdünnungen jedes Phagen werden in den Spalten 1-8 steriler 96-Well-Mikrotiterplatten hergestellt. Vier Phagen gegen einen Bakterienstamm können in zweifacher Form in benachbarten Säulen auf jeder Platte getestet werden. Die restlichen Spalten sind für Steuerelemente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
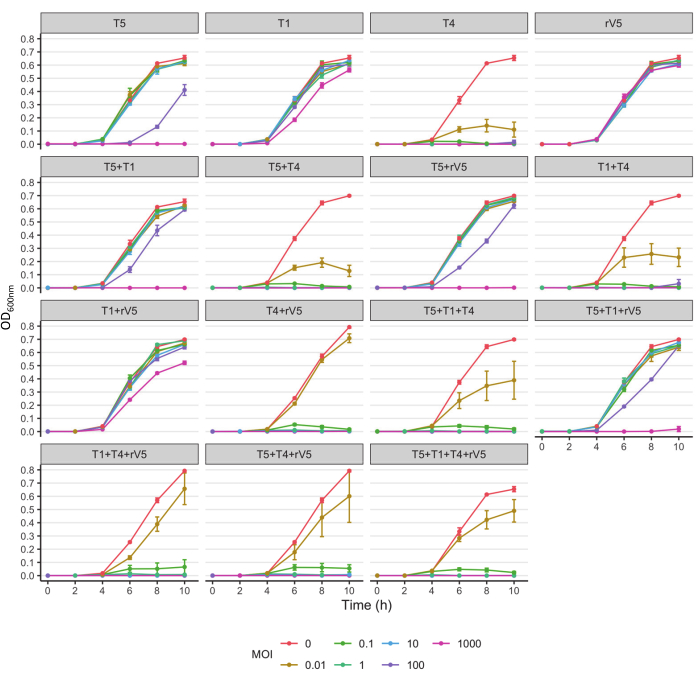
Abbildung 2: Wachstumskurven von E. coli O157 Stamm 3081 bei 37 °C behandelt und nicht mit Phagen an jedem MOIs behandelt. Die Daten wurden aus zwei unabhängigen Studien zusammengestellt. Balken stellen die Standardabweichung dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
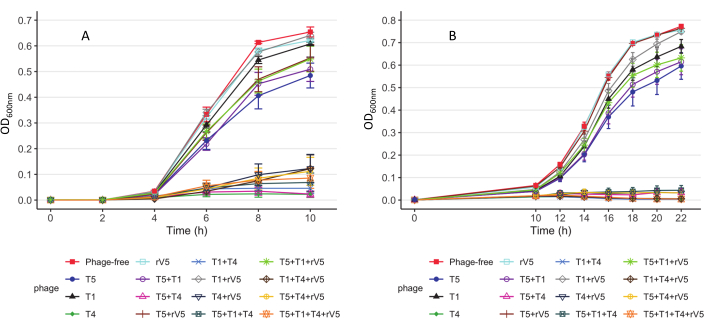
Abbildung 3: Wachstumskurven von E. coli O157 Stamm 3081 Stämme. (A) Wachstumskurven bei 37 °C. (B) Wachstumskurven bei 22 °C. Jede Kurve repräsentiert individuelle und gemischte Kulturen, die über MOIs hinweg mit Phagen behandelt und nicht behandelt werden. Die Daten wurden aus zwei unabhängigen Studien zusammengestellt. Balken stellen den Standardfehler des Mittelwerts dar (angepasst von Reference9 mit Erlaubnis). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Odds Ratios im Vergleich der Wahrscheinlichkeit einer überlegenen Phagenwirksamkeit gegen E. coli O157 bei Inkubationstemperaturen, Inkubationszeiten, MOIs, Phagen und Stämmen von E. coli O157 (angepasst von Reference9 mit Genehmigung). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Gesamtpphagenwirksamkeit gegen E. coli O157 bei 37 °C (angepasst von Reference9 mit Genehmigung). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Gesamtpagenwirksamkeit gegen E. coli O157 bei 22 °C (angepasst von Reference9 mit Genehmigung). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Abbildungen 1-11: Momentaufnahmen des Betriebs und der Verfahren des Mikrotiterplattenlesers. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieses Protokoll beschrieb einen robusten Ansatz zur systematischen Bewertung der Wirksamkeit von Phagen gegen lebensmittelbedingte Krankheitserreger, einschließlich STEC9 und Salmonella10. Ein kritischer Schritt ist bei der Verdünnung der Bakterienkultur über Nacht, die Verwendung von vorgekühltem Medium und die Manipulation der Verdünnung mit einem Eiskübel, um das potenzielle Bakterienwachstum zu minimieren. Darüber hinaus wurde vor der Verdünnung der Bakterienkultur eine Phagenverdünnung hergestellt. Der Zählschritt 2.8 lieferte die tatsächliche Anzahl der bakteriellen Inokulums für die Berechnung des endgültigen MOI. Für die Phagenvorbereitung werden im Allgemeinen rohe Phagenlysate verwendet, die durch Filterphagen hergestellt werden, die in 4-6 h Bakterienkultur infiziert sind. Der kritische Schritt, der mit der Phageninfektiosität verbunden ist, ist immer die Verwendung von Phagenarbeitsbeständen, die innerhalb von 3 Monaten vorbereitet wurden. Extrem genaues Pipettieren (insbesondere bei Verwendung einer Mehrkanalpipette) und eine einheitliche Herangehensweise sind ebenfalls unerlässlich, um vergleichbare und interpretierbare Ergebnisse zu erhalten. Modifiziertes TSB, ergänzt mit 10 mM Mg2+, wurde zur Verdünnung von Phagen, Bakterienkultur und Basenmedium verwendet, um die Adsorption und Infektion von Phagen zu optimieren.
Da sich Bakterien während der Log-Phase, auch unter inkubatortemperatur, vermehren, wird empfohlen, verdünnte Nachtkultur anstelle von Log-Phasenkultur zu verwenden, um das potenzielle Bakterienwachstum zu minimieren.
Das vorgeschlagene Protokoll hat Einschränkungen. Erstens, da Mikrotiterplatten nur 200 μL aufnehmen können, kann eine längere Inkubation zu einer erheblichen Verdunstung führen und wird nicht empfohlen. In diesem Fall ist der Assay möglicherweise nicht für langsam wachsende Bakterien geeignet. Zweitens war das vorgeschlagene Protokoll nicht in der Lage, die Amplifikation von Phagen zu überwachen. Drittens konnte dieses Protokoll die Entwicklung der Phagenresistenz im Laufe der Zeit nicht überwachen, ein kritischer Faktor, der das Ergebnis der Phagenbehandlung bestimmt11,12. Follow-up-Experimente sind erforderlich, um die weitere Leistung des einflussreichsten Cocktails im Screening bei der Verhinderung der Entstehung von Anti-Phagen-Mutanten in einem umfangreichen Brühenkultursystem und anderen biologischen Matrices zu bewerten.
Im Gegensatz zu herkömmlichen antimikrobiellen Wirkstoffen beeinflusst die biologische Natur von Phagen die Komplexität der Biokontrolle und des therapeutischen Einsatzes in der Praxis. Herkömmlicherweise basiert die rationelle Auswahl von Phagencocktails in erster Linie auf der lytischen Aktivität und dem Wirtsspektrum der Phagen. Phagenkandidaten mit der stärksten lytischen Aktivität und dem breitesten Wirtsbereich werden häufig empfohlen13,14. Basierend auf der aktuellen Studie haben Phagen wie rV5 und T1, obwohl sie allein nicht so virulent sind wie T4 und T5, das Gesamtergebnis der Biokontrolle in Kombination mit T4 und/oder T5 erheblich erleichtert. Um eine überlegene Wirksamkeit von Phagencocktails zu erreichen, wird daher ein systemisches Screening der antibakteriellen Aktivität potenzieller Phagenkombinationen gegen gezielte Wirtsstämme unter gewünschten Umweltbedingungen empfohlen. Darüber hinaus können die Bestimmung von Rezeptoren für Phagenkandidaten und die Einbeziehung von Phagen mit verschiedenen Rezeptoren den Wettbewerb um die Wirtsanbindung verhindern, die rasche Entwicklung von Antiphagenmutanten vereiteln und die Biokontrollergebnisse verbessern13.
Diese Methode ermöglichte eine genaue Quantifizierung der Phagenlysekinetik in einem Hochdurchsatzformat. Darüber hinaus ermöglichte es eine systematische Bewertung verschiedener biologischer und umweltbedingter Faktoren auf die antibakterielle Wirksamkeit einer Reihe von Phagen und erleichterte so die Formulierung von Phagencocktails mit optimierten Ergebnissen. Es wird davon ausgegangen, dass die zukünftigen Anwendungen und die Entwicklung der Methode die In-situ-Überwachung der Wirksamkeit jeder Phage in Phagencocktails durch Fluoreszenzmarkierung von Phagen beinhalten. Zusätzlich zu dem vorgeschlagenen Protokoll würde das Verständnis genetischer Determinanten, die synergistische und erleichterte Effekte zwischen Phagen fördern, wenn ein Wirt mitinfiziert wird, die Formulierung geeigneter Phagencocktails mit überlegener Wirksamkeit erleichtern.
Offenlegungen
Die Autoren erklären, dass die Forschung in Ermangelung kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Forschung wurde vom Natural Sciences and Engineering Research Council of Canada (NSERC Discovery Grant, RGPIN-2019-04384), der Canada Foundation for Innovation (Projekt Nr. 38710) und dem Major Innovation Fund, Alberta, unterstützt. Wir danken Dr. John Kastelic für die Bearbeitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Essential supplies, reagents, and equipment | |||
| Inoculating loops | VWR | 12000-806 | |
| Magnesium sulfate heptahydrate | Sigma | 1374361 | MgSO4.7H2O |
| Petri Dishes with Clear Lid | Fisher | FB0875713 | Diameter: 100 mm, sterile |
| Phosphate-buffered saline (PBS) | Fisher | 10010023 | |
| Pipet-Lite LTS Pipette L-1000XLS+ | METTLER TOLEDO | 17014382 | |
| Pipet-Lite LTS Pipette L-300XLS+ | METTLER TOLEDO | 17014405 | |
| Pipet-Lite Multi Pipette L12-20XLS+ | METTLER TOLEDO | 17013808 | |
| Pipet-Lite Pipette, Unv. SL-20XLS+ | METTLER TOLEDO | 17014412 | |
| Pipette Tips RT LTS 1000µL FL 768A/8-low retention | METTLER TOLEDO | 30389213 | |
| Pipette Tips SR LTS 20µL F 960A/5 | METTLER TOLEDO | 17005860 | |
| Pipette Tips SR LTS 300µL 768A/4 | METTLER TOLEDO | 17005867 | no filter |
| Reservoir | METTLER TOLEDO | 89094-662 | |
| Sterile, clear, 96-well flat-bottom polystyrene microplates with lids | Fisher | 168055 | |
| Tryptic soy agar (TSA) | Sigma | 105458-0500 | |
| Tryptic soy broth (TSB) | Sigma | 105459-0500 | |
| T-Shaped Cell Spreaders | VWR | 76299-566 | |
| Instruments | |||
| Analog Vortex Mixer | Fisher | 02-215-414 | |
| Compact Microbiological Incubators | Fisher | 50125590H | |
| Magnetic Stirrer Hotplates | FIsher | 13-889-335 | |
| Polygon Stir Bars | FIsher | 14-512-125 | length: 20 mm |
| Synergy Neo2 Hybrid Multi-Mode Reader | Fisher | BTNEO2M | |
| Software | |||
| SAS | SAS Institute | 9.4 |
Referenzen
- Carvalho, C., Costa, A. R., Silva, F., Oliveira, A. Bacteriophages and their derivatives for the treatment and control of food-producing animal infections. Critical Reviews in Microbiology. 43 (5), 583-601 (2017).
- Czaplewski, L., et al. Alternatives to antibiotics-a pipeline portfolio review. The Lancet. Infectious Diseases. 16 (2), 239-251 (2016).
- Cisek, A. A., Dabrowska, I., Gregorczyk, K. P., Wyzewski, Z. Phage therapy in bacterial infections treatment: one hundred years after the discovery of bacteriophages. Current Microbiology. 74 (2), 277-283 (2017).
- Liu, H., et al. Control of Escherichia coli O157 on beef at 37, 22 and 4°C by T5-, T1-, T4-and O1-like bacteriophages. Food Microbiology. 51, 69-73 (2015).
- Moye, Z. D., Woolston, J., Sulakvelidze, A. Bacteriophage applications for food production and processing. Viruses. 10 (4), (2018).
- Ly-Chatain, M. H. The factors affecting effectiveness of treatment in phages therapy. Frontiers in Microbiololgy. 5, 51(2014).
- Dy, R. L., Rigano, L. A., Fineran, P. C. Phage-based biocontrol strategies and their application in agriculture and aquaculture. Biochemical Society Transactions. 46 (6), 1605-1613 (2018).
- Bourdin, G., et al. Coverage of diarrhoea-associated Escherichia coli isolates from different origins with two types of phage cocktails. Microbial Biotechnology. 7 (2), 165-176 (2014).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Efficacy of individual bacteriophages does not predict efficacy of bacteriophage cocktails for control of Escherichia coli O157. Frontiers in Microbiololgy. 12, 616712(2021).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Effect of a bacteriophage T5virus on growth of Shiga toxigenic Escherichia coli and Salmonella strains in individual and mixed cultures. Virology Journal. 17, 3(2020).
- Brüssow, H. What is needed for phage therapy to become a reality in Western medicine. Virology. 434 (2), 138-142 (2012).
- Chan, B. K., Abedon, S. T., Loc-Carrillo, C. Phage cocktails and the future of phage therapy. Future Microbiology. 8 (6), 769-783 (2013).
- Nikolich, M. P., Filippov, A. A. Bacteriophage therapy: developments and directions. Antibiotics. 9 (3), Basel, Switzerland. 135(2020).
- Niu, Y. D., et al. Host range and lytic capability of four bacteriophages against bovine and clinical human isolates of Shiga toxin-producing Escherichia coli O157:H7. Journal of Applied Microbiology. 107 (2), 646-656 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten