Method Article
Eficácia do bacteriófago para o biocontrole de patógenos transmitidos por alimentos avaliados através de configurações de alto rendimento
Neste Artigo
Resumo
Este protocolo descreve um método robusto para o uso de configurações de alta produtividade para testar a eficácia antibacteriana de coquetéis bacteriófagos.
Resumo
Patógenos bacterianos desafiam continuamente os sistemas de segurança alimentar em todo o mundo. Com preocupações crescentes com o surgimento de bactérias resistentes ao calor e desinfetante, novos agentes antibacterianos são urgentemente necessários. Uma estratégia de biocontrole baseada em bacteriófago é o uso terapêutico de phages para controlar patógenos bacterianos em ambientes agrícolas. O biocontrole phage é cada vez mais aceito como uma tecnologia sustentável, eficaz na descontaminação de patógenos transmitidos por alimentos. Para garantir resultados eficazes de biocontrole, o rastreamento sistemático de combinações de phage contra bactérias-alvo em condições ambientais necessárias é crucial. A eficácia antibacteriana dos coquetéis phage pode ser afetada por gêneros phage e combinação, cepas bacterianas direcionadas, a multiplicidade de infecção, temperatura e tempo. Para formular um coquetel de phage com eficácia superior, o método proposto foi avaliar sistematicamente a eficácia de phages individuais e coquetéis de phage na morte de patógenos bacterianos transmitidos por alimentos em condições direcionadas. A eficácia da matança bacteriana foi monitorada pela medição da densidade óptica nas temperaturas e durações desejadas. A eficácia da físia superior foi determinada pela inibição completa do crescimento bacteriano. O método proposto é uma abordagem robusta e baseada em evidências para facilitar a formulação de coquetéis de phage com eficácia antibacteriana superior.
Introdução
Bacteriófagos (phages) são vírus que naturalmente invadem células bacterianas, interrompendo o metabolismo bacteriano e causando lise da bactéria. Em contraste com os antimicrobianos convencionais (por exemplo, antibióticos), os espectros de hospedeiros phage são relativamente estreitos, apenas capazes de infectar um conjunto direcionado de espécies ou cepas bacterianas e, portanto, devem minimizar efeitos colaterais sobre a microbiota que beneficiam a saúde animal e humana. Com o aumento da resistência antimicrobiana (RMR), as pragas e seus derivados levam a antimicrobianos alternativos para controlar doenças infecciosas bacterianas, incluindo infecções bacterianas amr em humanos e animais1,2. Phages confirmaram potencial terapêutico contra patógenos bacterianos >20 que causam infecções superficiais e infecções do sistema respiratório superior e do trato gastrointestinal dos humanos3.
Em ambientes agrícolas, uma estratégia de biocontrole à base de phage é o uso terapêutico de phages para controlar patógenos bacterianos. O biocontrole de phage é bem aceito como uma tecnologia verde, eficaz na descontaminação de patógenos transmitidos por alimentos (por exemplo, shiga-toxina que produz Escherichia coli (STEC), Salmonella e Listeria) em vários alimentos4,5. Além disso, os phages podem ser usados como desinfetantes para desinfetar superfícies de processamento de alimentos e peles de animais, que podem ser integrados em sistemas antimicrobianos convencionais (por exemplo, produtos químicos, vapor e pasteurização de água quente) para melhorar os resultados desejados e reduzir os impactos ambientais. O uso de phages para reduzir bactérias zoonóticas em animais também é promissor1. No entanto, é necessário enfrentar os desafios técnicos para melhorar os resultados da abordagem de biocontrole phage a ser popularmente aplicada em diversos sistemas de produção de alimentos. O principal desafio é a eficácia prejudicada das pragas devido ao desenvolvimento de mutantes resistentes a bactérias5 e mudanças na fisiologia bacteriana devido à exposição a estressores ambientais6.
Para minimizar o risco de resistência à praga, são propostos coquetéis de phage (ou seja, uma combinação de múltiplos phages) e melhoram a potência do biocontrole na agricultura e na aquicultura7. No entanto, a partir de vários estudos, foi comprovado que os coquetéis phage nem sempre ofereciam melhor eficácia do que a administração de um único phage. Por exemplo, um coquetel de phages 3 T4 tinha uma faixa de hospedeiro mais estreita contra e. coli strains8. Além disso, a AKFV33, membro do Tequintavirus, teve maior eficácia do que um coquetel de quatro phages na remoção de E. coli O157 da carne bovina, apesar das temperaturas de incubação aplicadas4. Recentemente, foi relatado que a eficácia dos phages individuais não prevê a eficácia de coquetéis phage para o controle da O1579, pois interações entre múltiplos phages podem alterar a eficácia. Mais importante, inúmeros fatores, como gêneros e combinações de phage, cepas direcionadas e MEIs, e temperaturas e tempos de incubação, podem impactar interações entre phages. Portanto, a triagem cuidadosa de combinações de phages contra bactérias específicas para avaliar a sinergia ou facilitação de phage, ou pelo menos para garantir o antagonismo mínimo de phage em condições ambientais específicas, é de vital importância para os resultados ideais. Aqui, um método é descrito para avaliar sistematicamente a eficácia de várias combinações de phage contra patógenos transmitidos por alimentos sob uma série de condições ambientais. O benefício dessa abordagem é permitir a triagem de todos os possíveis fatores bióticos e abióticos previstos para afetar a eficácia antibacteriana dos phages em ambientes naturais. No protocolo, stec O157 e seus phages infecciosos são empregados como exemplo.
Protocolo
1. Preparação de tampão e reagentes
- Faça 500 mL de caldo de soja tripptic (TSB) (15 g de pó TSB e 500 mL de água ultrapura) e autoclave.
NOTA: Pode ser armazenado à temperatura ambiente por até 3 meses ou a 4 °C por até 6 meses. - Faça 500 mL de ágar de soja tripptic (TSA) (20 g de pó TSA e 500 mL de água ultrauso) e autoclave.
NOTA: Pode ser armazenado a 4 °C por até 3 meses. - Faça 500 mL de Salina Tamponada fosfato (PBS; 4 g de NaCl, 0,1 g de KCl, 0,77 g de Na2HPO4, e 0,12 g de KH2PO4, 500 mL de água ultrauso), medir e ajustar o pH para 7,2 ± 0,2 a 25 °C e autoclave.
NOTA: Pode ser armazenado a 4 °C por até 6 meses. - Faça 200 mL de 1 M MgSO4 (49.294 g e 200 mL de água ultrapura) e esterilize através do filtro de poliesterulfone de 0,22 μm.
- Faça 500 mL de TSB com 10 mM MgSO4 (mTSB; 15 g de pó TSB, 500 mL de água ultrauso e 5 mL de 1 M MgSO4) e autoclave; deixe a mídia autoclaved esfriar à temperatura ambiente. Aplique a técnica asséptica. Utilizando uma pipeta sorológica, transfira cuidadosamente 5,0 mL de 1 M MgSO4; redemoinho suavemente para misturar.
2. Preparação da cultura bacteriana
- Para preparar a Cultura do Laboratório de Pesquisa Bacteriana (BRLC), remova os frascos de estoque de glicerol do inventário do congelador e transfira para o laboratório.
- Use um laço de inoculação descartável ou equivalente, mergulhe no frasco, remova uma raspagem de inóculo (lama congelada) e listra em uma placa TSA ou equivalente dentro de um armário de segurança biológica nível II. Incubar a placa a 37 ± 2 °C para 15-18 h.
- Ensce as placas BRLC preparadas e armazene a 4 °C.
NOTA: Prazo geral de validade para BRLC: 14 dias a 4 °C após a geração. - Inocular uma única colônia de cada cepa E. coli O157 das placas BRLC a ser testada em 10 mL de TSB e incubar estaticamente a 37 °C por 18 h para atingir 9 log10 CFU/mL.
- Prepare uma diluição serial das culturas durante a noite (na manhã seguinte), cada cepa E. coli O157 usando mTSB contendo 10 mM de MgSO4 para alcançar 4-5 log10 CFU/ml (ou outro nível inóculo desejado).
- Misture um volume igual de uma cultura durante a noite de cada cepa para alcançar 4-5 log10 CFU/mL no total (ou conforme desejado) para preparar a mistura bacteriana.
- Coloque imediatamente a cultura bacteriana diluída a 4 °C para uso pendente.
- Diluir a cultura do inóculo 10 ou 100 vezes e as alíquotas de placa 0,1 mL dessas diluições nas placas TSA para obter as colônias isoladas.
3. Elaboração de soluções de trabalho phage
- Prop propagar estoques de trabalho de alto título para cada phage a ser examinado (≥108 PFU/mL) seguindo os métodos padrão4.
NOTA: O prazo de validade geral para os estoques de phage é de 3 meses em uma garrafa plástica a 4 °C após a geração. - Para alcançar o titer desejado de, por exemplo, ~108 PFU/mL para cinética de lise, diluir preparações individuais de phage com mTSB contendo 10 mM de MgSO4. Prepare coquetéis de phage misturando volumes iguais de cada estoque de trabalho com o mesmo titer em todas as combinações possíveis.
4. Preparação de cinética de lise in vitro para coquetéis individuais de phage e phage
- Prepare diluições de 10 vezes de cada phages em Colunas 1-8 em microplacas estéreis de 96 poços para configurar o ensaio de microplacas.
NOTA: Quatro phages contra uma cepa bacteriana podem ser testados em duplicatas, em colunas adjacentes, em cada placa. As quatro colunas restantes são para controles, que estão sem phage, bem como mTSB em branco (Figura 1). - Coloque 180 μL de mTSB em poços das Colunas 1 a 12 da microplaca de 96 poços.
- Adicione 20 μL de phages individuais diluídos ou coquetéis phage (~108 PFU/mL) aos poços 1-8 da linha superior da microplacão (Linha A).
- Para o controle sem phage e em branco, adicione 20 μL de mTSB ao poço superior das Colunas 9, 10 e 11.
- Com uma pipeta de 12 canais, diluir a placa. Transfira 20 μL de linha em linha. Misture o conteúdo do poço por aspiração suave e repetida, ejeção (pelo menos cinco vezes) e dicas de mudança entre diluições. Remova 20 μL da última linha (Linha H).
NOTA: O uso de dicas com filtros é recomendado para evitar contaminação cruzada. - Configure um reservatório para cada cepa, use pipeta de 1 mL para transferir 2-3 mL da cultura diluída para o reservatório. Para as colunas 1-10, use uma pipeta multicanal para adicionar 20 μL da cultura bacteriana diluída a cada poço. Alterar dicas entre cada adição.
- Cubra e incubar a microplacão nas condições desejadas (por exemplo, 37 °C para 10 h ou 22 °C por 22 h).
- Em 2h ou em outros intervalos desejados, remova as microplacões da incubadora.
5. Determinação da densidade óptica
- Examine a densidade óptica a 600 nm (OD600nm) usando um Leitor de Microplato.
NOTA: É aconselhável configurar e salvar o protocolo de ensaio no programa antes da preparação da placa de teste. - Ligue o leitor de microplacões e abra o programa.
- Selecione o modo Simples na janela Opções de Inicialização e selecione Criar um novo protocolo no gerenciador de tarefas (Figura Suplementar 1a,b).
- Na janela Select Plate Type , escolha 96 Placa de poço da lista de drop-down (Figura Suplementar 2).
- Selecione Absorvância para método de detecção, opção Endpoint/Cinética para tipo de leitura e Monocromadores para tipo de óptica. Clique em OK (Figura Suplementar 3).
- Para Read Step, digite 600 nm para comprimentos de onda e selecione Normal para obter velocidade de leitura. Clique em OK (Figura Suplementar 4).
- Para definir a temperatura do ensaio, clique na caixa de seleção Incubate e selecione Incubadora On. Digite a temperatura desejada na caixa temperatura . Clique em OK. Para evitar a condensação na tampa da placa durante a incubação, defina um gradiente de temperatura digitando um valor (1-3) na caixa gradiente . Clique em OK (Figura Suplementar 5a).
NOTA: Clique no Pré-aqueça antes de continuar com a caixa de seleção próximo passo para a temperatura de incubação de 37 °C. Esta etapa não é necessária para a condição de teste a 22 °C (RT). - Em seguida, clique na caixa de seleção Kinetic para abrir a Configuração Cinética. Defina o tempo de execução para 10h para incubação de 37 °C ou 22 h para RT. Digite 2h para intervalo de leitura. Clique em OK (Figura Suplementar 5b).
- Clique na caixa de seleção Shake na janela Procedimento para configurar a condição de shake, se necessário, para cada leitura cinética (Figura Suplementar 6a).
- Selecione Linear para Modos de Shake e altere Duração para 30 s. Defina o valor da frequência linear para 731 cpm (2 mm) e, em seguida, clique em OK (Figura Suplementar 6b).
- Na janela Diálogo resumo do protocolo , clique em Layout da placa e selecione Espaços em Branco, Controles de Ensaio e Amostras. Clique em Next (Figura Suplementar 7).
NOTA: Digite 1 em Número de Diferentes Tipos de Controle para controle negativo. - Depois de definir as configurações para cada tipo de poço, clique em Concluir.
- Selecione um Bem ID na interface lateral esquerda e, em seguida, atribua-o à matriz mostrada na viúva do layout da placa. Clique em OK (Figura Suplementar 8).
- Clique no botão Ler placa e salve o protocolo como um arquivo .prt e clique em Salvar (Figura Suplementar 9).
- Insira a placa e clique em OK.
- Uma vez que o experimento seja concluído, salve o experimento como um arquivo .xpt e clique em Salvar (Figura Suplementar 10).
- Exporte dados para o Excel clicando no botão Sim na caixa da janela da mensagem para análise suplementar (Figura Complementar 11).
- Clique na seleção Salvar sim/não e na caixa de seleção "Não pergunte novamente " para salvar a preferência.
6. Análises de dados
- Repita pelo menos dois experimentos independentes como descrito acima. Compile os resultados de todos os testes independentes. Calcule o desvio médio e padrão do OD600 de cada cultura tratada e livre de phage.
- Execute a raiz quadrada dos valores de OD a 600 nm e analise-os usando um modelo estatístico apropriado para cada cepa bacteriana e temperatura.
NOTA: Para o software SAS, o modelo MIXED e os mínimos quadrados para diferenciar meios (P < 0,05) são selecionados. Para cada cepa, atribua painéis A−G a cada tratamento de phage dos quais a eficácia global anti-O157 ao longo do tempo e os MOIs diferem (P < 0,05). - Definir eficácia de phage superior com base no valor de OD600nm ≤ 0,01 correspondente a nenhum crescimento bacteriano detectável (limite de detecção:300 UFC/mL).
- Analise os efeitos do tempo, temperatura de incubação, cepas E. coli O157, MOIs e tipos de phage sobre a eficácia da praga usando um modelo estatístico apropriado.
NOTA: Para o software SAS, use o GLIMMIX com medidas aleatórias. - Calcular odds ratios para comparar eficácia superior para diferentes fatores ambientais e biológicos de interesse.
- Analise os efeitos do tempo, temperatura de incubação, cepas E. coli O157, MOIs e tipos de phage sobre a eficácia da praga usando um modelo estatístico apropriado.
Resultados
Seguindo o protocolo, foi realizada uma comparação da eficácia da praga anti-O157 com várias combinações de phage, temperaturas, tempos e MEIs. Impactos da temperatura e dos tempos de incubação, MOIs, phages e cepas bacterianas utilizadas para melhorar a eficácia anti-E. coli O157 é apresentado na Tabela 1 (tabela de razão de odds)9. O percentual (%) da medição óptica de turbidez ≤ 0,01 foi analisado por cada preparação de phage em cada condição experimental. Com base nesta análise, a eficácia da praga anti-O157 foi maximizada após 14, 16 ou 18 h de incubação a 22 °C (P < 0,001) e MOI = 1000 (P < 0,001), sendo 75% e 89% do crescimento da cultura tratada com phage sendo completamente inibido, respectivamente. Em geral, entre 11 preparações de phage, um coquetel de T1, T4 e rV5 foi mais eficaz (P < 0,05) contra O157. Além disso, entre as temperaturas de incubação, os tempos, MOIs e phages testados, a sensibilidade aos phages variou, com cepas O157 testadas com cepa CO281-31N sendo mais sensíveis (P < 0,001) e 3081 (P < 0,001) sendo menos sensíveis aos phages.
Para entender a cinética que mata phage de cada cepa bacteriana testada, o valor de OD600 foi plotado contra cada tempo de amostragem, MOIs e tratamento de phage a cada temperatura de incubação. Os resultados representativos da eficácia das phages contra E. coli O157 3081 a 37 °C são mostrados na Figura 2. Assegura-se que a curva de crescimento da cultura de controle livre de phage é normal antes de avaliar a inibição da curva de crescimento da cultura tratada com phage. De acordo com a Figura 2, a inclusão do T4 inibiu completamente o crescimento bacteriano a 37 °C, a cada tempo de amostragem em um MOI tão baixo quanto 1. Para ver como a phage inibiu o crescimento bacteriano ao longo do tempo a várias temperaturas, independentemente dos MEIs, o valor médio de OD600nm médio de todos os MOIs (MOI > 0) foi traçado contra cada tempo de amostragem e tratamento de phage (Figura 3). Em comparação com 37 °C, a eficácia particular da morte por phage, por exemplo, phages T4 e T1 + T4, foi aprimorada acima de 22 °C. Outra abordagem para resumir e comparar a eficácia global anti-O157 entre os phages é mostrada na Tabela 2 e Na Tabela 39. O valor OD600 foi mediado de cada tempo de amostragem e MOI e classificação da eficácia da praga de maior (A) para a mais baixa (F: 37 °C e D: 22 °C). Esta tabela facilita a identificação do melhor tratamento de phage. Por exemplo, para a cepa 3081, os phages T4 e T5 + T4 (Painel A) foram os tratamentos mais eficazes a 37 °C, enquanto além do phage T4, os phages T1 + T4, T1 + T4 + rV5 e 4 coquetéis phage (Painel A) foram o tratamento mais eficaz a 22 °C.
Este protocolo também nos permitiu comparar a eficácia do phage com várias cepas bacterianas direcionadas e personalizar a preparação de phage. Por exemplo, ao selecionar phages, a 37 °C, excluindo a cepa 3081, phage T1 + T4 + rV5 teve a eficácia mais significativa contra todas as outras cepas, independentemente de seus tipos de phage. Com 22 °C, o coquetel de 4-phage foi o mais eficaz contra todas as cepas testadas. Os melhores MOIs resultaram em lise completa (OD600 ≤ 0,01), o que garantiu eficácia potencial superior em condições experimentais (Tabela 2 e Tabela 3).
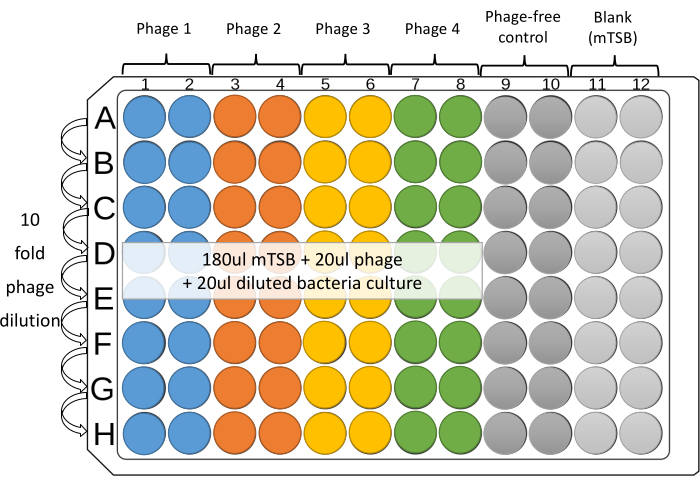
Figura 1: Layout sugerido de ensaio de microplacão de 96 poços. Diluições de 10 vezes cada phage são preparadas nas colunas 1-8 de microplacas estéreis de 96 poços. Quatro phages contra uma cepa bacteriana podem ser testados em duplicata, em colunas adjacentes, em cada placa. As demais colunas são para controles. Clique aqui para ver uma versão maior desta figura.
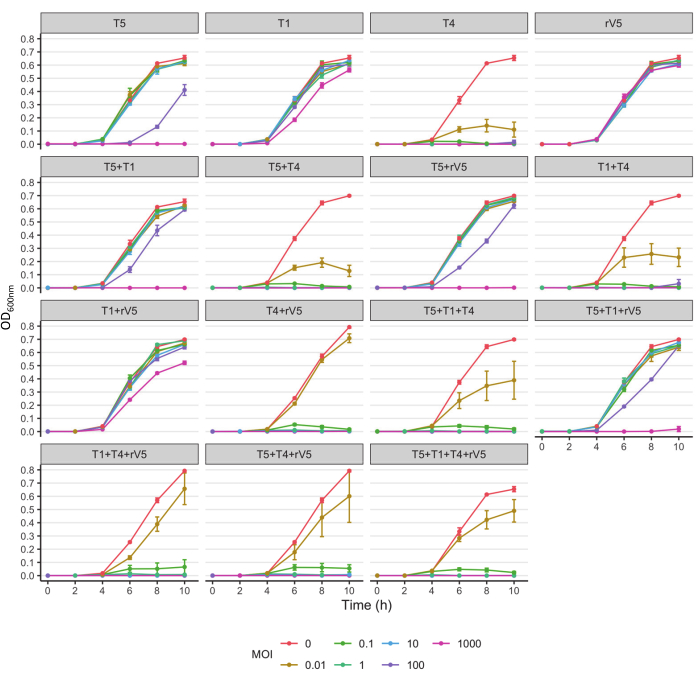
Figura 2: Curvas de crescimento da cepa E. coli O157 3081 a 37 °C tratadas e não tratadas com phages em cada MEIs. Os dados foram compilados a partir de dois ensaios independentes. As barras apresentam desvio padrão. Clique aqui para ver uma versão maior desta figura.
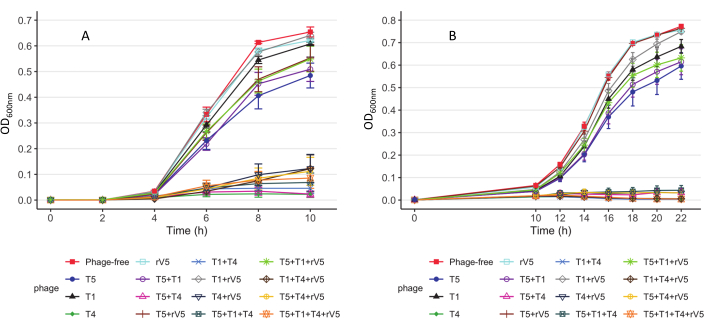
Figura 3: Curvas de crescimento da cepa E. coli O157 3081 cepas. (A) Curvas de crescimento a 37 °C. (B) Curvas de crescimento a 22 °C. Cada curva representa culturas individuais e mistas, tratadas e não tratadas com phages em moIs. Os dados foram compilados a partir de dois ensaios independentes. As barras apresentam o erro padrão da média (adaptado do Reference9 com permissão). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Razões de odds comparando a probabilidade de eficácia de phage superior em E. coli O157 em temperaturas de incubação, tempos de incubação, MOIs, phages e cepas de E. coli O157 (adaptado de Reference9 com permissão).
Tabela 2: Eficácia geral da praga contra E. coli O157 a 37 °C (adaptado de Reference9 com permissão). Clique aqui para baixar esta Tabela.
Tabela 3: Eficácia geral da praga contra E. coli O157 a 22 °C (adaptado de Reference9 com permissão). Clique aqui para baixar esta Tabela.
Figuras suplementares 1-11: Instantâneos da operação e procedimentos do leitor de microplaca. Por favor, clique aqui para baixar este Arquivo.
Discussão
Este protocolo descreveu uma abordagem robusta para avaliar sistemicamente a eficácia da praga contra patógenos transmitidos por alimentos, incluindo STEC9 e Salmonella10. Um passo crítico é ao diluir a cultura noturna das bactérias, usar o meio pré-refrigerado e manipular a diluição com um balde de gelo são recomendados para minimizar o crescimento bacteriano potencial. Além disso, a diluição de phage foi preparada antes de diluir a cultura bacteriana. A enumeração passo 2.8 forneceu números reais de inóculo bacteriano para cálculo do MOI final aplicado. Para a preparação da praga, são geralmente utilizados os lises de phage brutos preparados por phage de filtro infectados em 4-6 h de cultura bacteriana. A etapa crítica associada à infectividade da praga é sempre utilizar os estoques de trabalho phage preparados dentro de 3 meses. Pipetização extremamente precisa (particularmente quando se usa uma pipeta multicanal) e uniformidade de abordagem também são essenciais para obter resultados comparáveis e interpretatáveis. TSB modificado suplementado com 10 mM de Mg2+ foi utilizado para diluir phages, cultura bacteriana e meio base para otimizar a adsorção e infecção de phages.
À medida que as bactérias se proliferam durante a fase de tronco, mesmo abaixo da temperatura da incubadora, recomenda-se usar cultura diluída durante a noite em vez de cultura de fase de log, para minimizar o crescimento potencial bacteriano.
O protocolo proposto tem limitações. Primeiro, porque a microplacão só pode conter 200 μL, a incubação prolongada pode causar evaporação substancial e não é recomendada. Neste caso, o ensaio pode não ser adequado para bactérias de crescimento lento. Em segundo lugar, o protocolo proposto não foi capaz de monitorar a amplificação de phages. Em terceiro lugar, este protocolo não pôde monitorar o desenvolvimento da resistência ao phage ao longo do tempo, fator crítico que determina o resultado do tratamento de phage11,12. Experimentos de acompanhamento são necessários para avaliar o desempenho do coquetel mais influente na triagem, impedindo o surgimento de mutantes anti-phage em um extenso sistema de cultura de caldo e outras matrizes biológicas.
Em contraste com os antimicrobianos convencionais, a natureza biológica das pragas afeta a complexidade do biocontrole e do uso terapêutico em ambientes práticos. Convencionalmente, a seleção racional de coquetéis phage é baseada principalmente na atividade lítica e na gama hospedeira de phages. Candidatos com a atividade lítica mais forte e maior faixa de hospedagem são frequentemente recomendados13,14. No entanto, com base no presente estudo, phages como rV5 e T1, embora sozinhos não tão virulentos como T4 e T5, facilitaram muito o resultado geral do biocontrole quando combinados com T4 e/ou T5. Consequentemente, para alcançar uma eficácia superior dos coquetéis phage, recomenda-se o rastreamento sistêmico da atividade antibacteriana de combinações potenciais de phage contra cepas de hospedeiras direcionadas sob as condições ambientais desejadas. Além disso, a determinação de receptores para candidatos à phage e a inclusão de phages com vários receptores podem impedir a concorrência para o apego ao hospedeiro, impedir o desenvolvimento rápido de mutantes anti-phage e melhorar os resultados do biocontrole13.
Este método permitiu quantificação precisa da cinética de lise fásis em um formato de alto rendimento. Além disso, permitiu a avaliação sistemática de diversos fatores biológicos e ambientais sobre a eficácia antibacteriana de uma variedade de phages, facilitando assim a formulação de coquetéis de phage com desfechos otimizados. Presume-se que as futuras aplicações e desenvolvimento do método envolvam o monitoramento in situ da eficácia de cada phages dentro de coquetéis de phage por rotulagem de fluorescência de phages. Além do protocolo proposto, compreender determinantes genéticos que promovem efeitos sinérgicos e facilitados entre os phages ao co-infectar um hospedeiro facilitaria a formulação de coquetéis phage apropriados com eficácia superior.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Esta pesquisa foi apoiada pelo Conselho de Pesquisa em Ciências Naturais e Engenharia do Canadá (NSERC Discovery Grant, RGPIN-2019-04384), pela Fundação Canadense para a Inovação (Projeto nº 38710) e pelo Major Innovation Fund, Alberta. Agradecemos ao Dr. John Kastelic por editar o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Essential supplies, reagents, and equipment | |||
| Inoculating loops | VWR | 12000-806 | |
| Magnesium sulfate heptahydrate | Sigma | 1374361 | MgSO4.7H2O |
| Petri Dishes with Clear Lid | Fisher | FB0875713 | Diameter: 100 mm, sterile |
| Phosphate-buffered saline (PBS) | Fisher | 10010023 | |
| Pipet-Lite LTS Pipette L-1000XLS+ | METTLER TOLEDO | 17014382 | |
| Pipet-Lite LTS Pipette L-300XLS+ | METTLER TOLEDO | 17014405 | |
| Pipet-Lite Multi Pipette L12-20XLS+ | METTLER TOLEDO | 17013808 | |
| Pipet-Lite Pipette, Unv. SL-20XLS+ | METTLER TOLEDO | 17014412 | |
| Pipette Tips RT LTS 1000µL FL 768A/8-low retention | METTLER TOLEDO | 30389213 | |
| Pipette Tips SR LTS 20µL F 960A/5 | METTLER TOLEDO | 17005860 | |
| Pipette Tips SR LTS 300µL 768A/4 | METTLER TOLEDO | 17005867 | no filter |
| Reservoir | METTLER TOLEDO | 89094-662 | |
| Sterile, clear, 96-well flat-bottom polystyrene microplates with lids | Fisher | 168055 | |
| Tryptic soy agar (TSA) | Sigma | 105458-0500 | |
| Tryptic soy broth (TSB) | Sigma | 105459-0500 | |
| T-Shaped Cell Spreaders | VWR | 76299-566 | |
| Instruments | |||
| Analog Vortex Mixer | Fisher | 02-215-414 | |
| Compact Microbiological Incubators | Fisher | 50125590H | |
| Magnetic Stirrer Hotplates | FIsher | 13-889-335 | |
| Polygon Stir Bars | FIsher | 14-512-125 | length: 20 mm |
| Synergy Neo2 Hybrid Multi-Mode Reader | Fisher | BTNEO2M | |
| Software | |||
| SAS | SAS Institute | 9.4 |
Referências
- Carvalho, C., Costa, A. R., Silva, F., Oliveira, A. Bacteriophages and their derivatives for the treatment and control of food-producing animal infections. Critical Reviews in Microbiology. 43 (5), 583-601 (2017).
- Czaplewski, L., et al. Alternatives to antibiotics-a pipeline portfolio review. The Lancet. Infectious Diseases. 16 (2), 239-251 (2016).
- Cisek, A. A., Dabrowska, I., Gregorczyk, K. P., Wyzewski, Z. Phage therapy in bacterial infections treatment: one hundred years after the discovery of bacteriophages. Current Microbiology. 74 (2), 277-283 (2017).
- Liu, H., et al. Control of Escherichia coli O157 on beef at 37, 22 and 4°C by T5-, T1-, T4-and O1-like bacteriophages. Food Microbiology. 51, 69-73 (2015).
- Moye, Z. D., Woolston, J., Sulakvelidze, A. Bacteriophage applications for food production and processing. Viruses. 10 (4), (2018).
- Ly-Chatain, M. H. The factors affecting effectiveness of treatment in phages therapy. Frontiers in Microbiololgy. 5, 51(2014).
- Dy, R. L., Rigano, L. A., Fineran, P. C. Phage-based biocontrol strategies and their application in agriculture and aquaculture. Biochemical Society Transactions. 46 (6), 1605-1613 (2018).
- Bourdin, G., et al. Coverage of diarrhoea-associated Escherichia coli isolates from different origins with two types of phage cocktails. Microbial Biotechnology. 7 (2), 165-176 (2014).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Efficacy of individual bacteriophages does not predict efficacy of bacteriophage cocktails for control of Escherichia coli O157. Frontiers in Microbiololgy. 12, 616712(2021).
- Niu, Y. D., Liu, H., Johnson, R. P., McAllister, T. A., Stanford, K. Effect of a bacteriophage T5virus on growth of Shiga toxigenic Escherichia coli and Salmonella strains in individual and mixed cultures. Virology Journal. 17, 3(2020).
- Brüssow, H. What is needed for phage therapy to become a reality in Western medicine. Virology. 434 (2), 138-142 (2012).
- Chan, B. K., Abedon, S. T., Loc-Carrillo, C. Phage cocktails and the future of phage therapy. Future Microbiology. 8 (6), 769-783 (2013).
- Nikolich, M. P., Filippov, A. A. Bacteriophage therapy: developments and directions. Antibiotics. 9 (3), Basel, Switzerland. 135(2020).
- Niu, Y. D., et al. Host range and lytic capability of four bacteriophages against bovine and clinical human isolates of Shiga toxin-producing Escherichia coli O157:H7. Journal of Applied Microbiology. 107 (2), 646-656 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados