Method Article
用于生物医学研究的3D犬肝和肠类器官培养物的标准化和维护
摘要
描述了从犬肠和肝脏组织收获成体干细胞以建立3D类器官培养物的实验方法。此外,还讨论了确保持续生长并提供标准操作程序以收获,生物库和恢复犬肠道和肝脏类器官培养的实验室技术。
摘要
狗会发展出类似于人类的复杂多因素疾病,包括炎症性疾病,代谢性疾病和癌症。因此,它们代表了具有人类医学转化潜力的相关大型动物模型。类器官是3维(3D),自组装结构来自干细胞,模仿其起源器官的显微解剖学和生理学。这些转化 体外 模型可用于药物通透性和发现应用、毒理学评估,并提供对多因素慢性病病理生理学的机制理解。此外,犬类器官可以改善伴侣犬的生活,为兽医研究的各个领域提供投入,并促进兽医学中的个性化治疗应用。一小群供体可以创建类器官样品的生物库,从而减少连续组织收获的需求,因为类器官细胞系可以无限期地进行亚培养。本文介绍了三种方案,这些方案侧重于来自成体干细胞的肠和肝犬类器官的培养。犬类器官分离方案概述了处理组织和将细胞分离物嵌入支持基质(可溶的细胞外膜基质)的方法。犬类器官维持方案描述了类器官的生长和维护,包括清洁和传代以及适当的扩张时间。类器官摘取和生物样本库方案描述了提取,冷冻和保存类器官以进行进一步分析的方法。
引言
啮齿动物是生物医学和转化研究中最常用的动物模型1。它们对于研究疾病的基本分子发病机制特别有用,尽管它们与慢性多因素疾病的临床相关性最近受到质疑2。与啮齿动物相比,犬类模型具有几个优点3,4。狗和人类在代谢组学和肠道微生物组学方面具有相似性,这些代谢组学和肠道微生物组是由于在驯化的不同时期食用人类饮食而发展起来的5,6,7。犬类与人体胃肠道解剖学和生理学之间的相似之处是另一个例子8。
此外,狗通常与主人共享相似的环境和生活方式9。与啮齿动物相比,狗的寿命更长,因此可以自然发展许多慢性疾病10。炎症性肠病或代谢综合征是人类和狗之间具有重要相似性的多因素慢性疾病的例子11,12。涉及患有自然发生疾病的狗的犬类临床前试验可以产生比啮齿动物模型更可靠的数据13。然而,为了尽量减少使用活体动物研究并遵守3R(减少,精炼,替换)14的原则,已经出现了使用3D体外犬类器官进行体内测试的替代方案15。
类器官是自组装的3D干细胞衍生结构,概括了其原始器官的生理学和显微解剖学16,17。该技术由Sato等人于2009年首次描述17 ,并且允许在上皮细胞系中进行比以前使用2D癌细胞培养物更可翻译的 体外 研究18,19,20。类器官在许多生物医学学科中是有用的 体外 模型,例如在临床前毒理学21,22,23,吸收或代谢研究中24,25,26,27,28,以及个性化医疗方法29,30,31.犬肠道类器官的成功培养在2019年首次被描述12,而Nantasanti等人于2015年首次报道了来自狗的肝脏类器官32。此后,犬类器官已成功用于调查犬类慢性肠病,胃肠道间质瘤,结直肠腺癌12和威尔逊氏病的研究33,34。
虽然成体干细胞可以通过尸检收获,但类器官技术并不总是需要牺牲动物。内窥镜和腹腔镜活检,甚至是器官细针抽吸术35,是用于上皮类器官分离的成体干细胞的可行来源12。在兽医实践中广泛使用这种非侵入性技术有助于反向转化研究的选择(将信息从兽医临床实践转换为人类临床实践,反之亦然)15。类器官技术的进一步发展可以通过类器官培养和维护方法的标准化来保证。这里介绍的类器官方案部分基于Saxena等人从201536年发表的工作,并且对方法进行了调整以适应犬肠道和肝脏类器官培养的具体情况。犬类器官实验方案的整体工作流程如图1所示。
犬类器官分离方案介绍了从内窥镜,腹腔镜和手术活检以及尸检中获取样本的方法。它概述了组织样本的初始预处理以及用于运输到实验室的方法。类器官分离所需的材料和试剂在"分离准备"一节中进行了总结。从组织样本中分离成体干细胞的过程进一步详细描述。最后,讨论了使用增溶的细胞外膜基质将类器官电镀成圆顶状结构的过程。
第二种方案,犬类器官维持方案,描述了记录和培养类器官的方法。本节将讨论媒体更改及其频率。此外,还描述了实验室程序,例如传代和清洁细胞培养物,这对于确保成功维护3D犬类器官至关重要。适当的传代是协议的关键步骤,手稿中将进一步讨论此步骤的可能调整和故障排除。
最后一个方案是犬类器官摘取和生物样本库方案,其中包含用于制备用于石蜡包埋和RNA保存的成熟类器官的方法。这里还描述了在液氮储存中生物样本库类器官样品的方法。最后,讨论了解冻冷冻样品并支持其生长的方法。
总之,本文旨在通过实验室间方案的标准化提供一致的犬类器官培养程序。在此过程中,该手稿旨在促进从犬类器官模型中提取的数据的可重复性,以增加其在转化生物医学研究中的相关性。

图1:犬类器官实验方案的工作流程。 犬类器官分离方案描述了类器官分离所需材料的制备,组织样本的收获(通过尸检,内窥镜,腹腔镜和手术活检),以及细胞群细胞解离和接种的指导。犬类器官维持方案讨论了类器官培养的清洁和传代。类器官摘取和生物样本库实验方案讨论了用于石蜡包埋和进一步类器官表征的类器官样品的制备。还讨论了生物库类器官培养物并将其从液氮储存中恢复的方法。 请点击此处查看此图的放大版本。
研究方案
该研究获得批准并按照爱荷华州立大学机构动物护理和使用委员会(IACUC-19-337;IACUC-18-065;IACUC-19-017)。
注意:以下部分(步骤 1-3)介绍了犬类器官分离方案。
1. 隔离准备
- 转运管:在类器官分离之前(通常提前24小时),用10 mL Dulbecco的改良鹰培养基/营养混合物F-12(高级DMEM / F12)填充50 mL锥形管,富含0.2 mL笔链球菌。
- 对于腹腔镜、切口或切除活检,请再准备三个 50 mL 锥形管。用10mL完整的螯合溶液填充这些管(1x CCS;见 表1)。
注意:对于步骤1.2,磷酸盐缓冲盐水(PBS)中的2mM N-乙酰半胱氨酸(NAC)也可以用作用于干细胞收获的传统溶液。在PBS中使用1x CCS或NAC时没有观察到差异。将两种溶液都添加到溶液中以释放溶液中的细胞。 - 将管子保持在4°C过夜,并在协议的其余部分将管子在冰上运输。
- 准备 5 个 15 mL 离心管,内含 5 mL 1x CCS,1 个 15 mL 离心管,3 mL 1x CCS,一个空的 15 mL 离心管(上清液管),以及一个 15 mL 离心管,含 5 mL 1x CCS 和 2 mL 胎牛血清 (FBS)。
注意:如果要处理多个样品,则可以在隔离日之前准备上述内容。如图2所示,请参见 图2中的隔离管布局。 - 在隔离当天,在生物安全柜中准备培养皿,手术刀,冰桶和冷的高级DMEM / F12。将所需数量的24孔细胞培养板置于培养箱(37°C;5%CO2 气氛)中以预热。
- 将溶解的细胞外膜基质(ECM;见 材料表)放在冰上开始解冻。
注意:浸没在冰中可防止快速解冻,并有助于避免凝固。一盒移液器吸头可以放在冰箱中,以帮助电镀溶解的ECM。 - 将离心机预冷至4°C。
- 将含有生长因子"CMGF +"或"类器官培养基"(参见 表1 的成分)的完整培养基从冷冻室/冰箱移至37°C水浴中。尽可能避免直接光照射。
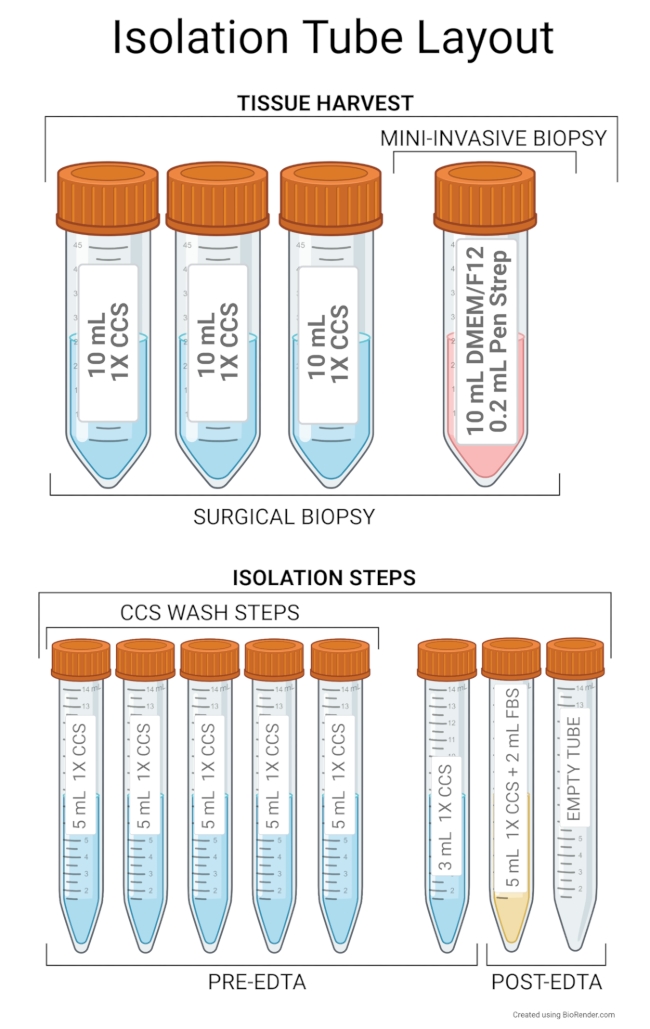
图2:隔离管布局。 推荐的组织采集设置包括在 50 mL 离心管中加入 10 mL 高级 DMEM/F12 和 0.2 mL 笔链球菌。此外,外科活检或尸检需要三个装有 10 mL 1x CCS 的 50 mL 试管。推荐的隔离步骤试管布局包括五个管子,其中包含 5 mL 1x CCS,用于 CCS 洗涤步骤。第一管用作含有切碎组织的样品管,其余管用作1x CCS的储液器,以添加到第一管中。第六管含有3mL的1x CCS,用于在转移到6孔板时冲洗样品管中的剩余组织。这六个试管将在EDTA孵育步骤之前使用。EDTA孵育后,含有5 mL 1x CCS和2 mL FBS的管可用作样品管,并且来自该管的上清液与干细胞一起转移到空管中以进行剩余的分离。在开始隔离之前,将试管保持在4°C。 请点击此处查看此图的放大版本。
2. 组织采集
- 肠内镜和腹腔镜活检(直径 2.8 mm)可以使用大型活检钳进行。每个肠道部位至少采集八个内窥镜样本。
- 将样品直接收集到运输管中并放在冰上。
- 对于手术活检和尸检,收获尺寸为0.5 cm x 0.5 cm的组织块,并将其放入第一个1x CCS管中。
注意:对于肠道活检,去除任何剩余的肠道内容物,并用手术刀刮擦粘膜层以去除绒毛。如果样本充足,可以在含有RNA储存试剂(1 mL)或石蜡包埋的冷冻管中收集额外的活检,以便将来比较类器官及其来源组织。在进行活检进行TEM分析的情况下,不要刮刮绒毛并将样品储存在防腐剂(3%多聚甲醛和3%戊二醛在磷酸盐缓冲盐水(PBS)中)并储存在4°C。 - 用力摇动1x CCS管约30秒,然后使用镊子将样品转移到新的1x CCS管中。重复此过程两次。
- 将样品从最后1x CCS管转移到运输管(高级DMEM / F12 + 笔链球菌)并将样品带回实验室。
注意:以这种方式预处理的样品也可以在冰上过夜运输(不要在干冰上运输)。
3. 类器官分离
注意:在生物安全柜中使用无菌技术进行隔离。参见 图3 ,了解犬类器官分离工作流程。
- 在转运管中摇动组织样品约30秒,并通过在流体表面附近缓慢移液,除去多余的上清液,直到管中剩余0.5mL。确保不要丢弃任何纸巾。
- 将组织和剩余的上清液转移到无菌培养皿中。使用一次性手术刀(或无菌的镊子和剪刀),将组织切割并切碎成更小的碎片(大小为1 mm 2),类似于麦芽浆稠度约5分钟。
- 用培养皿中的液体将切碎的组织移液到第一个CCS管中。将2 mL高级DMEM / F12加入培养皿中,冲洗剩余的组织,然后转移到第一个CCS管中。
- 涡旋1x CCS管约5秒约5次。让活检沉降到15 mL管的底部(约1分钟),并取出上清液,直到管中还剩下5 mL。将1x CCS从新试管转移到样品管。
- 对接下来的两个管重复上一步。在最后两次洗涤中,取出管中剩余的3 mL上清液。
- 将活检和1x CCS从样品管转移到6孔板的一个孔中。然后,向样品管中加入3mL的1x CCS,轻轻旋转以收集任何剩余的组织,然后转移到板的同一孔中。
- 加入150μL0.5 M EDTA(以达到孔中总体积为6.15mL)。将6孔板置于4°C的20°,24-rpm螺母混合器/摇臂上。 将肝脏样品孵育10分钟,并将肠道样品在移动的摇杆上孵育1小时。
- 将6孔板运回生物安全柜。将切碎的组织和液体转移到1x CCS / FBS管中,并使组织沉降。将上清液(该部分现在包括游离干细胞)和组织上部的约0.2mL运输到空管中。
- 向下旋转含有样品的管(在4°C下700× g5分钟)。干细胞现在与切碎的组织一起沉淀。小心地除去并丢弃上清液,以免干扰沉淀。
- 将沉淀重悬于高级DMEM / F12中,然后再次旋转管(在4°C下700× g 5分钟)。吸出上清液,不要干扰沉淀。
- 计算接种解离细胞和组织所需的溶解ECM的体积。在24孔板的每孔中使用30μL溶解的ECM,以实现适当的接种密度。
注意:分离后将样品嵌入24孔板的4至6孔中(即,基于样品中切碎组织的量)。 - 将计算出的溶解ECM体积加入样品管中,并缓慢上下移液,以避免形成气泡。在孔的中间播种悬浮液,以便溶解的ECM可以形成圆顶状结构。
注意:使用-20°C冰箱中的移液器吸头有助于电镀溶解的ECM。如果组织块大于 P200 移液器吸头,请使用宽冷吸头或切冷 P1000 吸头以协助电镀。尽可能将样品与溶解的ECM一起保存在冰上。 - 将板转移到培养箱(37°C;5%CO2 气氛)并允许溶解的ECM固化约30分钟。
- 在CMGF+中混合ROCK抑制剂和GSK3β(浓度见 表1)。向每个孔中加入500μL该溶液(CMGF + R / G)。将板放入培养箱(37°C;5%CO2 气氛)。

图3:犬类器官分离工作流程。 将收获的组织样品转移到培养皿中并适当切碎。然后将样品转移到1x CCS管中,并执行洗涤步骤。对于EDTA在6孔板中孵育,然后将样品转移到含有1x CCS和FBS的管中。组织沉降后,将具有少量组织的上清液转移到空管中。因此,样品被旋转,上清液被除去,并且沉淀被重悬于高级DMEM / F12中。再次旋转管子,吸出上清液并丢弃。将溶解的ECM加入到管中,混合,并将样品接种在24孔板中。因此,将板孵育(37°C;5%CO2 气氛)30分钟,然后加入培养基。 请点击此处查看此图的放大版本。
注意:以下部分(步骤4和5)描述了犬类器官维持方案。根据 表2 更换培养基,每天检查类器官是否有细胞凋亡、污染、过度拥挤和溶解ECM脱离的迹象。必须根据 图4 进行日常笔记,以准确监测条件和对培养物的实验影响。参见 补充表1 ,了解允许准确和可重复的类器官培养相关笔记的模板。对于肝脏类器官,使用用ROCK抑制剂和GSK3β增强的CMGF +。

图4:类器官大小和密度指南。 (A)用于准确跟踪类器官生长的类器官大小图表。尺寸指南包括超小型 (XS)、小型 (S)、中型 (M)、大型 (L) 和超大 (XL) 类别。(B) 密度指南由极低密度 (VLD)、低密度 (LD)、中等密度 (MD)、高密度 (HD) 和极高密度类别 (VHD) 组成。(C)类器官样品的细菌和真菌污染的代表性图像。(D)类器官过度拥挤和凋亡的代表性图像。每个面板中都标明了物镜放大倍率。 请点击此处查看此图的放大版本。
| 媒体更改建议 | ||||||
| 星期一 | 星期二 | 星期三 | 星期四 | 星期五 | 星期六 | 星期日 |
| 500 μL | 不适用 | 500 μL | 不适用 | 750 μL | 不适用 | 不适用 |
表2:介质更换建议。 每周媒体更换的建议时间表。建议每隔一天更换一次培养基(500 μL CMGF+用于肠道类器官,或500 μL CMGF+ R/G用于肝脏类器官)。为了考虑周末的额外时间,周五下午添加750μL培养基,周一早上刷新培养基。
4. 类器官清洁
注意:必须定期进行类器官清洁或传代,以保持类器官培养的健康。每当注意到培养物凋亡、存在碎屑、类器官过度拥挤或溶解的 ECM 脱离时,就执行清洁程序。参见 图4D。
- 在倾斜板的同时从孔中取出介质,以避免破坏溶解的ECM。
注意:如果溶解的ECM脱离相当大,建议将培养基转移到15 mL管中,以避免丢失含有样品的溶解ECM片段。 - 向每个孔中加入0.5 mL预冷的高级DMEM / F12,通过使用P1000吸头重复移液来溶解基质圆顶(避免产生过多的气泡)。将含有类器官的溶解基质转移到15mL离心管中。将试管保持在冰上,如果体积低于6 mL,请用高级DMEM / F12缓慢填充试管,以达到6 mL的总体积。
- 旋转管(在4°C下700× g 5分钟)并除去所有上清液,同时确保不干扰沉淀。
- 加入所需体积的溶解ECM(每孔30μL以达到适当的接种密度),并通过移液管混合缓慢重悬沉淀。将悬浮液放在24孔板的中间以形成圆顶。
- 将板置于培养箱(37°C;5%CO2 气氛)中约30分钟,然后加入适当体积的培养基(表2)。
5. 类器官传承
注意:传代通常在初始培养后5-7天进行,以扩增类器官细胞系。类器官培养通常可以以1:3的比例扩增。准备通过的健康培养物的图像如图 4所示。类器官必须至少中等大小。
- 执行步骤 4.1 至 4.3。
- 除去上清液,在试管中留下0.5 mL。确保不要干扰颗粒。
- 加入0.5mL胰蛋白酶样蛋白酶( 见材料表),用移液管吸气适当混合,并在37°C水浴中孵育(孵育肠道类器官8分钟或肝脏类器官10分钟)。通过在孵育的一半时间点轻拂管几次来继续混合溶液。
- 将含有样品的管子移回生物安全柜,并缓慢加入6mL预冷的Advanced DMEM / F12以灭活胰蛋白酶样蛋白酶并停止细胞的解离。
- 旋转管(在4°C下700× g5 分钟)并除去上清液。确保不要干扰颗粒。
- 执行步骤 4.4。和 4.5.
注意:以下部分(步骤6-9)描述了类器官摘取和生物样本库方案。类器官培养物必须不含在先前传代期间被移除的组织。培养物也应该是健康的,至少是大尺寸的,中到高的密度。 图4显示了为下游应用准备的健康培养物的图像。通过保存和收获次优类器官培养物向下游移动可能会对表征结果和生物库的生存能力产生负面影响。查看 图5中推荐的24孔板布局。
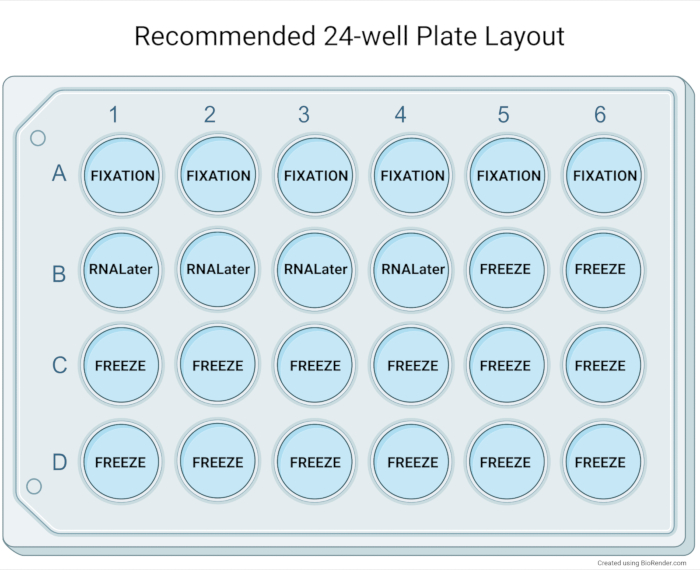
图5:推荐的24孔板布局。 推荐的24孔板布局,用于类器官培养物扩增后的基本表征。石蜡包埋六个孔(中到高密度的中到大类器官)通常允许组织学阻滞中高浓度的类器官。四孔类器官可以与RNA储存试剂一起汇集到一个冷冻室中,用于下游应用。14个孔用于生物库类器官样品,并为多达七个冷冻保存的小瓶提供材料。 请点击此处查看此图的放大版本。
6. 固定类器官
- 从孔中取出介质,并确保不会干扰溶解的ECM圆顶。
- 加入500μL福尔马林 - 乙酸 - 醇溶液作为固定剂(FAA; 表1中的成分)。
- 在室温下储存类器官。24小时后,吸入FAA并用70%乙醇填充井中。用实验室柔性薄膜胶带包裹板(见 材料表)以避免快速蒸发。类器官现在已经准备好进行石蜡包埋。类器官培养物的石蜡包埋在传统的金属基体模具中进行。
7. 核糖核酸保存
- 从孔中取出介质,并确保不会干扰溶解的ECM圆顶。
- 每孔使用 0.5 mL 预冷的高级 DMEM/F12,通过反复上下移液来溶解溶解的 ECM 圆顶(避免产生过多气泡)。将类器官转移到15 mL离心管中。将试管保持在冰上,如果体积低于6 mL,请用高级DMEM / F12缓慢填充试管以达到6 mL的总体积。
- 旋转管(在4°C下700× g5 分钟)并除去所有上清液。确保不要干扰颗粒。
- 向样品管中加入100μLPBS,并通过轻柔移液重悬沉淀。将样品管的内容物转移到冷冻管中。
- 将900μLRNA储存试剂(见 材料表)加入样品管并混合以收集任何剩余的类器官。将这些残留的类器官转移到冷冻室中并将其储存在-80°C(通常将四个孔汇集到一个冷冻室中就足够了,包括qPCR和RNA测序)。
注意:一个冷冻管通常产生总共4,000ng的RNA( 通过 分光光度计分析测量)。
8. 类器官生物样本库
注意:生物样本库通常在传代后3-4天进行。细胞凋亡的迹象不应存在于培养物中以执行该方法。有关适合冷冻的尺寸和密度的参考,请参阅 图4 。生物样本库中等到超大型类器官,密度为中到非常高。如果类器官细胞系特别罕见或不能保证进一步的活力,则可以遵循紧急冷冻步骤。遵循与正常类器官生物样本库相同的步骤(步骤8.1至8.4)。紧急冷冻使用较小和密度较低的培养物进行。按照步骤8.1至8.4将尽可能多的生长类器官孔汇集到一个冷冻室中。请记住,必须保持足够数量的类器官存活以试图扩增培养物(紧急冷冻只是一种备用程序,以防止因污染或其他意外事件 而 可能丢失培养物)。
- 按照步骤 7.1 到 7.3 操作。
- 向样品管中加入每个冷冻管1mL冷冻培养基( 表1中的成分),并通过上下移液轻轻重悬沉淀。
- 将1mL溶液转移到一个冷冻管(两个孔/冷冻管的比例)中,并将冷冻管保持在冰上。
- 将冷冻管从冰转移到冷冻容器中(定期用异丙醇重新填充储液器),并立即转移到-80°C。 将样品移至液氮(-196°C)中,在24小时后长期储存。
注意:也可以使用无酒精细胞冷冻容器代替传统的容器。确保样品在从-80°C运输到长期液氮储存期间不会解冻。反复解冻会降低细胞培养物的活力。
9. 从液氮储存中复苏
注意:当选择解冻类器官系时,必须重新冷冻复活的类器官的一个子集,并尽快在生物库中用至少一种(最好是更多)冷冻管替换。
- 将溶解的ECM放在冰上缓慢解冻,将24孔板放入培养箱(37°C; 5%CO 2 气氛),并制备所需的试剂,如15 mL管和高级DMEM / F12。
- 从液氮储存中回收含有类器官样品的冷冻管,并立即将其转移到热浴(37°C)中2分钟。
- 将冷冻管的内容物转移到生物安全柜中的15 mL离心管中。缓慢加入预冷的高级 DMEM/F12,以达到 6 mL 的总容积。
- 旋转管(在4°C下700× g 5分钟)。除去上清液,确保不干扰沉淀。
- 向沉淀中加入180μL(每孔30μL)溶解的ECM,并将该悬浮液加入预热的24孔板中。一个冷冻管可以接种到24孔板的六个孔中。
- 将24孔板置于培养箱(37°C;5%CO2 气氛)中约30分钟,并加入CMGF + R / G(对于肠道类器官,在24至48小时内切换到CMGF +)。
注意:当样品在24孔板中接种并生长时,必须在传代前至少2天恢复以增加活力。
结果
犬类器官方案通常每孔产生约50,000至约150,000个24孔板的肠或肝细胞。代表性类器官如图 6所示。
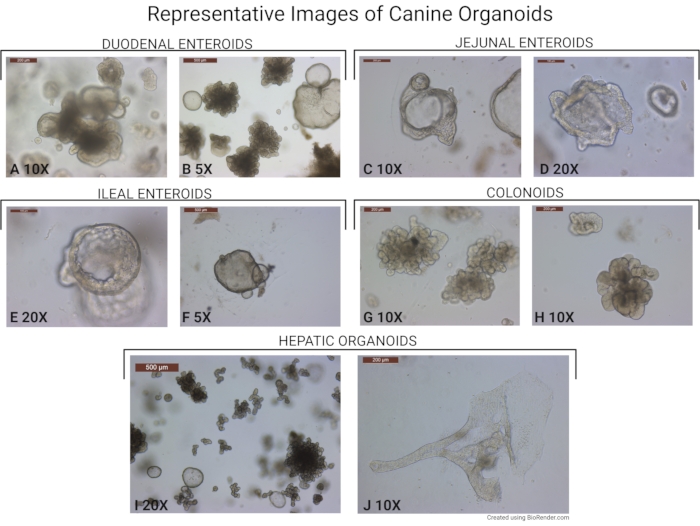
图6:犬类器官的代表性图像。 描绘了使用该协议分离的类器官的图像。(A,B)来自十二指肠的肠道类器官(以10倍和5倍物镜放大倍率拍摄)。注意存在较老的萌芽类器官和较年轻的球状体。(C,D)来自空肠下部的犬类肠(以10倍和20倍物镜放大倍率拍摄)。(五,F)回肠类(以 20 倍和 5 倍物镜放大倍率拍摄)和 (G,H) 结肠样体(以 10 倍物镜放大倍率拍摄)。(I)在20倍物镜放大镜下拍摄的肝脏类器官的代表性图像。大多数类器官都处于萌芽状态。在图片中也可以看到较年轻的肝球体。(J)代表性图像,显示形成导管样结构的罕见肝脏类器官(以10倍物镜放大倍率拍摄)。比例尺(500μm)位于每个图像的左上角。 请点击此处查看此图的放大版本。
使用该协议衍生的类肠体和结肠样体之前由Chandra等人在201912年进行了表征12。犬肠类器官由肠上皮的常规细胞群组成。利用RNA 原位 杂交,干细胞生物标志物(富含亮氨酸的重复含G蛋白偶联受体5 - LGR5和SRY-Box转录因子9 - SOX9),Paneth细胞生物标志物(肾上腺素B型受体2 - EPHB2),吸收性上皮细胞标志物(碱性磷酸酶- ALP)和肠内分泌标志物(神经生殖器官-3 - 神经G3)的表达12 已确认。在石蜡包埋的载玻片上进行Alcian Blue染色以确认杯状细胞的存在。此外,还进行了功能性测定,例如光学代谢成像(OMI)或囊性纤维化跨膜电导调节剂(CFTR)肿胀测定,以确认类器官的代谢活性。还使用该协议分离了来自被诊断患有炎症性肠病,胃肠道间质瘤(GIST)或结直肠腺癌的狗的犬类器官12。
干细胞分离后,肝犬类器官作为膨胀的球状体开始其生命周期,并在约7天后,它们变成萌芽和分化的类器官。测量根据该协议分离和培养的犬肝球体以量化其生长并确定理想的通过时间。在培养的前7天测量来自健康成年犬的腹腔镜肝活检(n = 7)的球状体。拍摄代表性图像,并在整个培养过程中测量球体的纵向(a)和对角线(b)半径(n = 845)。计算了球体的体积(V)、表面积(P)、二维椭圆面积(A)和周长(C)。实验的计算和结果总结在 图7中。使用2D椭圆面积和周长使用光学显微镜评估类器官培养物的健康状况。这些值可以作为区域性维护决策的指南。
简而言之,旋转椭球体在体积、表面积、2D 椭圆面积和周长方面迅速膨胀。对七只小猎犬的测量数据进行了平均,以进行以下计算。从第2天到第3天,交易量增加了479%(±6%)。同时,球体表面积和二维椭圆面积分别增加了211%(±208%)和209%(±198%)。2D椭圆周长从第2天增加到第3天增加了73%(±57%)。从第2-7天开始,肝脏类器官总量增加365倍以上,表面积和二维椭圆面积增加49倍,二维椭圆周长增加6倍。
接下来,从两个成年犬样本中提取的球体在通过后进一步生长,并每天(第2-7天)收集RNA 原位 杂交(RNA ISH)。设计了犬探针(探针列表作为 补充表2提供),并评估了mRNA表达的干细胞标志物(LGR5),胆管细胞特异性标记(细胞角蛋白7 - KRT-7和水通道蛋白1 - AQP1)以及肝细胞标志物(叉头盒蛋白A1 - FOXA1;和细胞色素P450 3A12 - CYP3A12)。以半定量方式评估标记物的表达( 图8中的代表性图片)。球状体优先表达胆管细胞标志物KRT-7,信号面积/细胞总面积从1%到26%不等。AQP1在类器官样本中没有表达,可以说是因为它在犬肝样本中的存在是稀疏的。干细胞标志物表达(LGR5)在0.17%~0.78%之间,而肝细胞标志物表达程度较低,FOXA1为0.05%~0.34%,CYP3A12为0.03%~0.28%。
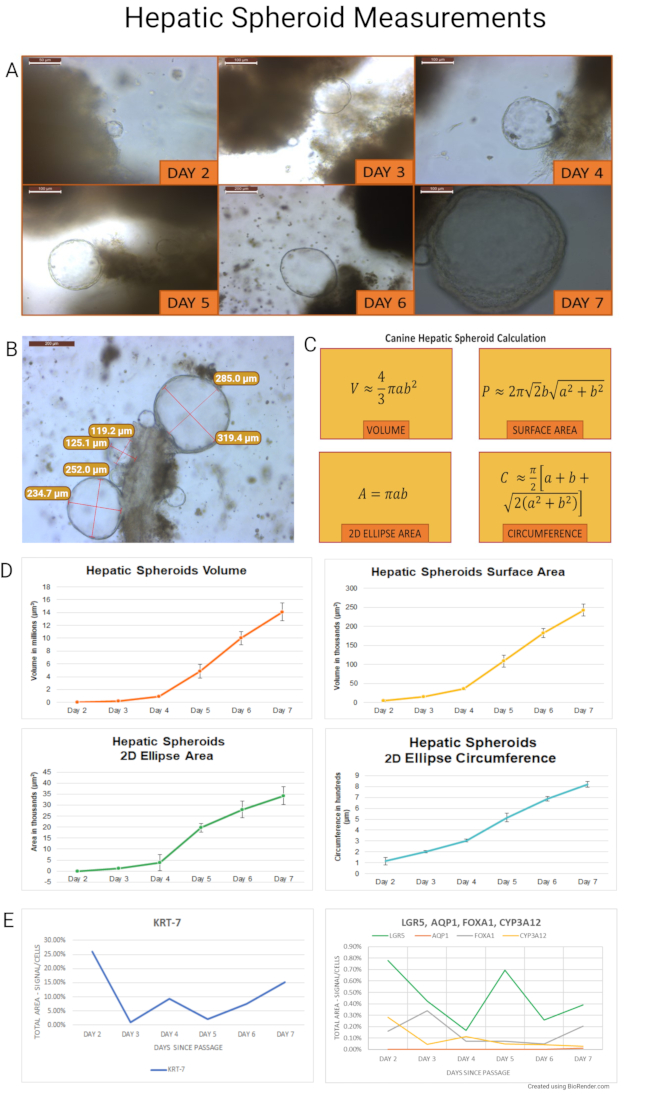
图7:肝球体测量(A)从第2-7天开始,每天观察培养物的肝球体生长。球体首先在第2天形成,最后一个旋转体在第7天开始萌芽过程。随后的实验在通过后使用两条犬类器官线每天收获球体进行石蜡包埋以进行RNA ISH(第2天的图像以40倍拍摄,第6天的图像以10倍拍摄,其余图像以20倍放大倍率拍摄)。(B)肝球状簇显示,在分离后4天,肝球状簇附着在溶解的ECM中的组织块上。测量了球体的纵向和对角线半径(在10x下拍摄的图像)。图 (C) 描述了用于计算得出体积 (V)、表面积 (P)、二维椭圆面积 (A) 和周长 (C) 的公式。对于这些计算,假设犬肝球体是理想的球体。单个生长天数的肝球体体积、表面积、2D 椭圆面积和 2D 椭圆周长的测量结果显示在面板 (D) 中。误差线表示平均值 (SEM) 的标准误差。(E)在第2天至第7天通过后,在犬肝球体样品中测定KRT-7,LGR5,FOXA1和CYP3A12的mRNA表达。AQP1在这些样本中没有表达。比例尺(5x:500 μm;10x:200 μm;20x:100 μm;40x:50 μm)位于每个图像的左上角。注意到客观放大倍率。请点击此处查看此图的放大版本。
在遵循这种标准化技术的传代过程中,类器官很少不会分解。如果未发生解离,可以调整传代时间以达到最佳的细胞群崩解。然而,长期暴露于胰蛋白酶样蛋白酶会对类器官的生长产生负面影响。在随后的实验中使用肝脏类器官来研究最佳解离时间并建立适当的传代方法。简而言之,来自两只健康狗(每只6孔重复)的肝脏类器官与胰蛋白酶样蛋白酶一起传代12分钟和24分钟。每6分钟搅拌一次样品。在解离时间点结束时,将6mL冰冷的高级DMEM / F12加入溶液中,并旋转样品(在4°C下700× g 5分钟)。除去上清液(具有稀释的胰蛋白酶的高级DMEM / F12),并将沉淀物包埋在如上所述的溶解ECM中(步骤4.4-4.5)。在溶解的ECM和CMGF + R / G中培养12小时后,在两个样品中观察到差异。用胰蛋白酶样蛋白酶孵育12分钟不会抑制类器官生长。然而,使用24分钟孵育对类器官的生长产生负面影响(见 图9)。

图9:犬肝类器官通过实验。 来自两只狗(D_1和D_2)的类器官的代表性图像,使用胰蛋白酶样蛋白酶孵育方法传代12分钟或24分钟。将对照样品与胰蛋白酶样蛋白酶传代10分钟。每个图像的左上角都有一个比例尺(μm),表示500μm(5倍物镜放大倍率)。 请点击此处查看此图的放大版本。
接下来,对从该协议衍生的犬肝类器官在不利环境(剥夺结构支持和营养)中的生存能力进行了调查。调查的重点是确定肝脏类器官成功生长和存活所需的类器官培养基和基底基质的体积,并确定这些条件对类器官培养物的影响。在具有有限数量的类器官的96孔板中测量生存能力。如上所述,将来自两只狗的类器官排出,并包埋(12个重复)在不同体积的溶解ECM(10μL或15μL)中。将细胞接种在400个细胞/ 10μL孔和600个细胞/ 15μL孔的浓度中,对应于40,000个细胞/ mL。以不同的体积(25μL,30μL或35μL)加入两种培养基类型(CMGF +或CMGF + R / G)。介质从未更换过,也没有执行任何维护过程。每天监测类器官的生存能力。类器官死亡被定义为超过50%的类器官结构的溶解。在这些条件下,类器官的存活率范围从12.9(±2.3)天到18(±1.5)天,结果总结在 表3中。存活时间最长的两个样品是来自狗的类器官,嵌入15μL溶解的ECM和30μLCMGF +培养基中。在剥夺18天后,将两个样品包埋在标准24孔板中的溶解ECM(30μL)和新鲜培养基(500μL)中,以确保仍然可能进行类器官扩增(图10)。
| 介质类型 | 平均值(存活天数) | 中位数 | 简历% | 平均值(存活天数) | 中位数 | 简历% | 平均值(存活天数) | 中位数 | 简历% | 平均值(存活天数) | 中位数 | 简历% | |
| 培养基(μL) | 30 | 25 | 35 | 30 | |||||||||
| 液相干 (μL) | 10 | 10 | 10 | 15 | |||||||||
| D_1 | CMGF+ R/G | 12.50 | 13 | 11.57 | 12.83 | 13 | 4.50 | 11.83 | 11.5 | 12.91 | 12.08 | 13 | 12.46 |
| 中华富+ | 17.08 | 17 | 16.26 | 18.50 | 19 | 4.89 | 18.42 | 19 | 14.54 | 17.82 | 19 | 8.99 | |
| D_2 | CMGF+ R/G | 13.67 | 14 | 13.36 | 13.00 | 13 | 12.70 | 14.00 | 14.5 | 17.23 | 13.08 | 13 | 8.90 |
| 中华富+ | 15.50 | 15 | 18.56 | 17.50 | 18 | 10.48 | 17.50 | 19 | 20.89 | 17.00 | 17 | 14.41 | |
| 总 | CMGF+ R/G | 13.08 | 13 | 13.13 | 12.92 | 13 | 9.39 | 12.92 | 13 | 17.52 | 12.58 | 13 | 11.22 |
| 中华富+ | 16.29 | 16.5 | 17.69 | 18.00 | 18.5 | 8.35 | 17.96 | 19 | 17.65 | 17.43 | 17 | 11.70 | |
| 死亡=超过50%的类器官质量不可存活 | |||||||||||||
表3:生存能力实验结果。 该实验基于剥夺两种类器官培养物的结构支持或营养。结果包括个体狗中溶解的ECM和培养基的个体浓度的平均值,中位数和标准差(CV%)。
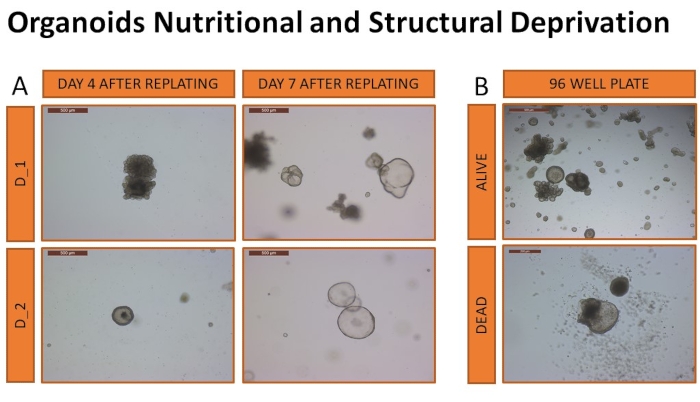
图10:类器官营养和结构剥夺。 将类器官重新接种在24孔板中,以确认剥夺后扩增的能力(A)。重镀后第4天和第7天的代表性图像显示类器官的膨胀,证实了视觉识别活体类器官的能力(图像以5倍物镜放大倍率拍摄)。在(B)中可以看到被认为是活的或死亡的类器官的代表性图像。图像以5倍物镜放大倍率拍摄。 请点击此处查看此图的放大版本。

图8:肝球体RNA 原位 杂交代表性图像。 从通过后第2-7天开始,在样品的60倍物镜放大率下拍摄LGR5,KRT7,FOXA1和CYP3A12标记的代表性图像。阳性 mRNA 分子染成红色。样品中没有表达AQP1。 请点击此处查看此图的放大版本。
| 不完全螯合液(ICS)组合物 | 最终浓度 |
| 500 毫升氢氧化氢 | 那 |
| 2.49 克 Na2HPO4-2H2O | 4.98毫克/毫升 |
| 2.7克高分子钾4 | 5.4毫克/毫升 |
| 14克氯化钠 | 28毫克/毫升 |
| 0.3 克氯化钾 | 0.6毫克/毫升 |
| 37.5克蔗糖 | 75毫克/毫升 |
| 25克D-山梨糖醇 | 50毫克/毫升 |
| 完整的螯合液(CCS)组合物 | V/V % 或终浓度 |
| 不完全螯合溶液 | 20% |
| 无菌 H2O | 80% |
| 断续器 | 520微米 |
| 笔链球菌 | 笔: 196 U/mL;链球菌 196 ug/mL |
| 类器官培养基组合物 | 最终浓度 |
| 高级 DMEM/F12 | 那 |
| 断续器 | 8% |
| 谷氨酰胺 | 2 兆米 |
| 异丙酮 | 10 毫米 |
| 普瑞莫星 | 100微克/毫升 |
| B27 补充剂 | 1 倍 |
| N2 补充剂 | 1 倍 |
| N-乙酰基-L-半胱氨酸 | 1 毫米 |
| 小鼠 EGF | 50 纳克/毫升 |
| 小鼠诺金 | 100 纳克/毫升 |
| 人类 R-海绵-1 | 500 纳克/毫升 |
| 小鼠 Wnt-3a | 100 纳克/毫升 |
| [Leu15]-胃泌素I人类 | 10 毫微米 |
| 烟 酰 胺 | 10 毫米 |
| A-83-01 | 500 毫安 |
| SB202190(P38抑制剂) | 10 微米 |
| TMS(甲氧苄啶磺胺甲噁唑) | 10 微克/毫升 |
| 其他组件 | 最终浓度 |
| 岩石抑制剂 (Y-27632) | 10 微米 |
| 茎胚层 CHIR99021 (GSK3β) | 2.5 微米 |
| 冷冻介质组成 | V/V 百分比 |
| 类器官培养基和ROCK抑制剂 | 50% |
| 断续器 | 40% |
| 二甲基亚砜 | 10% |
| 美国联邦航空局组成 | V/V 百分比 |
| 乙醇(100%) | 50% |
| 醋酸,冰川 | 5% |
| 甲醛 (37%) | 10% |
| 蒸馏水 | 35% |
表1:溶液和培养基的组成。 不完整和完整的螯合溶液,CMGF+(类器官培养基),冷冻培养基和FAA的组分和浓度列表。
补充表1:类器官护理模板。此模板允许每天准确和可重复的类器官笔记。 请点击此处下载此表格。
补充表2:RNA 原位 杂交探针。 由该技术制造商专门为犬类mRNA靶标设计的探针列表,以执行RNA 原位 杂交技术。列出了有关单个标记物的重要性、探针名称、其参考编号和目标区域的信息。 请点击此处下载此表格。
讨论
目前缺乏可用于分离和维持犬肝和肠道类器官的标准化方案。建立类器官培养的标准操作程序是必要的,以便该模型适用于不同的实验室环境。具体而言,为这些犬类器官模型的培养提供标准化的操作方案是表征类器官在培养和传代过程中的正常生长的关键,从而获得扩展和维持的最佳时间点。使用该协议培养的犬肠类器官先前已被Chandra等人表征12。
该协议最关键的步骤之一是类器官的传代。根据肝球体测量结果,确定肝球体首次通过的最佳时间是分离后的第7天。到第7天达到最大体积的球状体,同时,球体开始萌芽并形成肝脏类器官。从分离后的第2-7天开始,总类器官体积增加超过365倍,表明最佳通过时间比犬肠道类器官培养时间长。培养7天后,即使没有清洁或传代,也没有观察到肝球体细胞凋亡的严重迹象(图7)。肠道和肝脏类器官的传代可能具有挑战性,因为该过程可能导致细胞损失和活力改变。结果表明,肝脏类器官与胰蛋白酶样蛋白酶的长期孵育(长达12分钟)不会对传代培养产生负面影响。在胰蛋白酶样蛋白酶中孵育类器官超过24分钟可能对随后的类器官传代培养有害。
在类器官传代的细胞簇破损次优的情况下,机械解离而不是与胰蛋白酶样蛋白酶长期孵育可能更有益。如果在类器官的适当解离方面遇到问题,可以尝试对样品进行短暂的涡旋以提高通道产量。另一方面,涡旋有可能破坏培养物并损害细胞,因此只有在其他程序反复失败时才应使用它。将肝脏类器官分解成单个细胞会降低类器官的生长速率,而将它们分解成细胞簇可以大大提高它们的生存能力。选择十分钟作为类器官方案的孵育时间。与胰蛋白酶样蛋白酶实验中的24分钟孵育相比,12分钟的孵育时间点被认为没有细胞毒性。
生存能力实验证实,犬肝类器官可以在不利条件下存活长达19.5天(结构和营养枯竭)。在这些条件下存活时间最长的类器官用CMGF +培养基培养。这一观察结果可能是由于未补充Rock抑制剂和GSK3β的培养基中肝脏类器官生长较慢引起的。使用CMGF + R / G的类器官培养物生长得更快,并且可能更快地耗尽其资源。该实验为将犬类器官培养小型化以实现高通量系统转换开辟了可能性。这种技术显示出以大幅降低成本促进药物发现或毒理学研究的潜力。
在犬类器官培养维护过程中遇到的一些常见问题是电镀时样品凝固不当,培养污染以及建立类器官的适当密度和大小。如果溶解的ECM在电镀过程中过早凝固,请立即将其放在冰上10分钟。如果溶解的ECM没有形成圆顶状结构,则可能没有从样品中除去足够的培养基。如果是这种情况,请用更溶解的ECM稀释样品,直到形成圆顶。
当在整个板中发现真菌或细菌污染时(见 图4),最好的解决方案是丢弃板。可以尝试使用抗真菌药或抗生素药物治疗,但这种尝试的成功率极低。如果板中的单个孔被污染,则可以将可行和未受影响的孔清洁(按照步骤4.1至4.5)到新板并密切监测。如果样品已经过紧急冷冻,建议丢弃整个样品,因为解冻样品会使培养箱面临额外的污染风险。
健康的类器官培养应至少处于中等大小和中等密度类别或更大。最佳密度对于类器官培养生长至关重要。必须通过将类器官清洁到中等密度来校正较低的密度。如果发生极端密度的情况(过度拥挤),类器官应扩大到更多的孔。细胞凋亡的严重体征通常伴随过度拥挤和类器官培养密度低。如果这些问题没有及时纠正,整个类器官培养物将在几天内变成凋亡。如果类器官达到超大尺寸或非常高的密度,应将培养物用于实验,冷冻或固定。
类器官培养基目前含有17种成分,因此添加类器官维持和扩增所需的生长因子可能很昂贵。这个问题可以通过培养2D细胞培养物来解决,这些培养物合成生长因子以产生条件化的CMGF +。细胞培养L-WRN产生Wnt-3a,R-Spondin-3和Noggin生长因子37。细胞集落使用90%DMEM/F12和10%FBS培养基。当培养物达到90%的融合度时,每天收获培养基,持续1周。然后将收获的培养基与2x CMGF +(不含这些生长因子)混合。虽然2D培养物可以以一小部分成本产生所需的生长因子,但必须预期生产培养基的额外时间和准备工作。条件培养基批次之间的生长因子浓度也可能不同37,38。
犬类成体干细胞衍生的类器官培养物是一种独特的生物医学模型,可以帮助实现"一个健康倡议"的目标39。类器官技术可用于许多基础和生物医学研究领域,从发育生物学,病理生理学,药物发现和测试,毒理学到传染病和再生医学的研究40。转化和反向转化研究都是犬类器官适用的领域15。几个世纪以来,狗一直在转化实验环境中使用,它们的伴侣动物地位也促进了它们作为兽医学中最受探索的物种之一的地位。
总之,本手稿为犬类肝脏和肠道类器官的分离、维持、收获和生物样本库提供了标准化的操作规程,以促进该模型在各种生物医学领域的应用。该模型特别适合促进反向转化研究,作为"同一个健康"倡议的工具,以促进跨学科和跨学科的知识共享。
披露声明
K. Allenspach是LifEngine Animal Health和3D Health Solutions的联合创始人。她担任Ceva Animal Health,Bioiberica,LifeDiagnostics,Antech Diagnostics,Deerland Probiotics和Mars的顾问。J. P. Mochel是LifEngine Animal Health和3D Health Solutions的联合创始人。Mochel博士担任Ceva Animal Health和Ethos Animal Health的顾问。其他作者没有任何利益冲突要声明。
致谢
作者要感谢爱荷华州立大学兽医诊断实验室的员工,即Haley M. Lambert,Emily Rahe,Rosalyn M. Branaman,Victoria J. Green和Jennifer M. Groeltz-Thrush,他们及时处理了所提供的样本。作者希望感谢教师创业,ISU VPR Miller奖,ISU VPR Miller奖和NSF SBIR子奖对ISU # 1912948的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
参考文献
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? - Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA - Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal - Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。