Method Article
生物医学研究に使用するための3D犬肝および腸オルガノイド培養の標準化と維持
要約
イヌの腸組織および肝組織から成体幹細胞を採取して3Dオルガノイド培養物を確立するための実験方法が記載されている。さらに、一貫した成長を確保し、イヌの腸および肝臓オルガノイド培養物を収穫、バイオバンク、および復活させるための標準的な操作手順を提供するための実験室技術が議論される。
要約
イヌは、炎症性疾患、代謝性疾患、および癌を含むヒトに類似した複雑な多因子疾患を発症する。したがって、それらは、ヒト医学への翻訳の可能性を有する関連する大型動物モデルを表す。オルガノイドは、幹細胞に由来する3次元(3D)の自己組織化構造であり、その起源の器官のミクロ解剖学および生理学を模倣する。これらのトランスレーショナル インビトロ モデルは、薬物透過性および発見用途、毒物学評価、および多因子慢性疾患の病態生理学の機構的理解を提供するために使用することができる。さらに、犬のオルガノイドは、コンパニオンドッグの生活を向上させ、獣医学研究のさまざまな分野でのインプットを提供し、獣医学におけるパーソナライズされた治療アプリケーションを容易にします。ドナーの小さなグループは、オルガノイド細胞株を無期限に継代培養することができるため、オルガノイドサンプルのバイオバンクを作成し、継続的な組織採取の必要性を低減することができる。本明細書には、成体幹細胞に由来する腸および肝臓イヌオルガノイドの培養に焦点を当てた3つのプロトコールが提示される。犬オルガノイド単離プロトコルは、支持マトリックス(可溶化細胞外膜マトリックス)における細胞単離物の組織および埋め込みを処理する方法を概説している。犬オルガノイド維持プロトコルは、拡張のための適切なタイミングとともに、洗浄および継代を含むオルガノイドの成長および維持を記述する。オルガノイド採取およびバイオバンキングプロトコルは、さらなる分析のためにオルガノイドを抽出、凍結、および保存する方法を説明しています。
概要
げっ歯類は、生物医学的およびトランスレーショナル研究に最も一般的に利用されている動物モデルです1。これらは、疾患の基本的な分子病因を調査するのに非常に有用であるが、慢性多因子疾患に対する臨床的関連性が最近疑問視されている2。犬のモデルは、げっ歯類と比較していくつかの利点を示しています3,4。イヌとヒトは、家畜化のさまざまな期間を通じて人間の食事を摂取したために発達したメタボロミクスと腸内微生物叢の類似点を共有しています5,6,7。イヌとヒトの胃腸解剖学および生理学との類似点は、実施例8の別のものである。
さらに、犬はしばしば飼い主と似たような環境やライフスタイルを共有しています9。げっ歯類と比較して犬の寿命が長いため、多数の慢性疾患の自然な発達が可能になります10。炎症性腸疾患またはメタボリックシンドロームは、ヒトとイヌとの間に重要な類似点を共有する多因子性慢性疾患の例です11,12。自然発生的な疾患を持つ犬を対象とした犬の前臨床試験では、げっ歯類モデルから得られたものよりも信頼性の高いデータを生成することができます13。しかし、生きた動物研究の使用を最小限に抑え、3R(Reduce、Refine、Replace)14の原則に準拠するために、3D in vitroイヌオルガノイドを使用したin vivo試験に代わるものが登場しました15。
オルガノイドは自己組織化された3D幹細胞由来の構造で、元の臓器の生理学とミクロ解剖学を再現します16,17。この技術は、200917年にSatoらによって初めて記載され、2D癌細胞培養物を使用して以前に可能であったよりも上皮細胞株においてより多くの翻訳可能なインビトロ研究を可能にした18,19,20。オルガノイドは、前臨床毒物学21,22,23、吸収、または代謝研究24,25,26,27,28、ならびに個別化医療アプローチ29,30,31など、多くの生物医学分野においてインビトロモデルとして有用である。.犬腸オルガノイドの培養の成功は2019年に初めて記載され12、犬由来の肝臓オルガノイドは201532年にNantasantiらによって最初に報告されました。それ以来、犬のオルガノイドは、犬の慢性腸内障、胃腸間質腫瘍、結腸直腸腺癌12、およびウィルソン病を調査する研究で首尾よく使用されています33,34。
成体幹細胞は剖検によって採取することができるが、オルガノイド技術は必ずしも動物を犠牲にする必要はない。内視鏡的および腹腔鏡的生検、あるいは臓器の細い針吸引液35でさえ、上皮オルガノイド単離のための成体幹細胞の生存可能な供給源である12。このような非侵襲的技術が獣医診療において広く使用されることで、逆翻訳研究(獣医臨床診療からヒト臨床診療への情報の翻訳、またはその逆)の選択肢が容易になります15。オルガノイド技術のさらなる進歩は、オルガノイド培養・維持方法の標準化によって保証することができる。ここで提示されたオルガノイドプロトコルは、201536年からSaxenaらの以前に発表された研究に部分的に基づいており、方法は犬の腸および肝臓オルガノイド培養の特異に合うように適合させた。イヌオルガノイドプロトコルの全体的なワークフローを図1に示します。
犬オルガノイド単離プロトコルは、内視鏡、腹腔鏡、外科生検、ならびに剖検からサンプルを得る方法を導入しています。組織サンプルの初期前処理と、実験室への輸送に使用される方法論を概説しています。オルガノイドの単離に必要な材料および試薬は、「単離の準備」セクションに要約されています。組織試料からの成体幹細胞単離のプロセスは、さらに詳細に説明される。最後に、可溶化された細胞外膜マトリックスを用いてオルガノイドをドーム状構造にメッキするプロセスが議論される。
第2のプロトコルである犬オルガノイド維持プロトコルは、オルガノイドを文書化および培養する方法を記載している。このセクションでは、メディアの変更とその頻度について説明します。さらに、3Dイヌオルガノイドの維持を確実に成功させるために不可欠な細胞培養物の継代および洗浄などの実験室手順が記載されている。適切な継代はプロトコルの重要なステップであり、このステップの可能な調整とトラブルシューティングについては、原稿でさらに詳しく説明します。
最後のプロトコルは、パラフィン包埋およびRNA保存のために完全に成長したオルガノイドを調製するための方法を含むイヌオルガノイド収穫およびバイオバンキングプロトコルである。液体窒素貯蔵中のオルガノイドサンプルをバイオバンキングする方法もここで記載されている。最後に、凍結サンプルを解凍し、その成長をサポートする方法について説明します。
結論として、この記事は、実験室間プロトコルの標準化を通じて一貫した犬オルガノイド培養手順を提供することを目的としている。そうすることで、この原稿は、イヌオルガノイドモデルに由来するデータの再現性を促進し、トランスレーショナル生物医学研究におけるそれらの関連性を高めることを目的としている。

図1:イヌオルガノイドプロトコルのワークフロー。 イヌオルガノイド単離プロトコルは、オルガノイド単離に必要な材料の調製、組織サンプルの採取(剖検、内視鏡、腹腔鏡、および外科的生検の手段による)、および細胞集団の細胞解離およびプレーティングに関するガイダンスを記載しています。犬オルガノイド維持プロトコルは、オルガノイド培養物の洗浄と継代について論じている。オルガノイドハーベスティングおよびバイオバンキングプロトコルでは、パラフィン包埋およびさらなるオルガノイド特性評価のためのオルガノイドサンプルの調製について説明しています。オルガノイド培養物をバイオバンクし、液体窒素中での貯蔵からそれらを復活させる方法も議論されている。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
この研究は、アイオワ州立大学の施設動物ケアおよび使用委員会(IACUC-19-337;IACUC-18-065;IACUC-19-017)。
メモ: 次のセクション (手順 1 ~ 3) では、犬用オルガノイド分離プロトコルについて説明します。
1. 隔離の準備
- 輸送チューブ:オルガノイド単離前(通常は24時間前)に、50mLの円錐形チューブに、0.2mLのペンストレップを濃縮したダルベッコの改変イーグル培地/栄養素混合物F-12(Advanced DMEM/F12)10mLを充填してください。
- 腹腔鏡下、切開、または切除生検の場合は、さらに3本の50mL円錐形チューブを調製する。これらのチューブを10mLの完全キレート溶液(1x CCS; 表1参照)で満たします。
注:ステップ1.2では、リン酸緩衝生理食塩水(PBS)中の2mM N-アセチルシステイン(NAC)を幹細胞採取に使用される従来の溶液として使用することもできます。PBSで1x CCSまたはNACを使用した場合、差は認められなかった。両方の溶液は、溶液中の細胞を放出するために添加される。 - チューブを一晩4°Cに保ち、残りのプロトコルでチューブを氷上で輸送する。
- 5 mL の 1x CCS を含む 5 本の 15 mL 遠沈管、3 mL の 1x CCS を含む 15 mL 遠沈管 1 本、空の 15 mL 遠沈管 (上清管) 1 本、および 5 mL の 1x CCS および 2 mL のウシ胎児血清 (FBS) を含む 15 mL の遠沈管を 1 本用意します。
注:複数のサンプルが処理される場合、上記は単離日の前に準備することができます。図については、 図2の絶縁チューブのレイアウトを参照してください。 - 隔離の日に、バイオセーフティキャビネットにペトリ皿、メス、アイスバケツ、および冷たいAdvanced DMEM/F12を準備します。必要数の24穴細胞培養プレートをインキュベーター内(37°C;5%CO2 雰囲気)に入れ、予備加温する。
- 可溶化した細胞外膜マトリックス(ECM; 材料表を参照)を氷の上に置き、融解を開始する。
注:氷に浸かることは、急速な融解から保護し、固化を避けるのに役立ちます。ピペットチップの箱を冷凍庫に入れて、可溶化ECMのメッキを補助することができます。 - 遠心分離機を4°Cに予チルする。
- 成長因子「CMGF+」または「オルガノイド培地」(組成については 表1 を参照)を含む完全な培地を冷凍庫/冷蔵庫から37°Cの水浴に移す。可能な限り、直接光に当たらないようにしてください。
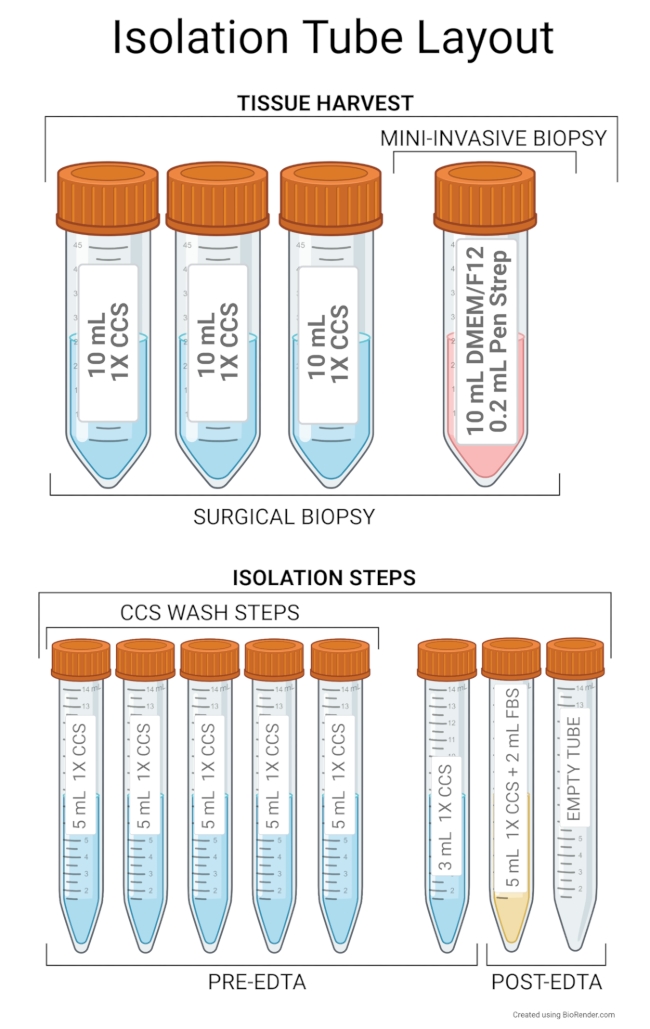
図2:絶縁チューブのレイアウト 組織採取の推奨セットアップには、50 mL 遠沈管に 10 mL のアドバンスト DMEM/F12 と 0.2 mL の Pen Strep が含まれます。さらに、10mLの1x CCSで満たされた3本の50mLチューブが外科的生検または剖検に必要である。単離ステップの推奨チューブレイアウトには、CCS 洗浄ステップで使用する 5 mL の 1x CCS を含む 5 本のチューブが含まれます。第1のチューブは、ミンチ組織を含むサンプルチューブとして使用され、残りのチューブは、第1のチューブに添加される1x CCSのリザーバとして機能する。第6のチューブは、6ウェルプレートに移す際にサンプルチューブから残りの組織を洗い流すための3mLの1x CCSを含む。これらの6本のチューブは、EDTAインキュベーションステップの前に使用されます。5 mL の 1x CCS および 2 mL の FBS を含むチューブは、EDTA インキュベーション後のサンプルチューブとして機能し、このチューブからの上清を幹細胞と共に空のチューブに移して残りの単離を行います。絶縁を開始する前にチューブを4°Cに保ちます。 この図の拡大版を表示するには、ここをクリックしてください。
2. 組織採取
- 腸内視鏡下、および腹腔鏡下生検(直径2.8mm)は、大型生検鉗子を使用して取得することができる。腸部位ごとに少なくとも8つの内視鏡サンプルを採取する。
- サンプルを輸送チューブに直接集め、氷の上に置きます。
- 外科的生検および剖検の場合、0.5cm x 0.5cmのサイズの組織片を採取し、最初の1x CCSチューブに入れます。
注:腸生検の場合は、残りの腸内容物を除去し、メスで粘膜層をこすり取って絨毛を除去してください。サンプルが豊富な場合は、RNA保存試薬(1mL)を含むクライオビアで追加の生検を採取するか、パラフィン包埋して、オルガノイドとその起源組織との将来の比較を行うことができます。TEM分析のために生検を行う場合は、絨毛を掻き取り、試料を防腐剤(リン酸緩衝生理食塩水(PBS)中3%パラホルムアルデヒド、3%グルタルアルデヒド)で保存し、4°Cで保存してください。 - 1x CCSチューブを約30秒間激しく振ってから、鉗子を使用してサンプルを新しい1x CCSチューブに移します。このプロセスを 2 回繰り返します。
- 最後の1x CCSチューブから輸送チューブ(Advanced DMEM/F12 + Pen Strep)にサンプルを移し、サンプルを実験室に戻します。
注: この方法で前処理されたサンプルは、氷上で一晩出荷することもできます (ドライアイスでは出荷しないでください)。
3. オルガノイド単離
メモ:バイオセーフティキャビネットで無菌技術を使用して単離を実行します。イヌオルガノイド単離ワークフローについては 、図3 を参照してください。
- 輸送チューブ内の組織サンプルを〜30秒間振盪し、流体表面付近でゆっくりとピペッティングすることによってチューブ内に0.5mLが残るまで過剰な上清を除去する。ティッシュを捨てないようにしてください。
- 組織および残りの上清を滅菌ペトリ皿に移す。使い捨てメス(または滅菌した鉗子とハサミ)を使用して、組織を切断し、マッシュの粘稠度に似た小さな小片(1mm2のサイズ)に約5分間細かく刻む。
- 細切った組織をペトリ皿から液体で最初のCCSチューブにピペッティングする。2 mLのアドバンストDMEM/F12をペトリ皿に加え、残りの組織を洗い流し、最初のCCSチューブに移す。
- 1x CCSチューブを5秒間約5回渦巻きます。生検を15mLチューブの底に沈降させ(約1分間)、チューブ内に5mLが残るまで上清を除去する。1x CCSを新しいチューブからサンプルチューブに移します。
- 次の 2 本のチューブについて、前の手順を繰り返します。最後の2回の洗浄で、チューブ内に残っている上清を3mLまで除去する。
- 生検および1x CCSをサンプルチューブから6ウェルプレートの1ウェルに移す。次いで、3mLの1x CCSをサンプル管に加え、穏やかに旋回させて残りの組織を採取し、プレートの同じウェルに移す。
- 150 μL の 0.5 M EDTA を追加します (ウェル内の総容量 6.15 mL を達成するため)。6ウェルプレートを4°Cの20°、24rpmのナッティングミキサー/ロッカーの上に置きます。 肝臓サンプルを10分間、腸サンプルを移動ロッカー上で1時間インキュベートする。
- 6ウェルプレートをバイオセーフティキャビネットに戻します。ミンチ組織と液体を1x CCS/FBSチューブに移し、組織を沈降させます。上清(この部分には遊離幹細胞が含まれるようになった)および組織の上部の約0.2mLを空のチューブに輸送する。
- サンプルを入れたチューブをスピンダウンします(700 x g、4°Cで5分間)。幹細胞は現在、ミンチ組織とともにペレット化されている。ペレットを乱さないように上澄み液を慎重に取り除いて捨てます。
- ペレットをアドバンストDMEM/F12に再懸濁し、チューブを再び回転させます(700 x g 、4°Cで5分間)。上清を吸引し、ペレットを乱さないでください。
- 解離した細胞および組織を播種するのに必要な可溶化ECMの体積を計算する。適切な播種密度を達成するために、24ウェルプレートのウェルあたり30μLの可溶化ECMを使用する。
注: 単離後、24 ウェルプレートの 4 ~ 6 ウェルにサンプルを埋め込む (つまり、サンプル中のミンチ組織の量に基づきます)。 - 可溶化ECMの計算された容量をサンプルチューブに加え、泡の形成を避けるためにゆっくりと上下にピペットします。可溶化ECMがドーム様構造を形成できるように、懸濁液をウェルの中央に播種する。
注:-20°Cの冷凍庫のピペットチップを使用すると、可溶化ECMのメッキに役立ちます。ティッシュチャンクがP200ピペットチップよりも大きい場合は、幅の広いコールドチップを使用するか、冷たいP1000チップをカットしてメッキを補助します。可溶化ECMでサンプルを可能な限り氷上に保管してください。 - プレートをインキュベーター(37°C、5%CO2 雰囲気)に輸送し、可溶化ECMを約30分間固化させます。
- CMGF+中のROCK阻害剤とGSK3βを混合する( 濃度は表1)。この溶液(CMGF+ R/G)を500 μLをすべてのウェルに加えます。プレートをインキュベーター(37°C;5%CO2 雰囲気)に置きます。

図3:犬オルガノイド分離ワークフロー 採取した組織サンプルをペトリ皿に移し、適切にミンチする。次いで、サンプルを1x CCSチューブに移し、洗浄ステップを実行する。6ウェルプレートでのEDTAインキュベーションのために、次いで、サンプルを1x CCSおよびFBSを含むチューブに移す。組織が落ち着いた後、少量の組織を有する上清を空のチューブに移す。その結果、サンプルがスピンされ、上清が除去され、ペレットがアドバンストDMEM/F12に再懸濁される。チューブを再び回転させ、上清を吸引して廃棄する。可溶化ECMをチューブに添加し、混合し、試料を24ウェルプレートに播種する。その結果、プレートを30分間インキュベート(37°C、5%CO2 雰囲気)し、次いで培地を加える。 この図の拡大版を表示するには、ここをクリックしてください。
メモ: 次のセクション (手順 4 および 5) では、犬用オルガノイドメンテナンスプロトコルについて説明します。 表2 に従って培地を交換し、オルガノイドにアポトーシス、汚染、過密、および可溶化ECMの剥離の徴候がないか毎日チェックする。培養物に対する条件と実験効果を正確に監視するために、 図4 に従って毎日のメモを取る必要があります。正確で再現性のあるオルガノイド培養関連のメモ作成を可能にするテンプレートについては、 補足表1 を参照してください。肝オルガノイドには、ROCK阻害剤とGSK3βで増強したCMGF+を使用してください。

図4:オルガノイドのサイズと密度ガイド(A)オルガノイドの成長を正確に追跡するためのオルガノイドサイズチャート。サイジング ガイドには、超小型 (XS)、小 (S)、中 (M)、大 (L)、および特大 (XL) カテゴリが含まれています。(B) 密度ガイドは、超低密度(VLD)、低密度(LD)、中密度(MD)、高密度(HD)、および超高密度カテゴリ(VHD)で構成されています。(c)オルガノイド試料の細菌および真菌汚染の代表的な画像。(D)オルガノイド過密およびアポトーシスの代表的な画像。客観的な倍率はすべてのパネルに表示されます。この図の拡大版を表示するには、ここをクリックしてください。
| メディア変更の推奨事項 | ||||||
| 月曜日 | 火曜日 | 水曜日 | 木曜日 | 金曜日 | 土曜日 | 日曜日 |
| 500 μL | 該当なし | 500 μL | 該当なし | 750 μL | 該当なし | 該当なし |
表2:メディア交換の推奨事項 毎週のメディア変更の推奨タイムライン。培地(腸管オルガノイドの場合は500 μLのCMGF+、肝臓オルガノイドの場合は500 μLのCMGF+ R/G)を1日おきに交換することをお勧めします。週末の余分な時間を考慮するために、金曜日の午後に750μLのメディアが追加され、月曜日の朝にメディアが更新されます。
4. オルガノイド洗浄
注:オルガノイド培養物の健康を維持するために、オルガノイドの洗浄または継代を定期的に行う必要があります。培養物中のアポトーシス、破片の存在、オルガノイドの過密化、または可溶化ECMの剥離が認められたときはいつでも、洗浄手順を実行する。 図4Dを参照してください。
- 可溶化ECMの破壊を避けるためにプレートを傾けながらウェルから培地を除去します。
注:可溶化ECM剥離がかなり大きい場合は、サンプルを含む可溶化ECMの断片が失われないように、培地を15mLチューブに移すことをお勧めします。 - プレチルドアドバンストDMEM/F12を各ウェルに0.5 mL追加し、P1000チップを使用してピペッティングを繰り返してマトリックスドームを溶解します(過度の気泡の発生は避けてください)。オルガノイド含有溶解マトリックスを15mL遠沈管に移す。チューブを氷の上に置き、容量が6 mL未満の場合は、チューブにアドバンストDMEM/F12をゆっくりと充填して総容量6 mLに達します。
- チューブをスピン(700 x g 、4°Cで5分間)し、ペレットを乱さないようにしながらすべての上清を除去します。
- 必要量の可溶化ECM(適切な播種密度を達成するためにウェルあたり30μL)を加え、ピペット混合によってペレットをゆっくりと再懸濁する。懸濁液を24穴プレートの中央にプレートし、ドームを形成した。
- プレートをインキュベーター(37°C、5%CO2 雰囲気)に約30分間置き、適切な量の培地を加えます(表2)。
5. オルガノイド継代
注:継代は、典型的には、オルガノイド細胞株を拡大するために初期培養の5〜7日後に行われる。オルガノイド培養は、典型的には1:3の比率で拡張することができる。継代準備が整った健康な培養物の画像を 図4に示します。オルガノイドは、少なくとも中程度の大きさでなければならない。
- 手順 4.1 ~ 4.3 を実行します。
- チューブ内に0.5 mLを残して上清を取り除く。ペレットを乱さないようにしてください。
- 0.5 mLのトリプシン様プロテアーゼ( 材料表を参照)を加え、ピペットで吸引して適切に混合し、37°Cの水浴中でインキュベートする(腸オルガノイドを8分間、または肝臓オルガノイドを10分間インキュベートする)。インキュベーションのハーフタイムポイントでチューブを数回フリックして溶液を混合し続けます。
- サンプルを入れたチューブをバイオセーフティキャビネットに戻し、プレチルドアドバンストDMEM/F12をゆっくりと加えてトリプシン様プロテアーゼを不活性化し、細胞の解離を止めます。
- チューブをスピンさせ(700 x g 、4°Cで5分間)、上清を除去した。ペレットを乱さないようにしてください。
- 手順 4.4 を実行します。と 4.5.
注:次のセクション(ステップ6〜9)では、オルガノイドハーベスティングおよびバイオバンキングプロトコルについて説明します。オルガノイド培養物は、以前の継代中に除去された組織を含まないものでなければならない。また、培養物は健康的で、少なくともサイズが大きく、密度が中程度から高いものでなければなりません。ダウンストリームアプリケーション用の準備ができている健康な培養物の画像を 図4に示します。最適ではないオルガノイド培養物の保存と収穫によって下流に移動すると、特性評価結果とバイオバンクの生存率に悪影響を及ぼす可能性があります。 図 5 の推奨 24 ウェルプレートレイアウトを確認します。
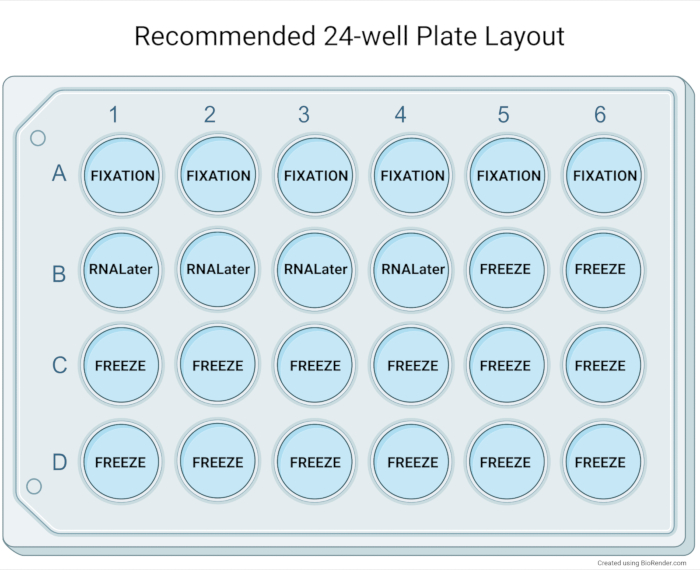
図5:推奨24ウェルプレートレイアウト オルガノイド培養の拡張後の基本的な特性評価のための24ウェルプレートの推奨レイアウト。6つのウェル(中~高密度の中~大規模オルガノイド)のパラフィン包埋は、典型的には、組織学ブロック内に高濃度のオルガノイドを可能にする。オルガノイドの4つのウェルは、下流用途のためのRNA貯蔵試薬を用いて1つのクライオビアにプールすることができる。14のウェルがオルガノイドサンプルのバイオバンキングに使用され、最大7つの凍結保存バイアルの材料を提供します。 この図の拡大版を表示するには、ここをクリックしてください。
6. オルガノイドの固定
- ウェルから培地を取り出し、可溶化ECMドームを乱さないようにしてください。
- 固定液となるホルマリン-酢酸-アルコール溶液500 μLを加える(FAA; 表1の組成)。
- オルガノイドを室温で保存する。24時間後、FAAを吸引し、井戸を70%エタノールで満たします。プレートを実験室の可撓性フィルムテープ( 材料表を参照)で包み、急速な蒸発を避けてください。オルガノイドはパラフィン包埋の準備が整いました。オルガノイド培養物のパラフィン包埋は、従来の金属ベースモールドで行われている。
7. RNAの保存
- ウェルから培地を取り出し、可溶化ECMドームを乱さないようにしてください。
- ウェルあたり0.5 mLのプレチルドアドバンストDMEM/F12を使用して、上下に繰り返しピペッティングすることによって可溶化ECMドームを溶解します(過度の気泡の発生を避けてください)。オルガノイドを15mL遠沈管に移す。チューブを氷の上に置き、容量が6 mL未満の場合は、チューブにアドバンストDMEM/F12をゆっくりと充填して、総容量の6 mLに達します。
- チューブをスピンさせ(700 x g 、4°Cで5分間)、上清をすべて除去した。ペレットを乱さないようにしてください。
- 100 μLのPBSをサンプルチューブに加え、穏やかなピペッティングによってペレットを再懸濁する。サンプルチューブの内容物をクライオビアルに移す。
- 900 μLのRNA保存試薬( 材料表を参照)をサンプルチューブに追加し、混合して残りのオルガノイドを収集します。これらの残留オルガノイドをクライオビアに移し、-80 °C で保存します (通常、1 つのクライオビアにプールされた 4 つのウェルで十分で、qPCR や RNA シーケンシングなどのダウンストリームアプリケーションに適しています)。
注:1つのクライオビアは、通常、合計4,000ngのRNAを生成します(分光光度計分析 によって 測定)。
8. オルガノイドバイオバンキング
注:バイオバンキングは通常、通過後3〜4日で発生します。アポトーシスの徴候は、この方法を実行するために培養物中に存在すべきではない。凍結に適したサイズと密度については、 図4 を参照してください。バイオバンクは、中~超高密度の超大型オルガノイド。オルガノイド細胞株が特にまれであるか、またはさらなる生存率が保証されない場合、緊急凍結ステップに従うことができる。通常のオルガノイドバイオバンキングについても同じ手順に従います(手順8.1~8.4)。緊急凍結は、より小さく、密度の低い文化で行われます。成長中のオルガノイドのウェルをできるだけ多くプールし、ステップ8.1~8.4に従って1つのクライオビアルにします。培養物を拡張するためには、十分な数のオルガノイドを生かしておく必要があることに留意してください(緊急凍結は、汚染やその他の予期しない出来事 による 培養物の損失の可能性から保護するための単なるバックアップ手順です)。
- 手順 7.1 から 7.3 を実行します。
- クライオビアあたり1mLの凍結培地( 表1の組成)をサンプルチューブに加え、上下にピペッティングしてペレットを穏やかに再懸濁する。
- 1 mLの溶液を1つのクライオビア(2つのウェル/クライオビアの比率)に移し、クライオビアを氷上に保持する。
- 凍結容器を氷から凍結容器に移し(定期的にイソプロパノールでリザーバを補充する)、直ちに-80°Cに移す。 サンプルを液体窒素(-196°C)に移動し、24時間後に長期保存する。
注:アルコールフリーの細胞凍結容器は、従来のものの代わりに使用することもできます。-80°Cから液体窒素の長期貯蔵までの輸送中にサンプルが融解しないようにしてください。融解を繰り返すと、細胞培養物の生存率が低下する。
9. 液体窒素貯蔵からの復活
注:オルガノイドラインを融解することを選択する場合、復活したオルガノイドのサブセットを再凍結し、できるだけ早くバイオバンク内で少なくとも1つ(好ましくはそれ以上)のクライオビアルで交換する必要があります。
- 可溶化したECMを氷の上に置き、ゆっくりと解凍し、24ウェルプレートをインキュベーター(37°C、5%CO2雰囲気)に入れ、15mLチューブやアドバンストDMEM/F12 などの必要な試薬を調製します。
- 液体窒素貯蔵庫からオルガノイド試料を含むクライオビアを回収し、直ちにそれを熱浴(37°C)に2分間移送する。
- クライオビアルの内容物をバイオセーフティキャビネット内の15mL遠沈管に移す。プレチルドアドバンストDMEM/F12をゆっくりと加えて、総容量が6mLになるようにします。
- チューブを回転させます(700 x g 、4°Cで5分間)。上清を取り除き、ペレットを乱さないようにしてください。
- 180 μL(1ウェルあたり30 μL)の可溶化ECMをペレットに加え、この懸濁液を予熱した24ウェルプレートにプレートする。1つのクライオビアルを24ウェルプレートの6ウェルに播種することができる。
- 24ウェルプレートをインキュベーター(37°C、5%CO2 雰囲気)に約30分間置き、CMGF+ R/Gを加えます(腸内オルガノイドの場合は、24〜48時間でCMGF+に切り替えます)。
注:サンプルを播種し、24ウェルプレートで増殖させる場合、生存率を高めるために継代前に少なくとも2日間回復させる必要があります。
結果
イヌオルガノイドプロトコルは、典型的には、24ウェルプレートのウェル当たり約50,000〜〜150,000個の腸細胞または肝臓細胞を生成する。代表的なオルガノイドは 図6に見られる。
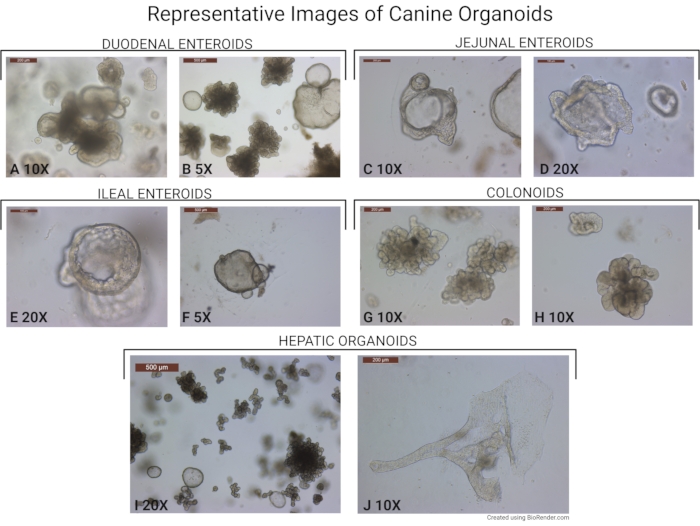
図6:イヌオルガノイドの代表的な画像。 このプロトコルを用いて単離されたオルガノイドの画像が描かれている。(A,B)十二指腸に由来する腸オルガノイド(10倍および5倍の対物倍率で採取)。古い出芽オルガノイドと若い回転楕円体の存在に注意してください。(C、D)空腸の下部からのイヌ腸内膜(10倍および20倍の対物倍率で採取)。(E,F)回腸エンテロイド(20倍および5倍の対物倍率で採取)、および(G,H)コロノイド(10倍の対物倍率で採取)。(i)20倍の対物倍率で撮影した肝オルガノイドの代表的な画像。オルガノイドのほとんどは出芽形をしています。若い肝楕円体も写真で見ることができます。(j)ダクト様構造を形成する希少肝オルガノイドを示す代表画像(対物倍率10倍で撮影)。スケールバー(500 μm)は、各画像の左上隅にあります。 この図の拡大版を表示するには、ここをクリックしてください。
このプロトコールを用いて誘導されたエンテロイドおよびコロノイドは、201912年にChandra et al.によって以前に特徴付けられた。イヌ腸オルガノイドは、腸上皮の規則的な細胞集団から構成される。RNAin situハイブリダイゼーションを用いて、幹細胞バイオマーカー(Gタンパク質共役型受容体5-LGR5およびSRY-Box転写因子9-SOX9を含むロイシンリッチリピート)、パネス細胞バイオマーカー(エフリンB型受容体2-EPHB2)、吸収性上皮細胞マーカー(アルカリホスファターゼ-ALP)および腸内分泌マーカー(ニューロゲニン-3-ニューロG3)12の発現 )が確認された。パラフィン包埋スライドに対してアルシアンブルー染色を行い、ゴブレット細胞の存在を確認した。さらに、オルガノイドの代謝活性を確認するために、光代謝イメージング(OMI)または嚢胞性線維症膜貫通コンダクタンス調節因子(CFTR)腫脹アッセイなどの機能アッセイを実施した。炎症性腸疾患、胃腸間質腫瘍(GIST)、または結腸直腸腺癌と診断されたイヌからのイヌオルガノイドも、このプロトコルを用いて単離された12。
幹細胞単離後、肝臓犬オルガノイドは膨張性スフェロイドとしてそのライフサイクルを開始し、〜7日後には出芽および分化オルガノイドに変わる。このプロトコールに従って単離および培養されたイヌ肝スフェロイドを測定し、それらの増殖を定量化し、継代のための理想的な時間を決定した。健康な成犬の腹腔鏡下肝生検に由来するスフェロイド(n=7)を、培養の最初の7日間に測定した。代表的な画像を撮影し、スフェロイドの縦(a)および対角線(b)半径(n=845)を培養物全体を通して測定した。回転楕円体の体積(V)、表面積(P)、2D楕円領域(A)、および円周(C)を計算した。実験の計算と結果を 図7にまとめた。2D楕円領域および円周を使用して、光学顕微鏡を用いてオルガノイド培養物の健康状態を評価した。これらの値は、カルチャ維持の決定のガイドとして役立ちます。
簡単に言うと、回転楕円体は体積、表面積、2D楕円領域、および円周において急速に拡大した。7匹のビーグルからの測定データを、以下の計算のために平均化した。ボリュームは2日目から3日目に479%(±6%)増加しました。同時に、回転楕円体表面積と2D楕円面積は、それぞれ211%(±208%)および209%(±198%)増加した。2D 楕円の円周は、2 日目から 3 日目に 73% (±57%) 増加しました。2~7日目の肝オルガノイドの全体積の増加は365倍以上、表面積と2D楕円面積は49倍、2D楕円周は6倍に増加した。
次に、2匹の成体イヌサンプルに由来するスフェロイドを継代後にさらに増殖させ、RNA in situ ハイブリダイゼーション(RNA ISH)について毎日(2〜7日目)収集した。イヌプローブを設計し(プローブリストは 補足表2として提供される)、およびmRNA発現を、幹細胞マーカー(LGR5)、胆管細胞に特異的なマーカー(サイトケラチン7−KRT−7、およびアクアポリン1−AQP1)、ならびに肝細胞マーカー(フォークヘッドボックスタンパク質A1−FOXA1;およびシトクロムP450 3A12〜CYP3A12)について評価した。マーカーの発現を半定量的に評価した(代表的な写真は 図8)。スフェロイドは、細胞のシグナル面積/総面積において1%から26%の範囲の胆管細胞マーカーKRT-7を優先的に発現した。AQP1はオルガノイド試料中で発現しなかったが、これはおそらく、イヌ肝臓試料におけるその存在がまばらであるためである。幹細胞マーカー発現(LGR5)は0.17%〜0.78%の範囲であったが、肝細胞マーカーはFOXA1で0.05%〜0.34%、CYP3A12で0.03%〜0.28%と低い程度で発現した。
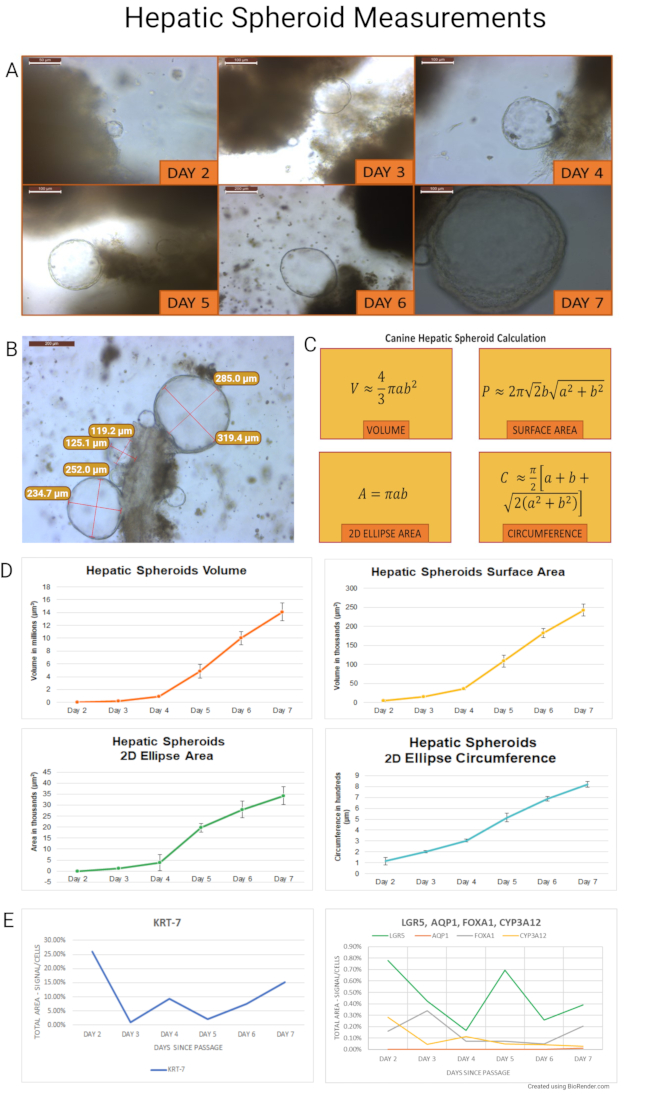
(A)肝スフェロイド増殖は、培養2日目から7日目まで毎日観察された。回転楕円体は2日目に最初に形成され、最後の回転楕円体は7日目に出芽プロセスを開始した。その後の実験では、継代後に2本のイヌオルガノイド系統を用いて、パラフィン包埋のために毎日スフェロイドを採取し、RNA ISHを行った(2日目の画像は40倍、6日目の画像は10倍、残りの画像は20倍の倍率で撮影)。(b)肝スフェロイドクラスターが、単離後4日目に可溶化ECMに埋め込まれた組織チャンクに結合して示されている。回転楕円体の縦方向および対角線半径を測定した(10xで撮影した画像)。パネル (C) は、体積 (V)、表面積 (P)、2D 楕円領域 (A)、および円周 (C) を導出するための計算に使用される式を示しています。これらの計算から、イヌ肝スフェロイドは理想的なスフェロイドであると推測された。個々の成長日における肝スフェロイドの体積、表面積、2D楕円面積、および2D楕円円周の測定結果をパネル(D)に示します。エラーバーは平均の標準誤差(SEM)を表す。(e)KRT-7、LGR5、FOXA1、およびCYP3A12のmRNA発現を、2日目から7日目の経過後にイヌ肝スフェロイドのサンプルで測定した。これらの試料ではAQP1は発現しなかった。スケールバー(5倍:500μm、10倍速:200μm、20倍速:100μm、40倍速:50μm)は、各画像の左上にあります。客観的な倍率に留意した。この図の拡大版を表示するには、ここをクリックしてください。
オルガノイドは、この標準化された技術に従った継代プロセス中に分解しないことはめったにありません。解離が起こらない場合、継代時間を調整して、最適な細胞クラスター崩壊を達成することができる。しかし、トリプシン様プロテアーゼへの長期曝露は、オルガノイドの成長に悪影響を及ぼす可能性がある。肝オルガノイドは、最適な解離時間を調査し、適切な継代方法を確立するために、その後の実験で使用された。簡単に説明すると、2匹の健康なイヌ由来の肝臓オルガノイド(それぞれ6ウェル複製)をトリプシン様プロテアーゼで12分間および24分間継代した。試料は6分毎に撹拌した。解離時間の終わりに、6mLの氷冷アドバンストDMEM/F12を溶液に添加し、サンプルを紡糸した(700 x g 、4°Cで5分間)。上清(希釈したトリプシン様プロテアーゼによるAdvanced DMEM/F12)を除去し、ペレットを上記のように可溶化ECMに包埋した(ステップ4.4〜4.5)。可溶化ECMおよびCMGF+ R/Gで12時間培養した後、両方のサンプルで差異が観察された。トリプシン様プロテアーゼとの12分間のインキュベーションは、オルガノイド増殖を阻害しなかった。しかしながら、オルガノイドの成長は、24分間のインキュベーションを用いて悪影響を及ぼした( 図9参照)。

図9:犬肝オルガノイド継代実験 トリプシン様プロテアーゼインキュベーション法を用いて継代した2匹のイヌ(D_1およびD_2)に由来するオルガノイドの代表的な画像は、12分間または24分間である。対照試料をトリプシン様プロテアーゼと共に10分間継代した。スケールバー(μm)は各画像の左上にあり、500μm(対物倍率5倍)を表します。 この図の拡大版を表示するには、ここをクリックしてください。
次に、このプロトコールに由来するイヌ肝オルガノイドの不利な環境(構造的支持および栄養の剥奪)における生存可能性の調査を行った。この調査は、肝臓オルガノイドの成長と生存を成功させるために必要なオルガノイド培地と地下マトリックスの量を決定し、オルガノイド培養に対するそのような条件の影響を確立することに焦点を当てました。生存率は、限られた数のオルガノイドを有する96ウェルプレートで測定した。2匹のイヌ由来のオルガノイドを上記のように継代し、異なる量の可溶化ECM(10μLまたは15μL)に包埋(12反復)した。細胞を400細胞/10 μLウェルおよび40,000細胞/mLに相当する600細胞/15 μLウェルの濃度で播種した。2つの培地タイプ(CMGF+、またはCMGF+ R/G)を異なる容量(25 μL、30 μL、または35 μL)で添加した。メディアは変更されず、保守手順も実行されませんでした。オルガノイドの生存率を毎日モニターした。オルガノイド死は、オルガノイド構造の50%以上の溶解と定義した。これらの条件におけるオルガノイドの生存率は12.9(±2.3)日から18(±1.5)日の範囲であり、その結果を 表3にまとめた。最も長く生存した2つのサンプルは、15μLの可溶化ECMおよび30μLのCMGF+培地に埋め込まれたイヌ由来のオルガノイドであった。両方のサンプルを、18日間の剥奪後に標準24ウェルプレートに可溶化ECM(30μL)および新鮮な培地(500μL)に包埋し、オルガノイド増殖がまだ可能であることを確認しました(図10)。
| メディアの種類 | 平均(生存日数) | 中央値 | 履歴書% | 平均(生存日数) | 中央値 | 履歴書% | 平均(生存日数) | 中央値 | 履歴書% | 平均(生存日数) | 中央値 | 履歴書% | |
| 培地 (μL) | 30 | 25 | 35 | 30 | |||||||||
| エム (μL) | 10 | 10 | 10 | 15 | |||||||||
| D_1 | CMGF+ R/G | 12.50 | 13 | 11.57 | 12.83 | 13 | 4.50 | 11.83 | 11.5 | 12.91 | 12.08 | 13 | 12.46 |
| CMGF+ | 17.08 | 17 | 16.26 | 18.50 | 19 | 4.89 | 18.42 | 19 | 14.54 | 17.82 | 19 | 8.99 | |
| D_2 | CMGF+ R/G | 13.67 | 14 | 13.36 | 13.00 | 13 | 12.70 | 14.00 | 14.5 | 17.23 | 13.08 | 13 | 8.90 |
| CMGF+ | 15.50 | 15 | 18.56 | 17.50 | 18 | 10.48 | 17.50 | 19 | 20.89 | 17.00 | 17 | 14.41 | |
| トータル | CMGF+ R/G | 13.08 | 13 | 13.13 | 12.92 | 13 | 9.39 | 12.92 | 13 | 17.52 | 12.58 | 13 | 11.22 |
| CMGF+ | 16.29 | 16.5 | 17.69 | 18.00 | 18.5 | 8.35 | 17.96 | 19 | 17.65 | 17.43 | 17 | 11.70 | |
| 死亡=オルガノイド質量の50%以上が生存不能である | |||||||||||||
表3:生存率実験結果 実験は、2つのオルガノイド培養物の構造的支持または栄養の剥奪に基づいていた。結果には、個々のイヌにおける可溶化ECMおよび培地の個々の濃度の平均、中央値、および標準偏差(CV%)が含まれる。
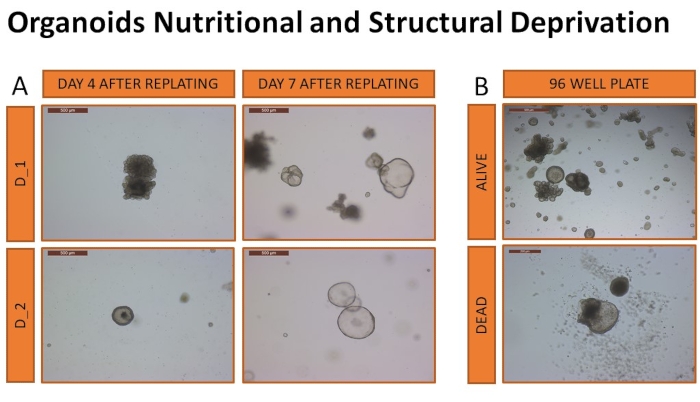
図10:オルガノイドの栄養的および構造的剥奪。 オルガノイドを24ウェルプレートで再播種し、剥奪後の膨張能を確認した(A)。再めっき後4日目および7日目の代表的な画像は、オルガノイドの膨張を示し、生存可能なオルガノイドを視覚的に識別する能力を確認した(画像は5倍の客観的倍率で撮影される)。生きている、または死んでいると考えられるオルガノイドの代表的な画像は、(B)に見られる。画像は5倍の対物倍率で撮影されます。 この図の拡大版を表示するには、ここをクリックしてください。

図8:肝スフェロイド RNAin situ ハイブリダイゼーション代表的な画像。 LGR5、KRT7、FOXA1、およびCYP3A12マーカーの代表的な画像を、継代後2〜7日目のサンプルの60倍の客観的倍率で撮影した。陽性のmRNA分子は赤色に染色する。AQP1はサンプルでは発現していなかった。 この図の拡大版を表示するには、ここをクリックしてください。
| 不完全キレート溶液(ICS)組成物 | 最終濃度 |
| 500 mL H2O | ティッカー |
| 2.49 グラム Na2HPO4-2H2O | 4.98 ミリグラム/mL |
| 2.7グラムKH2PO4 | 5.4 ミリグラム/ミリリットル |
| 14グラム NaCl | 28 ミリグラム/ミリリットル |
| 0.3 グラム KCl | 0.6 ミリグラム/mL |
| 37.5グラムスクロース | 75ミリグラム/ミリリットル |
| 25 g D-ソルビトール | 50 ミリグラム/ミリリットル |
| 完全キレート溶液(CCS)組成物 | V/V % または最終濃度 |
| 不完全なキレート化溶液 | 20% |
| 滅菌H2O | 80% |
| ティッカー | 520 μM |
| ペンストレップ | ペン: 196 U/mL;ストレップ 196 ug/mL |
| オルガノイド培地組成物 | 最終濃度 |
| 高度な DMEM/F12 | ティッカー |
| ティッカー | 8% |
| グルタマックス | 2ミリオンユーロ |
| ヘーペス | 10ミリオンメートル |
| プリモシン | 100 μg/mL |
| B27サプリメント | 1倍速 |
| N2サプリメント | 1倍速 |
| N-アセチル-L-システイン | 1 ミリオン |
| マウスEGF | 50 ng/mL |
| マウス・ノギン | 100 ng/mL |
| ヒト R-スポンディン-1 | 500 ng/mL |
| マウスWnt-3a | 100 ng/mL |
| [Leu15]-ガストリンI.ヒト | 10 ナノメートル |
| ニコチンアミド | 10ミリオンメートル |
| A-83-01 | 500 nM |
| SB202190 (P38阻害剤) | 10 μM |
| TMS(トリメトプリムスルファメトキサゾール) | 10 μg/mL |
| 追加コンポーネント | 最終濃度 |
| ロック防止剤(Y-27632) | 10 μM |
| ステモレキュラー CHIR99021 (GSK3β) | 2.5 μM |
| 凍結培地組成物 | V/Vパーセント |
| オルガノイド培地及びROCK阻害剤 | 50% |
| ティッカー | 40% |
| ジメチルスルホキシド(DMSO) | 10% |
| FAAの構成 | V/Vパーセント |
| エタノール (100%) | 50% |
| 酢酸、氷河 | 5% |
| ホルムアルデヒド (37%) | 10% |
| 蒸留水 | 35% |
表1:溶液および媒体の組成。 不完全および完全なキレート溶液、CMGF+(オルガノイド媒体)、凍結媒体、およびFAAの成分および濃度のリスト。
補足表1:オルガノイドケアテンプレート。このテンプレートは、毎日正確で再現可能なオルガノイドメモを取ることを可能にします。 この表をダウンロードするには、ここをクリックしてください。
補足表2:RNAin situ ハイブリダイゼーションプローブ。 RNA in situ ハイブリダイゼーション技術を実行する技術の製造業者によるイヌmRNA標的用に特別に設計されたプローブのリスト。個々のマーカーの有意性、プローブの名前、その参照番号、およびターゲット領域に関する情報がリストされています。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
現在、犬の肝臓および腸のオルガノイドの単離および維持に利用可能な標準化されたプロトコルが不足している。オルガノイド培養の標準操作手順を確立することは、このモデルが異なる実験室設定で適用可能であることを保証する。具体的には、これらのイヌオルガノイドモデルの培養に標準化された動作プロトコルを提供することは、培養および継代中のオルガノイドの正常な成長を特徴付け、拡張および維持のための最適なタイムポイントを導き出すための鍵となる。プロトコールを用いて培養されたイヌ腸管オルガノイドは、チャンドラらによって以前に特徴付けられてきた12。
プロトコルの最も重要なステップの1つは、オルガノイドの継代である。肝スフェロイドの最初の通過のための最適時間は、肝スフェロイド測定に基づいて単離後7日目であると決定された。スフェロイドの最大体積は7日目までに達成され、同時にスフェロイドは芽を出し始め、肝臓オルガノイドを形成した。単離後2〜7日目からの全体的なオルガノイド体積の増加は365倍以上であり、最適な通過時間がイヌ腸オルガノイド培養よりも長いことを示唆している。培養7日後、肝臓スフェロイドにおける細胞アポトーシスの肉眼徴は、洗浄または継代を行わなくても観察されなかった(図7)。腸および肝臓オルガノイドの継代は、細胞の喪失および生存率の変化につながる可能性があるため、困難な場合があります。この結果は、肝オルガノイドとトリプシン様プロテアーゼとの長期インキュベーション(最大12分)が継代培養に悪影響を及ぼさないことを示している。オルガノイドをトリプシン様プロテアーゼ中で24分より長くインキュベートすることは、オルガノイドのその後の継代培養に有害であり得る。
オルガノイド継代を伴う細胞集塊の最適でない切断の場合、トリプシン様プロテアーゼによる長時間のインキュベーションの代わりに機械的解離がより有益であり得る。オルガノイドの適切な解離に問題が発生した場合、サンプルの短時間のボルテックス処理が、通過収率を高めるために試みられ得る。一方、ボルテックスは培養物を台無しにし、細胞に損傷を与える可能性があるため、他の手順が繰り返し失敗した場合にのみ使用してください。肝臓オルガノイドを単一細胞に分解すると、オルガノイドの増殖速度が低下しますが、細胞のクラスターに分解すると、生存率が大幅に向上します。オルガノイドプロトコールのインキュベーション時間として10分を選択した。12分間のインキュベーション時点は、トリプシン様プロテアーゼ実験における24分間のインキュベーションと比較して細胞毒性がないとみなされた。
生存可能性実験は、犬の肝臓オルガノイドが不利な条件(構造的および栄養的枯渇)で最大19.5日間生存できることを確認した。これらの条件を最も長く生存したオルガノイドは、CMGF+培地で培養した。この観察は、Rock阻害剤およびGSK3βを補充していない培地中の肝臓オルガノイドの遅い成長によって引き起こされた可能性がある。CMGF+ R/Gを用いたオルガノイド培養は、より速く成長し、資源をより早く枯渇させた可能性がある。この実験は、イヌオルガノイド培養を小型化し、ハイスループットなシステム変換を実現する可能性を開きます。このような技術は、大幅に低減されたコストで創薬または毒物学研究を促進する可能性を示している。
イヌオルガノイド培養の維持中に遭遇するいくつかの一般的な問題は、めっき時の不適切なサンプル凝固、培養汚染、およびオルガノイドの適切な密度およびサイズの確立である。可溶化ECMがめっき中に早期に固化した場合は、直ちに氷上に10分間置く。可溶化ECMがドーム様構造を形成しない場合、試料から除去された培地が十分でない可能性がある。この場合、ドームが形成されるまで、より可溶化されたECMでサンプルを希釈する。
プレート全体に真菌または細菌の汚染が見つかった場合( 図4参照)、最善の解決策はプレートを廃棄することです。抗真菌薬または抗生物質薬による治療を試みることができるが、そのような試みの成功は非常に低い。1つのウェルがプレート内で汚染されている場合、生存可能で影響を受けていないウェルを新しいプレートに洗浄し(ステップ4.1〜4.5に従ってください)、注意深く監視することができます。サンプルがすでに緊急凍結されている場合は、サンプルを解凍するとインキュベーターが追加の汚染リスクにさらされるため、サンプル全体を廃棄することをお勧めします。
健康なオルガノイド培養は、少なくとも中規模および中密度のカテゴリー以上でなければならない。最適な密度は、オルガノイド培養の成長に不可欠です。低密度は、オルガノイドを中密度に洗浄することによって補正されなければならない。極端な密度の状況(過密状態)が発生した場合、オルガノイドはより多くの井戸に拡張されるべきである。細胞アポトーシスの肉眼的徴候は、しばしばオルガノイド培養の過密状態および低密度の両方を伴う。これらの問題が時間内に修正されなければ、オルガノイド培養全体が数日でアポトーシスに変わります。オルガノイドが特大サイズまたは非常に高い密度を達成する場合、培養物を実験、凍結、または固定に使用するべきである。
オルガノイド培地は現在17の成分を含み、したがって、オルガノイドの維持および拡大に必要な成長因子の添加は高価であり得る。この問題は、成長因子を合成して馴化CMGF+を産生する2D細胞培養物を増殖させることによって解決することができる。細胞培養L-WRNは、Wnt-3a、R-スポンジン-3、およびノギン増殖因子37を産生する。細胞コロニーは、90%DMEM/F12および10%FBS培養培地を使用する。培養物が90%のコンフルエントを達成すると、培地は1週間毎日収穫される。次いで、収穫した培地を2x CMGF+(これらの成長因子を含まない)と混合する。2D 培養では、必要な成長因子をわずかなコストで生産できますが、培地を製造するための時間と準備の追加を期待する必要があります。馴化培地バッチ間の成長因子の濃度も異なる可能性がある37,38。
犬の成体幹細胞由来オルガノイド培養は、One Health Initiativeの目標達成に役立つユニークな生物医学モデルです39。オルガノイド技術は、発生生物学、病態生理学、創薬・検査、毒物学から感染症や再生医療の研究まで、多くの基礎研究および生物医学研究分野で使用することができます40。トランスレーショナル研究と逆トランスレーショナル研究は、どちらもイヌオルガノイドが適用可能な分野です15。犬は何世紀にもわたって翻訳実験環境で使用されてきました、そして彼らのコンパニオンアニマルの地位はまた獣医学で最も探求された種の1つとしての彼らの地位を促進しました。
結論として、この原稿は、様々な生物医学分野でのこのモデルの適用を容易にするために、イヌ肝臓および腸オルガノイドの単離、維持、収穫、およびバイオバンキングのための標準化された動作プロトコルを提供する。このモデルは、知識の学際的および学際的な共有を促進するためのOne Health Initiativeのツールとして、逆トランスレーショナル研究を促進するのにユニークに適しています。
開示事項
K. Allenspach は、LifEngine Animal Health と 3D Health Solutions の共同設立者です。彼女はCeva Animal Health、Bioiberica、LifeDiagnostics、Antech Diagnostics、Deerland Probiotics、Marsのコンサルタントを務めています。J. P. Mochel は、LifEngine Animal Health と 3D Health Solutions の共同設立者です。モシェル博士は、Ceva Animal HealthとEthos Animal Healthのコンサルタントを務めています。他の著者は、宣言する利益相反を持っていません。
謝辞
著者らは、アイオワ州立大学の獣医診断研究所の職員、すなわちヘイリー・M・ランバート、エミリー・レイエ、ロザリン・M・ブラナマン、ビクトリア・J・グリーン、ジェニファー・M・グロールツ・ツグミに、提供されたサンプルのタイムリーな処理に感謝の意を表したいと考えている。著者らは、教員スタートアップ、ISU VPR Miller Award、ISU VPR Miller Award、NSF SBIR sub AwardからISU # 1912948への支援に感謝したいと考えている。
資料
| Name | Company | Catalog Number | Comments |
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
参考文献
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? - Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA - Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal - Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved