Method Article
体外 使用纯化的重组 果蝇 半胱天冬酶进行底物筛选的切割测定
摘要
在这里,我们提出了一种表达和纯化重组 果蝇 半胱天冬酶Dronc和Drice的方案,以及它们在 体外 切割测定中的应用。
摘要
半胱天冬酶是非常特异性的细胞死亡蛋白酶,参与凋亡和非凋亡过程。虽然半胱天冬酶在细胞凋亡中的作用已经非常明确,并且已经鉴定和表征了许多半胱天冬酶的凋亡蛋白水解底物,但半胱天冬酶对非凋亡过程的作用尚不清楚。特别是,到目前为止,已经鉴定出很少的半胱天冬酶的非凋亡底物。在这里,为了便于鉴定和表征潜在的半胱天冬酶底物,描述了一种允许在 体外半 胱天冬酶裂解测定中测试候选底物的方案。该方案包括重组半胱天冬酶蛋白的生产和纯化,重组或在无细胞表达系统中生产候选底物,以及实际的 体外 切割反应,然后是SDS-PAGE和免疫印迹。该协议是为 果蝇 半胱天冬酶Dronc和Drice量身定制的,但可以很容易地适用于其他生物体(包括哺乳动物)的半胱天冬酶。
引言
程序性细胞死亡或凋亡由一类高度特化的细胞死亡蛋白酶执行,称为半胱天冬酶(参见参考文献1)。半胱天冬酶是在催化位点含有Cys残基的Cys蛋白酶。他们已经确定了共识切割位点,并在Asp残基后蛋白水解底物(尽管据报道果 蝇 半胱天冬酶Dronc在Glu残基2之后裂解)。它们细分为引发剂(也称为顶端或上游)和效应器(刽子手或下游)半胱天冬酶。引发性半胱天冬酶激活效应半胱天冬酶。例如,在哺乳动物中,引发半胱天冬酶半胱天冬酶-9裂解并激活半胱天冬酶-33。同样,在 黑腹果蝇中,半胱天冬酶-9-直系同源物Dronc切割并激活半胱天冬酶-3-直系同源物Drice2,4。在细胞凋亡过程中,效应半胱天冬酶切割数百种底物,导致细胞死亡5。
半胱天冬酶在细胞中合成为无活性的前酶(酶原)。在这种形式中,它们包含一个N末端前结构域,一个大亚基,在酶的中央部分具有催化Cys,在C末端1处包含一个小亚基(图1)。引发半胱天冬酶和效应半胱天冬酶的激活机制不同。引发剂半胱天冬酶(半胱天冬酶-9,Dronc)需要二聚化才能激活,其通过掺入称为凋亡体6的大型蛋白质复合物中发生。为了掺入凋亡体,Caspase-9和Dronc在N端前结构域中携带半胱天冬酶活化和募集结构域(CARD)(图1)。细胞凋亡体成分Apaf-1还包含一个CARD,并通过CARD/CARD相互作用将Caspase-9或Dronc募集到细胞凋亡体3,6,7中。虽然半胱天冬酶-9和Dronc可以在凋亡体中进行蛋白水解处理,但酶活性8,9并不完全需要这种处理。
相反,效应半胱天冬酶(半胱天冬酶-3,Drice)在其前域中不携带CARD,并且不掺入大型蛋白质复合物中以进行活化1。它们分别依赖于活性半胱天冬酶-9或Dronc1的蛋白水解裂解。活性效应半胱天冬酶形成由两个大亚基和两个小亚基组成的四聚体,因此包含两个催化位点(图1)。对于该协议来说,重要的是,大肠杆菌中半胱天冬酶的重组表达导致半胱天冬酶的自动处理和激活,包括Drice10和Dronc2,8,9,11,12,即使没有Apaf-1。这种自动处理允许使用重组半胱天冬酶蛋白对候选底物进行体外切割测定。
半胱天冬酶不仅参与细胞凋亡,而且还具有许多非凋亡功能,包括增殖、分化、细胞迁移、神经元修剪、先天免疫等13,14,15。目前尚不清楚尽管在非凋亡过程中含有活性半胱天冬酶,细胞如何存活。这些细胞可能仅在亚致死水平16激活半胱天冬酶,或者它们将活性半胱天冬酶隔离在细胞的非凋亡区室中,例如质膜17,18。因此,非凋亡底物的鉴定和验证不仅将揭示半胱天冬酶如何介导非凋亡过程,而且还可能有助于了解细胞如何在活性半胱天冬酶存在下存活。
作为半胱天冬酶底物的候选蛋白质可以使用遗传和生化方法鉴定。可以检查鉴定出的蛋白质是否存在共识Dronc切割位点。这可以通过目视检查蛋白质序列或使用更复杂的在线生物信息学工具(如CasCleave(https://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)19,20)来完成。这些工具使用半胱天冬酶的已知共识切割位点和结构考虑来预测半胱天冬酶的新靶标。虽然CasCleave结合了来自人类半胱天冬酶-1,-3,-6,-7和-8的经过验证的底物的信息,但它也可能用于此处描述的目的,因为这些半胱天冬酶及其共识切割位点保存良好。然而,由于Dronc切割位点尚未明确(两项研究确定了两种不同的最佳裂解位点,TATD/ E 2 和LALD9),因此还检查候选底物是否存在其他半胱天冬酶切割位点,包括Drice。
为了验证半胱天冬酶的预测底物,需要额外的测定。其中一种测定是证明给定的半胱天冬酶实际上可以在 体外切割候选蛋白质。在这里,我们为 体外 半胱天冬酶切割测定提供了一种方便的方案。使用该协议,使用Dronc作为半胱天冬酶测试候选底物。它们也可以作为Drice的基质进行测试。虽然该协议是为 果蝇 半胱天冬酶Dronc和Drice编写的,但它也可以适用于其他生物的半胱天冬酶。
Dronc和Drice的提取和纯化以及体外切割测定必须在同一天进行,因为这些半胱天冬酶的催化活性丧失。该协议已从以前的出版物8,9,11,12,21,22进行了修改和优化。在该协议中,四种不同的半胱天冬酶蛋白在大肠杆菌菌株BL21(DE3)pLysS中重组表达。这些蛋白质是:6xHis-Dronc wt,6xHis-DroncC318A,6xHis-Dricewt和6xHis-DriceC211A。这些蛋白质中的每一个在N末端标记6个组氨酸残基(6xHis)以进行纯化。Dronc wt和Dricewt是野生型蛋白,可以在重组表达时自动加工成活性半胱天冬酶。DroncC318A和DriceC211A编码Dronc和Drice的突变形式,将催化Cys残基变为Ala残基。这些结构在催化上是无活性的,不能自动处理(见图2A)。它们用作切割测定中的对照。由于DriceC211A不能自动处理,因此在这里描述的体外切割测定中,它也被用作Droncwt的模型底物。
研究方案
1. 重组半胱天冬酶在细菌中的表达
- 使用标准方案将目的基因(半胱天冬酶或推定底物)克隆到具有N和/或C末端标签的细菌表达载体中23。
注意:标签可以增加重组蛋白的溶解度,并用于重组蛋白的纯化。在这里,Dronc,Drice及其催化突变体被克隆到载体pET28a中,该载体提供N-末端6xHis标签(pET28a-6xHis-Dronc wt,pET28a-6xHis-Dronc C318A,pET28a-6xHis-Dricewt,pET28a-6xHis-Drice C211A);(引物信息见补充表1)。 - 使用标准程序将具有目标基因的载体转化为感受态BL21(DE3)pLysS 大肠杆菌细胞23,24。用适当的抗生素(pET28a为卡那霉素)将转化混合物铺在LB琼脂平板上,以选择转化的细菌。(请参阅补充表2。
- 从平板中选择一个菌落,并接种在含有适当抗生素的5mLLB培养基中,以在37°C下以220rpm在振荡平台上生长过夜。
- 第二天,用抗生素制备 30-50 mL(每个样品)LB 培养基,并加入 1 mL 过夜生长的培养物。使用生物光度计/分光光度计的600nm(OD600)的光密度应在0.1和0.2之间。
- 在振荡平台上以220rpm在37°C下生长培养物,直到OD600 达到0.6。每小时检查一次 OD600 ,直到达到 0.6。这大约需要 2 到 3 小时。
- 为了诱导蛋白质(半胱天冬酶)表达,加入IPTG至终浓度为0.1-0.2mM(从IPTG储备液中稀释1:1,000-1:500,见 补充表2)。
- 将培养物在30°C以220rpm生长3小时。
注意:时间和温度取决于表达的蛋白质种类及其溶解度。如果表达不同的半胱天冬酶或底物,则可能需要调整这些条件。 - 3小时后,在4°C以2,000× g离心50mL离心管中旋转培养物20分钟。弃去上清液并继续沉淀。
注意:此时可以停止协议,稍后继续。细菌沉淀可以在-80°C下冷冻。
2. 小规模重组半胱天冬酶提取
- 从-80°C储存中取出带有沉淀培养物的冷冻管,并将其保持在冰上10分钟以软化沉淀。
- 10分钟后,使用带有1 mL血清移液管的移液器控制器将补充有新添加的蛋白酶抑制剂,10mg / mL溶菌酶和50 U / mL苯并酶的细菌细胞裂解缓冲液(补充表2)加入含沉淀的管中。
- 使用相同的移液器吸头,通过上下移液溶解沉淀,直到可见没有任何颗粒的透明淡黄色溶液。在冰上孵育30分钟。
- 将裂解物转移到适当的离心管中,并在4°C下以17,000× g 离心裂解物40分钟。
- 将上清液转移到 1.5 mL 微量离心管中。这是含有半胱天冬酶的粗提取物。
- 将试管放在冰上,然后用Ni-NTA琼脂糖进行纯化。
3. 小规模His标记的半胱天冬酶纯化
- 将0.2mL的50%Ni-NTA琼脂糖浆液加入步骤2.5的半胱天冬酶提取物的每个管中。在4°C下在端到端旋转器上旋转管1小时。
- 1小时后,将带有Ni-NTA琼脂糖的提取物加入1mL聚丙烯柱中,尖端完好无损,置于架子中。静置5分钟。
- 5分钟后,取下柱盖,让上清液通过重力流出。
- 小心地将1 mL洗涤缓冲液(补充表2)加入色谱柱中,不要干扰Ni-NTA琼脂糖的填充树脂,并通过重力流洗涤。
- 执行三次洗涤步骤。
- 为了洗脱半胱天冬酶,在完全排出洗涤缓冲液后,将1.5 mL微量离心管置于色谱柱的收集喷嘴下方。
- 向每根色谱柱中加入 0.5 mL 洗脱缓冲液(使用前立即补充 1x 蛋白酶抑制剂),并将洗脱液收集在 1.5 mL 微量离心管中。
注意:精细纯化的洗脱液将是透明的。 - 将洗脱液保持在冰上,并通过布拉德福德测定法25测量蛋白质的浓度。通过SDS-PAGE确认纯化的半胱天冬酶的纯度/均匀性,然后进行考马斯蓝染色26。
注意:50 mL LB 培养物的产量范围在 0.5 至 1.5 mg 半胱天冬酶蛋白之间。假设洗脱液使用0.5 mL洗脱缓冲液,则浓度范围为1至3 mg/mL。重要的是在裂解和纯化的同一天使用纯化的半胱天冬酶洗脱液进行 体外 切割测定,因为这些半胱天冬酶制剂在夜间失去活性。
4. 假定的半胱天冬酶底物在无细胞表达系统中的表达
注意:在本协议中,Dronc的天然底物Drice通过 大肠杆菌 中的重组表达(见上文第3节)和兔网织红细胞裂解物(RRL)中的表达制备,这是一种哺乳动物无细胞表达系统(本节,见下文)。
- 使用标准程序将推定底物的基因克隆到含有 T7、T3 或 SP6 启动子的表达载体中23。
注意:在该协议中,DriceC211A 被用作模型底物,并被克隆到载体pT7CFE1-N-Myc中,该载体携带用于基因表达的T7启动子,并用N端Myc标签标记假定的蛋白质底物,以便通过免疫印迹进行检测。 - 在RRL中,候选底物可以放射性或非放射性合成。
- 非放射性合成:在 0.5 mL 微量离心管中,加入 25 μL RRL、2 μL 反应缓冲液、0.5 μL 氨基酸混合物 - 减去亮氨酸 (1 mM)、0.5 μL 氨基酸混合物 - 减去蛋氨酸 (1 mM)、1 μL 核糖核酸酶抑制剂 (40 U/μL)、2 μL DNA 模板 (0.5 μg/μL) 和 1 μL T7-RNA 聚合酶。加入无核酸酶水,将反应的最终体积调节至 50 μL。 通过移液或用移液器吸头搅拌轻轻混合组分,然后短暂旋转。
注意:RRL裂解物含有100-200mg / mL的内源性蛋白质。对于 体外 翻译反应,加入 50% 浓度的 RRL(此处为 25 μL/50 μL 反应)。 - 放射性合成:在 0.5 mL 微量离心管中,加入 25 μL RRL 裂解物、2 μL 反应缓冲液、0.5 μL 氨基酸混合物减去蛋氨酸 (1 mM)、1 μL 核糖核酸酶抑制剂 (40 U/μL)、2 μL DNA 模板 (0.5 μg/μL)、2 μL S35 标记的蛋氨酸(10 mCi / mL 时为 1000 Ci/mmol)和 1 μL T7-RNA 聚合酶。加入无核酸酶水,将反应的最终体积调节至 50 μL。 通过移液或用移液器吸头搅拌轻轻混合组分,然后短暂旋转。将尖端和管子丢弃在放射性废物容器中。
注意:不要添加不含亮氨酸的氨基酸混合物。pT7CFE1载体使用T7启动子进行蛋白表达。其他载体使用 T3 或 SP6 启动子。在这种情况下,应使用T3或SP6 RNA聚合酶代替T7 RNA聚合酶。请确保DNA模板纯度高。
- 非放射性合成:在 0.5 mL 微量离心管中,加入 25 μL RRL、2 μL 反应缓冲液、0.5 μL 氨基酸混合物 - 减去亮氨酸 (1 mM)、0.5 μL 氨基酸混合物 - 减去蛋氨酸 (1 mM)、1 μL 核糖核酸酶抑制剂 (40 U/μL)、2 μL DNA 模板 (0.5 μg/μL) 和 1 μL T7-RNA 聚合酶。加入无核酸酶水,将反应的最终体积调节至 50 μL。 通过移液或用移液器吸头搅拌轻轻混合组分,然后短暂旋转。
- 将反应在30°C孵育90分钟。
- 短暂旋转10秒,然后将试管放在冰上。通过SDS-PAGE和免疫印迹/放射自显影检查RRL中推定底物的表达水平。
注意:添加到切割反应中的RRL提取物的量应基于检测方法(免疫印迹或S35 放射自显影)可以检测到的蛋白质量。进行 体外 切割测定(下一节)或将其储存在-80°C。
5. 用RRL生成的底物进行 体外 切割测定
- 取生成的推定底物,如第4节所述。在该协议中,N-Myc-DriceC211A 用作模型底物。
- 根据推定底物的表达水平(通过免疫印迹或放射自显影分析分别确定,参见步骤4.4),使用1-10μL在切割测定中用目标蛋白质编程的RRL。
- 加入 10 μg 在第 1、2 和 3 节中产生的纯化半胱天冬酶蛋白。
- 用半胱天冬酶测定缓冲液使总反应体积达到50μL。
- 将反应在30°C的水浴中孵育3小时。确保在切割测定中包括适当的对照。在这里,催化突变体DroncC318A 用作对照。
- 3小时后,通过将试管转移到冰上来停止反应。
- 加入一体积含有 50 mM DTT 的 LDS 样品缓冲液。加入LDS样品缓冲液后完全停止反应。
- 将样品在75°C的加热块中孵育10分钟。
- 快速旋转,轻弹混合,每个样品上样 24 μL 并运行 SDS-PAGE(参见第 7 节)或将样品储存在 -20 °C。
6.用细菌表达的重组底物蛋白进行 体外 切割试验
- 将 10 μg 纯化的候选底物(此处为 6xHis-DriceC211A,在第 1、2 和 3 节中生成)加入 0.5 mL 微量离心管中。
- 加入10μg在第1节和第2节中产生的纯化的半胱天冬酶蛋白。使用半胱天冬酶测定缓冲液使总体积达到 50 μL。
- 按照步骤 5.5 到 5.9 操作。
7. SDS-PAGE和免疫印迹
- 将切割反应(24μL)加载到4%-12%Tris-甘氨酸或Bis-Tris梯度凝胶上(材料表),并进行蛋白质电泳和免疫印迹(如果使用S35标记的底物,则进行放射自显影)以使用标准程序可视化结果27,28。
注意:在此协议中,使用了带有Mops电泳缓冲液和LDS上样缓冲液的Bis-Tris梯度凝胶。通常,Tris-甘氨酸凝胶常用的PAGE方案使用Tris-甘氨酸-SDS电泳缓冲液和SDS上样缓冲液运行良好。
结果
该协议为大肠杆菌中的半胱天冬酶诱导,重组果蝇半胱天冬酶Dronc和Drice的纯化,候选底物的合成以及与候选底物(此处为DriceC211A)和半胱天冬酶Dronc的体外切割反应提供了分步说明。在该测定中,催化突变体DriceC211A用作模型底物,因为它不具有自动处理活性(图2A),并且在被Droncwt切割之前保持全长。DriceC211A应始终用作阳性对照,以验证Droncwt制剂是否具有酶活性。
图2A提供了重组半胱天冬酶表达和纯化的代表性实例。诱导和纯化四种不同的重组半胱天冬酶:6xHis-Dronc wt、6xHis-DroncC318A、6xHis-Dricewt和6xHis-DriceC211A。纯化的半胱天冬酶由SDS-PAGE运行,免疫印迹,并用抗His抗体(稀释1:5,000;然后是抗小鼠IgG,HRP连接抗体(1:10,000))探测印迹。未加工的6xHis-Dronc(proDronc)的相对分子量(MW r)为55 kDa(泳道2),未加工的6xHis-Drice(proDrice)的MWr为35 kDa(泳道4)。半胱天冬酶的自动处理可以通过较小MWr的条带的出现可见,由于N末端存在His标签,因此代表了半胱天冬酶的大亚基(图1)。在6x-Dronc的情况下,大型亚单元的MWr为40 kDa(车道1)。6x-Drice的大型亚基以23 kDa(车道3)运行。催化突变体6xHis-DroncC318A和6xHis-DriceC211A无法自动处理,只能检测为全长蛋白质(泳道2和4)。
图2B为了证明细菌产生和纯化的6xHis-Droncwt制剂具有酶活性,进行了本协议中所述的体外切割测定。作为阴性对照,使用催化突变体6xHis-DroncC318A。底物是RRL生成的N-Myc-DriceC211A,其在N末端用Myc标签标记。体外切割反应后,通过SDS-PAGE分离蛋白质,免疫印迹,并将印迹与抗Myc抗体(1:1,000稀释)一起孵育,然后使用抗小鼠IgG,HRP连接抗体(1:10,000))检测N-Myc-DriceC211A。与底物的全长、未加工形式相比,至少出现一个较小MWr的条带,可以证明半胱天冬酶的成功切割和因此的酶活性。未加工的全长N-Myc-Drice C211A的MWr为40 kDa(泳道2和4),而加工过的N-Myc-DriceC211A的大亚基以30 kDa(泳道3)运行。泳道 1 代表未编程的 RRL 裂解物(未添加质粒/转录本)。泳道 2 展示了通过 RRL 表达体外生产 DriceC211A。泳道 3 包含与 6xHis-Droncwt 的体外裂解反应。泳道 4 包含与 6xHis-DroncC318A 的体外裂解反应。
图2C根据该协议使用重组和纯化的半胱天冬酶(6xHis-Droncwt和6x-His-DroncC318A)和底物(6xHis-DriceC211A)的体外切割反应,通过SDS-PAGE和免疫印迹进行分析。为了分析切割反应,在该免疫印迹中使用抗裂解的Drice抗体(稀释1:5,000;然后是抗兔IgG,HRP连接抗体(1:10,000))。抗裂解的Drice抗体仅在通过6xHis-Droncwt(泳道1)处理后才能在6xHis-DriceC211A的大亚基(23 kDa)中检测其新表位。催化突变体6xHis-DroncC318A在该测定中无法处理6xHis-Drice C211A,全长6xHis-DriceC211A显示为35 kDa的微弱未加工带(泳道2)。
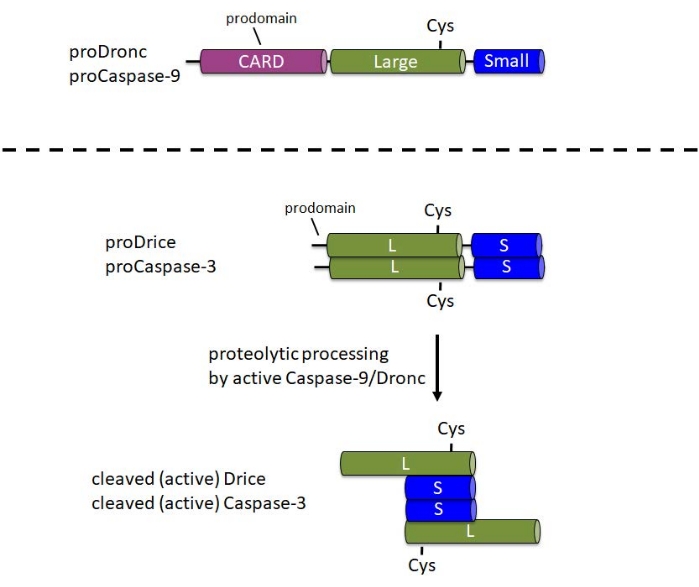
图1:引发剂半胱天冬酶-9和Dronc以及效应半胱天冬酶-3和Drice的结构域结构。卡 - 半胱天冬酶活化和募集领域;Cys - 催化半胱氨酸残基的相对位置;L - 大亚单位;S - 小亚单位。指示了N端前结构域的位置。请点击此处查看此图的大图。
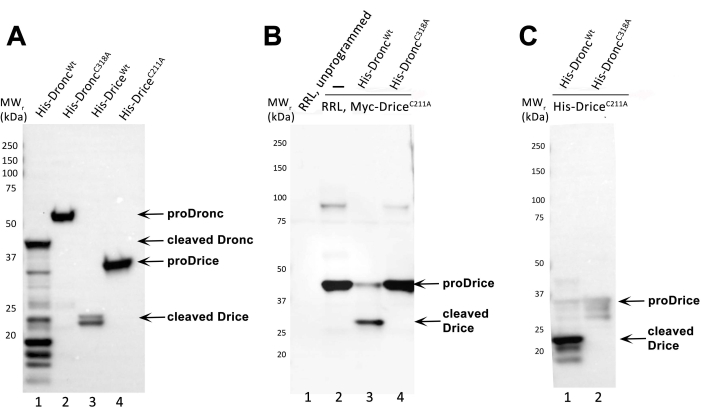
图2:代表性结果。 (A)用抗His抗体探测的纯化重组6xHis-Dronc和6xHis-Drice制剂的免疫印迹分析。未加工(proDronc和proDrice)和切割的6xHis-Dronc和6xHis-Drice用箭头表示。MW 标记显示在左侧。(B)RRL生成的N-Myc-Drice与半胱天冬酶6xHis-Droncwt(泳道3)或6x-His-DroncC318A(泳道4)用抗Myc抗体探测的体外切割反应的免疫印迹分析。未编程和编程(N-Myc-DriceC211A)RRL反应在泳道1和2中加载和分离。未加工(proDrice)和裂解的N-Myc-Drice用箭头表示。MW 标记显示在左侧。(C)细菌表达和纯化的重组6xHis-Drice C211A与半胱天冬酶6xHis-Droncwt(泳道1)或6x-His-DroncC318A(泳道2)的体外切割反应的免疫印迹分析,用抗裂解的Drice抗体探测。全长(proDrice)和切割的6xHis-DriceC211A用箭头表示。MW 标记显示在左侧。请点击此处查看此图的大图。
补充表1: 该表包含用于在pET28a载体中克隆的引物。 请点击此处下载此文件。
补充表2: 此表包含缓冲区和媒体的组成。 请点击此处下载此文件。
讨论
我们关于半胱天冬酶和半胱天冬酶功能的大部分知识都来自过去三十年来细胞凋亡的紧张工作。已经非常确定,引发剂半胱天冬酶蛋白水解处理效应半胱天冬酶,并且在细胞凋亡期间已经鉴定出数百种蛋白质作为效应半胱天冬酶底物5,29。相比之下,关于半胱天冬酶对非凋亡过程的功能以及它们正在处理哪些非凋亡底物知之甚少。可以想象,引发者半胱天冬酶是这里的关键决策者。在细胞凋亡过程中,它们激活效应半胱天冬酶,导致细胞死亡。然而,为了触发非凋亡过程,它们可能会激活控制非凋亡过程的不同蛋白质(效应半胱天冬酶除外)。该协议测试候选蛋白质作为 果蝇17,30中引发剂半胱天冬酶Dronc的底物。
在切割测定中测试的底物可以在 体外 哺乳动物无细胞表达系统(如RRL)中或通过 大肠杆菌中的重组表达产生。与细菌表达相比,使用RRL进行 体外 表达有几个优点。RRL表达方案简单快速,允许并行制备许多不同的底物。在许多情况下,含有目标蛋白质的RRL提取物可以在用于切割测定之前储存在-80°C(尽管这需要为每个底物单独测定)。推定的底物可以用S35-Met标记,这使得在SDS-PAGE之后通过放射自显影轻松分析。如果没有底物特异性抗体可用,这尤其有用。或者,如果不需要S35-Met标记,则可以使用常用标签(例如Flag,HA或Myc标签)标记假定的底物,这允许通过免疫印迹检测半胱天冬酶切割。
需要强调的是,该方案的成功取决于重组Dronc和Drice蛋白的仔细和一致的纯化。不幸的是,这些蛋白质不能储存 - 即使是短期的 - 无论是在冰箱里还是冷冻。它们以任何储存形式在一夜之间失去酶活性。因此,它们需要在切割测定当天新鲜制备。无论测试的候选蛋白如何,DriceC211A都应始终用作阳性对照,以验证Droncwt制剂的酶活性(见图2B,C)。或者,Dronc和Drice制剂的活性也可以通过体外裂解荧光合成四肽底物2,9,31来测试。
如果使用抗体来检测候选底物,则需要由用户32,33对其进行验证。这也适用于检测表位标签(如Flag,HA,Myc或其他)的市售抗体。抗体质量差会掩盖重要结果。还建议在N端和C端对候选底物进行具有不同标签的双表位标记34。如果发生裂解,双重标记有助于追踪两种裂解产物,并可能有助于阐明裂解是否发生在一个或多个位点。
虽然该协议很容易验证Dronc,Drice的已知生物底物,但也存在局限性。一个限制是,这是一种具有重组蛋白的 体外 方案。在这些测定中,半胱天冬酶以非生理学高浓度存在,这从观察中可以明显看出它们可以在 大肠杆菌 中自发自动处理。在生理条件下,自发的自动处理通常不会发生。这种高半胱天冬酶浓度可能导致虚假活性,从而导致假阳性。假阳性可以通过降低 体外 裂解反应中的半胱天冬酶浓度来消除。此外,如下所述,需要额外的检测来确认真正的底物并消除假阳性。
重组半胱天冬酶可能不具有与体内正常细胞环境中相同的特异性。例如,半胱天冬酶的活性可以通过翻译后修饰来改变。这些不存在于重组蛋白上。此外,在体内,引发剂半胱天冬酶(包括Dronc)被掺入大型蛋白质复合物中,例如细胞凋亡体。在本协议的条件下,未实现细胞凋亡体的形成。这将需要重组表达果蝇Apaf-1(又名Dark或Hac-1)35-37,这本身也存在挑战。因此,在体外,Dronc可能不具有与体内相同的特异性。
也可以想象,Dronc被掺入不同的蛋白质复合物中,用于非凋亡过程。这可能赋予Dronc不同的切割特异性,这也可以解释为什么Dronc在非凋亡条件下不会诱导细胞凋亡。与此相关,CasCleave使用已知的切割共识位点来预测新的半胱天冬酶底物。然而,尚不清楚相同的切割共识位点是否也用于非凋亡过程。事实上,最近,研究表明,Caspase-3在雏鸡胚胎38发育的听觉脑干的非凋亡过程中改变了其首选的共识位点。同样,如果引发剂半胱天冬酶被掺入不同的蛋白质复合物中,它们可能具有不同的特异性,因此可能在不同的共识序列上切割。
这些局限性表明,仅仅依靠本协议中描述的体外切割测定是不够的。应采用替代方法来进一步验证使用该协议获得的结果。理想情况下,体内测定应用于解决以下问题:候选蛋白质是否在体内非凋亡过程中进行蛋白水解处理?如果是这样,体内和体外是否使用相同的切割位点?如果裂解被裂解位点的诱变阻塞,后果是什么?候选底物的加工是否依赖于半胱天冬酶,如果是,是哪一种?切割片段对非凋亡过程的作用是什么?这些问题可以在遗传模型生物(如秀丽隐杆线虫和果蝇)中使用标准的遗传和转基因方法轻松解决。
总之,该协议描述了一种可靠且一致的方法来产生酶活性半胱天冬酶,特别是 果蝇 半胱天冬酶Dronc和Drice。该协议的最终目标是检查Dronc是否可以 在体外切割通过遗传,生化或生物信息学方法鉴定的候选底物。如上一段所述,需要额外的测定来验证这些蛋白质作为 体内半胱天冬酶底物。鉴于半胱天冬酶基因在后生动物中的保守程度,应该有可能使该协议适应来自其他生物体的半胱天冬酶。
披露声明
作者声明没有竞争利益。
致谢
我们要感谢Elif Kamber-Kaya博士帮助在实验室中建立协议。Guy Salvesen博士慷慨地提供了DriceC211A 突变体9。这项工作由美国国立卫生研究院(NIH)国家普通医学科学研究所(NIGMS)的MIRA奖资助,授权号为2R35GM118330。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| Ampicillin | Fisher | BP1760-25 | |
| Anti-His antibody | Sigma-Aldrich | MA1-21315 | |
| Anti-mouse IgG, HRP-linked Antibody | Cell signaling | 7076P2 | |
| Anti-Myc antibody | Santa Cruz Biotechnology | sc-40 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell signaling | 7074P2 | |
| Benchtop Centrifuge | Eppendorf | 5415 R | |
| Benzonase | Sigma-Aldrich | E1014-5KU | |
| BioPhotometer | Eppendorf | #6131 | |
| BL21 (DE3) pLysS Competent Cells | Promega | L1195 | |
| Centrifuge rotor | Beckman Coulter | JA-25.50 | |
| CHAPS | Sigma-Aldrich | C3023-1G | |
| ChemiDoc with image software | Bio-Rad | Universal Hood II | For Chemiluminiscence imaging |
| Chemiluminiscence Substrate | Thermofisher Scientific | 34095 | For Chemiluminiscence imaging |
| Cleaved Drosophila ICE (drICE) (Asp230) Antibody | Cell Signaling Technology | 9478S | |
| Disposable cuvettes | Fisher Scientific | 14955128 | Used to measure bacterial growth and protein concentration |
| Dithiothreitol (DTT) | Bio-Rad | #1610610 | |
| Erlenmeyer flasks, 1000 mL | Millipore sigma | CLS49801L | For LB agar media preparation and autoclaving |
| Erlenmeyer flasks, 250 mL | Millipore sigma | CLS4980250 | For bacterial culture growth and induction. |
| Ethylene-diamine-tetra-acetic Acid (EDTA) | Sigma-Aldrich | E5134 | |
| Gel extraction kit | Qiagen | 28704 | |
| Gel tank SDS-PAGE system | Thermofisher Scientific | STM1001 | |
| Glycine | Sigma-Aldrich | G8898 | |
| Halt Protease Inhibitor Cocktail (100x) | Thermofisher scientific | 87786 | |
| HEPES | Sigma-Aldrich | H3375 | |
| His-Drice-pET28a | This study | N/A | Available from authors |
| His-DriceC211A-pET28a | This study | N/A | Available from authors |
| His-Dronc-pET28a | This study | N/A | Available from authors |
| His-DroncC318A-pET28a | This study | N/A | Available from authors |
| Imidazole | Sigma-Aldrich | I2399-100G | |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermofisher Scientific | FERR0392 | |
| Kanamycin | Fisher Scientific | BP906-5 | |
| LB Agar, Miller (Powder) | Fisher Scientific | BP1425-500 | |
| LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Lysozyme | Thermofisher Scientific | 90082 | |
| Microbiological plate incubator | Fisher Scientific | 11-690-650D | For colony growth after transformation |
| Microcentrifuge tubes, 0.5 mL | Eppendorf | 22363611 | |
| Microcentrifuge tubes, 1.5 mL | Eppendorf | 22363204 | |
| Midiprep kit | Qiagen | 12243 | |
| Mini tube rotator | Fisher Scientific | 05-450-127 | for mixing bacterial lysates and Ni-NTA agarose |
| Miniprep kit | Qiagen | 27106 | |
| Motorized Pipette Controller | Gilson | F110120 | For using serological pipettes |
| NaH2PO4 | Fisher Scientific | BP330-1 | |
| Ni-NTA Agarose | Qiagen | 30210 | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm, Midi Protein Gel, 20-well | Thermofisher Scientific | WG1402BOX | |
| NuPAGE LDS Sample Buffer (4x) | Thermofisher Scientific | NP0007 | |
| NuPAGE MOPS SDS Running Buffer (20x) | Thermofisher Scientific | NP0001 | |
| NuPAGE Transfer Buffer (20x) | Invitrogen | NP00061 | |
| Orbital shaking incubator with temperature control | New Brunswick Scientific | C25 incubator shaker | |
| Petridish 100 mm x 15 mm | Fisher Scientific | FB0875712 | |
| Plating beads | Zymo research | S1001 | For spreading culture on AmpR/KanR plates |
| Polypropylene Columns (1 mL) | Qiagen | 34924 | For purification of His-tagged proteins |
| Precision Plus Protein Standards | Bio-Rad | #161-0374 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| pT7CFE1-NMyc | Thermofisher Scientific | 88863 | For cloning substrates for RRL expression |
| PVDF membrane | Invitrogen | LC2007 | |
| 14 mL Polypropylene round bottom tubes | Fisher Scientific | 352029 | For growing plasmid cultures |
| QiaRack | Qiagen | 19095 | For holding polypropylene columns during purification |
| Refrigerated High speed Centrifuge | Beckman Coulter | Avanti J-25 | |
| rRNasin Ribonuclease Inhibitor | Promega | N251A | For RRL expression |
| Sodium chloride | Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Fisher Scientific | BP359-500 | |
| Sterile Falcon tubes, 15 mL | Fisher Scientific | 05-527-90 | |
| Sterile Falcon tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Sucrose | Sigma-Aldrich | S70903-250G | |
| 1 mL Serological Pipets, Sterile | celltreat | 229001B | For bacterial cell lysis in 50 mL tubes |
| TnT Coupled Reticulocyte Lysate -T7 | Promega | L4611 | |
| Tris-base | Fisher Scientific | BP154-1 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Waterbath | Fisher Scientific | 2340 | |
| Western wet transferring cassette | Thermofisher Scientific | STM2001 |
参考文献
- Kumar, S. Caspase function in programmed cell death. Cell Death and Differentiation. 14 (1), 32-43 (2007).
- Hawkins, C. J., et al. The Drosophila caspase DRONC cleaves following glutamate or aspartate and is regulated by DIAP1, HID, and GRIM. Journal of Biological Chemistry. 275 (35), 27084-27093 (2000).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Meier, P., Silke, J., Leevers, S. J., Evan, G. I. The Drosophila caspase DRONC is regulated by DIAP1. EMBO Journal. 19 (4), 598-611 (2000).
- Timmer, J. C., Salvesen, G. S. Caspase substrates. Cell Death and Differentiation. 14 (1), 66-72 (2007).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. Journal of Biological Chemistry. 274 (17), 11549-11556 (1999).
- Zou, H., Henzel, W. J., Liu, X., Lutschg, A., Wang, X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 90 (3), 405-413 (1997).
- Stennicke, H. R., et al. Caspase-9 can be activated without proteolytic processing. Journal of Biological Chemistry. 274 (13), 8359-8362 (1999).
- Snipas, S. J., Drag, M., Stennicke, H. R., Salvesen, G. S. Activation mechanism and substrate specificity of the Drosophila initiator caspase DRONC. Cell Death and Differentiation. 15 (5), 938-945 (2008).
- Fraser, A. G., Evan, G. I. Identification of a Drosophila melanogaster ICE/CED-3-related protease, drICE. EMBO Journal. 16 (10), 2805-2813 (1997).
- Denton, D., Mills, K., Kumar, S. Methods and protocols for studying cell death in Drosophila. Methods in Enzymology. 446, 17-37 (2008).
- Dorstyn, L., Kumar, S. A biochemical analysis of the activation of the Drosophila caspase DRONC. Cell Death and Differentiation. 15 (3), 461-470 (2008).
- Aram, L., Yacobi-Sharon, K., Arama, E. CDPs: caspase-dependent non-lethal cellular processes. Cell Death and Differentiation. 24 (8), 1307-1310 (2017).
- Arama, E., Baena-Lopez, L. A., Fearnhead, H. O. Non-lethal message from the Holy Land: The first international conference on nonapoptotic roles of apoptotic proteins. FEBS Journal. 288 (7), 2166-2183 (2021).
- Baena-Lopez, L. A. All about the caspase-dependent functions without cell death. Seminars in Cell and Developmental Biology. 82, 77-78 (2018).
- Florentin, A., Arama, E. Caspase levels and execution efficiencies determine the apoptotic potential of the cell. Journal of Cell Biology. 196 (4), 513-527 (2012).
- Amcheslavsky, A., et al. Plasma membrane localization of apoptotic caspases for non-apoptotic functions. Developmental Cell. 45 (4), 450-464 (2018).
- Bergmann, A. Are membranes non-apoptotic compartments for apoptotic caspases. Oncotarget. 9 (60), 31566-31567 (2018).
- Song, J., et al. Cascleave: towards more accurate prediction of caspase substrate cleavage sites. Bioinformatics. 26 (6), 752-760 (2010).
- Wang, M., et al. Cascleave 2.0, a new approach for predicting caspase and granzyme cleavage targets. Bioinformatics. 30 (1), 71-80 (2014).
- Kamber Kaya, H. E., Ditzel, M., Meier, P., Bergmann, A. An inhibitory mono-ubiquitylation of the Drosophila initiator caspase Dronc functions in both apoptotic and non-apoptotic pathways. PLoS Genetics. 13 (2), 1006438 (2017).
- Stennicke, H. R., Salvesen, G. S. Caspases: preparation and characterization. Methods. 17 (4), 313-319 (1999).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual (4th edition). , (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253 (2007).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Brunelle, J. L., Green, R. Coomassie blue staining. Methods in Enzymology. 541, 161-167 (2014).
- Hirano, S. Western blot analysis. Methods in Molecular Biology. 926, 87-97 (2012).
- Kim, B. Western blot techniques. Methods in Molecular Biology. 1606, 133-139 (2017).
- Luthi, A. U., Martin, S. J. The CASBAH: a searchable database of caspase substrates. Cell Death and Differentiation. 14 (4), 641-650 (2007).
- Fogarty, C. E., et al. Extracellular reactive oxygen species drive apoptosis-induced proliferation via Drosophila macrophages. Current Biology. 26 (5), 575-584 (2016).
- Song, Z., et al. Biochemical and genetic interactions between Drosophila caspases and the proapoptotic genes rpr, hid, and grim. Molecular and Cellular Biology. 20 (8), 2907-2914 (2000).
- Edfors, F., et al. Enhanced validation of antibodies for research applications. Nature Communications. 9 (1), 4130 (2018).
- Uhlen, M., et al. A proposal for validation of antibodies. Nature Methods. 13 (10), 823-827 (2016).
- Brizzard, B. Epitope tagging. Biotechniques. 44 (5), 693-695 (2008).
- Kanuka, H., et al. Control of the cell death pathway by Dapaf-1, a Drosophila Apaf-1/CED-4-related caspase activator. Molecular Cell. 4 (5), 757-769 (1999).
- Rodriguez, A., et al. Dark is a Drosophila homologue of Apaf-1/CED-4 and functions in an evolutionarily conserved death pathway. Nature Cell Biology. 1 (5), 272-279 (1999).
- Zhou, L., Song, Z., Tittel, J., Steller, H. HAC-1, a Drosophila homolog of APAF-1 and CED-4 functions in developmental and radiation-induced apoptosis. Molecular Cell. 4 (5), 745-755 (1999).
- Weghorst, F., Mirzakhanyan, Y., Hernandez, K. L., Gershon, P. D., Cramer, K. S. Non-Apoptotic caspase activity preferentially targets a novel consensus sequence associated with cytoskeletal proteins in the developing auditory brainstem. Frontiers in Cell and Developmental Biology. 10, 844844 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。