Method Article
İn Vitro Substrat Taraması için Saflaştırılmış Rekombinant Drosophila Caspases Kullanarak Bölünme Testleri
Bu Makalede
Özet
Burada rekombinant Drosophila kaspazlarını Dronc ve Drice'i ve bunların in vitro bölünme tahlillerini eksprese etmek ve saflaştırmak için bir protokol sunuyoruz.
Özet
Kaspazlar, apoptotik ve apoptotik olmayan süreçlerde rol oynayan çok spesifik hücre ölümü proteazlarıdır. Apoptoz sırasında kaspazların rolü çok iyi tanımlanmış ve birçok apoptotik proteolitik kaspaz substratı tanımlanmış ve karakterize edilmiş olsa da, apoptotik olmayan süreçlerde kaspazların rolü iyi anlaşılmamıştır. Özellikle, şimdiye kadar az sayıda apoptotik olmayan kaspaz substratı tanımlanmıştır. Burada, potansiyel kaspaz substratlarının tanımlanmasını ve karakterizasyonunu kolaylaştırmak için, aday substratların in vitro olarak kaspaz bölünme tahlillerinde test edilmesine izin veren bir protokol açıklanmaktadır. Bu protokol, rekombinant kaspaz proteinlerinin üretimini ve saflaştırılmasını, aday substratların rekombinant olarak veya hücresiz bir ekspresyon sisteminde üretilmesini ve SDS-PAGE ve immünoblotlama ile takip edilen gerçek in vitro bölünme reaksiyonunu içerir. Bu protokol Drosophila kaspazları Dronc ve Drice için uyarlanmıştır, ancak memeliler de dahil olmak üzere diğer organizmalardan gelen kaspazlar için kolayca uyarlanabilir.
Giriş
Programlanmış hücre ölümü veya apoptoz, kaspazlar olarak adlandırılan yüksek derecede uzmanlaşmış hücre ölümü proteazlarının bir sınıfı tarafından yürütülür (referans1'de gözden geçirilmiştir). Kaspazlar, katalitik bölgede bir Cys kalıntısı içeren Cys proteazlarıdır. Konsensüs bölünme bölgelerini ve yarık substratlarını Asp kalıntılarından sonra proteolitik olarak tanımlamışlardır (Drosophila kaspaz Dronc'un da Glu kalıntılarından sonra yarıldıkları bildirilmiştir2). Başlatıcı (apikal veya yukarı akış olarak da bilinir) ve efektör (cellat veya aşağı akış) kaspazlara bölünürler. Başlatıcı kaspazlar efektör kaspazları aktive eder. Örneğin, memelilerde, başlatıcı kaspaz Kaspaz-9, efektör kaspaz Kaspaz-33'ü parçalara ayırır ve aktive eder. Benzer şekilde, Drosophila melanogaster'de, kaspaz-9-ortolog Dronc, kaspaz-3-ortolog Drice 2,4'ü parçalara ayırır ve aktive eder. Apoptoz sırasında, efektör kaspazlarhücre 5'in ölümüne yol açan yüzlerce substratı parçalar.
Kaspazlar hücrede inaktif proenzimler (zimojenler) olarak sentezlenir. Bu formda, bir N-terminal prodomain, proenzimin orta kısmında katalitik Cys ile büyük bir alt birim ve C-terminus 1'de küçük bir alt birim içerirler (Şekil 1). Aktivasyon mekanizması başlatıcı ve efektör kaspazlar arasında farklıdır. Başlatıcı kaspazlar (Kaspaz-9, Dronc), apoptozom6 olarak adlandırılan büyük bir protein kompleksine dahil edilerek meydana gelen aktivasyon için dimerizasyon gerektirir. Apoptozomun dahil edilmesi için, Caspase-9 ve Dronc, N-terminal prodomaininde bir kaspaz aktivasyon ve işe alım alanı (CARD) taşır (Şekil 1). Apoptozom bileşeni Apaf-1 ayrıca bir CARD içerir ve Caspase-9 veya Dronc'u CARD / CARD etkileşimi yoluyla apoptozom 3,6,7'ye alır. Kaspaz-9 ve Dronc apoptozomda proteolitik olarak işlenebilirken, bu işlem enzimatik aktivite 8,9 için tam olarak gerekli değildir.
Buna karşılık, efektör kaspazlar (Caspase-3, Drice) prodomainlerinde bir CARD taşımaz ve aktivasyon1 için büyük protein komplekslerine dahil edilmez. Sırasıyla aktif Caspase-9 veya Dronc1 ile proteolitik bölünmeye bağımlıdırlar. Aktif efektör kaspaz, iki büyük ve iki küçük alt birimden oluşan bir tetramer oluşturur ve bu nedenle iki katalitik bölge içerir (Şekil 1). Bu protokol için önemli olan, E. coli'deki kaspazların rekombinant ekspresyonu, Apaf-1'in yokluğunda bile, Drice10 ve Dronc 2,8,9,11,12 dahil olmak üzere kaspazların otomatik olarak işlenmesine ve aktivasyonuna neden olur. Bu otomatik işleme, rekombinant kaspaz proteini ile aday substratların in vitro bölünme tahlillerinin yapılmasına izin verir.
Kaspazlar sadece apoptozda rol oynamakla kalmaz, aynı zamanda proliferasyon, farklılaşma, hücre göçü, nöronal budama, doğuştan gelen bağışıklık ve diğerleri13,14,15 dahil olmak üzere apoptotik olmayan birçok fonksiyona sahip olabilirler. Apoptotik olmayan süreçler sırasında aktif kaspazlar içermesine rağmen hücrelerin nasıl hayatta kalabileceği şu anda bilinmemektedir. Bu hücrelerin kaspazları sadece sub-ölümcül seviyelerde aktive etmeleri mümkündür16 veya plazma zarı17,18 gibi hücrenin apoptotik olmayan bölmelerinde aktif kaspazları ayırırlar. Bu nedenle, apoptotik olmayan substratların tanımlanması ve doğrulanması sadece kaspazların apoptotik olmayan süreçlere nasıl aracılık ettiğini ortaya çıkarmakla kalmayacak, aynı zamanda aktif kaspazların varlığında hücrelerin nasıl hayatta kalabileceğini anlamaya da yardımcı olacaktır.
Kaspaz substratları olarak aday proteinler genetik ve biyokimyasal yöntemler kullanılarak tanımlanabilir. Tanımlanan proteinler, konsensüs Dronc bölünme bölgelerinin varlığı açısından kontrol edilebilir. Bu, protein dizisini görsel olarak inceleyerek veya CasCleave (https://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)19,20 gibi daha sofistike çevrimiçi biyoinformatik araçlar kullanılarak yapılabilir. Bu araçlar, kaspazların yeni hedeflerini tahmin etmek için kaspazların bilinen konsensüs bölünme bölgelerini ve yapısal hususları kullanır. CasCleave, insan Kaspazları-1, -3, -6, -7 ve -8'den doğrulanmış substratların bilgilerini içerirken, yine de bu kaspazlar ve konsensüs bölünme bölgeleri iyi korunduğundan, burada açıklanan amaçlar için de yararlı olabilir. Bununla birlikte, Dronc bölünme bölgesi iyi tanımlanmadığından (iki çalışma iki farklı optimal bölünme bölgesi, TATD / E2 ve LALD9 tanımlamıştır), aday substratlar Drice de dahil olmak üzere diğer kapaz bölünme bölgesinin varlığı açısından da incelenmiştir.
Kaspazların öngörülen substratlarını doğrulamak için, ek testler gereklidir. Bu testlerden biri, belirli bir kaspazın aday proteini in vitro olarak parçalayabileceğinin gösterilmesidir. Burada, in vitro kaspaz bölünme testleri için uygun bir protokol sunuyoruz. Bu protokol kullanılarak, aday substratlar kaspaz olarak Dronc ile test edilir. Ayrıca Drice'ın substratları olarak da test edilebilirler. Bu protokol Drosophila kaspazları Dronc ve Drice için yazılmış olsa da, diğer organizmalardan gelen kaspazlar için de uyarlanabilir.
Dronc ve Drice'ın in vitro bölünme testi ile birlikte ekstraksiyonu ve saflaştırılması, bu kaspazların katalitik aktivite kaybı nedeniyle aynı gün yapılmalıdır. Bu protokol değiştirilmiş ve önceki yayınlardan optimize edilmiştir 8,9,11,12,21,22. Bu protokolde, dört farklı kaspaz proteini, E. coli suşu BL21 (DE3) pLysS'de rekombinant olarak eksprese edilir. Bu proteinler şunlardır: 6xHis-Dronc wt, 6xHis-DroncC318A, 6xHis-Dricewt ve 6xHis-DriceC211A. Bu proteinlerin her biri, saflaştırma için N-terminusunda 6 Histidin kalıntısı (6xHis) ile etiketlenmiştir. Dronc wt ve Dricewt vahşi tip proteinlerdir ve rekombinant ekspresyon üzerine aktif kaspaz içine otomatik olarak işlenebilir. DroncC318A ve DriceC211A, katalitik Cys kalıntısını bir Ala kalıntısına dönüştüren Dronc ve Drice'ın mutant formlarını kodlar. Bu yapılar katalitik olarak etkin değildir ve otomatik olarak işlenemez (bkz. Şekil 2A). Bölünme tahlilinde kontrol olarak kullanılırlar. DriceC211A otomatik olarak işlenemediğinden, burada açıklanan in vitro bölünme testinde Droncwt için model substrat olarak da kullanılır.
Protokol
1. Bakterilerde rekombinant kaspaz ekspresyonu
- İlgilenilen geni (Kaspaz veya varsayılan substrat) standart protokolleri kullanarak N- ve / veya C-terminal etiketleri ile bir bakteri ekspresyon vektörüne klonlayın23.
NOT: Etiketler rekombinant proteinlerin çözünürlüğünü artırabilir ve rekombinant proteinlerin saflaştırılması için kullanılır. Burada, Dronc, Drice ve katalitik mutantları, N-terminal 6xHis etiketi sağlayan pET28a vektörüne klonlanır (pET28a-6xHis-Dronc wt, pET28a-6xHis-Dronc C318A, pET28a-6xHis-Dricewt, pET28a-6xHis-Drice C211A); (primer bilgi için Ek Tablo 1'e bakınız). - İlgilenilen genlere sahip vektörleri, standart prosedürleri kullanarak yetkin BL21 (DE3) pLysS E. coli hücrelerine dönüştürün23,24. Transformasyon karışımını LB agar plakaları üzerine uygun antibiyotik (pET28a durumunda kanamisin) ile plakalayın ve dönüştürülmüş bakterileri seçin. (Ek Tablo 2'ye bakınız.)
- Plakadan bir koloni seçin ve sallanan bir platformda 220 rpm'de 37 ° C'de gece boyunca büyümek için uygun antibiyotik içeren 5 mL LB ortamında aşılayın.
- Ertesi gün, antibiyotik ile 30-50 mL (örnek başına) LB ortamı hazırlayın ve bir gecede yetiştirilen kültürün 1 mL'sini ekleyin. Bir biyofotometre / spektrofotometre kullanılarak 600 nm'deki (OD600) optik yoğunluk 0,1 ile 0,2 arasında olmalıdır.
- OD600 0,6'ya ulaşana kadar kültürü sallanan bir platformda 220 rpm'de 37 °C'de büyütün. OD600'ü 0,6'ya ulaşana kadar saatte bir kontrol edin. Bu yaklaşık 2 ila 3 saat sürer.
- Protein (kaspaz) ekspresyonunu indüklemek için, IPTG'yi 0.1-0.2 mM'lik bir nihai konsantrasyona ekleyin (IPTG stokundan 1:1.000-1:500 seyreltin, Ek Tablo 2'ye bakınız).
- Kültürleri 220 rpm'de 30 °C'de 3 saat boyunca büyütün.
NOT: Zaman ve sıcaklık, ne tür bir proteinin ifade edildiğine ve çözünürlüğüne bağlıdır. Farklı kaspaz veya substratlar ifade edilirse bu koşulların ayarlanması gerekebilir. - 3 saat sonra, kültürleri 50 mL santrifüj tüplerinde 20 dakika boyunca 4 ° C'de 2.000 x g'de döndürün. Süpernatantı atın ve pelet ile devam edin.
NOT: Protokol bu noktada durdurulabilir ve daha sonra devam ettirilebilir. Bakteriyel peletler -80 °C'de dondurulabilir.
2. Küçük ölçekli rekombinant kaspazların ekstraksiyonu
- Pelet edilmiş kültürlerle donmuş tüpleri -80 °C depodan çıkarın ve peleti yumuşatmak için 10 dakika boyunca buz üzerinde tutun.
- 10 dakika sonra, yeni eklenen proteaz inhibitörleri, 10 mg / mL lizozim ve 50 U / mL benzonaz ile desteklenmiş 0.6 mL bakteriyel hücre lizis tamponu (Ek Tablo 2), 1 mL serolojik pipetli bir pipet kontrolörü kullanarak pelet içeren tüplere ekleyin.
- Aynı pipet ucuyla, herhangi bir pelet partikülü olmadan berrak soluk sarı bir çözelti görünene kadar yukarı ve aşağı pipetleyerek, peleti çözün. Buz üzerinde 30 dakika kuluçkaya yatırın.
- Lizatı uygun santrifüj tüplerine aktarın ve lizatları 4 ° C'de 40 dakika boyunca 17.000 x g'de santrifüj edin.
- Süpernatantları 1,5 mL'lik bir mikrosantrifüj tüpüne aktarın. Bu, kaspazları içeren ham ekstrakttır.
- Tüpleri buz üzerinde tutun ve Ni-NTA agarozu ile saflaştırmaya devam edin.
3. Küçük ölçekli His etiketli kaspazların saflaştırılması
- Adım 2.5'ten itibaren kaspaz ekstraktlarının her bir tüpüne %50 Ni-NTA agaroz bulamacının 0.2 mL'sini ekleyin. Tüpleri uçtan uca bir rotatörde 4 °C'de 1 saat boyunca döndürün.
- 1 saat sonra, Ni-NTA agarozu ile ekstraktı, ucu bozulmamış, bir rafa yerleştirilmiş 1 mL polipropilen sütunlara ekleyin. 5 dakika bekletin.
- 5 dakika sonra, sütunların kapağını çıkarın ve süpernatantın yerçekimi akışıyla dışarı akmasına izin verin.
- Ni-NTA agarozun paketlenmiş reçinesini bozmadan sütunlara 1 mL yıkama tamponunu (Ek Tablo 2) dikkatlice ekleyin ve yerçekimi akışıyla yıkayın.
- Yıkama adımını üç kez uygulayın.
- Kaspazların elüsyonu için, yıkama tamponunun tamamen boşaltılmasından sonra kolonların toplama nozulunun altına 1,5 mL mikrosantrifüj tüpleri yerleştirin.
- Her kolona 0,5 mL elüsyon tamponu ekleyin (kullanımdan hemen önce 1x proteaz inhibitörleri ile desteklenir) ve elüatı 1,5 mL mikrosantrifüj tüplerinde toplayın.
NOT: İnce saflaştırılmış elüat renkli olarak şeffaf olacaktır. - Elüatları buz üzerinde tutun ve Bradford testi25 ile proteinlerin konsantrasyonunu ölçün. SDS-PAGE ile saflaştırılmış kaspazların saflığını/homojenliğini onaylayın ve ardından Coomassie Blue boyama26.
NOT: 50 mL'lik bir LB kültürünün verimi 0.5 ila 1.5 mg kaspaz proteini arasında değişmektedir. Elüsyon için 0.5 mL elüsyon tamponunun kullanıldığı göz önüne alındığında, konsantrasyon 1 ila 3 mg / mL arasında değişmektedir. Saflaştırılmış kaspaz elüatlarının in vitro bölünme tahlilleri için aynı lizis ve saflaştırma gününde kullanılması önemlidir, çünkü bu kaspaz preparatları gece boyunca aktivitesini kaybeder.
4. Hücresiz ekspresyon sistemlerinde varsayılan kaspaz substratının ekspresyonu
NOT: Bu protokolde, Dronc'un doğal substratı olan Drice, hem E. coli'deki rekombinant ekspresyon (yukarıdaki bölüm 3'e bakınız) hem de bir memeli hücresinden arındırılmış ekspresyon sistemi olan tavşan retikülosit lizatındaki (RRL) ekspresyon ile hazırlanır (bu bölüm, aşağıya bakınız).
- Varsayılan substratın genini, standart prosedürler23 kullanarak T7, T3 veya SP6 promotörü içeren bir ekspresyon vektörüne klonlayın.
NOT: Bu protokolde, DriceC211A model substrat olarak kullanılmaktadır ve gen ekspresyonu için bir T7 promotörü taşıyan ve varsayılan protein substratını immünoblotlama yoluyla tespit için bir N-terminal Myc-etiketi ile etiketleyen pT7CFE1-N-Myc vektörüne klonlanmıştır. - RRL'de, aday substratlar radyoaktif veya radyoaktif olmayan olarak sentezlenebilir.
- Radyoaktif olmayan sentez: 0.5 mL'lik bir mikrosantrifüj tüpünde, 25 μL RRL, 2 μL reaksiyon tamponu, 0.5 μL Amino Asit Karışımı -Eksi Lösin (1 mM), 0.5 μL Amino Asit Karışımı-Eksi Metiyonin (1 mM), 1 μL Ribonükleaz İnhibitörü (40 U / μL), 2 μL DNA Şablonu (0.5 μg / μL) ve 1 μL T7-RNA Polimeraz ekleyin. Reaksiyonun son hacmini 50 μL'ye ayarlamak için nükleaz içermeyen su ekleyin.
NOT: RRL lizat, endojen proteinlerin 100-200 mg / mL'sini içerir. İn vitro translasyon reaksiyonları için, RRL'yi %50 konsantrasyonda ekleyin (burada 25 μL/50 μL reaksiyon). - Radyoaktif sentez: 0.5 mL'lik bir mikrosantrifüj tüpünde, 25 μL RRL lizat, 2 μL reaksiyon tamponu, 0.5 μL Amino Asit Karışımı-Eksi Metiyonin (1 mM), 1 μL Ribonükleaz İnhibitörü (40 U / μL), 2 μL DNA Şablonu (0.5 μg / μL), 2 μL S35 etiketli Metiyonin (10 mCi / mL'de 1000 Ci / mmol) ve 1 μL T7-RNA Polimeraz ekleyin. Reaksiyonun son hacmini 50 μL'ye ayarlamak için nükleaz içermeyen su ekleyin. Uçları ve tüpleri radyoaktif bir atık kabına atın.
NOT: Amino Asit Karışımını Lösinsiz eklemeyin. pT7CFE1 vektörü, protein ekspresyonu için bir T7 promotörü kullanır. Diğer vektörler T3 veya SP6 destekleyicilerini kullanır. Bu durumda, T7 RNA polimeraz yerine T3 veya SP6 RNA polimerazlar kullanılmalıdır. Lütfen DNA kalıbının yüksek saflıkta olduğundan emin olun.
- Radyoaktif olmayan sentez: 0.5 mL'lik bir mikrosantrifüj tüpünde, 25 μL RRL, 2 μL reaksiyon tamponu, 0.5 μL Amino Asit Karışımı -Eksi Lösin (1 mM), 0.5 μL Amino Asit Karışımı-Eksi Metiyonin (1 mM), 1 μL Ribonükleaz İnhibitörü (40 U / μL), 2 μL DNA Şablonu (0.5 μg / μL) ve 1 μL T7-RNA Polimeraz ekleyin. Reaksiyonun son hacmini 50 μL'ye ayarlamak için nükleaz içermeyen su ekleyin.
- Reaksiyonu 30 °C'de 90 dakika boyunca inkübe edin.
- 10 saniye boyunca kısaca döndürün ve tüpleri buzun üzerine yerleştirin. RRL'deki varsayılan substratın ekspresyon seviyesini SDS-PAGE ve immünoblotlama/otoradyografi ile kontrol edin.
NOT: Bölünme reaksiyonuna eklenen RRL ekstraktı miktarı, tespit yöntemiyle (immünoblotlama veya S35 otoradyografi) tespit edilebilen protein miktarına dayanmalıdır. İn vitro bölünme testine (bir sonraki bölüm) devam edin veya -80 ° C'de saklayın.
5. RRL ile üretilen substratlarla in vitro bölünme testi
- Bölüm 4'te açıklandığı gibi oluşturulan varsayılan substratları ele alalım. Bu protokolde, model substrat olarak N-Myc-DriceC211A kullanılır.
- Varsayılan substratın ekspresyon seviyesine bağlı olarak (immünoblot veya otoradyografi analizi ile ayrı ayrı belirlenecek, bkz. adım 4.4), bölünme tahlilinde ilgilenilen protein ile programlanmış RRL'nin 1-10 μL'sini kullanın.
- Bölüm 1, 2 ve 3'te üretilen 10 μg saflaştırılmış kaspaz proteini ekleyin.
- Toplam reaksiyon hacmini kapaz tahlil tamponu ile 50 μL'ye getirin.
- Bir su banyosundaki reaksiyonları 3 saat boyunca 30 ° C'de inkübe edin. Bölünme testine uygun kontrolleri eklediğinizden emin olun. Burada kontrol olarak katalitik mutant DroncC318A kullanılmaktadır.
- 3 saat sonra, tüpleri buz üzerine aktararak reaksiyonları durdurun.
- 50 mM DTT içeren bir birim LDS örnek arabelleği ekleyin. LDS numune tamponunun eklenmesiyle reaksiyon tamamen durdurulur.
- Numuneleri 75 °C'de bir ısı bloğunda 10 dakika boyunca inkübe edin.
- Hızlı bir şekilde döndürün, hafifçe karıştırın, numune başına 24 μL yükleyin ve SDS-PAGE'i çalıştırın (bkz. bölüm 7) veya numuneleri -20 °C'de saklayın.
6. Bakteriyel olarak eksprese edilen rekombinant substrat proteini ile in vitro bölünme testi
- 0,5 mL'lik bir mikrosantrifüj tüpüne 10 μg saflaştırılmış aday substrat (burada 6xHis-DriceC211A, bölüm 1, 2 ve 3'te üretilen) ekleyin.
- Bölüm 1 ve 2'de üretilen saflaştırılmış kaspaz proteinlerinin 10 μg'ını ekleyin. Kaspaz tahlil tamponu kullanarak toplam hacmi 50 μL'ye getirin.
- 5,5 ile 5,9 arasındaki adımları izleyin.
7. SDS-PAGE ve immünoblotlama
- Bölünme reaksiyonlarını (24 μL) %4-%12 Tris-Glisin veya Bis-Tris gradyan jellerine (Malzeme Tablosu) yükleyin ve standart prosedürleri kullanarak sonuçları görselleştirmek için protein elektroforezi ve immünoblotlama (veya S35 etiketli substratlar kullanılıyorsa otoradyografi) yapın27,28.
NOT: Burada, bu protokolde, tampon ve LDS yükleme tamponu çalıştıran paspaslı Bis-Tris gradyan jelleri kullanılmıştır. Genel olarak, Tris-Glisin jellerinin yaygın olarak kullanılan PAGE protokolleri, Tris-Glisin-SDS çalışan tampon kullanılarak çalışır ve SDS yükleme tamponu iyi çalışır.
Sonuçlar
Bu protokol, E. coli'de kaspaz proteini indüksiyonu, rekombinant Drosophila kaspazlarının Dronc ve Drice'nin saflaştırılması, aday substratların sentezi ve aday substratlarla in vitro bölünme reaksiyonu (burada DriceC211A) ve kaspaz Drunc için adım adım talimatlar sağlar. Katalitik mutant DriceC211A , bu tahlilde model substrat olarak kullanılmıştır, çünkü otomatik işleme aktivitesine sahip değildir (Şekil 2A) ve Droncwt tarafından bölünene kadar tam uzunlukta kalır. DriceC211A, Droncwt preparatının enzimatik aktiviteye sahip olduğunu doğrulamak için her zaman pozitif bir kontrol olarak kullanılmalıdır.
Şekil 2A , rekombinant kaspazların ekspresyonu ve saflaştırılmasına temsili bir örnek sunmaktadır. Dört farklı rekombinant kaspaz indüklendi ve saflaştırıldı: 6xHis-Droncwt, 6xHis-DroncC318A, 6xHis-Dricewt ve 6xHis-DriceC211A. Saflaştırılmış kaspazlar SDS-PAGE tarafından çalıştırıldı, immünoblotlandı ve leke bir anti-His antikoru ile araştırıldı (seyreltilmiş 1:5.000; ardından anti-fare IgG, HRP'ye bağlı antikor (1:10.000)). İşlenmemiş 6xHis-Dronc (proDronc), 55 kDa'lık (şerit 2) göreceli bir moleküler ağırlıkta (MWr) çalışır ve işlenmemiş 6xHis-Drice (proDrice), 35kDa'lık (şerit 4) bir MW r'ye sahiptir. Kaspazların otomatik işlenmesi, N-terminusunda His-etiketinin varlığından dolayı kaspazların büyük alt birimlerini temsil eden daha küçük MWr bantlarının ortaya çıkmasıyla görülebilir (Şekil 1). 6x-Drunc durumunda, büyük alt ünite 40 kDa'lıkbir MW r'ye sahiptir (şerit 1). 6x-Drice'ın büyük alt birimi 23 kDa'da (şerit 3) çalışır. Katalitik mutantlar 6xHis-DroncC318A ve 6xHis-DriceC211A otomatik olarak işlenemez ve sadece tam uzunlukta proteinler (şerit 2 ve 4) olarak tespit edilebilir.
Şekil 2B Bakteriyel olarak üretilen ve saflaştırılan 6xHis-Droncwt preparatının enzimatik aktiviteye sahip olduğunu göstermek için, bu protokolde açıklandığı gibi bir in vitro bölünme testi yapılmıştır. Negatif kontrol olarak, katalitik mutant 6xHis-DroncC318A kullanıldı. Substrat, N-terminusunda bir Myc-etiketi ile etiketlenmiş RRL-tarafından oluşturulan N-Myc-DriceC211A idi. İn vitro bölünme reaksiyonundan sonra, proteinler SDS-PAGE ile ayrıldı, immünoblotlandı ve lekeler, N-Myc-DriceC211A'yı tespit etmek için bir anti-Myc antikoru (seyreltilmiş 1: 1.000) ve ardından anti-fare IgG, HRP'ye bağlı antikor (1: 10.000)) ile inkübe edildi. Kaspazın başarılı bölünmesi ve dolayısıyla enzimatik aktivitesi, substratın tam uzunlukta, işlenmemiş formuna kıyasla en az bir küçük MWr bandının ortaya çıkmasıyla gösterilebilir. İşlenmemiş, tam uzunlukta N-Myc-Drice C211A, 40 kDa'lık(şerit 2 ve 4) bir MW r'ye sahipken, işlenmiş N-Myc-DriceC211A'nın büyük alt birimi 30kDa'da (şerit 3) çalışır. Şerit 1, programlanmamış RRL lizatını temsil eder (plazmid/transkript eklenmemiştir). Şerit 2, RRL ifadesiyle DriceC211A'nın in vitro üretimini gösterir. Şerit 3, 6xHis-Droncwt ile in vitro bölünme reaksiyonunu içerir. Şerit 4, 6xHis-DroncC318A ile in vitro bölünme reaksiyonunu içerir.
Şekil 2C Bu protokole göre hem rekombinant hem de saflaştırılmış kaspaz (6xHis-Droncwt ve 6x-His-DroncC318A) ve substrat (6xHis-DriceC211A) kullanan bir in vitro bölünme reaksiyonu SDS-PAGE ve immünoblot ile analiz edildi. Bölünme reaksiyonunun analizi için, bu immünoblotta anti-yarıklı Drice antikoru (seyreltilmiş 1:5.000; ardından anti-tavşan IgG, HRP'ye bağlı antikor (1:10.000)) kullanılmıştır. Anti-yarık Drice antikoru, neo-epitopunu 6xHis-DriceC211A'nın büyük alt biriminde (23 kDa) ancak 6xHis-Droncwt (şerit 1) ile işlendikten sonra tespit eder. Katalitik mutant 6xHis-DroncC318A, bu tahlilde 6xHis-Drice C211A'yı işleyemez ve tam uzunluktaki 6xHis-DriceC211A, 35kDa'lık (şerit 2) soluk işlenmemiş bant olarak görünür.
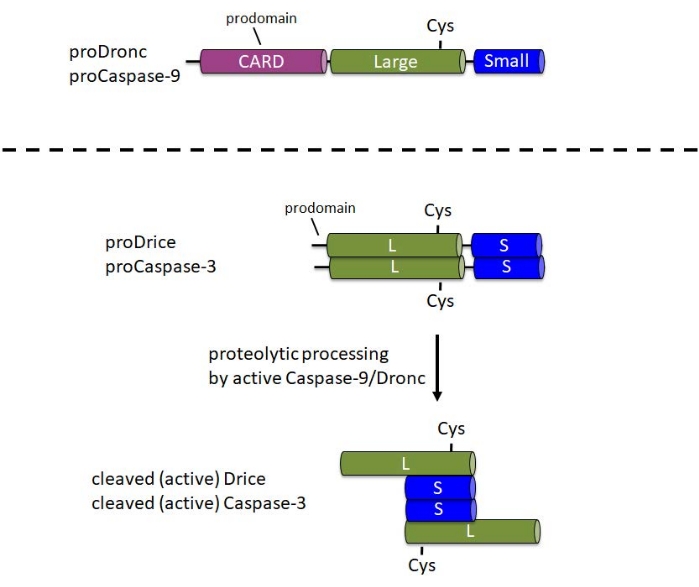
Resim 1: Başlatıcı kaspazların Kaspaz-9 ve Dronc ile efektör kaspazların Kaspaz-3 ve Drice'ın etki alanı yapısı. CARD - kaspaz aktivasyon ve işe alım alanı; Cys - katalitik Sistein kalıntısının göreceli konumu; L - büyük alt birim; S - küçük alt birim. N-terminal prodomainlerinin konumu belirtilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
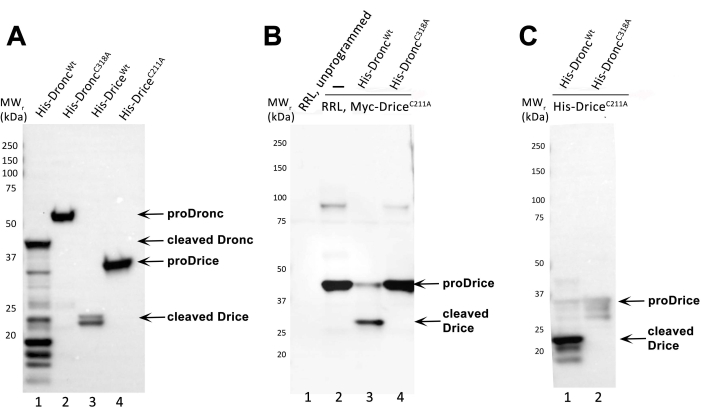
Şekil 2: Temsili sonuçlar. (A) Bir anti-His antikoru ile incelenen saflaştırılmış rekombinant 6xHis-Dronc ve 6xHis-Drice preparatlarının immünoblot analizi. İşlenmemiş (proDronc ve proDrice) ve yarıklı 6xHis-Dronc ve 6xHis-Drice oklarla gösterilir. MW belirteçleri solda belirtilmiştir. (B) RRL-tarafından üretilen N-Myc-Drice'ın kaspazlar 6xHis-Droncwt (şerit 3) veya 6x-His-DroncC318A (şerit 4) ile in vitro bölünme reaksiyonunun immünoblot analizi, bir anti-Myc antikoru ile incelendi. Programlanmamış ve programlanmış (N-Myc-DriceC211A) RRL reaksiyonları yüklenir ve şerit 1 ve 2'de ayrılır. İşlenmemiş (proDrice) ve parçalanmış N-Myc-Drice oklarla gösterilir. MW belirteçleri solda belirtilmiştir. (C) Bakteriyel olarak eksprese edilen ve saflaştırılan rekombinant 6xHis-DriceC211A'nın kaspazlar 6xHis-Droncwt (şerit 1) veya 6x-His-DroncC318A (şerit 2) ile in vitro bölünme reaksiyonunun immünoblot analizi, anti-yarıklı Drice antikoru ile incelenir. Tam uzunlukta (proDrice) ve yarık 6xHis-DriceC211A oklarla gösterilir. MW belirteçleri solda belirtilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Tablo 1: Bu tablo pET28a vektöründe klonlama için kullanılan primerleri içerir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Tablo 2: Bu tablo tamponların ve ortamların bileşimini içerir. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Kaspazlar ve kaspaz fonksiyonu hakkındaki bilgimizin büyük kısmı, son otuz yılda apoptozdaki yoğun çalışmalardan kaynaklanmaktadır. Başlatıcı kaspazların proteolitik olarak efektör kaspazları işlediği çok iyi bilinmektedir ve yüzlerce protein apoptoz sırasında efektör kaspaz substratları olarak tanımlanmıştır 5,29. Buna karşılık, apoptotik olmayan süreçler için kaspazların işlevi ve hangi apoptotik olmayan substratları işledikleri hakkında çok daha az şey bilinmektedir. Başlatıcı kaspazların burada kilit karar vericiler olduğu düşünülebilir. Apoptoz sırasında, hücre ölümüne neden olan efektör kaspazları aktive ederler. Bununla birlikte, apoptotik olmayan süreçleri tetiklemek için, apoptotik olmayan süreci kontrol eden farklı proteinleri (efektör kaspazlar hariç) aktive edebilirler. Bu protokol, aday proteinleri Drosophila 17,30'da başlatıcı kaspaz Dronc'un substratları olarak test eder.
Bölünme testinde test edilecek substratlar, RRL gibi in vitro memeli hücresiz ekspresyon sisteminde veya E. coli'de rekombinant ekspresyon ile üretilebilir. Bakteriyel ekspresyona göre RRL kullanarak in vitro ekspresyonun birçok avantajı vardır. RRL ifade protokolü basit ve hızlıdır ve birçok farklı substratın paralel olarak hazırlanmasına izin verir. Birçok durumda, ilgili proteini içeren RRL ekstraktı, bölünme tahlilinde kullanılmadan önce -80 ° C'de saklanabilir (bunun her substrat için ayrı ayrı belirlenmesi gerekmesine rağmen). Varsayılan substrat, SDS-PAGE'den sonra otoradyografi ile kolay analiz sağlayan S35-Met ile etiketlenebilir. Bu, substrata özgü bir antikor mevcut değilse, özellikle yararlıdır. Alternatif olarak, S35-Met etiketlemesi istenmiyorsa, varsayılan substrat, immünoblotlama yoluyla kaspaz bölünmesinin tespit edilmesini sağlayan Flag, HA veya Myc etiketleri gibi yaygın etiketlerle etiketlenebilir.
Bu protokolün başarısının, rekombinant Dronc ve Drice proteinlerinin dikkatli ve tutarlı bir şekilde saflaştırılmasına bağlı olduğu vurgulanmalıdır. Ne yazık ki, bu proteinler ne buzdolabında saklanamaz - kısa süreli bile değil - ne buzdolabında ne de dondurulamaz. Enzimatik aktiviteyi bir gecede depolanan herhangi bir biçimde kaybederler. Bu nedenle, bölünme testi gününde taze olarak hazırlanmaları gerekir. Test edilen aday protein(ler)den bağımsız olarak, DriceC211A, Droncwt preparatının enzimatik aktivitesini doğrulamak için her zaman pozitif bir kontrol olarak kullanılmalıdır (bkz. Şekil 2B, C). Alternatif olarak, Dronc ve Drice preparatlarının aktivitesi, florojenik sentetik tetrapeptit substratlarının in vitro bölünmesiile de test edilebilir 2,9,31.
Aday substratları tespit etmek için antikorlar kullanılıyorsa, kullanıcı32,33 tarafından doğrulanmaları gerekir. Bu, Flag, HA, Myc veya diğerleri gibi epitop etiketlerini tespit eden ticari olarak temin edilebilen antikorlar için de geçerlidir. Düşük antikor kalitesi önemli sonuçları gizleyebilir. Hem N- hem de C-terminusundaki aday substratların farklı etiketlerle çift epitop etiketlenmesi de önerilir34. Bölünme meydana gelirse, çift etiketleme her iki bölünme ürününü izlemeye yardımcı olur ve bölünmenin bir veya daha fazla bölgede meydana gelip gelmediğini aydınlatmaya yardımcı olabilir.
Bu protokol, Dronc, Drice'nin bilinen biyolojik substratını kolayca doğrularken, sınırlamalar da vardır. Bir sınırlama, bunun rekombinant proteinlerle in vitro bir protokol olmasıdır. Bu tahlillerde, kaspazlar fizyolojik olarak yüksek bir konsantrasyonda bulunurlar, bu da E. coli'de kendiliğinden otomatik olarak işleyebildikleri gözleminden açıkça anlaşılmaktadır. Spontan otomatik işleme genellikle fizyolojik koşullar altında gerçekleşmez. Bu yüksek kaspaz konsantrasyonu, yanlış pozitiflerle sonuçlanan sahte aktiviteye neden olabilir. Yanlış pozitifler, in vitro bölünme reaksiyonundaki kaspaz konsantrasyonunu düşürerek ortadan kaldırılabilir. Ayrıca, aşağıda daha ayrıntılı olarak belirtildiği gibi, gerçek substratları doğrulamak ve yanlış pozitifleri ortadan kaldırmak için ek testler gereklidir.
Rekombinant kaspazlar, normal hücresel ortamlarında in vivo olarak sahip oldukları özgüllüğe sahip olmayabilir. Örneğin, kaspazların aktivitesi post-translasyonel modifikasyonlarla değiştirilebilir. Bunlar rekombinant proteinlerde mevcut değildir. Ayrıca, in vivo, Dronc da dahil olmak üzere başlatıcı kaspazlar, apoptozom gibi büyük protein komplekslerine dahil edilir. Bu protokol koşulları altında, apoptozom oluşumu sağlanamaz. Bu, kendi başına zorlukları olan Drosophila Apaf-1'in (aka Dark veya Hac-1) 35-37'nin rekombinant ifadesini gerektirir. Bu nedenle, in vitro, Dronc in vivo sahip olduğu aynı özgüllüğe sahip olmayabilir.
Dronc'un apoptotik olmayan süreçler için farklı bir protein kompleksine dahil edilmesi de düşünülebilir. Bu, Dronc'a farklı bir bölünme özgüllüğü kazandırabilir, bu da Dronc'un neden apoptotik olmayan koşullar altında apoptozu indüklemediğini açıklayabilir. Bununla ilgili olarak, CasCleave yeni kaspaz substratlarını tahmin etmek için bilinen bölünme konsensüs bölgelerini kullanır. Bununla birlikte, aynı bölünme konsensüs bölgelerinin apoptotik olmayan süreçler için de kullanılıp kullanılmadığı bilinmemektedir. Aslında, son zamanlarda, Caspase-3'ün, civciv embriyosu38'de gelişen işitsel beyin sapında apoptotik olmayan bir süreç sırasında tercih edilen konsensüs bölgesini değiştirdiği gösterilmiştir. Benzer şekilde, başlatıcı kaspazlar farklı protein komplekslerine dahil edilirse, farklı bir özgüllüğe sahip olabilirler ve bu nedenle farklı konsensüs dizilerinde ayrılabilirler.
Bu sınırlamalar, yalnızca bu protokolde açıklanan in vitro bölünme tahlillerine güvenmenin yeterli olmadığını göstermektedir. Bu protokol kullanılarak elde edilen sonuçları daha da doğrulamak için alternatif yaklaşımlar kullanılmalıdır. İdeal olarak, aşağıdaki soruları ele almak için in vivo testler kullanılmalıdır: Aday protein, apoptotik olmayan süreç sırasında in vivo olarak proteolitik olarak işlenir mi? Eğer öyleyse, aynı bölünme bölgesi in vivo ve in vitro olarak kullanılıyor mu? Bölünme, bölünme bölgesinin mutagenezisi ile bloke edilirse sonuç nedir? Aday substratın işlenmesi kaspazlara bağlı mıdır ve eğer öyleyse, hangisi? Apoptotik olmayan süreç için bölünme parçalarının rolü nedir? Bu sorular, C. elegans ve Drosophila gibi genetik model organizmalarda standart genetik ve transgenik yöntemler kullanılarak kolayca ele alınabilir.
Özetle, bu protokol enzimatik olarak aktif kaspazlar, özellikle Drosophila kaspazları Dronc ve Drice üretmek için güvenilir ve tutarlı bir yöntemi tanımlar. Bu protokolün nihai amacı, Dronc'un genetik, biyokimyasal veya biyoinformatik yaklaşımlarla tanımlanan aday substratları in vitro olarak parçalayıp ayıramayacağını incelemektir. Önceki paragrafta açıklandığı gibi, bu proteinleri in vivo olarak kaspaz substratları olarak doğrulamak için ek testler gereklidir. Metazoa boyunca kaspaz genlerinin korunum derecesi göz önüne alındığında, bu protokolü diğer organizmalardan gelen kaspazlara da uyarlamak mümkün olmalıdır.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Dr. Elif Kamber-Kaya'ya laboratuvarda protokolün oluşturulmasına yönelik yardımlarından dolayı teşekkür ederiz. Dr. Guy Salvesen nazikçe DriceC211A mutant 9'u sağladı. Bu çalışma, Ulusal Sağlık Enstitüleri'nin (NIH) Ulusal Genel Tıp Bilimleri Enstitüsü'nden (NIGMS) 2R35GM118330 hibe numarası altında bir MIRA ödülü ile finanse edildi. Fon verenlerin çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ampicillin | Fisher | BP1760-25 | |
| Anti-His antibody | Sigma-Aldrich | MA1-21315 | |
| Anti-mouse IgG, HRP-linked Antibody | Cell signaling | 7076P2 | |
| Anti-Myc antibody | Santa Cruz Biotechnology | sc-40 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell signaling | 7074P2 | |
| Benchtop Centrifuge | Eppendorf | 5415 R | |
| Benzonase | Sigma-Aldrich | E1014-5KU | |
| BioPhotometer | Eppendorf | #6131 | |
| BL21 (DE3) pLysS Competent Cells | Promega | L1195 | |
| Centrifuge rotor | Beckman Coulter | JA-25.50 | |
| CHAPS | Sigma-Aldrich | C3023-1G | |
| ChemiDoc with image software | Bio-Rad | Universal Hood II | For Chemiluminiscence imaging |
| Chemiluminiscence Substrate | Thermofisher Scientific | 34095 | For Chemiluminiscence imaging |
| Cleaved Drosophila ICE (drICE) (Asp230) Antibody | Cell Signaling Technology | 9478S | |
| Disposable cuvettes | Fisher Scientific | 14955128 | Used to measure bacterial growth and protein concentration |
| Dithiothreitol (DTT) | Bio-Rad | #1610610 | |
| Erlenmeyer flasks, 1000 mL | Millipore sigma | CLS49801L | For LB agar media preparation and autoclaving |
| Erlenmeyer flasks, 250 mL | Millipore sigma | CLS4980250 | For bacterial culture growth and induction. |
| Ethylene-diamine-tetra-acetic Acid (EDTA) | Sigma-Aldrich | E5134 | |
| Gel extraction kit | Qiagen | 28704 | |
| Gel tank SDS-PAGE system | Thermofisher Scientific | STM1001 | |
| Glycine | Sigma-Aldrich | G8898 | |
| Halt Protease Inhibitor Cocktail (100x) | Thermofisher scientific | 87786 | |
| HEPES | Sigma-Aldrich | H3375 | |
| His-Drice-pET28a | This study | N/A | Available from authors |
| His-DriceC211A-pET28a | This study | N/A | Available from authors |
| His-Dronc-pET28a | This study | N/A | Available from authors |
| His-DroncC318A-pET28a | This study | N/A | Available from authors |
| Imidazole | Sigma-Aldrich | I2399-100G | |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermofisher Scientific | FERR0392 | |
| Kanamycin | Fisher Scientific | BP906-5 | |
| LB Agar, Miller (Powder) | Fisher Scientific | BP1425-500 | |
| LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Lysozyme | Thermofisher Scientific | 90082 | |
| Microbiological plate incubator | Fisher Scientific | 11-690-650D | For colony growth after transformation |
| Microcentrifuge tubes, 0.5 mL | Eppendorf | 22363611 | |
| Microcentrifuge tubes, 1.5 mL | Eppendorf | 22363204 | |
| Midiprep kit | Qiagen | 12243 | |
| Mini tube rotator | Fisher Scientific | 05-450-127 | for mixing bacterial lysates and Ni-NTA agarose |
| Miniprep kit | Qiagen | 27106 | |
| Motorized Pipette Controller | Gilson | F110120 | For using serological pipettes |
| NaH2PO4 | Fisher Scientific | BP330-1 | |
| Ni-NTA Agarose | Qiagen | 30210 | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm, Midi Protein Gel, 20-well | Thermofisher Scientific | WG1402BOX | |
| NuPAGE LDS Sample Buffer (4x) | Thermofisher Scientific | NP0007 | |
| NuPAGE MOPS SDS Running Buffer (20x) | Thermofisher Scientific | NP0001 | |
| NuPAGE Transfer Buffer (20x) | Invitrogen | NP00061 | |
| Orbital shaking incubator with temperature control | New Brunswick Scientific | C25 incubator shaker | |
| Petridish 100 mm x 15 mm | Fisher Scientific | FB0875712 | |
| Plating beads | Zymo research | S1001 | For spreading culture on AmpR/KanR plates |
| Polypropylene Columns (1 mL) | Qiagen | 34924 | For purification of His-tagged proteins |
| Precision Plus Protein Standards | Bio-Rad | #161-0374 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| pT7CFE1-NMyc | Thermofisher Scientific | 88863 | For cloning substrates for RRL expression |
| PVDF membrane | Invitrogen | LC2007 | |
| 14 mL Polypropylene round bottom tubes | Fisher Scientific | 352029 | For growing plasmid cultures |
| QiaRack | Qiagen | 19095 | For holding polypropylene columns during purification |
| Refrigerated High speed Centrifuge | Beckman Coulter | Avanti J-25 | |
| rRNasin Ribonuclease Inhibitor | Promega | N251A | For RRL expression |
| Sodium chloride | Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Fisher Scientific | BP359-500 | |
| Sterile Falcon tubes, 15 mL | Fisher Scientific | 05-527-90 | |
| Sterile Falcon tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Sucrose | Sigma-Aldrich | S70903-250G | |
| 1 mL Serological Pipets, Sterile | celltreat | 229001B | For bacterial cell lysis in 50 mL tubes |
| TnT Coupled Reticulocyte Lysate -T7 | Promega | L4611 | |
| Tris-base | Fisher Scientific | BP154-1 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Waterbath | Fisher Scientific | 2340 | |
| Western wet transferring cassette | Thermofisher Scientific | STM2001 |
Referanslar
- Kumar, S. Caspase function in programmed cell death. Cell Death and Differentiation. 14 (1), 32-43 (2007).
- Hawkins, C. J., et al. The Drosophila caspase DRONC cleaves following glutamate or aspartate and is regulated by DIAP1, HID, and GRIM. Journal of Biological Chemistry. 275 (35), 27084-27093 (2000).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Meier, P., Silke, J., Leevers, S. J., Evan, G. I. The Drosophila caspase DRONC is regulated by DIAP1. EMBO Journal. 19 (4), 598-611 (2000).
- Timmer, J. C., Salvesen, G. S. Caspase substrates. Cell Death and Differentiation. 14 (1), 66-72 (2007).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. Journal of Biological Chemistry. 274 (17), 11549-11556 (1999).
- Zou, H., Henzel, W. J., Liu, X., Lutschg, A., Wang, X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 90 (3), 405-413 (1997).
- Stennicke, H. R., et al. Caspase-9 can be activated without proteolytic processing. Journal of Biological Chemistry. 274 (13), 8359-8362 (1999).
- Snipas, S. J., Drag, M., Stennicke, H. R., Salvesen, G. S. Activation mechanism and substrate specificity of the Drosophila initiator caspase DRONC. Cell Death and Differentiation. 15 (5), 938-945 (2008).
- Fraser, A. G., Evan, G. I. Identification of a Drosophila melanogaster ICE/CED-3-related protease, drICE. EMBO Journal. 16 (10), 2805-2813 (1997).
- Denton, D., Mills, K., Kumar, S. Methods and protocols for studying cell death in Drosophila. Methods in Enzymology. 446, 17-37 (2008).
- Dorstyn, L., Kumar, S. A biochemical analysis of the activation of the Drosophila caspase DRONC. Cell Death and Differentiation. 15 (3), 461-470 (2008).
- Aram, L., Yacobi-Sharon, K., Arama, E. CDPs: caspase-dependent non-lethal cellular processes. Cell Death and Differentiation. 24 (8), 1307-1310 (2017).
- Arama, E., Baena-Lopez, L. A., Fearnhead, H. O. Non-lethal message from the Holy Land: The first international conference on nonapoptotic roles of apoptotic proteins. FEBS Journal. 288 (7), 2166-2183 (2021).
- Baena-Lopez, L. A. All about the caspase-dependent functions without cell death. Seminars in Cell and Developmental Biology. 82, 77-78 (2018).
- Florentin, A., Arama, E. Caspase levels and execution efficiencies determine the apoptotic potential of the cell. Journal of Cell Biology. 196 (4), 513-527 (2012).
- Amcheslavsky, A., et al. Plasma membrane localization of apoptotic caspases for non-apoptotic functions. Developmental Cell. 45 (4), 450-464 (2018).
- Bergmann, A. Are membranes non-apoptotic compartments for apoptotic caspases. Oncotarget. 9 (60), 31566-31567 (2018).
- Song, J., et al. Cascleave: towards more accurate prediction of caspase substrate cleavage sites. Bioinformatics. 26 (6), 752-760 (2010).
- Wang, M., et al. Cascleave 2.0, a new approach for predicting caspase and granzyme cleavage targets. Bioinformatics. 30 (1), 71-80 (2014).
- Kamber Kaya, H. E., Ditzel, M., Meier, P., Bergmann, A. An inhibitory mono-ubiquitylation of the Drosophila initiator caspase Dronc functions in both apoptotic and non-apoptotic pathways. PLoS Genetics. 13 (2), 1006438 (2017).
- Stennicke, H. R., Salvesen, G. S. Caspases: preparation and characterization. Methods. 17 (4), 313-319 (1999).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual (4th edition). , (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253 (2007).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Brunelle, J. L., Green, R. Coomassie blue staining. Methods in Enzymology. 541, 161-167 (2014).
- Hirano, S. Western blot analysis. Methods in Molecular Biology. 926, 87-97 (2012).
- Kim, B. Western blot techniques. Methods in Molecular Biology. 1606, 133-139 (2017).
- Luthi, A. U., Martin, S. J. The CASBAH: a searchable database of caspase substrates. Cell Death and Differentiation. 14 (4), 641-650 (2007).
- Fogarty, C. E., et al. Extracellular reactive oxygen species drive apoptosis-induced proliferation via Drosophila macrophages. Current Biology. 26 (5), 575-584 (2016).
- Song, Z., et al. Biochemical and genetic interactions between Drosophila caspases and the proapoptotic genes rpr, hid, and grim. Molecular and Cellular Biology. 20 (8), 2907-2914 (2000).
- Edfors, F., et al. Enhanced validation of antibodies for research applications. Nature Communications. 9 (1), 4130 (2018).
- Uhlen, M., et al. A proposal for validation of antibodies. Nature Methods. 13 (10), 823-827 (2016).
- Brizzard, B. Epitope tagging. Biotechniques. 44 (5), 693-695 (2008).
- Kanuka, H., et al. Control of the cell death pathway by Dapaf-1, a Drosophila Apaf-1/CED-4-related caspase activator. Molecular Cell. 4 (5), 757-769 (1999).
- Rodriguez, A., et al. Dark is a Drosophila homologue of Apaf-1/CED-4 and functions in an evolutionarily conserved death pathway. Nature Cell Biology. 1 (5), 272-279 (1999).
- Zhou, L., Song, Z., Tittel, J., Steller, H. HAC-1, a Drosophila homolog of APAF-1 and CED-4 functions in developmental and radiation-induced apoptosis. Molecular Cell. 4 (5), 745-755 (1999).
- Weghorst, F., Mirzakhanyan, Y., Hernandez, K. L., Gershon, P. D., Cramer, K. S. Non-Apoptotic caspase activity preferentially targets a novel consensus sequence associated with cytoskeletal proteins in the developing auditory brainstem. Frontiers in Cell and Developmental Biology. 10, 844844 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır