Method Article
В пробирке Анализ расщепления с использованием очищенных рекомбинантных Drosophila Caspases для скрининга субстрата
В этой статье
Резюме
Здесь мы представляем протокол экспрессии и очистки рекомбинантных Drosophila caspases Dronc и Drice, а также их использование в анализах расщепления in vitro .
Аннотация
Каспазы являются очень специфическими протеазами гибели клеток, которые участвуют в апоптотических и неапоптотических процессах. В то время как роль каспаз во время апоптоза была очень хорошо определена и многие апоптотические протеолитические субстраты каспаз были идентифицированы и охарактеризованы, роль каспаз для неапоптотических процессов не совсем понятна. В частности, до сих пор было выявлено мало неапоптотических субстратов каспаз. Здесь, чтобы облегчить идентификацию и характеристику потенциальных подложек каспазы, описан протокол, который позволяет тестировать субстраты-кандидаты в анализах расщепления каспазы in vitro . Этот протокол включает в себя производство и очистку рекомбинантных белков каспазы, производство субстратов-кандидатов либо рекомбинантно, либо в бесклеточной системе экспрессии, а также фактическую реакцию расщепления in vitro с последующим SDS-PAGE и иммуноблоттингом. Этот протокол предназначен для Drosophila caspases Dronc и Drice, но может быть легко адаптирован для каспаз других организмов, включая млекопитающих.
Введение
Запрограммированная гибель клеток или апоптоз выполняется классом высокоспециализированных протеаз гибели клеток, называемых каспазами (рассмотренных в ссылке1). Caspases - это протеазы Cys, которые содержат остаток Cys в каталитическом участке. Они определили консенсусные участки расщепления и расщепляют субстраты протеолитически после остатков Asp (хотя сообщалось, что Drosophila caspase Dronc также расщепляется после остатков Glu2). Они подразделяются на инициирующие (также известные как апикальные или восходящие) и эффекторные (палач или нисходящий поток) каспазы. Инициирующие каспазы активируют эффекторные каспазы. Например, у млекопитающих инициатор каспазы Каспазы-9 расщепляется и активирует эффектор каспазы Каспазы-33. Аналогичным образом, у Drosophila melanogaster каспаза-9-ортолог Dronc расщепляется и активирует caspase-3-ortholog Drice 2,4. Во время апоптоза эффекторные каспазы расщепляют сотни субстратов, что приводит к гибели клетки5.
Каспазы синтезируются в виде неактивных проферментов (зимогенов) в клетке. В этой форме они содержат N-концевой продомен, большую субъединицу с каталитическим Cys в центральной части профермента и небольшую субъединицу на C-конце1 (рисунок 1). Механизм активации различен между инициатором и эффектором каспаз. Инициаторные каспазы (Caspase-9, Dronc) требуют димеризации для активации, которая происходит путем включения в большой белковый комплекс, называемый апоптосомой6. Для включения в апоптосому Caspase-9 и Dronc несут домен активации и рекрутирования каспазы (CARD) в N-концевом продомене (рисунок 1). Компонент апоптосомы Apaf-1 также содержит CARD и набирает Caspase-9 или Dronc через взаимодействие CARD/CARD в апоптосому 3,6,7. В то время как Caspase-9 и Dronc могут быть протеолитически обработаны в апоптосоме, эта обработка не полностью требуется для ферментативной активности 8,9.
Напротив, эффекторные каспазы (Caspase-3, Drice) не несут CARD в своих продоменах и не включаются в крупные белковые комплексы для активации1. Они зависят от протеолитического расщепления активным Caspase-9 или Dronc1 соответственно. Активная эффекторная каспаза образует тетрамер, состоящий из двух больших и двух малых субъединиц, и, таким образом, содержит два каталитических участка (рисунок 1). Важно отметить, что для этого протокола рекомбинантная экспрессия каспаз в E. coli вызывает автоматическую обработку и активацию каспаз, включая Drice10 и Dronc 2,8,9,11,12, даже в отсутствие Apaf-1. Эта автообработка позволяет проводить анализы расщепления in vitro субстратов-кандидатов с рекомбинантным белком каспазы.
Каспазы не только участвуют в апоптозе, но они также могут иметь много неапоптотических функций, включая пролиферацию, дифференцировку, миграцию клеток, обрезку нейронов, врожденный иммунитет и другие 13,14,15. В настоящее время неизвестно, как клетки могут выживать, несмотря на содержание активных каспаз во время неапоптотических процессов. Возможно, что эти клетки активируют каспазы только на сублетальных уровнях16 или они изолируют активные каспазы в неапоптотических компартментах клетки, таких как плазматическая мембрана17,18. Таким образом, идентификация и проверка неапоптотических субстратов не только покажет, как каспазы опосредуют неапоптотические процессы, но также может помочь понять, как клетки могут выжить в присутствии активных каспаз.
Белки-кандидаты в качестве субстратов каспазы могут быть идентифицированы с использованием генетических и биохимических методов. Идентифицированные белки могут быть проверены на наличие консенсусных участков расщепления Dronc. Это можно сделать, визуально проверив последовательность белка или используя более сложные онлайн-биоинформационные инструменты, такие как CasCleave (https://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)19,20. Эти инструменты используют известные консенсусные участки расщепления каспаз и структурные соображения для прогнозирования новых целей каспаз. Хотя CasCleave включает в себя информацию о проверенных субстратах от человеческих Caspases-1, -3, -6, -7 и -8, он, тем не менее, также может быть полезен для целей, описанных здесь, поскольку эти каспазы и их консенсусные участки расщепления хорошо сохраняются. Однако, поскольку участок расщепления Дронка не имеет четкого определения (в двух исследованиях были выявлены два различных оптимальных участка расщепления, TATD/E2 и LALD9), субстраты-кандидаты также исследуются на наличие других участков расщепления каспазы, включая Drice.
Для проверки прогнозируемых субстратов каспаз необходимы дополнительные анализы. Одним из таких анализов является демонстрация того, что данная каспаза может фактически расщеплять белок-кандидат in vitro. Здесь мы предоставляем удобный протокол для анализов расщепления in vitro каспазы. Используя этот протокол, субстраты-кандидаты тестируются с Dronc в качестве каспазы. Они также могут быть протестированы в качестве субстратов Drice. Хотя этот протокол написан для Drosophila caspases Dronc и Drice, он также может быть адаптирован для каспаз других организмов.
Экстракция и очистка Dronc и Drice вместе с анализом расщепления in vitro должны быть выполнены в тот же день из-за потери каталитической активности этими каспазами. Этот протокол был модифицирован и оптимизирован из предыдущих публикаций 8,9,11,12,21,22. В этом протоколе четыре различных белка каспазы рекомбинантно экспрессируются в штамме E. coli BL21 (DE3) pLysS. Этими белками являются: 6xHis-Droncwt, 6xHis-DroncC318A, 6xHis-Dricewt и 6xHis-DriceC211A. Каждый из этих белков помечен 6 остатками гистидина (6xHis) на N-конце для очистки. Droncwt и Dricewt являются белками дикого типа и могут автоматически перерабатываться в активную каспазу при рекомбинантной экспрессии. DroncC318A и DriceC211A кодируют мутантные формы Dronc и Drice, которые изменяют каталитический остаток Cys на остаток Ala. Эти конструкции каталитически неактивны и не могут автоматически обрабатываться (см. рисунок 2A). Они используются в качестве элементов управления в анализе расщепления. Поскольку DriceC211A не может автоматически обрабатываться, он также используется в качестве модельного субстрата для Droncwt в анализе расщепления in vitro, описанном здесь.
протокол
1. Экспрессия рекомбинантной каспазы у бактерий
- Клонирование интересующего гена (Caspase или предполагаемого субстрата) в вектор бактериальной экспрессии с N- и/или C-концевым тегом (метками) с использованием стандартных протоколов23.
ПРИМЕЧАНИЕ: Метки могут увеличивать растворимость рекомбинантных белков и используются для очистки рекомбинантных белков. Здесь Dronc, Drice и их каталитические мутанты клонируются в вектор pET28a, который обеспечивает N-концевую метку 6xHis (pET28a-6xHis-Droncwt, pET28a-6xHis-DroncC318A, pET28a-6xHis-Dricewt, pET28a-6xHis-DriceC211A); (информацию о грунтовке см. в дополнительной таблице 1). - Трансформируйте векторы с интересующими генами в компетентные клетки BL21 (DE3) pLysS E. coli с помощью стандартных процедур23,24. Нанесите трансформационную смесь на пластины агара LB с соответствующим антибиотиком (канамицином в случае pET28a) для отбора трансформированных бактерий. (См. Дополнительную таблицу 2.)
- Выберите колонию из пластины и привите в 5 мл среды LB, содержащей соответствующий антибиотик, чтобы расти в течение ночи при 37 ° C при 220 оборотах в минуту на встряхивающей платформе.
- На следующий день подготовьте 30-50 мл (на образец) lb-среды с антибиотиком и добавьте 1 мл выращенной на ночь культуры. Оптическая плотность при 600 нм (OD600) с использованием биофотометра/спектрофотометра должна составлять от 0,1 до 0,2.
- Выращивайте культуру при 37 °C при 220 об/мин на встряхивающей платформе до тех пор, пока OD600 не достигнет 0,6. Проверяйте OD600 каждый час, пока он не достигнет 0,6. Это занимает от 2 до 3 часов.
- Чтобы индуцировать экспрессию белка (каспазы), добавляют IPTG к конечной концентрации 0,1-0,2 мМ (разбавляют 1:1000-1:500 из запаса IPTG, см. Дополнительную таблицу 2).
- Выращивайте культуры в течение 3 ч при 30 °C при 220 об/мин.
ПРИМЕЧАНИЕ: Время и температура зависят от того, какой белок экспрессируется и его растворимость. Эти условия, возможно, потребуется скорректировать, если выражены различные каспазы или подложки. - Через 3 ч вращайте культуры в 50 мл центрифужных пробирок в течение 20 мин при 4 °C при 2000 х г. Выбросьте супернатант и приступайте к гранулированию.
ПРИМЕЧАНИЕ: Протокол может быть остановлен на этом этапе и продолжен позже. Бактериальные гранулы могут быть заморожены при -80 °C.
2. Мелкомасштабная экстракция рекомбинантных каспаз
- Выньте замороженные трубки с гранулированными культурами из хранилища при температуре -80 °C и держите их на льду в течение 10 минут, чтобы смягчить гранулы.
- Через 10 мин добавляют 0,6 мл буфера лизиса бактериальных клеток (Дополнительная таблица 2), дополненные свеженазначенными ингибиторами протеазы, 10 мг/мл лизоцима и 50 ЕД/мл бензоназы в гранулсодержащие пробирки с помощью пипеточного контроллера с серологической пипеткой 1 мл.
- С тем же наконечником пипетки растворите гранулу, пипеткой вверх и вниз, пока не будет виден прозрачный бледно-желтый раствор без каких-либо частиц гранул. Инкубировать в течение 30 мин на льду.
- Переложите лизат в соответствующие центрифужные трубки и центрифугируйте лизаты при 17 000 х г в течение 40 мин при 4 °C.
- Перенесите супернатанты в микроцентрифужную трубку объемом 1,5 мл. Это сырой экстракт, содержащий каспазы.
- Держите трубки на льду и приступайте к очистке с помощью Ni-NTA агарозы.
3. Мелкомасштабная очистка его меченых каспаз
- Добавьте 0,2 мл 50% суспензии Ni-NTA агарозы в каждую пробирку экстрактов каспазы со стадии 2,5. Поверните трубки на сквозном ротаторе в течение 1 ч при 4 °C.
- Через 1 ч добавляют экстракт с Ni-NTA агарозой в 1 мл полипропиленовых столбиков с неповрежденным наконечником, помещают в стойку. Дайте постоять 5 минут.
- Через 5 мин снимите крышку колонн и дайте супернатанту вытечь под действием силы тяжести.
- Осторожно добавьте 1 мл промывочного буфера (дополнительная таблица 2) в колонки, не нарушая упакованную смолу Ni-NTA агарозы и промыть ее через гравитационный поток.
- Выполните этап стирки три раза.
- Для элюирования каспаз поместите микроцентрифужные трубки объемом 1,5 мл под сопло коллектора колонн после полного слива промывочного буфера.
- Добавьте 0,5 мл элюционного буфера (дополненного 1x ингибиторами протеазы непосредственно перед использованием) к каждой колонке и соберите элюат в пробирки микроцентрифуги объемом 1,5 мл.
ПРИМЕЧАНИЕ: Мелкоочищенный очищенный элюат будет прозрачным по цвету. - Держите элюаты на льду и измеряйте концентрацию белков с помощью анализа Брэдфорда25. Подтвердите чистоту/однородность очищенных каспаз с помощью SDS-PAGE, за которым следует окрашивание Coomassie Blue26.
ПРИМЕЧАНИЕ: Выход культуры LB объемом 50 мл колеблется от 0,5 до 1,5 мг белка каспазы. Учитывая, что для элюирования используется 0,5 мл элюционного буфера, концентрация колеблется от 1 до 3 мг/мл. Важно использовать очищенные элюаты каспазы для анализов расщепления in vitro в тот же день лизиса и очистки, поскольку эти препараты каспазы теряют активность в течение ночи.
4. Экспрессия предполагаемого субстрата каспазы в бесклеточных экспрессионных системах
ПРИМЕЧАНИЕ: В этом протоколе Drice, естественный субстрат Dronc, получают как рекомбинантной экспрессией в E. coli (см. раздел 3 выше), так и экспрессией в лизате ретикулоцитов кролика (RRL), бесклеточной системе экспрессии млекопитающих (этот раздел см. ниже).
- Клонирование гена предполагаемого субстрата в вектор экспрессии, содержащий промотор T7, T3 или SP6, используя стандартные процедуры23.
ПРИМЕЧАНИЕ: В этом протоколе DriceC211A используется в качестве модельного субстрата и был клонирован в вектор pT7CFE1-N-Myc, который несет промотор T7 для экспрессии генов и помечает предполагаемый белковый субстрат N-концевой Myc-меткой для обнаружения иммуноблоттингом. - В RRL субстраты-кандидаты могут быть синтезированы как радиоактивно, так и нерадиоактивно.
- Нерадиоактивный синтез: в микроцентрифужной пробирке объемом 0,5 мл добавьте 25 мкл РРЛ, 2 мкл реакционного буфера, 0,5 мкл смеси аминокислот -минус лейцин (1 мМ), 0,5 мкл смеси аминокислот минус метионин (1 мМ), 1 мкл ингибитора рибонуклеазы (40 ЕД/мкл), 2 мкл шаблона ДНК (0,5 мкг/мкл) и 1 мкл Т7-РНК-полимеразы. Добавьте воду без нуклеазы, чтобы отрегулировать конечный объем реакции до 50 мкл. Осторожно перемешайте компоненты путем пипетки или перемешивания кончиком пипетки и ненадолго покрутите вниз.
ПРИМЕЧАНИЕ: Лизат RRL содержит 100-200 мг/мл эндогенных белков. Для реакций трансляции in vitro добавляют RRL в концентрации 50% (здесь реакция 25 мкл/50 мкл). - Радиоактивный синтез: в микроцентрифужной трубке объемом 0,5 мл добавьте 25 мкл лизата РРЛ, 2 мкл реакционного буфера, 0,5 мкл смеси аминокислот минус метионин (1 мМ), 1 мкл ингибитора рибонуклеазы (40 ЕД/мкл), 2 мкл шаблона ДНК (0,5 мкг/мкл), 2 мкл меченогоS35 метионина (1000 Ки/ммоль при 10 мКи/мл) и 1 мкл Т7-РНК-полимеразы. Добавьте воду без нуклеазы, чтобы отрегулировать конечный объем реакции до 50 мкл. Осторожно перемешайте компоненты путем пипетки или перемешивания кончиком пипетки и ненадолго покрутите вниз. Утилизируйте наконечники и трубки в контейнер с радиоактивными отходами.
ПРИМЕЧАНИЕ: Не добавляйте аминокислотную смесь без лейцина. Вектор pT7CFE1 использует промотор T7 для экспрессии белка. Другие векторы используют промоторы T3 или SP6. В этом случае вместо Т7 РНК-полимеразы следует использовать РНК-полимеразы Т3 или СП6. Пожалуйста, убедитесь, что шаблон ДНК имеет высокую чистоту.
- Нерадиоактивный синтез: в микроцентрифужной пробирке объемом 0,5 мл добавьте 25 мкл РРЛ, 2 мкл реакционного буфера, 0,5 мкл смеси аминокислот -минус лейцин (1 мМ), 0,5 мкл смеси аминокислот минус метионин (1 мМ), 1 мкл ингибитора рибонуклеазы (40 ЕД/мкл), 2 мкл шаблона ДНК (0,5 мкг/мкл) и 1 мкл Т7-РНК-полимеразы. Добавьте воду без нуклеазы, чтобы отрегулировать конечный объем реакции до 50 мкл. Осторожно перемешайте компоненты путем пипетки или перемешивания кончиком пипетки и ненадолго покрутите вниз.
- Инкубируют реакцию при 30 °C в течение 90 мин.
- Вращайтесь ненадолго в течение 10 с и поместите трубки на лед. Проверить уровень экспрессии предполагаемого субстрата в РРЛ с помощью SDS-PAGE и иммуноблоттинга/ауторадиографии.
ПРИМЕЧАНИЕ: Количество экстракта RRL, добавляемого к реакции расщепления, должно основываться на количестве белка, которое может быть обнаружено методом обнаружения (либо иммуноблоттинг, либо ауторадиография S35 ). Перейдите к анализу расщепления in vitro (следующая секция) или храните его при -80 °C.
5. Анализ расщепления in vitro с субстратами, полученными с помощью RRL
- Возьмем предполагаемый (сгенерированные субстраты), как описано в разделе 4. В этом протоколе в качестве модельного субстрата используется N-Myc-DriceC211A .
- В зависимости от уровня экспрессии предполагаемого субстрата (определяемого отдельно иммуноблотом или ауторадиографическим анализом, см. этап 4.4) используйте 1-10 мкл РРЛ, запрограммированного белком, представляющим интерес в анализе расщепления.
- Добавьте 10 мкг очищенного белка каспазы, полученного в разделах 1, 2 и 3.
- Доведите общий объем реакции до 50 мкл с помощью буфера анализа каспазы.
- Инкубируют реакции на водяной бане при 30 °C в течение 3 ч. Обязательно включите соответствующие элементы управления в анализ расщепления. Здесь каталитический мутант DroncC318A используется в качестве контроля.
- Через 3 ч остановите реакции, перенеся трубки на лед.
- Добавьте один том буфера образцов СПД, содержащего 50 мМ DTT. Реакция полностью прекращается с добавлением буфера образца LDS.
- Инкубируйте образцы при 75 °C в тепловом блоке в течение 10 мин.
- Быстро вращайте, смешивайте путем пролистывания, загружайте 24 мкл на образец и запускайте SDS-PAGE (см. раздел 7) или храните образцы при -20 °C.
6. Анализ расщепления in vitro с бактериально выраженным рекомбинантным белком субстрата
- Добавьте 10 мкг очищенного субстрата-кандидата (здесь 6xHis-DriceC211A, полученного в секциях 1, 2 и 3) в микроцентрифужную трубку объемом 0,5 мл.
- Добавьте 10 мкг очищенных белков каспазы, образующихся в разделах 1 и 2. Доведите общий объем до 50 мкл с помощью буфера анализа каспазы.
- Выполните шаги с 5.5 по 5.9.
7. SDS-PAGE и иммуноблоттинг
- Загрузите реакции расщепления (24 мкл) на 4%-12% градиентные гели Tris-Glycine или Bis-Tris (Таблица материалов) и выполните белковый электрофорез и иммуноблоттинг (или ауторадиографию при использовании S35-меченых субстратов) для визуализации результатов с использованием стандартных процедур27,28.
ПРИМЕЧАНИЕ: Здесь, в этом протоколе, использовались градиентные гели Bis-Tris с работающим буфером Mops и буфером загрузки LDS. В целом, обычно используемые протоколы PAGE гелей Tris-Glycine работают с использованием буфера работы Tris-Glycine-SDS и буфера загрузки SDS.
Результаты
Этот протокол содержит пошаговые инструкции по индукции белка каспазы в E. coli, очистке рекомбинантных Drosophila caspases Dronc и Drice, синтезу субстратов-кандидатов и реакции расщепления in vitro с субстратами-кандидатами (здесь DriceC211A) и каспазой Dronc. Каталитический мутант DriceC211A был использован в качестве модельного субстрата в этом анализе, поскольку он не обладает активностью автоматической обработки (рисунок 2A) и остается полноразмерным до тех пор, пока не будет расщеплен Droncwt. DriceC211A всегда следует использовать в качестве положительного контроля для подтверждения того, что препарат Droncwt обладает ферментативной активностью.
На фиг.2А приведен репрезентативный пример экспрессии и очистки рекомбинантных каспаз. Четыре различных рекомбинантных каспазы были индуцированы и очищены: 6xHis-Droncwt, 6xHis-DroncC318A, 6xHis-Dricewt и 6xHis-DriceC211A. Очищенные каспазы запускались SDS-PAGE, иммуноблоттированными, и пятно зондировали анти-Его антителом (разбавленным 1: 5000; за которым следовал антимыший IgG, HRP-связанный антитело (1: 10 000)). Необработанный 6xHis-Dronc (proDronc) работает при относительной молекулярной массе (MWr) 55 кДа (линия 2), а необработанный 6xHis-Drice (proDrice) имеет MWr 35 кДа (полоса 4). Автообработка каспаз видна по появлению полос меньших MWr , которые благодаря наличию His-метки на N-конце представляют собой крупные субъединицы каспаз (рис. 1). В случае 6x-Dronc большая субъединица имеет МВтr 40 кДа (полоса 1). Большая субъединица 6x-Drice работает на 23 кДа (полоса 3). Каталитические мутанты 6xHis-DroncC318A и 6xHis-DriceC211A не поддаются автоматической обработке и обнаруживаются только как полноразмерные белки (полосы 2 и 4).
Рисунок 2B Чтобы продемонстрировать, что бактериально продуцируемый и очищенный препарат 6xHis-Droncwt обладает ферментативной активностью, был выполнен анализ расщепления in vitro, как описано в этом протоколе. В качестве отрицательного контроля использовался каталитический мутант 6xHis-DroncC318A. Субстрат представлял собой RRL-генерируемый N-Myc-DriceC211A, который помечен Myc-меткой на N-конце. После реакции расщепления in vitro белки были разделены SDS-PAGE, иммуноблоттированы, и пятна инкубировали с антимиковым антителом (разбавленным 1: 1000), за которым следовали антимышечные IgG, HRP-связанные антитела (1: 10 000)) для обнаружения N-Myc-DriceC211A. Успешное расщепление и, следовательно, ферментативная активность каспазы может быть продемонстрировано появлением, по меньшей мере, одной полосы меньшего MWr по сравнению с полноразмерной, необработанной формой подложки. Необработанный, полноразмерный N-Myc-DriceC211A имеет МВтr 40 кДа (полосы 2 и 4), тогда как большая субъединица обработанного N-Myc-DriceC211A работает на 30 кДа (полоса 3). Полоса 1 представляет собой незапрограммированный лизат RRL (без плазмиды/транскрипта). Lane 2 демонстрирует in vitro производство DriceC211A экспрессией RRL. Полоса 3 содержит реакцию расщепления in vitro с 6xHis-Droncwt. Полоса 4 содержит реакцию расщепления in vitro с 6xHis-DroncC318A.
Рисунок 2C Реакция расщепления in vitro , в которой используются как рекомбинантная, так и очищенная каспаза (6xHis-Droncwt и 6x-His-DroncC318A) и субстрат (6xHis-DriceC211A) в соответствии с этим протоколом, была проанализирована С помощью SDS-PAGE и иммуноблота. Для анализа реакции расщепления в этом иммуноблоте использовали антирасщепленное антитело Drice (разбавленное 1:5000; за которым последовал анти-кролик IgG, HRP-связанное антитело (1:10,000)). Антирасщепленное антитело Drice обнаруживает свой неоэпитоп в большой субъединице (23 кДа) 6xHis-DriceC211A только после обработки 6xHis-Droncwt (полоса 1). Каталитический мутант 6xHis-DroncC318A не может обрабатывать 6xHis-DriceC211A в этом анализе, а полноразмерный 6xHis-DriceC211A выглядит как слабая необработанная полоса 35 кДа (полоса 2).
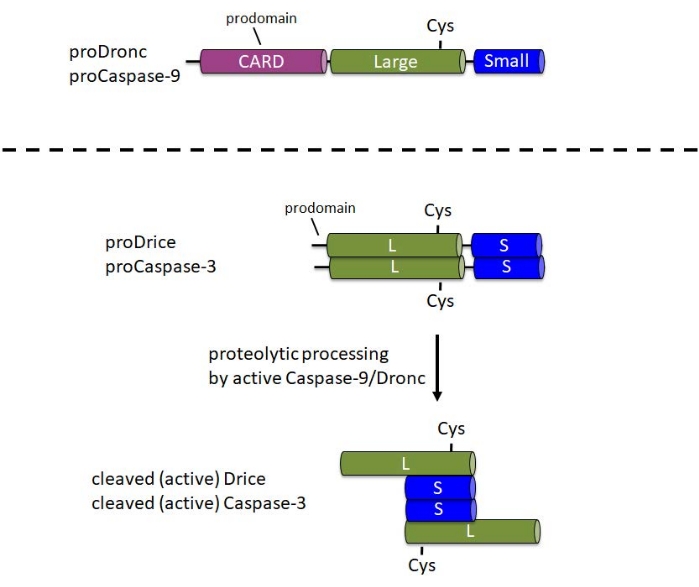
Рисунок 1: Доменная структура инициаторных каспаз Caspase-9 и Dronc и эффекторных каспаз Caspase-3 и Drice. CARD - домен активации и вербовки каспазы; Cys - относительное расположение каталитического остатка цистеина; L - крупная субъединица; S - малая субъединица. Указано расположение N-концевых продоменов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
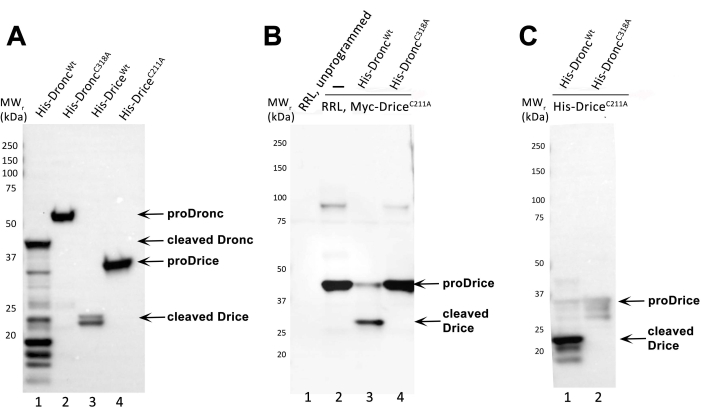
Рисунок 2: Репрезентативные результаты. (A) Иммуноблотический анализ очищенных рекомбинантных препаратов 6xHis-Dronc и 6xHis-Drice, исследованных анти-Его антителом. Необработанные (proDronc и proDrice) и расщепленные 6xHis-Dronc и 6xHis-Drice обозначены стрелками. Маркеры MW указаны слева. (B) Иммуноблотический анализ реакции расщепления in vitro генерируемого RRL N-Myc-Drice с каспазами 6xHis-Droncwt (полоса 3) или 6x-His-DroncC318A (полоса 4), исследованными антимик-антителом. Незапрограммированные и запрограммированные (N-Myc-DriceC211A) реакции RRL загружаются и разделяются в полосах 1 и 2. Необработанные (proDrice) и расщепленные N-Myc-Drice обозначены стрелками. Маркеры MW указаны слева. (C) Иммуноблотический анализ реакции расщепления in vitro бактериально экспрессированного и очищенного рекомбинанта 6xHis-DriceC211A с каспазами 6xHis-Droncwt (полоса 1) или 6x-His-DroncC318A (полоса 2), исследованных антирасщепленным антителом Drice. Полноразмерные (proDrice) и расщепленные 6xHis-DriceC211A обозначены стрелками. Маркеры MW указаны слева. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная таблица 1: Эта таблица содержит грунтовки, используемые для клонирования в векторе pET28a. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 2: Эта таблица содержит состав буферов и носителей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Основная часть наших знаний о каспазах и функции каспазы была получена из интенсивной работы в апоптозе в течение последних трех десятилетий. Очень хорошо установлено, что инициирующие каспазы протеолитически перерабатывают эффекторные каспазы, и сотни белков были идентифицированы как эффекторные каспазные субстраты во время апоптоза 5,29. Напротив, гораздо меньше известно о функции каспаз для неапоптотических процессов и о том, какие неапоптотические субстраты они обрабатывают. Вполне возможно, что инициаторы каспазы являются ключевыми лицами, принимающими решения здесь. Во время апоптоза они активируют эффекторные каспазы, вызывающие гибель клеток. Однако, чтобы запустить неапоптотические процессы, они могут активировать различные белки (кроме эффекторных каспаз), которые контролируют неапоптотический процесс. Этот протокол тестирует белки-кандидаты в качестве субстратов инициатора каспазы Dronc у Drosophila 17,30.
Субстраты, подлежащие тестированию в анализе расщепления, могут быть получены либо в бесклеточной экспрессионной системе in vitro млекопитающих, такой как RRL, либо путем рекомбинантной экспрессии в E. coli. Существует несколько преимуществ экспрессии in vitro с использованием RRL по сравнению с бактериальной экспрессией. Протокол выражений RRL прост и быстр, что позволяет параллельно готовить множество различных субстратов. Во многих случаях экстракт RRL, содержащий интересующий белок, может храниться при -80 °C перед использованием в анализе расщепления (хотя это необходимо определить отдельно для каждого субстрата). Предполагаемая подложка может быть маркирована S35-Met, что позволяет легко анализировать с помощью авторедиографии после SDS-PAGE. Это особенно полезно, если нет субстрат-специфического антитела. Альтернативно, если маркировка S35-Met не желательна, предполагаемый субстрат может быть помечен общими метками, такими как метки Flag, HA или Myc, что позволяет обнаруживать расщепление каспазы иммуноблоттингом.
Необходимо решительно подчеркнуть, что успех этого протокола зависит от тщательной и последовательной очистки рекомбинантных белков Dronc и Drice. К сожалению, эти белки не могут храниться — даже кратковременно — ни в холодильнике, ни в замороженном виде. Они теряют ферментативную активность в одночасье в любом сохраненном виде. Поэтому их нужно готовить свежими в день анализа расщепления. Независимо от тестируемого белка-кандидата, DriceC211A всегда следует использовать в качестве положительного контроля для подтверждения ферментативной активности препарата Droncwt (см. Рисунок 2B, C). Альтернативно, активность препаратов Dronc и Drice также может быть проверена расщеплением in vitro фторогенных синтетических тетрапептидных субстратов 2,9,31.
Если антитела используются для обнаружения субстратов-кандидатов, они должны быть проверены пользователем 32,33. Это также относится к коммерчески доступным антителам, которые обнаруживают эпитопные метки, такие как Flag, HA, Myc или другие. Плохое качество антител может затмить важные результаты. Также рекомендуется двойная эпитопная маркировка субстратов-кандидатов как на N-, так и на С-конце с различными метками34. Если происходит расщепление, двойная маркировка помогает отследить оба продукта расщепления и может помочь выяснить, происходит ли расщепление в одном или нескольких местах.
Хотя этот протокол легко проверяет известный биологический субстрат Dronc, Drice, существуют также ограничения. Одним из ограничений является то, что это протокол in vitro с рекомбинантными белками. В этих анализах каспазы присутствуют в нефизиологически высокой концентрации, что видно из наблюдения, что они могут спонтанно аутопроцессироваться в E. coli. Спонтанная автообработка обычно не происходит в физиологических условиях. Эта высокая концентрация каспазы может вызвать ложную активность, приводящую к ложным срабатываниям. Ложноположительные результаты могут быть устранены путем снижения концентрации каспазы в реакции расщепления in vitro . Кроме того, как более подробно описано ниже, необходимы дополнительные анализы для подтверждения подлинных субстратов и устранения ложных срабатываний.
Рекомбинантные каспазы могут не иметь такой же специфичности, как в нормальной клеточной среде in vivo. Например, активность каспаз может быть изменена посттрансляционными модификациями. Они не присутствуют в рекомбинантных белках. Кроме того, in vivo инициирующие каспазы, включая Dronc, включаются в крупные белковые комплексы, такие как апоптосома. В условиях этого протокола образование апоптосомы не достигается. Это потребовало бы рекомбинантного выражения Drosophila Apaf-1 (он же Dark или Hac-1)35-37, который имеет свои собственные проблемы. Поэтому in vitro Dronc может не иметь той же специфичности, которую он имеет in vivo.
Также возможно, что Dronc включен в другой белковый комплекс для неапоптотических процессов. Это может придать Dronc другую специфичность расщепления, что также может объяснить, почему Dronc не вызывает апоптоз в неапоптотических условиях. В связи с этим CasCleave использует известные участки консенсуса расщепления для прогнозирования новых субстратов каспазы. Тем не менее, неизвестно, используются ли те же сайты консенсуса раскола для неапоптотических процессов. Фактически, недавно было показано, что Caspase-3 изменяет свой предпочтительный консенсусный сайт во время неапоптотического процесса в развивающемся слуховом стволе мозга у эмбриона цыпленка38. Аналогичным образом, если инициирующие каспазы включены в различные белковые комплексы, они могут иметь различную специфичность и, таким образом, могут расщепляться в разных консенсусных последовательностях.
Эти ограничения показывают, что недостаточно полагаться исключительно на анализы расщепления in vitro , описанные в настоящем протоколе. Для дальнейшей проверки результатов, полученных с использованием этого протокола, следует использовать альтернативные подходы. В идеале, анализы in vivo должны использоваться для решения следующих вопросов: Является ли белок-кандидат протеолитически обработанным во время неапоптотического процесса in vivo? Если да, то используется ли один и тот же участок расщепления in vivo и in vitro? Каковы последствия, если расщепление блокируется мутагенезом участка расщепления? Зависит ли обработка субстрата-кандидата от каспаз, и если да, то какой? Какова роль фрагментов расщепления для неапоптотического процесса? Эти вопросы могут быть легко решены в генетических модельных организмах, таких как C. elegans и Drosophila , с использованием стандартных генетических и трансгенных методов.
Таким образом, этот протокол описывает надежный и последовательный метод получения ферментативно активных каспаз, в частности Drosophila caspases Dronc и Drice. Конечной целью этого протокола является изучение того, может ли Dronc расщеплять субстраты-кандидаты in vitro, которые были идентифицированы генетическими, биохимическими или биоинформатическими подходами. Как поясняется в предыдущем пункте, для проверки этих белков в качестве субстратов каспазы in vivo требуются дополнительные анализы. Учитывая степень сохранения генов каспазы в метазоа, должна быть возможность адаптировать этот протокол и к каспазам других организмов.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы хотели бы поблагодарить доктора Элифа Камбер-Кайю за ее помощь в установлении протокола в лаборатории. Доктор Гай Салвесен любезно предоставил мутант DriceC211A 9. Эта работа финансировалась премией MIRA от Национального института общих медицинских наук (NIGMS) Национальных институтов здравоохранения (NIH) под номером гранта 2R35GM118330. Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Ampicillin | Fisher | BP1760-25 | |
| Anti-His antibody | Sigma-Aldrich | MA1-21315 | |
| Anti-mouse IgG, HRP-linked Antibody | Cell signaling | 7076P2 | |
| Anti-Myc antibody | Santa Cruz Biotechnology | sc-40 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell signaling | 7074P2 | |
| Benchtop Centrifuge | Eppendorf | 5415 R | |
| Benzonase | Sigma-Aldrich | E1014-5KU | |
| BioPhotometer | Eppendorf | #6131 | |
| BL21 (DE3) pLysS Competent Cells | Promega | L1195 | |
| Centrifuge rotor | Beckman Coulter | JA-25.50 | |
| CHAPS | Sigma-Aldrich | C3023-1G | |
| ChemiDoc with image software | Bio-Rad | Universal Hood II | For Chemiluminiscence imaging |
| Chemiluminiscence Substrate | Thermofisher Scientific | 34095 | For Chemiluminiscence imaging |
| Cleaved Drosophila ICE (drICE) (Asp230) Antibody | Cell Signaling Technology | 9478S | |
| Disposable cuvettes | Fisher Scientific | 14955128 | Used to measure bacterial growth and protein concentration |
| Dithiothreitol (DTT) | Bio-Rad | #1610610 | |
| Erlenmeyer flasks, 1000 mL | Millipore sigma | CLS49801L | For LB agar media preparation and autoclaving |
| Erlenmeyer flasks, 250 mL | Millipore sigma | CLS4980250 | For bacterial culture growth and induction. |
| Ethylene-diamine-tetra-acetic Acid (EDTA) | Sigma-Aldrich | E5134 | |
| Gel extraction kit | Qiagen | 28704 | |
| Gel tank SDS-PAGE system | Thermofisher Scientific | STM1001 | |
| Glycine | Sigma-Aldrich | G8898 | |
| Halt Protease Inhibitor Cocktail (100x) | Thermofisher scientific | 87786 | |
| HEPES | Sigma-Aldrich | H3375 | |
| His-Drice-pET28a | This study | N/A | Available from authors |
| His-DriceC211A-pET28a | This study | N/A | Available from authors |
| His-Dronc-pET28a | This study | N/A | Available from authors |
| His-DroncC318A-pET28a | This study | N/A | Available from authors |
| Imidazole | Sigma-Aldrich | I2399-100G | |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermofisher Scientific | FERR0392 | |
| Kanamycin | Fisher Scientific | BP906-5 | |
| LB Agar, Miller (Powder) | Fisher Scientific | BP1425-500 | |
| LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Lysozyme | Thermofisher Scientific | 90082 | |
| Microbiological plate incubator | Fisher Scientific | 11-690-650D | For colony growth after transformation |
| Microcentrifuge tubes, 0.5 mL | Eppendorf | 22363611 | |
| Microcentrifuge tubes, 1.5 mL | Eppendorf | 22363204 | |
| Midiprep kit | Qiagen | 12243 | |
| Mini tube rotator | Fisher Scientific | 05-450-127 | for mixing bacterial lysates and Ni-NTA agarose |
| Miniprep kit | Qiagen | 27106 | |
| Motorized Pipette Controller | Gilson | F110120 | For using serological pipettes |
| NaH2PO4 | Fisher Scientific | BP330-1 | |
| Ni-NTA Agarose | Qiagen | 30210 | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm, Midi Protein Gel, 20-well | Thermofisher Scientific | WG1402BOX | |
| NuPAGE LDS Sample Buffer (4x) | Thermofisher Scientific | NP0007 | |
| NuPAGE MOPS SDS Running Buffer (20x) | Thermofisher Scientific | NP0001 | |
| NuPAGE Transfer Buffer (20x) | Invitrogen | NP00061 | |
| Orbital shaking incubator with temperature control | New Brunswick Scientific | C25 incubator shaker | |
| Petridish 100 mm x 15 mm | Fisher Scientific | FB0875712 | |
| Plating beads | Zymo research | S1001 | For spreading culture on AmpR/KanR plates |
| Polypropylene Columns (1 mL) | Qiagen | 34924 | For purification of His-tagged proteins |
| Precision Plus Protein Standards | Bio-Rad | #161-0374 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| pT7CFE1-NMyc | Thermofisher Scientific | 88863 | For cloning substrates for RRL expression |
| PVDF membrane | Invitrogen | LC2007 | |
| 14 mL Polypropylene round bottom tubes | Fisher Scientific | 352029 | For growing plasmid cultures |
| QiaRack | Qiagen | 19095 | For holding polypropylene columns during purification |
| Refrigerated High speed Centrifuge | Beckman Coulter | Avanti J-25 | |
| rRNasin Ribonuclease Inhibitor | Promega | N251A | For RRL expression |
| Sodium chloride | Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Fisher Scientific | BP359-500 | |
| Sterile Falcon tubes, 15 mL | Fisher Scientific | 05-527-90 | |
| Sterile Falcon tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Sucrose | Sigma-Aldrich | S70903-250G | |
| 1 mL Serological Pipets, Sterile | celltreat | 229001B | For bacterial cell lysis in 50 mL tubes |
| TnT Coupled Reticulocyte Lysate -T7 | Promega | L4611 | |
| Tris-base | Fisher Scientific | BP154-1 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Waterbath | Fisher Scientific | 2340 | |
| Western wet transferring cassette | Thermofisher Scientific | STM2001 |
Ссылки
- Kumar, S. Caspase function in programmed cell death. Cell Death and Differentiation. 14 (1), 32-43 (2007).
- Hawkins, C. J., et al. The Drosophila caspase DRONC cleaves following glutamate or aspartate and is regulated by DIAP1, HID, and GRIM. Journal of Biological Chemistry. 275 (35), 27084-27093 (2000).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Meier, P., Silke, J., Leevers, S. J., Evan, G. I. The Drosophila caspase DRONC is regulated by DIAP1. EMBO Journal. 19 (4), 598-611 (2000).
- Timmer, J. C., Salvesen, G. S. Caspase substrates. Cell Death and Differentiation. 14 (1), 66-72 (2007).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. Journal of Biological Chemistry. 274 (17), 11549-11556 (1999).
- Zou, H., Henzel, W. J., Liu, X., Lutschg, A., Wang, X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 90 (3), 405-413 (1997).
- Stennicke, H. R., et al. Caspase-9 can be activated without proteolytic processing. Journal of Biological Chemistry. 274 (13), 8359-8362 (1999).
- Snipas, S. J., Drag, M., Stennicke, H. R., Salvesen, G. S. Activation mechanism and substrate specificity of the Drosophila initiator caspase DRONC. Cell Death and Differentiation. 15 (5), 938-945 (2008).
- Fraser, A. G., Evan, G. I. Identification of a Drosophila melanogaster ICE/CED-3-related protease, drICE. EMBO Journal. 16 (10), 2805-2813 (1997).
- Denton, D., Mills, K., Kumar, S. Methods and protocols for studying cell death in Drosophila. Methods in Enzymology. 446, 17-37 (2008).
- Dorstyn, L., Kumar, S. A biochemical analysis of the activation of the Drosophila caspase DRONC. Cell Death and Differentiation. 15 (3), 461-470 (2008).
- Aram, L., Yacobi-Sharon, K., Arama, E. CDPs: caspase-dependent non-lethal cellular processes. Cell Death and Differentiation. 24 (8), 1307-1310 (2017).
- Arama, E., Baena-Lopez, L. A., Fearnhead, H. O. Non-lethal message from the Holy Land: The first international conference on nonapoptotic roles of apoptotic proteins. FEBS Journal. 288 (7), 2166-2183 (2021).
- Baena-Lopez, L. A. All about the caspase-dependent functions without cell death. Seminars in Cell and Developmental Biology. 82, 77-78 (2018).
- Florentin, A., Arama, E. Caspase levels and execution efficiencies determine the apoptotic potential of the cell. Journal of Cell Biology. 196 (4), 513-527 (2012).
- Amcheslavsky, A., et al. Plasma membrane localization of apoptotic caspases for non-apoptotic functions. Developmental Cell. 45 (4), 450-464 (2018).
- Bergmann, A. Are membranes non-apoptotic compartments for apoptotic caspases. Oncotarget. 9 (60), 31566-31567 (2018).
- Song, J., et al. Cascleave: towards more accurate prediction of caspase substrate cleavage sites. Bioinformatics. 26 (6), 752-760 (2010).
- Wang, M., et al. Cascleave 2.0, a new approach for predicting caspase and granzyme cleavage targets. Bioinformatics. 30 (1), 71-80 (2014).
- Kamber Kaya, H. E., Ditzel, M., Meier, P., Bergmann, A. An inhibitory mono-ubiquitylation of the Drosophila initiator caspase Dronc functions in both apoptotic and non-apoptotic pathways. PLoS Genetics. 13 (2), 1006438 (2017).
- Stennicke, H. R., Salvesen, G. S. Caspases: preparation and characterization. Methods. 17 (4), 313-319 (1999).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual (4th edition). , (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253 (2007).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Brunelle, J. L., Green, R. Coomassie blue staining. Methods in Enzymology. 541, 161-167 (2014).
- Hirano, S. Western blot analysis. Methods in Molecular Biology. 926, 87-97 (2012).
- Kim, B. Western blot techniques. Methods in Molecular Biology. 1606, 133-139 (2017).
- Luthi, A. U., Martin, S. J. The CASBAH: a searchable database of caspase substrates. Cell Death and Differentiation. 14 (4), 641-650 (2007).
- Fogarty, C. E., et al. Extracellular reactive oxygen species drive apoptosis-induced proliferation via Drosophila macrophages. Current Biology. 26 (5), 575-584 (2016).
- Song, Z., et al. Biochemical and genetic interactions between Drosophila caspases and the proapoptotic genes rpr, hid, and grim. Molecular and Cellular Biology. 20 (8), 2907-2914 (2000).
- Edfors, F., et al. Enhanced validation of antibodies for research applications. Nature Communications. 9 (1), 4130 (2018).
- Uhlen, M., et al. A proposal for validation of antibodies. Nature Methods. 13 (10), 823-827 (2016).
- Brizzard, B. Epitope tagging. Biotechniques. 44 (5), 693-695 (2008).
- Kanuka, H., et al. Control of the cell death pathway by Dapaf-1, a Drosophila Apaf-1/CED-4-related caspase activator. Molecular Cell. 4 (5), 757-769 (1999).
- Rodriguez, A., et al. Dark is a Drosophila homologue of Apaf-1/CED-4 and functions in an evolutionarily conserved death pathway. Nature Cell Biology. 1 (5), 272-279 (1999).
- Zhou, L., Song, Z., Tittel, J., Steller, H. HAC-1, a Drosophila homolog of APAF-1 and CED-4 functions in developmental and radiation-induced apoptosis. Molecular Cell. 4 (5), 745-755 (1999).
- Weghorst, F., Mirzakhanyan, Y., Hernandez, K. L., Gershon, P. D., Cramer, K. S. Non-Apoptotic caspase activity preferentially targets a novel consensus sequence associated with cytoskeletal proteins in the developing auditory brainstem. Frontiers in Cell and Developmental Biology. 10, 844844 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены