Method Article
小鼠卵母细胞质微管组织中心的多光子激光消融
摘要
提出了一种优化的方案,该方案能够使用近红外飞秒激光在中期I期间消耗小鼠卵母细胞中的细胞质微管组织中心。
摘要
卵母细胞减数分裂的保真度对于产生发育能力的整倍体卵至关重要。在哺乳动物中,卵母细胞在第一次减数分裂的前期I经历长时间停滞。青春期后和减数分裂恢复时,核膜分解(核包膜分解),纺锤体主要在卵母细胞中心组装。初始中心纺锤体定位对于防止异常动粒-微管 (MT) 附着和非整倍性至关重要。位于中央的纺锤体以对时间敏感的方式向皮层迁移,这是挤出微小极体的必要过程。在有丝分裂细胞中,纺锤体定位依赖于中心体介导的星体MT与细胞皮层之间的相互作用。相反,小鼠卵母细胞缺乏经典的中心体,而是包含许多无中心粒MT组织中心(MTOC)。在中期I阶段,小鼠卵母细胞有两组不同的MTOC:(1)MTOC聚集和分选以组装纺锤体极(极性MTOCs),以及(2)留在细胞质中的中期细胞质MTOCs(mcMTOCs),它们不直接促进纺锤体的形成,但在调节纺锤体定位和及时的纺锤体迁移中起着至关重要的作用。在这里,描述了一种多光子激光消融方法,以选择性地去除从 Cep192-eGfp 报告小鼠收集的卵母细胞中的内源性标记的mcMTOC。该方法有助于了解哺乳动物卵母细胞中纺锤体定位和迁移的分子机制。
引言
单倍体配子(精子和卵母细胞)是通过减数分裂产生的,减数分裂需要一轮DNA复制,然后是受精前染色体数量减少所必需的两次连续分裂。在哺乳动物中,在胎儿早期,卵母细胞在第一次减数分裂前期I的双普洛汀阶段经历长时间的停滞(直到青春期),这一阶段称为生发囊泡(GV)阶段。减数分裂恢复后,GV卵母细胞经历核包膜分解(NEBD),纺锤体主要组装在卵母细胞中心1,2,3处。之后,在F-肌动蛋白的驱动下,纺锤体及时从卵母细胞中心迁移到皮层,以确保高度不对称的分裂,从而产生具有微小极体(PB)的卵子4,5,6。
在有丝分裂细胞中,中心体由一对被中心粒周围物质成分(PMC)包围的中心粒组成,例如周围中心蛋白,γ-微管蛋白,Cep152和Cep1927。这些含中心粒的中心体有助于双极纺锤体形成的保真度8。然而,在包括啮齿动物在内的各种物种的早期卵子发生过程中,中心粒丢失9。因此,小鼠卵母细胞采用使用许多无中心微管(MT)组织中心(MTOC)的不依赖性纺锤体组装途径9,10。减数分裂恢复后,核周MTOC经历三个不同的步骤,即再缩聚,拉伸和碎裂成大量较小的MTOC11,12。然后将碎片化的MTOC聚集并分类以组织双极主轴10,13,14。在NEBD期间,另一个MTOC池位于细胞质中。其中一些细胞质MTOC迁移并形成纺锤体极(极性MTOC,pMTOCs)10,11。最近,发现了另一个细胞质MTOC亚群,称为中期细胞质MTOC(mcMTOCs),它不有助于纺锤体极的形成,但在中期I(Met I)期间保留在卵母细胞质中15。通过多光子激光消融耗尽mcMTOC或通过自噬抑制异常增加其数量会扰乱纺锤体定位和迁移,并增加中期II卵母细胞中非整倍性的发生率15。
有趣的是,mcMTOC在许多方面与pMTOC不同15。例如,与主要起源于核周MTOC的pMTOC相反,mcMTOCs起源于卵母细胞皮层。当纺锤体仍在卵母细胞中心时,mcMTOC不对称地定位于纺锤体迁移到PB挤出的一侧15。星体样MT不能到达相对较大的卵母细胞中的皮层。因此,这些mcMTOC成核MT以将纺锤体(通过 星体样MTOC)锚定到皮层。这些发现提出了一个模型,其中mcMTOC有核MT力抵消了F-肌动蛋白介导的力,该力驱动纺锤体向皮层迁移。这两种相反力之间的平衡对于调节中心主轴定位和及时主轴迁移至关重要15.
迄今为止,所有检查的PMC蛋白(周围中心蛋白,g-微管蛋白,Cep192和Aurora激酶A)定位于两个MTOC池:mcMTOC和pMTOC15。因此,没有化学或遗传方法可以在不扰动pMTOCs的情况下选择性地扰动mcMTOC。这些限制可以通过选择性地靶向激光烧蚀的mcMTOC来规避。在为微烧蚀开发的基于激光的技术中,脉冲多光子飞秒激光器由于其仅限于焦平面的精度影响,近红外光的高穿透深度以及对细胞的光毒性和热损伤减少而显示出巨大的潜力16,17,18。这项工作描述了一种使用多光子激光器耦合到倒置显微镜来消融小鼠卵母细胞中的mcMTOC的选择性方法。
研究方案
此处描述的所有方法均已获得密苏里大学批准(动物护理质量保证参考编号9695)。本研究使用 Cep192-eGFP报告6-8 周龄的雌性小鼠。为了产生 Cep192-eGFP 报告小鼠,使用CRISPR / Cas9介导的同源定向修复将EGFP报告基因整合到CF-1小鼠基因组中。EGFP报告器在Cep192(MTOC的一个组成部分)的C末端融合15。为了维持小鼠集落,使用纯合 Cep192-eGfp 报告小鼠。所有动物均在21°C和55%湿度的笼子(最多四只动物/笼)中饲养,光照/黑暗循环12小时,并 随意 获取食物和水。
1.小鼠卵母细胞采集
- 准备培养基(Chatot,Ziomek和Bavister,CZB19,参见 材料表),并将其在37°C和5%CO2 下孵育过夜。
注意:CZB培养基可以在4°C下储存1个月(参见补充 文件1 了解培养基成分)。 - 用谷氨酰胺(1mM)和米力农(2.5mM)(CZB + M)补充CZB培养基(参见 材料表),并将其放入培养箱中。
注意:米力农是一种磷酸二酯酶抑制剂,可维持在前期I时停止的卵母细胞并防止减数分裂恢复20。 - 制备含有 3 mg/mL 聚乙烯吡咯烷酮 (PVP)、25 mM HEPES (pH 7.3)(补充文件 1) 和米力农 (2.5 mM)(MEM/PVP + M,参见 材料表)的收集培养基(无碳酸氢盐最小必需培养基,MEM)。
- 准备收集和培养皿,分别在60毫米和35毫米培养皿中制作四微滴(100μL)的收集培养基(MEM / PVP + M)和两微滴(100μL)培养基(CZB + M),并用矿物油覆盖它们(参见 材料表)。将载玻片上的收集皿保持温暖,并将培养皿放入37°C和5%CO2的培养箱中。
- 在卵母细胞收集前44-48小时将5IU的怀孕母马血清促性腺激素(PMSG,参见 材料表)注射到性成熟(6-8周龄) Cep192-eGFP 报告雌性小鼠中。
- 通过颈椎脱位处死小鼠,鉴定并去除卵巢21,并将它们转移到含有37°C预热收集培养基(MEM / PVP + M)的手表玻璃中。
- 通过将 1 mL 注射器触摸到手表玻璃的底部并使用捆绑在一起的缝纫针将其刺穿几次(每个卵巢~40 次)以将卵母细胞释放到培养基中来固定卵巢。
- 使用塑料移液管,将步骤1.7中含有卵丘 - 卵母细胞复合物(COC)的所有培养基转移到空的100mm塑料培养皿中。
- 在体视显微镜下,使用巴斯德玻璃移液管收集COC,并将它们转移到含有MEM / PVP + M的收集皿中。
- 使用狭窄的巴斯德玻璃移液管(直径约100μm),通过轻柔的重复移液以机械方式剥离卵母细胞,然后在转移到CZB + M培养皿之前,将它们转移到CZB + M培养皿的四微滴(100μL)MEM / PVP + M(收集培养皿)中转移和洗涤。
- 将剥落的卵母细胞在37°C下孵育1小时,空气中有5%的CO2 。
2.卵母细胞显微注射
- 将 250 μL 滴 MEM/PVP + M 放入 100 mm 塑料培养皿盖中,并用矿物油覆盖。
注意:培养皿盖具有下边缘,为调整显微操纵器提供了更多空间。 - 打开显微注射系统(参见 材料表)。
- 将显微注射皿放在显微镜的加热台(37°C)上。
- 使用微量移液器吸头(参见材料表)用0.5 μL mCh-Cep192cRNA加载进样针头,并将进样针固定在显微操纵器上。
- 将剥落的卵母细胞(步骤1.11)转移到250μL微滴(步骤2.1)中。
- 在20x或40x物镜下,根据卵母细胞位置调整注射和保持针的位置和焦点(图1)。
- 设置显微注射单元,并设置注射压力(p i),补偿压力(pc)和注射时间(ti),以便能够注射5-10 pl的mCh-Cep192 cRNA(外源性标记MTOC)。
- 小心地注射卵母细胞而不接触细胞核。
- 注射所有卵母细胞后,用三微滴CZB + M洗涤,将它们转移到培养皿(CZB + M)中,并在37°C下孵育3小时以使mCh-Cep192表达。
3. 卵母细胞成熟
- 通过将谷氨酰胺(1mM)添加到CZB培养基中来制备成熟培养基,该培养基在37°C的空气中具有5%CO2 的培养箱中预先平衡至少3小时。
- 在35毫米培养皿中制作两微滴(100μL)的成熟培养基,并用矿物油(成熟培养皿)覆盖它们。
- 在 100 μL 不含米力农的 CZB 微滴中洗涤前期 I 期 I 被捕的卵母细胞至少三次,以完全去除米力农并允许减数分裂恢复。
- 将卵母细胞转移到成熟培养皿中,并在37°C的空气中含有5%CO2 的加湿培养箱中孵育5小时(中期I期)。
4. 用于消融和成像的卵母细胞制备
- 将前期I卵母细胞(步骤3.4)转移到含有100μL成熟培养基(步骤3.1)的玻璃底培养皿中,并覆盖有矿物油。
5. 烧蚀显微镜准备
- 消融前至少30分钟,打开载物台培养箱的温度控制器(参见 材料表)并将其设置为37°C。
- 打开 CO2 控制器并将其设置为 5% CO2。
- 选择40倍油浸复消色差物镜,然后涂上一小滴浸油。
- 将装有卵母细胞的玻璃底培养皿安装在载物台顶部培养箱上,并用气盖盖住培养箱。
- 在图像采集软件(参见 材料表)中,选择一个可以保存多个载物台位置的选项(例如,"定义标记并查找实验")。使用透射光明场照明,以单个卵母细胞为中心并保存其位置。
- 在图像采集软件中,选择 XYZ扫描 模式,将图像格式设置为 256 x 256 像素,将变焦系数设置为 2.5倍-3.0倍,并选择 600 Hz的扫描频率。这相当于像素停留时间约为1.6 μs。
- 将488 nm激发激光线设置为大约10%的激光功率(对应于样品水平的4.0μW)(参见 材料表),并使用500-550nm的光谱带宽来观察来自MTOC的GFP信号。为了同时观察来自mCherry标记的Cep192的荧光,将585 nm激发激光线设置为大约8%的激光功率(相当于样品水平的10.7μW),并使用另一个设置为595-645nm光谱带宽的检测器。
注意:使用共聚焦显微镜的透射光检测器(TLD)同时检测卵母细胞边界很有帮助。 - 使用实时扫描模式和z驱动器的手动控制,筛查卵母细胞中的MTOC。
- 检测到 mcMTOC 后,在其周围绘制一个正方形感兴趣区域 (ROI)。
6. 消融 mcMTOC
- 将飞秒激光器设置为 740 nm 波长。
注意:激光波长可以根据显微镜和激光条件改变。 - 使用多光子显微镜的电光调制器(见 材料表)将激光功率设置为70%-80%,对应于样品平面处的60-70mW功率。
注意:如果激光器配备了飞秒脉冲补偿器,请使用它来校正群延迟色散(GDD)。GDD校正减少了有效mcMTOC消融所需的激光功率,并最大限度地减少了对卵母细胞的光损伤。GDD控制通常与商用多光子显微镜的图像采集软件集成。 - 使用与步骤 5.6 中相同的图像格式、缩放系数和扫描频率。将线和帧平均参数设置为 1。
- 单击软件中的 " 扫描"按钮,通过对所选ROI进行单次激光扫描来执行mcMTOC的消融。
- 使用步骤5.7中的通道设置,通过比较多光子激光曝光前后拍摄的GFP标记结构的图像来查看消融结果。如果消融成功,靶向mcMTOC中的GFP荧光强度将降低到背景中观察到的水平。
- 如果GFP标记结构的某些片段仍然存在,请通过聚焦mcMTOC的各种z平面重复步骤6.4一次或多次。
- 使用步骤 5.7 中的通道设置通过完全丢失 mcMTOC 相关的 mCherry 信号 (mCh-Cep192) 来验证消融效率。
- 重复步骤5.8至步骤6.7,直到卵母细胞的所有MTOCs(在各个焦平面)被消融。
注意:本协议使用 mCh-Cep192 显微注射作为策略来确认多光子激光曝光后的mcMTOC消耗,并排除GFP荧光损失是由GFP光漂白引起的。然而,该探针的显微注射是可选的,并且不是消融程序所必需的。
结果
多光子激光烧蚀提供了一种选择性消融细胞内结构的有效方法。目前的研究采用多光子激光消融选择性地去除小鼠卵母细胞中的mcMTOC。激光烧蚀有效地耗尽了mcMTOC,如靶向mcMTOC中的内源性GFP荧光降低到与背景相当的水平所示。靶向mcMTOC中的外源性mCh-Cep192在激光烧蚀后也被废除。mcMTOC的激光消融应在卵母细胞内的不同焦平面(mcMTOC所在的位置,图 2)进行,以确保卵母细胞内的所有mcMTOC都被耗尽(图3)。
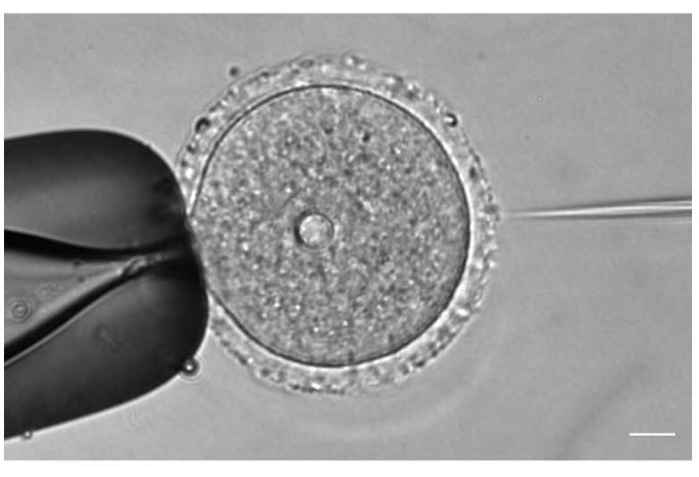
图1:卵母细胞显微注射。 用 mCh-Cep192 cRNA显微注射前期I期停滞的小鼠卵母细胞。比例尺:10 μm。 请点击此处查看此图的大图。
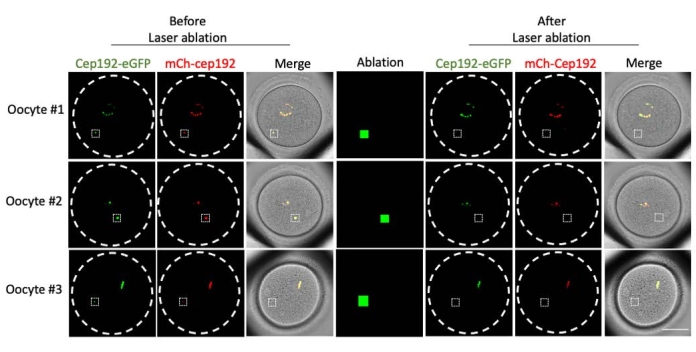
图2:小鼠卵母细胞中mcMTOC的消耗。 单焦平面的代表性图像。白色方块表示多光子激光烧蚀前后的mcMTOC。比例尺:40 μm。 请点击此处查看此图的大图。
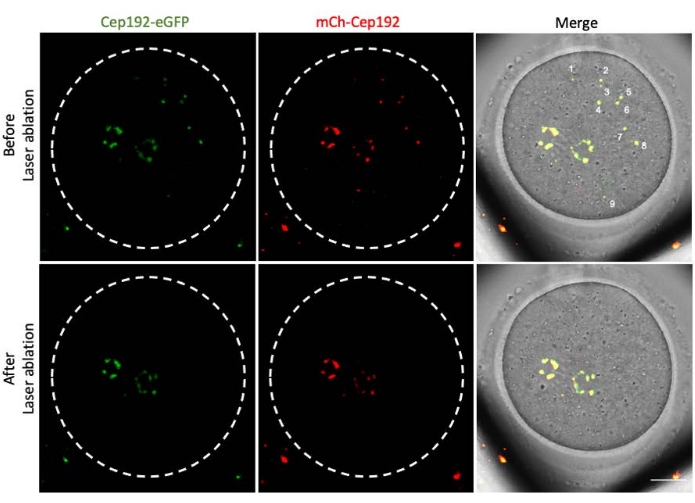
图 3:小鼠卵母细胞中不同焦平面处 mcMTOC 的耗竭。 mcMTOC消融小鼠卵母细胞的代表性最大投影图像。比例尺:20 μm。 请点击此处查看此图的大图。
补充文件1:Chatot,Ziomek和Bavister(CZB)和无碳酸氢盐最小必需培养基(MEM / PVP)的组合物。请点击此处下载此文件。
讨论
存在不同的方法来干扰细胞内的细胞骨架相关结构22,23,24,25。然而,找到有效的技术来选择性地扰动靶向结构而不影响细胞活力具有挑战性。这里介绍的多光子激光消融方法是一种有效的策略,可以在不改变卵母细胞活力的情况下诱导卵母细胞内mcMTOC的选择性机械扰动。
激光消融已被广泛用于了解有丝分裂和减数分裂期间控制染色体分离的分子机制22,23,26,27。由于与体细胞28相比,哺乳动物卵母细胞的尺寸相对较大(直径>80毫米),因此其细胞内结构的消融是一个挑战。此外,中期I卵母细胞中的平均mcMTOC体积为~20μm15,这是一个额外的挑战。必须采用一种提供更深层次组织渗透的有效方法来克服这些挑战。使用多光子激光进行消融的主要优点是它能够更深入地进入细胞,同时最大限度地减少脱靶效应29。
为了验证激光消融方法去除靶标结构的有效性和效率,建议使用荧光标记的蛋白质来识别靶标结构随时间的变化(消融前后)23。重要的是要注意激光烧蚀会耗尽整个mcMTOC作为一个结构,尽管较小的mcMTOC只需要一次激光曝光即可耗尽,但较大的mcMTOC可能需要在不同焦平面上进行多次激光曝光。还建议使用 MTOC 标志物(例如 γ-微管蛋白、周围中心蛋白或 Cep192)固定和免疫标记对照和 mcMTOC 消融卵母细胞亚群,以进一步确认 mcMTOC 消融的效率。在对照卵母细胞中,与mcMTOC相邻但不重叠的细胞质区域将暴露于激光下。
该实验需要在卵母细胞内的不同焦平面之间移动时进行几次mcMTOC消融。因此,强烈建议在执行实验之前多次练习该技术,以尽量减少实验时间,从而提高卵母细胞活力。此外,重要的是使用足以耗尽mcMTOC而不影响卵母细胞活力的最小激光功率。
此技术有一些局限性。首先,多光子共聚焦显微镜比普通共聚焦显微镜相对昂贵。其次,在不同焦平面上扰动所有mcMTOC比化学或遗传扰动更耗时。第三,该协议需要技术技能在尽可能短的时间内消融所有mcMTOC。然而,一旦掌握,多光子激光的使用提供了一种极好的策略来扰乱小鼠卵母细胞中的几种细胞内结构,包括mcMTOCs,有助于理解调节纺锤体定位及其在哺乳动物卵母细胞中的及时迁移的分子机制。
披露声明
作者声明没有竞争利益。
致谢
作者要感谢Balboula实验室的所有成员的宝贵帮助和讨论。作者感谢Melina Schuh友好地分享mCherry-Cep192结构。这项研究得到了AZB的R35GM142537(NIGMS,NIH)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4 IN thinwall GL 1.0 OD/.75 ID | World precision instrument | TW100F-4 | Injection needles |
| Borosilicate glass | Fisherbrand | Cat# 13-678-20D | |
| Borosilicate glass capillarities | World Precision Instrument | Cat# TW100-6 | Holding needles |
| Bovine serum albumine | MilliporeSigma | Cat# A4503 | |
| Cage incubator for Leica DMI6000 B microscope | Life Imaging Services GmbH | ||
| Calcium chlrode dihydrate | MilliporeSigma | Cat# C7902 | |
| CO2 controller | Pecon | # 0506.000 | |
| CO2 Cover HP | Pecon | # 0506.020 | |
| DL-Lactic acid | MilliporeSigma | Cat# L7900 | |
| DMi8 | Leica | N/A | Microscope |
| EDTA | MilliporeSigma | Cat# E5134 | |
| Femtojet 4i | Eppendorf | N/A | Microinjector |
| Femtotips Microloader | Fisher scientific | E5242956003 | |
| Gentamicin | MilliporeSigma | Cat# G1272 | |
| Gentamycin | MilliporeSigma | Cat# 1272 | |
| Glass bottom dish | Mat Tek Corporation | Cat# P35G-1.0-20-C | |
| Hepes | MilliporeSigma | Cat# H3784 | |
| Hepes Sodium Salt | MilliporeSigma | Cat # H3784 | |
| Hera Cell vios 160i | Thermo | N/A | CO2 incubator |
| Leica TCP SP8 spectral laser scanning confocal micorscope with inverted stand DMI6000 B | Leica Microsystems, Inc | N/A | |
| L-Glutamine | MilliporeSigma | Cat#G8540 | |
| Magnesium sulfate dihydrate | MilliporeSigma | Cat# M7774 | |
| MaiTai DeepSee Ti-Sapphire femtosecond laser | Spectra-Physics | N/A | |
| mCH-Cep192 cRNA | N/A | ||
| Medium Essential Medium Eagle - MEM | MilliporeSigma | Cat #M0258 | |
| Milrinone | MilliporeSigma | Cat# M4659 | |
| Mineral oil | MilliporeSigma | Cat# M5310 | |
| Minimum essential medium eagle (MEM) | MilliporeSigma | Cat# M0268 - 1L | |
| Mouse: Cep192-eGFP reporter CF-1 | N/A | ||
| Petri dish (100 mm) | Fisherbrand | Cat# FB0875712 | |
| Petri dish (35 mm) | Corning | Cat# 430165 | |
| Petri dish (60 mm) | Falcon | Cat# 351007 | |
| Phenol Red | MilliporeSigma | Cat# P5530 | |
| Polyvinylpyrolidone | MilliporeSigma | Cat# P2307 | |
| Polyvinylpyrolidone (PVP) | MilliporeSigma | Cat# P2307 | |
| Potassium chloride | MilliporeSigma | Cat# P5405 | |
| Potassium phosphate monobasic | MilliporeSigma | Cat# P5655 | |
| Pregnant mare´s serum gonadotropin | Lee BioSolutions | Cat# 493-10-10 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Sewing needles | D.M.C | N/A | N° 5 * 16 Needles |
| Sodium bicarbonate | MilliporeSigma | Cat# S5761 | |
| Sodium chloride | MilliporeSigma | Cat# S5886 | |
| Stage-top heating insert P | Pecon | # 0426.300 | |
| Sterezoom S9i | Leica | N/A | Stereomicroscope |
| Syringe 1 mL | BD company | Cat# 309597 | |
| Taurine | MilliporeSigma | Cat# T0625 | |
| Temperature controller Tempcontrol 37-2 digital | Pecon | # 0503.000 | |
| The Cube temperature controller for the cage incubator | Life Imaging Services GmbH |
参考文献
- Bennabi, I., Terret, M. E., Verlhac, M. H. Meiotic spindle assembly and chromosome segregation in oocytes. Journal of Cell Biology. 215 (5), 611-619 (2016).
- Hashimoto, N., Kishimoto, T. Regulation of meiotic metaphase by a cytoplasmic maturation-promoting factor during mouse oocyte maturation. Development Biology. 126 (2), 242-252 (1988).
- Kitajima, T. S., Ohsugi, M., Ellenberg, J. Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes. Cell. 146 (4), 568-581 (2011).
- Azoury, J., Verlhac, M. H., Dumont, J. Actin filaments: Key players in the control of asymmetric divisions in mouse oocytes. Biology of the Cell. 101 (2), 69-76 (2009).
- Li, H., Guo, F., Rubinstein, B., Li, R. Actin-driven chromosomal motility leads to symmetry breaking in mammalian meiotic oocytes. Nature Cell Biology. 10 (11), 1301-1308 (2008).
- Schuh, M., Ellenberg, J. A new model for asymmetric spindle positioning in mouse oocytes. Current Biology. 18 (24), 1986-1992 (2008).
- Pimenta-Marques, A., Bettencourt-Dias, M. Pericentriolar material. Current Biology. 30 (12), 687-689 (2020).
- Hinchcliffe, E. H. The centrosome and bipolar spindle assembly: Does one have anything to do with the other. Cell Cycle. 10 (22), 3841-3848 (2011).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of centrioles in the first and second meiotic spindles of mouse oocytes. Journal of Cell Science. 11 (2), 521-541 (1972).
- Schuh, M., Ellenberg, J. Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell. 130 (3), 484-498 (2007).
- Clift, D., Schuh, M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes. Nature Communications. 6, 7217 (2015).
- Luksza, M., Queguigner, I., Verlhac, M. H., Brunet, S. Rebuilding MTOCs upon centriole loss during mouse oogenesis. Developmental Biology. 382 (1), 48-56 (2013).
- Balboula, A. Z., et al. Haspin kinase regulates microtubule-organizing center clustering and stability through Aurora kinase C in mouse oocytes. Journal of Cell Science. 129 (19), 3648-3660 (2016).
- Breuer, M., et al. HURP permits MTOC sorting for robust meiotic spindle bipolarity, similar to extra centrosome clustering in cancer cells. Journal of Cell Biology. 191 (7), 1251-1260 (2010).
- Londoño-Vásquez, D., Rodriguez-Lukey, K., Behura, S. K., Balboula, A. Z. Microtubule organizing centers regulate spindle positioning in mouse oocytes. Developmental Cell. 57 (2), 197-211 (2022).
- Konig, K., Riemann, I., Fischer, P., Halbhuber, K. J. Intracellular nanosurgery with near infrared femtosecond laser pulses. Cellular and Molecular Biology. 45 (2), 195-201 (1999).
- Galbraith, J. A., Terasaki, M. Controlled damage in thick specimens by multiphoton excitation. Molecular Biology of the Cell. 14 (5), 1808-1817 (2003).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: Setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D., Lewis, J. L., Torres, I. An improved culture medium supports development of random-bred 1-cell mouse embryos in vitro. Journal of Reproduction and Fertility. 86 (2), 679-688 (1989).
- Tsafriri, A., Chun, S. Y., Zhang, R., Hsueh, A. J., Conti, M. Oocyte maturation involves compartmentalization and opposing changes of cAMP levels in follicular somatic and germ cells: Studies using selective phosphodiesterase inhibitors. Developmental Biology. 178 (2), 393-402 (1996).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio Protocol. 11 (15), 4104 (2021).
- Khodjakov, A., Cole, R. W., Rieder, C. L. A synergy of technologies: Combining laser microsurgery with green fluorescent protein tagging. Cell Motility and the Cytoskeleton. 38 (4), 311-317 (1997).
- Pavin, N., Tolic, I. M. Mechanobiology of the mitotic spindle. Developmental Cell. 56 (2), 192-201 (2021).
- Khodjakov, A., Cole, R. W., Oakley, B. R., Rieder, C. L. Centrosome-independent mitotic spindle formation in vertebrates. Current Biology. 10 (2), 59-67 (2000).
- Aist, J. R., Liang, H., Berns, M. W. Astral and spindle forces in PtK2 cells during anaphase B: a laser microbeam study. Journal of Cell Science. 104, 1207-1216 (1993).
- Bennabi, I., Manil-Segalen, M. Laser Ablation of microtubule-chromosome attachment in mouse oocytes. Methods in Molecular Biology. 1818, 153-161 (2018).
- Milas, A., Jagric, M., Martincic, J., Tolic, I. M. Optogenetic reversible knocksideways, laser ablation, and photoactivation on the mitotic spindle in human cells. Methods in Cell Biology. 145, 191-215 (2018).
- Warzych, E., Lipinska, P. Energy metabolism of follicular environment during oocyte growth and maturation. Journal of Reproduction and Development. 66 (1), 1-7 (2020).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。