Method Article
Ablación con láser multifotón de centros organizadores de microtúbulos citoplasmáticos en ovocitos de ratón
En este artículo
Resumen
Se presenta un protocolo optimizado que permite el agotamiento de los centros organizadores de microtúbulos citoplasmáticos en ovocitos de ratón durante la metafase I utilizando un láser de femtosegundo de infrarrojo cercano.
Resumen
La fidelidad de la meiosis ovocitaria es crítica para generar óvulos euploides competentes para el desarrollo. En los mamíferos, el ovocito sufre un largo paro en la profase I de la primera división meiótica. Después de la pubertad y tras la reanudación meiótica, la membrana nuclear se desmonta (ruptura de la envoltura nuclear), y el huso se ensambla principalmente en el centro de los ovocitos. El posicionamiento inicial del huso central es esencial para proteger contra las uniones anormales de cinetocoro-microtúbulos (MT) y la aneuploidía. El huso colocado centralmente migra de una manera sensible al tiempo hacia la corteza, y este es un proceso necesario para extruir un pequeño cuerpo polar. En las células mitóticas, el posicionamiento del huso se basa en la interacción entre las MT astrales mediadas por el centrosoma y la corteza celular. Por el contrario, los ovocitos de ratón carecen de centrosomas clásicos y, en cambio, contienen numerosos centros organizadores de MT acentriolares (MTOC). En la etapa de metafase I, los ovocitos de ratón tienen dos conjuntos diferentes de MTOC: (1) MTOC que se agrupan y clasifican para ensamblar polos del huso (MTOC polares) y (2) MTOC citoplasmáticos de metafase (mcMTOC) que permanecen en el citoplasma y no contribuyen directamente a la formación del huso, pero desempeñan un papel crucial en la regulación del posicionamiento del huso y la migración oportuna del huso. Aquí, se describe un método de ablación con láser multifotón para agotar selectivamente los mcMTOC marcados endógenamente en ovocitos recolectados de ratones reporteros Cep192-eGfp . Este método contribuye a la comprensión de los mecanismos moleculares subyacentes al posicionamiento y la migración del huso en ovocitos de mamíferos.
Introducción
Los gametos haploides (espermatozoides y ovocitos) se producen a través de la meiosis, que implica una ronda de replicación del ADN seguida de dos divisiones consecutivas que son necesarias para la reducción del número de cromosomas antes de la fertilización. En los mamíferos, durante la vida fetal temprana, el ovocito sufre un paro prolongado (hasta la pubertad) en la etapa diploteno de la profase I de la primera división meiótica, una etapa llamada etapa de vesícula germinal (GV). Después de la reanudación meiótica, el ovocito GV sufre una ruptura de la envoltura nuclear (NEBD), y el huso se ensambla principalmente en el centro ovocitario 1,2,3. Más tarde, impulsado por la actina F, el huso migra de manera oportuna desde el centro del ovocito a la corteza para asegurar una división altamente asimétrica, lo que resulta en un huevo con un pequeño cuerpo polar (PB)4,5,6.
En las células mitóticas, los centrosomas consisten en un par de centriolos rodeados por componentes de material pericentriolar (PMC), como pericentrina, γ-tubulina, Cep152 y Cep1927. Estos centrosomas que contienen centriolo contribuyen a la fidelidad de la formación del huso bipolar8. Sin embargo, los centriolos se pierden durante la ovogénesis temprana en varias especies, incluidos los roedores9. Por lo tanto, los ovocitos de ratón adoptan una vía de ensamblaje del huso independiente del centríolo utilizando numerosos centros organizadores de microtúbulos acentriolares (MT) (MTOC)9,10. Tras la reanudación meiótica, los MTOC perinucleares experimentan tres pasos distintos de recondensación, estiramiento y fragmentación en un gran número de MTOC más pequeños11,12. Los MTOC fragmentados se agrupan y ordenan para organizar un huso bipolar10,13,14. Otro grupo de MTOC se encuentra en el citoplasma durante NEBD. Algunos de estos MTOC citoplasmáticos migran y forman polos fusiformes (MTOCs polares, pMTOCs)10,11. Recientemente, se descubrió otro subconjunto de MTOCs citoplasmáticos, denominados MTOCs citoplasmáticos metafásicos (mcMTOCs), que no contribuyen a la formación del polo fusiforme pero permanecen en el citoplasma ovocitario durante la metafase I (Met I)15. El agotamiento de los mcMTOC por ablación con láser multifotón o el aumento anormal de su número por inhibición de la autofagia perturba el posicionamiento y la migración del huso y aumenta la incidencia de aneuploidía en ovocitos metafase II15.
Curiosamente, los mcMTOC difieren de los pMTOC en muchos aspectos15. Por ejemplo, a diferencia de los pMTOC, que se originan principalmente en los MTOC perinucleares, los mcMTOC se originan en la corteza ovocitaria. Cuando el husillo todavía está en el centro del ovocito, los mcMTOC se localizan asimétricamente opuestos al lado al que migra el husillo para la extrusión de PB15. Las MT de tipo astral no pueden alcanzar la corteza en la célula de ovocitos relativamente grande. Por lo tanto, estos mcMTOC nuclean MT para anclar el huso (a través de MTOC astrales) a la corteza. Estos hallazgos sugieren un modelo en el que la fuerza MT nucleada por mcMTOC contrarresta la fuerza mediada por la actina F que impulsa la migración del huso hacia la corteza. El equilibrio entre estas dos fuerzas opuestas es esencial para regular el posicionamiento del husillo central y la migración oportuna del husillo15.
Hasta la fecha, todas las proteínas PMC examinadas (pericentrina, g-tubulina, Cep192 y Aurora quinasa A) se localizan en ambos grupos MTOC: mcMTOCs y pMTOCs15. Por lo tanto, no existe un enfoque químico o genético para perturbar selectivamente los mcMTOC sin perturbar los pMTOC. Estas limitaciones se pueden eludir dirigiéndose selectivamente a los mcMTOC con ablación láser. Entre las tecnologías basadas en láser desarrolladas para la microablación, los láseres de femtosegundo multifotón pulsados muestran un gran potencial debido a su impacto de precisión limitado al plano focal, la alta profundidad de penetración de la luz infrarroja cercana y la reducción de la fototoxicidad y el daño térmico a la célula16,17,18. Este trabajo describe un enfoque selectivo para extirpar mcMTOCs en ovocitos de ratón utilizando un láser multifotón acoplado a un microscopio invertido.
Protocolo
Todos los métodos descritos aquí fueron aprobados por la Universidad de Missouri (Animal Care Quality Assurance Ref. Number 9695). En el presente estudio se utilizaron ratones hembra reporteros Cep192-eGFP de 6 a 8 semanas de edad. Para generar ratones reporteros Cep192-eGFP , se utilizó la reparación dirigida por homología mediada por CRISPR / Cas9 para integrar el gen reportero EGFP en el genoma del ratón CF-1. El reportero del EGFP se fusionó en el extremo C del CEP192 (un componente integral de los MTOC)15. Para mantener la colonia de ratones, se utilizaron ratones reporteros homocigotos Cep192-eGfp . Todos los animales se mantuvieron en jaulas (hasta cuatro animales/jaula) a 21 °C y 55% de humedad, con un ciclo de luz/oscuridad de 12 h y acceso ad libitum a alimentos y agua.
1. Recolección de ovocitos de ratón
- Preparar el medio de cultivo (Chatot, Ziomek y Bavister, CZB19, ver la Tabla de materiales) e incubarlo a 37 °C y 5% deCO2 durante la noche.
NOTA: El medio CZB puede almacenarse a 4 °C durante 1 mes (consulte el archivo complementario 1 para la composición del soporte). - Complemente el medio CZB con glutamina (1 mM) y milrinona (2.5 mM) (CZB + M) (ver Tabla de materiales), y colóquelo en la incubadora.
NOTA: La milrinona es un inhibidor de la fosfodiesterasa que mantiene los ovocitos detenidos en la profase I y previene la reanudación meiótica20. - Prepare el medio de recolección (medio esencial mínimo libre de bicarbonato, MEM) que contiene 3 mg/ml de polivinilpirodona (PVP), 25 mM HEPES (pH 7.3) (Archivo complementario 1) y milrinona (2.5 mM) (MEM/PVP + M, consulte la Tabla de materiales).
- Prepare las placas de recolección y cultivo, haga cuatro microgotas (100 μL) de medio de recolección (MEM / PVP + M) y dos microgotas (100 μL) de medio de cultivo (CZB + M) en placas de Petri de 60 mm y 35 mm, respectivamente, y cúbralas con aceite mineral (ver Tabla de materiales). Mantenga el plato de recolección en el calentador de portaobjetos y coloque el plato de cultivo en la incubadora a 37 °C y 5% deCO2.
- Inyecte por vía intraperitoneal 5 UI de gonadotropina sérica de yegua embarazada (PMSG, consulte la Tabla de materiales) en ratones hembra reporteros Cep192-eGFP sexualmente maduros (6-8 semanas de edad) 44-48 h antes de la recolección de ovocitos.
- Sacrificar los ratones por luxación cervical, identificar y extraer los ovarios21, y transferirlos a un cristal de reloj que contenga medio de recolección precalentado (MEM/PVP + M) a 37 °C.
- Fije el ovario tocando una jeringa de 1 ml en el fondo del vidrio del reloj y perforándolo varias veces (~ 40 veces por ovario) con agujas de coser agrupadas para liberar los ovocitos en el medio.
- Utilizando una pipeta de transferencia de plástico, transfiera todo el medio que contiene los complejos cúmulo-ovocitos (AOC) del paso 1.7 a una placa de Petri de plástico vacía de 100 mm.
- Bajo un microscopio estereoscópico, recoja los AOC con una pipeta de vidrio Pasteur y transfiéralos al plato de recolección que contenga MEM/PVP + M.
- Con una pipeta de vidrio Pasteur estrecha (aproximadamente 100 μm de diámetro), desnudar los ovocitos mecánicamente mediante un suave pipeteo repetitivo, seguido de transferirlos y lavarlos en cuatro microgotas de (100 μL) MEM/PVP + M (la placa de recolección) antes de su transferencia a la placa de cultivo CZB + M.
- Incubar los ovocitos desnudos durante 1 h a 37 °C con un 5% deCO2 en el aire.
2. Microinyección de ovocitos
- Coloque una gota de 250 μL de MEM/PVP + M en una tapa de placa de Petri de plástico de 100 mm y cúbrala con aceite mineral.
NOTA: La tapa de la placa de Petri tiene un borde inferior que proporciona más espacio para ajustar el micromanipulador. - Encienda el sistema de microinyección (consulte la Tabla de materiales).
- Coloque la placa de microinyección en la etapa de calentamiento (37 °C) del microscopio.
- Cargue la aguja de inyección con 0,5 μL de ARNc mCh-Cep192utilizando puntas de pipeta de microcargador (consulte la Tabla de materiales) y fije la aguja de inyección al micromanipulador.
- Transfiera los ovocitos desnudos (paso 1.11) a la microgota de 250 μL (paso 2.1).
- Bajo una lente de objetivo 20x o 40x, ajuste la posición y el enfoque de las agujas de inyección y sujeción de acuerdo con la posición del ovocito (Figura 1).
- Configure la unidad de microinyección y establezca la presión de inyección (p i), la presión de compensación (pc) y el tiempo de inyección (ti) para poder inyectar 5-10 pl de ARNc mCh-Cep192 (para etiquetar exógenamente los MTOC).
- Inyectar cuidadosamente los ovocitos sin tocar el núcleo.
- Una vez inyectados todos los ovocitos, lavarlos en tres microgotas de CZB+M, transferirlos a la placa de cultivo (CZB+M), e incubarlos durante 3 h a 37 °C para permitir la expresión de mCh-Cep192.
3. Maduración de los ovocitos
- Preparar el medio de maduración añadiendo glutamina (1 mM) al medio CZB preequilibrado en una incubadora con un 5% deCO2 en el aire a 37 °C durante al menos 3 h.
- Hacer dos microgotas (100 μL) del medio de maduración en una placa de Petri de 35 mm, y cubrirlas con aceite mineral (placa de maduración).
- Lave los ovocitos detenidos con profase I al menos tres veces en microgotas CZB sin milrinona de 100 μL para eliminar completamente la milrinona y permitir la reanudación meiótica.
- Transfiera los ovocitos a la placa de maduración e incube durante 5 h (etapa prometafase I) en una incubadora humidificada con 5% deCO2 en el aire a 37 °C.
4. Preparación de ovocitos para ablación e imagen
- Transferir los ovocitos de prometafase I (paso 3.4) a una placa de cultivo con fondo de vidrio que contenga 100 μL de medio de maduración (paso 3.1) cubierta con aceite mineral.
5. Preparación del microscopio para la ablación
- Al menos 30 minutos antes de la ablación, encienda el regulador de temperatura de la incubadora de escenarios (consulte la Tabla de materiales) y configúrelo a 37 °C.
- Encienda el controlador de CO2 y configúrelo en 5% deCO2.
- Seleccione un objetivo apocromático de inmersión en aceite 40x y aplique una pequeña gota del aceite de inmersión.
- Monte el plato de cultivo con fondo de vidrio con los ovocitos en una incubadora de etapa y cubra la incubadora con una tapa de gas.
- En el software de adquisición de imágenes (consulte la Tabla de materiales), seleccione una opción que permita guardar varias posiciones de etapa (por ejemplo, "Definir marcar y encontrar experimento"). Usando iluminación de campo claro de luz transmitida, céntrate en los ovocitos individuales y guarda sus posiciones.
- En el software de adquisición de imágenes, seleccione el modo de escaneo XYZ , establezca el formato de imagen en 256 x 256 píxeles, establezca el factor de zoom en 2.5x - 3.0x y seleccione una frecuencia de escaneo de 600 Hz. Esto corresponde a un tiempo de permanencia de píxeles de aproximadamente 1,6 μs.
- Establezca una línea láser de excitación de 488 nm a aproximadamente el 10% de la potencia del láser (que corresponde a 4.0 μW a nivel de muestra) (consulte la Tabla de materiales) y use un ancho de banda espectral de 500-550 nm para observar la señal GFP de los MTOC. Para la observación simultánea de la fluorescencia del Cep192 marcado con mCherry, configure una línea láser de excitación de 585 nm en aproximadamente el 8% de la potencia del láser (que corresponde a 10.7 μW a nivel de muestra) y use otro detector configurado con un ancho de banda espectral de 595-645 nm.
NOTA: Es útil utilizar el detector de luz transmitida (TLD) del microscopio confocal para detectar simultáneamente los límites de los ovocitos. - Usando un modo de escaneo en vivo y el control manual del z-drive, examine el ovocito en busca de MTOC.
- Una vez que se detecta un mcMTOC, dibuje una región cuadrada de interés (ROI) a su alrededor.
6. Ablación de mcMTOCs
- Ajuste un láser de femtosegundo a una longitud de onda de 740 nm.
NOTA: La longitud de onda del láser se puede cambiar de acuerdo con el microscopio y las condiciones del láser. - Utilice el modulador electroóptico del microscopio multifotón (consulte la Tabla de materiales) para ajustar la potencia del láser al 70% -80%, correspondiente a la potencia de 60-70 mW en el plano de muestra.
NOTA: Si el láser está equipado con un compensador de pulso de femtosegundo, utilícelo para corregir la dispersión de retardo de grupo (GDD). La corrección GDD reduce la cantidad de potencia láser requerida para una ablación mcMTOC eficiente y minimiza el fotodaño al ovocito. El control GDD generalmente se integra con el software de adquisición de imágenes de microscopios multifotónicos comerciales. - Utilice el mismo formato de imagen, factor de zoom y frecuencia de escaneo que en el paso 5.6. Establezca los parámetros de promedio de línea y fotograma en 1.
- Haga clic en el botón Escanear en el software para realizar la ablación del mcMTOC realizando un solo escaneo láser del ROI seleccionado.
- Utilice la configuración de canal del paso 5.7 para revisar los resultados de la ablación comparando las imágenes de las estructuras marcadas con GFP tomadas antes y después de la exposición al láser multifotón. Si la ablación es exitosa, la intensidad de la fluorescencia GFP en el mcMTOC objetivo disminuye a los niveles observados en el fondo.
- Si quedan algunos fragmentos de una estructura de etiquetado GFP, repita el paso 6.4 una o más veces centrándose en varios planos z del mcMTOC.
- Utilice la configuración de canal del paso 5.7 para verificar la eficiencia de ablación mediante la pérdida completa de señales mCherry asociadas a mcMTOC (mCh-Cep192).
- Repita los pasos 5.8 a 6.7 hasta que se ablacionen todos los MTOC de un ovocito (en varios planos focales).
NOTA: Este protocolo utiliza la microinyección mCh-Cep192 como estrategia para confirmar el agotamiento de mcMTOC después de la exposición al láser multifotón y excluir la posibilidad de que la pérdida de fluorescencia GFP sea causada por el fotoblanqueo de GFP. Sin embargo, la microinyección de esta sonda es opcional y no es necesaria para el procedimiento de ablación.
Resultados
La ablación con láser multifotón proporciona un método eficiente para extirpar selectivamente las estructuras intracelulares. El estudio actual empleó la ablación con láser multifotón para agotar los mcMTOC en ovocitos de ratón de forma selectiva. La ablación con láser agotó los mcMTOC de manera eficiente, como lo demuestra la reducción de la fluorescencia endógena de GFP en los mcMTOC específicos a un nivel comparable al de fondo. El mCh-Cep192 exógeno en los mcMTOC específicos también se abolió después de la ablación con láser. La ablación con láser de los mcMTOC debe realizarse en diferentes planos focales dentro del ovocito (donde se encuentran los mcMTOC, Figura 2) para garantizar que todos los mcMTOC dentro del ovocito se agoten (Figura 3).
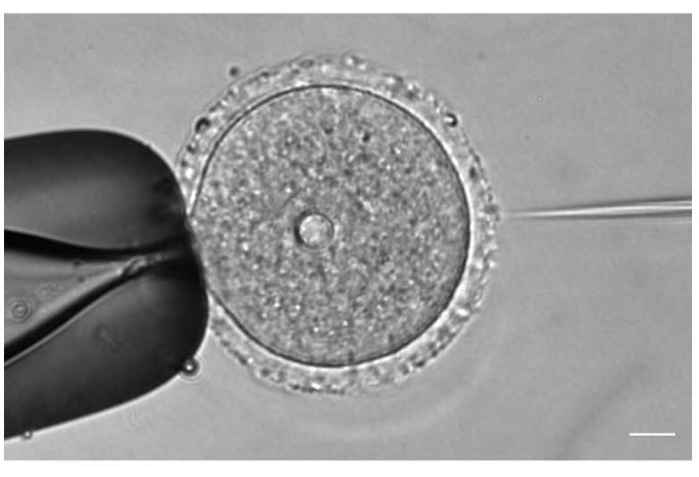
Figura 1: Microinyección de ovocitos. Microinyección de un ovocito de ratón detenido en profase I con ARNc mCh-Cep192 . Barra de escala: 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
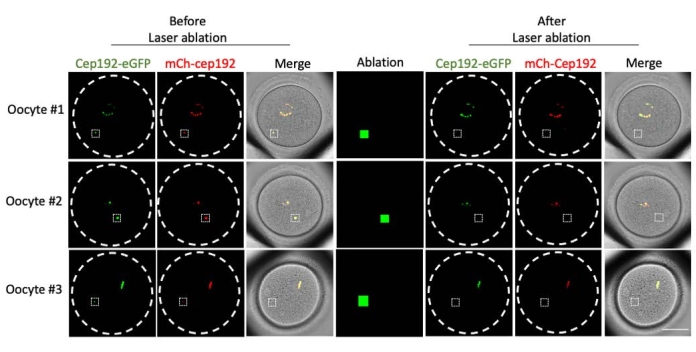
Figura 2: Agotamiento de mcMTOCs en ovocitos de ratón. Imágenes representativas de planos focales individuales. Los cuadrados blancos indican un mcMTOC antes y después de la ablación con láser multifotón. Barra de escala: 40 μm. Haga clic aquí para ver una versión más grande de esta figura.
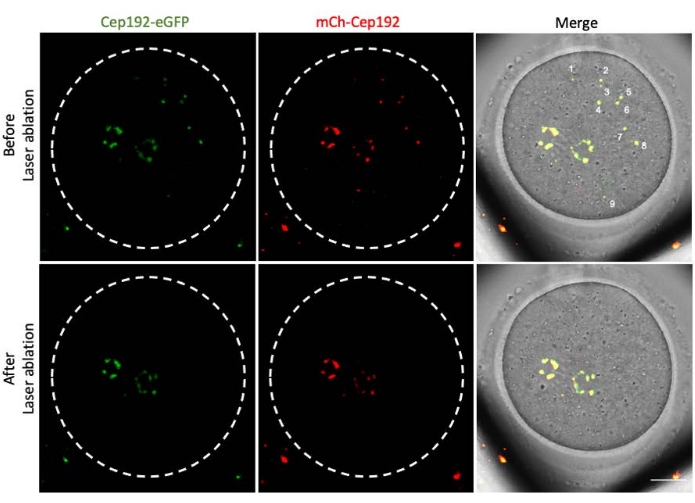
Figura 3: Agotamiento de mcMTOCs en diferentes planos focales en un ovocito de ratón. Imágenes representativas de máxima proyección de un ovocito de ratón ablacionado por mcMTOC. Barra de escala: 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Composiciones de Chatot, Ziomek y Bavister (CZB) y medio esencial mínimo libre de bicarbonato (MEM/PVP). Haga clic aquí para descargar este archivo.
Discusión
Existen diferentes métodos para perturbar las estructuras relacionadas con el citoesqueleto dentro de las células22,23,24,25. Sin embargo, encontrar técnicas eficientes para perturbar selectivamente la estructura objetivo sin comprometer la viabilidad celular es un desafío. El método de ablación con láser multifotón presentado aquí es una estrategia eficiente para inducir una perturbación mecánica selectiva a los mcMTOCs dentro del ovocito sin alterar la viabilidad del ovocito.
La ablación con láser se ha utilizado ampliamente para comprender los mecanismos moleculares que controlan la segregación cromosómica durante la mitosis y la meiosis22,23,26,27. Debido al tamaño relativamente grande (>80 mm de diámetro) de los ovocitos de mamíferos en comparación con las células somáticas28, la ablación de sus estructuras intracelulares representa un desafío. Además, el volumen promedio de mcMTOC en ovocitos en metafase I es ~ 20 μm15, lo que representa un desafío adicional. Se debe adoptar un método eficiente que ofrezca una penetración más profunda del tejido para superar estos desafíos. La principal ventaja de utilizar el láser multifotón para la ablación es su capacidad para penetrar más profundamente en la célula y minimizar los efectos fuera del objetivo29.
Para verificar la eficacia y eficiencia del método de ablación láser para agotar la estructura objetivo, se recomienda utilizar una proteína marcada fluorescentemente para identificar la estructura objetivo a lo largo del tiempo (antes y después de la ablación)23. Es importante notar que la ablación con láser agota todo el mcMTOC como estructura, y aunque los mcMTOC más pequeños requieren solo una exposición al láser para agotarse, los mcMTOC más grandes pueden requerir más de una exposición al láser en diferentes planos focales. También se recomienda fijar e inmunomarcar un subconjunto de ovocitos control y ablacionados con mcMTOC con un marcador MTOC (como γ-tubulina, pericentrina o Cep192) para confirmar aún más la eficiencia de la ablación de mcMTOC. En los ovocitos de control, las áreas del citoplasma adyacentes pero que no se superponen con los mcMTOC estarán expuestas al láser.
Este experimento requiere varias ablaciones de mcMTOC mientras se mueve entre diferentes planos focales dentro de los ovocitos. Por lo tanto, es muy recomendable practicar esta técnica varias veces antes de ejecutar el experimento para minimizar el tiempo del experimento, aumentando así la viabilidad de los ovocitos. Además, es importante utilizar la potencia mínima del láser que sea suficiente para agotar los mcMTOC sin afectar la viabilidad de los ovocitos.
Esta técnica tiene algunas limitaciones. En primer lugar, los microscopios confocales multifotónicos son relativamente más caros que los microscopios confocales regulares. En segundo lugar, perturbar todos los mcMTOC en diferentes planos focales requiere más tiempo que las perturbaciones químicas o genéticas. En tercer lugar, este protocolo requiere habilidades técnicas para extirpar todos los mcMTOC en el menor tiempo posible. Sin embargo, una vez dominado, el uso del láser multifotón proporciona una excelente estrategia para perturbar varias estructuras intracelulares en ovocitos de ratón, incluidos los mcMTOC, contribuyendo a la comprensión de los mecanismos moleculares que regulan el posicionamiento del huso y su migración oportuna en ovocitos de mamíferos.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Los autores desean agradecer a todos los miembros del laboratorio Balboula por su valiosa ayuda y discusiones. Los autores agradecen a Melina Schuh por compartir amablemente la construcción mCherry-Cep192. Este estudio fue apoyado por R35GM142537 (NIGMS, NIH) a AZB.
Materiales
| Name | Company | Catalog Number | Comments |
| 4 IN thinwall GL 1.0 OD/.75 ID | World precision instrument | TW100F-4 | Injection needles |
| Borosilicate glass | Fisherbrand | Cat# 13-678-20D | |
| Borosilicate glass capillarities | World Precision Instrument | Cat# TW100-6 | Holding needles |
| Bovine serum albumine | MilliporeSigma | Cat# A4503 | |
| Cage incubator for Leica DMI6000 B microscope | Life Imaging Services GmbH | ||
| Calcium chlrode dihydrate | MilliporeSigma | Cat# C7902 | |
| CO2 controller | Pecon | # 0506.000 | |
| CO2 Cover HP | Pecon | # 0506.020 | |
| DL-Lactic acid | MilliporeSigma | Cat# L7900 | |
| DMi8 | Leica | N/A | Microscope |
| EDTA | MilliporeSigma | Cat# E5134 | |
| Femtojet 4i | Eppendorf | N/A | Microinjector |
| Femtotips Microloader | Fisher scientific | E5242956003 | |
| Gentamicin | MilliporeSigma | Cat# G1272 | |
| Gentamycin | MilliporeSigma | Cat# 1272 | |
| Glass bottom dish | Mat Tek Corporation | Cat# P35G-1.0-20-C | |
| Hepes | MilliporeSigma | Cat# H3784 | |
| Hepes Sodium Salt | MilliporeSigma | Cat # H3784 | |
| Hera Cell vios 160i | Thermo | N/A | CO2 incubator |
| Leica TCP SP8 spectral laser scanning confocal micorscope with inverted stand DMI6000 B | Leica Microsystems, Inc | N/A | |
| L-Glutamine | MilliporeSigma | Cat#G8540 | |
| Magnesium sulfate dihydrate | MilliporeSigma | Cat# M7774 | |
| MaiTai DeepSee Ti-Sapphire femtosecond laser | Spectra-Physics | N/A | |
| mCH-Cep192 cRNA | N/A | ||
| Medium Essential Medium Eagle - MEM | MilliporeSigma | Cat #M0258 | |
| Milrinone | MilliporeSigma | Cat# M4659 | |
| Mineral oil | MilliporeSigma | Cat# M5310 | |
| Minimum essential medium eagle (MEM) | MilliporeSigma | Cat# M0268 - 1L | |
| Mouse: Cep192-eGFP reporter CF-1 | N/A | ||
| Petri dish (100 mm) | Fisherbrand | Cat# FB0875712 | |
| Petri dish (35 mm) | Corning | Cat# 430165 | |
| Petri dish (60 mm) | Falcon | Cat# 351007 | |
| Phenol Red | MilliporeSigma | Cat# P5530 | |
| Polyvinylpyrolidone | MilliporeSigma | Cat# P2307 | |
| Polyvinylpyrolidone (PVP) | MilliporeSigma | Cat# P2307 | |
| Potassium chloride | MilliporeSigma | Cat# P5405 | |
| Potassium phosphate monobasic | MilliporeSigma | Cat# P5655 | |
| Pregnant mare´s serum gonadotropin | Lee BioSolutions | Cat# 493-10-10 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Sewing needles | D.M.C | N/A | N° 5 * 16 Needles |
| Sodium bicarbonate | MilliporeSigma | Cat# S5761 | |
| Sodium chloride | MilliporeSigma | Cat# S5886 | |
| Stage-top heating insert P | Pecon | # 0426.300 | |
| Sterezoom S9i | Leica | N/A | Stereomicroscope |
| Syringe 1 mL | BD company | Cat# 309597 | |
| Taurine | MilliporeSigma | Cat# T0625 | |
| Temperature controller Tempcontrol 37-2 digital | Pecon | # 0503.000 | |
| The Cube temperature controller for the cage incubator | Life Imaging Services GmbH |
Referencias
- Bennabi, I., Terret, M. E., Verlhac, M. H. Meiotic spindle assembly and chromosome segregation in oocytes. Journal of Cell Biology. 215 (5), 611-619 (2016).
- Hashimoto, N., Kishimoto, T. Regulation of meiotic metaphase by a cytoplasmic maturation-promoting factor during mouse oocyte maturation. Development Biology. 126 (2), 242-252 (1988).
- Kitajima, T. S., Ohsugi, M., Ellenberg, J. Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes. Cell. 146 (4), 568-581 (2011).
- Azoury, J., Verlhac, M. H., Dumont, J. Actin filaments: Key players in the control of asymmetric divisions in mouse oocytes. Biology of the Cell. 101 (2), 69-76 (2009).
- Li, H., Guo, F., Rubinstein, B., Li, R. Actin-driven chromosomal motility leads to symmetry breaking in mammalian meiotic oocytes. Nature Cell Biology. 10 (11), 1301-1308 (2008).
- Schuh, M., Ellenberg, J. A new model for asymmetric spindle positioning in mouse oocytes. Current Biology. 18 (24), 1986-1992 (2008).
- Pimenta-Marques, A., Bettencourt-Dias, M. Pericentriolar material. Current Biology. 30 (12), 687-689 (2020).
- Hinchcliffe, E. H. The centrosome and bipolar spindle assembly: Does one have anything to do with the other. Cell Cycle. 10 (22), 3841-3848 (2011).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of centrioles in the first and second meiotic spindles of mouse oocytes. Journal of Cell Science. 11 (2), 521-541 (1972).
- Schuh, M., Ellenberg, J. Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell. 130 (3), 484-498 (2007).
- Clift, D., Schuh, M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes. Nature Communications. 6, 7217(2015).
- Luksza, M., Queguigner, I., Verlhac, M. H., Brunet, S. Rebuilding MTOCs upon centriole loss during mouse oogenesis. Developmental Biology. 382 (1), 48-56 (2013).
- Balboula, A. Z., et al. Haspin kinase regulates microtubule-organizing center clustering and stability through Aurora kinase C in mouse oocytes. Journal of Cell Science. 129 (19), 3648-3660 (2016).
- Breuer, M., et al. HURP permits MTOC sorting for robust meiotic spindle bipolarity, similar to extra centrosome clustering in cancer cells. Journal of Cell Biology. 191 (7), 1251-1260 (2010).
- Londoño-Vásquez, D., Rodriguez-Lukey, K., Behura, S. K., Balboula, A. Z. Microtubule organizing centers regulate spindle positioning in mouse oocytes. Developmental Cell. 57 (2), 197-211 (2022).
- Konig, K., Riemann, I., Fischer, P., Halbhuber, K. J. Intracellular nanosurgery with near infrared femtosecond laser pulses. Cellular and Molecular Biology. 45 (2), 195-201 (1999).
- Galbraith, J. A., Terasaki, M. Controlled damage in thick specimens by multiphoton excitation. Molecular Biology of the Cell. 14 (5), 1808-1817 (2003).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: Setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D., Lewis, J. L., Torres, I. An improved culture medium supports development of random-bred 1-cell mouse embryos in vitro. Journal of Reproduction and Fertility. 86 (2), 679-688 (1989).
- Tsafriri, A., Chun, S. Y., Zhang, R., Hsueh, A. J., Conti, M. Oocyte maturation involves compartmentalization and opposing changes of cAMP levels in follicular somatic and germ cells: Studies using selective phosphodiesterase inhibitors. Developmental Biology. 178 (2), 393-402 (1996).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio Protocol. 11 (15), 4104(2021).
- Khodjakov, A., Cole, R. W., Rieder, C. L. A synergy of technologies: Combining laser microsurgery with green fluorescent protein tagging. Cell Motility and the Cytoskeleton. 38 (4), 311-317 (1997).
- Pavin, N., Tolic, I. M. Mechanobiology of the mitotic spindle. Developmental Cell. 56 (2), 192-201 (2021).
- Khodjakov, A., Cole, R. W., Oakley, B. R., Rieder, C. L. Centrosome-independent mitotic spindle formation in vertebrates. Current Biology. 10 (2), 59-67 (2000).
- Aist, J. R., Liang, H., Berns, M. W. Astral and spindle forces in PtK2 cells during anaphase B: a laser microbeam study. Journal of Cell Science. 104, 1207-1216 (1993).
- Bennabi, I., Manil-Segalen, M. Laser Ablation of microtubule-chromosome attachment in mouse oocytes. Methods in Molecular Biology. 1818, 153-161 (2018).
- Milas, A., Jagric, M., Martincic, J., Tolic, I. M. Optogenetic reversible knocksideways, laser ablation, and photoactivation on the mitotic spindle in human cells. Methods in Cell Biology. 145, 191-215 (2018).
- Warzych, E., Lipinska, P. Energy metabolism of follicular environment during oocyte growth and maturation. Journal of Reproduction and Development. 66 (1), 1-7 (2020).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados