Method Article
在非手术胚胎移植或人工授精之前诱导雌性小鼠假妊娠,而无需输精管切除雄性
摘要
所提出的宫颈操作方法可以在小鼠中诱导假妊娠,而无需用输精管切除的雄性繁殖雌性。诱导假妊娠是非手术胚胎移植和非手术人工授精成功所必需的,两者都被介绍。
摘要
为了通过胚胎移植或人工授精成功维持怀孕,必须诱导雌性受体小鼠进入假怀孕状态。传统上,雌性小鼠与输精管切开的雄性配对过夜,第二天早上,评估交配塞的存在。为了提高生产假性雌性妊娠的效率,宫颈操作技术已被标准化,与小鼠的非手术胚胎移植或人工授精技术结合使用。将小塑料棒的钝端阴道插入以接触子宫颈,并通过与修剪器接触振动 30 秒。该过程很快,不需要麻醉或镇痛。该技术提高了生产假性妊娠女性的可靠性和可预测性,并完全消除了对输精管切除男性的需求。对于CD1小鼠,发情期雌性使用宫颈操作诱导假妊娠的效率为83%(N = 76),但发情期雌性中只有38%被输精管切除的雄性堵塞(N = 24)。CD1小鼠的人工授精是通过发情与激素同步,宫颈操作和精子的子宫移植进行的。接受宫颈操作的人工授精接受者(N = 76)的怀孕率为72%,平均产仔数为8.3只幼崽。该方法也可用于生产假性妊娠女性进行非手术胚胎移植。因此,在进行非手术辅助生殖技术时,通过宫颈操作诱导假妊娠是与输精管切除的男配的方便有效的替代方案。使用宫颈操作通过减少所需的动物数量并消除手术改变雄性的必要性,为辅助生殖技术提供了3R(替换,减少和细化)的好处。
引言
辅助生殖技术用于生产转基因小鼠模型,以及从冷冻保存中恢复菌株,从受损的健康状况中重新衍生菌株,以及战略性动物饲养管理,包括生产年龄匹配的队列。小鼠的所有辅助生殖技术都需要使用假怀孕雌性受体进行胚胎发育。从历史上看,假怀孕受者是通过与不育雄配产生的,这些雄性要么是手术输精管切除术,要么是遗传性不育的,第二天早上评估交配塞的存在1。最近,已经开发出一种用于小鼠声波刺激的方案,用于原核或双细胞小鼠胚胎的手术移植2。我们还开发了一种宫颈操作(CM)方案,用于人工授精和囊胚的非手术胚胎移植。使用该程序的基本原理是将所需动物数量减少3R(不再需要雄性小鼠)并改进所用技术(不再需要雄性小鼠的手术输精管切除术)。该协议的描述包括相关的辅助生殖技术,以帮助将CM集成到正常工作中。CM方法的总体目标是取代在假怀孕雌性生成中使用雄性小鼠进行辅助生殖技术,包括人工授精和胚胎移植。
这里描述的CM方案最初是为了协助小鼠的人工授精而开发的。如最初所述,人工授精方案实现了 50% 的怀孕率,平均产仔数为 7 只幼崽3。CD1受体小鼠在授精前47小时间隔内发情与低剂量激素同步,包括怀孕母马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)。发情同步的一个优点是它允许在正常工作时间内使用协议。雌性在人工授精后立即与输精管切除的雄性配对,并通过交配栓的存在确认交配。据报告,与受体的交配率不一致是手术中的一个困难。因此,寻求交配的替代方法来诱导假妊娠。
本研究提出了一种标准化的CM技术,以提高假怀孕女性的生产效率。对于发情期或发情期的女性,将小塑料棒的钝端阴道插入以接触子宫颈,并通过与修剪器接触振动 30 秒。该过程在钢丝顶笼上进行。不需要麻醉或镇痛。CM技术便于生产假性妊娠雌性,非手术人工授精后即可产仔,无需与输精管切除的雄配。CM也可用于生产假怀孕的女性作为胚胎移植的接受者。具体来说,CM技术可以与非手术胚胎移植配对,如此处所述。非手术方法已被证明对小鼠4,5和大鼠6,7的囊胚期胚胎移植有效。由于这种非手术方法是手术方法的有效替代方案,因此它被认为是该技术的3R改进。根据先前的研究,粪便皮质酮水平作为压力的衡量标准表明,该程序的非手术性质不会增加啮齿动物的压力水平7,8。与手术胚胎移植相比,这些程序在技术上的挑战性要小得多,并且执行速度要快得多。当胚胎被转移到子宫时,必须移植子宫发育正确阶段的胚胎。对于小鼠,囊胚被转移到后2.5天(dpc)假怀孕接受者。
对于这里描述的两种非手术技术,激素给药的时间和CM技术不同。CM手术相对于发情的时机对于成功很重要,因为它取代了假怀孕受者产生的自然交配。通过消除输精管切除雄性诱导假妊娠的需要,该程序通过减少所需的动物数量和消除手术改变雄性的必要性来提供3R益处。该过程本身很快(30秒),不需要麻醉或镇痛。该技术大大提高了生产假怀孕雌性用于辅助生殖的可靠性和可预测性。
研究方案
遵循所有适用的国际、国家和机构动物护理和使用指南。在涉及动物的研究中执行的所有程序均符合ParaTechs公司机构动物护理和使用委员会的道德标准,并根据实验动物福利办公室,国立卫生研究院,公共卫生服务,美国卫生与公众服务部规定的标准进行。本研究使用年龄>8周龄的雄性和雌性CD1(ICR)和雌性C57Bl / 6J小鼠。这些动物是从商业来源获得的(见 材料表)。
1.用于CD1小鼠人工授精的宫颈操作程序
- 第1天和第3天雌性小鼠同步排卵
- 在第1天,在动物室黑暗周期开始前0.5小时通过腹膜内注射(IP)向雌性小鼠注射2.5IU PMSG(参见 材料表)。
注意:每个男性捐赠者将为10名女性接受者提供足够的精子。 - 在动物园黑暗周期开始前3天,通过IP注射向雌性注射2.5IU hCG(见 材料表)。
注意:注射的时间,精子转移和光周期彼此非常重要。为本协议中的所有程序指定的时间基于12小时亮/暗循环。
- 在第1天,在动物室黑暗周期开始前0.5小时通过腹膜内注射(IP)向雌性小鼠注射2.5IU PMSG(参见 材料表)。
- 第4天新鲜精子的收集和获能
- 在石蜡油下的60mm组织培养皿中制备500μL精子预孵育培养基(PM,参见 材料表)。每个男性捐赠者准备一道菜。在精子收集之前在37°C和5%CO2 下平衡至少30分钟。
- 在动物饲养场光循环开始后1小时,根据机构指南对雄性实施安乐死。每个雄性将为10次人工授精提供足够的精子。
- 快速解剖小鼠的附睾尾部。使用夹层剪刀和齿钳在膀胱上方进行横向腹部切口。
- 睾丸脂肪垫位于膀胱的两侧。用弯曲的镊子抓住其中一个睾丸脂肪垫,并从体腔中取出睾丸和附睾。将附睾尾部识别为睾丸正下方的扁平椭圆管状结构。
- 用弯曲的镊子握住附睾尾部,然后用小的倾斜剪刀切除。取出两个附睾尾,并将它们转移到吸收性组织中,以在解剖显微镜下去除脂肪和血液。
- 将两个附睾尾放入石蜡油下每500μL平衡PM滴中,温度为37°C。用小剪刀做六个切口来切组织。如果使用多个男性供体,则为每个精子样本使用每个供体的一个附睾,以减少样本之间的差异。
- 轻轻旋转培养皿,让精子离开组织3分钟,每分钟旋转一次。取出所有纸巾。
- 将精子样品在37°C和5%CO2 下孵育45分钟至1小时以致能。
- 可选:测量精子数量,并使用血细胞计数器在显微镜下评估运动性。为了计数,根据需要在PM中稀释精子。
- 通过细胞学评估确认发情周期同步
- 使用预先润湿的小拭子(参见材料表),通过将拭子滚动到组织上,轻轻地从阴道壁收集阴道细胞,将它们涂抹在显微镜载玻片上的 20 μL 无菌水中,然后风干。
- 在使用100倍放大倍率和明场照明的显微镜下,评估角化上皮细胞的存在。发情期或发情晚期的女性将存在角化上皮细胞,应选择进行宫颈操作。
- 可选:在授精前记录雌性接受者的体重。
- 进行颈椎推拿(CM)
- 在授精前约0.5小时,将受体雌性放在带有金属架的笼子顶部,让小鼠"抓住"笼子杆表面。用拇指和食指抓住尾巴根部附近,并在稳定动物的同时向上倾斜尾巴(图1)。
注意:正确执行处理技术后,鼠标将在程序期间保持静止。如果鼠标移出位置,请轻轻重新定位并继续。如果选择攻击性动物作为接受者,则在手术过程中允许动物进入浓缩隧道可能会平静下来。使用隧道是可选的,但它可以通过在此过程中分散注意力来帮助研究人员处理动物。 - 将小塑料棒的钝端(见材料表)阴道插入以与子宫颈接触,并通过与修剪器接触振动30秒(见 材料表)。
注意:在启动修剪器之前,请将杆放置到位。在手术过程中,两者都用一只手握住。不需要麻醉或镇痛。
- 在授精前约0.5小时,将受体雌性放在带有金属架的笼子顶部,让小鼠"抓住"笼子杆表面。用拇指和食指抓住尾巴根部附近,并在稳定动物的同时向上倾斜尾巴(图1)。
- 用于人工授精的非手术精子移植
- 将授精装置(参见材料表)放在设置为40μL的P200移液管上,然后取下保护盖。
- 在37°C和5%CO2下从培养皿中取出等分试样的致敏精子样品,并将其转移到37°C下无油的35mm组织培养皿中。 精子样本将立即用于转移。
注意:精子将在CO2 培养箱外迅速失去活力。将有能力的精子样品尽可能保持在37°C和5%CO2 。 - 将移液器柱塞按到第一站,将导管尖端降低到37°C的精子样品中,然后将精子缓慢装入转移装置中。避免任何结块。使用吸收组织从授精装置的外部去除残留的油。将移液器放在一边。
注意:必须避免将石蜡油转移到子宫角。使用吸收组织从授精装置的外部去除残留的油。 - 将接收者母头放在金属丝架笼顶部。使用与CM相同的处理技术将鼠标保持在适当的位置;用拇指和食指抓住尾巴根部附近,在稳定动物的同时向上倾斜尾巴。
- 将小窥器(见 材料表)放入阴道。
- 将授精装置导管插入窥器,通过子宫颈,进入子宫。一旦设备集线器接触窥器,通过将移液器柱塞按到第一站来分配精子。避免将多余的空气转移到子宫角中。
注意:如果导管位置不正确,它会撞击子宫颈周围的组织,导致其弯曲并最终弯曲。如果导管在第一次尝试时没有滑过子宫颈,请轻轻地将导管取出,然后重新尝试直到成功。可能需要重新定位窥器。 - 取出设备和窥器。无需术后监测。
- 可选:第10-12天妊娠检查
- 使用体重增加来确定妊娠状态。体重增加将取决于应变,但至少增加 1-2 克与怀孕相关。
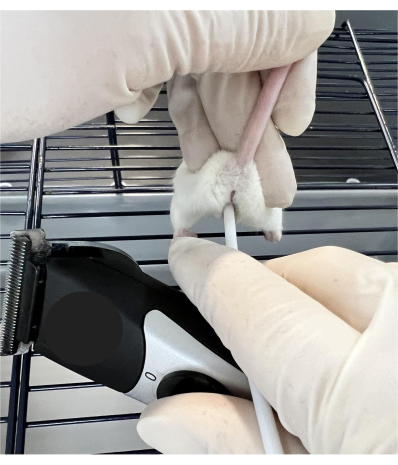
图1:用于颈椎操作的鼠标握持技术。 鼠标放在铁丝笼顶部,在尾部和后腿前部的两侧稳定。小塑料棒的钝端插入阴道以接触子宫颈,并通过与修剪器接触而振动。 请点击此处查看此图的大图。
2. 用于CD1小鼠颈椎操作的非手术胚胎移植程序
- 雌性小鼠在第1天和第3天同步排卵
- 在第1天,在动物饲养光周期开始后约6小时,通过IP注射向雌性小鼠注射2.5 IU PMSG。
- 在第3天通过IP注射向雌性注射2.5 IU hCG,间隔PMSG注射后47小时或动物饲养场光周期开始后约5小时。
- 通过细胞学评估确认发情周期同步
- 在第3天,在CM前约1小时,对潜在的受体进行细胞学检查。使用预先润湿的小拭子,通过将拭子滚动到组织上,轻轻地从阴道壁收集阴道细胞,将它们涂抹在显微镜载玻片上的 20 μL 无菌水中,然后风干。
- 在使用100倍放大倍率和明场照明的显微镜下,评估角化上皮细胞的存在。发情期或发情晚期的女性将存在角化上皮细胞,应选择进行宫颈操作。
- 可选:记录潜在女性胚胎接受者的体重。
- 执行 CM
- 在第3天,在动物饲养室黑暗周期开始前1小时,将受体雌性放在带有金属架的笼子顶部,让动物"抓住"笼子杆表面。用食指和拇指抓住尾巴根部附近,然后在稳定动物的同时向上倾斜尾巴(图1)。
注意:正确执行处理技术后,鼠标将在程序期间保持静止。如果鼠标移出位置,请轻轻重新定位,然后继续。如果选择攻击性动物作为接受者,则在手术过程中允许动物进入浓缩隧道可能会平静下来。 - 将小塑料棒的钝端阴道插入以接触子宫颈,并通过与修剪器接触振动 30 秒。
注意:在启动修剪器之前,请将杆放置到位。在手术过程中,两者都用一只手握住。不需要麻醉或镇痛。
- 在第3天,在动物饲养室黑暗周期开始前1小时,将受体雌性放在带有金属架的笼子顶部,让动物"抓住"笼子杆表面。用食指和拇指抓住尾巴根部附近,然后在稳定动物的同时向上倾斜尾巴(图1)。
- 第6天非手术胚胎移植
- 将 20 μL M2 培养基液滴(参见 材料表)滴到组织培养皿的盖子上。
注意:选择盖子是因为它的边缘较短,因此便于接触滴中的胚胎。任何时候都不要在M2滴上涂上石蜡油,因为将油引入子宫角似乎会对胚胎移植产生负面影响。 - 在显微镜下并使用反射照明,使用标准胚胎处理移液管将10-20个囊胚装入培养基液滴中(参见材料表)。
注意:移植的最佳胚胎数量取决于小鼠品系和胚胎所经历的任何操作。对于健康的未经处理的胚胎,移植10-15个胚胎就足够了。对于再衍生或转基因胚胎,移植更多的胚胎是合适的。 - 将非手术胚胎移植装置(参见材料表)固定在设置为1.8μL的P2移液管上。 取下保护导管盖。
- 将移液器的柱塞按到第一站,将导管的尖端降低到培养基中,然后将胚胎缓慢拉入装置的导管尖端。从介质中取出吸头。
注意:在低放大倍率下可视化胚胎将更容易将胚胎加载到设备中。如果胚胎散落在液滴中,轻轻左右摇动培养皿,将胚胎集中在液滴的中心,或使用胚胎处理移液管重新定位它们。 - 将移液器体积设置为 2.0 μL,以在导管尖端产生一个小气泡。轻轻地将移液管与装载胚胎放在小鼠笼附近。
- 将接收者母头放在金属丝架笼顶部。使用与CM相同的处理技术将鼠标保持在适当的位置;用食指和拇指抓住尾巴根部附近,然后在稳定动物的同时向上倾斜尾巴。
- 将一个小窥器(见 材料表)放入阴道。
- 将转移装置导管插入窥器,通过子宫颈,进入子宫。一旦设备集线器接触窥器,通过将移液器柱塞按到第一站来分配胚胎。避免将多余的空气转移到子宫角中。
- 在不释放移液器柱塞的情况下,取出设备和窥器。无需术后监测。
- 将 20 μL M2 培养基液滴(参见 材料表)滴到组织培养皿的盖子上。
结果
由于电9和声波10宫颈刺激已被用于诱导大鼠假妊娠,这项工作提出了一种可用于小鼠的标准化机械程序。阴道细胞学检查可以帮助识别处于发情不同阶段的女性。为了确认女性假妊娠,采用了相同的方法。首先,比较CD1和C57Bl/6小鼠在整个发情周期,怀孕期间以及由交配或CM诱导的假妊娠期间的雌性细胞学谱。 从雌性中取出阴道拭子并使用Papanicolaou染色系统进行染色(见材料表)。在100倍放大倍率和明场照明下观察细胞。观察到的细胞包括白细胞、有核上皮细胞和无核角化上皮细胞。发情周期阶段的确定基于每种细胞类型的相对百分比11,12。发情期的特征是角化上皮细胞占优势。随着发情期的结束,肠胃病开始,白细胞开始出现,而角化的上皮细胞变得不那么明显。Diestrus具有中度至低的细胞性,白细胞占主导地位,有核上皮细胞开始出现。发情期的特点是白细胞的丢失,有核上皮细胞的增加以及角化上皮细胞的出现。发情后,发情开始,循环继续。
为了建立基线概况,在交配前记录每个雌性至少两个完整的发情周期的阴道细胞学检查(CD1的N = 20,C57Bl / 6的N = 20)。周期长度和个体特征在小鼠之间有所不同;但是,观察到了预期的总趋势。CD1和C57Bl / 6小鼠发情周期的平均长度为3.8天,范围为3-5天。在自然交配发生的前一天,所有雌性小鼠都处于发情期。交配后,在后 1.5 天再次进行细胞学检查 (dpc),直到发情循环恢复。 图2 显示了假性妊娠CD1和C57Bl / 6雌性与输精管切除雄性的细胞学特征。
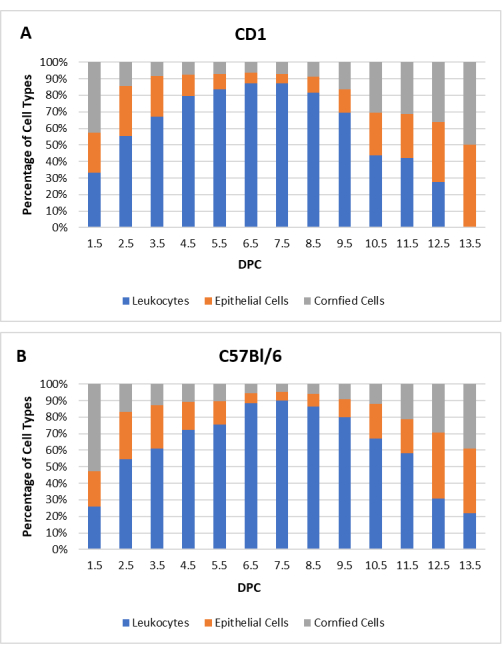
图2:假性妊娠雌性小鼠的细胞学谱。 白细胞,有核上皮细胞和角化上皮细胞的每种细胞类型的平均百分比显示为(A)CD1(N = 20)和(B)C57Bl / 6(N = 20)小鼠后天数(DPC)的函数。 请点击此处查看此图的大图。
在这项工作中,CM技术已被标准化,以提高生产假怀孕女性的效率。对于发情期或发情期的女性,将小塑料棒的钝端阴道插入以接触子宫颈,并通过与修剪器接触振动 30 秒。该过程在钢丝顶笼上进行。不需要麻醉或镇痛。为了确定CM程序的有效性,比较雌性CD1(N = 20)和C57Bl / 6(N = 20)小鼠在与输精管切除的雄配后和CM后(总N = 40)的阴道细胞学检查。CM诱导的假妊娠的细胞学特征与交配诱导的假性妊娠的细胞学特征相似,如图 3所示。
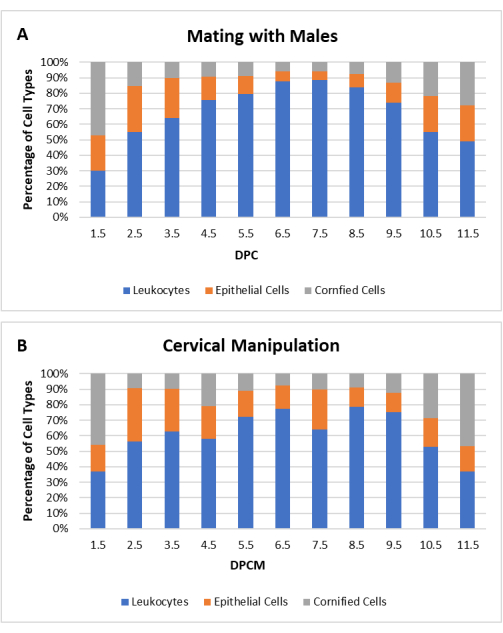
图3:宫颈操作(CM)后假性妊娠雌性小鼠的细胞学谱。 白细胞、有核上皮细胞和角化上皮细胞的每种细胞类型的百分比显示为后天数 (DPC) 或宫颈操作后天数 (DPCM) 的函数。显示CD1和C57Bl / 6小鼠(N = 40)(A)与输精管切除的雄配或CM后(B)的平均细胞类型百分比。 请 点击此处查看此图的大图。
为了确定CM技术是否足以确定妊娠以进行辅助生殖,CM作为CD1女性非手术人工授精(NSAI)方案的一部分进行。人工授精方案包括在精子移植前雌性发情与低剂量激素PMSG和hCG同步。CM是在精子移植之前进行的。对于CD1小鼠,使用CM诱导发情期雌性假妊娠的效率为83%(N = 76)。在对照实验中,只有38%的发情女性被输精管切除的男性堵塞(N = 24)。接受宫颈操作的人工授精接受者(N = 76)的怀孕率为72%,平均产仔数为8.3只幼崽。因此,在进行NSAI时,通过CM诱导假妊娠是与输精管切除的男配的方便有效的替代方法。使用CM在发情期制备CD1受体(N = 4)用于新鲜CD1囊胚的非手术胚胎移植导致100%的怀孕率。移植9-15个胚胎产生了3个健康的窝,出生率为45%,平均产仔数为6只幼崽。相比之下,与输精管切除的雄配以诱导假妊娠的CD1受体(N = 20)在转移20个新鲜B6C3F2囊胚后,妊娠率为80%,出生率为46%。
辅助生殖技术的结果可能是菌株特异性的,因为已经发现超排卵激素给药的剂量和时间等变量是菌株依赖性的13。此外,接受者年龄和体重等因素会影响对激素的反应14。在这项工作中,当进行人工授精的CM程序时,仅发现发情后期或发情期的女性有反应。一般来说,为了增加人群中可用接受者的数量,女性首先发情与低剂量的激素同步3。在这项工作中,发情与2.5 IU的PMSG和hCG同步对11-14周龄CD1女性(N = 27)有效率为78%,对18-32周龄C57Bl / 6女性(N = 22)的有效率为60%。使用该技术在发情期的CD1女性(N = 76)中使用宫颈操作诱导假妊娠的效率为83%,发情期C57Bl / 6女性的假妊娠诱导率为82%(N = 100)。
讨论
3R是动物在研究中使用的伦理框架,正如Russel和Burch在1959年"人道实验技术原理"15中所描述的那样。3R代表动物使用的替代,减少和改进。此处突出显示的协议与3R一致。宫颈操作技术减少了所需的动物数量,不再需要使用雄性来产生假怀孕的雌性。该技术还消除了对男性进行输精管切除术的需要,从而通过减轻疼痛和痛苦来提供改进。这里描述的辅助生殖技术(人工授精和胚胎移植)是非手术的,因此,两者都通过减少由其手术替代方案引起的疼痛和痛苦8来提供3R细化。
在小鼠1中进行辅助生殖时,使用假怀孕雌性对于幼崽的恢复是必要的。CM程序是产生假性怀孕女性的有效方法,但受体女性发情周期阶段的同步是该过程的关键第一步。发情同步可以大大减少菌落中准备潜在受体所需的雌性数量,并有助于按需生产定时假妊娠雌性。使用低剂量的激素似乎不会对CD1小鼠活窝的恢复造成任何有害影响。必须注意其他菌株,以找到激素和浓度组合,为移植的胚胎或精子产生最优质的受体女性。使用PMSG和hCG16可以实现同步,但产生超排卵女性的剂量可能不适合持续妊娠17。
为了确定女性是否处于发情期,在这项工作中进行了细胞学评估。发情期也可以通过观察阴道开口11,18来评估。虽然这种方法非常有用,可以单独使用或作为确认使用,但它比使用细胞学更主观。无需染色的阴道细胞学检查对于选择发情期的女性既快速又有效,因为角化上皮细胞很容易识别。在该协议中,在CM之前进行细胞学评估以确定潜在的受体。在CM之前进行细胞学检查很重要,因为该过程往往会使从阴道区域脱落的细胞碎裂,从而使鉴定变得困难。假妊娠或妊娠的细胞学评估可在CM(dpcm)后3.5-11.5天进行,连续3天。发情周期性女性的概况应至少为 1 天,角化上皮细胞大量浸润。假性妊娠/妊娠女性应连续 3 天显示双发性(主要是细胞数量可能较低的白细胞)。
通过CM技术的发展,发现一些小鼠比其他小鼠更容易接受该程序。CD1雌性小鼠是极好的候选者,因为它们具有冷静的天性和出色的培育本能。这种菌株易于处理,并且在CM和非手术辅助生殖技术中表现良好。C57Bl/6小鼠往往更具攻击性,养育能力较差。虽然该方案使用CM有效地产生了假怀孕的C57Bl / 6女性,但她们不太可能始终如一地允许该程序。这似乎与CM期间的发情期有关,发情期或发情期的女性更容易接受。使用富集管让动物进入允许进入阴道进行手术,并帮助使雌性平静下来。该程序本身并不能完全约束雌性,因此动物可以随时拉开。如果发生这种情况,可以重新定位动物,然后可以继续该过程。如果女性走开,手术的时间就会停止,并在手术恢复时恢复。手术成功的关键是发情周期的阶段(发情后期和发情)以及杆与子宫颈的接触。微调器的振动提供标准化的 CM。为了确保与子宫颈接触,对杆施加温和的压力,并通过杆的小来回运动确保杆与子宫颈的位置。
CM的使用改进了NSAI方案,因为在精子移植之前可以选择处于发情周期正确阶段的雌性,并且该方案不再取决于与输精管切除的雄配。人工授精发情周期同步的定时使得卵母细胞成熟对应于第4天早上的精子转移。该方案成功的关键是调整排卵时间,以便发生受精。在预期的精子移植前15-17小时必须注意施用hCG,如 体外 受精使用的时间建议的那样1。精子样本的质量将直接影响人工授精的结果。被激活的新鲜精子将表现最佳。冷冻保存的优质精子可以在 体内产生受精胚胎。但是,应注意直接转移解冻的精子,因为转移到子宫角的残留冷冻保护剂可能会抑制植入(未发表的观察结果)。
将CM与胚胎移植结合使用在概念上是一种简单的适应。发情周期同步减少了产生受体池所需的雌性数量。在CM之前确定发情期会增加获得假性妊娠受者的可能性。该方法的一个缺点是胚胎移植时受体的细胞学处于流动阶段。如果女性从发情期过渡到假妊娠期,则存在所有细胞类型,并且只有在细胞学检查跟踪数天后假妊娠才会变得明显。基于CD1和C57Bl/6小鼠从发情期过渡到假妊娠的成功(>80%),该方法有望适用于胚胎移植受者。初步结果显示,有限的非手术胚胎移植取得了良好的成功。一般来说,非手术胚胎移植的效率与手术技术相当4,5,并且非手术移植可以在囊胚阶段代替手术胚胎移植。对于早期胚胎,需要胚胎培养到囊胚阶段。但是,如果首选手术转移,则可以使CM技术适应适当的假妊娠受者所需的正确时间2。一般来说,胚胎接受者比胚胎早1天。例如,囊胚以3.5 dpc从供体处收获,并转移到2.5 dpc接受者。因此,需要进行CM以使受体处于比胚胎更不发达的假性怀孕状态。
总之,这里概述的CM技术显示出与其他小鼠辅助生殖技术集成的良好前景。我们已经为使用非手术技术的人工授精和胚胎移植提供了成功的方案。综合起来,CM技术提供了3R的优势,包括(1)通过消除对输精管切除的雄性的需求来减少动物数量,以及(2)通过用非手术替代方案取代手术技术来改进技术。
披露声明
Barbara Stone和Sarah Srodulski都受雇于美国肯塔基州列克星敦的ParaTechs Corporation。ParaTechs拥有制造小鼠mNSET设备的独家许可权。ParaTechs Corp开发并销售mNSET和mC&I设备,分别可用于非手术胚胎移植和非手术人工授精。
致谢
本出版物中报告的研究得到了美国国立卫生研究院研究基础设施计划办公室主任办公室的支持,奖励编号为R43OD020304,美国国立卫生研究院国家心理健康研究所的奖励编号为R44MH122117。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| Blastocyst stage embryos | |||
| CARD Fertiup Preincubation Medium (PM) | CosmoBio | KYD-002-EX | For sperm capacitation |
| Embryo handling pipette | Cook Medical | K-FPIP-1120-10BS | Flexipet is available in various diameters |
| Embryo handling pipette assembly | Paratechs | 90010 | |
| Female mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| Forceps | Fine Science Tools | 11053-10 | Toothed, for dissection |
| Forceps | Fine Science Tools | 11052-10 | Curved, for dissection |
| Forceps | Fine Science Tools | Dumont #5 | Fine, for dissection |
| Hemocytometer | Fisher Scientific | 267110 | Optional |
| human Chorionic Gonadotropin (hCG) | Prospec | hor-250 | For estrus synchronization |
| Incubator, 37 °C 5% CO2 | Thermo Scientific | ||
| Incubator, 37 °C, benchtop | Cook | K-MINC-1000 | |
| Kimwipes | Kimberly-Clark | 34155 | Absorbant tissues |
| M2 medium | Millipore | MR-015-D | Embryo handling medium |
| Male mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| mC&I device | ParaTechs | 60020 | For sperm transfer, specula included |
| mCM rod | ParaTechs | 90050 | Smooth, blunt, with a diameter @3 mm |
| Microscope | Olympus | SZX7 | 20x and 40x magnification with transmitted and reflected illumination source for embryo work and dissections |
| Microscope | ACCU-SCOPE | 3032 | 100x magnification with bright field illumination |
| Microscope slides | Fisher Scientific | 12-544-7 | |
| mNSET device | ParaTechs | 60010 | For embryo transfer, specula included |
| Needles, 26 G | Exel | 26402 | |
| Papanicolaou Staining System | VWR | 76265-730 | Optional |
| Paraffin oil | Sigma-Aldrich | 18512 | |
| Pipette, P200 | Corning | 4074 | Fits the C&I device for sperm transfer |
| Pipette, PR-2 | Rainin | 17008648 | Fits the NSET device for embryo transfer |
| Pregnant Mare Serum Gonadotropin (PMSG) | Prospec | hor-272 | For estrus synchronization |
| Scale | American Weigh Scales | LB-1000 | |
| Scissors | Fine Science Tools | 14068-12 | Dissection |
| Scissors | Fine Science Tools | 14081-09 | Angled, dissection |
| Swabs, Constix | Contec | SC-4 | For vaginal cytology |
| Syringes, 1 cc | Becton Dickenson and Company | 309659 | |
| Tissue culture dishes, 35 mm | Falcon | 353001 | |
| Tissue culture dishes, 60 mm | Falcon | 353004 | |
| Trimmer | Wahl | ChroMini T-Cut | |
| Wire bar topped mouse cage |
参考文献
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual, fourth edition. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (2014).
- Wake, Y., et al. Successful induction of pseudopregnancy using sonic vibration in mice. Scientific Reports. 13 (1), 3604(2023).
- Stone, B. J., Steele, K. H., Fath-Goodin, A. A rapid and effective nonsurgical artificial insemination protocol using the NSET device for sperm transfer in mice without anesthesia. Transgenic Research. 24 (4), 775-781 (2015).
- Green, M., Bass, S., Spear, B. A device for the simple and rapid transcervical transfer of mouse embryos eliminates the need for surgery and potential post-operative complications. BioTechniques. 47 (5), 919-924 (2009).
- Bin Ali, R., et al. Improved pregnancy and birth rates with routine application of nonsurgical embryo transfer. Transgenic Research. 23 (4), 691-695 (2014).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Stone, B. J., et al. A nonsurgical embryo transfer technique for fresh and cultured blastocysts in rats. Journal of the American Association for Laboratory Animal Science. 59 (5), 488-495 (2020).
- Steele, K. H., et al. Nonsurgical embryo transfer device compared with surgery for embryo transfer in mice. Journal of the American Association for Laboratory Animal Science. 52 (1), 17-21 (2013).
- Terkel, J., Witcher, J. A., Adler, N. T. Evidence for "memory" of cervical stimulation for the promotion of pregnancy in rats. Hormones and Behavior. 24 (1), 40-49 (1990).
- Kaneko, T., Endo, M., Tsunoda, S., Nakagawa, Y., Abe, H. Simple induction of pseudopregnancy by artificial stimulation using a sonic vibration in rats. Scientific Reports. 10 (1), 2729(2020).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Cora, M. C., Kooistra, L., Travlos, G. Vaginal cytology of the laboratory rat and mouse: Review and criteria for the staging of the estrous cycle using stained vaginal smears. Toxicologic Pathology. 43 (6), 776-793 (2015).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. Journal of the American Association for Laboratory Animal Science. 50 (4), 471-478 (2011).
- Gates, A. H. Viability and developmental capacity of eggs from immature mice treated with gonadotrophins. Nature. 177 (4512), 754-755 (1956).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen & Co., Ltd. London, UK. (1959).
- Hasegawa, A., et al. Efficient and scheduled production of pseudopregnant female mice for embryo transfer by estrous cycle synchronization. Journal of Reproduction and Development. 63 (6), 539-545 (2017).
- Beaumont, H. M., Smith, A. F. Embryonic mortality during the pre- and post-implantation periods of pregnancy in mature mice after superovulation. Journal of Reproduction and Fertility. 45 (3), 437-448 (1975).
- Champlin, A. K., Dorr, D. L., Gates, A. H. Determining the stage of the estrous cycle in the mouse by the appearance of the vagina. Biology of Reproduction. 8 (4), 491-494 (1973).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。