Method Article
非外科的胚移植または人工授精の前に精管切除された雄を必要とせずに雌マウスに偽妊娠を誘導する
要約
提示された子宮頸部操作方法は、精管切除された雄と雌を繁殖させる必要なしに、マウスにおいて偽妊娠を誘発することができる。偽妊娠の誘導は、非外科的胚移植および非外科的人工授精の成功に必要であり、どちらも提示されている。
要約
胚移植または人工授精で妊娠を正常に維持するためには、雌レシピエントマウスを偽妊娠状態に誘導する必要があります。雌マウスは伝統的に精管切除された雄と一晩ペアになり、翌朝、交尾プラグの存在が評価されます。偽妊娠雌の作製効率を高めるために、マウスにおける非外科的胚移植または人工授精技術と組み合わせて使用される子宮頸部操作技術が標準化されている。小さなプラスチック棒の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーとの接触によって30秒間振動させます。手順は迅速で、麻酔や鎮痛を必要としません。この技術は、偽妊娠の女性を生産する信頼性と予測可能性を高め、精管切除された男性の必要性を完全に排除します。CD1マウスの場合、子宮頸部操作を用いた偽妊娠誘導の効率は、発情期の雌では83%(N = 76)でしたが、発情期の雌の38%のみが精管切除された雄(N = 24)によって塞がれていました。CD1マウスの人工授精は、ホルモンとの発情同期、子宮頸部操作、および精子の子宮移植によって行われました。子宮頸管操作を受けた人工授精レシピエント(N = 76)の妊娠率は72%、平均同腹児数は8.3匹でした。この方法は、非外科的胚移植用の偽妊娠雌を作製するためにも使用することができる。したがって、子宮頸部操作による偽妊娠の誘発は、非外科的生殖補助技術を実行するときに精管切除された男性と交尾するよりも便利で効率的な代替手段です。子宮頸部マニピュレーションを使用すると、必要な動物の数を減らし、外科的に変更された男性の必要性を排除することにより、生殖補助医療に3R(置換、縮小、および改良)の利点が提供されます。
概要
生殖補助医療は、遺伝子組み換えマウスモデルの作製、凍結保存からの菌株の回収、健康状態が損なわれた菌株の再誘導、年齢を一致させたコホートの産生を含む戦略的なビバリウム管理に使用されます。マウスにおけるすべての生殖補助医療は、胚発生のために偽妊娠の女性レシピエントの使用を必要とする。歴史的に、偽妊娠レシピエントは、外科的精管切除または遺伝的に不妊のいずれかである不妊の男性と交尾することによって生成され、交尾プラグの存在は翌朝評価されます1。最近、マウスにおける音波刺激のためのプロトコルが、前核または二細胞マウス胚の外科的移植のために開発された2。また、人工授精や胚盤胞の非外科的胚移植に使用するための子宮頸管操作(CM)プロトコルも開発しました。この手順を使用する理論的根拠は、必要な動物の数を3R削減し(雄マウスを必要としなくなった)、使用される技術を改良すること(雄マウスの外科的精管切除術手順をもはや必要としない)を提供することです。このプロトコルの説明には、CMを通常のワークフローに統合するのに役立つ関連する生殖補助医療が含まれています。CM法の全体的な目標は、人工授精や胚移植などの生殖補助医療のための偽妊娠雌の生成における雄マウスの使用を置き換えることです。
ここで説明するCMプロトコルは、マウスの人工授精を支援するために最初に開発されました。人工授精プロトコルは、最初に説明したように、50%の妊娠率を達成し、平均同腹児数は7匹でした3。CD1レシピエントマウスは、授精前の47時間間隔で、妊娠中の牝馬血清ゴナドトロピン(PMSG)およびヒト絨毛性ゴナドトロピン(hCG)を含む低用量のホルモンと発情同期した。発情同期の利点は、通常の勤務時間中にプロトコルを使用できることでした。人工授精直後に雌を精管切除雄と対にし,交尾プラグの存在により交配を確認した。レシピエントとの交配率の不一致は、手順の難しさとして報告されました。したがって、偽妊娠の誘発のために交配に代わるものが求められました。
本研究は、偽妊娠雌の産生効率を高めるための標準化されたCM技術を提示する。発情期または発情期の女性の場合、小さなプラスチック棒の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーとの接触によって30秒間振動させます。この手順は、ワイヤートップケージで行われます。麻酔や鎮痛は必要ありません。CM技術は、精管切除された男性と交配する必要なしに、非外科的人工授精後に同腹仔を産生することができる偽妊娠雌を産生するのに便利である。CMは、胚移植のレシピエントとしての偽妊娠雌の産生にも使用できます。具体的には、CM技術は、ここで説明するように、非外科的胚移植と組み合わせることができる。非外科的方法は、マウス4,5およびラット6,7における胚盤胞期の胚の胚移植に有効であることが示されている。この非外科的方法は外科的方法に代わる効果的な方法であるため、技術の3Rの改良と見なされます。以前の研究に基づいて、ストレスの尺度としての糞便コルチコステロンレベルは、手順の非外科的性質がげっ歯類のストレスレベルを増加させないことを示しています7,8。この手順は、外科的胚移植よりも技術的に困難が少なく、実行がはるかに高速です。胚が子宮に移されるにつれて、子宮発生のための正しい段階の胚が移されなければならない。マウスの場合、胚盤胞は性交後2.5日(dpc)の偽妊娠レシピエントに移されます。
ここで説明する2つの非外科的手法については、ホルモン投与とCM手法のタイミングが異なる。発情に対するCM処置のタイミングは、偽妊娠レシピエントの生産のための自然な交配に取って代わるので、成功にとって重要である。精管切除された男性が偽妊娠を誘発する必要がなくなるため、この手順は、必要な動物の数を減らし、外科的に変更された男性の必要性を排除することにより、3Rの利点を提供します。手順自体は迅速(30秒)で、麻酔や鎮痛を必要としません。この技術は、生殖補助医療のための偽妊娠雌を作製する際の信頼性と予測可能性を大幅に向上させます。
プロトコル
動物の世話と使用に関して適用されるすべての国際的、国内的、および制度的ガイドラインが守られました。動物を対象とした研究で実施されたすべての手順は、ParaTechs Corporationの施設動物管理および使用委員会の倫理基準に準拠し、米国保健社会福祉省の国立衛生研究所、公衆衛生サービス、実験動物福祉局によって定められた基準に基づいて実施されました。本研究では、>8週齢の雄および雌のCD1(ICR)および雌のC57Bl / 6Jマウスを使用しました。動物は商業的な情報源から入手した( 材料表を参照)。
1. CD1マウスの人工授精に用いる子宮頸部操作法
- 1日目と3日目の雌マウスの同期排卵
- 雌マウスに2.5IU PMSG( 材料の表を参照)を腹腔内注射(IP)で1日目、ビバリウム暗サイクルの開始の0.5時間前に注射します。
注:各男性ドナーは、10人の女性レシピエントに十分な精子を提供します。 - ビバリウム暗サイクルの開始の1時間前の3日目にIP注射によって2.5IU hCG( 材料表を参照)を雌に注射する。
注:注射、精子の移動、および互いの光サイクルのタイミングは非常に重要です。このプロトコルのすべての手順に指定された時間は、12時間の明暗サイクルに基づいています。
- 雌マウスに2.5IU PMSG( 材料の表を参照)を腹腔内注射(IP)で1日目、ビバリウム暗サイクルの開始の0.5時間前に注射します。
- 4日目の新鮮な精子の収集と容量化
- 500 μL滴の精子プレインキュベーション培地(PM、 材料の表を参照)をパラフィンオイル下の60 mm組織培養皿に調製します。男性のドナーごとに1つの料理を準備します。精子採取前に37°Cおよび5%CO2 で少なくとも30分間平衡化する。
- ビバリウムライトサイクルの開始から1時間後に、施設のガイドラインに従って男性を安楽死させます。各男性は10回の人工授精に十分な精子を提供します。
- マウスから精巣上体尾を素早く解剖する。解剖ハサミと歯付き鉗子を使用して、膀胱の上に横方向の腹部切開を行います。
- 精巣脂肪パッドは膀胱の両側にあります。湾曲した鉗子で精巣脂肪パッドの1つをつかみ、体腔から精巣と精巣上体を取り除きます。精巣上体尾を精巣のすぐ下の平らな楕円形の管状構造として識別します。
- 湾曲した鉗子で精巣尾を持ち、小さな角度の付いたはさみを使用して切除します。両方の精巣上体尾を除去し、それらを吸収組織に移して、解剖顕微鏡下で脂肪と血液を除去します。
- 2つの精巣上体尾を37°Cのパラフィンオイル下で平衡化PMの各500μL滴に入れます。小さなハサミを使って6つの切開をして組織を切り取ります。複数の男性ドナーを使用する場合は、精子サンプルごとに各ドナーから1つの精巣上体を使用して、サンプル間のばらつきを減らします。
- 皿をそっと回転させ、精子が3分間組織から出るようにし、1分間に1回旋回させます。すべての組織を取り除きます。
- 精子サンプルを37°Cおよび5%CO2 で45分〜1時間インキュベートして容量化する。
- オプション:精子数を測定し、血球計算盤を使用して顕微鏡下で運動性を評価します。カウントするには、必要に応じて精子をPMで希釈します。
- 細胞学的評価による発情周期同期の確認
- あらかじめ湿らせた小さな綿棒(材料表を参照)を使用して、綿棒を組織に押し付けて膣壁から膣細胞をそっと集め、顕微鏡スライド上で20 μLの滅菌水滴に塗りつけ、風乾します。
- 明視野照明による100倍の倍率を用いた顕微鏡下で、角化上皮細胞の存在を評価します。発情期または発情期後期の女性は、角質化した上皮細胞が存在し、子宮頸部操作のために選択する必要があります。
- オプション:授精前に女性のレシピエントの体重を記録します。
- 頸部マニピュレーション(CM)の実行
- 授精の約0.5時間前に、レシピエントの女性をワイヤーラック付きのケージの上に置き、マウスがケージバーの表面を「つかむ」ことができるようにします。親指と人差し指で尾の付け根近くをつかみ、動物を安定させながら尾を上に傾けます(図1)。
注意: 操作手順が正しく実行されると、マウスは手順の間静止したままになります。マウスの位置がずれた場合は、ゆっくりと位置を変えて続行します。攻撃的な動物がレシピエントとして選択された場合、手順中に動物が濃縮トンネルに足を踏み入れることを許可することは落ち着くことができます。トンネルの使用はオプションですが、この手順中に気を散らすことで、研究者が動物を扱うのに役立ちます。 - 小さなプラスチック棒(材料表を参照)の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーと接触させて30秒間振動させます( 材料表を参照)。
注意: トリマーを開始する前に、ロッドを所定の位置に配置してください。処置中は両方とも片手で保持されます。麻酔や鎮痛は必要ありません。
- 授精の約0.5時間前に、レシピエントの女性をワイヤーラック付きのケージの上に置き、マウスがケージバーの表面を「つかむ」ことができるようにします。親指と人差し指で尾の付け根近くをつかみ、動物を安定させながら尾を上に傾けます(図1)。
- 人工授精のための非外科的精子移植
- 授精装置(材料表を参照)を40μLに設定したP200ピペットに置き、保護カバーを取り外します。
- 容量入り精子サンプルのアリコートを37°C、5%CO2でディッシュから取り出し、37°Cで油を含まない35mm組織培養ディッシュに移します。 精子サンプルはすぐに転送に使用されます。
注:精子はCO2 インキュベーターの外で急速に運動性を失います。容量化された精子サンプルを可能な限り37°Cおよび5%CO2 に保ちます。 - ピペットプランジャーを最初の停止まで押し、カテーテルチップを37°Cで精子サンプルに下げ、精子をゆっくりと移送装置にロードします。塊を避けてください。吸収性組織を使用して、授精装置の外側から残留油を取り除きます。ピペットを脇に置きます。
注:子宮角へのパラフィンオイルの移動は避けなければなりません。吸収性組織を使用して、授精装置の外側から残留油を取り除きます。 - 受信者の女性をワイヤーラックケージの上部に置きます。CMで使用されているのと同じ処理手法を使用して、マウスを所定の位置に保持します。親指と人差し指で尾の付け根近くをつかみ、動物を安定させながら尾を上に傾けます。
- 小さな検鏡( 材料表を参照)を膣に入れます。
- 授精装置カテーテルを検鏡、子宮頸部、子宮に挿入します。デバイスハブが検鏡に接触したら、ピペットプランジャーを最初の停止まで押して精子を分注します。子宮角への余分な空気の移動を避けてください。
注意: カテーテルが正しく配置されていないと、子宮頸部の周囲の組織に当たり、カテーテルが曲がり、最終的には曲がります。最初の試行でカテーテルが子宮頸部を滑らない場合は、カテーテルをそっと戻し、成功するまで再試行します。検鏡の再配置が必要な場合があります。 - デバイスと検鏡を取り外します。処置後のモニタリングは必要ありません。
- オプション:10〜12日目の妊娠チェック
- 体重増加を使用して妊娠状態を判断します。体重増加は緊張に依存しますが、少なくとも1〜2 gの増加は妊娠と相関します。
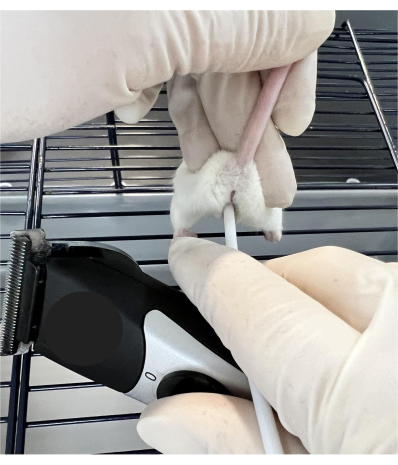
図1:頸部操作のためのマウス保持技術。 マウスはワイヤーケージの上部に置かれ、尾と後ろ足の前部の両側で安定しています。小さなプラスチック棒の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーとの接触によって振動させます。 この図の拡大版を表示するには、ここをクリックしてください。
2. CD1マウスの子宮頸部マニピュレーションに用いる非外科的胚移植法
- 1日目と3日目の雌マウスの同期排卵
- 雌マウスにIP注射により2.5IU PMSGを注射し、ビバリウム光サイクルの開始から約6時間後。
- PMSG注射後47時間間隔またはビバリウム光サイクルの開始後約5時間間隔で、3日目にIP注射によって2.5IU hCGを雌に注射する。
- 細胞学的評価による発情周期の同期の確認
- CMの約1時間前の3日目に、潜在的なレシピエントの細胞診を行います。あらかじめ湿らせた小さな綿棒を使用して、綿棒を組織に押し付けて膣壁から膣細胞をそっと集め、顕微鏡スライド上で20 μLの滅菌水滴に塗りつけ、風乾します。
- 明視野照明による100倍の倍率を用いた顕微鏡下で、角化上皮細胞の存在を評価します。発情期または発情期後期の女性は、角質化した上皮細胞が存在し、子宮頸部操作のために選択する必要があります。
- オプション:潜在的な女性胚レシピエントの体重を記録します。
- CMの実行
- ビバリウムダークサイクルの開始の1時間前の3日目に、レシピエントのメスをワイヤーラック付きのケージの上に置き、動物がケージバーの表面を「つかむ」ことができるようにします。人差し指と親指で尾の付け根付近をつかみ、動物を安定させながら尾を上に傾けます(図1)。
注意: 操作手順が正しく実行されると、マウスは手順の間静止したままになります。マウスの位置がずれた場合は、ゆっくりと位置を変えて続行します。攻撃的な動物がレシピエントとして選択された場合、手順中に動物が濃縮トンネルに足を踏み入れることを許可することは落ち着くことができます。 - 小さなプラスチック棒の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーと接触させて30秒間振動させます。
注意: トリマーを開始する前に、ロッドを所定の位置に配置してください。処置中は両方とも片手で保持されます。麻酔や鎮痛は必要ありません。
- ビバリウムダークサイクルの開始の1時間前の3日目に、レシピエントのメスをワイヤーラック付きのケージの上に置き、動物がケージバーの表面を「つかむ」ことができるようにします。人差し指と親指で尾の付け根付近をつかみ、動物を安定させながら尾を上に傾けます(図1)。
- 6日目の非外科的胚移植
- 20 μLのM2培地( 材料表を参照)を組織培養皿の蓋の上に置きます。
注:蓋は縁が短いため、ドロップ内の胚にアクセスするのに便利です。子宮角に油を導入すると胚移植に悪影響を与えるように見えるため、M2の低下の上にパラフィン油を重ねないでください。 - 顕微鏡下で反射照明を使用して、標準的な胚処理ピペットを使用して、10〜20個の胚盤胞を培地滴にロードします(材料表を参照)。
注:移植する胚の最適な数は、マウスの系統と胚が受けた操作によって異なります。健康な未操作の胚の場合、10〜15個の胚を移植すれば十分です。再誘導または遺伝子組み換え胚の場合、より多くの胚の移植が適切です。 - 非外科的胚移植装置(材料表を参照)を1.8 μLにセットしたP2ピペットに固定します。 保護カテーテルカバーを取り外します。
- ピペットのプランジャーを最初の停止まで押し、カテーテルの先端を培地に下げ、胚をデバイスのカテーテル先端にゆっくりと引き込みます。メディアからチップを取り外します。
注:低倍率で胚を視覚化すると、胚をデバイスに簡単にロードできます。胚が滴の中に散らばっている場合は、皿を左右に静かに振って胚を滴の中央に集中させるか、胚処理ピペットを使用して胚の位置を変えます。 - ピペット容量を2.0μLに設定して、カテーテルの先端に小さな気泡を発生させます。マウスケージの近くに胚をロードした状態でピペットを静かに置きます。
- 受信者の女性をワイヤーラックケージの上部に置きます。CMで使用したのと同じ処理方法を使用して、マウスを所定の位置に保持します。人差し指と親指で尻尾の付け根付近をつかみ、動物を安定させながら尻尾を上に傾けます。
- 小さな検鏡( 材料表を参照)を膣に入れます。
- 移送装置カテーテルを検鏡、子宮頸部、子宮に挿入します。デバイスハブが検鏡に接触したら、ピペットプランジャーを最初の停止まで押して胚を分注します。子宮角への余分な空気の移動を避けてください。
- ピペットプランジャーを離さずに、デバイスと検鏡を取り外します。処置後のモニタリングは必要ありません。
- 20 μLのM2培地( 材料表を参照)を組織培養皿の蓋の上に置きます。
結果
電気9 およびソニック10 頸部刺激がラットの偽妊娠を誘発するために使用されているため、この研究はマウスで使用できる標準化された機械的手順を提示します。膣細胞診は、発情のさまざまな段階にある女性の識別に役立ちます。女性の偽妊娠を確認するために、これと同じ方法が採用されました。まず、雌の細胞診プロファイルを、発情周期全体、妊娠中、および交配またはCMによって誘発された偽妊娠中のCD1およびC57Bl/6マウスについて比較しました。 雌から膣スワブを採取し、パパニコロウ染色システムを使用して染色しました( 材料表を参照)。細胞を明視野照明で100倍の倍率で観察した。観察された細胞には、白血球、有核上皮細胞、および環状角化上皮細胞が含まれていました。発情周期ステージの決定は、各細胞型の相対的な割合に基づいていた11、12。発情は角質化上皮細胞の優勢によって特徴付けられる。発情が終わると、メテストラスが始まり、白血球が現れ始めますが、角質化した上皮細胞はあまり目立たなくなります。発情は中等度から低細胞性を有し、白血球が優勢であり、有核上皮細胞が出現し始めている。発情前期は、白血球の損失、有核上皮細胞の増加、および角質化上皮細胞の出現によって区別されます。発情前期の後、発情が始まり、周期が続きます。
ベースラインプロファイルを作成するために、交尾前に、各雌について少なくとも2回の完全な発情サイクル(CD1でN = 20、C57Bl / 6でN = 20)の膣細胞診が記録されました。サイクルの長さと個々のプロファイルはマウス間で異なりました。ただし、予想される一般的な傾向が観察されました。CD1およびC57Bl/6マウスの発情周期の平均期間は3.8日であり、3〜5日の範囲であった。自然交配が起こる前日、すべての雌マウスは発情期にあった。交尾後、発情サイクルが再開するまで性交(dpc)の1.5日後に細胞診を再度実施した。 図2 は、精管切除された雄と交配した偽妊娠CD1およびC57Bl/6雌の細胞学的プロファイルを示しています。
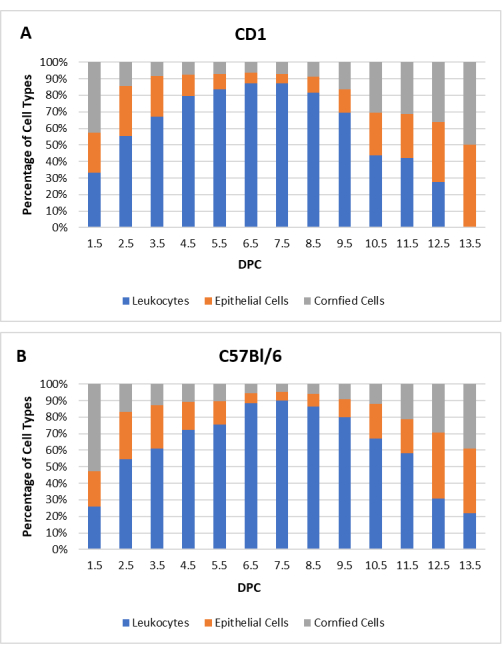
図2:偽妊娠雌マウスの細胞学的プロファイル。 白血球、有核上皮細胞、および角化上皮細胞に対する各細胞タイプの平均パーセンテージは、(A)CD1(N = 20)および(B)C57Bl / 6(N = 20)マウスの性交後日数(DPC)の関数として示されています。 この図の拡大版を表示するには、ここをクリックしてください。
この研究では、偽妊娠雌の産生効率を高めるためにCM手法が標準化されました。発情期または発情期の女性の場合、小さなプラスチック棒の鈍い端を膣に挿入して子宮頸部に接触させ、トリマーとの接触によって30秒間振動させます。この手順は、ワイヤートップケージで行われます。麻酔や鎮痛は必要ありません。CM手順の有効性を決定するために、精管切除された雄と交尾した後およびCM後(合計N = 40)の雌CD1(N = 20)およびC57Bl / 6(N = 20)マウスについて膣細胞診を比較した。CMによって誘発された偽妊娠の細胞学的プロファイルは、 図3に示すように、交配によって誘発された偽妊娠のプロファイルと同様でした。
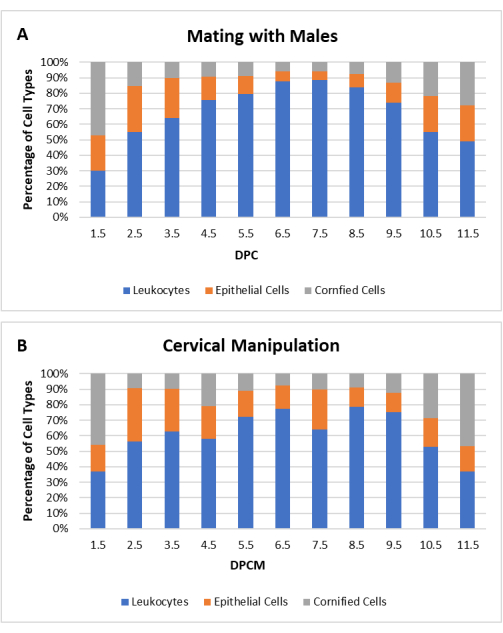
図3:子宮頸部操作(CM)後の偽妊娠雌マウスの細胞学的プロファイル。 白血球、有核上皮細胞、および角化上皮細胞の各細胞タイプの割合は、性交後日数(DPC)または子宮頸部操作後日数(DPCM)の関数として示されます。平均細胞型パーセンテージは、CD1およびC57Bl / 6マウス(N = 40)(A)精管切除された雄と交配した、または(B)CM後について示されています。 この 図の拡大版を表示するには、ここをクリックしてください。
CM技術が生殖補助医療のための妊娠を確立するのに十分であるかどうかを判断するために、CMはCD1女性における非外科的人工授精(NSAI)プロトコルの一部として実施された。人工授精プロトコルには、精子移植前の低用量のホルモンPMSGおよびhCGと女性の発情同期が含まれていました。CMは精子移植の直前に行った。CD1マウスの場合、本手法を用いた発情期の雌(N=76)に対するCMを用いた偽妊娠誘導の効率は83%であった。対照実験では、発情期の女性の38%だけが精管切除された男性によって塞がれていました(N = 24)。子宮頸管操作を受けた人工授精レシピエント(N = 76)の妊娠率は72%で、平均同腹児数は8.3匹でした。したがって、CMによる偽妊娠の誘導は、NSAIを行う際の精管切除された男性との交配に代わる便利で効率的な代替物です。新鮮なCD1胚盤胞の非外科的胚移植のために発情期のCD1レシピエント(N = 4)を調製するためにCMを使用すると、100%の妊娠率がもたらされました。9〜15個の胚の移植により、出生率が45%、平均同腹児数が6匹の健康な同腹仔が3頭生まれました。比較すると、偽妊娠を誘発するために精管切除された男性と交配したCD1レシピエント(N = 20)は、20個の新鮮なB6C3F2胚盤胞の移植後の妊娠率が80%、出生率が46%でした。
過剰排卵のためのホルモン投与の用量やタイミングなどの変数は株依存的であることがわかっているため、生殖補助医療の結果は菌株特異的である可能性があります13。さらに、レシピエントの年齢や体重などの要因がホルモンへの反応に影響を与える可能性があります14。本研究では,人工授精のCM手技を行ったところ,発情後期または発情期の雌のみが反応することがわかった。一般に、集団内で利用可能なレシピエントの数を増やすために、女性は最初に低用量のホルモンと発情同期します3。2.5IUのPMSGおよびhCGとの発情同期は、この研究において、11〜14週齢のCD1雌(N = 27)で78%有効であり、18〜32週齢のC57Bl / 6雌(N = 22)で60%有効であった。CD1雌に対する頸部操作による偽妊娠誘導の効率は,発情期の雌で83%(N = 76)、発情期のC57Bl/6雌で82%(N = 100)であった。
ディスカッション
3Rは、1959年にラッセルとバーチが「人道的実験技術の原則」15で説明したように、研究における動物使用の倫理的枠組みです。3Rは、動物の使用における置換、削減、および改良を表しています。ここで強調されているプロトコルは、3Rに準拠しています。子宮頸部操作技術は、偽妊娠の女性を産むために男性の使用を必要としなくなることによって、必要な動物の数を減らします。この技術はまた、男性に精管切除術を行う必要性を排除し、痛みや苦痛を軽減することで洗練を提供します。ここで説明する生殖補助医療(人工授精と胚移植)は非外科的であるため、どちらも外科的代替手段によって引き起こされる痛みと苦痛を軽減することにより、3Rの洗練を提供します8。
偽妊娠雌の使用は、マウスで生殖補助医療を行う際の子犬の回復に必要です1。CM手順は偽妊娠雌を作製するための効果的な方法であるが、レシピエント雌の発情周期の位相の同期は、プロセスの重要な最初のステップである。発情同期は、潜在的なレシピエントを準備するためにコロニーで必要な雌の数を大幅に減らすことができ、オンデマンドで時限の偽妊娠雌を生産するのに役立ちます。低用量のホルモンを使用しても、CD1マウスの生きた同腹仔の回復に有害な影響はないようです。移植された胚または精子に対して最高品質のレシピエント雌を生み出すホルモンと濃度の組み合わせを見つけるために、他の株に注意を払う必要があります。同期はPMSGとhCG16を使用して達成できますが、過剰排卵の女性を産生する用量は、持続的な妊娠には適切ではない可能性があります17。
女性が発情しているかどうかを判断するために、この研究で細胞学的評価が行われました。発情期は、膣口11、18の観察によっても評価することができる。この方法は非常に有用であり、単独でまたは確認として使用できますが、細胞診の使用よりも主観的です。染色なしの膣細胞診は、角化した上皮細胞を容易に同定できるため、発情期の雌を選択するのに迅速かつ効果的です。このプロトコルでは、潜在的なレシピエントを決定するために、CMの前に細胞学的評価が行われます。CMの前に細胞診を行うことが重要です, 手順では膣領域から脱落した細胞を断片化する傾向があるため, したがって、識別を困難にします.偽妊娠または妊娠の細胞学的評価は、CM(dpcm)後3.5〜11.5日で3日間連続して実施することができる。発情期のサイクリング女性のプロファイルは、角質化上皮細胞のかなりの浸潤を伴う少なくとも1日を有するべきである。偽妊娠/妊娠中の女性は、発情プロファイル(主に細胞数が少ない可能性のある白血球)を3日間連続して表示する必要があります。.
CM技術の開発を通じて、一部のマウスは他のマウスよりもこの手順を受け入れやすいことがわかりました。CD1雌マウスは、その穏やかな性質と優れた育成本能のために優れた候補です。この菌株は取り扱いが容易で、CMおよび非外科的生殖補助医療技術中に良好に機能します。C57Bl/6マウスは、より攻撃的で育成が少ない傾向があります。このプロトコルは、CMを使用して偽妊娠C57Bl / 6女性を効果的に生成しましたが、手順に一貫して寛容である可能性は低かった。これは、CM中の発情期といくらか相関しているようでした。 発情期または発情期の女性はより受容的でした。動物が入るための濃縮チューブの使用は、処置のための膣へのアクセスを可能にし、そして女性を落ち着かせるのを助けた。手順自体は女性を完全に拘束していないので、動物はいつでも引き離すことができます。これが発生した場合、動物の位置を変えることができ、その後手順を続けることができます。女性が立ち去ると処置のタイミングは止まり、処置が再開されたときに再開する。手技の成功に重要なのは、発情周期の段階(発情後期および発情期)および桿体と子宮頸部との接触である。トリマーの振動は標準化されたCMを提供します。子宮頸部との接触を確実にするために、ロッドに穏やかな圧力が加えられ、ロッドの小さな前後の動きで子宮頸部に対するロッドの位置が保証されます。
CMの使用は、発情周期の正しい段階にある女性を精子移植の前に選択することができ、プロトコルが精管切除された男性との交配を条件としなくなったため、NSAIプロトコルを改善しました。人工授精の発情周期の同期は、卵母細胞の成熟が4日目の朝の精子移植に対応するようにタイミングが調整されます。プロトコルの成功に重要なのは、受精が起こるように排卵のタイミングを適応させることです。 体外 受精に使用されるタイミングについて示唆されているように、予想される精子移植の15〜17時間前にhCGを投与するように注意する必要があります1。精子サンプルの品質は、人工授精の結果に直接影響します。容量化された新鮮な精子は最高のパフォーマンスを発揮します。良質の凍結保存された精子は、 生体内で受精胚を生成することができます。ただし、子宮角に移された残留凍結保護剤は着床を阻害する可能性があるため、解凍した精子の直接移動には注意が必要です(未発表の観察)。
胚移植と組み合わせたCMの使用は、概念的には簡単な適応です。発情周期の同期により、受信者プールの生成に必要な女性の数が減少します。CMの前に発情期を決定すると、偽妊娠レシピエントを獲得する可能性が高まります。この方法の1つの欠点は、胚移植時のレシピエントの細胞診が流動的な段階にあることである。女性が発情期から偽妊娠プロファイルに移行している場合、すべての細胞型が存在し、偽妊娠は細胞診が数日間追跡された場合にのみ明らかになります。CD1およびC57Bl/6マウスの発情期から偽妊娠への移行の成功率>80%から、この方法は胚移植レシピエントに適していると期待されます。予備的な結果は、限られた非外科的胚移植で良好な成功を示しています。一般に、非外科的胚移植の効率は外科的技術4,5の効率に匹敵し、非外科的移植は胚盤胞段階での外科的胚移植に取って代わることができます。初期段階の胚では、胚盤胞期までの胚培養が必要です。しかしながら、外科的移植が好ましい場合、適切な偽妊娠レシピエント2に必要な正しいタイミングにCM技術を適合させることができる。一般に、胚レシピエントは胚よりも1日進んでいません。例えば、胚盤胞はドナーから3.5 dpcで採取され、2.5 dpcレシピエントに移されます。したがって、CMは、レシピエントが胚よりも発達の少ない偽妊娠状態になるように実行する必要があります。
結論として、ここで概説したCM技術は、マウスの他の生殖補助医療技術との統合に優れた有望性を示しています。私たちは、非外科的技術を使用した人工授精と胚移植のための成功したプロトコルを提供してきました。組み合わせて、CM技術は、(1)精管切除された男性の必要性を排除することによる動物数の減少、および(2)外科的技術を非外科的代替手段に置き換えることによる技術の洗練を含む3Rの利点を提供します。
開示事項
バーバラ・ストーンとサラ・スロドルスキーは、米国ケンタッキー州レキシントンのパラテックスコーポレーションに勤務しています。パラテックスは、マウス用mNSETデバイスを製造する独占的ライセンス権を保有しています。ParaTechs Corpは、非外科的胚移植と非外科的人工授精にそれぞれ使用できるmNSETおよびmC&Iデバイスを開発および販売しています。
謝辞
この出版物で報告された研究は、賞番号R43OD020304の国立衛生研究所の研究インフラストラクチャプログラム局長室と、賞番号R44MH122117の国立衛生研究所の国立精神衛生研究所によってサポートされました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Blastocyst stage embryos | |||
| CARD Fertiup Preincubation Medium (PM) | CosmoBio | KYD-002-EX | For sperm capacitation |
| Embryo handling pipette | Cook Medical | K-FPIP-1120-10BS | Flexipet is available in various diameters |
| Embryo handling pipette assembly | Paratechs | 90010 | |
| Female mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| Forceps | Fine Science Tools | 11053-10 | Toothed, for dissection |
| Forceps | Fine Science Tools | 11052-10 | Curved, for dissection |
| Forceps | Fine Science Tools | Dumont #5 | Fine, for dissection |
| Hemocytometer | Fisher Scientific | 267110 | Optional |
| human Chorionic Gonadotropin (hCG) | Prospec | hor-250 | For estrus synchronization |
| Incubator, 37 °C 5% CO2 | Thermo Scientific | ||
| Incubator, 37 °C, benchtop | Cook | K-MINC-1000 | |
| Kimwipes | Kimberly-Clark | 34155 | Absorbant tissues |
| M2 medium | Millipore | MR-015-D | Embryo handling medium |
| Male mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| mC&I device | ParaTechs | 60020 | For sperm transfer, specula included |
| mCM rod | ParaTechs | 90050 | Smooth, blunt, with a diameter @3 mm |
| Microscope | Olympus | SZX7 | 20x and 40x magnification with transmitted and reflected illumination source for embryo work and dissections |
| Microscope | ACCU-SCOPE | 3032 | 100x magnification with bright field illumination |
| Microscope slides | Fisher Scientific | 12-544-7 | |
| mNSET device | ParaTechs | 60010 | For embryo transfer, specula included |
| Needles, 26 G | Exel | 26402 | |
| Papanicolaou Staining System | VWR | 76265-730 | Optional |
| Paraffin oil | Sigma-Aldrich | 18512 | |
| Pipette, P200 | Corning | 4074 | Fits the C&I device for sperm transfer |
| Pipette, PR-2 | Rainin | 17008648 | Fits the NSET device for embryo transfer |
| Pregnant Mare Serum Gonadotropin (PMSG) | Prospec | hor-272 | For estrus synchronization |
| Scale | American Weigh Scales | LB-1000 | |
| Scissors | Fine Science Tools | 14068-12 | Dissection |
| Scissors | Fine Science Tools | 14081-09 | Angled, dissection |
| Swabs, Constix | Contec | SC-4 | For vaginal cytology |
| Syringes, 1 cc | Becton Dickenson and Company | 309659 | |
| Tissue culture dishes, 35 mm | Falcon | 353001 | |
| Tissue culture dishes, 60 mm | Falcon | 353004 | |
| Trimmer | Wahl | ChroMini T-Cut | |
| Wire bar topped mouse cage |
参考文献
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual, fourth edition. , (2014).
- Wake, Y., et al. Successful induction of pseudopregnancy using sonic vibration in mice. Scientific Reports. 13 (1), 3604 (2023).
- Stone, B. J., Steele, K. H., Fath-Goodin, A. A rapid and effective nonsurgical artificial insemination protocol using the NSET device for sperm transfer in mice without anesthesia. Transgenic Research. 24 (4), 775-781 (2015).
- Green, M., Bass, S., Spear, B. A device for the simple and rapid transcervical transfer of mouse embryos eliminates the need for surgery and potential post-operative complications. BioTechniques. 47 (5), 919-924 (2009).
- Bin Ali, R., et al. Improved pregnancy and birth rates with routine application of nonsurgical embryo transfer. Transgenic Research. 23 (4), 691-695 (2014).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Stone, B. J., et al. A nonsurgical embryo transfer technique for fresh and cultured blastocysts in rats. Journal of the American Association for Laboratory Animal Science. 59 (5), 488-495 (2020).
- Steele, K. H., et al. Nonsurgical embryo transfer device compared with surgery for embryo transfer in mice. Journal of the American Association for Laboratory Animal Science. 52 (1), 17-21 (2013).
- Terkel, J., Witcher, J. A., Adler, N. T. Evidence for "memory" of cervical stimulation for the promotion of pregnancy in rats. Hormones and Behavior. 24 (1), 40-49 (1990).
- Kaneko, T., Endo, M., Tsunoda, S., Nakagawa, Y., Abe, H. Simple induction of pseudopregnancy by artificial stimulation using a sonic vibration in rats. Scientific Reports. 10 (1), 2729 (2020).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538 (2012).
- Cora, M. C., Kooistra, L., Travlos, G. Vaginal cytology of the laboratory rat and mouse: Review and criteria for the staging of the estrous cycle using stained vaginal smears. Toxicologic Pathology. 43 (6), 776-793 (2015).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. Journal of the American Association for Laboratory Animal Science. 50 (4), 471-478 (2011).
- Gates, A. H. Viability and developmental capacity of eggs from immature mice treated with gonadotrophins. Nature. 177 (4512), 754-755 (1956).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Hasegawa, A., et al. Efficient and scheduled production of pseudopregnant female mice for embryo transfer by estrous cycle synchronization. Journal of Reproduction and Development. 63 (6), 539-545 (2017).
- Beaumont, H. M., Smith, A. F. Embryonic mortality during the pre- and post-implantation periods of pregnancy in mature mice after superovulation. Journal of Reproduction and Fertility. 45 (3), 437-448 (1975).
- Champlin, A. K., Dorr, D. L., Gates, A. H. Determining the stage of the estrous cycle in the mouse by the appearance of the vagina. Biology of Reproduction. 8 (4), 491-494 (1973).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved