Method Article
微尺度神经元细胞培养装置的双光子聚合3D打印
摘要
微米级的 3D 打印可以快速制作用于神经元细胞培养的聚合物器件的原型设计。作为原理验证,神经元之间的结构连接受到影响神经突生长的屏障和通道的限制,而这种操作的功能后果是通过细胞外电生理学观察到的。
摘要
几十年来,神经元培养物一直是参考实验模型。然而,缺少 3D 细胞排列、神经突生长的空间限制和真实的突触连接。后者限制了在区隔化背景下对结构和功能的研究,并削弱了文化在神经科学中的重要性。近似 于突 触连接的结构化解剖学排列并非微不足道,尽管它是节律、突触可塑性以及最终脑病理生理学出现的关键。在这里,双光子聚合 (2PP) 被用作 3D 打印技术,能够使用聚二甲基硅氧烷 (PDMS) 在微米尺度上快速制造聚合物细胞培养装置。与基于显微光刻的传统复制成型技术相比,2PP微尺度印刷可以快速、经济地完成原型的周转。该协议说明了基于PDMS的微流体装置的设计和制造,旨在培养模块化神经元网络。作为原理验证,提出了一种双腔设备来物理约束连接。具体来说,在 离体 发育过程中不对称的轴突生长受到青睐,并允许从一个腔室引导到另一个腔室。为了探究单向突触相互作用的功能后果,选择商业微电极阵列来监测互连神经元模块的生物电活动。在这里,说明了 1) 以微米精度制造模具和 2) 在大鼠皮质神经元培养物中进行 体外 多位点细胞外记录的方法。通过降低成本和未来2PP 3D打印的广泛可及性,这种方法将在全球研究实验室中变得越来越重要。特别是在神经技术和高通量神经数据记录方面,简化 体外 模型的原型设计的易用性和快速性将提高实验控制和对 体内 大规模神经系统的理论理解。
引言
研究行为生物体的神经元活动面临一些挑战。例如,由于需要保持其完整性,对脑组织的物理访问受到限制,因此更容易考虑大脑的浅表区域。在完整组织中分离特定靶标通常是一项艰巨的任务,有时甚至是不可能的。尽管解离的同质神经元培养物可以方便地获得神经回路中单个(亚)细胞成分的分子、生化和生物物理特性,但完整大脑的现实连接和解剖组织却丢失了。这些基本限制激发了研究工作,以实现中间立场,即避免体内复杂性,同时可以在体外构建结构,这是按需构建的1,2,3,4,5,6,7,8,9 .特别是,模块化神经元培养物在过去几十年中一直是广泛研究的主题,旨在解决下述的大脑生理学关键问题。
组织:体内研究表明,大脑在解剖学上是以精确的细胞类型和投影阵列分层构建的。功能测定揭示了节点组件和模块中神经元网络的组织,具有精确的连接方案10,11。然而,由于涉及的突触数量之多,以及发育和活动依赖性可塑性的交织效应,无法在体内充分研究连接和微电路基序的作用。
信号传输: 在 体内 或随机 体外 培养中,评估信号传递具有挑战性。沿其长度检查轴突传导和动作电位需要通过表面功能化或化学图案引导神经突生长,从而在电活动的细胞外读数中提供高信噪比12。
转化相关性: 破译突触前与突触后元素在病理条件下的独特作用需要单独访问这些元素。具有受限连接的模块化培养物,有效地隔离突触前和突触后元素,是实现这一目标不可或缺的工具13。
有几种方法可以在神经元培养物中获得某种形式的结构。它们可以大致归类为化学和物理表面操作9。前一种方法14,15依赖于神经元细胞附着在某些(生物)化合物上的倾向。这需要以微观精度在表面上沉积粘合剂或有吸引力的分子,并遵循详细的图案。虽然这允许部分覆盖细胞表面,但遵循所需的模式,化学方法本质上是有限的,并且在神经突生长指导方面的成功率相对较低16。完全控制轴突方向性需要建立临时化学物质的空间梯度来塑造轴突引导17.后一种方法涉及物理表面操作,更常用于体外构建神经元网络。神经元细胞通过几何限制(如微观腔室、壁、通道等)在所需位置受到物理约束,形成生物相容性聚合物,如聚二甲基硅氧烷 (PDMS)3、5、6、7、18、19、20 固化并固化成微流控装置。PDMS微流控制造的实际方法是软光刻21,其中二维掩模在微尺度上图案化,并用于在紫外线照射下选择性地蚀刻硅基材料。简而言之,紫外线固化树脂(即光刻胶)通过旋涂覆覆在硅晶圆上,达到由其粘度和旋转速度决定的特定高度。然后,将图案掩模放置在光刻胶上并暴露在紫外线下。掩模内的透明区域,对应于感兴趣的区域,将使紫外光诱导光刻胶分子的局部交联。使用溶剂洗掉未曝光的光刻胶区域,从而形成母模。这被反复用于烘烤所选的弹性体(即PDMS),然后根据需要在任意数量的复制品中雕刻出所需的几何形状。这种制造方法是制造微流控器件的最常用方法22。也许软光刻的主要局限性是大量资本投资的先决条件,以及生物实验室对所需技术和专业知识的不熟悉。掩模的制备和设计复杂的多高高纵横比几何形状所需的软光刻步骤是非同小可无的23,并且通常需要外包。尽管已经提出了替代和低预算的方法,但它们并不总是满足生物原型设计的高精度要求24。
本文介绍了一种基于双光子聚合(2PP)和增材制造的替代制造方法。它很简单,本身不需要先进的微纳加工和显微光刻专业知识。2PP微制造的研究领域出现在90年代后期25,从那时起,它见证了指数级增长26。有关该技术基本原理的更多信息,请参见其他部分26.简而言之,通过将激发光脉冲聚焦在三维空间中,2PP利用了多光子吸收对强度的非线性依赖性。这赋予了密闭吸收的能力,确保在非常局部的区域内进行精确和选择性的激发。从本质上讲,负色调光刻胶是一种在光照下溶解度降低的材料,在低占空比27下受到飞秒激光脉冲的聚焦束。这允许在低平均功率下产生高强度的脉冲,从而在不损害材料的情况下实现聚合。光诱导的自由基单体的相互作用产生自由基低聚物,引发聚合,该聚合在整个光刻胶中延伸至不同的体积,即体素,其大小取决于激光脉冲的强度和持续时间28。
在这项工作中,提出了两个组成部分:A)3D打印模具的设计和快速制造,可多次重复使用以生产一次性聚合物神经元细胞培养装置(图1),以及B)它们的机械耦合到平面神经元细胞培养基质的表面,甚至是能够多位点记录生物电信号的基质集成微电极阵列。
这里非常简要地描述了 3D 机械模型的计算机辅助设计,并详细介绍了导致 3D 打印模具和制造 PDMS 设备的步骤。
各种计算机辅助设计软件应用程序可用于生成起始 3D 对象模型并生成 STL 文件以控制 2PP 打印过程。在 材料表中,列出的第一个和最后一个应用程序是免费的或提供免费许可证。构建 3D 模型始终需要创建 2D 草图,然后在后续建模步骤中将其拉伸。为了演示这一概念,协议部分突出显示了通用的 3D CAD 软件设计过程,从而形成了一个由重叠立方体组成的结构。如需更全面的信息,可以使用许多在线教程和免费培训资源,如 材料表所示。
然后将生成的STL文件转换为一系列命令,由3D打印机执行(即切片程序)。对于正在使用的特定 2PP 3D 打印机,DeScribe 软件用于导入 STL 文件并将其转换为专有的通用书写语言 (GWL) 格式。2PP印刷工艺的成功取决于各种参数,特别是激光功率及其扫描速度、拼接和影线切片距离。这些参数的选择,以及物镜和光刻胶的选择,取决于设计的最小特征以及预期的应用。因此,参数优化对于满足不同设计场景和用例的要求至关重要。对于这项工作,推荐的配方 IP-S 25x ITO Shell (3D MF) 已被视为打印参数的配置。最终,以必要的分辨率打印出机械稳定的打印部件,同时最大限度地减少其 3D 打印时间。
本工作中演示的模具设计和相关的STL文件包括一个方形框架,用于将细胞培养物的空间隔离在两个隔间中:外部区域(即,随后称为源)和内部区域(即,随后称为靶标)。这两个隔室通过一组微通道连接,每个微通道都具有锐角边界,旨在专门阻碍神经突从靶向源的生长,但反之亦然,因此促进在两个区域生长的神经元之间的定向突触连接。
早期的研究采用了不同几何形状的微通道来促进神经突的定向生长。示例包括三角形18、通道倒钩结构19和锥形通道20。在这里,采用了一种横跨微通道边界的尖角屏障的设计,其特征也是不对称的入口。这些微通道用于在封闭的内部(目标隔间)和外部区域(源隔间)之间建立连续性。从源侧来看,微通道初始部分的漏斗形状旨在促进轴突束的形成及其沿连接源和靶标的最短路径(即直线)生长。通过面对锐角实现的三角形空间在目标侧具有较大的体积,旨在有效延迟神经突的寻路,同时有利于源头的束的快速射击和对可用空间的占用。微通道长度选择540μm可有效过滤掉通常较短的树枝状生长物39。此外,它们 5 μm 的高度可防止细胞胞体穿透微通道。总体而言,这种配置被证明可以促进外部、源和内部目标模块之间的单向连接,这里将其作为众多替代选择中的原理验证。
虽然由2PP模具制造的PDMS器件可以附着在常见细胞培养基质的表面,如玻璃盖玻片或培养皿,但在这项工作中,使用了市售的基质集成微电极阵列。没有努力优化微电极阵列布局的 3D 设计,机械耦合是在立体显微镜引导下进行的,旨在将器件定位在阵列上,在源和目标两侧留下一些微电极。这样可以初步评估神经元细胞培养物中受限连接的功能后果。
研究方案
所有涉及动物处理的程序均按照欧洲和意大利法律(2010 年 9 月 22 日欧洲议会和理事会指令 [2010/63/EU];2014 年 3 月 4 日意大利政府法令,第 26 号),由国际高等研究机构 OpBA(动物护理委员会)明确批准,并得到意大利卫生部的正式授权(授权第 22 号。N.UVD)。这些导致来自外植大鼠脑组织的无感知材料的可用性,用于对本工作中提出的方法进行实验验证。
1. 3D双光子聚合制模
- 生成 CAD 文件
注意:以下步骤演示了使用计算机辅助设计软件(即 SolidWorks)的通用 3D 设计工作流程。本作品中描述的示例STL设计文件(图2)可作为 补充编码文件1获得,也可以通过Zenodo(https://doi.org/10.5281/zenodo.8222110)获得。- 启动计算机辅助设计软件桌面应用程序。从顶部菜单栏中,选择 新建。
- 从选项中,选择 "零件:单个设计元件的 3D 表示"。按组合键 Ctrl + 5 建立草图的顶视图。
- 从侧面板中,选择 "草绘 ",然后选择 "角矩形"。通过单击矩形选择矩形的一条边。当出现参数面板时,将长度设置为 100 个单位。
- 对垂直于上一条边的边重复步骤 1.1.3:将其长度设置为 50 个单位。通过在按住鼠标左键的同时拖动矩形来选择矩形。
- 从 "添加关系 "菜单中,选择 "修复"以约束线之间的关系。
- 退出草图并重复步骤 1.1.3 至 1.1.5,创建一个新的(较小的)矩形,与上一个草图重叠。
- 从侧面板中,选择 "特征"(Features),然后选择" 拉伸凸台/底座"(Extruded Boss/Base):将大矩形和小矩形的深度分别设置为 5 和 10 单位。
- 从 "文件 "菜单中,将零件保存为 STL 格式(即标准曲面细分语言)。
- 处理 CAD 文件
- 将 STL 文件传输到配备 DeScribe 应用程序软件的个人计算机。
- 启动 "描述 ",然后从其"文件"菜单中打开 STL 文件。将显示模型的 3D 表示。
- 从右侧菜单的方向部分,旋转模型以使其在空间中适当定位,并将其在平面中居中。
- 通过选择右侧菜单的 "缩放 "部分来调整整体缩放比例。
- 从顶部的下拉菜单中,选择 IP-S 25x ITO Shell (3D MF) 配方。这指定 IP-S 为光刻胶,25 倍为物镜的放大倍率,氧化铟锡 (ITO) 涂层基板作为打印基材,外壳和脚手架打印作为具有中等尺寸特征 (MF) 的操作模式。
- 在向导中导航,选择壳和脚手架的 切片距离 为 1 μm,剖 面线距离 为 0.5 μm,并将其设置为 0.5 μm。
- 在导入向导的输出步骤中,在拆分下,将块大小定义为 X = 200 μm、Y = 200 μm 和 Z = 265 μm,块偏移量为 X = 133 μm、Y = 133 μm 和 Z = 0,确保微通道的精细结构不受拼接线的影响。
- 在扫描模式下,使用默认值:Galvo 表示 X-Y 平面,压电表示 Z 轴。
- 按 保存 ,然后在下一个文本菜单中,将 var $baseLaserPower = $shellLaserPower 替换为 var $baseLaserPower = 75,以将打印最底层的激光功率降低到 75%。
- 将通过上述步骤获得的GWL文件传输到专用于2PP 3D打印的工作站。
- 3D打印和样品开发
- 启动 NanoWrite 应用软件。打印机初始化后,单击软件界面上的 Exchange Holder ,插入承印板支架并安装物镜。
- 将 25 倍物镜安装在物镜转换器上的适当位置。通过设置用于测量电阻的电子万用表确定玻璃基板的哪一侧涂有 ITO:读数应为低值,例如 100-300 Ω,但仅适用于涂有 ITO 的一侧。
- 将玻璃基板放在支架上,将 ITO 涂层的一面朝上。使用胶带将其牢固地固定到位。
- 在化学通风橱下,在玻璃基板的中心涂上一滴 IP-S 光刻胶。
- 将支架插入 3D 打印机,树脂液滴朝向物镜(即向下)。
- 通过软件 文件 菜单,加载 GWL 文件。选择 "进近样品"(Approach Sample),将物镜移近树脂液滴。
- 选择 "查找界面"(Find Interface ) 以允许根据两种材料的折射率差异检测 ITO 光刻胶打印界面。
- 选择 "开始作业" 以启动打印。打印完成后,按 Exchange Holder 取回支架。
- 取回支架并轻轻取下带有打印部件的承印物。将玻璃基板浸入丙二醇乙酸甲醚(PGMEA)中,在通风橱下浸泡20分钟,以显影印刷部件。
- 从PGMEA中取出底物,并将其浸没在异丙醇中5分钟。让打印部件在化学通风橱下风干。
- 印后处理和模具安装
- 通过暴露在紫外线(即 365-405 nm)下固化打印部件,并具有足够的功率 5-20 分钟(有关功率详细信息,请参阅 讨论 )。
- 在层流罩下,轻轻地从玻璃基板上取下打印部件。将 ~2 μL 树脂滴入 35 mm x 10 mm 培养皿的底部。
- 小心地将打印部件放在液滴上,让树脂在部件下方流动。通过暴露在紫外线下进一步固化打印部件,持续5分钟。
- 盖上培养皿的盖子,并将其转移到烘箱中热固化,在80°C下超过30分钟。 请勿预热烘箱,以免打印部件变形或断裂。固化后,打印部分将永久附着在培养皿的底部。从现在开始,打印和安装的部分将被称为模具。
2. 从模具和细胞培养基质制造PDMS器件
- PDMS器件制造
- 制备20 mL 10:1(重量比)的基和未聚合PDMS固化剂 的混合物。对于每个设备,根据其所需的高度,1-2 mL PDMS 混合物就足够了。将过量的未聚合PDMS储存在-20°C以备后用。
- 在层流罩下,彻底搅拌混合物 4 分钟。当混合物均匀地捕获气泡时,它会变得不透明。
- 将混合物转移到 50 μL μ 管中,并以 168 x g 离心 5 分钟,以消除混合物中的气泡并获得清晰的外观。
- 用 10 μL 疏水剂(即排斥硅烷 ES)处理模具并静置 7 分钟,确保聚合的 PDMS 稍后从模具中顺利分离。
- 用 70% 乙醇冲洗模具 1 次,用去离子 (DI) 水冲洗 2 次。让模具在层流罩下风干。
- 轻轻地将PDMS混合物倒在模具上,直到达到设备的预期最终高度。为防止气泡的形成,请将混合物轻轻倒入模具表面。
- 盖上模具并将其转移到已预热并在80°C下稳定的烤箱中18分钟,进行固化。对于高度超过 5 毫米且不超过 1 厘米的设备,将固化时间从 18 分钟延长到 25 分钟。
- 在层流罩下,轻轻地将固化的PDMS块从模具上取下,并将其浸没在玻璃培养皿中的异丙醇中至少10分钟。异丙醇消除了未交联的PDMS。始终保持 PDMS 块被覆盖。
- 更新异丙醇,并在立体显微镜下,用眼科刺刀小心地切出装置的中心方形部分(在本作品中确定为目标区域)。然后,继续沿边缘进一步切割,以实现设备的最终形状。
- 从异丙醇中取出装置并将其浸没在乙醇中30分钟,然后用无菌去离子水冲洗3次。从现在开始保持无菌状态。
- 在层流罩下,将设备转移到新的培养皿中,使其盖子略微打开。让它完全风干。
- 设备安装和细胞培养底物制备。
- 通过浸泡在70%乙醇中30分钟对每个微电极阵列(MEA)进行灭菌,然后用无菌去离子水冲洗3次。
- 使用无菌细镊子,在层流罩和立体显微镜下,将PDMS设备安装到MEA的内部区域。将PDMS器件的一侧对准内部MEA区域的中心,具有基板集成的微电极,因此从源和目标区域都很少暴露微电极(见 图2)。
注意:对于这项工作,没有必要将MEA微电极与PDMS设备微通道对齐。可能需要轻轻推动设备,以实现PDMS设备和MEA表面之间的紧密密封。不惜一切代价避免用镊子的尖端接触微电极。 - 将带有PDMS装置的MEA插入等离子清洗室,以通过空气等离子体激活表面活化。从腔室的 4 分钟真空泵抽真空开始该过程。接下来,轻轻打开空气阀以控制空气排出。关闭空气阀并打开等离子体诱导器,在 10 W 和 18 W 之间调节射频功率电平。
- 一旦出现发光灯,让该过程运行 80 秒。然后,关闭等离子诱导器,关闭真空泵阀,轻轻打开空气阀。打开腔室取回 MEA。
注意:如果等离子体处理涉及将 MEA 暴露于非无菌环境中,请将每个 MEA 置于层流罩中的紫外光下 30 分钟,以确保无菌。 - 向 MEA 中加入 1 mL 聚乙烯亚胺 (PEI) 0.1% wt/vol 溶液,并在 37 °C 下孵育过夜。吸入PEI溶液并用无菌去离子水冲洗5次。向 MEA 中加入 1 mL 细胞培养基,并在细胞接种前孵育。
3. 神经元细胞培养和电生理学
- 预先准备解剖培养基,消解溶液和溶液1-3(见 表1)。
- 解离的神经元细胞培养物。
- 用鼻子轻轻抓住0-1天龄的新生Wistar大鼠幼崽,并用锋利的剪刀进行快速斩首。
- 剥下头皮皮肤,用细剪刀沿着颅骨的矢状中线做一个切口,然后在小脑交界处的颅骨上做一个冠状切口。
- 取出头骨,用细刮刀挖出大脑并将其转移到冷(4°C)解剖培养基中。
- 切除皮质下组织、海马体和脑膜。将组织切碎成小块(即 1-2 mm3),然后将它们转移到 15 mL 管中。弃去溶液,用新鲜的解剖培养基冲洗组织,然后用消化培养基洗涤。
- 弃去消解培养基,然后加入 1 mL 溶液 1。将混合物在37°C孵育5分钟。弃去溶液1,用新鲜的解剖培养基冲洗组织。然后加入1mL溶液2,并将混合物在4°C下保持10分钟。
- 弃去溶液2,用新鲜的解剖培养基冲洗组织。然后加入 1 mL 溶液 3。通过缓慢地上下移液20至30次来机械解离细胞。当出现均匀浑浊的解离细胞混合物时,通过加入解剖培养基将其体积增加到 3 mL。
- 通过将混合物以100× g 离心5分钟来收集细胞沉淀。吸出上清液并将细胞沉淀重悬于 1 mL 预热培养基中。
- 对细胞进行计数(即通过细胞计数室)并相应地调整细胞接种溶液的密度。
- 用标称细胞密度为 1.8 x 106 (~ 6500 个细胞/mm2) 的 1 mL 接种溶液接种每个 MEA。将接种的MEA在37°C和5%CO2的潮湿培养箱中孵育。每 2 天用新鲜(即每周制作)培养基交换培养基。
- 细胞外电生理学
注意:解离的神经元细胞培养物 在体外2-3周后达到完全成熟的电表型。以下各节描述了一种细胞外刺激方案,该方案使用商业MEA应用软件(Experimenter)对在模块(即源或靶标)中培养的任何一个神经元群体进行电刺激,同时在成熟网络中记录两个群体的活动。- 轻轻地将一个MEA安装在多通道电子放大器的头部,在干燥的培养箱(37°C,5%CO2)内,并使其容纳10分钟。定制的PDMS盖可以单独制造,并用作每个MEA的紧密覆盖物,以减少水分蒸发并保持无菌。
- 启动 Experimenter 软件。将采样率设置为25 kHz,然后按 开始DAQ开始数据采集。在"数据显示"面板中,将显示每个通道的细胞外记录活动的原始痕迹。
- 监控自发活动,并直观地识别和选择 3 对相邻的微电极,这些微电极在全网自发同步活动突发期间处于活动状态,无论是来自源侧还是目标侧微电极。
- 在软件的刺激器面板中,以双极配置每个刺激微电极对配置参数:选择双相脉冲波形并将峰值幅度设置为 ± 800 mV,将脉冲持续时间设置为 200 μs。
- 设置记录器并记录刺激前 300 毫秒至刺激后 1000 毫秒的时间。
- 以交错方式对源端和目标端重复步骤 3.3.3 至 3.3.5,以获得所需的重复次数。
结果
本文报道了一种 2 室聚合物(神经元)细胞培养装置的制造,举例说明了使用 2PP 3D 打印对 PDMS 装置进行快速原型设计。具体来说,为具有单向突触连接的模块化神经元网络生产了一种器件,其功能表征从多位点细胞外电生理学的角度呈现。简而言之,使用市售的 3D 打印机通过直接激光书写实现了微米级模具。特别是,该打印机通过中心波长为 780 nm、持续时间为 80 至 100 fs 的激光脉冲提供 50 mW 的功率。在制造过程中,激光束通过打印机的物镜(25x,NA=0.8)聚焦到负色调光刻胶(IP-S)上,使用振镜扫描仪扫描x轴和y轴,以及压电平台扫描z轴。将打印体积适当地分成 200 mm x 200 mm x 265 mm 的块,以实现整体尺寸为 6500 mm x 6500 mm x 545 mm、标称体积为 12.423 mL 的模具。 图2A 表示模具的2D草图,突出显示了其尺寸和特征尺寸,而 图2B 显示了安装在MEA上的成品设备的特写照片。如上一节所述制备的模具经久耐用,可以重复使用50次以上来制造PDMS器件。
打印模具用于铸造PDMS器件,然后将其安装在微电极阵列(MEA)的玻璃基板集成阵列的内部区域,用于神经元电活动的多位点细胞外记录并作为原理验证。商业底物整合的 MEA 用于监测模块化培养物的活性,以响应由位于每个培养室中的微电极子集在细胞外传递的空间局部电刺激。每个 MEA 包含 120 个直径为 30 μm 的硝酸钛 (TiN) 微电极,电极间距为 100 μm。图2C-D显示了PDMS器件在MEA顶部的位置。设备各个微通道的几何特征以及图2C所示的腔室的整体占地面积导致培养神经元的区隔化。这些可以根据它们所属的隔间、设备的外部区域(源)或设备的内部区域(目标)来区分。首选的轴突引导,从源到靶,由微通道的锐角边缘决定。图2D显示了聚合物装置在MEA上的位置,以及位于源或目标隔间内的记录电极的相对覆盖区域。请注意,我们的案例研究既不需要将设备的微通道内部精确对准到一排或多排 MEA 微电极,也不需要这样做。
图3提供了不对称神经突生长的代表性证据,在离体发育过程中,在活体成像中,细胞接种后6天(图3A)和2天(图3B-D)显示荧光标记的神经突。当设备目标侧的神经突遇到锐角障碍物作为阻碍它们在空间中前进的障碍物时,来自源侧的神经突不间断地生长并穿过通道。这种不对称性有利于两个隔间中神经元之间的单向轴突连接,从源投影到靶标,正如设计中明确预期的那样。这一结果得到了对两个隔室中每个隔室中交替传递的刺激引起的电反应的(功能性)电生理学评估的进一步支持。
在体外3-4周后,随着神经元网络达到完全成熟29,30,在传递短暂的电刺激和监测它们引起的神经元反应时,可以探测两个隔室之间的功能连接31。然后交替地将振幅为 800 mV 的双相电脉冲仅施加到源或仅施加到目标群体(N 重复 = 150,N 个模块化培养物 = 6),由 3 对并列的平面微电极以双极配置和交错方式传递。因此,这 3 对电极可以位于 MEA 的源区域内或 MEA 的目标区域内。然后,在传播延迟后,所有MEA微电极都可以检测到每个刺激引起的电响应。以 25 kHz/通道的采样率进行记录,并以 16 位的模数转换分辨率对生成的细胞外原始电信号进行数字化。离线使用阈值交叉峰值检测算法32来检测细胞外动作电位的发生时间,而无需进行任何尖峰分选。图4A-B清楚地揭示了诱发反应的强烈不对称性,根据刺激传递的位置重复150次,表明几何约束对连接的首选方向性具有显着的功能影响。事实上,在刺激源侧时,源神经元群的放电速率(通过计算刺激周围尖峰时间直方图估计)如预期的那样增加,产生完整的动作电位网络爆发 33,31,34,随后,在延迟后,目标群的放电速率增加。然而,由于刺激是在目标人群中传递的,只有目标人群的发射率增加,而源人群大多保持沉默。图4C-D在对照培养物中重复相同的刺激/反应范式,不存在聚合物装置(即非结构化神经元培养物),细胞外刺激也重复了4次。对于这样的控制条件,任一刺激引起的反应都没有发生不对称。虽然用于传递刺激的MEA微电极子集与模块化网络中使用的微电极相匹配,但刺激传递的位置导致了整个人群的类似诱发反应。这证实了PDMS设备有利于跨两个隔间的单向突触连接。总体而言,在模块化培养物中诱发的不对称反应(N = 6)和对照培养物中诱发的对称反应(N = 4)强烈表明区室化体外系统的解剖学连接受到限制。用于生成图4的电生理数据和脚本可通过Zenodo(https://doi.org/10.5281/zenodo.8220990)获得。
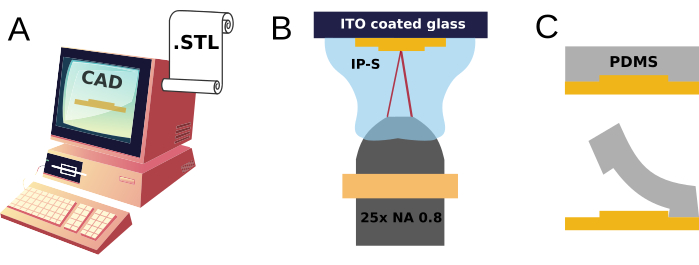
图1:2PP微模具制造和PDMS复制成型的草图。(A) 在 CAD 中设计 3D 模型并以标准曲面细分语言 (STL) 格式文件导出, (B) 通过一滴树脂 (IP-S) 中的激光诱导聚合来指示其 2 光子 3D 打印。 (C) 将所得结构用作重复制造PDMS复制品的模具。 请点击这里查看此图的较大版本.
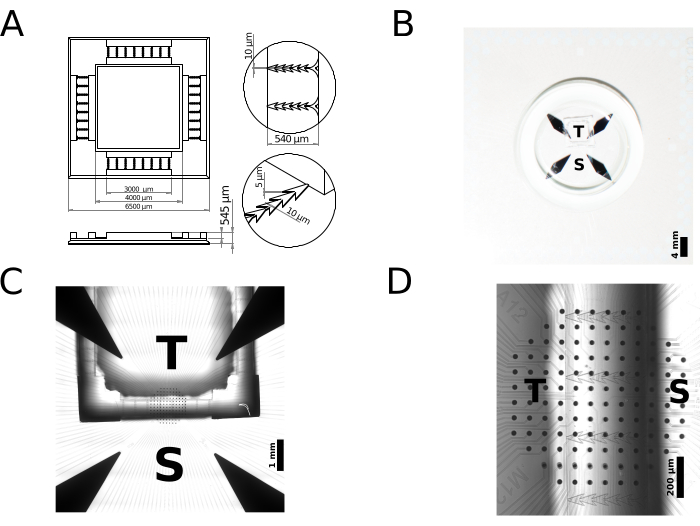
图 2:聚合物(神经元)细胞培养 PDMS 设备的内部快速原型设计示例。(A) 在不到 24 小时的时间内,微规模增材制造允许从 CAD 模型到 3D 打印母版,可以立即重复使用,作为具有生物相容性弹性体(如 PDMS)的复制模具。 (B-C) 由此产生的PDMS器件耦合到神经元细胞培养平面底物上,此处由微电极阵列表示。对于 (A)中的特定样品设计,定义了两个腔室:一个称为源,用S表示,另一个称为靶标,用T 表示。 当 在(C)中的立体显微镜引导下适当排列时,两组基底集成微电极暴露在外,以便可以刺激和记录位于两个隔室中的附近神经元的生物电活动。这里需要注意的是,在单个微通道内对齐微电极并不是本原理验证的优先事项。 请点击这里查看此图的较大版本.
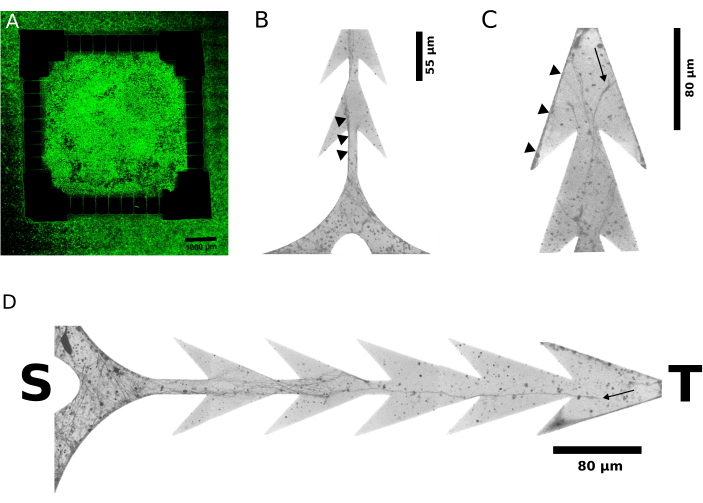
图 3:细胞未透过的荧光报告分子的实时成像,识别细胞铺板后几天被神经元拉长的神经突。(A-D) 在细胞铺板后 2 天和 6 天采集了从 图 1 和 图 2 (N = 4,128 个单独的微通道)制造的装置模块化神经元培养物的代表性共聚焦荧光显微照片。 (B-D) 显微照片的 40 倍放大倍率和倒灰度可提高可见度。来自源区和目标区间的微通道的末端分别用 S 和 T 表示。 (A) 显示培养物的宽扫描图像,其中源(即内部方形区域)和靶标(即外部区域)充满细胞,在铺板后6天。 (B) 和 (C) 分别在铺板后2天的较早时间点显示微通道源侧和靶侧神经突的生长。黑色小三角形表示假定轴突束末端的代表性例子,显然仅来自源头。箭头形微通道的边界指向神经突沿边缘 (B) 的伸长,在那里它们的通道不间断并被引导到目标。在相反的方向上,在微通道 (C ) 的目标末端旁边,起源于目标并推进到源侧的神经突被捕获在尖角处。 (D) 进一步揭示了微通道内神经突生长的细节。 请点击这里查看此图的较大版本.
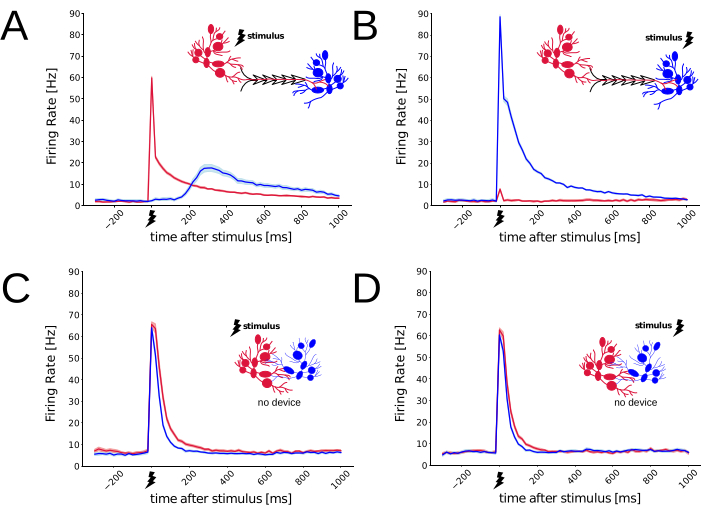
图 4:使用和不使用 PDMS 设备的神经元电响应的功能表征。 MEA被用作细胞培养底物,并用于测量由非常短(即200μs,0.8V)双相电刺激脉冲引起的全网脉冲,以双极配置传递。使用 图2所示的PDMS设备时,从源(红色)和目标(蓝色)记录的神经元尖峰响应不同,具体取决于刺激的传递位置。推定的轴突、突触和整合延迟在 (A) 中变得明显,但在 (B) 中不明显,表明存在首选的突触连接(即从源到靶)。 (C-D) 在对照条件下(即,没有PDMS设备),在两组不同的MEA微电极上检测到的诱发反应不依赖于刺激传递位置。包裹图中线条的浅色调阴影表示平均值的瞬时标准误差 (N 刺激 = 150)。 请点击这里查看此图的较大版本.
| 解决方案名称 | 组成 | ||
| 聚乙烯亚胺(PEI)0.1% | 1 mL PEI 储备溶液,9 mL 无菌去离子 (DI) 水。 | ||
| 培养基 (50 mL) | 最低必需培养基 (MEM),补充 20 μM 葡萄糖、50 μg/mL 庆大霉素、50 μM L-谷氨酰胺和 10% 热灭活马血清。 | ||
| 解剖培养基 (1000 mL) | Hanks' 平衡盐 9.52 g、碳酸氢钠 350 mg、HEPES 2.83 g、D-(+)-葡萄糖 6 g、犬尿烯酸(终浓度 200 μM)、D-AP5(终浓度 25 μM)、庆大霉素 250 μl、牛血清白蛋白 300 mg、硫酸镁 1.44 g。将pH值调节至7.3,避光保存,并在4°C下储存。 | ||
| 消解培养基 (100 mL) | 氯化钠 800 mg、氯化钾 37 mg、磷酸氢二钠 99 mg、HEPES 600 mg、碳酸氢钠 35 mg、犬尿烯酸,200 μL(来自 100 mM 原液)、D-AP5 100 μL(来自原液 25 mM)。将pH调节至7.4,避光保存,储存在4°C。 | ||
| 解决方案 1 | 胰蛋白酶 5 mg,脱氧核糖核酸酶 I 1.5 mg,在 2 mL 消化培养基中。 | ||
| 解决方案 2 | 胰蛋白酶抑制剂 5 mg,在 5 mL 解剖培养基中。 | ||
| 解决方案 3 | 脱氧核糖核酸酶 I 1.5 g,在 2.5 mL 解剖培养基中。 | ||
表 1:解决方案表。 有关产品说明,请参阅材料表。
补充编码文件 1: STL设计文件与 图2A中描述的结构相对应。 请点击此处下载此文件。
讨论
尽管已有数十年的历史,但 2PP 技术在基于微米级 PDMS 的复制品成型中的应用是最近的发展43,44。在此背景下,下面讨论一系列要点,以帮助用户有效地复制这项工作。
对于 3D 模型设计,请确保模型没有孔或自相交。在另存为 STL 时,请优先使用二进制文件格式,因为它的文件大小比 ASCII 编码的文件占用空间小。这对于具有复杂几何形状的设计和毫升宽的物体特别有益。使用二进制 STL 文件也意味着低 CPU 负载,在准备要 3D 打印的机械部件的过程中。 STL 文件中要素的物理尺寸以无量纲单位表示。在对 STL 文件进行后处理期间,单位被解释为千分尺。因此,建议在准备文件时预先采用感兴趣的单位,即千分尺。打印模型的精度由近似镶嵌三角形的曲面数量决定。对于表面数量不足,将出现不需要的表面粗糙度。尽管如此,通过大量曲面实现过高的精度是以高计算负载为代价的,导致文件处理速度变慢。
对于3D打印,在打印过程中,使用x-y平面上的快速振镜扫描和z方向上的压电运动形成3D物理对象。这会将飞秒激光束聚焦在任何给定的 3D 体素内。但是,当打印结构大于振镜和压电陶瓷的空间覆盖范围时,必须以编程方式将对象拆分为块。虽然这是毫米级打印部件的要求,但块之间的连接点与(不完美的)拼接线有关。仔细优化块数和在 x、y 和 z 方向上放置拼接线对于避免拼接线破坏最终对象的关键几何特征至关重要。由于各种原因(例如,基材光刻胶的杂质和不均匀性),打印界面可能会形成气泡,并对打印结构的质量和完整性产生负面影响。此外,更高的激光功率会导致它们的发生增加。降低打印部件最低层的激光功率将最大限度地减少气泡形成的机会。作为将整个零件打印为实体结构的替代方法,可以考虑采用壳体和脚手架方法。它仅涉及打印零件(外壳)的外表面以及其中的三棱镜元件。这些元件由水平层(支架)隔开,将未聚合的树脂固定在小口袋中。这种方法大大缩短了打印时间,特别是与毫米级结构有关。然而,由于非聚合树脂仍然存在,因此必须进行印刷后的紫外线照射,以确保完全的机械稳定性,尽管必须轻柔地执行此步骤以避免印刷部件的任何变形。后固化时间取决于所选的树脂、零件厚度和UV 功率 40。为了获得最佳效果,建议进行初步试验,以估计全深度固化所需的时间,使用一滴光刻胶并评估其在紫外线照射后的切片。通常的固化期在5至20分钟之间。
对于PDMS复制成型,在没有洁净室设施的情况下,清洁制造具有微米级特征的PDMS器件可能具有挑战性:空气中的微粒可能驻留在PDMS的高粘性表面上,阻碍器件和基板之间的密封,或阻塞单个微通道的部分。在层流罩下执行方案步骤,并始终如一地用异丙醇屏蔽PDMS表面,可大大降低污染风险。固化温度及其持续时间直接影响PDMS交联和由此产生的物理性能。特别是,固化PDMS的粘合性是一个关键因素。一方面,PDMS装置与用于神经元细胞培养的表面(例如,玻璃盖玻片或MEA)之间需要紧密密封,以有效限制神经突的通过。另一方面,PDMS器件应可逆地附着在表面,使精密的绝缘层MEA在取下器件后不会损坏。虽然PDMS在固化过程中会发生收缩,并且可以通过预先重新缩放模具来纠正,但对于此处所示的温度和固化间隔,收缩率将小于2%42 ,并且不会显着影响单层PDMS器件。总体而言,请严格遵循推荐的固化温度和持续时间值,以获得最佳效果。
该方法的优点和局限性概述
提出了一种基于2光子直接激光写入的快速制备微尺度聚合物器件的技术,用于模块化神经网络的实验研究。与软光刻相反,所提出的方法不需要高水平的技术专长,只要功能性的2PP 3D打印设置是可访问和操作的。值得注意的是,该方法可以在一天内从 CAD 设计的 3D 模型转换为功能性的 PDMS 设备,从而提供了从概念到实际实现的直接有效的路径。具体来说,选择外壳和脚手架打印模式可显着减少创建模具所需的时间,因为仅打印其体积的一小部分。随后对打印部件进行UV固化,保证了其机械稳定性和坚固性,这在50个浇注周期中得到了验证。
与传统方法相比,2PP 3D打印具有明显的优势,这在制造具有显着纵横比、苛刻分辨率要求和复杂三维几何形状的模具时最为明显。使用标准UV光刻技术生产母模时,光刻胶厚度约为200μm。为了实现更高的高度和纵横比,需要复杂的旋涂和曝光循环序列35、昂贵的LIGA(光刻、电镀和成型)或深度反应离子蚀刻(DRIE)工艺36 。与此形成鲜明对比的是,正如 Kumi 等人在 201037 年的开创性工作所证明的那样,2PP 技术为打印部件的纵横比提供了从亚微米到毫米的无限范围。在这里,以模具各部分高度差异显著的模具的微制造过程为例,其特点是微通道的高度(5 μm)和最大模具高度(545 μm;见 图2)之间的差异超过100倍。
此外,通过遵循概述的协议规范,可以很容易地实现亚微米分辨率。相比之下,通过UV光刻技术实现更高的模具分辨率需要资本投资。具有最佳分辨率的掩模,利用石英上的铬沉积,标称分辨率为600 nm,价格比激光打印的顶置透明掩模高出几个数量级,后者的分辨率为250 μm35,但参见Pirlo等人的工作41。为了在内部使用,所选方法必须具有成本效益。对于许多生物实验室来说,与传统软光刻或直接激光写入相关的总费用是一个障碍。虽然通过购买和组装基本组件使这两种技术更容易获得是可行的,但这种方法需要额外的专业知识,并且仍然需要大量投资。在这种情况下,需要考虑的一个基本点是通过直接激光写入实现的更广泛的应用。与传统的软光刻技术(主要局限于模具微制造)不同,2PP 3D打印表现出非凡的多功能性。其潜在应用范围从微流控和微光学到集成光子学和微力学。这使得对这项技术的投资具有吸引力,因为它是多个不同科学领域的共享设施。例如,该协议中设计的基于 2PP 的方法是我们机构内神经科学和数学部门之间跨学科合作的结果。此外,光刻胶开发是一个活跃的研究领域,可以潜在地扩大2PP 3D打印的应用范围。最近推出的IP-PDMS树脂就是一个很好的例子。通过聚合成具有 PDMS38 等特性的结构,这种树脂释放了对具有复杂表面或包含空心空间的生物相容性成分进行直接微纳加工的潜力。这些复杂性阻碍了通过传统的复制成型程序实现类似的结果。
作为这种方法的演示,提供了证据表明模块化神经元网络中两个模块之间的单向连接的发展。通过2PP技术制造的微型模具具有足够的耐久性,可以进行多次PDMS铸造,并具有所需的微规模精度。总之,本著作中描述的协议的适用范围超出了所说明的情况。随着2PP印刷技术的普及,其实施所需的初始投资将减少,而其潜在应用范围将扩大。
披露声明
作者没有什么可透露的。
致谢
M.G.感谢欧盟H2020框架计划通过欧洲创新委员会(IN-FET项目,GA n. 862882,Arbor-IO项目,FLAG-ERA和人脑项目,ID 650003)和SISSA(神经科学领域)提供的财政支持。G.N.感谢意大利大学和研究部(MUR)通过Dipartimenti di Eccellenza 2018-2022(数学领域)赠款提供的财政支持。我们感谢 M. Gigante、B. Pastore 和 M. Grandolfo 在 3D 打印、细胞培养和实时成像方面的帮助,以及 P. Massobrio、P. Heppenstall、L. Ballerini、Di Clemente 和 H.C. Schultheiss 博士的讨论。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| 2-Propanol | Sigma-Aldrich | 650447 | |
| BB cure compact polymerizer | PCube Srl | Wavelengths 365-405 nm, Power 120W | |
| BioMed Amber Resin 1 L | formlabs | Resin used for mounting the 3D Printed mold to Petri dish | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| CAD application software SolidWorks | Dassault Systèmes SolidWorks Corporation, US | Fusion 360 (Autodesk Inc., US), AutoCAD (Autodesk Inc., US), PTC Creo (PTC corp., US), SolidWorks (Dassault Systèmes SolidWorks corp., US) and Tinkercad (Autodesk Inc., US). -------------------------------------- Tutorials: https://www.mycadsite.com/tutorials.html Trainings: https://www.autodesk.com/training | |
| CellTracker Green CMFDA | Invitrogen | C7025 | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| D-AP5 | Tocris | #0106 | |
| Deoxyribonuclease I | Sigma-Aldrich | D5025 | |
| DeScribe | Nanoscribe GmbH & Co. KG | ||
| di-Sodium hydrogen phosphate | Sigma-Aldrich | 106585 | |
| Gentamicin | Thermo Fisher | 15710049 | |
| Hanks′ Balanced Salts | Sigma-Aldrich | H2387 | |
| HEPES | Sigma-Aldrich | H7523 | |
| Horse Serum | Sigma-Aldrich | H1138 | |
| in vitro MEA recording system MEA2000 mini | Multichannel Systems GmBH, Reutlingen, Germany | ||
| IP-S Photoresist | Nanoscribe GmbH & Co. KG | ||
| Kynurenic acid | Sigma-Aldrich | K3375 | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Magnesium sulfate | Sigma-Aldrich | M2643 | |
| MEA recording application software (Experimenter) | Multichannel Systems GmBH, Reutlingen, Germany | ||
| Minimum Essential Medium | Sigma-Aldrich | 51412C | |
| NanoWrite | Nanoscribe GmbH & Co. KG | ||
| ophthalmic stab Knife 15° | HESTIA Medical | ||
| Photonic Professional GT2 (PPGT2) 3D printer | Nanoscribe GmbH & Co. KG | SN617 | |
| Plasma Cleaner | HARRICK PLASMA | ||
| Poly(ethyleneimine) solution | Sigma-Aldrich | P3143 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Propylene glycol methyl ether acetate (PGMEA) | Sigma-Aldrich | 484431 | |
| Repel-silane ES | Sigma-Aldrich | GE17133201 | |
| Soda lime ITO-coated substrates for 3D MF DiLL | Nanoscribe GmbH & Co. KG | ||
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Substrate-integrated planar MEAs (120MEA100/30iR-ITO-gr) | Multichannel Systems GmBH, Reutlingen, Germany | TiN electrodes, SiN isolator, 4 internal reference electrodes,120 recording electrodes, Electrode spacing 100 µm,Electrode diameter 30 µm | |
| SYLGARD 184 Kit | Dow Corning | ||
| Trypsin | Sigma-Aldrich | T1005 | |
| Trypsin inhibitor | Sigma-Aldrich | T9003 | |
| vacuum pump Single phase asynchronous 2 poles | CIMAMOTORI |
参考文献
- Kanagasabapathi, T. T., et al. Dual-compartment neurofluidic system for electrophysiological measurements in physically segregated and functionally connected neuronal cell culture. Front Neuroeng. 4, 13 (2011).
- Maeda, E., Robinson, H. P. C., Kawana, A. The mechanisms of generation and propagation of synchronized bursting in developing networks of cortical neurons. J Neurosci. 15 (10), 6834-6845 (1995).
- Wheeler, B. C., Brewer, G. J. Designing neural networks in culture. Proc IEEE Inst Electr Electron Eng. 98 (3), 398-406 (2010).
- DeMarse, T. B., Pan, L., Alagapan, S., Brewer, G. J., Wheeler, B. C. Feed-forward propagation of temporal and rate information between cortical populations during coherent activation in engineered in vitro networks. Front Neural Circuits. 10, 32 (2016).
- Kanagasabapathi, T. T., et al. Functional connectivity and dynamics of cortical-thalamic networks co-cultured in a dual compartment device. J Neural Eng. 9 (3), 036010 (2012).
- Brofiga, M., Pisano, M., Tedesco, M., Raiteri, R., Massobrio, P. Three-dimensionality shapes the dynamics of cortical interconnected to hippocampal networks. J Neural Eng. 15 (5), 056044 (2020).
- Bisio, M., Bosca, A., Pasquale, V., Berdondini, L., Chiappalone, M. Emergence of bursting activity in connected neuronal sub-populations. PLoS One. 9 (9), e107400 (2014).
- Hasan, M. F., Berdichevsky, Y. Neural circuits on a chip. Micromachines. 7 (9), 157 (2016).
- Aebersold, M. J., et al. 34;Brains on a chip": Towards engineered neural networks. TrAC Tren Anal Chem. 78, 60-69 (2016).
- Zamora-López, G., Chen, Y., Deco, G., Kringelbach, M. L., Zhou, C. Functional complexity emerging from anatomical constraints in the brain: The significance of network modularity and rich-clubs. Sci Rep. 6, 38424 (2016).
- Eytan, D., Marom, S. Dynamics and effective topology underlying synchronization in networks of cortical neurons. J Neurosci. 26 (33), 8465-8476 (2006).
- Pan, L., Alagapan, S., Franca, E., Brewer, G. J., Wheeler, B. C. Propagation of action potential activity in a predefined microtunnel neural network. J Neural Eng. 8 (4), 046031 (2011).
- Virlogeux, A., et al. Reconstituting corticostriatal network on-a-chip reveals the contribution of the presynaptic compartment to Huntington's disease. Cell Rep. 22 (1), 110-122 (2018).
- Kleinfeld, D., Kahler, K., Hockberger, P. E. Controlled outgrowth of dissociated neurons on patterned substrates. J Neurosci. 8 (11), 4098-4120 (1988).
- Vogt, A. K., Wrobel, G., Meyer, W., Knoll, W., Offenhäusser, A. Synaptic plasticity in micropatterned neuronal networks. Biomaterials. 26 (15), 2549-2557 (2005).
- Staii, C., et al. Positioning and guidance of neurons on gold surfaces by directed assembly of proteins using atomic force microscopy. Biomaterials. 30 (20), 3397-3404 (2009).
- Fricke, R., et al. Axon guidance of rat cortical neurons by microcontact printed gradients. Biomaterials. 32 (8), 2070-2076 (2011).
- Gladkov, A., et al. Design of cultured neuron networks in vitro with predefined connectivity using asymmetric microfluidic channels. Sci Rep. 7 (1), 15625 (2017).
- le Feber, J., Postma, W., de Weerd, E., Weusthof, M., Rutten, W. L. Barbed channels enhance unidirectional connectivity between neuronal networks cultured on multi electrode arrays. Front Neurosci. 9, 412 (2015).
- Peyrin, J. M., et al. Axon diodes for the reconstruction of oriented neuronal networks in microfluidic chambers. Lab Chip. 11 (21), 3663-3673 (2011).
- Xia, Y., Whitesides, G. M. Soft lithography. Angewandte Chemie - International Edition. 37 (5), 550-575 (1998).
- Qi, D., Hoelzle, D. J., Rowat, A. C. Probing single cells using flow in microfluidic devices. Eur Phys J Spec Top. 204, 85-101 (2012).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. J Vis Exp. (119), e55276 (2017).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. (153), e60307 (2019).
- Maruo, S., Nakamura, O., Kawata, S. Three-dimensional microfabrication with two-photon-absorbed photopolymerization. Opt Lett. 22 (2), 132-134 (1997).
- Baldacchini, T. . Three-dimensional microfabrication using two-photon polymerization: Fundamentals, technology, and applications. , (2015).
- Madou, M. J. . Fundamentals of Microfabrication. , (2018).
- Sun, H. B., Kawata, S. Two-photon photopolymerization and 3D lithographic microfabrication. NMR, 3D Anal, Photopolymeriz. Adv Poly Sci. 170, 169-273 (2004).
- Marom, S., Shahaf, G. Development, learning and memory in large random networks of cortical neurons: Lessons beyond anatomy. Q Rev Biophys. 35 (1), 63-87 (2002).
- Kamioka, H., Maeda, E., Jimbo, Y., Robinson, H. P. C., Kawana, A. Spontaneous periodic synchronized bursting during formation of mature patterns of connections in cortical cultures. Neurosci Lett. 206 (2-3), 109-112 (1996).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), e2056 (2010).
- Mahmud, M., Pulizzi, R., Vasilaki, E., Giugliano, M. QSPIKE tools: A generic framework for parallel batch preprocessing of extracellular neuronal signals recorded by substrate microelectrode arrays. Front Neuroinform. 8, 26 (2014).
- Pulizzi, R., et al. Brief wide-field photostimuli evoke and modulate oscillatory reverberating activity in cortical networks. Sci Rep. 6 (1), 24701 (2016).
- Scarsi, F., Tessadori, J., Chiappalone, M., Pasquale, V. Investigating the impact of electrical stimulation temporal distribution on cortical network responses. BMC Neurosci. 18 (1), 49 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Kim, K., et al. Rapid replication of polymeric and metallic high aspect ratio microstructures using PDMS and liga technology. Microsystem Technologies. 9 (1-2), 5-10 (2002).
- Kumi, G., Yanez, C. O., Belfield, K. D., Fourkas, J. T. High-speed multiphoton absorption polymerization: Fabrication of microfluidic channels with arbitrary cross-sections and high aspect ratios. Lab Chip. 10 (8), 1057-1060 (2010).
- Bunea, A. I., et al. et al.Micro 3D printing by two-photon polymerization: Configurations and parameters for the nanoscribe system. Micro. 1 (2), 164-180 (2021).
- Taylor, A., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nat Methods. 2 (8), 599-605 (2005).
- Oakdale, J. S., Ye, J., Smith, W. L., Biener, J. Post-print UV curing method for improving the mechanical properties of prototypes derived from two-photon lithography. Opt. Express. 24 (24), 27077-27086 (2016).
- Pirlo, R. K., Sweeney, A. J., Ringeisen, B. R., Kindy, M., Gao, B. Z. Biochip/laser cell deposition system to assess polarized axonal growth from single neurons and neuron/glia pairs in microchannels with novel asymmetrical geometries. Biomicrofluidics. 5 (1), 13408 (2011).
- Madsen, M. H., Feidenhans'l, N. A., Hansen, P. E., Garnæs, J., Dirscherl, K. Accounting for PDMS shrinkage when replicating structures. J Micromech Microeng. 24 (12), 127002 (2014).
- Comina, G., Suskaa, A., Filippini, D. PDMS lab-on-a-chip fabrication using 3D printed templates. Lab Chip. 14 (2), 424-430 (2013).
- Chan, H. N., et al. one-step molding of 3D-printed structures for convenient fabrication of truly 3D PDMS microfluidic chips. Microfluid Nanofluid. 19, 9-18 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。