Method Article
Impresión 3D de polimerización de dos fotones de dispositivos de cultivo de células neuronales a microescala
En este artículo
Resumen
La impresión 3D a escala micrométrica permite la creación rápida de prototipos de dispositivos poliméricos para cultivos de células neuronales. Como prueba de principio, las conexiones estructurales entre las neuronas se vieron limitadas por la creación de barreras y canales que influyen en el crecimiento de las neuritas, mientras que las consecuencias funcionales de dicha manipulación fueron observadas por la electrofisiología extracelular.
Resumen
Los cultivos neuronales han sido un modelo experimental de referencia durante varias décadas. Sin embargo, falta la disposición celular en 3D, las limitaciones espaciales en el crecimiento de las neuritas y la conectividad sináptica realista. Esto último limita el estudio de la estructura y la función en el contexto de la compartimentación y disminuye la importancia de las culturas en la neurociencia. Aproximarse ex vivo a la disposición anatómica estructurada de la conectividad sináptica no es trivial, a pesar de ser clave para la aparición de los ritmos, la plasticidad sináptica y, en última instancia, la fisiopatología cerebral. Aquí, la polimerización de dos fotones (2PP) se emplea como técnica de impresión 3D, lo que permite la fabricación rápida de dispositivos de cultivo celular polimérico utilizando polidimetil-siloxano (PDMS) a escala micrométrica. En comparación con las técnicas convencionales de moldeo de réplicas basadas en microfotolitografía, la impresión a microescala de 2PP permite una entrega rápida y asequible de prototipos. Este protocolo ilustra el diseño y la fabricación de dispositivos microfluídicos basados en PDMS destinados a cultivar redes neuronales modulares. Como prueba de principio, se presenta un dispositivo de dos cámaras para restringir físicamente la conectividad. Específicamente, se favorece un crecimiento axonal asimétrico durante el desarrollo ex vivo y se permite que se dirija de una cámara a otra. Con el fin de sondear las consecuencias funcionales de las interacciones sinápticas unidireccionales, se eligen matrices de microelectrodos comerciales para monitorizar la actividad bioeléctrica de los módulos neuronales interconectados. Aquí, se ilustran los métodos para 1) fabricar moldes con precisión micrométrica y 2) realizar registros extracelulares multisitio in vitro en cultivos neuronales corticales de rata. Al disminuir los costes y la futura accesibilidad generalizada de la impresión 3D 2PP, este método será cada vez más relevante en los laboratorios de investigación de todo el mundo. Especialmente en neurotecnología y registro de datos neuronales de alto rendimiento, la facilidad y rapidez de la creación de prototipos simplificados de modelos in vitro mejorará el control experimental y la comprensión teórica de los sistemas neuronales in vivo a gran escala.
Introducción
La investigación de la actividad neuronal en organismos que se comportan presenta varios desafíos. Por ejemplo, el acceso físico al tejido cerebral está limitado por la necesidad de mantener su integridad, por lo que las regiones superficiales del cerebro son más fáciles de considerar. Aislar objetivos específicos dentro del tejido intacto es a menudo una tarea desalentadora y, a veces, imposible. Aunque los cultivos neuronales homogéneos disociados ofrecen un acceso conveniente a las propiedades moleculares, bioquímicas y biofísicas de los componentes (sub)celulares individuales de un circuito neuronal, se pierde una conectividad realista y una organización anatómica del cerebro intacto. Estas limitaciones fundamentales inspiraron los esfuerzos de investigación para lograr un término medio, donde se evita la complejidad in vivo mientras que la estructura se puede construir in vitro, lo que está bajo demanda 1,2,3,4,5,6,7,8,9 . En particular, los cultivos neuronales modulares han sido objeto de una amplia investigación en las últimas décadas, con el objetivo de abordar cuestiones clave de la fisiología del cerebro, como se describe a continuación.
Organización: Los estudios in vivo muestran que el cerebro está estructurado anatómicamente en capas con tipos celulares precisos y matrices de proyecciones. Los ensayos funcionales revelaron la organización de las redes neuronales en ensamblajes de nodos y módulos, con esquemas de conectividad precisos10,11. Sin embargo, el papel de la conectividad y los motivos de microcircuitos no puede estudiarse adecuadamente in vivo debido al gran número de sinapsis implicadas, así como a los efectos entrelazados del desarrollo y la plasticidad dependiente de la actividad.
Transferencia de señal: En cultivos in vivo o aleatorios in vitro , es difícil evaluar la transferencia de señales. El examen de la conducción axonal y el potencial de acción a lo largo de su longitud requiere guiar el crecimiento de las neuritas mediante la funcionalización de la superficie o el patrón químico, proporcionando una alta relación señal-ruido en las lecturas extracelulares de la actividad eléctrica12.
Relevancia traslacional: Descifrar el papel exclusivo de los elementos presinápticos frente a los postsinápticos en condiciones patológicas requiere tener acceso a estos elementos individualmente. Las culturas modulares con conectividad restringida, que segregan efectivamente los elementos presinápticos y postsinápticos, son herramientas indispensables para este fin13.
Existen varios métodos para obtener algún tipo de estructura en el cultivo neuronal. A grandes rasgos, se pueden clasificar como manipulación química y física de la superficie9. Los primeros métodos 14,15 se basan en la propensión de las células neuronales a unirse a ciertos compuestos (bio)químicos. Para ello es necesario depositar adhesivo o moléculas atractivas sobre una superficie con precisión a microescala y siguiendo un patrón detallado. Si bien esto permite una cobertura parcial de la superficie de las células, siguiendo el patrón deseado, los métodos químicos son inherentemente limitados y tienen una tasa de éxito relativamente baja en la guía del crecimiento de neuritas16. El control total sobre la direccionalidad de los axones requiere el establecimiento de un gradiente espacial de sustancias químicas ad-hoc para dar forma a la guía axonal17. Estos últimos métodos implican la manipulación de la superficie física y se utilizan más comúnmente para estructurar las redes neuronales in vitro. Las células neuronales están físicamente constreñidas en los lugares deseados por confinamientos geométricos, como cámaras microscópicas, paredes, canales, etc., dando forma a un polímero biocompatible como el polidimetilsiloxano (PDMS)3,5,6,7,18,19,20 curado y solidificado en un dispositivo microfluídico. El método de facto para la fabricación microfluídica de PDMS es la fotolitografía blanda21, en la que se modela una máscara bidimensional a microescala y se emplea para grabar selectivamente un material a base de silicio tras la exposición a los rayos UV. En pocas palabras, una resina curable por UV (es decir, fotorresistente) se recubre sobre una oblea de silicio a través de un recubrimiento por centrifugación, alcanzando una altura específica determinada por su viscosidad y velocidad de centrifugado. A continuación, la máscara estampada se coloca sobre la fotorresistencia y se expone a la luz ultravioleta. Las áreas transparentes dentro de la máscara, correspondientes a las regiones de interés, permitirán que la luz ultravioleta induzca la reticulación localizada de las moléculas fotorresistentes. Las áreas de fotorresistencia no expuestas se lavan con un solvente, lo que da como resultado la formación de un molde maestro. Esto se usa repetidamente para hornear un elastómero de la elección (es decir, PDMS), que luego se graba con las geometrías deseadas en tantas réplicas como se desee. Este método de fabricación es el método más común para fabricar dispositivos microfluídicos22. Quizás las principales limitaciones de la fotolitografía blanda son el requisito previo de una notable inversión de capital y la falta de familiaridad de los laboratorios biológicos con las técnicas y la experiencia requeridas. La preparación de la máscara y los pasos de fotolitografía blanda necesarios para diseñar geometrías complejas de alta relación de aspecto de múltiples alturas no son triviales23 y, a menudo, requieren subcontratación. A pesar de que se han propuesto métodos alternativos y de bajo presupuesto, no siempre satisfacen los requisitos de alta precisión de la creación de prototipos biológicos24.
Aquí, se presenta un método de fabricación alternativo, basado en la polimerización de dos fotones (2PP) y la fabricación aditiva. Es sencillo y no requiere per se experiencia avanzada en microfabricación y microfotolitografía. El campo de investigación de la microfabricación de 2PP surgió a finales de los años 9025 y, desde entonces, ha experimentado un crecimiento exponencial26. Se puede encontrar más información sobre los principios fundamentales de esta técnica en otro lugar26. Brevemente, al enfocar el impulso de luz de excitación en el espacio tridimensional, 2PP aprovecha la dependencia no lineal de la absorción multifotónica de la intensidad. Esto otorga la capacidad de absorción confinada, asegurando una excitación precisa y selectiva dentro de regiones muy localizadas. En esencia, un fotorresistente de tono negativo, un material con solubilidad disminuida tras la exposición a la luz, se somete a un haz enfocado de pulsos de láser de femtosegundos a un ciclo de trabajo bajo27. Esto permite impulsos con altas intensidades a bajas potencias medias, lo que permite la polimerización sin dañar el material. La interacción de los monómeros radicales fotoinducidos da lugar a oligómeros radicales, iniciando una polimerización que se extiende por todo el fotorresistente hasta un volumen distinto, es decir, vóxel, cuyo tamaño depende de la intensidad y duración de los pulsos láser28.
En este trabajo se presentan dos componentes: A) el diseño y fabricación rápida de un molde impreso en 3D, reutilizable muchas veces para producir dispositivos de cultivo celular neuronal polimérico desechables (Figura 1), y B) su acoplamiento mecánico sobre la superficie de sustratos de cultivo celular neuronal plano, o incluso de matrices de microelectrodos integradas en sustratos capaces de registros multisitio de señales bioeléctricas.
Aquí se describe muy brevemente el diseño asistido por ordenador de un modelo mecánico en 3D y, acompañado de los pasos que conducen a un molde impreso en 3D y a la fabricación de dispositivos PDMS.
Se puede utilizar una variedad de aplicaciones de software de diseño asistido por computadora para generar el modelo de objeto 3D inicial y producir un archivo STL para controlar el proceso de impresión 2PP. Dentro de la Tabla de Materiales, la primera y la última aplicación enumeradas son gratuitas o se proporcionan con una licencia gratuita. La construcción de un modelo 3D siempre requiere la creación de un boceto 2D, que luego se extruye en los pasos de modelado posteriores. Para demostrar este concepto, se destaca un proceso genérico de diseño de software CAD 3D en la sección de protocolo, que conduce a una estructura hecha de cubos superpuestos. Para obtener información más completa, hay disponibles una serie de tutoriales en línea y recursos de capacitación gratuitos, como se indica en la Tabla de materiales.
El archivo STL resultante se traduce en una serie de comandos que debe ejecutar la impresora 3D (es decir, el procedimiento de corte). Para la impresora 3D 2PP específica en uso, se utiliza el software DeScribe para importar el archivo STL y convertirlo al formato propietario General Writing Language (GWL). El éxito del proceso de impresión 2PP depende de varios parámetros, en particular, la potencia del láser y su velocidad de escaneo, las distancias de costura y corte de sombreado. La elección de estos parámetros, junto con la selección del objetivo y la fotorresistencia, depende de las características más pequeñas del diseño, así como de la aplicación prevista. Por lo tanto, la optimización de parámetros se vuelve esencial para cumplir con los requisitos de diferentes escenarios de diseño y casos de uso. Para este trabajo, se ha considerado la receta recomendada IP-S 25x ITO Shell (3D MF) como configuración para los parámetros de impresión. En última instancia, una pieza impresa mecánicamente estable se imprime con la resolución necesaria al tiempo que se minimiza su tiempo de impresión 3D.
El diseño del molde y el archivo STL relacionado, demostrado en este trabajo, comprende un marco cuadrado para segregar el espacio de un cultivo celular en dos compartimentos: un área exterior (es decir, denominada Fuente posteriormente) y un área interior (es decir, denominada Objetivo posteriormente). Estos dos compartimentos están conectados a través de conjuntos de microcanales, cada uno caracterizado por bordes de ángulo agudo, diseñados para obstaculizar específicamente el crecimiento de las neuritas desde el Objetivo hasta la Fuente, pero no al revés, y como tal promueven una conectividad sináptica direccional entre las neuronas que crecen en las dos áreas.
Estudios anteriores emplearon diferentes geometrías de microcanales para estimular el crecimiento direccional de las neuritas. Algunos ejemplos son las formas triangulares18, las estructuras de púas de canal19 y los canales cónicos20. Aquí, se emplea un diseño con barreras de ángulo agudo a través de los bordes del microcanal, caracterizado también por entradas asimétricas. Estos microcanales sirven para establecer la continuidad entre un interior cerrado, el compartimento de destino, y el área externa, el compartimento de origen. La forma de embudo de la parte inicial de los microcanales, desde el lado de la fuente, está diseñada para promover la formación de haces axonales y su crecimiento a lo largo del camino más corto, es decir, en línea recta, que conecta la fuente con el objetivo. El espacio triangular realizado al enfrentar ángulos agudos tiene un mayor volumen en el lado del objetivo para tratar de retrasar efectivamente la búsqueda del camino de las neuritas, al tiempo que favorece el disparo rápido de los haces que se originan en la fuente y la ocupación del espacio disponible. La elección de 540 μm para la longitud de los microcanales filtra eficazmente la excrecencia dendrítica, generalmente más corta,39. Además, su altura de 5 μm evita que los somas celulares penetren a través de los microcanales. En general, esta configuración demostró promover la conectividad unidireccional entre los módulos externos, de origen, e internos, de destino, y se presenta aquí como una prueba de principio entre las muchas opciones alternativas.
Mientras que los dispositivos PDMS, fabricados por el molde de 2PP, se pueden unir a la superficie de sustratos comunes de cultivo celular, como cubreobjetos de vidrio o placas de Petri, en este trabajo se utilizaron matrices de microelectrodos integradas en sustrato disponibles comercialmente. No se ha hecho ningún esfuerzo para optimizar el diseño 3D a la disposición de la matriz de microelectrodos, y el acoplamiento mecánico se realizó bajo la guía de microscopía estereoscópica con el único objetivo de posicionar el dispositivo a través de la matriz, dejando algunos microelectrodos descubiertos en ambos lados, la fuente y el objetivo. Esto permite la evaluación preliminar de las consecuencias funcionales de la conectividad restringida en cultivos celulares neuronales.
Protocolo
Todos los procedimientos relacionados con la manipulación de animales se llevaron a cabo de conformidad con las leyes europeas e italianas (Directiva del Parlamento Europeo y del Consejo de 22 de septiembre de 2010 [2010/63/UE]; Decreto del Gobierno italiano del 4 de marzo de 2014, n.º 26), fueron aprobados explícitamente por el OpBA institucional (Comité para el Cuidado de los Animales) de la Scuola Internazionale Superiore di Studi Avanzati y fueron autorizados oficialmente por el Ministerio de Salud italiano (Autorización n.º 22DAB. N.UVD). Esto condujo a la disponibilidad de material no sensible del tejido cerebral de rata explantado, para ser utilizado para la validación experimental del método presentado en este trabajo.
1. 3D fabricación de moldes mediante polimerización de dos fotones
- Generación de los archivos CAD
NOTA: Los siguientes pasos muestran un flujo de trabajo de diseño 3D genérico, empleando software de diseño asistido por computadora (es decir, SolidWorks). El archivo de diseño STL de muestra descrito en este trabajo (Figura 2) está disponible como Archivo de Codificación Suplementaria 1, así como a través de Zenodo (https://doi.org/10.5281/zenodo.8222110).- Inicie la aplicación de escritorio del software de diseño asistido por computadora. En la barra de menú superior, seleccione Nuevo.
- En las opciones, elija Pieza: una representación 3D de un solo componente de diseño. Pulse la combinación de teclas Ctrl + 5 para establecer la vista superior del boceto.
- En el panel lateral, seleccione Boceto y elija Rectángulo de esquina. Seleccione un borde del rectángulo haciendo clic en él. Cuando aparezca un panel de parámetros, establezca la longitud en 100 unidades.
- Repita el paso 1.1.3 para el borde perpendicular al anterior: establezca su longitud en 50 unidades. Seleccione el rectángulo arrastrándolo mientras mantiene presionado el botón izquierdo del mouse.
- En el menú Agregar relación , seleccione Corregir para restringir las relaciones entre líneas.
- Salga del boceto y repita los pasos 1.1.3 a 1.1.5, creando un nuevo rectángulo (más pequeño), superponiendo el boceto anterior.
- En el panel lateral, seleccione Entidades y elija Saliente/Base extruido: establezca la profundidad de los rectángulos grande y pequeño en 5 y 10 unidades, respectivamente.
- En el menú Archivo , guarde la pieza en formato STL (es decir, lenguaje de teselación estándar).
- Procesamiento de los archivos CAD
- Transfiera el archivo STL a una computadora personal, equipada con el software de aplicación DeScribe.
- Inicie Describe y, en el menú Archivo, abra el archivo STL. Aparecerá una representación 3D del modelo.
- En la sección de orientación del menú de la derecha, gire el modelo para orientarlo adecuadamente en el espacio y céntrelo en el plano.
- Ajuste la escala general seleccionando la sección Escala del menú del lado derecho.
- En el menú desplegable de la parte superior, seleccione la receta IP-S 25x ITO Shell (3D MF). Esto especifica IP-S como fotorresistencia, 25x para la potencia de aumento del objetivo, sustrato recubierto de óxido de indio y estaño (ITO) como sustrato de impresión e impresión de carcasa y andamio como modo de funcionamiento con características de tamaño medio (MF).
- Desplácese por el asistente, seleccionando y estableciendo Distancia de corte en 1 μm y Distancia de sombreado en 0,5 μm tanto para el vaciado como para el andamio.
- En el paso de salida del asistente de importación, en división, defina el tamaño de bloque como X = 200 μm, Y = 200 μm y Z = 265 μm y el desplazamiento de bloque como X = 133 μm, Y = 133 μm y Z = 0, asegurándose de que las delicadas estructuras de los microcanales no se vean afectadas por las líneas de unión.
- Como modo de escaneo, utilice el valor predeterminado: Galvo para el plano X-Y y Piezoeléctrico para el eje Z.
- Pulse Guardar y, en el siguiente menú textual, sustituya la línea var $baseLaserPower = $shellLaserPower por var $baseLaserPower = 75, para reducir al 75% la potencia del láser en la capa más baja de la impresión.
- Transfiera los archivos GWL obtenidos por los pasos anteriores a la estación de trabajo dedicada a la impresión 3D 2PP.
- Impresión 3D y desarrollo de muestras
- Inicie el software de la aplicación NanoWrite . Después de la inicialización de la impresora, haga clic en Exchange Holder en la interfaz del software para insertar el soporte de sustrato y montar el objetivo.
- Monte el objetivo 25x en la posición adecuada en el revólver. Identifique qué lado del sustrato de vidrio está recubierto con ITO, mediante un multímetro electrónico configurado para medir resistencias: la lectura debe ser de valores bajos, como 100-300 Ω, pero solo para el lado recubierto de ITO.
- Coloque el sustrato de vidrio en el soporte, orientando el lado recubierto de ITO hacia arriba. Use cinta adhesiva para mantenerlo firmemente en su lugar.
- Debajo de la campana de extracción química, aplique una gota de fotorresistencia IP-S en el centro del sustrato de vidrio.
- Inserte el soporte en la impresora 3D, con la gota de resina hacia el objetivo (es decir, hacia abajo).
- A través del menú Archivo del software, cargue los archivos GWL. Seleccione Muestra de aproximación para acercar el objetivo a la gota de resina.
- Seleccione Buscar interfaz para permitir la detección de la interfaz de impresión ITO-fotorresistencia, en función de la diferencia del índice de refracción de los dos materiales.
- Seleccione Iniciar trabajo para iniciar la impresión. Cuando finalice la impresión, pulse Exchange Holder (Intercambiar soporte ) para recuperar el soporte.
- Recupere el soporte y retire suavemente el sustrato con la pieza impresa. Sumerja el sustrato de vidrio en acetato de éter metílico de propilenglicol (PGMEA) durante 20 minutos debajo de la campana extractora, para revelar la pieza impresa.
- Retire el sustrato del PGMEA y sumérjalo en isopropanol durante 5 min. Deje que la pieza impresa se seque al aire, debajo de la campana de extracción de gases químicos.
- Tratamiento posterior a la impresión y montaje del molde
- Cura la pieza impresa mediante la exposición a la luz ultravioleta (es decir, 365-405 nm) con suficiente potencia durante 5-20 minutos (consulta la discusión para obtener más información sobre la potencia).
- Bajo una campana de flujo laminar, retire suavemente la pieza impresa del sustrato de vidrio. Deja caer ~2 μL de resina en el fondo de una placa de Petri de 35 mm x 10 mm.
- Coloca con cuidado la pieza impresa sobre la gota y deja que la resina fluya por debajo de la pieza. Curar aún más la pieza impresa mediante la exposición a la luz ultravioleta, durante 5 min.
- Cubra la placa de Petri con su tapa y transfiérala al horno para que se cure con calor, durante 30 minutos a 80 °C. No precaliente el horno para evitar la deformación o fractura de la pieza impresa. Después del curado, la pieza impresa se unirá permanentemente al fondo de la placa de Petri. A partir de ahora, la pieza impresa y montada se denominará molde.
2. Fabricación de dispositivos PDMS a partir de sustratos de cultivo celular y de moldes
- Fabricación de dispositivos PDMS
- Prepare 20 mL de mezcla 10:1 (relación en peso) de la base y elagente de curado de PDMS no polimerizado. Para cada dispositivo, y dependiendo de su altura requerida, 1-2 mL de mezcla de PDMS es suficiente. Almacene el exceso de PDMS no polimerizado a -20 °C para su uso posterior.
- Bajo una campana de flujo laminar, revuelva bien la mezcla durante 4 min. A medida que la mezcla atrapa las burbujas de aire de manera uniforme, se volverá opaca.
- Transfiera la mezcla a un tubo μ de 50 μL y centrifugue a 168 x g durante 5 min, para eliminar las burbujas de aire de la mezcla y lograr una apariencia clara.
- Trate el molde con 10 μL de agente hidrófobo (es decir, Repel-silano ES) y déjelo reposar durante 7 minutos, asegurando un desprendimiento suave del PDMS polimerizado del molde más adelante.
- Enjuague el molde 1 vez con etanol al 70 % y 2 veces con agua desionizada (DI). Deje que el molde se seque al aire debajo de la campana de flujo laminar.
- Vierta suavemente la mezcla de PDMS sobre el molde, hasta alcanzar la altura final prevista del dispositivo. Para evitar la formación de burbujas de aire, vierta la mezcla suavemente y desde una distancia cercana a la superficie del molde.
- Tapar el molde y trasladarlo durante 18 min a un horno precalentado y estabilizado a 80 °C, para su curado. Para alturas de dispositivo superiores a 5 mm y hasta 1 cm, amplíe el tiempo de curado de 18 a 25 min.
- Debajo de la campana de flujo laminar, separe suavemente el bloque de PDMS curado del molde y sumérjalo en isopropanol durante al menos 10 minutos, dentro de una placa de Petri de vidrio. El isopropanol elimina el PDMS no reticulado. Mantenga siempre cubierto el bloque PDMS.
- Renueve el isopropanol y, bajo un microscopio estereoscópico, corte cuidadosamente la sección cuadrada central del dispositivo (identificada como el área objetivo, en este trabajo) con un cuchillo punzante oftálmico. Luego, proceda a cortar más a lo largo de los bordes para lograr la forma definitiva del dispositivo.
- Recupere el dispositivo del isopropanol y sumérjalo en etanol durante 30 minutos, y luego enjuáguelo 3 veces con agua desionizada estéril. Mantener la esterilidad a partir de este momento.
- Bajo una campana de flujo laminar, transfiera el dispositivo a una nueva placa de Petri, dejando su tapa ligeramente abierta. Deja que se seque completamente al aire.
- Montaje de dispositivos y preparación de sustratos de cultivo celular.
- Esterilice cada matriz de microelectrodos (MEA) sumergiéndola en etanol al 70% durante 30 minutos y luego enjuáguela 3 veces con agua desionizada estéril.
- Usando pinzas finas estériles, bajo una campana de flujo laminar y un microscopio estereoscópico, monte el dispositivo PDMS en el área interna de un MEA. Alinee un lado del dispositivo PDMS con el centro del área MEA interna, con microelectrodos integrados en el sustrato, de modo que queden pocos microelectrodos descubiertos tanto en las áreas de origen como de destino (consulte la Figura 2).
NOTA: Para este trabajo, no es necesario alinear los microelectrodos MEA con el microcanal del dispositivo PDMS. Es posible que se requiera un empuje suave en el dispositivo para lograr un sellado hermético entre el dispositivo PDMS y la superficie MEA. Evite a toda costa tocar los microelectrodos por la punta de las pinzas. - Inserte el MEA con el dispositivo PDMS en la cámara del limpiador de plasma para activar la activación de la superficie a través del plasma de aire. Comience el proceso con una evacuación de la cámara con bomba de vacío de 4 minutos. A continuación, abra ligeramente la válvula de aire para permitir una purga de aire controlada. Cierre la válvula de aire y encienda los inductores de plasma, ajustando el nivel de potencia de RF entre 10 W y 18 W.
- Una vez que aparezca una luz brillante, deje que el proceso se ejecute durante 80 s. Luego, apague el inductor de plasma, cierre la válvula de la bomba de vacío y abra suavemente la válvula de aire. Abra la cámara para recuperar el MEA.
NOTA: Si el tratamiento con plasma implica la exposición de MEA a un ambiente no estéril, coloque cada MEA bajo luz ultravioleta en una campana de flujo laminar durante 30 minutos, para garantizar la esterilidad. - Añadir 1 mL de solución de polietileneimina (PEI) al 0,1% en peso/vol al MEA e incubar a 37 °C durante la noche. Aspire la solución de PEI y enjuague con agua desionizada estéril 5 veces. Agregue 1 ml del medio de cultivo celular al MEA e incélelo antes de la siembra celular.
3. Cultivo de células neuronales y electrofisiología
- Prepare de antemano el medio de disección, la solución de digestión y las soluciones 1-3 (véase la Tabla 1).
- Cultivo de células neuronales disociadas.
- Agarre suavemente por el hocico a un cachorro de rata Wistar neonatal de 0 a 1 días de edad y realice una decapitación rápida con unas tijeras afiladas.
- Retire la piel del cuero cabelludo, haga una incisión a lo largo de la línea media sagital del cráneo con unas tijeras finas y luego cree un corte coronal a través del cráneo en la unión del cerebelo.
- Retire el cráneo, saque el cerebro con una espátula fina y transfiéralo a un medio de disección frío (4 °C).
- Extirpar el tejido subcortical, el hipocampo y las meninges. Picar el tejido en trozos pequeños (es decir, 1-2 mm3) y transferirlos en un tubo de 15 ml. Deseche la solución y enjuague el tejido con un medio de disección fresco, seguido de un lavado con medio de digestión.
- Deseche el medio de digestión, luego agregue 1 ml de solución 1. Incubar la mezcla a 37 °C durante 5 min. Deseche la solución 1 y enjuague el tejido con un medio de disección fresco. A continuación, añadir 1 ml de solución 2 y mantener la mezcla durante 10 min a 4 °C.
- Deseche la solución 2 y enjuague el tejido con un medio de disección fresco. A continuación, agregue 1 ml de solución 3. Disocie mecánicamente las células pipeteando lentamente hacia arriba y hacia abajo la solución de 20 a 30 veces. A medida que aparece una mezcla uniformemente turbia de células disociadas, aumente su volumen a 3 ml agregando medio de disección.
- Recoja el gránulo de celda centrifugando la mezcla a 100 x g durante 5 min. Aspirar el sobrenadante y resuspender el gránulo celular en 1 ml de medio de cultivo precalentado.
- Cuente las células (es decir, mediante una cámara de recuento de células) y ajuste la densidad de la solución de siembra celular en consecuencia.
- Siembre cada MEA con 1 mL de solución de siembra con una densidad celular nominal de 1,8 x 106 (~ 6500 células/mm2). Incubar los MEAs sembrados en una incubadora húmeda a 37 °C y 5% de CO2. Cambie el medio por un medio de cultivo fresco (es decir, hecho semanalmente) cada 2 días.
- Electrofisiología extracelular
NOTA: Los cultivos celulares neuronales disociados alcanzan un fenotipo eléctrico completamente maduro después de 2-3 semanas in vitro. En las siguientes secciones se describe un protocolo de estimulación extracelular utilizando un software de aplicación MEA comercial (Experimenter) para estimular eléctricamente cualquiera de las poblaciones neuronales cultivadas en módulos, es decir, Fuente o Objetivo, mientras se registra simultáneamente la actividad de ambas poblaciones, en redes maduras.- Monte suavemente un MEA dentro de la cabecera del amplificador electrónico multicanal, dentro de una incubadora seca (37 °C, 5% CO2) y deje que se acomode durante 10 minutos. Se puede fabricar una tapa de PDMS personalizada por separado y usarla como una cubierta hermética para cada MEA, para reducir la evaporación del agua y mantener la esterilidad.
- Inicie el software Experimenter. Ajuste la frecuencia de muestreo a 25 kHz e inicie la adquisición de datos pulsando Start DAQ. En el panel Visualización de datos, aparecen las trazas sin procesar de la actividad registrada extracelularmente para cada canal.
- Supervise la actividad espontánea e identifique visualmente y seleccione 3 pares de microelectrodos vecinos que estén activos durante las ráfagas de ráfagas de actividad sincronizada espontánea en toda la red, ya sea desde los microelectrodos del lado de origen o de destino.
- En el panel estimulador del software, configure los parámetros para cada uno de los pares de microelectrodos estimulantes en configuración bipolar: seleccione una forma de onda de pulso bifásica y ajuste las amplitudes de pico a ± 800 mV, y la duración del pulso a 200 μs.
- Ajuste la grabadora y grabe durante un período de 300 ms antes a 1000 ms después de la estimulación.
- Repita los pasos 3.3.3 a 3.3.5 para el lado de origen y el lado de destino de forma intercalada durante el número requerido de repeticiones.
Resultados
Aquí se informa de la fabricación de un dispositivo de cultivo celular polimérico (neuronal) de 2 compartimentos, que ejemplifica el uso de la impresión 3D 2PP para la creación rápida de prototipos de dispositivos PDMS. En concreto, se produce un dispositivo para redes neuronales modulares con conectividad sináptica unidireccional y se presenta su caracterización funcional en términos de electrofisiología extracelular multisitio. Brevemente, se realizó un molde a escala micrométrica por medio de escritura láser directa, utilizando una impresora 3D disponible en el mercado. En particular, la impresora ofrece una potencia de 50 mW a través de pulsos láser con una longitud de onda central de 780 nm y una duración de 80 a 100 fs. Durante el proceso de fabricación, el rayo láser se enfoca a través del objetivo (25x, NA = 0,8) de la impresora sobre la fotorresistencia de tono negativo (IP-S) para escanear el volumen de impresión utilizando el escáner galvo para los ejes x e y, y la etapa piezoeléctrica para el eje z. El volumen de impresión se dividió adecuadamente en bloques de 200 mm x 200 mm x 265 mm para realizar un molde con un tamaño total de 6500 mm x 6500 mm x 545 mm y un volumen nominal de 12.423 mL. La Figura 2A representa un boceto 2D del molde, destacando sus dimensiones y el tamaño de sus características, mientras que la Figura 2B muestra una foto en primer plano del dispositivo terminado montado en un MEA. Los moldes preparados como se describe en la sección anterior eran duraderos y podían reutilizarse más de 50 veces para fabricar dispositivos PDMS.
El molde impreso se utilizó para fundir el dispositivo PDMS, que luego se montó en el área interna de matrices integradas de microelectrodos (MEA) integradas en sustrato de vidrio, para ser utilizado para registros extracelulares multisitio de la actividad eléctrica neuronal y como prueba de principio. Se utilizaron MEAs comerciales integrados en sustrato para monitorizar la actividad de los cultivos modulares en respuesta a estímulos eléctricos localizados espacialmente administrados extracelularmente por un subconjunto de microelectrodos situados en cada compartimento de cultivo. Cada MEA contiene 120 microelectrodos de nitrato de titanio (TiN) con un diámetro de 30 μm y un paso entre electrodos de 100 μm. La Figura 2C-D muestra la ubicación del dispositivo PDMS en la parte superior del MEA. Las características geométricas de los microcanales individuales del dispositivo, junto con la huella general de la cámara que se muestra en la Figura 2C, conducen a una compartimentación de las neuronas cultivadas. Estos se pueden distinguir en función del compartimento al que pertenecen, en la zona exterior (Fuente) del dispositivo, o en la zona interior (Destino) del dispositivo. La guía axonal preferida, restringida desde la Fuente hasta el Objetivo, está dictada por los bordes de ángulo agudo de los microcanales. La Figura 2D muestra la ubicación del dispositivo polimérico en el MEA y el área de cobertura relativa de los electrodos de registro ubicados dentro de los compartimentos de Fuente o Destino. Tenga en cuenta que no se requirió una alineación precisa del interior de los microcanales del dispositivo con una o más filas de microelectrodos MEA para nuestro estudio de caso ni se llevó a cabo.
En la Figura 3, durante el desarrollo ex vivo, se proporciona evidencia representativa del crecimiento asimétrico de neuritas marcadas con fluorescencia en imágenes en vivo, 6 días (Figura 3A) y 2 días después de la siembra celular (Figura 3B-D). Mientras que las neuritas en el lado objetivo del dispositivo se encontraron con barreras de ángulo agudo como obstáculos que impedían su progresión a través del espacio, las neuritas que se originaban en el lado de la fuente crecieron ininterrumpidamente y cruzaron los canales. Esta asimetría favorece una conexión axonal unidireccional entre las neuronas de los dos compartimentos, proyectándose de Fuente a Objetivo, tal y como se pretende explícitamente en el diseño. Este resultado se ve respaldado por una evaluación electrofisiológica (funcional) de las respuestas eléctricas evocadas por los estímulos administrados alternativamente en cada uno de los dos compartimentos.
Después de 3-4 semanas in vitro, cuando las redes neuronales alcanzaron la madurez completa29,30, la conectividad funcional a través de los dos compartimentos pudo ser probada mediante la entrega de breves estímulos eléctricos y el monitoreo de las respuestas neuronales que evocaron31. A continuación, se aplicaron impulsos eléctricos bifásicos con una amplitud de 800 mV alternativamente sólo a la fuente o sólo a las poblaciones diana (N repeticiones = 150, N cultivos modulares = 6), suministrados por 3 pares yuxtapuestos de microelectrodos planos en una configuración bipolar, y de forma intercalada. Por lo tanto, los 3 pares de electrodos podrían ubicarse dentro del área de la fuente del MEA o dentro del área objetivo del MEA. Las respuestas eléctricas evocadas por cada estímulo podrían ser detectadas por todos los microelectrodos de MEA después de un retraso de propagación. Las grabaciones se realizaron con una frecuencia de muestreo de 25 kHz/canal, y las señales eléctricas extracelulares en bruto resultantes se digitalizaron a una resolución de conversión de analógico a digital de 16 bits. Se utilizó un algoritmo de detección de picos de cruce de umbral32 fuera de línea para detectar el tiempo de ocurrencia de potenciales de acción extracelulares, sin realizar ninguna clasificación de picos. La Figura 4A-B revela claramente una fuerte asimetría de las respuestas evocadas, repetidas 150 veces, dependiendo de la ubicación de la entrega del estímulo, lo que sugiere un impacto funcional significativo de las restricciones geométricas en la direccionalidad preferida de la conectividad. De hecho, al estimular el lado de la Fuente, la tasa de disparo de la población neuronal de la Fuente, estimada mediante el cálculo del histograma de los tiempos de pico del periestímulo, aumentó como se esperaba generando una explosión completa de la red de potenciales de acción 33,31,34 y fue seguida, después de un retraso, por un aumento en la tasa de disparo de la población Objetivo. Sin embargo, a medida que la estimulación se administró dentro de la población objetivo, solo aumentó la tasa de disparo de la población objetivo, y la población fuente permaneció mayormente en silencio. La figura 4C-D repite el mismo paradigma de estímulo/respuesta en un cultivo de control, sin ningún dispositivo polimérico presente (es decir, un cultivo neuronal no estructurado), los estímulos extracelulares también se administraron en 4 repeticiones. Para tales condiciones de control, no se produjo ninguna asimetría en las respuestas evocadas por ninguno de los estímulos. Si bien el subconjunto de microelectrodos MEA utilizados para administrar los estímulos coincidió con el utilizado en las redes modulares, la ubicación de la administración del estímulo condujo a una respuesta evocada similar de toda la población. Esto confirma que el dispositivo PDMS favoreció la conectividad sináptica unidireccional, a través de los dos compartimentos. En general, las respuestas asimétricas evocadas en cultivos modulares (N = 6) y las respuestas simétricas evocadas en cultivos control (N = 4) indican fuertemente una conectividad anatómica restringida de un sistema in vitro compartimentado. Los datos electrofisiológicos y los scripts utilizados para generar la Figura 4, están disponibles a través de Zenodo (https://doi.org/10.5281/zenodo.8220990).
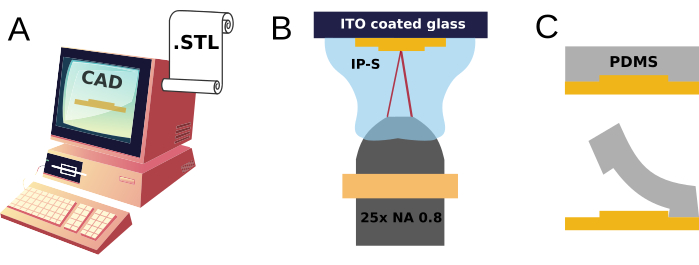
Figura 1: Croquis de la fabricación del micromolde de 2PP y la moldura de réplica de PDMS. (A) Un modelo 3D se diseña en CAD y se exporta en un archivo de formato de lenguaje de teselación estándar (STL), (B) instruyendo su impresión 3D de 2 fotones a través de la polimerización inducida por láser dentro de una gota de resina (IP-S). (C) La estructura resultante se utiliza como molde para la fabricación repetida de réplicas de PDMS. Haga clic aquí para ver una versión más grande de esta figura.
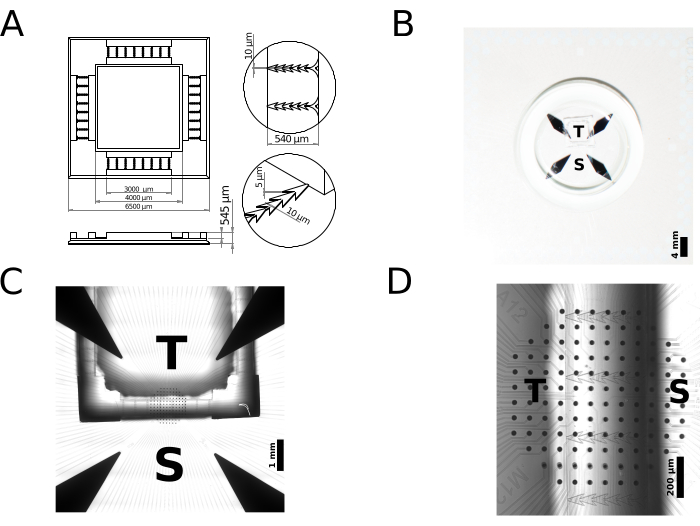
Figura 2: Ejemplo de prototipado rápido interno de un dispositivo PDMS de cultivo celular polimérico (neuronal). (A) En menos de 24 h, la fabricación aditiva a microescala permite pasar de un modelo CAD a un máster impreso en 3D, para ser utilizado de forma inmediata, y repetida, como réplica de molde con elastómeros biocompatibles, como el PDMS. (B-C) Los dispositivos PDMS resultantes se acoplan a un sustrato plano de cultivo celular neuronal, aquí representado por una matriz de microelectrodos. Para el diseño de muestra específico en (A), se definen dos cámaras: una denominada Fuente e indicada por S, y la otra denominada Objetivo e indicada por T. (D) Las neuronas colocadas en cada cámara solo pueden hacer crecer sus neuritas a través de una serie de microcanales. Cuando se alinean adecuadamente bajo la guía de microscopía estereoscópica en (C), dos conjuntos de microelectrodos integrados en el sustrato se dejan expuestos, de modo que se pueda estimular y registrar la actividad bioeléctrica de las neuronas cercanas ubicadas en ambos compartimentos. Tenga en cuenta aquí que la alineación de microelectrodos dentro de microcanales individuales no era la prioridad de esta prueba de principio. Haga clic aquí para ver una versión más grande de esta figura.
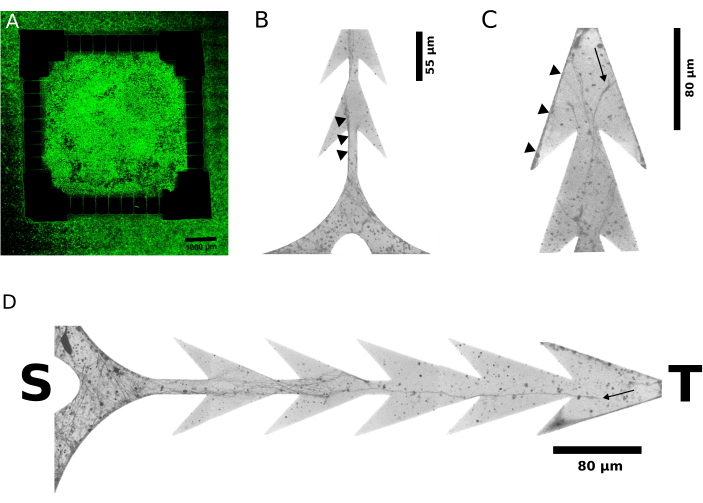
Figura 3: Imágenes en vivo de moléculas reporteras fluorescentes impermeabilizadas por células, identifica neuritas alargadas por neuronas, pocos días después de la colocación de placas celulares. (A-D) Se han adquirido micrografías de fluorescencia confocal representativas de cultivos neuronales modulares del dispositivo fabricados a partir de la Figura 1 y la Figura 2 (N = 4, 128 microcanales individuales) 2 y 6 días después de la siembra de las células. (B-D) El aumento de 40x y una escala de grises invertida de las micrografías para una mayor visibilidad. Las terminaciones de los microcanales de los compartimentos Origen y Destino se indican con S y T, respectivamente. (A) muestra la imagen de barrido amplio del cultivo, donde la fuente (es decir, el área cuadrada interior) y el objetivo (es decir, el área exterior) están llenos de células, 6 días después de la siembra. (B) y (C) muestran, en el punto de tiempo más temprano de 2 días después de la siembra, el crecimiento de neuritas en los lados Fuente y Objetivo de los microcanales, respectivamente. Los pequeños triángulos negros indican ejemplos representativos de terminales de haces de axones putativos, aparentemente originados solo en la Fuente. Los límites de los microcanales en forma de flecha apuntan a la elongación de las neuritas a lo largo del borde (B), donde su paso es ininterrumpido y guiado hacia el objetivo. En la dirección opuesta, y junto a la terminación del objetivo de un microcanal (C), las neuritas que se originan en el objetivo y avanzan hacia el lado de la fuente quedan atrapadas en las esquinas afiladas. (D) revela además los detalles del crecimiento de neuritas dentro de un microcanal. Haga clic aquí para ver una versión más grande de esta figura.
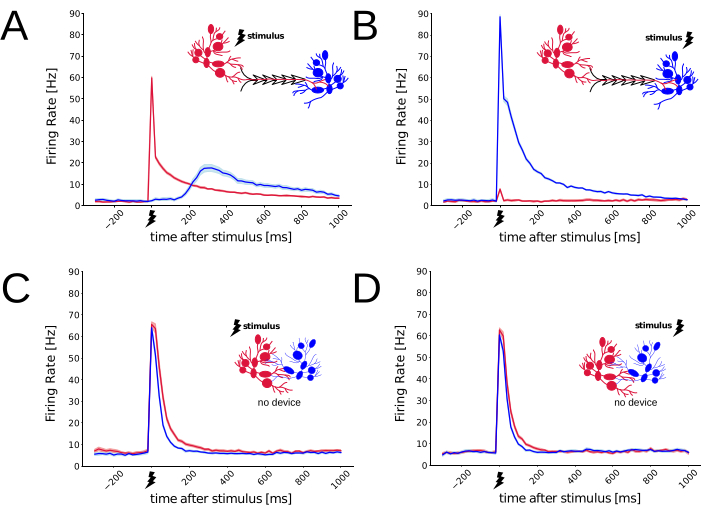
Figura 4: Caracterización funcional de las respuestas eléctricas neuronales, con y sin el dispositivo PDMS. Los MEA se utilizaron como sustratos de cultivo celular y se emplearon para medir las respuestas de picos en toda la red evocadas por un pulso de estimulación eléctrica bifásico muy breve (es decir, 200 μs, 0,8 V), administrado en una configuración bipolar. Con el dispositivo PDMS de la Figura 2, las respuestas de picos neuronales registradas desde la Fuente (rojo) y desde el Objetivo (azul) difieren, dependiendo de dónde se administre el estímulo. Los retrasos axonales, sinápticos y de integración putativos se hacen evidentes en (A) pero no en (B), lo que sugiere que existe una conectividad sináptica preferida (es decir, de origen a destino). (C-D) En condiciones de control (es decir, sin dispositivo PDMS), las respuestas evocadas detectadas en dos conjuntos distintos de microelectrodos MEA no dependen de la ubicación de administración del estímulo. El sombreado de tonos pálidos, que envuelve las líneas en los gráficos, denota el error estándar instantáneo de la media (N estímulos = 150). Haga clic aquí para ver una versión más grande de esta figura.
| Nombre de la solución | Composición | ||
| polietilemina (PEI) 0,1% | 1 mL de solución madre de PEI, 9 mL de agua desionizada (DI) estéril. | ||
| Medio de cultivo (50 mL) | Medio esencial mínimo (MEM), complementado con 20 μM de glucosa, 50 μg/mL de gentamicina, 50 μM de L-glutamina y 10% de suero de caballo inactivado por calor. | ||
| Medio de disección (1000 mL) | Sales equilibradas Hanks 9,52 g, Bicarbonato de sodio 350 mg, HEPES 2,83 g, D-(+)-glucosa 6 g, Ácido cinurénico (concentración final 200 μM), D-AP5 (concentración final 25 μM), Gentamicina 250 μl, Albúmina sérica bovina 300 mg, Sulfato de magnesio 1,44 g. Ajustar el pH a 7,3, proteger de la luz y conservar a 4°C. | ||
| Medio de digestión (100 mL) | Cloruro de sodio 800 mg, Cloruro de potasio 37 mg, hidrogenofosfato disódico 99 mg, HEPES 600 mg, Bicarbonato de sodio 35 mg, Ácido quinúnico, 200 μL (de stock de 100 mM), D-AP5 100 μL (de stock de 25 mM). Ajustar el pH a 7,4, proteger de la luz y conservar a 4 °C. | ||
| Solución 1 | Tripsina 5 mg, Desoxirribonucleasa I 1,5 mg, en 2 mL de medio de digestión. | ||
| Solución 2 | Inhibidor de tripsina 5 mg, en 5 mL de medio de disección. | ||
| Solución 3 | Desoxirribonucleasa I 1,5 g, en 2,5 mL de medio de disección. | ||
Tabla 1: Tabla de soluciones. Consulte la tabla de materiales para ver las descripciones de los productos.
Archivo de codificación suplementario 1: El archivo de diseño STL corresponde a la estructura representada en la Figura 2A. Haga clic aquí para descargar este archivo.
Discusión
A pesar de tener décadas de antigüedad, la aplicación de la tecnología 2PP en el moldeo de réplicas basadas en PDMS a escala micrométrica es un desarrollo reciente43,44. En este contexto, a continuación se analizan una serie de puntos para ayudar a los usuarios a reproducir eficazmente esta obra.
Para el diseño de modelos 3D, asegúrese de que el modelo no tenga agujeros ni autointersecciones. Privilegie el formato de archivo binario al guardar como STL, por su tamaño de archivo más pequeño que el codificado en ASCII. Esto es especialmente beneficioso para diseños con geometrías intrincadas y para objetos de mililitros de ancho. El uso de archivos STL binarios también implica una baja carga de CPU, más adelante en el proceso de preparación de la pieza mecánica para ser impresa en 3D. Las dimensiones físicas de las entidades dentro del archivo STL se representan en unidades adimensionales. Durante el posprocesamiento del archivo STL, las unidades se interpretan como micrómetros. Por lo tanto, se recomienda adoptar por adelantado la unidad de interés, es decir, micrómetro, al preparar el archivo. La precisión del modelo impreso viene determinada por el número de superficies que se aproximan a los triángulos teselados. Para un número insuficiente de superficies, surgirá una rugosidad superficial no deseada. No obstante, apuntar a una precisión excesivamente alta por parte de un gran número de superficies tiene el precio de una alta carga computacional, lo que hace que el procesamiento del archivo sea lento.
Para la impresión 3D, durante la impresión, el objeto físico 3D se forma mediante un escaneo galvo rápido en el plano x-y y un movimiento piezoeléctrico en la dirección z. Esto enfoca el rayo láser de femtosegundos dentro de cualquier vóxel 3D dado. Sin embargo, cuando las estructuras de impresión son más grandes que los rangos de cobertura espacial de galvo y piezoeléctrico, el objeto debe dividirse mediante programación en bloques. Si bien este es un requisito para las piezas impresas de tamaño milimétrico, las uniones entre bloques están asociadas a líneas de costura (imperfectas). La optimización cuidadosa del recuento de bloques y la colocación de las líneas de costura en las direcciones x, y y z son cruciales para evitar la interrupción de las características geométricas críticas del objeto final con las líneas de unión. Las burbujas pueden formarse en la interfaz de impresión por varias razones (por ejemplo, las impurezas e inhomogeneidades de los sustratos fotorresistentes) y afectar negativamente a la calidad e integridad de la estructura impresa. Además, una mayor potencia del láser puede conducir a un aumento en su aparición. La reducción de la potencia del láser, en la capa más baja de la pieza impresa, minimizará las posibilidades de formación de burbujas. Como alternativa a la impresión de toda la pieza como una estructura sólida, se puede considerar el método de carcasa y andamio. Consiste en imprimir solo la superficie exterior de la pieza (carcasa), así como los elementos de prisma triangular dentro de ella. Estos elementos están separados por capas horizontales (andamio), sosteniendo la resina no polimerizada en pequeñas bolsas. Este método acorta significativamente el tiempo de impresión, especialmente para estructuras de tamaño milimétrico. Sin embargo, como la resina no polimerizada permanece, la exposición a los rayos UV posterior a la impresión es imprescindible para garantizar una estabilidad mecánica completa, aunque este paso debe realizarse con suavidad para evitar cualquier deformación de la pieza impresa. El tiempo de poscurado depende de la resina elegida, el grosor de la pieza y la potencia UV40. Para obtener resultados óptimos, se recomienda realizar un ensayo inicial para estimar el tiempo necesario para el curado en profundidad completa, utilizando una gota de fotorresistencia y evaluando su corte en sección, después de la exposición a los rayos UV. El período de curación habitual oscila entre 5 y 20 min.
Para el moldeo de réplicas de PDMS, la fabricación limpia de un dispositivo PDMS con características de escala micrométrica, sin instalaciones de sala limpia, puede ser un desafío: las micropartículas transportadas por el aire pueden residir en la superficie altamente adhesiva del PDMS y dificultar el sellado entre el dispositivo y el sustrato, o bloquear la sección de microcanales individuales. Realizar los pasos del protocolo bajo una campana de flujo laminar y proteger constantemente la superficie del PDMS con isopropanol minimiza sustancialmente los riesgos de contaminación. La temperatura de curado y su duración afectan directamente a la reticulación del PDMS y a las propiedades físicas resultantes. En particular, la adhesividad del PDMS curado es un factor crítico. Por un lado, se requiere un sello hermético entre el dispositivo PDMS y la superficie utilizada para el cultivo de células neuronales (por ejemplo, un cubreobjetos de vidrio o un MEA), para restringir eficazmente el paso de las neuritas. Por otro lado, el dispositivo PDMS debe adherirse a la superficie de forma reversible, de modo que la delicada capa aislante MEA no se dañe después de retirar el dispositivo. Si bien se produce una contracción de PDMS durante el curado y puede corregirse volviendo a escalar el molde por adelantado, para las temperaturas y los intervalos de curado indicados aquí, la contracción será inferior al 2%42 y no afectará significativamente a los dispositivos de PDMS de una sola capa. En general, siga con precisión los valores recomendados de temperatura y duración de curado, para obtener los mejores resultados.
Resumen de las ventajas y limitaciones del método
Se propone una técnica basada en la escritura láser directa de 2 fotones para la fabricación rápida de dispositivos poliméricos a microescala para el estudio experimental de redes neuronales modulares. A diferencia de la fotolitografía blanda, el enfoque propuesto no requiere un alto nivel de experiencia técnica, siempre que se pueda acceder y operar una configuración funcional de impresión 3D de 2PP. Sorprendentemente, el método permite pasar de un modelo 3D diseñado por CAD a un dispositivo PDMS funcional en un solo día, proporcionando así un camino directo y eficiente desde el concepto hasta la realización tangible. En concreto, optar por el modo de impresión de carcasa y andamio reduce significativamente el tiempo necesario para crear el molde, ya que solo se imprime una fracción de su volumen. El curado UV posterior del componente impreso garantiza su estabilidad mecánica y robustez, como se verifica aquí a lo largo de 50 ciclos de fundición con PDMS.
En comparación con los métodos tradicionales, la impresión 3D 2PP cuenta con una clara ventaja, que es más pronunciada cuando se trata de la fabricación de moldes con una relación de aspecto significativa, requisitos de resolución exigentes y geometrías tridimensionales complejas. La producción de moldes maestros mediante litografía UV estándar está limitada por un espesor de resistencia de aproximadamente 200 μm. Se requieren secuencias intrincadas de ciclos de recubrimiento por centrifugado y exposición35, costosos procesos LIGA (litografía, galvanoplastia y moldeo) o grabado iónico reactivo profundo (DRIE)36 36 para lograr una mayor altura y relaciones de aspecto. En marcado contraste, como se demostró en el trabajo pionero de Kumi et al. en 201037, la técnica 2PP ofrece un alcance esencialmente ilimitado para la relación de aspecto de las piezas impresas, que abarca desde submicrómetros hasta milímetros. Aquí, se ha ejemplificado el proceso de microfabricación de un molde con una diferencia significativa en la altura de sus porciones, con una distinción de más de 100 veces entre la altura de los microcanales (5 μm) y la altura máxima del molde (545 μm; ver Figura 2).
Además, la resolución submicrométrica podría lograrse fácilmente siguiendo las especificaciones del protocolo descritas. En comparación, lograr resoluciones de molde mejoradas a través de la fotolitografía UV exige una inversión de capital. Las máscaras con la resolución más fina, que utilizan deposición de cromo sobre cuarzo a una resolución nominal de 600 nm, tienen un precio varios órdenes de magnitud más alto que las máscaras de transparencia aéreas impresas con láser, que poseen una resolución de 250 μm35, sin embargo, véase el trabajo de Pirlo et al.41. Para que sea viable para el uso interno, el método elegido debe ser rentable. Para muchos laboratorios biológicos, el gasto total asociado con la fotolitografía blanda convencional o la escritura láser directa presenta una barrera. Si bien es factible hacer que ambas tecnologías sean más accesibles mediante la compra y el ensamblaje de los componentes esenciales, este enfoque exige experiencia adicional y aún requiere una inversión notable. En este contexto, un punto esencial a tener en cuenta es el amplio espectro de aplicaciones que se pueden lograr a través de la escritura láser directa. A diferencia de la fotolitografía blanda convencional, limitada principalmente a la microfabricación de moldes, la impresión 3D 2PP exhibe una notable versatilidad. Sus aplicaciones potenciales abarcan desde la microfluídica y la microóptica hasta la fotónica integrada y la micromecánica. Esto hace que invertir en esta tecnología sea atractivo como una instalación compartida para múltiples y diversos campos científicos. Por ejemplo, la metodología basada en 2PP ideada en este protocolo es el resultado de una colaboración interdisciplinaria entre los departamentos de neurociencia y matemáticas de nuestra institución. Además, el desarrollo de fotorresistencia es un campo activo de investigación y puede ampliar potencialmente la gama de aplicaciones de la impresión 3D 2PP. Un ejemplo de ello es la reciente introducción de la resina IP-PDMS. Al polimerizar en estructuras con propiedades como PDMS38, esta resina desbloquea el potencial para la microfabricación directa de componentes biocompatibles que tienen una superficie enrevesada o contienen espacios huecos. Estas complejidades se erigen como barreras para lograr resultados similares a través de los procedimientos convencionales de moldeo de réplicas.
Como demostración de este método, se proporcionó evidencia que sugiere el desarrollo de conectividad unidireccional entre dos módulos en una red neuronal modular. El molde a microescala, fabricado con la técnica 2PP, tenía suficiente resistencia para someterse a múltiples fundiciones de PDMS y tiene la precisión a microescala requerida. En conclusión, el ámbito de aplicación del protocolo descrito en este trabajo se extiende más allá del caso ilustrado. A medida que el acceso a la tecnología de impresión 2PP se generalice cada vez más, la inversión inicial necesaria para su implementación disminuirá, mientras que su gama de aplicaciones potenciales se ampliará.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
M.G. agradece el apoyo financiero del Programa Marco H2020 de la Unión Europea a través del Consejo Europeo de Innovación (proyecto IN-FET, GA n. 862882, proyecto Arbor-IO, FLAG-ERA y Human Brain Project, ID 650003) y de SISSA (Área de Neurociencias). G.N. agradece el apoyo financiero del Ministerio de Universidad e Investigación de Italia (MUR) a través de la beca Dipartimenti di Eccellenza 2018-2022 (Área de Matemáticas). Agradecemos a M. Gigante, B. Pastore y M. Grandolfo por su ayuda con la impresión 3D, el cultivo celular y la imagen en vivo, así como a los Dres. P. Massobrio, P. Heppenstall, L. Ballerini, Di Clemente y H.C. Schultheiss por las discusiones. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Propanol | Sigma-Aldrich | 650447 | |
| BB cure compact polymerizer | PCube Srl | Wavelengths 365-405 nm, Power 120W | |
| BioMed Amber Resin 1 L | formlabs | Resin used for mounting the 3D Printed mold to Petri dish | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| CAD application software SolidWorks | Dassault Systèmes SolidWorks Corporation, US | Fusion 360 (Autodesk Inc., US), AutoCAD (Autodesk Inc., US), PTC Creo (PTC corp., US), SolidWorks (Dassault Systèmes SolidWorks corp., US) and Tinkercad (Autodesk Inc., US). -------------------------------------- Tutorials: https://www.mycadsite.com/tutorials.html Trainings: https://www.autodesk.com/training | |
| CellTracker Green CMFDA | Invitrogen | C7025 | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| D-AP5 | Tocris | #0106 | |
| Deoxyribonuclease I | Sigma-Aldrich | D5025 | |
| DeScribe | Nanoscribe GmbH & Co. KG | ||
| di-Sodium hydrogen phosphate | Sigma-Aldrich | 106585 | |
| Gentamicin | Thermo Fisher | 15710049 | |
| Hanks′ Balanced Salts | Sigma-Aldrich | H2387 | |
| HEPES | Sigma-Aldrich | H7523 | |
| Horse Serum | Sigma-Aldrich | H1138 | |
| in vitro MEA recording system MEA2000 mini | Multichannel Systems GmBH, Reutlingen, Germany | ||
| IP-S Photoresist | Nanoscribe GmbH & Co. KG | ||
| Kynurenic acid | Sigma-Aldrich | K3375 | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Magnesium sulfate | Sigma-Aldrich | M2643 | |
| MEA recording application software (Experimenter) | Multichannel Systems GmBH, Reutlingen, Germany | ||
| Minimum Essential Medium | Sigma-Aldrich | 51412C | |
| NanoWrite | Nanoscribe GmbH & Co. KG | ||
| ophthalmic stab Knife 15° | HESTIA Medical | ||
| Photonic Professional GT2 (PPGT2) 3D printer | Nanoscribe GmbH & Co. KG | SN617 | |
| Plasma Cleaner | HARRICK PLASMA | ||
| Poly(ethyleneimine) solution | Sigma-Aldrich | P3143 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Propylene glycol methyl ether acetate (PGMEA) | Sigma-Aldrich | 484431 | |
| Repel-silane ES | Sigma-Aldrich | GE17133201 | |
| Soda lime ITO-coated substrates for 3D MF DiLL | Nanoscribe GmbH & Co. KG | ||
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Substrate-integrated planar MEAs (120MEA100/30iR-ITO-gr) | Multichannel Systems GmBH, Reutlingen, Germany | TiN electrodes, SiN isolator, 4 internal reference electrodes,120 recording electrodes, Electrode spacing 100 µm,Electrode diameter 30 µm | |
| SYLGARD 184 Kit | Dow Corning | ||
| Trypsin | Sigma-Aldrich | T1005 | |
| Trypsin inhibitor | Sigma-Aldrich | T9003 | |
| vacuum pump Single phase asynchronous 2 poles | CIMAMOTORI |
Referencias
- Kanagasabapathi, T. T., et al. Dual-compartment neurofluidic system for electrophysiological measurements in physically segregated and functionally connected neuronal cell culture. Front Neuroeng. 4, 13 (2011).
- Maeda, E., Robinson, H. P. C., Kawana, A. The mechanisms of generation and propagation of synchronized bursting in developing networks of cortical neurons. J Neurosci. 15 (10), 6834-6845 (1995).
- Wheeler, B. C., Brewer, G. J. Designing neural networks in culture. Proc IEEE Inst Electr Electron Eng. 98 (3), 398-406 (2010).
- DeMarse, T. B., Pan, L., Alagapan, S., Brewer, G. J., Wheeler, B. C. Feed-forward propagation of temporal and rate information between cortical populations during coherent activation in engineered in vitro networks. Front Neural Circuits. 10, 32 (2016).
- Kanagasabapathi, T. T., et al. Functional connectivity and dynamics of cortical-thalamic networks co-cultured in a dual compartment device. J Neural Eng. 9 (3), 036010 (2012).
- Brofiga, M., Pisano, M., Tedesco, M., Raiteri, R., Massobrio, P. Three-dimensionality shapes the dynamics of cortical interconnected to hippocampal networks. J Neural Eng. 15 (5), 056044 (2020).
- Bisio, M., Bosca, A., Pasquale, V., Berdondini, L., Chiappalone, M. Emergence of bursting activity in connected neuronal sub-populations. PLoS One. 9 (9), e107400 (2014).
- Hasan, M. F., Berdichevsky, Y. Neural circuits on a chip. Micromachines. 7 (9), 157 (2016).
- Aebersold, M. J., et al. 34;Brains on a chip": Towards engineered neural networks. TrAC Tren Anal Chem. 78, 60-69 (2016).
- Zamora-López, G., Chen, Y., Deco, G., Kringelbach, M. L., Zhou, C. Functional complexity emerging from anatomical constraints in the brain: The significance of network modularity and rich-clubs. Sci Rep. 6, 38424 (2016).
- Eytan, D., Marom, S. Dynamics and effective topology underlying synchronization in networks of cortical neurons. J Neurosci. 26 (33), 8465-8476 (2006).
- Pan, L., Alagapan, S., Franca, E., Brewer, G. J., Wheeler, B. C. Propagation of action potential activity in a predefined microtunnel neural network. J Neural Eng. 8 (4), 046031 (2011).
- Virlogeux, A., et al. Reconstituting corticostriatal network on-a-chip reveals the contribution of the presynaptic compartment to Huntington's disease. Cell Rep. 22 (1), 110-122 (2018).
- Kleinfeld, D., Kahler, K., Hockberger, P. E. Controlled outgrowth of dissociated neurons on patterned substrates. J Neurosci. 8 (11), 4098-4120 (1988).
- Vogt, A. K., Wrobel, G., Meyer, W., Knoll, W., Offenhäusser, A. Synaptic plasticity in micropatterned neuronal networks. Biomaterials. 26 (15), 2549-2557 (2005).
- Staii, C., et al. Positioning and guidance of neurons on gold surfaces by directed assembly of proteins using atomic force microscopy. Biomaterials. 30 (20), 3397-3404 (2009).
- Fricke, R., et al. Axon guidance of rat cortical neurons by microcontact printed gradients. Biomaterials. 32 (8), 2070-2076 (2011).
- Gladkov, A., et al. Design of cultured neuron networks in vitro with predefined connectivity using asymmetric microfluidic channels. Sci Rep. 7 (1), 15625 (2017).
- le Feber, J., Postma, W., de Weerd, E., Weusthof, M., Rutten, W. L. Barbed channels enhance unidirectional connectivity between neuronal networks cultured on multi electrode arrays. Front Neurosci. 9, 412 (2015).
- Peyrin, J. M., et al. Axon diodes for the reconstruction of oriented neuronal networks in microfluidic chambers. Lab Chip. 11 (21), 3663-3673 (2011).
- Xia, Y., Whitesides, G. M. Soft lithography. Angewandte Chemie - International Edition. 37 (5), 550-575 (1998).
- Qi, D., Hoelzle, D. J., Rowat, A. C. Probing single cells using flow in microfluidic devices. Eur Phys J Spec Top. 204, 85-101 (2012).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. J Vis Exp. (119), e55276 (2017).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. (153), e60307 (2019).
- Maruo, S., Nakamura, O., Kawata, S. Three-dimensional microfabrication with two-photon-absorbed photopolymerization. Opt Lett. 22 (2), 132-134 (1997).
- Baldacchini, T. . Three-dimensional microfabrication using two-photon polymerization: Fundamentals, technology, and applications. , (2015).
- Madou, M. J. . Fundamentals of Microfabrication. , (2018).
- Sun, H. B., Kawata, S. Two-photon photopolymerization and 3D lithographic microfabrication. NMR, 3D Anal, Photopolymeriz. Adv Poly Sci. 170, 169-273 (2004).
- Marom, S., Shahaf, G. Development, learning and memory in large random networks of cortical neurons: Lessons beyond anatomy. Q Rev Biophys. 35 (1), 63-87 (2002).
- Kamioka, H., Maeda, E., Jimbo, Y., Robinson, H. P. C., Kawana, A. Spontaneous periodic synchronized bursting during formation of mature patterns of connections in cortical cultures. Neurosci Lett. 206 (2-3), 109-112 (1996).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to culture, record and stimulate neuronal networks on micro-electrode arrays (MEAs). J Vis Exp. (39), e2056 (2010).
- Mahmud, M., Pulizzi, R., Vasilaki, E., Giugliano, M. QSPIKE tools: A generic framework for parallel batch preprocessing of extracellular neuronal signals recorded by substrate microelectrode arrays. Front Neuroinform. 8, 26 (2014).
- Pulizzi, R., et al. Brief wide-field photostimuli evoke and modulate oscillatory reverberating activity in cortical networks. Sci Rep. 6 (1), 24701 (2016).
- Scarsi, F., Tessadori, J., Chiappalone, M., Pasquale, V. Investigating the impact of electrical stimulation temporal distribution on cortical network responses. BMC Neurosci. 18 (1), 49 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Kim, K., et al. Rapid replication of polymeric and metallic high aspect ratio microstructures using PDMS and liga technology. Microsystem Technologies. 9 (1-2), 5-10 (2002).
- Kumi, G., Yanez, C. O., Belfield, K. D., Fourkas, J. T. High-speed multiphoton absorption polymerization: Fabrication of microfluidic channels with arbitrary cross-sections and high aspect ratios. Lab Chip. 10 (8), 1057-1060 (2010).
- Bunea, A. I., et al. et al.Micro 3D printing by two-photon polymerization: Configurations and parameters for the nanoscribe system. Micro. 1 (2), 164-180 (2021).
- Taylor, A., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nat Methods. 2 (8), 599-605 (2005).
- Oakdale, J. S., Ye, J., Smith, W. L., Biener, J. Post-print UV curing method for improving the mechanical properties of prototypes derived from two-photon lithography. Opt. Express. 24 (24), 27077-27086 (2016).
- Pirlo, R. K., Sweeney, A. J., Ringeisen, B. R., Kindy, M., Gao, B. Z. Biochip/laser cell deposition system to assess polarized axonal growth from single neurons and neuron/glia pairs in microchannels with novel asymmetrical geometries. Biomicrofluidics. 5 (1), 13408 (2011).
- Madsen, M. H., Feidenhans'l, N. A., Hansen, P. E., Garnæs, J., Dirscherl, K. Accounting for PDMS shrinkage when replicating structures. J Micromech Microeng. 24 (12), 127002 (2014).
- Comina, G., Suskaa, A., Filippini, D. PDMS lab-on-a-chip fabrication using 3D printed templates. Lab Chip. 14 (2), 424-430 (2013).
- Chan, H. N., et al. one-step molding of 3D-printed structures for convenient fabrication of truly 3D PDMS microfluidic chips. Microfluid Nanofluid. 19, 9-18 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados