需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
构建经济实惠、耐用、中等保真度的弹道凝胶模型,用于超声引导的神经阻滞训练
* 这些作者具有相同的贡献
摘要
在这里,我们演示了四个定制弹道明胶超声模型的设计和创建,用于超声引导的区域麻醉训练。我们使用计算机辅助设计软件设计了模型,使用3D打印模型创建硅胶模具,然后将熔化的弹道凝胶倒入模具中以创建自定义组织层。
摘要
超声模型 - 活体人体组织的替代品 - 为学习者提供了练习超声引导区域麻醉的机会,而不会给患者带来不必要的风险。基于明胶的模型为教育工作者提供了耐用且可重复使用的任务训练器;然而,市售的基于凝胶的模型价格昂贵。在这里,我们研究了用于正中神经阻滞、股骨神经、腹股沟上筋膜平面和锯肌前平面神经阻滞的耐用、低成本、基于弹道凝胶的超声模型的生产,以及用于任何超声引导神经阻滞手术的模型的生产方法。
利用计算机辅助设计(CAD)软件设计了4个模型,复制了正中神经阻滞、股神经、腹股沟上筋膜平面和前锯肌平面神经阻滞的解剖结构,包括相关的标志和组织平面。所需组织平面的塑料模型被3D打印出来,并用于制造硅胶模具。将弹道凝胶熔化并与面粉和染料混合,制成液态回声弹道凝胶,将其倒入硅胶模具中。通过使用金属棒在弹道凝胶中创建负空间来模拟血管。使用浸没在超声波凝胶中的纱线模拟神经。模拟骨骼是使用 CAD 和 3D 打印设计的。
Ballistic Gel 是一种多功能、耐用的介质,可用于模拟各种组织,并且可以熔化和模塑成任何形状。在超声波下,这些模型提供了真实的组织平面,代表了皮肤、肌肉和筋膜不同层之间的边界。肌肉组织层、神经、血管和骨骼的回声是真实的,骨骼具有明显的后部阴影,就像在人类受试者中观察到的那样。这些模型的第一个模型每个模型的成本为 200 美元,每个后续模型的成本为 60 美元。这些模型需要一些技术技能来设计,但它们的制造成本仅为商业模型的 4%。
引言
超声模型 - 活体人体组织的替代品 - 为学习者提供了练习医疗程序的机会,包括超声引导的区域麻醉 (UGRA),而不会给患者带来不必要的风险1.虽然最常见的是通过液态硅橡胶的注塑成型制造,但定制的模型可以使用多功能材料以较低的成本自制。豆腐、猪肉和牛肉等有机组织价格便宜,但很快就会变质,制作起来很有挑战性2.人体尸体组织是了解剖学准确性的理想选择,但获取和保存起来既困难又昂贵1.最近,虚拟现实已被用于提供UGRA培训;然而,触觉反馈是程序学习的关键组成部分,很少实施。即使软硬件混合模型提供高视觉保真度和触觉反馈,执行此类培训所需的硬件和软件也往往成本过高3.基于明胶的模型在成本、寿命和保真度之间取得平衡2.
弹道明胶模型在商业上是可用的,但对于在医疗模拟中心被高度利用的易腐资源来说,价格昂贵。小巧、简单、基于凝胶的超声模型,具有均匀的实质和两个或三个模拟血管,零售价为数百美元。例如,CAE Blue Phantom 基础超声训练模块的费用超过 800 美元4.特定于单个神经阻滞手术的高保真度模型需要花费数千美元。CAE Blue Phantom 股骨区域麻醉超声训练模型的费用为 5,000 美元(表 1)5。为了降低成本,教育工作者尝试使用明胶或其他低成本或可重复使用的材料定制模型 6,7,8。面粉、玉米淀粉、石墨粉、Metamucil等添加剂可用于雾化明胶并定制模型的回声性,从而提高其保真度8,9,10,11,12,13,14。
以前对自制明胶基神经阻滞训练器的尝试要么无法在超声波下充分再现神经的外观,要么使用了易腐烂的物品,从而限制了保质期15,16。即使没有这些缺点,以前的迭代也没有包括相关的解剖标志和筋膜平面,这些标志和筋膜平面将使受训者能够练习特定的神经阻滞程序。在这里,我们研究了用于正中神经阻滞、股骨神经、腹股沟上筋膜平面和锯肌前平面神经阻滞的耐用、低成本的弹道凝胶超声模型的生产,以及为任何超声引导的神经阻滞手术生成模型的方法。
研究方案
在这个项目中,作者 JR 和 PS 自愿担任超声检查对象,并获得了双方的口头同意。对于那些遵循本协议的人,在使用患者或人类志愿者作为研究对象之前,请获得伦理委员会或机构审查委员会 (IRB) 的批准。
1.幻影设计和硅胶模具制作
- 创建参考超声图像
- 对于每个超声模型,请让具有超声亚专业并熟悉所需模型模拟的神经阻滞程序的医生从志愿者人类受试者创建参考超声图像(图 1)。确保该超声图像的视图垂直于将麻醉剂注射到的适用神经或组织平面。
- 组织层模型的设计和 3D 打印
- 绘制每个模型的横截面设计 (图2),并利用计算机辅助设计 (CAD) 设计所需组织层的塑料模型和用于模型整体形状的外部容器 (图3A, 补充文件 1、补充文件 2、补充文件 3和 补充文件 4).
注意:从设计的角度来看,筋膜平面块可以被认为是一系列紧密配合的棱镜,这些棱镜封闭在一个具有 5 毫米壁的空心矩形棱柱内。小于 5 毫米的墙壁太脆弱,无法可靠生产。这个矩形棱柱体用作模型的最外层,其他组织层被组装和放置到其中。正中神经模型(显示在 图3 和 图4) 使用拱形容器而不是矩形棱柱来模拟人体手臂的形状。- 在 CAD 软件中,从超声波、CT 或其他具有已知尺寸的目标图像创建平面画布。单击 "Solid |插入 |画布,选择 文件,单击 XY 平面,拖动到 +X +Y 空间,然后拖动以缩放,使图片长度精确到已知单位。
- 在图像区域上创建一个矩形棱柱,通过单击" 实心"|"创建草图 |XY平面 |2 点矩形工具。将矩形拖动到该区域上,并在靠近时在长度/宽度框内进行细化;按 Enter 键;点击 完成草图;点击 Rectangle |实心 |挤出;将矩形拖动到所需的高度,并在接近时使用高度框进行细化;,然后按 Enter 键。
注意:根据它们所代表的解剖结构,我们的每个模型都有不同的长度和宽度,但我们通常发现 ~100 毫米是有效的模型高度。 - 通过单击矩形棱柱的顶部,在矩形棱柱的顶部创建另一个草图 |通过 单击" 草图"|"创建草图"并绘制出所需的解剖结构以及封装矩形棱柱的内边缘。创作 和 草绘 |修改工具箱。使用棱镜后面可见的画布来指导设计;如果无法通过矩形棱柱看到画布,请通过 "显示设置"进行更改。创建表示模型横截面的草图后,单击 "完成草图"。
注意:没有特定的理想工具来绘制所需的解剖结构和封装棱镜的内边缘。上述步骤是此协议中使用的步骤。 - 接下来,通过单击草图中的形状从草图创建每个内部棱柱 |实心 |挤出;将形状按所需长度拖回矩形棱柱体中,通常比整个矩形长度小 5 毫米;,然后单击操作 = 新主体 |进入。要查看此新对象,请单击新主体名称旁边的"主体"|"眼睛符号"来关闭所有其他对象的可见性。
注意:血管和应由设计在筋膜平面体的边缘或中心中的圆形或椭圆形棱柱形孔表示。此时,如果您 直接 在初始画布上查看虚拟模型,则可以直观地看到各个模型部分以及它们如何组合在一起。 - 通过单击" 身体"|"每个身体旁边的眼睛符号"(正在导出的物体除外) 单独导出每个身体以进行 3D 打印;单击" 文件"|"导出 |类型 = .stl 文件 |进入。
注意:您现在应该有多个 .stl 文件,每个文件代表一个独特的筋膜平面或骨骼,还有一个额外的 .stl 文件表示筋膜平面件将适合的矩形边界框。
- 在与将用于打印模型的 3D 打印机兼容的切片器软件中打开 STL 文件。
- 使用"放置在脸上"按钮将模型放在床上,使模型的底部接触打印床。
- 在"打印机"下,选择打印机。在打印设置下,选择 0.20mm SPEED,在灯丝下,选择通用 PLA。为填充选择 15-20%,在"支持"菜单上选择"无处不在",并在必要时添加帽檐以确保打印稳定性。单击 Slice now。
- 将 G 代码文件导出到 SD 卡,将其插入 3D 打印机,然后使用聚乳酸 (PLA) 长丝打印文件。
- 绘制每个模型的横截面设计 (图2),并利用计算机辅助设计 (CAD) 设计所需组织层的塑料模型和用于模型整体形状的外部容器 (图3A, 补充文件 1、补充文件 2、补充文件 3和 补充文件 4).
- 硅胶模具的制作
- 根据制造商指南17,将每个3D打印模型粘在裸照有机玻璃容器的底部,然后将其浸入快速固化的硅橡胶中。
- 一旦硅胶凝固,取下硬塑料模型和有机玻璃外壳,留下一个柔韧、耐用和可重复使用的硅胶模具,用于每个所需的组织层和容器,将弹道凝胶倒入其中(图3B)。
注意:此时,协议可能会暂停并在以后重新启动。
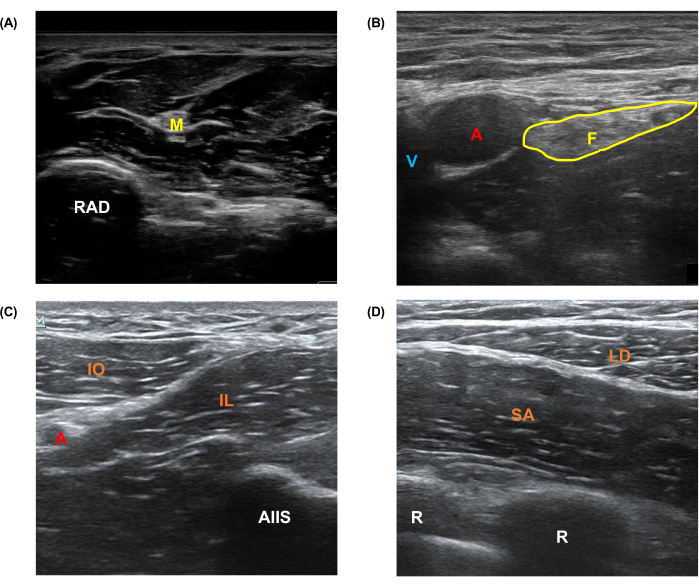
图 1:从人体获得的代表性超声图像。 从志愿者人类受试者获得的 (A) 正中、(B) 股骨、(C) 腹股沟上筋膜平面和 (D) 锯肌前平面神经阻滞模型的代表性图像。缩写:A = 动脉;V = 静脉;M = 正中神经;F = 股神经;RAD = 半径;U = 尺骨;AIIS = 髂前下棘;R =肋骨;SART = 缝匠肌;IL=髂肌;IO = 内部斜线;SA = 前锯肌;LD = 背阔肌。 请点击这里查看此图的较大版本.
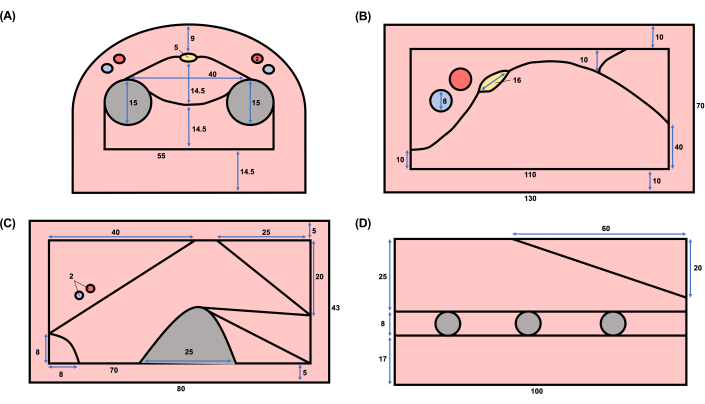
图 2:神经阻滞超声模型的横截面示意图。 (A) 正中肌,(B) 股骨,(C) 腹股沟上筋膜平面,(D) 锯肌前平面神经阻滞超声模型。原理图是根据 图1所示的代表性人体超声图像设计的。 请点击这里查看此图的较大版本.

图 3:正中神经阻滞模型组件的创建。 (A) 用于打印正中神经阻滞模型的每个组织层的塑料模型的计算机辅助设计文件的代表性图像。(B) 用于正中神经阻滞模型的每个组织层的硅胶模具,包括插入的金属棒以在弹道凝胶内形成血管。(C)将热的、液态的、染色的弹道凝胶倒入硅胶模具中。(D) 在血管充满模拟血液后,使用液体弹道凝胶密封模拟血管的开口端。 请点击这里查看此图的较大版本.
2. 创建其他幻影地标
- 模拟骨骼设计和创建
- 如果在 CAD 中设计的模型区域代表骨骼而不是软组织,则使用上述步骤 3D 打印仿骨骼,但改用丙烯腈丁二烯苯乙烯 (ABS) 长丝。
注意: ABS 长丝烟雾可能含有挥发性有机化合物 (VOC),这会导致身体不适,例如嗜睡、眼睛或呼吸道刺激、恶心和/或头痛18.ABS 应在通风和/或空气过滤良好的房间内使用封闭的 3D 打印机或未封闭的打印机打印。
- 如果在 CAD 中设计的模型区域代表骨骼而不是软组织,则使用上述步骤 3D 打印仿骨骼,但改用丙烯腈丁二烯苯乙烯 (ABS) 长丝。
- 模拟神经生成
- 将 80% 腈纶、20% 羊毛纱线浸入装有超声波凝胶的塑料杯中。将杯子置于-1 atm压力室中。
- 使用单级真空泵反复建立,然后在腔室中释放压力,直到从超声波凝胶中去除所有气泡,大约在 4-6 个循环后完成。
注意:此步骤有助于模拟神经。此时,协议可能会暂停并在以后重新启动。
3.弹道凝胶熔化和浇注
- 熔化弹道凝胶
- 在商用对流烤箱中,以大约 20:1 的体积比加热市售的弹道凝胶和染料,并间歇搅拌,直到液体达到 132 °C。
注意:由于处理热流体存在灼伤风险,因此应谨慎处理加热的液体弹道凝胶。处理装满液体防弹凝胶的平底锅时,请使用烤箱手套。避免皮肤与液体弹道凝胶直接接触。
- 在商用对流烤箱中,以大约 20:1 的体积比加热市售的弹道凝胶和染料,并间歇搅拌,直到液体达到 132 °C。
- 用于回声的添加剂
- 将每公斤弹道凝胶中约4.5克细粒状面粉搅拌到液体弹道凝胶中。将凝胶在烤箱中保持至少 20 分钟,并间歇性搅拌,以使混合均匀并让任何气泡逸出。
- 根据需要添加额外的透明弹道凝胶或染料,以调整混合物的颜色以模拟人体组织。
- 将弹道凝胶倒入硅胶模具中
- 如果适合该特定的神经阻滞模型,将不同直径的实心钢棒插入可重复使用的硅胶模具上的指定位置,以在最终的超声模型中创建通道,该通道将代表血管(图3C)。
- 将现在由染料着色的液体弹道凝胶与悬浮的面粉颗粒一起倒入硅胶模具中,并且没有保留的气泡,并使其冷却。
- 冷却后,从模具中取出金属棒和最终的弹道凝胶组织层。当将它们与超声凝胶涂层放在一起时,相邻的组织块几乎完美地对齐,并在超声波上共同产生模拟筋膜平面。
注意:每个超声模型需要大约 0.7 公斤的弹道凝胶。冷却时间取决于组织层的大小,从20分钟到1.5小时不等。
- 添加模拟血液和密封血管
- 对于具有模拟血管的组织层,将组织层的一侧浸入液体弹道凝胶中并使其冷却,从而封闭血管通道的一侧。
- 将这些组织层直立,并使用针头和注射器将模拟血液引入每条血管。
注意:我们使用带有红色或蓝色食用色素的水分别代表动脉血和静脉血。 - 使用静止液态弹道凝胶覆盖剩余的容器开口,从而完全密封每个充满液体的容器(图3D)。
注意:此时,协议可能会暂停并在以后重新启动;但是,必须再次熔化弹道凝胶才能进行下一步。
4. 幻影组件
- 组织层、神经和骨骼的组装
注意: 图 4A 描绘了组装前的正中神经阻滞模型的各个组件,包括组织层、模拟神经和模拟骨骼。- 通过将每个组件涂覆在超声凝胶中来组装模型,如 图2中的横截面所示组装组件,并将它们插入各自的弹道凝胶矩形棱镜中(图4B)。在此步骤中正确放置任何 3D 打印的骨头或纱线神经。
- 密封幻影的末端
- 通过将模型的两面浸入装有液体弹道凝胶的锅中来密封模型(图4C)。在每侧多次重复密封过程。
- 最后,使用热风枪抚平幻影的边缘,去除气泡和瑕疵,并加强侧面密封。
- 添加假皮肤(可选)
注意:筋膜平面模型的增强是添加了假皮肤。- 将液体弹道凝胶倒在密封和冷却的模型上,该模型已松散地覆盖在超声波凝胶中,以防止新浇注的皮肤层与现有模型之间发生退火(图4D 和 补充视频S1)。

图 4:正中神经阻滞超声模型的组装。 (A) 拆卸的正中神经阻滞模型的各个组成部分,包括弹道凝胶组织层、3D 打印的桡骨和尺骨、浸没在超声凝胶中的纱线正中神经、一瓶超声凝胶和装满液体弹道凝胶的锅。(B) 正中神经阻滞模型的组装,包括插入组织层和覆盖在超声凝胶中的模拟骨骼。(C) 将模型的一端浸入一锅液体弹道凝胶中,以密封幻影的一端。(D) 通过将液体弹道凝胶倒在已完成的正中神经阻滞模型上来创建一层假皮肤。 请点击这里查看此图的较大版本.
结果
使用上述方法成功设计和建造了四个超声模型。 图 5 显示了每个模型的超声横截面与等效人体解剖结构的超声对齐。在超声波下,这些模型提供逼真的组织平面,代表皮肤、肌肉和筋膜不同层之间的边界。肌肉组织具有适当且均匀的回声源性。这种回声性可以根据熔化过程中添加到弹道凝胶中的面粉量进行调整。与背景肌肉组织相比,筋膜边界是高回声的。纱线呈现不规则...
讨论
这些定制的基于弹道凝胶的模型为受训者提供中等保真度的正中、股骨、腹股沟上筋膜平面和锯肌前平面神经阻滞训练,而成本仅为市售神经阻滞模型的一小部分(表 1)。我们的第一台正中神经阻滞和股神经阻滞训练器是内部制造的,价格分别是最便宜的市售正中神经阻滞和股神经阻滞训练器价格的 12% 和 9%。可用的股神经阻滞模型都无法像我们的模型那样模拟髂筋膜阻滞的腹股沟?...
披露声明
本文的作者没有任何利益冲突需要披露。
致谢
该项目由位于加利福尼亚州拉霍亚的加州大学圣地亚哥分校医学院的模拟培训中心(STC)资助。我们要感谢 Blake Freechtle 对 Figure 5 的贡献。
材料
| Name | Company | Catalog Number | Comments |
| ABS Filament - 1.75 m+B+A2:A14 | Hatchbox (Pomona, CA) | https://www.hatchbox3d.com/collections/abs-1-75mm | |
| Adobe Photoshop | Adobe (San Jose, CA) | https://www.adobe.com/products/photoshop.html | |
| Amber Tone Dye | Humimic Medical (Greenville, SC) | 852844007925 | Ballistic gel dye; https://humimic.com/product/amber-tone-dye/ |
| Fusion 360 | Autodesk (San Franciso, CA) | Computer-assisted design (CAD) software; https://www.autodesk.com/products/fusion-360/overview?term=1-YEAR&tab=subscription&plc=F360 | |
| Gelatin #1 - Medical Gel by the Pound | Humimic Medical (Greenville, SC) | 852844007406 | Ballistic gel; https://humimic.com/product/gelatin-1-medical-gelatin-by-the-pound/ |
| Gluten-Free All-Purpose Flour | Arrowhead Mills (Hereford, TX) | Flour for echogenicity; https://arrowheadmills.com/products/gluten-free/organic-gluten-free-all-purpose-flour/ | |
| Microsoft PowerPoint | Microsoft (Redmond, WA) | https://www.microsoft.com/en-us/microsoft-365/powerpoint | |
| Mold Star 16 FAST Pourable Silicone Rubber | Smooth-On (Macungie, PA) | Pourable silicone rubber; https://www.smooth-on.com/products/mold-star-16-fast/ | |
| Peach Tone Dye | Humimic Medical (Greenville, SC) | 852844007895 | Ballistic gel dye; https://humimic.com/product/peach-tone-dye/ |
| PLA Filament - 1.75 mm | Hatchbox (Pomona, CA) | https://www.hatchbox3d.com/collections/pla-1-75mm | |
| Prusa Original i3 MK3S+ printer | Prusa Research (Prague, Czech Republic) | 3D printer; https://www.prusa3d.com/category/original-prusa-i3-mk3s/ | |
| Prusa Slicer 2.6.1 | Prusa Research (Prague, Czech Republic) | 3D printer slicer software; https://www.prusa3d.com/page/prusaslicer_424/ | |
| Wool-Ease Thick & Quick Yarn | Lion Brand Yarn (Lyndhurst, NJ) | 640-610B | Yarn for simulated nerves; https://www.lionbrand.com/products/wool-ease-thick-and-quick-yarn?variant=32420963516509 |
参考文献
- Hocking, G., Hebard, S., Mitchell, C. A review of the benefits and pitfalls of phantoms in ultrasound-guided regional anesthesia. Reg Anesth Pain Med. 36 (2), 162-170 (2011).
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound Med Biol. 36 (6), 861-873 (2010).
- Grottke, O. Virtual reality-based simulator for training in regional anaesthesia. Br J Anaesth. 103 (4), 594-600 (2009).
- . Regional anesthesia ultrasound training block Available from: https://medicalskillstrainers.cae.com/regional-anesthesia-ultrasound-training-block/p (2023)
- CAE Healthcare. . Gen II femoral vascular access & regional anesthesia ultrasound training model. , (2023).
- Osmer, C. L. A gelatine-based ultrasound phantom. Anaesthesia. 63 (1), 107 (2008).
- Nicholson, R. A., Crofton, M. Training phantom for ultrasound guided biopsy. Br J Radiol. 70, 192-194 (1997).
- Bude, R. O., Adler, R. S. An easily made, low-cost, tissue-like ultrasound phantom material. J Clin Ultrasound. 23 (4), 271-273 (1995).
- Patel, A. S., Harrington, T. J., Saunt, K. S., Jones, W. K. Construction of an ultrasound biopsy phantom. Australas Radiol. 40 (2), 185-186 (1996).
- Culp, W. C. Relative ultrasonographic echogenicity of standard, dimpled, and polymeric-coated needles. J Vasc Interv Radiol. 11 (3), 351-358 (2000).
- Morehouse, H., Thaker, H. P., Persaud, C. Addition of Metamucil to gelatin for a realistic breast biopsy phantom. J Ultrasound Med. 26 (8), 1123-1126 (2007).
- Phal, P. M., Brooks, D. M., Wolfe, R. Sonographically guided biopsy of focal lesions: a comparison of freehand and probe-guided techniques using a phantom. AJR Am J Roentgenol. 184 (5), 1652-1656 (2005).
- McNamara, M. P., McNamara, M. E. Preparation of a homemade ultrasound biopsy phantom. J Clin Ultrasound. 17 (6), 456-458 (1989).
- Gibson, R. N., Gibson, K. I. A home-made phantom for learning ultrasound-guided invasive techniques. Australas Radiol. 39 (4), 356-357 (1995).
- Lollo, L., Stogicza, A. R. Low-cost, high-fidelity ultrasound phantom gels for regional anesthesia training programs. MedEdPORTAL. 8, (2023).
- Rathbun, K. M., Brader, W. T., Norbury, J. W. A simple, realistic, inexpensive nerve phantom. J Ultrasound Med. 38 (8), 2203-2207 (2019).
- . Mold Star™ 16 FAST Product Information Available from: https://www.smooth-on.com/products/mold-star-16-fast/ (2023)
- Wojtyła, S., Klama, P., Baran, T. Is 3D printing safe? Analysis of the thermal treatment of thermoplastics: ABS, PLA, PET, and nylon. J Occup Environ Hyg. 14 (6), D80-D85 (2017).
- . Original Prusa i3 MK3S+ 3D Printer kit Available from: https://www.prusa3d.com/product/original-prusa-i3-mk3s-3d-printer-kit/ (2023)
- . Original Prusa MINI+ kit Available from: https://www.prusa3d.com/product/original-prusa-mini-kit-2/ (2023)
- . FreeCAD: Your own 3D parametric modeler Available from: https://www.freecad.org/ (2023)
- Xu, D., Abbas, S., Chan, V. W. Ultrasound phantom for hands-on practice. Reg Anesth Pain Med. 30 (6), 593-594 (2005).
- de Oliveira Filho, G. R., et al. Learning curves and mathematical models for interventional ultrasound basic skills. Anesth Analg. 106 (2), 568-573 (2008).
- Koscielniak-Nielsen, Z. J., Rasmussen, H., Hesselbjerg, L. An animal model for teaching ultrasound-guided peripheral nerve blocks. Reg Anesth Pain Med. 34 (4), 379-380 (2009).
- Pollard, B. A. New model for learning ultrasound-guided needle to target localization. Reg Anesth Pain Med. 33 (4), 360-362 (2008).
- Wells, M., Goldstein, L. The polony phantom: a cost-effective aid for teaching emergency ultrasound procedures. Int J Emerg Med. 3 (2), 115-118 (2010).
- van Geffen, G. J., et al. A needle guidance device compared to free hand technique in an ultrasound-guided interventional task using a phantom. Anaesthesia. 63 (9), 986-990 (2008).
- Liu, Y., Glass, N. L., Power, R. W. Technical communication: new teaching model for practicing ultrasound-guided regional anesthesia techniques: no perishable food products. Anesth Analg. 110 (4), 1233-1235 (2010).
- Sultan, S., Iohom, G., Shorten, G. A novel phantom for teaching and learning ultrasound-guided needle manipulation. J Med Ultrasound. 21 (3), 152-155 (2013).
- Micheller, D. A low-fidelity, high-functionality, inexpensive ultrasound-guided nerve block model. CJEM. 19 (1), 58-60 (2017).
- Sparks, S., Evans, D., Byars, D. A low cost, high fidelity nerve block model. Crit Ultrasound J. 6 (1), 12 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。