Method Article
用于珊瑚精子冷冻保存以支持生物样本库和水产养殖的半自动化工作流程
摘要
该协议描述了一种半自动途径,可以提高受威胁珊瑚物种精子的处理和冷冻保存的效率和能力,旨在确保遗传多样性并支持珊瑚礁恢复工作。
摘要
随着海洋变暖引起的白化事件频率增加,珊瑚礁正面临危机,导致世界各地珊瑚礁上的珊瑚死亡。随后遗传多样性和生物多样性的丧失会削弱珊瑚适应不断变化的气候的能力,因此努力保护现有的多样性对于最大限度地利用现在和未来可用于珊瑚礁恢复的资源至关重要。长期保护遗传学的最有效方法是冷冻保存和生物样本库,它允许在低温下将活体样品无限期地冷冻储存在液氮中。自 2012 年以来,珊瑚精子的冷冻保存已经成为可能,但珊瑚繁殖的季节性意味着生物样本库活动仅限于每年产卵的几个晚上。因此,提高珊瑚精子处理和冷冻保存工作流程的效率对于最大限度地利用这些有限的生物样本库机会至关重要。为此,我们着手优化珊瑚精子的冷冻保存处理途径,方法是在现有技术的基础上创建一种半自动化方法来简化珊瑚精子的评估、处理和冷冻保存。该过程结合了计算机辅助精子分析、条形码冻存管和一系列链接的自动数据表,供多个用户同时编辑,提高了现场样品处理和元数据管理的效率。通过与澳大利亚珊瑚礁恢复和适应计划等跨领域研究计划相结合,低温保存可以通过促进水产养殖种群的遗传管理、支持提高耐热性的研究以及防止珊瑚物种灭绝,在大规模珊瑚礁恢复计划中发挥关键作用。所描述的程序将用于全球珊瑚礁上的珊瑚冷冻保存和生物样本库从业者,并将为冷冻保存技术从研究实验室过渡到大规模应用提供模型。
引言
由于气候变化引起的海洋变暖和酸化,全球珊瑚礁正在经历珊瑚物种、种群和遗传多样性的丧失,这削弱了这些关键栖息地的生存能力并影响了它们所支持的物种 1,2。长期保护遗传学的最有效方法是冷冻保存和生物样本库,它允许在低温下将活体样品无限期地冷冻储存在液氮中 3。2012 年开发出的珊瑚精子冷冻保存方法4 首次实现了这些物种的遗传学生物样本库,并导致 2012 年开发了第一个珊瑚遗传学生物储存库5。从那时起,这种低温保存方案得到了进一步完善6,并用于保护全球 50 多种珊瑚的遗传学,其中 30 种来自澳大利亚的大堡礁7。冷冻保存的珊瑚精子可以产生发育正常的健康珊瑚,并已用于促进澳大利亚8 和加勒比海9 的辅助基因流实验。虽然目前正在开发能够冷冻保存复杂组织类型的技术,例如幼虫10 和成年珊瑚组织11,12,但珊瑚精子的冷冻保存是目前可用于珊瑚遗传学常规生物样本库的最成熟工具。
随着对珊瑚种群的影响增加,一些国家启动了大规模计划来支持珊瑚礁恢复和适应(例如,澳大利亚的珊瑚礁恢复和适应计划 [RRAP]13)或保护剩余的濒危珊瑚种群(例如,美国的佛罗里达珊瑚救援14)。在这些计划的背景下,冷冻保存可以被视为一种使能技术,除了保护现有的遗传多样性和防止灭绝外,还支持研究和大规模珊瑚生产。精子冷冻保存可以更好地控制物理或时间上分离的种群之间的繁殖,并允许亲鱼的遗传管理选择所需的性状,例如耐热性或抗病性8。迄今为止,珊瑚精子生物样本库的规模相对较小,以支持生物多样性管理7,因此,如果此类生物样本库要在这些更大的珊瑚礁恢复计划中发挥其潜力,则需要进行一定程度的升级。与所有基于珊瑚繁殖的珊瑚礁恢复工作一样,增加生物样本库工作的主要障碍是珊瑚配子可用的时间有限,因为大多数造礁物种的产卵与春末夏初的满月相吻合15,这意味着配子只能在每年的几个晚上进行冷冻保存和生物样本库。此外,在发生大规模产卵的地区,例如大堡礁,通常有多个物种在同一晚同时产卵或在几个小时内相互产卵15。因此,需要增强精子冷冻保存途径,以提高处理的规模和效率,以便在这些短暂的年度产卵窗口期间最大限度地提高生物样本库容量,同时确保样本和相关元数据的完整性。
珊瑚精子的冷冻保存和生物样本库涉及几个关键步骤,从产卵过程中的配子收集到将样本输入生物储存库和数据库(图 1)。该过程从卵子中分离精子(雌雄同体物种)或从水柱中收集精子(在房角物种中)开始,然后评估精子活力和浓度。然后将精子与冷冻保护剂(10% v/v 终浓度,二甲基亚砜,DMSO)在过滤海水 (FSW) 中混合,并在定制设计的冷却装置中以 -20 °C/min 的速度冷却4。该过程的早期迭代依赖于 通过 相差显微镜和血细胞计数板计数、打印和标记试管对精子活力和浓度进行目视评估,因为样品被处理以进行冷冻保存,将精子样品手动移液到冷冻管中,并在专门设计的浮动架上冷却16。计算机辅助精子分析 (CASA)17 的应用和 3D 打印冷却装置6 的开发提高了珊瑚精子冷冻保存的效率和可靠性,但精子样本处理途径自成立以来基本保持不变。虽然这种方法适用于在产卵之夜处理来自中等数量菌落和物种的样品,但对于大量和大量的菌落(例如,一次来自 >10 个菌落的单个样品),冷冻保存途径中存在瓶颈,阻碍了样品的及时处理(即,在精子释放后 2 小时内),而不会降低样品的生育潜力。尽管可以使用用于冻存管的大型流体处理系统(例如,Thomas 等人18),但它们通常是为大批量处理(即多个冻存管架)而设计的,不适合在现场运输和使用,因此对于这种应用来说并不划算。因此,本研究旨在通过在加工途径的关键步骤引入便携式、廉价的自动化设备和方法来提高珊瑚精子冷冻保存的效率,以最大限度地提高在产卵之夜可以有效冷冻保存的样本数量。
研究方案
本文描述的方法可用于处理和冷冻保存来自雌雄同体和角状珊瑚物种的精子。关于珊瑚生成和配子收集精子冷冻保存的一般介绍和入门知识可以在史密森尼的国家动物园和保护生物学研究所珊瑚冷冻保存培训课程19中找到。所描述的方法主要是使用从沃帕布拉海国的吉宝岛群和澳大利亚大堡礁宾达海国的戴维斯礁收集的 Acropora millepora 群落的配子开发的。珊瑚和配子的所有收集和使用均在相关海洋国家的传统监护人的自由事先知情同意下进行。用于本研究的试剂和设备列在 材料表中。
1. 产卵前 - 系统检查和精子活化溶液和低温稀释剂的制备
- 确认条码扫描器已充电、处于活动状态,并设置为输入电子表格数据作为水平单元格输入。请参阅条形码阅读器用户手册以自定义此设置。
- 为 CASA 准备珊瑚精子活化浓缩原液。
注意:处理用于制备活化溶液的化学品时,应佩戴一次性手套。- 通过将 1.5 g BSA 溶解在 4 mL 无菌纯化组织培养水中,借助设置为 37 °C 的试管加热器或将试管握在杯状手中,定期轻轻旋转(不要摇晃小瓶),制备 30% 牛血清白蛋白 (BSA) 储备液 (5 mL)。
- 溶液后,使用组织培养水补足至最终体积 (5 mL),用日期标记试管,并标记"30% BSA in H2O"。
- 在冰箱 (4 °C) 中储存长达 2 周。
- 将 0.2913 g 咖啡因溶解在 24 mL 过滤海水 (FSW) 中,制备 60 mM 咖啡因储备液 (25 mL)。
- 溶液后,使用 FSW 补足至最终体积 (25 mL),在试管上标记日期并标记"FSW 中的 60 mM 咖啡因"。
- 在冰箱中存放长达 1 个月。
注:咖啡因在 FSW 中的最大溶解度约为 71 mM。
- 为精子样品制备精子活化工作溶液,浓度为 ~109 个精子/mL(0.9% BSA + 12 mM 咖啡因,溶于 FSW)。
- 对于 10 mL 工作溶液,混合 2.0 mL 60 mM 咖啡因储备液 + 0.3 mL 30% BSA 储备液 + 7.7 mL FSW。
- 用日期和"精子活化工作溶液 - 0.9% BSA + 12 mM 咖啡因"标记试管。
- 每天使用时准备,在室温 (19-30 °C) 下储存,并在一天结束时丢弃未使用的溶液。
- 准备冷冻保护剂溶液(冷冻稀释剂)。确保在处理冷冻保护剂 DMSO 时佩戴一次性手套。
注:FSW 是用不同的冷冻保护剂浓度制备的,具体取决于样品中的初始精子浓度和冷冻保存等分试样的所需最终精子浓度。制备低温稀释剂时,确保在添加 DMSO 之前将 FSW 分装到 50 mL 试管中。- 从产卵前保存珊瑚的水箱系统中收集原始海水(~35 ppt 盐度)。
- 使用连接到真空泵的瓶口过滤系统过滤未经处理的海水,真空泵装有 0.2 μm 无热原膜过滤器。
- 对于精子浓度≥2 × 109 个精子/mL,通过在 50 mL 试管中混合 10 mL DMSO + 40 mL FSW 来制备 20% DMSO 的 FSW。
- 对于精子浓度<2 × 109 个精子/mL,通过在 50 mL 试管中混合 15 mL DMSO + 35 mL FSW 来制备 30% DMSO 的 FSW。
- 用日期和 DMSO 浓度标记试管,即 30% DMSO 或 20% DMSO。
- 每天使用准备,在室温 (19-30 °C) 下储存,并在每天结束时丢弃未使用的溶液。
注:DMSO 和 FSW 的混合会产生放热反应,冷冻稀释剂应在使用前充分配制,以便冷却至室温。FSW 可以储存在 4 °C 下,用于制备低温稀释剂以抵消这种热量的产生。
- 准备热电偶数据记录器。
- 为了测量每次冷冻保存运行的大致冷却速率,将含有 10% DMSO 的冷冻管放入 FSW 中,并通过盖子将热电偶探针插入精子样品旁边的冷冻保存架样品槽中。
- 要制作热电偶样品瓶,请在带条形码的冻存管盖上戳或熔化一个小孔,然后将 K 型或 T 型热电偶插入开口。将热电偶探针尖端向下推至一定水平,使其在填充样品瓶时位于样品中间,保持探针尖端在样品瓶中居中,以避免接触样品瓶内壁。密封盖子并用热胶将热电偶探头固定到位。
- 戴上一次性手套,在带条形码的冷冻管中加入 10% DMSO 的 FSW 溶液,体积等于要冷冻保存的精子样品的体积。
- 在 FSW 中制备新鲜的 10% DMSO,并每天重新填充热电偶样品瓶。
2. 精子准备和评估
- 对于雌雄同体物种(例如, 鹿角 物种),使用 3 mL 移液管从水面收集配子束,并将它们以 5 mL 配子束与 5 mL 海水(10 mL 总体积)的比例放入标记的 50 mL 管中。
- 对于房角物种,使用 3 mL 移液管从息肉口附近收集精子,并将样品放入标记的 50 mL 试管中,然后直接进行步骤 2.8。
注意:一次性手套对于收集和处理配子样本不是必需的,但如果需要,可以佩戴。应用清水彻底洗手,或在每个配子样本之间更换手套,以避免交叉污染。 - 对于雌雄同体物种,用手轻轻旋转样品直到精子束破裂,以搅动精子-卵束。
注意:一些 Montipora 物种的卵子中含有毒素,因此必须让它们以最小的搅动缓慢分解,以避免损坏精子。 - 让样品在试管架中静置 2 分钟,让卵子漂浮到表面,让精子沉淀(卵子会在表面形成粉红色/棕色层,可以看到单个卵子;参见 图 1i)。
- 为了分离精子并去除污染的卵子,请使用干净的 3 mL 移液管从试管底部轻轻吸出精子。
- 将精子样品转移到位于新的无菌 50 mL 离心管上的 100 μm 细胞过滤器中。样品应易于流过过滤器。轻敲过滤器以促进样品流动,如有必要,可以使用干净的移液管从过滤器底部收集任何残留样品。取下过滤器,然后松散地盖上管子以允许空气交换。
- 用菌落 ID 标记过滤后的精子样本,并将样本移至精子评估工作站。
- 打开 coral 生物样本库自动数据表文件(补充文件 1)。在 精子评估 选项卡中,输入珊瑚群落元数据(A-H 列)。
- 准备精子以进行 CASA 评估。
- 充分混合精子样品,将 10 μL 等分试样取出到空的 1.8 mL 微量离心管中。
- 立即在 10-20 秒内滴加 0.390 mL 精子活化工作溶液,将精子轻轻混合到溶液中。这给出了 1:39 的稀释比(精子:溶液,v/v)(或稀释因子 40),如果原始精子浓度为 ~2 ×× 109 个精子/mL,则为 CASA 评估提供了合适的浓度(~50 106/mL)。将试管倒置 5 次,并在打开试管前轻弹试管盖,使溶液沉降到试管底部。
注意:CASA 的精子浓度应在 8-50 × 106/mL 的范围内,以允许准确的精子追踪17。如果需要,可以将额外的精子活化工作溶液添加到生精子等分试样中以降低浓度。重新计算稀释率并将此值输入到电子表格中。在必须同时处理多个样品的情况下,可在 1.8 mL 微量离心管中预装 0.390 mL 精子活化工作溶液,并直接加入 10 μL 等分试样精子样品,然后倒置试管 10× 并在打开试管前轻弹试管盖,充分混合。
- 使用 Zuchowicz 等人 17 所述的计算机辅助精子分析 (CASA) 评估精子活力和活化样品的浓度,方法是将 4 μL 活化精子悬液放在 Makler 计数室20 上,或通过视觉评估和血细胞计数器计数在相差显微镜下进行计数,如 Hagedorn 等人4 所述。
注:Makler 腔室和盖玻片必须用 70% 乙醇充分清洁,然后用蒸馏水清洁,并在样品之间用无绒纸巾擦拭。 - 输入用于 CASA 评估的精子稀释因子,并在自动数据表中输入精子浓度 (million/mL)、总活力 (%) 和渐进活力 (%) 的 CASA 输出。
注意:其他 CASA 指标,包括平均路径速度 (VAP)、直线速度 (VSL) 和曲线速度 (VCL),可以选择包含在自动数据表中,也可以稍后从保存的 CASA 文件中检索。 - 将精子浓度写在过滤后的精子样品管上,并按照与精子束分离和处理相同的顺序将样品转移到冷冻保存工作站。
3. 精子稀释和冷冻保护剂平衡
- 在冷冻保存工作站上,打开精子评估工作站使用的同一珊瑚生物样本库自动数据表文件,然后选择 "冷冻保存 "选项卡。检查精子样品管标签,并通过检查 Colony ID(C 列)来识别相应的条目。如果在工作站之间没有同时访问相同的自动数据表文件,请手动将数据输入到自动数据表的 菌落 ID(C 列) 和 精子浓度(F 列) 中。
- 使用血清移液管,通过将样品吸入移液器并将其排回同一管中来测量精子样品体积;在 E 列中输入值。
- 检查自动计算的 色谱柱 I 是否为所需的冷冻保护剂浓度,检查色谱柱 H 为要添加的低温稀释剂的体积(表 1)。
- 启动计时器 10 分钟,然后使用血清移液管立即开始逐滴添加低温稀释剂,持续轻柔混合样品,确保在处理 DMSO 时佩戴一次性手套。
- 在 P 列中记录低温稀释剂添加时间。
| 精子浓度 | 低温稀释剂 | 稀释比(精子:低温稀释剂) | 精子样品中 DMSO 的最终浓度 (%) |
| < 2 × 109/mL | FSW 中 30% DMSO | 2:1 | 10% |
| ≥ 2 × 109/mL | 20% DMSO 的 FSW 溶液 | 1:1 | 10% |
表 1:用于珊瑚精子冷冻保存的低温稀释剂浓度和稀释比,基于对待冻存样品中精子总浓度的评估。
4. 精子冷冻保存
- 读取 K 列 以确定要填充的冻存管数量。这是根据精子总体积和每瓶所需体积(大多数情况下为 1 mL)自动计算得出的。在 10 分钟的孵育期内,继续执行步骤 4.2 至 4.6。
- 打开带标签的无菌条形码冻存管盖,将瓶盖放在干净/无菌的表面上。
- 可选:使用永久性标记在每个冻存管上写下运行 #;这有助于快速识别样本以加入生物样本库。
- 使用血清移液管和设置为所需样品体积 (1 mL) 的等分移液器,将样品分装到无加帽的条形码冻存管和加盖样品瓶中。
- 在室温下将一个热电偶样品瓶和所有装满样品的样品瓶放在空的冻存架上。确保所有样品瓶上的条形码表面朝外。
- 如有必要,在冷冻架上的任何空隙中放置额外的含有 10% DMSO FSW 溶液的虚拟冻存管,以确保所有空间都被占用。
- 在自动数据表(U 列)中输入运行编号,并将冻存架序列号(二维码)扫描到 V 列中。
- 将光标放在 Z 列 的正确单元格中,然后扫描热电偶样品瓶,然后扫描加载到架子上的所有冻存管(从 AA 列 开始)。避免将样品架侧向倾斜,以确保样品不会进入样品瓶的螺纹。
- 扫描时,交叉检查数据是否输入到正确的细胞中,以及所有冻存管是否都已扫描过一次。
- 将加载和扫描的架子放在冷冻保护剂平衡期的剩余时间内,并准备冷却容器以进行冷冻保存。
- 用液氮填充冷冻架冷却容器,以大约 −20 °C/min 的速度冷却所需的适当预定水平。
注意:氮气只能在通风良好的地方使用,因为有窒息的风险。处理液氮时,必须佩戴露趾鞋、安全眼镜/面罩和冷冻手套。有关液氮处理和使用的具体信息,请参阅机构指南。 - 在 10 分钟冷冻保护剂平衡期结束时,将热电偶探头连接到数据记录器并开始记录,然后轻轻地将完整的冷冻架放入冷却容器中并盖上盖子。
- 在 Q 列中记录开始时间。
- 一旦热电偶样品瓶在数据记录器上的读数为 −80 °C 或更低,将冻存架插件转移到单独容器(如聚苯乙烯盒)中的液氮浴中,在液氮中淬灭样品。
- 从架子上取下冻存管,将它们转移到干燥的运输箱中,以便运输到生物储存库。
结果
本协议中概述的步骤建立在 Hagedorn 等人 4 描述的原始珊瑚精子冷冻保存方法之上,随后由 Zuchowicz 等人 6 进行改进,为提高冷冻保存和生物样本库的精子处理效率提供了关键改进。使用带条形码的冷冻管和等分自动移液器无需打印和手动标记冷冻管,从而简化了精子包装程序,并减少了手动移液大量样品的压力。重要的是,这些改进还将冻存样品制备所需的时间从大约 8-10 分钟缩短到不到 5 分钟。结合 CASA 的使用,这些改进减少了珊瑚精子高效生物样本库所需的人员数量,从原始方法中的 4 人减少到 6 人,使用当前方案时只需 2 人。此外,使用条形码冻存管意味着每根冻存管都有一个唯一的标识符,因此可以在数据库中以比以前使用批量打印标签的方法更高的分辨率跟踪每根冻存管。
在澳大利亚 2022 年大堡礁产卵季节期间,对该方案的两次产卵事件进行了现场测试,结果由两名操作员(一名人员用于 CASA,一名人员用于低温保存)对来自 5 个物种的 57 个菌落的 389 个样本进行了冷冻保存和生物库,另外一名人员根据需要协助进行束分解和精子分离。在 2022 年 11 月澳大利亚昆士兰州 Konomie(北吉宝岛)的产卵活动中,两名操作员在 2 小时内冷冻保存了来自 24 个 Acropora millepora 群落的 150 个样本。从如此大量的珊瑚群落中高效处理和冻存如此数量的样品,主要是由于样品制备时间的提高和工作站之间元数据传输的简化。
对 2023 年 12 月产卵期间工作流程的进一步测试确定,对于 珊瑚精子,与 CASA 系统常用的市售固定盖玻片一次性使用腔室载玻片相比,Makler 计数室提供了更准确的运动和浓度数据。使用已知浓度的市售乳胶微珠、4 μL 样品体积和用于珊瑚精子的标准 CASA 设置17 ,对 Makler 计数室进行了 CASA 验证。这些分析显示,计数一致,变异性低(44.5 ± 70 万/mL),落在制造商提供的预期浓度范围(46.0 ± 700 万/mL)范围内(图 2)。使用 Makler 计数室和固定盖玻片室载玻片收集的 Acropora millepora 的 CASA 数据比较发现,两种腔室类型之间的精子浓度计数存在显着差异 (P = 0.002; 图 2),固定盖玻片室载玻片记录的浓度不到使用 Makler 计数室测定的浓度的一半。在来自其他两种珊瑚物种的精子样本中也观察到了这种趋势(数据未显示)。2023 年 12 月的测试还发现,在使用 20% DMSO 的 1:1 稀释度或 30% DMSO 的 1:2 稀释度(精子:低温稀释剂)冷冻保存的样品中,解冻后精子的总、活动或逐渐运动精子的浓度没有显着差异(图 3)。

图 1:用于珊瑚精子半自动处理以进行冷冻保存的工作流程和现场使用的移动设备示例。 (A) 以 5 mL 束与 5 mL FSW 的比例收集珊瑚配子束,并分解以分离卵子和精子 (i)。将菌落元数据输入到自动数据表 (ii) 中,并使用计算机辅助精子分析 (CASA) (iii) 评估分离的精子样本。将精子质量参数添加到自动数据表中,以计算在 FSW 中添加 20% 或 30% DMSO (iv),并将稀释的样品等分到带条形码的冻存管 (v) 中。将冻存管加载到冻存架上并扫描到自动数据表 (vi) 中,然后以 −20 °C/min 的速率冷却至 −80 °C (vii)。然后,样品在液氮中淬灭,并转移到干燥的运输罐中,以运输到塔龙加低温多样性库 (viii)。(B) 在 Konomie 环境教育中心教室的偏远野外站点设置的 CASA(左)和低温保存(右)站示例。(C) 在澳大利亚海洋科学研究所国家海洋模拟器设置的基于实验室的高容量低温保存站以运行多个低温架的示例。 请单击此处查看此图的较大版本。
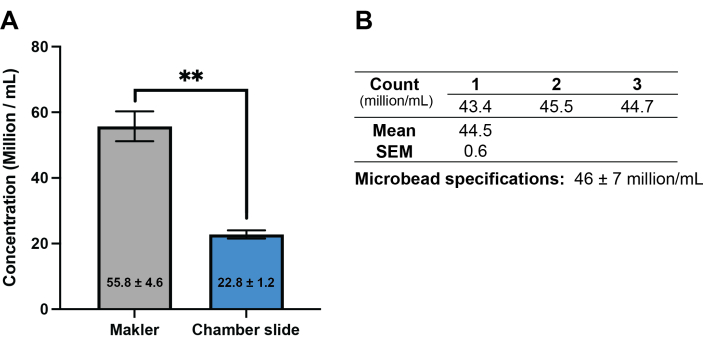
图 2:用于测量珊瑚精子浓度的两种不同腔室载玻片选项的比较。 (A) 使用 Makler 计数室和市售固定盖玻片室载玻片测量 Acropora millepora (n = 3 个个体)中精子总浓度测量值的比较。柱显示 SEM ±平均值。星号表示差异显著 (P = 0.002)。(B) 使用已知浓度的市售乳胶微珠和珊瑚精子的标准 CASA 设置验证 Makler 计数室。 请单击此处查看此图的较大版本。
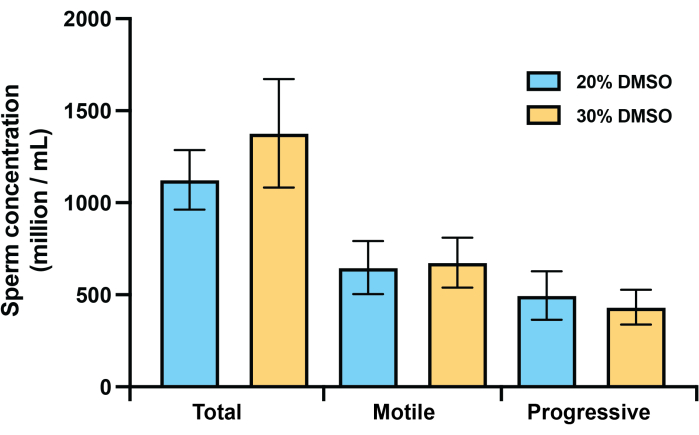
图 3:冻存样品中总精子、运动精子或逐渐运动精子的解冻后浓度。 在 FSW 中使用 20% 或 30% DMSO 对总精子、运动精子和逐渐运动精子浓度进行解冻后比较,以达到用于冷冻保存的最终 10% DMSO 浓度。将来自 n = 3 个个体的样品分成 2 个等分试样,其中一份等分试样以 1:1 的比例添加 20% DMSO 冷冻保存,第二份等分试样使用 FSW 稀释至 <2 × 109/mL,用于冷冻保存,以 1:2 的比例添加(精子:低温稀释剂)添加 30% DMSO。柱显示 SEM ±平均值。 请单击此处查看此图的较大版本。
补充文件 1:珊瑚生物样本库自动数据表文件。请点击此处下载此文件。
讨论
本协议中描述的半自动加工途径允许对珊瑚精子进行高效加工和冷冻保存,以保护来自受威胁物种的遗传学并支持珊瑚礁恢复和适应工作。开发该方案的动机是缺乏适合珊瑚精子冷冻保存的通量要求和使用冷冻管的现有系统,因为用于精子冷冻保存的高通量处理系统通常基于 0.25 mL 或 0.5 mL 法式吸管的样品包装21,22.相比之下,冻存管通常要么用于小规模低通量处理(例如,用于研究的实验室样品的冻存 23,24),要么用于使用昂贵、非便携式设备的散装样品的高通量处理系统(例如,用于工业的细胞培养处理18,25).我们还研究了使用自动加盖系统来简化冻存管盖的拆卸和更换的可能性,但系统仅适用于单个冻存管或整个冻存管架,因此它们无法提供经济高效的解决方案。目前,全球有几个团体正在使用 Hagedorn 等人4 设计的低温保存方案来确保珊瑚的遗传多样性,重要的是这项工作继续扩展到世界各地的更多珊瑚礁。因此,制定当前方案的一个主要考虑因素是需要利用这些其他群体可以轻松实施的具有成本效益且可访问的技术,并且对于想要开始珊瑚精子冷冻保存的新群体来说,这些技术不会令人望而却步。
所述协议的一个关键组成部分是通过 Microsoft Excel 中的链接电子表格 改进对样本元数据的处理。数据输入通常很简单,但必须注意,编辑自动数据表中的信息只能通过删除和重新输入信息来完成,因为编辑数据的快速功能(例如,Ctrl + C、Ctrl + V)可能会影响其他用户同时输入,并可能导致电子表格之间的数据链接出现问题。一个重要的元数据组件是与供体菌落相关联的唯一标识符(即菌落 ID),并在加工途径的所有阶段连接到样品。在收集样品束时,必须清楚地标明样品管上的菌落 ID,并且此信息必须准确转录到制备过程中(例如,在过滤以分离卵子和精子或添加低温稀释剂期间)将样品转移到的任何新试管上。尽管该方案能够将样品质量信息从 CASA 操作员自动传输到冻存工作站,但当互联网或 Wi-Fi 覆盖较差时,可能会遇到问题。如果遇到数据传输延迟,建议两个工作站离线工作,并维护单独的自动数据表,以便事后进行核对。冻存操作员需要的关键信息是菌落 ID 和样品浓度,因此建议 CASA 操作员将样品浓度写在样品管上作为备份,以确保如果计算机之间元数据的上传或下载出现延迟,这些信息可用于冻存制备。
用于该方案的条形码扫描仪和条形码冻存管的选择可以有所不同,以适应预算和产品可用性;但是,在选择时应考虑一些关键要素。条码扫描器应具有自定义设置的能力,特别是更改数据输入规范和数据输入方向的能力。用于该方案的自动数据表使用水平输入,但在某些情况下(例如,进入生物样本库或用于其他实验室用途)可能需要垂直输入,因此此功能的可定制性非常重要。虽然该方案可用于 1D 和 2D 条形码,但建议所选冻存管具有人类可读的组件(例如,1D 条形码通常包含唯一编号),以便在冻存过程中对样品输入进行交叉检查。除了样本输入之外,条形码扫描仪还可用于自动输入一些元数据字段,方法是创建并打印出二维码,以获取在产卵前在样本中重复的信息(例如,物种名称、日期和珊瑚礁位置)。然后,通过使用条形码扫描仪进行扫描,可以快速轻松地将此信息输入到自动数据表中。此外,通过将序列号条形码附加到每个冻存架和热电偶探头上,还可以将每次冻存运行与数据库中的一组特定设备联系起来,这对于质量控制和识别需要维修或更换的组件非常有用。
处理过程中的限制因素通常是等待成束分解所花费的时间,以及在 CASA 和冷冻保存之前过滤和分离精子与卵子所需的时间。在可能的情况下,建议按照样品束分解的顺序处理样品;但是,通过对样本处理订单的战略管理,可以进一步提高效率。例如,如果由于样品量少(即每个菌落的精子少于 3 mL)或需要用低温稀释剂 2:1 稀释的精子浓度低(即小于 2 到 10 9/mL)导致每个菌落有 5 个或更少的冷冻管(即小于 2 × 10个 9/mL),那么最好同时向两个菌落样品中添加低温稀释剂,以便它们可以在同一冻存架上一起运行(可用插槽总数 # = 11), 而不是用假人填充空白来单独运行它们。此外,可以同时运行多个冻存架(对于 > mL 体积的样品),前提是注意确保所有过程都能在 10 min 的低温稀释剂平衡时间内完成,这可以进一步提高样品通量。但是,当运行多个冻存架或在单个冻存架上组合多个菌落时,必须注意确保在自动数据表中将冻存元数据分配给正确的样品,特别是当样品的冻存顺序与其 CASA 评估不同时。
除了半自动工作流程的开发外,本方案描述还提供了两种与精子浓度相关的方法学比较,旨在改善精子分析和冷冻保存结果。一般来说,在 5 mL 海水(总体积 10 mL)上收集 5 mL 配子束将导致精子浓度等于或高于 2 × 109 个细胞/mL,但有时由于物种差异或精子束在收集过程中破裂,精子浓度可能会降低。使用更高浓度的 DMSO 低温稀释剂 (30% v/v) 可减少精子的稀释量,以帮助最大限度地减少冷冻管中精子浓度的批次间差异。重要的是,使用 30% DMSO 达到最终 DMSO 浓度不会影响解冻后浓度或运动参数,如图 3 中的代表性数据所示。第二种方法比较提供了通常用于 CASA 的一次性固定盖玻片室载玻片的替代方案。使用市售载玻片分析珊瑚精子的主要挑战是,由于精子粘附在载玻片涂层上,它们会影响运动评估的准确性。在许多(但不是全部)样品中使用活化溶液克服了这个问题,因此仍然建议使用普通玻片对运动进行单独的 CASA 分析,以确保可靠性和一致性。使用 Makler 计数室克服了单独分析浓度和运动性的需要,并可能提高浓度测量的准确性(图 2),因此建议与当前方案一起使用。鉴于浓度测量的这种差异,这一发现之前已经报道过20 年,重要的是始终在数据库中记录载玻片详细信息以及精子质量数据,并且尽可能在用于最大限度地减少批次间差异的腔室载玻片类型上保持一致,并有助于确保可靠的受精精子:卵子比例计算。
本文描述的半自动化过程为来自受威胁珊瑚物种的精子的冷冻保存和生物库提供了一种标准化和有效的途径,同时保持样品的生物安全性和质量。所描述的协议易于转移且在世界各地致力于使用冷冻保存保护现有珊瑚多样性的项目中实施成本相对较低,这对于防止灭绝和最大限度地利用现在和未来珊瑚礁恢复工作的可用资源至关重要。
披露声明
作者报告说,没有需要声明的竞争利益。
致谢
我们感谢 Konomie 的传统所有者 Woppaburra 人,允许在 2022 年 11 月的国内产卵期间试用本文中描述的系统,并感谢 Konomie 环境教育中心使用他们的设施。我们还要感谢澳大利亚海洋科学研究所工作人员和科学家的支持,他们促进了国家海洋模拟器内群落的收集和产卵。这项工作是珊瑚礁恢复和适应计划低温保存子计划 (RRAP-CP-01) 的一项活动,该计划是澳大利亚政府珊瑚礁信托基金和大堡礁基金会之间的合作伙伴关系,并得到了澳大利亚塔龙加保护协会、塔龙加保护科学倡议和支持塔龙加基金会的其他慈善家的额外支持。
材料
| Name | Company | Catalog Number | Comments |
| Ovation ALI-Q 2 VS Pipette Controller - Aliquotting pipette | Vistalab | 2100-1005 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| 5 mL serological pipettes (bulk) | Thermo Scientific | Nunc 170355 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| 10 mL serological pipettes (bulk) | Thermo Scientific | Nunc 170356 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| P2 0.2–2 µL pipettor | Gilson | F144054M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P10 1–10 µL pipettor | Gilson | F144055M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P20 2–20 µL pipettor | Gilson | F144056M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P200 20–200 µL pipettor | Gilson | F144058M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P1000 100–1000 µL pipettor | Gilson | F144059M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| Vacuum pump | Millipore | WP6122050 | Preparation of filtered sea water for solution preparation |
| Reusable bottle-top filtration system | Thermo Scientific | DS0320-5045 | Preparation of filtered sea water for solution preparation |
| 0.22-µm filter discs, mixed cellulose esters | Merck Millipore | GSWP04700 | Preparation of filtered sea water for solution preparation |
| Filtered sea water | N/A | – | Base medium for sperm activation and cryoprotectant solutions |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D4540 | Cryoprotectant chemical used at a final concentration of 10% v/v in filtered seawater for sperm cryopreservation |
| Caffeine | Sigma-Aldrich | C0750 | Used to activate sperm motility |
| BSA heat shock fraction | Sigma-Aldrich | A9647 | Used to minimise sperm adherance to CASA well slides |
| 15-mL tubes - racked | Thermo Scientific | 339651 | Preparation of sperm activation solution |
| 50-mL tubes racked | Thermo Scientific | 339653 | For collection of gamete bundles and filtered sperm samples |
| Transfer pipettes | Thermo Scientific | Samco 202PK | To aid collection of gamete bundles from the water surface |
| 100-µm filter baskets | Fisher Scientific | 22363549 | To exclude eggs during separation of the sperm sample |
| Eppendorf racks | Interpath | 511029 | Dilution and activation of sperm for concentration and motiliy assessment |
| Eppendorf 1.5-mL tube | Eppendorf | 30120086 | Dilution and activation of sperm for concentration and motiliy assessment |
| Glass coverslips 18x18 mm | Brand | 4700 45 | Assessment of sperm concentration and motility using phase microscopy |
| Plain glass slides, precleaned, 75x25 mm | Corning | 2947 | Assessment of sperm concentration and motility using phase microscopy |
| Haemocytometer | Hausser Scientific | 1492 | Assessment of sperm concentration and motility using phase microscopy |
| CASA slides (Leja 20-µm 4 chamber, SC-20-01-04-B) | IMV Technologies | 025107 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| Makler sperm counting chamber (CASA) | IVFStore | SM-373 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| accu-bead® counting beads | Hamilton-Thorne | 710111 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| CASA system + laptop | Hamilton Thorne | Ceros II | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| Safety Glasses | Generic | – | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Lab coat | Long sleeve, full length | – | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Cryogloves (pair) | Tempshield | Mid-Arm | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Medium forceps | Generic | – | For removing cryopreserved samples from the cryo racks and manipulating samples in liquid nitrogen |
| Barcode scanner (2D compatible) | Zebra | DS2278 | For reading 1D and 2D barcodes on cryovials for sample management |
| 2.0-mL CryoStorage Vial, external thread, pre-capped, 2D SafeCode (DataMatrix/ECC200), linear and human readable | Eppendorf | 30079434 | Barcoded cryovials for cryopreservation of sperm samples |
| Cryovial rack | Simport | T315 | Rack to hold cryovials, with locking base to allow for one hand de-capping and capping |
| Freezing racks | Custom | – | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Freezing rack lid | Custom | – | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Freezing Thermos – 1.5 Litre 18/8 Stainless Steel Double-Wall Vacuum Food Container | Isosteel | VA-9683 | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Lab timers | Generic | – | For timing of cryoprotectant equilibration prior to cryopreservation |
| Nitrogen bath 9L | BelArt | M16807-9104 | For quenching samples during cryopreservaton and holding samples during sorting and handling |
| Thermocouple data logger- multichannel | Omega | HH520 | Temperature monitoring during cryopreservation to determine freezing rate and end point |
| Thermocouple probe – Type K | Omega | 5SC-TT-K-30-36 | Temperature monitoring during cryopreservation to determine freezing rate and end point |
| Cryo pens/coloured permanent pen | Staedtler Lumocolor | 318 | Optional for marking cryovial lids to assist with sample management |
| Dry Shipper - charged | Taylor Wharton | CXR100, or CX500 | For transfer of cryopreserved samples from field/collection sites to the biorepository for storage |
参考文献
- Eakin, C. M., Sweatman, H. P. A., Brainard, R. E. The 2014-2017 global-scale coral bleaching event: Insights and impacts. Coral Reefs. 38 (4), 539-545 (2019).
- Anthony, K., et al. New interventions are needed to save coral reefs. Nature Ecology & Evolution. 1 (10), 1-3 (2017).
- Wildt, D. E. Genome resource banking for wildlife research, management, and conservation. ILAR journal / National Research Council, Institute of Laboratory Animal Resources. 41 (4), 228-234 (2000).
- Hagedorn, M., et al. Preserving and using germplasm and dissociated embryonic cells for conserving Caribbean and Pacific coral. PLoS ONE. 7 (3), e33354 (2012).
- Hagedorn, M., et al. First frozen repository for the Great Barrier Reef coral created. Cryobiology. 65 (2), 157-158 (2012).
- Zuchowicz, N., Daly, J., Lager, C., Williamson, O., Hagedorn, M. Freezing on the beach: A robust coral sperm cryopreservation design. Cryobiology. 101, 135-139 (2021).
- Hobbs, R. J., et al. A decade of coral biobanking science in Australia - transitioning into applied reef restoration. Frontiers in Marine Science. , 9 (2022).
- Daly, J., et al. Cryopreservation can assist gene flow on the Great Barrier Reef. Coral Reefs. 41, 455-462 (2022).
- Hagedorn, M., et al. Assisted gene flow using cryopreserved sperm in critically endangered coral. Proceedings of the National Academy of Sciences of the United States of America. 118 (38), e2110559118 (2021).
- Daly, J., et al. Successful cryopreservation of coral larvae using vitrification and laser warming. Scientific Reports. 8, 1-10 (2018).
- Daly, J., et al. The first proof of concept demonstration of nanowarming in coral tissue. Advanced Sustainable Systems. , (2023).
- Powell-Palm, M. J., et al. Cryopreservation and revival of Hawaiian stony corals via isochoric vitrification. Nature Communications. 14, 4859 (2023).
- . Reef Restoration and Adaptation Program Available from: https://gbrrestoration.org (2023)
- . Florida Coral Rescue Available from: https://myfwc.com/research/habitat/coral/disease/rescue (2023)
- Harrison, P. L. . Coral reefs: An ecosystem in transition. , 59-85 (2011).
- Hagedorn, M., Carter, V. L. Cryobiology: Principles, species conservation and benefits for coral reefs. Reproduction, Fertility and Development. 28 (8), 1049 (2016).
- Zuchowicz, N., et al. Assessing coral sperm motility. Scientific Reports. 11, 61 (2021).
- Thomas, D. Evaluation of an automated cryovial dispensing system for cell banking. Genetic Engineering & Biotechnology News. 37 (17), 22-23 (2017).
- . Coral cryopreservation training course Available from: https://nationalzoo.si.edu/center-for-species-survival/coral-cryopreservation-training-course (2023)
- Bailey, E., et al. Validation of sperm counting methods using limits of agreement. Journal of Andrology. 28 (3), 364-373 (2007).
- Hu, E., Yang, H., Tiersch, T. R. High-throughput cryopreservation of spermatozoa of blue catfish (Ictalurus furcatus): Establishment of an approach for commercial-scale processing. Cryobiology. 62 (1), 74-82 (2011).
- Pickett, B. W., Berndtson, W. E. Preservation of bovine spermatozoa by freezing in straws: A review. Journal of Dairy Science. 57 (11), 1287-1308 (1974).
- Westbrook, C. E., Daly, J., Bowen, B., Hagedorn, M. Cryopreservation of the collector urchin embryo, Tripneustes gratilla. Cryobiology. 15, 104865 (2024).
- Maria, A. N., et al. Use of cryotubes for the cryopreservation of Tambaqui fish semen (Colossoma macropomum). Cryobiology. 70 (2), 109-114 (2015).
- Fuchs, Y. F., et al. Next-generation biobanking: Employing a robotic system for automated mononuclear cell isolation. Biopreservation & Biobanking. 21 (1), 106-110 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。