Method Article
Un flusso di lavoro semi-automatizzato per la crioconservazione di sperma di corallo a supporto del biobanking e dell'acquacoltura
In questo articolo
Riepilogo
Questo protocollo descrive un percorso semi-automatizzato per migliorare l'efficienza e la capacità di elaborazione e crioconservazione dello sperma proveniente da specie di coralli minacciate, con l'obiettivo di garantire la diversità genetica e sostenere gli sforzi di ripristino della barriera corallina.
Abstract
Le barriere coralline stanno affrontando una crisi a causa dell'aumento della frequenza degli eventi di sbiancamento causati dal riscaldamento degli oceani, con conseguente morte dei coralli sulle barriere coralline di tutto il mondo. La conseguente perdita di diversità genetica e biodiversità può diminuire la capacità dei coralli di adattarsi ai cambiamenti climatici, quindi gli sforzi per preservare la diversità esistente sono essenziali per massimizzare le risorse disponibili per il ripristino della barriera corallina ora e in futuro. L'approccio più efficace per garantire la genetica a lungo termine è la crioconservazione e la biobanca, che consente la conservazione congelata di campioni viventi a temperature criogeniche in azoto liquido a tempo indeterminato. La crioconservazione degli spermatozoi di corallo è possibile dal 2012, ma la natura stagionale della riproduzione dei coralli significa che le attività di biobanca sono limitate a poche notti all'anno in cui si verifica la deposizione delle uova. Migliorare l'efficienza dei flussi di lavoro di processazione e crioconservazione dello sperma di corallo è quindi essenziale per massimizzare queste limitate opportunità di biobanca. A tal fine, abbiamo deciso di ottimizzare i percorsi di elaborazione della crioconservazione per lo sperma di corallo basandosi sulle tecnologie esistenti e creando un approccio semi-automatizzato per semplificare la valutazione, la gestione e la crioconservazione dello sperma di corallo. Il processo, che combina l'analisi dello sperma assistita da computer, crioviali con codice a barre e una serie di schede tecniche automatiche collegate per la modifica simultanea da parte di più utenti, migliora l'efficienza sia dell'elaborazione dei campioni che della gestione dei metadati sul campo. Attraverso l'integrazione con programmi di ricerca trasversali come il Reef Restoration and Adaptation Program in Australia, la crioconservazione può svolgere un ruolo cruciale nei programmi di ripristino della barriera corallina su larga scala, facilitando la gestione genetica delle popolazioni di acquacoltura, sostenendo la ricerca per migliorare la tolleranza termica e prevenendo l'estinzione delle specie di coralli. Le procedure descritte saranno utilizzate per i professionisti della crioconservazione dei coralli e delle biobanche sulle barriere coralline di tutto il mondo e forniranno un modello per la transizione delle tecnologie di crioconservazione dai laboratori di ricerca alle applicazioni su larga scala.
Introduzione
Le barriere coralline di tutto il mondo stanno subendo una perdita di specie, popolazioni e diversità genetica di coralli a causa del riscaldamento degli oceani e dell'acidificazione causata dai cambiamenti climatici, diminuendo la vitalità di questi habitat critici e influenzando le specie che supportano 1,2. L'approccio più efficace per garantire la genetica a lungo termine è la crioconservazione e la biobanca, che consente la conservazione congelata di campioni viventi a temperature criogeniche in azoto liquido a tempo indeterminato3. Lo sviluppo nel 2012 di metodi per la crioconservazione dello sperma di corallo4 ha permesso per la prima volta il biobanking della genetica di queste specie e ha portato allo sviluppo del primo biorepository per la genetica dei coralli nel 20125. Da allora, questo protocollo di crioconservazione è stato ulteriormente perfezionato6 e utilizzato per garantire la genetica di oltre 50 specie di coralli a livello globale, di cui 30 provenienti dalla Grande Barriera Corallina in Australia7. Gli spermatozoi di corallo crioconservati possono generare coralli sani che si sviluppano normalmente e sono stati utilizzati per facilitare esperimenti di flusso genico assistito in Australia8 e nei Caraibi9. Mentre le tecnologie sono attualmente in fase di sviluppo per consentire la crioconservazione di tipi di tessuti complessi come le larve10 e i tessuti di corallo adulto 11,12, la crioconservazione dello sperma di corallo è attualmente lo strumento più consolidato disponibile per la biobanca di routine della genetica dei coralli.
Con l'aumento dell'impatto sulle popolazioni di coralli, diversi paesi hanno avviato programmi su larga scala per sostenere il ripristino e l'adattamento della barriera corallina (ad esempio, il Reef Restoration and Adaptation Program [RRAP] in Australia13) o per garantire le popolazioni di coralli in pericolo rimanenti (ad esempio, Florida Coral Rescue negli Stati Uniti14). Nel contesto di questi programmi, la crioconservazione può essere considerata una tecnologia abilitante, che supporta la ricerca e la produzione di coralli su larga scala, oltre a garantire la diversità genetica esistente e prevenire le estinzioni. La crioconservazione dello sperma può consentire un maggiore controllo sulla riproduzione tra popolazioni fisicamente o temporalmente separate e può consentire la gestione genetica dei riproduttori per selezionare i tratti desiderabili come la tolleranza termica o la resistenza alle malattie8. Ad oggi, la biobanca degli spermatozoi di corallo è stata intrapresa su scala relativamente piccola a sostegno della gestione della biodiversità7, quindi sarà necessario un certo livello di upscaling se tale biobanca vuole raggiungere il suo potenziale all'interno di questi più ampi programmi di ripristino della barriera corallina. Come per tutti gli sforzi di ripristino della barriera corallina basati sulla riproduzione dei coralli, il principale ostacolo all'aumento degli sforzi di biobanca è il periodo limitato durante il quale i gameti di corallo sono disponibili, poiché la deposizione delle uova nella maggior parte delle specie che costruiscono la barriera corallina coincide con la luna piena in tarda primavera e all'inizio dell'estate15, il che significa che i gameti sono disponibili per la crioconservazione e il biobanking solo in poche notti all'anno. Inoltre, nelle regioni in cui si verifica la deposizione delle uova di massa, ad esempio la Grande Barriera Corallina, ci sono in genere più specie che depongono le uova contemporaneamente o entro poche ore l'una dall'altra nella stessa notte15. Sono quindi necessari miglioramenti al percorso di crioconservazione degli spermatozoi per aumentare la scala e l'efficienza del trattamento per massimizzare la capacità di biobanca durante queste brevi finestre annuali di riproduzione, garantendo al contempo l'integrità dei campioni e dei metadati associati.
La crioconservazione e la biobanca degli spermatozoi di corallo prevedono diverse fasi chiave, dalla raccolta dei gameti durante la deposizione delle uova all'inserimento dei campioni nel biorepository e nel database (Figura 1). Il processo inizia con la separazione degli spermatozoi dagli ovuli (nelle specie ermafrodite) o la raccolta degli spermatozoi dalla colonna d'acqua (nelle specie gonocoriche), seguita dalla valutazione della motilità e della concentrazione degli spermatozoi. Gli spermatozoi vengono quindi combinati con un crioprotettore (concentrazione finale del 10% v/v, dimetilsolfossido, DMSO) in acqua di mare filtrata (FSW) e raffreddati a -20 °C/min in un dispositivo di raffreddamento progettato su misura4. Le prime iterazioni di questo processo si basavano sulla valutazione visiva della motilità e della concentrazione degli spermatozoi tramite microscopia a contrasto di fase e conta dell'emocitometro, stampa e marcatura delle provette mentre i campioni venivano elaborati per la crioconservazione, il pipettaggio manuale dei campioni di sperma in crioviali e il raffreddamento su un rack galleggiante appositamente progettato16. L'applicazione dell'analisi dello sperma assistita da computer (CASA)17 e lo sviluppo di un dispositivo di raffreddamento stampato in 3D6 hanno migliorato l'efficienza e l'affidabilità della crioconservazione degli spermatozoi di corallo, ma il percorso di elaborazione dei campioni di sperma è rimasto in gran parte lo stesso sin dal suo inizio. Sebbene questo approccio sia adatto per l'elaborazione di campioni provenienti da un numero moderato di colonie e specie in una notte di riproduzione, per grandi volumi e numeri di colonie (ad esempio, singoli campioni da >10 colonie alla volta), ci sono colli di bottiglia nel percorso di crioconservazione che impediscono l'elaborazione dei campioni in modo tempestivo (cioè entro 2 ore dal rilascio dello sperma) senza degradazione del potenziale di fertilità del campione. Sebbene siano disponibili sistemi di movimentazione dei fluidi su larga scala per crioviali (ad esempio, Thomas et al.18), sono tipicamente progettati per l'elaborazione di grandi lotti (ad esempio, più rack di crioviali) e non sono adatti per il trasporto e l'uso sul campo, quindi non sono convenienti per questa applicazione. Pertanto, il presente studio mirava a migliorare l'efficienza della crioconservazione dello sperma di corallo introducendo apparecchiature e metodi di automazione portatili ed economici nelle fasi chiave del percorso di elaborazione per massimizzare il numero di campioni che potrebbero essere efficacemente crioconservati in una notte di deposizione delle uova.
Protocollo
I metodi qui descritti possono essere utilizzati per elaborare e crioconservare spermatozoi di specie di coralli ermafroditi e gonocori. Un'introduzione generale e un'introduzione sulla deposizione delle uova dei coralli e sulla raccolta dei gameti per la crioconservazione degli spermatozoi per entrambe le modalità riproduttive sono disponibili presso il corso di formazione sulla crioconservazione dei coralli dello Smithsonian's National Zoo & Conservation Biology Institute19. I metodi descritti sono stati sviluppati principalmente utilizzando gameti provenienti da colonie di Acropora millepora raccolte dal gruppo di isole Keppel nella regione del Mare di Woppaburra e dalla barriera corallina di Davies nella regione del Mare di Bindal, nella Grande Barriera Corallina in Australia. La raccolta e l'uso di coralli e gameti sono stati effettuati con il consenso libero, preventivo e informato dei Custodi Tradizionali dei Paesi Marittimi interessati. I reagenti e le attrezzature utilizzate per questo studio sono elencati nella Tabella dei materiali.
1. Pre-deposizione delle uova - controlli del sistema e preparazione della soluzione di attivazione dello sperma e del criodiluente
- Verificare che lo scanner di codici a barre sia carico, attivo e impostato per inserire i dati del foglio di calcolo come immissione orizzontale della cella. Consultare il manuale utente del lettore di codici a barre per personalizzare questa impostazione.
- Preparare soluzioni stock concentrate per l'attivazione degli spermatozoi di corallo per CASA.
NOTA: È necessario indossare guanti monouso quando si maneggiano sostanze chimiche per la preparazione della soluzione di attivazione.- Preparare una soluzione madre di albumina sierica bovina (BSA) al 30% (5 mL) sciogliendo 1,5 g di BSA in 4 mL di acqua sterile di coltura di tessuti purificati con l'aiuto di uno scaldaprovette impostato a 37 °C o tenendo la provetta con le mani a coppa, agitando delicatamente periodicamente (non agitare il flaconcino).
- Una volta in soluzione, portare al volume finale (5 mL) utilizzando acqua di coltura tissutale, etichettare la provetta con la data e contrassegnare "30% BSA in H2O".
- Conservare in frigorifero a 4 °C per un massimo di 2 settimane.
- Preparare 60 mM di soluzione madre di caffeina (25 mL) sciogliendo 0,2913 g di caffeina in 24 mL di acqua di mare filtrata (FSW).
- Una volta in soluzione, portare al volume finale (25 mL) utilizzando FSW, etichettare la provetta con la data e contrassegnare "60 mM di caffeina in FSW".
- Conservare in frigorifero per un massimo di 1 mese.
NOTA: La solubilità massima della caffeina in FSW è di circa 71 mM.
- Preparare la soluzione di lavoro per l'attivazione degli spermatozoi per i campioni di sperma a ~109 spermatozoi/mL (0,9% BSA + 12 mM di caffeina in FSW).
- Per una soluzione di lavoro da 10 mL, combinare 2,0 mL di 60 mM di soluzione madre di caffeina + 0,3 mL di soluzione madre BSA al 30% + 7,7 mL di FSW.
- Etichettare il tubo con la data e "soluzione di lavoro per l'attivazione degli spermatozoi - 0,9% BSA + 12 mM di caffeina".
- Preparare ogni giorno di utilizzo, conservare a temperatura ambiente (19-30 °C) e gettare la soluzione non utilizzata alla fine della giornata.
- Preparare soluzioni crioprotettive (criolubrificanti). Assicurarsi che vengano indossati guanti monouso quando si maneggia il crioprotettore DMSO.
NOTA: FSW viene preparato con concentrazioni di crioprotettore variabili a seconda della concentrazione iniziale di spermatozoi all'interno di un campione e della concentrazione finale di spermatozoi desiderata di aliquote crioconservate. Quando si prepara il criodiluente, assicurarsi che l'FSW sia aliquotato nella provetta da 50 ml prima dell'aggiunta di DMSO.- Raccogli l'acqua di mare grezza dal sistema di vasche in cui sono tenuti i coralli prima della deposizione delle uova (~35 ppt di salinità).
- Filtra l'acqua di mare grezza utilizzando un sistema di filtrazione a bottiglia collegato a una pompa a vuoto con un filtro a membrana apirogeno da 0,2 μm montato.
- Per una concentrazione di spermatozoi ≥2 × 109 spermatozoi/mL, preparare il 20% di DMSO in FSW combinando 10 mL di DMSO + 40 mL di FSW in una provetta da 50 mL.
- Per una concentrazione di spermatozoi <2 × 109 spermatozoi/mL, preparare il 30% di DMSO in FSW combinando 15 mL di DMSO + 35 mL di FSW in una provetta da 50 mL.
- Etichettare la provetta con la data e la concentrazione di DMSO, cioè 30% DMSO o 20% DMSO.
- Preparare ogni giorno di utilizzo, conservare a temperatura ambiente (19-30 °C) e gettare la soluzione non utilizzata alla fine di ogni giornata.
NOTA: La miscelazione di DMSO e FSW crea una reazione esotermica e il criodiluente deve essere preparato con largo anticipo rispetto all'uso per consentire il raffreddamento a temperatura ambiente. L'FSW può essere conservato a 4 °C per la preparazione del criodiluente per controbilanciare questa generazione di calore.
- Preparare il datalogger della termocoppia.
- Per misurare la velocità di raffreddamento approssimativa di ogni ciclo di crioconservazione, posizionare un crioviale contenente il 10% di DMSO in FSW con una sonda a termocoppia inserita attraverso il coperchio in una fessura per campioni del rack di crioconservazione accanto ai campioni di sperma.
- Per realizzare una fiala di termocoppia, infilzare o fondere un piccolo foro nel tappo del crioviale con codice a barre e inserire una termocoppia di tipo K o T attraverso l'apertura. Spingere la punta della sonda della termocoppia verso il basso a un livello tale che si trovi al centro del campione quando la fiala è piena, mantenendo la punta della sonda centrata nella fiala per evitare il contatto con la parete interna della fiala. Sigillare il tappo e tenere in posizione la sonda della termocoppia con la colla a caldo.
- Indossando guanti monouso, riempire il crioviale con codice a barre con un volume di DMSO al 10% in FSW pari al volume del campione di sperma da crioconservare.
- Preparare il DMSO fresco al 10% in FSW e riempire le fiale di termocoppia ogni giorno.
2. Preparazione e valutazione dello sperma
- Per le specie ermafrodite (ad esempio, le specie Acropora ), raccogliere i fasci di gameti dalla superficie dell'acqua utilizzando una pipetta di trasferimento da 3 ml e inserirli in una provetta da 50 ml etichettata con un rapporto di 5 ml di fasci di gameti su 5 ml di acqua di mare (10 ml di volume totale).
- Per le specie gonocoriche, raccogliere gli spermatozoi vicino alla bocca del polipo utilizzando una pipetta di trasferimento da 3 ml e posizionare il campione in una provetta da 50 ml etichettata, quindi procedere direttamente al passaggio 2.8.
NOTA: I guanti monouso non sono necessari per la raccolta e la manipolazione di campioni di gameti, ma possono essere indossati se si preferisce. Le mani devono essere lavate accuratamente con acqua dolce o i guanti devono essere cambiati tra un campione di gamete e l'altro per evitare la contaminazione incrociata. - Per le specie ermafrodite, agitare i fasci spermatozoo-ovulo facendo roteare delicatamente il campione a mano fino a quando i fasci non si sono rotti.
NOTA: Alcune specie di Montipora hanno una tossina nelle uova, quindi devono essere lasciate cadere a pezzi lentamente con una minima agitazione per evitare di danneggiare lo sperma. - Lasciare riposare il campione per 2 minuti in una rastrelliera per provette per consentire alle uova di galleggiare in superficie e allo spermatozoo di depositarsi (le uova formeranno uno strato rosa/marrone sulla superficie e le singole uova saranno visibili; vedere Figura 1i).
- Per separare gli spermatozoi e rimuovere gli ovuli contaminanti, aspirare delicatamente gli spermatozoi dal fondo della provetta utilizzando una pipetta di trasferimento pulita da 3 ml.
- Trasferire il campione di sperma in un filtro cellulare da 100 μm posizionato sopra una nuova provetta da centrifuga sterile da 50 mL. Il campione dovrebbe fluire facilmente attraverso il filtro. Picchiettare il filtro per favorire il flusso del campione e, se necessario, è possibile utilizzare una pipetta di trasferimento pulita per raccogliere il campione residuo dalla parte inferiore del filtro. Rimuovere il filtro, quindi tappare il tubo senza stringere per consentire il ricambio d'aria.
- Etichettare il campione di sperma filtrato con l'ID della colonia e spostare il campione nella postazione di valutazione dello sperma.
- Aprire il file della scheda tecnica automatica del biobanking dei coralli (File supplementare 1). Nella scheda Valutazione sperma, inserisci i metadati della colonia di coralli (colonne A-H).
- Preparare lo sperma per la valutazione CASA.
- Mescolare bene il campione di sperma e rimuovere un'aliquota da 10 μL in una provetta da microcentrifuga vuota da 1,8 mL.
- Aggiungere immediatamente 0,390 ml di soluzione di attivazione degli spermatozoi goccia a goccia nell'arco di 10-20 s, mescolando delicatamente gli spermatozoi nella soluzione. Questo dà un rapporto di diluizione di 1:39 (spermatozoi: soluzione, v/v) (o fattore di diluizione di 40), che fornisce una concentrazione appropriata per la valutazione CASA (~50 × 106/mL) se la concentrazione di spermatozoi grezzi è ~2 × 109 spermatozoi/mL. Capovolgere la provetta 5 volte e muovere il coperchio della provetta prima dell'apertura per depositare la soluzione sul fondo della provetta.
NOTA: La concentrazione di spermatozoi per CASA deve essere compresa tra 8-50 × 106/mL per consentire un accurato tracciamento degli spermatozoi17. Se necessario, è possibile aggiungere un'ulteriore soluzione di attivazione degli spermatozoi all'aliquota di spermatozoi grezzi per ridurne la concentrazione. Ricalcola il tasso di diluizione e inserisci questo valore nel foglio di calcolo. Nei casi in cui è necessario processare contemporaneamente molti campioni, le provette per microcentrifuga da 1,8 mL possono essere precaricate con 0,390 mL di soluzione di lavoro per l'attivazione degli spermatozoi con l'aggiunta diretta dell'aliquota di 10 μL di campione di sperma, quindi miscelate bene capovolgendo la provetta di 10× e muovendo il coperchio della provetta prima dell'apertura.
- Valutare la motilità degli spermatozoi e la concentrazione del campione attivato utilizzando l'analisi degli spermatozoi assistita da computer (CASA) come descritto in Zuchowicz et al.17 posizionando 4 μL di sospensione di spermatozoi attivati su una camera di conteggio Makler20 o mediante valutazione visiva e conta emocitometrica al microscopio a contrasto di fase come descritto in Hagedorn et al.4.
NOTA: La camera Makler e il vetrino coprioggetti devono essere puliti bene con etanolo al 70%, quindi acqua distillata e puliti con un panno privo di lanugine tra i campioni. - Inserire il fattore di diluizione degli spermatozoi utilizzato per la valutazione CASA e inserire gli output CASA per la concentrazione di spermatozoi (milioni/mL), la motilità totale (%) e la motilità progressiva (%) nella scheda tecnica automatica.
NOTA: Ulteriori metriche CASA, tra cui la velocità media del percorso (VAP), la velocità in linea retta (VSL) e la velocità curvilinea (VCL) possono essere incluse facoltativamente nella scheda tecnica automatica o recuperate dai file CASA salvati in un secondo momento. - Annotare la concentrazione di spermatozoi sulla provetta filtrata e trasferire il campione alla stazione di crioconservazione nello stesso ordine in cui avviene per la rottura e l'elaborazione del fascio.
3. Diluizione degli spermatozoi ed equilibrazione crioprotettiva
- Alla postazione di lavoro per la crioconservazione, aprire lo stesso file della scheda tecnica automatica per la biobanca dei coralli utilizzato dalla workstation per la valutazione dello sperma e selezionare la scheda Crioconservazione . Controllare l'etichetta della provetta del campione di sperma e identificare la voce corrispondente controllando l'ID della colonia (colonna C). Se non si accede contemporaneamente allo stesso file della scheda tecnica automatica tra le workstation, inserire manualmente i dati nell'ID della colonia (colonna C) e nella concentrazione di spermatozoi (colonna F) nella scheda tecnica automatica.
- Utilizzando una pipetta sierologica, misurare il volume del campione di sperma aspirando il campione nella pipetta ed espellendolo nuovamente nella stessa provetta; inserire il valore nella colonna E.
- Controllare la colonna I calcolata automaticamente per la concentrazione di crioprotettore richiesta e la colonna H per il volume di criodiluente da aggiungere (Tabella 1).
- Avviare un timer per 10 minuti e, utilizzando una pipetta sierologica, iniziare immediatamente ad aggiungere il criodiluente, goccia a goccia, mescolando costantemente e delicatamente il campione, assicurandosi che vengano indossati guanti monouso per la manipolazione del DMSO.
- Registrare il tempo di aggiunta del criodiluente nella colonna P.
| Concentrazione di spermatozoi | Criodiluente | Rapporto di diluizione (spermatozoo:criodiluente) | Concentrazione finale di DMSO nel campione di sperma (%) |
| < 2 × 109/mL | 30% DMSO in FSW | 2:1 | 10% |
| ≥ 2 × 109/mL | 20% DMSO in FSW | 1:1 | 10% |
Tabella 1: Rapporti di concentrazione e diluizione del criodiluente per la crioconservazione dello sperma di corallo, in base alla valutazione della concentrazione totale di spermatozoi nel campione da crioconservare.
4. Crioconservazione dello sperma
- Leggere la colonna K per determinare quanti crioviali riempire. Questo viene calcolato automaticamente dal volume totale di spermatozoi e dal volume desiderato per fiala (1 ml nella maggior parte dei casi). Durante il periodo di incubazione di 10 minuti, procedere con i passaggi da 4.2 a 4.6.
- Aprire i crioviali sterili con codice a barre e posizionare i tappi su una superficie pulita/sterile.
- Opzionale: Scrivi la corsa # su ogni crioviale usando un pennarello indelebile; Ciò può aiutare a identificare rapidamente il campione per l'accesso alla biobanca.
- Utilizzando una pipetta sierologica e un pipettatore di aliquotazione impostato sul volume di campione desiderato (1 mL), aliquotare i campioni in crioviali con codice a barre senza tappo e richiudere le fiale di riepilogo.
- Posizionare una fiala della termocoppia e tutte le fiale di campioni pieni su un rack criogenico vuoto a temperatura ambiente. Assicurarsi che la superficie del codice a barre sia rivolta verso l'esterno su tutte le fiale.
- Se necessario, posizionare ulteriori crioviali fittizi contenenti il 10% di DMSO in FSW in tutti gli spazi vuoti del rack criogenico per assicurarsi che tutti gli spazi siano occupati.
- Inserire il numero di corsa nella scheda tecnica automatica (colonna U) e scansionare il numero di serie del rack criogenico (codice QR) nella colonna V.
- Posizionare il cursore nella cella corretta della colonna Z ed eseguire la scansione nella fiala della termocoppia, seguita da tutte le provette crioviali caricate sul rack (dalla colonna AA in poi). Evitare di inclinare il rack su un lato per assicurarsi che il campione non entri nella filettatura del flaconcino.
- Durante la scansione, verificare che i dati siano stati inseriti nella cella corretta e che tutti i crioviali siano stati scansionati una volta.
- Mettere da parte i rack caricati e scansionati per il resto del periodo di equilibrio del crioprotettore e preparare il recipiente di raffreddamento per la crioconservazione.
- Riempire il recipiente di raffreddamento della criogriglia con azoto liquido fino al livello predeterminato appropriato necessario per il raffreddamento a circa -20 °C/min.
NOTA: L'azoto deve essere utilizzato solo in aree ben ventilate poiché esiste il rischio di asfissia. Quando si maneggia l'azoto liquido, è necessario indossare scarpe chiuse, occhiali di sicurezza/visiere e guanti criogenici. Fare riferimento alle linee guida istituzionali per informazioni specifiche sulla manipolazione e l'uso dell'azoto liquido. - Al termine del periodo di equilibrio crioprotettivo di 10 minuti, collegare la sonda della termocoppia al datalogger e iniziare la registrazione, quindi posizionare delicatamente il rack criogenico completo nel recipiente di raffreddamento e applicare il coperchio.
- Registrare l'ora di inizio nella colonna Q.
- Una volta che la fiala della termocoppia legge -80 °C o meno sul datalogger, spegnere i campioni in azoto liquido trasferendo l'inserto del rack criogenico in un bagno di azoto liquido in un recipiente separato come una scatola di polistirene.
- Rimuovi i crioviali dal rack e trasferiscili in uno spedizioniere a secco per il trasporto al biorepository.
Risultati
Le fasi descritte in questo protocollo si basano sui metodi originali per la crioconservazione dello sperma di corallo descritti da Hagedorn et al.4 e sul successivo perfezionamento di Zuchowicz et al.6, fornendo miglioramenti chiave per aumentare l'efficienza del trattamento dello sperma per la crioconservazione e il biobanking. L'uso di crioviali con codice a barre e di un autopipettatore aliquotatore semplifica la procedura di confezionamento dello sperma eliminando la necessità di stampare ed etichettare a mano i crioviali e riduce lo sforzo del pipettaggio manuale di un gran numero di campioni. È importante sottolineare che questi miglioramenti riducono anche il tempo necessario per la preparazione del campione per la crioconservazione, da circa 8-10 minuti a meno di 5 minuti. Insieme all'uso di CASA, questi miglioramenti riducono il numero di personale necessario per un'efficiente biobanca degli spermatozoi di corallo, da 4 a 6 nei metodi originali, fino a due persone utilizzando l'attuale protocollo. Inoltre, l'uso di crioviali con codice a barre significa che ogni provetta ha un identificatore univoco, in modo che ciascuna possa essere tracciata all'interno del database con una risoluzione maggiore rispetto al metodo precedente utilizzando etichette stampate in batch.
I test sul campo del protocollo in due eventi di deposizione delle uova durante la stagione riproduttiva della Grande Barriera Corallina 2022 in Australia hanno portato alla crioconservazione e alla biobanca di 389 campioni provenienti da 57 colonie di 5 specie da parte di due operatori (una persona per CASA, una persona per la crioconservazione), con un'altra persona che ha assistito alla rottura del fascio e alla separazione degli spermatozoi, se necessario. Durante l'evento di deposizione delle uova del novembre 2022 a Konomie (North Keppel Island) nel Queensland, in Australia, 150 campioni di 24 colonie di Acropora millepora sono stati crioconservati da due operatori per un periodo di 2 ore. L'efficiente elaborazione e crioconservazione di questo volume di campioni provenienti da un numero così elevato di colonie di coralli è stata resa possibile principalmente dall'efficienza ottenuta nei tempi di preparazione dei campioni e dal trasferimento semplificato dei metadati tra le workstation.
Ulteriori test del flusso di lavoro durante la deposizione delle uova nel dicembre 2023 hanno determinato che, per gli spermatozoi di corallo, la camera di conteggio Makler forniva dati di motilità e concentrazione più accurati rispetto ai vetrini da camera monouso a vetrino coprioggetti fissi disponibili in commercio comunemente utilizzati con i sistemi CASA. La camera di conteggio Makler è stata convalidata per CASA utilizzando microsfere di lattice disponibili in commercio a una concentrazione nota con un volume di campione di 4 μl e le impostazioni CASA standard17 utilizzate per lo sperma di corallo. Queste analisi hanno mostrato conteggi coerenti con bassa variabilità (44,5 ± 0,7 milioni/mL) che rientravano nell'intervallo di concentrazione previsto (46,0 ± 7,0 milioni/mL) fornito dal produttore (Figura 2). Un confronto tra i dati CASA per Acropora millepora raccolti utilizzando la camera di conteggio Makler e i vetrini della camera a vetrino coprioggetti ha rilevato una differenza significativa nel conteggio delle concentrazioni di spermatozoi tra i due tipi di camera (P = 0,002; Figura 2), con i vetrini della camera di scorrimento coprioggetti fissi che registrano meno della metà della concentrazione determinata utilizzando la camera di conteggio Makler. Questa tendenza è stata osservata anche in campioni di sperma di altre due specie di coralli (dati non mostrati). Inoltre, i test effettuati nel dicembre 2023 non hanno riscontrato differenze significative nelle concentrazioni post-scongelamento di spermatozoi totali, mobili o progressivamente mobili nei campioni crioconservati utilizzando una diluizione 1:1 con DMSO al 20% o una diluizione 1:2 (spermatozoi: criodiluente) con DMSO al 30% (Figura 3).

Figura 1: Il flusso di lavoro utilizzato per il trattamento semi-automatizzato di spermatozoi di corallo per la crioconservazione ed esempi di apparecchiature mobili utilizzate sul campo. (A) I fasci di gameti di corallo vengono raccolti in un rapporto di 5 mL di fasci su 5 mL di FSW e suddivisi per separare ovuli e spermatozoi (i). I metadati della colonia vengono inseriti nella scheda tecnica automatica (ii) e il campione di sperma isolato viene valutato utilizzando l'analisi dello sperma assistita da computer (CASA) (iii). I parametri di qualità dello sperma vengono aggiunti all'auto-datasheet per calcolare l'aggiunta del 20% o del 30% di DMSO in FSW (iv) e il campione diluito viene aliquotato in crioviali con codice a barre (v). I crioviali vengono caricati sul rack criogenico e scansionati nella scheda tecnica automatica (vi), quindi raffreddati a una velocità compresa tra -20 °C/min e -80 °C (vii). I campioni vengono quindi raffreddati in azoto liquido e trasferiti a spedizionieri secchi per il trasporto alla Taronga CryoDiversity Bank (viii). (B) Esempio delle stazioni CASA (a sinistra) e di crioconservazione (a destra) allestite in un sito remoto nell'aula del Konomie Environmental Education Centre. (C) Esempio della stazione di crioconservazione ad alta capacità in laboratorio allestita per l'esecuzione di più rack criogenici presso l'Australian Institute of Marine Science National Sea Simulator. Clicca qui per visualizzare una versione più grande di questa figura.
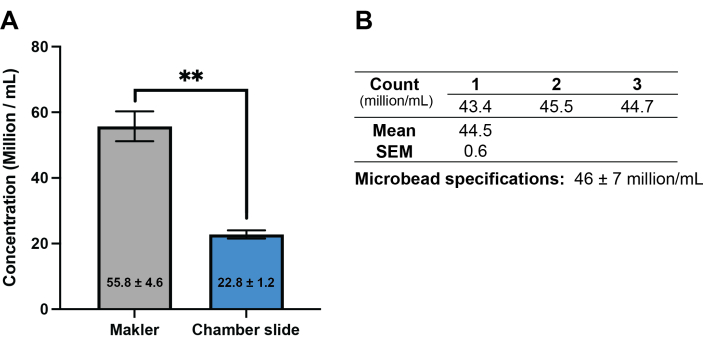
Figura 2: Confronto tra due diverse opzioni di vetrini da camera per la misurazione della concentrazione di spermatozoi di corallo. (A) Confronto delle misure della concentrazione totale di spermatozoi in Acropora millepora (n = 3 individui) utilizzando la camera di conteggio Makler e i vetrini a camera fissa per vetrini coprioggetti disponibili in commercio. Le colonne mostrano la media ± SEM.; gli asterischi indicano una differenza significativa (P = 0,002). (B) Convalida della camera di conteggio Makler utilizzando microsfere di lattice disponibili in commercio a una concentrazione nota e impostazioni CASA standard per spermatozoi di corallo. Clicca qui per visualizzare una versione più grande di questa figura.
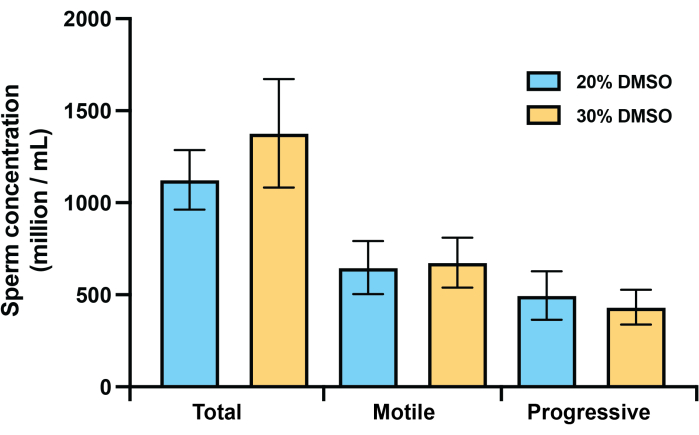
Figura 3: Concentrazioni post-scongelamento di spermatozoi totali, mobili o progressivamente mobili in campioni crioconservati. Confronti post-scongelamento delle concentrazioni di spermatozoi totali, mobili e progressivamente mobili utilizzando il 20% o il 30% di DMSO in FSW per ottenere la concentrazione finale di DMSO del 10% per la crioconservazione. I campioni di n = 3 individui sono stati divisi in 2 aliquote ciascuno, con un'aliquota crioconservata con un'aggiunta 1:1 del 20% di DMSO e la seconda aliquota diluita a <2 × 109/mL utilizzando FSW per la crioconservazione con un'aggiunta 1:2 (sperma: criodiluente) del 30% di DMSO. Le colonne mostrano la media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: File della scheda tecnica automatica del biobanking corallo. Clicca qui per scaricare questo file.
Discussione
Il percorso di elaborazione semi-automatizzato descritto in questo protocollo consente l'elaborazione efficiente e la crioconservazione dello sperma di corallo per proteggere la genetica dalle specie minacciate e sostenere gli sforzi di ripristino e adattamento della barriera corallina. La motivazione per lo sviluppo di questo protocollo è stata la mancanza di sistemi esistenti adatti ai requisiti di produttività della crioconservazione degli spermatozoi di corallo e l'uso di crioviali, poiché i sistemi di elaborazione ad alto rendimento per la crioconservazione degli spermatozoi si basano tipicamente sul confezionamento di campioni in paillettes francesi da 0,25 mL o 0,5 mL21,22. In confronto, i crioviali sono generalmente utilizzati su piccola scala per l'elaborazione a basso rendimento (ad esempio, la crioconservazione di campioni di laboratorio per la ricerca23,24), o in sistemi di elaborazione ad alto rendimento per campioni di massa che utilizzano apparecchiature costose e non portatili (ad esempio, l'elaborazione di colture cellulari per l'industria18,25). Abbiamo anche studiato il potenziale per l'utilizzo di un sistema di auto-decapping per semplificare la rimozione e la sostituzione dei cappucci criovali, ma i sistemi erano disponibili solo per singoli crioviali o per interi rack crioviali, quindi non fornivano una soluzione conveniente. Attualmente, ci sono diversi gruppi a livello globale che stanno utilizzando il protocollo di crioconservazione ideato da Hagedorn et al.4 per garantire la diversità genetica dei coralli, ed è importante che questo lavoro continui ad espandersi a più barriere coralline in tutto il mondo. Pertanto, una considerazione importante nello sviluppo dell'attuale protocollo è stata la necessità di utilizzare tecnologie convenienti e accessibili che potessero essere prontamente implementate da questi altri gruppi e che non fossero proibitive per i nuovi gruppi che volevano iniziare la crioconservazione degli spermatozoi di corallo.
Un componente chiave del protocollo descritto è la migliore gestione dei metadati di esempio tramite fogli di calcolo collegati in Microsoft Excel. L'inserimento dei dati è generalmente semplice, ma va notato che la modifica delle informazioni nei fogli dati automatici deve essere eseguita solo eliminando e reinserendo le informazioni, poiché le funzioni rapide (ad esempio, Ctrl + C, Ctrl + V) per modificare i dati influenzeranno potenzialmente gli input simultanei da parte di altri utenti e possono causare problemi con il collegamento dei dati tra i fogli di calcolo. Un importante componente dei metadati è un identificatore univoco (vale a dire, l'ID della colonia) che è collegato alla colonia donatrice e che è collegato al campione in tutte le fasi del percorso di elaborazione. È essenziale che le provette del campione siano chiaramente etichettate con l'ID della colonia al momento della raccolta del fascio e che queste informazioni siano accuratamente trascritte su tutte le nuove provette in cui il campione viene trasferito durante la preparazione (ad esempio, durante il filtraggio per separare ovuli e spermatozoi o per l'aggiunta di criodiluente). Sebbene il protocollo consenta il trasferimento automatico delle informazioni sulla qualità del campione dall'operatore CASA alla workstation di crioconservazione, è possibile che si verifichino problemi quando la copertura Internet o Wi-Fi è scarsa. Se si verificano ritardi nel trasferimento dei dati, si consiglia di utilizzare le due workstation offline e di mantenere fogli dati automatici separati che possono essere riconciliati in seguito. Le informazioni chiave richieste dall'operatore di crioconservazione sono l'ID della colonia e la concentrazione del campione, quindi si raccomanda che l'operatore CASA scriva la concentrazione del campione sulla provetta del campione come backup per garantire che queste informazioni siano a portata di mano per la preparazione della crioconservazione in caso di ritardo nel caricamento o nel download dei metadati tra computer.
La scelta dello scanner di codici a barre e dei crioviali con codice a barre utilizzati per questo protocollo può essere variata in base al budget e alla disponibilità del prodotto; Tuttavia, ci sono alcuni elementi chiave che dovrebbero essere considerati nella loro selezione. Lo scanner di codici a barre dovrebbe avere la capacità di personalizzare le impostazioni, in particolare la capacità di modificare le specifiche di input dei dati e la direzione di inserimento dei dati. Le schede tecniche automatiche utilizzate per questo protocollo utilizzano l'inserimento orizzontale, ma in alcune occasioni (ad esempio, l'accesso alla biobanca o per altri usi di laboratorio) potrebbe essere richiesto l'inserimento verticale, quindi è importante che questa funzione sia personalizzabile. Sebbene il protocollo possa essere utilizzato sia con codici a barre 1D che 2D, si raccomanda che i crioviali selezionati abbiano un componente leggibile dall'uomo (ad esempio, i codici a barre 1D in genere includono un numero univoco) per consentire il controllo incrociato dell'ingresso del campione durante la crioconservazione. Oltre all'inserimento dei campioni, lo scanner di codici a barre può essere utilizzato per automatizzare l'inserimento di alcuni campi di metadati creando e stampando codici QR per informazioni che vengono ripetute tra i campioni (ad esempio, nomi di specie, date e posizioni della barriera corallina) prima della deposizione delle uova. Queste informazioni possono quindi essere inserite rapidamente e facilmente nelle schede tecniche automatiche scansionando con lo scanner di codici a barre. Inoltre, allegando codici a barre con numero di serie a ciascun rack criogenico e sonda a termocoppia, è anche possibile collegare ogni ciclo di crioconservazione con un set specifico di apparecchiature all'interno del database, utile per il controllo qualità e per identificare i componenti che richiedono riparazione o sostituzione.
I fattori limitanti nella lavorazione sono spesso il tempo trascorso in attesa che i fasci si rompano e il tempo necessario per filtrare e separare lo sperma dagli ovuli prima della CASA e della crioconservazione. Ove possibile, si consiglia di trattare i campioni nell'ordine in cui i fasci si rompono; Tuttavia, è possibile ottenere ulteriori guadagni in termini di efficienza attraverso la gestione strategica degli ordini di elaborazione dei campioni. Ad esempio, se ci sono 5 o meno crioviali per colonia a causa di bassi volumi di campione (cioè meno di 3 mL di spermatozoi per colonia) o di una bassa concentrazione di spermatozoi che richiede una diluizione 2:1 con criodiluente (cioè meno di 2 × 109/mL), allora è meglio aggiungere criodiluente a due campioni di colonia contemporaneamente in modo che possano essere eseguiti insieme sullo stesso rack criogenico (totale # slot disponibili = 11), piuttosto che eseguirli separatamente con manichini che riempiono gli spazi vuoti. Inoltre, è possibile eseguire più rack criogenici contemporaneamente (per campioni >6 mL di volume), a condizione che si presti attenzione a garantire che tutti i processi possano essere completati entro il tempo di equilibratura criodiluente di 10 minuti, il che può aumentare ulteriormente la produttività del campione. Tuttavia, quando si eseguono più rack criogenici o si combinano più colonie su un singolo rack criogenico, è necessario prestare attenzione per garantire che i metadati di crioconservazione siano assegnati al campione corretto nella scheda tecnica automatica, soprattutto se i campioni vengono crioconservati in un ordine diverso dalla loro valutazione CASA.
Oltre allo sviluppo del flusso di lavoro semi-automatizzato, la presente descrizione del protocollo fornisce anche due confronti metodologici relativi alla concentrazione di spermatozoi che mirano a migliorare i risultati dell'analisi dello sperma e della crioconservazione. In generale, la raccolta di 5 ml di fasci di gameti su 5 ml di acqua di mare (volume totale 10 ml) si tradurrà in una concentrazione di spermatozoi pari o superiore a 2 × 109 cellule/mL, ma ci sono occasioni in cui la concentrazione di spermatozoi può essere inferiore a causa di differenze di specie o di fasci che si rompono durante la raccolta. L'uso di un criodiluente DMSO a concentrazione più elevata (30% v/v) riduce la quantità di diluizione degli spermatozoi per ridurre al minimo la variazione da lotto a lotto nella concentrazione di spermatozoi nel crioviale. È importante sottolineare che l'uso del 30% di DMSO per raggiungere la concentrazione finale di DMSO non influisce sulla concentrazione post-scongelamento o sui parametri di motilità, come mostrato dai dati rappresentativi nella Figura 3. Il secondo confronto metodologico fornisce un'alternativa ai vetrini monouso a camera fissa a vetrino coprioggetti tipicamente utilizzati per CASA. La sfida principale con l'utilizzo di vetrini disponibili in commercio per l'analisi degli spermatozoi di corallo è che possono influire sull'accuratezza della valutazione della motilità a causa dell'adesione degli spermatozoi al rivestimento del vetrino. L'uso della soluzione di attivazione risolve questo problema in molti, ma non in tutti, i campioni, pertanto si consiglia comunque di eseguire un'analisi CASA separata per la motilità utilizzando un vetrino semplice per garantire affidabilità e coerenza. L'uso di una camera di conteggio Makler supera la necessità di analizzare separatamente la concentrazione e la motilità e potenzialmente migliora l'accuratezza delle misure di concentrazione (Figura 2), quindi se ne consiglia l'uso con il protocollo attuale. Data questa discrepanza nelle misurazioni della concentrazione, un risultato che è stato riportato in precedenza20, è importante registrare sempre i dettagli del vetrino nel database insieme ai dati sulla qualità dello sperma e, ove possibile, essere coerenti nel tipo di vetrino da camera utilizzato per ridurre al minimo la variazione da lotto a lotto e contribuire a garantire calcoli affidabili dei rapporti spermatozoi/ovuli per le fecondazioni.
Il processo semi-automatizzato qui descritto fornisce un percorso standardizzato ed efficiente per la crioconservazione e la bioconservazione dello sperma di specie di coralli minacciate, mantenendo al contempo la biosicurezza e la qualità del campione. Il protocollo descritto è facilmente trasferibile e relativamente poco costoso da implementare in programmi in tutto il mondo che stanno lavorando per garantire la diversità dei coralli esistenti utilizzando la crioconservazione, che sarà essenziale per prevenire le estinzioni e massimizzare le risorse disponibili per gli sforzi di ripristino della barriera corallina ora e in futuro.
Divulgazioni
Gli autori riferiscono che non ci sono interessi concorrenti da dichiarare.
Riconoscimenti
Ringraziamo i proprietari tradizionali di Konomie, il popolo Woppaburra, per il permesso di testare il sistema descritto in questo documento durante la deposizione delle uova nel paese nel novembre 2022, e il Centro di Educazione Ambientale di Konomie per l'uso delle loro strutture. Vorremmo anche ringraziare il supporto del personale dell'Australian Institute of Marine Science e degli scienziati che hanno facilitato la raccolta e la deposizione delle uova delle colonie all'interno del National Sea Simulator. Questo lavoro è stato intrapreso come attività del sottoprogramma di crioconservazione (RRAP-CP-01) per il Reef Restoration and Adaptation Program, una partnership tra il Reef Trust del governo australiano e la Great Barrier Reef Foundation, con il supporto aggiuntivo della Taronga Conservation Society Australia, della Taronga Conservation Science Initiative e di altri filantropi che sostengono la Taronga Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Ovation ALI-Q 2 VS Pipette Controller - Aliquotting pipette | Vistalab | 2100-1005 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| 5 mL serological pipettes (bulk) | Thermo Scientific | Nunc 170355 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| 10 mL serological pipettes (bulk) | Thermo Scientific | Nunc 170356 | Fluid handling – measuring sperm volume, addition of cryoprotectant solution, aliquoting samples into cryovials |
| P2 0.2–2 µL pipettor | Gilson | F144054M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P10 1–10 µL pipettor | Gilson | F144055M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P20 2–20 µL pipettor | Gilson | F144056M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P200 20–200 µL pipettor | Gilson | F144058M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| P1000 100–1000 µL pipettor | Gilson | F144059M | Preparation of sperm activation solutions and sperm sample handling for concentration and motiliy assessment |
| Vacuum pump | Millipore | WP6122050 | Preparation of filtered sea water for solution preparation |
| Reusable bottle-top filtration system | Thermo Scientific | DS0320-5045 | Preparation of filtered sea water for solution preparation |
| 0.22-µm filter discs, mixed cellulose esters | Merck Millipore | GSWP04700 | Preparation of filtered sea water for solution preparation |
| Filtered sea water | N/A | – | Base medium for sperm activation and cryoprotectant solutions |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D4540 | Cryoprotectant chemical used at a final concentration of 10% v/v in filtered seawater for sperm cryopreservation |
| Caffeine | Sigma-Aldrich | C0750 | Used to activate sperm motility |
| BSA heat shock fraction | Sigma-Aldrich | A9647 | Used to minimise sperm adherance to CASA well slides |
| 15-mL tubes - racked | Thermo Scientific | 339651 | Preparation of sperm activation solution |
| 50-mL tubes racked | Thermo Scientific | 339653 | For collection of gamete bundles and filtered sperm samples |
| Transfer pipettes | Thermo Scientific | Samco 202PK | To aid collection of gamete bundles from the water surface |
| 100-µm filter baskets | Fisher Scientific | 22363549 | To exclude eggs during separation of the sperm sample |
| Eppendorf racks | Interpath | 511029 | Dilution and activation of sperm for concentration and motiliy assessment |
| Eppendorf 1.5-mL tube | Eppendorf | 30120086 | Dilution and activation of sperm for concentration and motiliy assessment |
| Glass coverslips 18x18 mm | Brand | 4700 45 | Assessment of sperm concentration and motility using phase microscopy |
| Plain glass slides, precleaned, 75x25 mm | Corning | 2947 | Assessment of sperm concentration and motility using phase microscopy |
| Haemocytometer | Hausser Scientific | 1492 | Assessment of sperm concentration and motility using phase microscopy |
| CASA slides (Leja 20-µm 4 chamber, SC-20-01-04-B) | IMV Technologies | 025107 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| Makler sperm counting chamber (CASA) | IVFStore | SM-373 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| accu-bead® counting beads | Hamilton-Thorne | 710111 | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| CASA system + laptop | Hamilton Thorne | Ceros II | Assessment of sperm concentration and motility using Computer Assisted Sperm Analysis (CASA) |
| Safety Glasses | Generic | – | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Lab coat | Long sleeve, full length | – | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Cryogloves (pair) | Tempshield | Mid-Arm | Personal protective equi[pment for use when handling DMSO and liquid nitrogen |
| Medium forceps | Generic | – | For removing cryopreserved samples from the cryo racks and manipulating samples in liquid nitrogen |
| Barcode scanner (2D compatible) | Zebra | DS2278 | For reading 1D and 2D barcodes on cryovials for sample management |
| 2.0-mL CryoStorage Vial, external thread, pre-capped, 2D SafeCode (DataMatrix/ECC200), linear and human readable | Eppendorf | 30079434 | Barcoded cryovials for cryopreservation of sperm samples |
| Cryovial rack | Simport | T315 | Rack to hold cryovials, with locking base to allow for one hand de-capping and capping |
| Freezing racks | Custom | – | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Freezing rack lid | Custom | – | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Freezing Thermos – 1.5 Litre 18/8 Stainless Steel Double-Wall Vacuum Food Container | Isosteel | VA-9683 | Cryopreservation system custom designed for coral sperm, utilising 3D-printed and readily available components. Parts list and assembly instructions are available in Zuchwicz et al., 2021 (doi:10.1016/j.cryobiol.2021.04.005) |
| Lab timers | Generic | – | For timing of cryoprotectant equilibration prior to cryopreservation |
| Nitrogen bath 9L | BelArt | M16807-9104 | For quenching samples during cryopreservaton and holding samples during sorting and handling |
| Thermocouple data logger- multichannel | Omega | HH520 | Temperature monitoring during cryopreservation to determine freezing rate and end point |
| Thermocouple probe – Type K | Omega | 5SC-TT-K-30-36 | Temperature monitoring during cryopreservation to determine freezing rate and end point |
| Cryo pens/coloured permanent pen | Staedtler Lumocolor | 318 | Optional for marking cryovial lids to assist with sample management |
| Dry Shipper - charged | Taylor Wharton | CXR100, or CX500 | For transfer of cryopreserved samples from field/collection sites to the biorepository for storage |
Riferimenti
- Eakin, C. M., Sweatman, H. P. A., Brainard, R. E. The 2014-2017 global-scale coral bleaching event: Insights and impacts. Coral Reefs. 38 (4), 539-545 (2019).
- Anthony, K., et al. New interventions are needed to save coral reefs. Nature Ecology & Evolution. 1 (10), 1-3 (2017).
- Wildt, D. E. Genome resource banking for wildlife research, management, and conservation. ILAR journal / National Research Council, Institute of Laboratory Animal Resources. 41 (4), 228-234 (2000).
- Hagedorn, M., et al. Preserving and using germplasm and dissociated embryonic cells for conserving Caribbean and Pacific coral. PLoS ONE. 7 (3), e33354 (2012).
- Hagedorn, M., et al. First frozen repository for the Great Barrier Reef coral created. Cryobiology. 65 (2), 157-158 (2012).
- Zuchowicz, N., Daly, J., Lager, C., Williamson, O., Hagedorn, M. Freezing on the beach: A robust coral sperm cryopreservation design. Cryobiology. 101, 135-139 (2021).
- Hobbs, R. J., et al. A decade of coral biobanking science in Australia - transitioning into applied reef restoration. Frontiers in Marine Science. , 9 (2022).
- Daly, J., et al. Cryopreservation can assist gene flow on the Great Barrier Reef. Coral Reefs. 41, 455-462 (2022).
- Hagedorn, M., et al. Assisted gene flow using cryopreserved sperm in critically endangered coral. Proceedings of the National Academy of Sciences of the United States of America. 118 (38), e2110559118 (2021).
- Daly, J., et al. Successful cryopreservation of coral larvae using vitrification and laser warming. Scientific Reports. 8, 1-10 (2018).
- Daly, J., et al. The first proof of concept demonstration of nanowarming in coral tissue. Advanced Sustainable Systems. , (2023).
- Powell-Palm, M. J., et al. Cryopreservation and revival of Hawaiian stony corals via isochoric vitrification. Nature Communications. 14, 4859 (2023).
- . Reef Restoration and Adaptation Program Available from: https://gbrrestoration.org (2023)
- . Florida Coral Rescue Available from: https://myfwc.com/research/habitat/coral/disease/rescue (2023)
- Harrison, P. L. . Coral reefs: An ecosystem in transition. , 59-85 (2011).
- Hagedorn, M., Carter, V. L. Cryobiology: Principles, species conservation and benefits for coral reefs. Reproduction, Fertility and Development. 28 (8), 1049 (2016).
- Zuchowicz, N., et al. Assessing coral sperm motility. Scientific Reports. 11, 61 (2021).
- Thomas, D. Evaluation of an automated cryovial dispensing system for cell banking. Genetic Engineering & Biotechnology News. 37 (17), 22-23 (2017).
- . Coral cryopreservation training course Available from: https://nationalzoo.si.edu/center-for-species-survival/coral-cryopreservation-training-course (2023)
- Bailey, E., et al. Validation of sperm counting methods using limits of agreement. Journal of Andrology. 28 (3), 364-373 (2007).
- Hu, E., Yang, H., Tiersch, T. R. High-throughput cryopreservation of spermatozoa of blue catfish (Ictalurus furcatus): Establishment of an approach for commercial-scale processing. Cryobiology. 62 (1), 74-82 (2011).
- Pickett, B. W., Berndtson, W. E. Preservation of bovine spermatozoa by freezing in straws: A review. Journal of Dairy Science. 57 (11), 1287-1308 (1974).
- Westbrook, C. E., Daly, J., Bowen, B., Hagedorn, M. Cryopreservation of the collector urchin embryo, Tripneustes gratilla. Cryobiology. 15, 104865 (2024).
- Maria, A. N., et al. Use of cryotubes for the cryopreservation of Tambaqui fish semen (Colossoma macropomum). Cryobiology. 70 (2), 109-114 (2015).
- Fuchs, Y. F., et al. Next-generation biobanking: Employing a robotic system for automated mononuclear cell isolation. Biopreservation & Biobanking. 21 (1), 106-110 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon