Method Article
基于 SPE-UPLC 的单花生 (Arachis spp.) 中黄曲霉毒素和二苯乙烯类植物抗毒素的无损定量分析种子
摘要
我们展示了一种使用超高效液相色谱法定量单个花生种子中黄曲霉毒素和二苯乙烯类植物抗毒素的中等通量方法。该方法专为分析受产黄曲霉菌属攻击的野生花生物种而开发。
摘要
黄曲霉毒素是某些真菌物种(尤其是 黄曲霉)的高度致癌次生代谢产物。黄曲霉毒素通常会污染包括花生在内的具有重要经济价值的农产品,对人类和动物健康构成高风险。由于遗传基础狭窄,花生品种对真菌病原体的抵抗力有限。因此,许多对 曲霉 菌耐受的野生花生物种已被科学家大量考虑作为抗病来源。
探索植物种质对黄曲霉毒素的抗性是困难的,因为黄曲霉毒素的积累不遵循正态分布,这决定了需要分析数千颗单一花生种子。充分水合的花生 (Arachis spp.) 种子在被 曲霉 属感染时,能够产生具有生物活性的二苯乙烯 (stilbenoids),这些二苯乙烯被认为是防御性植物抗毒素。花生二苯乙烯抑制真菌发育和黄曲霉毒素的产生。因此,分析相同的种子中的花生二苯乙烯类化合物以解释种子对 曲霉 菌入侵的抗性/易感性的性质至关重要。已发表的方法均未提供黄曲霉毒素和/或二苯乙烯植物抗毒素的单种子分析。
我们试图满足对这种环境友好、使用廉价耗材、灵敏和选择性的方法的需求。此外,该方法是非破坏性的,因为它只使用一半的种子,而另一半包含胚轴则完好无损。这种技术允许花生植株从用于黄曲霉毒素和类苯乙烯分析的相同种子发芽和生长至完全成熟。该方法的集成部分,即用 曲霉菌手动挑战种子,是一个限制性步骤,与该方法中的其他步骤相比,需要更多的时间和劳动力。该方法已用于探索野生 花 生种质,以鉴定对 曲霉属 耐药的物种,并确定和表征对这种真菌病原体的遗传抗性的新来源。
引言
花生 (Arachis hypogaea L.) 是世界上主要的粮食作物之一。它在 100 多个国家/地区种植,总产量超过 4500 万吨1。农产品,如花生、玉米和棉籽,经常被 曲霉菌种入侵,曲霉菌是产生黄曲霉毒素的土壤真菌2。当环境条件以高温和干旱为特征时,这些商品特别容易受到采伐前黄曲霉毒素的污染。黄曲霉毒素是已知最有效的致癌物之一3.它们污染了世界上四分之一的农产品4 ,使世界上大约一半的人口长期接触黄曲霉毒素5。由于黄曲霉毒素具有很高的致癌性和毒性,因此世界上大多数国家/地区将食品中的黄曲霉毒素限制在实际可接受的最低限度6。
欧盟 (EU) 已立法规定,供人食用的商品中黄曲霉毒素 B1 的最高含量为 2 ng/g,总黄曲霉毒素(B1、B2、G1 和 G2)的最高含量为 4 ng/g7。如此低的限值给加工受黄曲霉毒素污染的商品的农业和食品工业带来了巨大压力。黄曲霉毒素监测和受污染花生的再加工可能被认为是防止黄曲霉毒素进入食物链的一种被动且昂贵的策略。这就是为什么由于当前花生品种的黄曲霉毒素污染,花生行业的所有主要部门都遭受了巨大的利润损失,这些品种通常对真菌病害的抵抗力有限。解决黄曲霉毒素问题的前瞻性方法是通过基因渗入获得抗真菌花生品种,即将遗传信息从抗性野生花生物种转移到优良品种。近年来 8,9,野生花生物种被广泛考虑作为遗传病抗性的来源,因为栽培花生的狭窄遗传基础不再能为花生植物提供所需水平的抗性状10,11。野生花生物种的成功渗入需要分析数千种单一的小而稀少的种子(图 1A) 12。
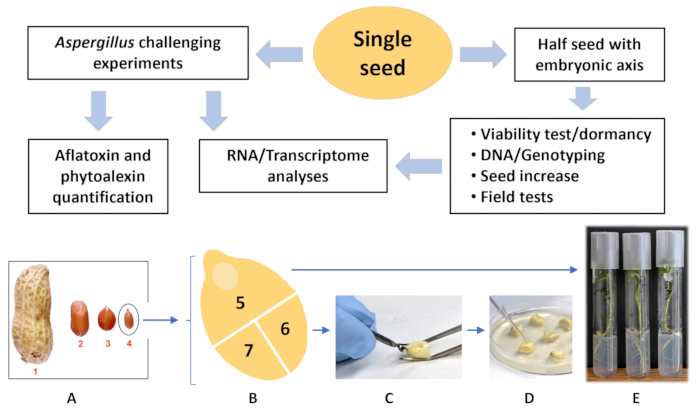
图 1:单种子分析流程图。(A) 不同市场型花生品种与野生花生品种的大小比较。(1) 弗吉尼亚州;(2) 转轮;(3) 西班牙语;(4) 野生花生属 (B) 野生花生属(板 A,种子 4)切成三段,(5) 半种子,胚轴;种子的这一部分用于种植植物 (E)。(C) 部分 (6) 和 (7) 用钻头钻孔,(D) 接种真菌孢子。在30°C下孵育72小时后,其中一个种子部分(6)或(7)用于黄曲霉毒素和植物抗毒素分析,另一个用于RNA /转录组测序。请单击此处查看此图的较大版本。
花生对真菌病原体的抗性与植物抗毒素 13,14,15,16,17 密切相关。花生植物抗毒素以抗菌二苯乙烯为代表,这些二苯乙烯在暴露于外源性刺激(特别是真菌入侵)后生物合成并积累在植物组织中 16,17,18。在真菌入侵部位快速积累足够浓度的植物抗毒素可抑制真菌生长,对植物防御至关重要 19,20,21。当植物抗毒素积累到抑制浓度16,22 时,病原体停止生长。30 多年前,在田间实验中评估了类苯乙烯作为花生中产黄曲霉菌的防御化合物的作用13。这些实验清楚地支持了花生二苯乙烯是收获前黄曲霉毒素污染的关键抗性因素的假设。这些证据基于以下事实:二苯乙烯是在田间受损的花生中自然产生的;二苯乙烯对产黄曲霉菌表现出明显的生物活性;只有当花生因干旱诱导的种子脱水而失去植物抗毒素合成能力时,才能检测到种子中的黄曲霉毒素污染。另一组田间实验证实了植物抗毒素产生与花生基因型对农业上重要的花生病害的抗性之间的关联17。
更好地了解花生对真菌入侵的天然植物抗毒素机制是控制黄曲霉毒素污染的一种有前途的策略15,17。因此,除了黄曲霉毒素分析外,定量分析相同的种子中的植物抗毒素也很重要。尽管这种抗性机制尚未得到充分研究和理解,但它对于培育和转基因新的抗真菌栽培品种的花生植物至关重要23。尽管存在各种分析程序来测定不同商品中的黄曲霉毒素,但仍需要简单的方法进行特定研究,特别是当传统方法无法满足分析和成本效益要求时。花生工业、农业和私人实验室使用的大多数现代净化方法是基于抗体的24 和免疫测定 25,26,27 设备。它们具有选择性和灵敏度,但比填充有常见吸附剂的微型柱要贵得多。此外,这些方法都不是为分析几毫克重量的样品而设计的。根据我们之前对镁硅胶 (Florisil) 填充微型柱28 的分析使用的研究,我们修改了该程序,以适应正在进行和潜在的育种前和育种计划的需求。
这项工作的目的是开发一种无损、中等通量、环保的方法,用于定量测定单个花生种子中的黄曲霉毒素和植物抗毒素。已经开发了这样的方法。与已发表的方法相比,它的优势在于灵敏度更高,能够分析单种子提取物中的黄曲霉毒素和植物抗毒素,无需称量样品,并且由于消耗品体积较小,成本更低。集成方法的流程图如图 1 所示。本文中提到了遗传分析和其他步骤,并在图中进行了演示,以表明所建议方法的重要性以及它如何与整个程序相结合。
研究方案
1. 准备用于真菌攻击的种子
- 将产黄曲霉 NRRL 3357 在试管中的马铃薯葡萄糖琼脂 (PDA) 上于 30 °C 下孵育 6 天。 用 10 mL 水和 Tween 20(100 μL 吐温在 1 L 蒸馏无菌水中)从试管中收获真菌孢子,通过放置在漏斗中的玻璃棉过滤,并参考用户手册用血细胞计数器计数孢子。
- 用无菌水将孢子悬液稀释至 1,000 个孢子/μL 浓度。用血细胞计数器确认浓度。
注意:在具有挑战性的实验前不早于 2 小时准备孢子悬浮液。 - 轻轻敲碎花生荚,去掉外壳。将种子放入无菌烧杯中,使种子体积不超过烧杯体积的 1/5,加入 0.05% 过氧化氢溶液至烧杯体积的约 70%,并让种子吸水 3 小时。
- 从种子中倒出过氧化氢溶液,并向烧杯中加入大约 3 倍量的 80% 乙醇-水混合物 (v/v) 以覆盖种子。静置 1 分钟,然后用等体积的无菌蒸馏水冲洗种子 2 次。
- 将 5 倍体积的 3% 过氧化氢加入装有乙醇灭菌种子的烧杯中,静置 5 分钟,然后倒出液体并用等体积的无菌水冲洗种子两次(图 2A)。
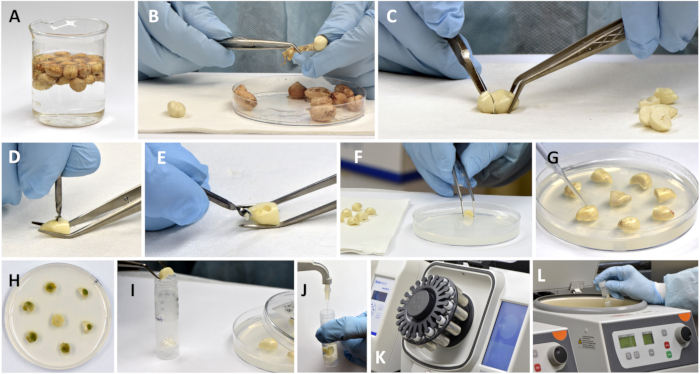
图 2:用于接种、孵育和提取黄曲霉毒素和植物抗毒素组分的花生种子的制备。 (A) 用 3% 过氧化氢对吸收的种子进行消毒;(B) 从种子中去除睾丸(皮);(C) 切断胚胎轴部分;(D,E) 带钻头的半子叶钻腔;(F) 将钻好的种子部分放在琼脂上;(G) 将真菌孢子施入钻孔的空腔中。(H) 孵育后带种子的培养皿;(I) 将孵育的单颗种子(对照样品的照片)放入增强的珠管中;(j) 加入测量体积的萃取溶剂;(K) 在微珠破裂器中粉碎样品;(L) 粉碎浆液的离心。 请单击此处查看此图的较大版本。
- 将种子放在无菌纸巾上,用镊子取出种子 testa,然后用手术刀切下约 1/3 的含有胚轴的种子(图 2B,C)。
- 丢弃这部分种子或使用它在带有生长培养基的试管中培养植物(图 1B,E)。
- 将种子的剩余部分分成两个子叶,将它们放入培养皿中,用湿润的无菌滤纸覆盖种子部分,盖上盖子以避免脱水,并立即进行接种步骤。
- 在进行具有挑战性的实验之前,将 26 mL 1.5% 无菌琼脂的水中倒入 100 x 15 mm 培养皿中,并让它们凝固过夜,从而用种子培养培养基制备足够数量的培养皿。
- 在每个剩余子叶的外侧中间,用直径为 1.5-2.34 毫米的无菌尖钻头手动钻种子,制成 1.5-2 毫米深的空腔。制作空腔需要 ~2-5 秒(图 2D,E)。
- 将 4 至 6 块“钻孔”的种子放入装有琼脂的培养皿中,然后用 10 μL 移液器将 2 μL 的 1,000 个孢子/μL 悬浮液加入每个半子叶块的钻孔腔中。不要使用孢子悬浮液,而是将无菌水涂抹在对照种子上(图 2F,G)。
- 用盖子盖住所有培养皿,并在 30 °C 无光下孵育 72 小时。
2. 用于黄曲霉毒素和植物抗毒素分析的孵育种子块的取样和制备
- 在 72 小时时收集种子块,方法是用镊子从琼脂中取出种子块,并将其每个放入带有 13 个锆陶瓷珠(12 个直径为 2.8 毫米,1 个直径为 6.5 毫米)的标记的 7 mL 珠子瓶中(图 2H,I)。
注:此时,如果不立即处理,可以将样品瓶放入 -80 °C 冰箱中,并在进一步处理之前保存长达 2 个月。 - 植物抗毒素和黄曲霉毒素在同一种子提取物中测定。对于提取,根据视觉种子大小(小、中或大),向微珠小瓶中加入 2 或 4 mL 精确测量的甲醇-水混合物(90:10,v/v),并以 5.5 m/sec 的速度粉碎 45 秒。将装有颗粒种子的小瓶放入离心机中,以 1,860 × g 离心 3 分钟(图 2J - L)。
注:确定了以下重要的 17,22 种二苯乙烯衍生物(均采用反式构型):白藜芦醇、花生素-1、花生素-2、花生素-3、3'-异戊二烯-3,5,4'-三羟基二苯乙烯 (IPD) 和 SB-1。 - 对于黄曲霉毒素分析,在运行具有挑战性的实验之前,请准备足够数量的净化柱,如下所示。将匹配的聚乙烯多孔 (20 μL) 筛板放入 1.5 mL 聚丙烯色谱柱中,借助以 90o 角切割的玻璃棒。用定制的勺子将 50 mg 镁硅胶(100-200 目)放入色谱柱中,然后用玻璃棒将其向下推,用相同的筛板盖住色谱柱(图 3A - E)。
注:此量的镁硅胶占 75 μL 体积,吸附层高度为 3 mm。

图 3:净化柱和过滤器的制备。 (A,B) 将多孔筛板放入桶中;(C,D) 用镁硅胶填充桶;(E) 填充吸附剂并将顶部多孔筛板插入桶中。(F) 将直径为 11.5 mm 的玻璃纤维圆圈放在巴斯德移液器的顶部。(G,H)用塑料或木棒将圆心向下推到巴斯德移液器桶的底部,并牢固地压实玻璃纤维。 请单击此处查看此图的较大版本。
- 此时,准备匹配数量的定制过滤器,如图 3F - H 所示。
- 对于黄曲霉毒素分析,精确测量多达 0.5 mL 等分试样的上清液(如步骤 2.2 所述获得),将其转移到定制填充的微型柱中,并让提取物在重力作用下排入 4 mL 玻璃瓶中。将 1.0 mL 甲醇-水 (90:10, v/v) 混合物转移至色谱柱中,通过重力将杂质洗入同一 4 mL 样品瓶中(图 4A)。

图 4:种子提取物的纯化和 UPLC 分析的准备工作。 (A) 填充柱架。 (B) 从六个 4 mL 样品瓶中加入 N2 气体蒸发溶剂,其中纯化提取物从净化柱中洗脱。(C) 将注射溶剂(MeOH-H2O 9:1,v/v)添加到 4 mL 样品瓶中之前和之后,将样品瓶和过滤器在加冰泡沫容器(1 和 2)中加热至零度以下温度。(D) 将 4 mL 样品瓶中冷却的提取物过滤到 400 μL 自动进样器样品瓶中。 请单击此处查看此图的较大版本。
- 丢弃合并的洗脱液。通过重力将黄曲霉毒素馏分从色谱柱洗脱到含有 1.2 mL 丙酮-乙腈-水-88% 甲酸(65:31:3.5:0.5,v/v)混合物的干净的 4 mL 玻璃瓶中(图 4A)。
- 或者,用 2.0 mL 乙腈-水-88% 甲酸 (96:3.5:0.5, v/v) 混合物从色谱柱中洗脱黄曲霉毒素,然后将等分试样(最多 2 μL)直接注入超高效液相色谱 (UPLC) 系统中(无需蒸发 N2 溶剂)。
注:在这种情况下,黄曲霉毒素的定量限预计最高可达 10 倍;在大多数情况下,这种灵敏度下降是可以接受的,因为攻击种子中的黄曲霉毒素浓度通常很高。 - 在 45 °C 的加热块中,以 N2 流的形式从样品瓶中取出溶剂。 盖上样品瓶盖,将其放入装有碎冰的容器中 30-45 秒,以尽量减少后续步骤中添加的溶剂的蒸发。将定制的过滤器放入一次性试管中,并将试管插入另一个容器中的冰中,以尽量减少过滤时溶剂的蒸发(图 4B,C)。
- 溶剂蒸发后,将干燥残留物溶解在精确测量的 0.25-1.0 mL 甲醇-水混合物(90:10,v/v)中,涡旋 1-2 秒。将装有纯化提取物的小瓶放入 UPLC 自动进样器中,向 UPLC 系统注入 0.1 至 3.0 μL(图 5A、B)。
注意:如果怀疑涡旋后的溶液中有一些悬浮颗粒,请通过冷却的过滤器过滤溶液(图 4D)。
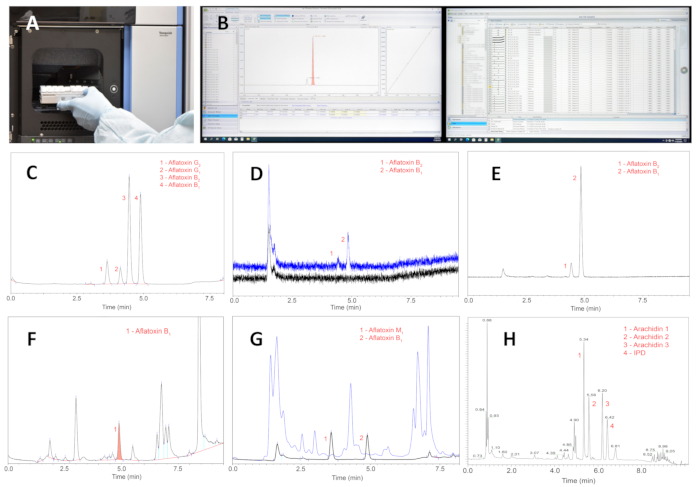
图 5:纯化提取物的 UPLC 分析过程和结果。 (A) 将装有纯化样品提取物的样品架放入 UPLC 自动进样器中。(B) 进行工具分析、获取数据和解释结果。(C) 四种主要黄曲霉毒素的 UPLC;感兴趣的主要峰黄曲霉毒素 B1 和 B2 分别代表 0.04 和 0.004 ng。(D) 黄曲霉毒素 B1 和 B2 的 UPLC;峰 2 表示 2 pg 水平的黄曲霉毒素 B1 (使用 8 μL 流通池)。(E) 从当地花生田收获的野生 花生 物种的种子纯化提取物的 UPLC。(F) 用碱性氧化铝微柱纯化的激发花生种子提取物的UPLC。(G) 用 Florisil 色谱柱纯化的攻击花生种子提取物的 UPLC;蓝色色谱图显示了用 1 mL 甲醇-水 (90:10 V/V) 混合物从色谱柱中清洗的杂质;黑色色谱图显示黄曲霉毒素 M1 和 B1 的峰。黄曲霉毒素 B1 的水平为 48 ng/g。(H) 来自攻击种子的花生二苯乙烯的典型色谱图;缩写:IPD = 3′-异戊二烯基-3,5,4′-三羟基二苯乙烯。注意:种子提取物中的所有二苯乙烯均采用 反式配置。 请单击此处查看此图的较大版本。
- 对于植物抗毒素分析,从每个珠子小瓶中,将 200 μL 上清液转移到上述巴斯德移液器过滤器中。使用来自压缩氮气罐的 N2 气体加速过滤到 400 μL UPLC 自动进样器样品瓶中,并用带有 PTFE 隔垫的匹配瓶盖盖住样品瓶(图 4D)。
3. 黄曲霉毒素分析
- 为了分离种子提取物中的黄曲霉毒素,使用配备自动进样器、四元泵、荧光检测器、UPLC BEH C18 3.0 mm x 100 mm、1.7 μm色谱柱和匹配前柱的柱后光化学反应器(PHRED)和柱后光化学反应器(PHRED),该反应器带有标准编织PTFE线圈(内径为0.25,切割至其原始长度的25%)。
注:材料 表中列出了作者使用的 UPLC 仪器和相关设备。 - 按以下梯度使用水 (A)、甲醇 (B) 和乙腈 (C):初始条件:62.7% A、24% B、13.3% C,在 3.75 min 内线性变化为 30% A、45% B、25% C,在 3.751 分钟内变为 0% A、64.4% B、35.6% C,保持等度 3.249 min,然后在 0.01 min 内变为初始条件,并在下次进样前保持等度 2.499 min。将流速设置为 0.45 mL/min,运行时间为 9.5 min。在系统柱温箱中将色谱柱保持在 40 °C。分别使用 362 nm 和 440 nm 作为黄曲霉毒素 B1、B2、G1、G2 和 M1 定量的激发波长和发射波长。主要黄曲霉毒素的结构如图 6A 所示。
注:在实验条件下,黄曲霉 NRRL 3357 预计仅产生黄曲霉毒素 B1 和 B2;如果 A. parasiticus 菌株用于种子挑战性,则预计会产生黄曲霉毒素 B1、B2、G1 和 G2。 - 参考软件用户手册中所述的相应确证标准品的峰面积(校准曲线)测定黄曲霉毒素的浓度。
注:由于 UPLC 程序在荧光检测器的高灵敏度设置下表现出基线噪音,因此使用广泛接受的信噪比(LOD 为 3:1)和 LOQ 为 10:1 来评估黄曲霉毒素的检测限 (LOD) 和定量限 (LOQ)。在第 2 节和第 3 节所述的花生种子分析常规实验设置中,黄曲霉毒素 G2 和 B2 的黄曲霉毒素 G1 和 B1 的定量限预计分别小于或等于 0.8 和 0.08 ng/g。
4. 二苯乙烯类植物抗毒素分析
- 对于二苯乙烯类化合物的分离,使用水 (A)、甲醇 (B) 和 88% 甲酸 (C) 按以下梯度:初始条件,53% A、42% B、5% C,在 2.0 分钟内线性变化为 35% A、60% B、5% C,保持等度 4 分钟,在 0.5 分钟内变为 0% A、95% B、5% C,保持等度 2.5 分钟, 然后在 0.1 分钟内变为初始条件,并在下次进样前保持等度 2.9 min。将流速设置为 0.5 mL/min,运行时间为 12.0 min。
- 参考相应确证标准品的峰面积(校准曲线)和/或软件用户手册中描述的公开摩尔消光系数来确定二苯乙烯的浓度。主要二苯乙烯衍生的植物抗毒素的结构如图 6B 所示。
注:植物抗毒素的分离是使用相同的系统实现的,但没有荧光检测器和 PHRED 反应器。相反,二极管阵列检测器用于检测和定量花生二苯乙烯类化合物。主要二苯乙烯类植物抗毒素的定量限 (LOQ) 没有实际意义,因为二苯乙烯浓度超过同一提取物中黄曲霉毒素的浓度几个数量级;孵育 3 天后,对 stilbenoids 进行可靠定量。
结果
开发的种子中黄曲霉毒素定量方法是评估野生花生物种对黄曲霉毒素积累的抗性整个过程的核心。由于缺乏大量溶剂、昂贵且不必要的 0.22 或 0.45 μm 商用过滤器以及泵送装置,定制填充的微型色谱柱和过滤器可节省大量成本并简化整个程序。黄曲霉毒素分析方法在研磨种子中黄曲霉毒素的 1.0-50.0 ng/g 测试范围内提供了高回收率、准确度和精密度,如 表 1 所示。将高度污染的样品稀释至线性测试值。 图 5C 显示了四种主要黄曲霉毒素 B1、B2、G1 和 G2 在 5 min 洗脱时间内的基线分离,这是可以接受的,因为花生种子的真菌挑战是程序的极限阶段,而不是 UPLC 分析。
所提出的方法足够灵敏,黄曲霉毒素 B1 的定量限为 2 pg(图 5D)。提取物的高纯度使其能够对黄曲霉毒素进行明确的定量分析,如从具有野生花生物种的田地中收获的种子的纯化提取物的UPLC(图5E)所见。与建议的方法(图 5G)相比,早先发表的微型柱方法29 无法为真菌攻击的花生种子(图 5F)获得令人满意的纯度。从图 5F 中可以明显看出,由于存在高浓度干扰杂质,黄曲霉毒素 B2、G1 和 G2 无法可靠地检测和定量,其中许多干扰杂质在黄曲霉毒素后洗脱,是二苯乙烯类植物抗毒素和真菌代谢物。相比之下,Figure 5G 展示了镁硅胶柱在去除黄曲霉毒素馏分中的杂质方面的高效性。蓝色色谱图显示干扰杂质,这些杂质用 1 mL 甲醇-水 (90:10) 混合物从色谱柱中清洗;黑色色谱图显示黄曲霉毒素 M1 和 B1 的峰未被遮挡。该色谱图代表被攻击的野生物种种子的提取物。黄曲霉毒素 B1 的水平为 48 ng/g。
花生植物抗毒素的定量是分析同一种子中黄曲霉毒素的重要补充,同一种子可能是来自田间的天然种子或受真菌攻击的种子。 图 5H 显示了来自攻击种子的花生防御性二苯乙烯的典型色谱图。使用用于黄曲霉毒素分析的同一分析柱实现化合物的分离。色谱柱和所选的色谱条件提供了令人满意的峰分离,从而能够可靠地定量二苯乙烯类化合物。对攻击种子中黄曲霉毒素-植物抗毒素关系的评估超出了本介绍的范围,这里建议该方法作为一种潜在的研究工具,该方法已在作者的实验室中使用了几年,并已被证明是有用的。
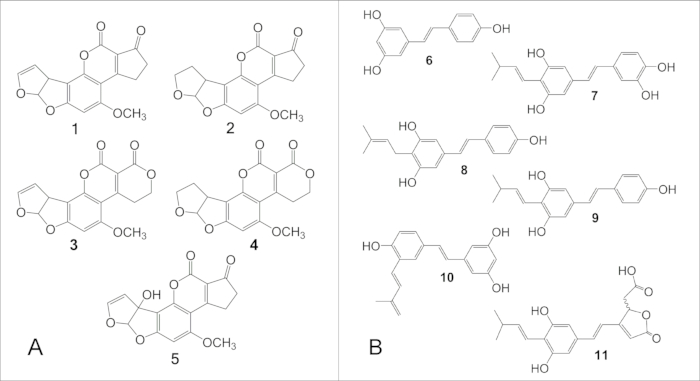
图 6: 主要黄曲霉毒素和二苯乙烯衍生的花生抗毒素的结构。 (A) 主要黄曲霉毒素的结构: 1,B 1; 2、B2; 3, G1; 4, G2.(B) 主要二苯乙烯衍生的花生抗毒素的结构: 6,白藜芦醇; 7, 花生素-1; 8, 花生素-2; 9, 花生素-3; 10, IPD (3′-异戊二烯基-3,5,4′-三羟基二苯乙烯); 11, SB-1. 请单击此处查看此图的较大版本。
| 尖峰级别a (纳克/克) | 黄曲霉毒素 | |||
| 乙1 | 乙2 | G1 | G2 型 | |
| 50 | 85.87 (0.97) | 82.33 (0.67) | 86.63 (2.89) | 84.01 (0.86) |
| 5 | 91.43 (2.76) | 87.32 (0.47) | 88.08 (2.08) | 87.73 (0.77) |
| 1 | 81.21 (3.16) | 85.33 (1.98) | 81.76 (4.66) | 88.46 (3.24) |
表 1:使用 Florisil 色谱柱和 1.2 mL 黄曲霉毒素馏分洗脱混合物从花生种子中回收黄曲霉毒素。 [平均值 (SD),%;n = 5]。在含有 50、5 或 1 ng/g 水平的黄曲霉毒素原液的微量注射器的帮助下,Georgia 06G 花生品种的无黄曲霉毒素研磨样品 (50 g) 均匀加标,并在室温下放置 16 小时。 a 给出黄曲霉毒素 B1 和 G1 的加标水平;对于黄曲霉毒素 B2 和 G2 ,应使用 0.33 的倍增因子。
讨论
根据我们以前的经验28,我们开发了一种简单、廉价、环保的化学程序,适用于探索野生 花 生种质资源,以识别对 曲霉菌 具有抗性的物种,并确定和表征对这种机会性真菌的遗传抗性的新来源。该方法基于固相萃取 (SPE) 技术种子提取物纯化和超高效液相色谱 (UPLC) 黄曲霉毒素定量,具有足够高的回收率、精密度和准确度。提出的“Florisil”方法是对单微型柱净化程序的改进,该程序基于 Florisil(镁硅胶)的独特特性,可强烈且选择性地保留黄曲霉毒素28。与原始方法一样,用 MeOH-H2O 混合物提取种子样品,但与已公布的 80:20 (v/v) 相比,90:10 (v/v) 的比例不同。这一变化使溶剂通过净化柱的流速提高了 2.5 倍,而黄曲霉毒素回收率相同。这种 90:10 (v/v) 的甲醇-水混合物在提取溶剂中添加的黄曲霉毒素 B1、B2、G1 和 G2 标准品的回收率接近 100%,加标水平相当于 1 g 底物中 5-50 ng 黄曲霉毒素浓度,并且从加标花生种子样品中获得了足够高的回收率(表 1)。
已经表明,黄曲霉毒素只能用大量的丙酮30、丙酮-甲醇31,32 和丙酮-水混合物 33,34,35,36 从 Florisil 吸附剂中洗脱出来。在本研究过程中,我们发现酸化乙腈的行为与丙酮相似,能够从 Florisil 中洗脱黄曲霉毒素。据我们所知,文献中尚未报道乙腈的这种特性。发现这一特性后,可以将纯化的提取物直接注入UPLC系统中,省去了溶剂蒸发步骤,从而大大缩短了制备时间。即使将乙腈与丙酮(丙酮-乙腈-水-88%甲酸(65:31:3.5:0.5,v/v))混合,也能顺利、完全、快速地从纯化的洗脱液中去除水分,从而显著缩短溶剂蒸发时间。与已公布的方法相比,乙腈的存在允许使用单一溶剂甲醇-水 (90:10, v/v) 混合物来有效去除 Florisil 色谱柱中的杂质,而已公布的方法需要两种额外的清洗溶剂,即甲醇和氯仿-甲醇混合物。28
平均而言,使用 1.2 mL 洗脱黄曲霉毒素时,黄曲霉毒素 B1 标准回收率为 ~98%。选择 50 mg Florisil 的量,使 1.2 mL 洗脱溶剂将微型色谱柱填充至枪管顶部,同时提供令人满意的回收率(表 1)。这种方法加快了净化过程,因为柱桶只需填充一次。在该项目的早期阶段,尚不清楚粒径相对较大的 100-200 目商业 Florisil 馏分是否适合于仅容纳 3 mm 层吸附剂的小色谱柱。因此,我们使用美国标准测试筛 120-140、140-170、170-200、200-270、270-400 和 >400 目探索了从商业 100-200 目产品中获得的不同 Florisil 馏分。所有这些馏分均提供了可重现、几乎匹配的结果和令人满意的回收率。尽管在紫外光下,较小粒径馏分在色谱柱中表现出较窄的黄曲霉毒素条带,但这些馏分在任何方面都不优于市售的 100-200 目产品。此外,100-200 目组分在整个过程中表现出最短的洗脱时间(8-12 分钟)。
梯度UPLC溶剂输送能够令人满意地分离黄曲霉毒素,并完全去除色谱柱中的非极性杂质(图5G)。这种方法实现了完美的色谱柱操作和数百个样品的分析结果的可重现性。如前所述,确认了从 Florisil 色谱柱洗脱的黄曲霉毒素的身份。28 与相同填料的直径为 2.1 mm 的色谱柱相比,本文使用的 3 mm 直径分析型 UPLC 色谱柱在较高浓度下对黄曲霉毒素 B1、B2、G1 和 G2 表现出更高的选择性和更可靠的分离。此外,3 mm 色谱柱的寿命(超过 1,200 次进样)明显高于 2.1 mm 色谱柱(多达 800 次进样)。尽管 3 mm 色谱柱需要更高的流动相速率(高出 40%),但该色谱柱的上述优势抵消了这一缺点。
Florisil 微型柱可有效纯化被 曲霉 代谢物严重污染的花生种子提取物(图 5G);这种种子还含有高水平的二苯乙烯类植物抗毒素,这些植物抗毒素是由种子在真菌入侵时产生的。所有这些杂质都可能超过种子中的黄曲霉毒素浓度,最高可达 106 倍22,这使得这些种子成为黄曲霉毒素分析的挑战对象。 图 5G 显示,在黄曲霉毒素保留时间内,色谱图中没有干扰峰,这使得黄曲霉毒素的检测和定量在所有测试水平上都不受影响(表 1)。如 表 1 所示,该方法的准确度和精密度在 1.0-50.0 ng/g 的测试范围内足够高,这也是黄曲霉毒素检测的最关键范围。不同野生花生基因型在不同水平的回收率是一致的,5 种不同提取的标准差基本上很低。
该方法还对自然污染的花生、棉花、玉米和水稻种子进行了测试,这些种子从零到极高水平 - 总黄曲霉毒素超过 10,000 ng/g。玉米、棉籽和水稻中黄曲霉毒素 B1、B2、G1 和 G2 的回收率为 5 ng/g 水平,分别为 76.1%-93.7%、77.1%-86.6% 和 90.5%-96.2%。大米中黄曲霉毒素的最高回收率伴随着洗脱液的“纯度”,即几乎不含任何杂质。此外,水稻是测试中最小的单一物体,平均为 19 毫克/种子。
使用 Florisil 色谱柱制备单个花生种子的总制备时间(包括去壳、称重、提取、离心和纯化)不超过 20 min。Florisil 微型色谱柱的成本比商业净化色谱柱低 >10 倍。与已发布的程序相比,使用较少量的吸附剂、溶剂和氮气可节省更多成本28。微型塔不需要泵送或真空装置即可运行,并且具有无限期的保质期。
探索植物种质对黄曲霉毒素的抗性非常困难,因为霉菌毒素的积累不遵循正态分布37,38;需要对单个种子进行大量的黄曲霉毒素分析来克服这种现象。除了黄曲霉毒素含量外,鉴于可以从单个种子(图 1A)获得并跟踪到特定植物(图 1E)的大量信息,有关定量植物抗毒素组成的信息非常有价值。该方法已成功用于筛选数百种种质,包括地方品种、高级育种系和优质花生品种。该方法建议用于花生预育种和育种研究计划,并可能有助于表征花生基因的真菌抗性。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了 USDA-ARS CRIS 项目 6044-42000-011-00D 和 CRIS 项目 6044-21000-005-000-D 的财政支持。我们感谢 Dan Todd 制作了微型立柱固定架。本文中提及的商品名称或商业产品仅用于提供具体信息,并不意味着美国农业部的推荐或认可。
材料
| Name | Company | Catalog Number | Comments |
| Acetone, Optima | Fisher Scientific | A929-4 | |
| Acetonitrile, Optima | Fisher Scientific | A996-4 | |
| Acquity BEH C18 2.1 x 5mm Van-Guard pre-column | Waters Corporation | 186003975 | |
| Acquity BEH C18 3 x 100mm column | Waters Corporation | 186004661 | |
| Acquity BEH C18 2.1 x 100mm column | Waters Corporation | 186002352 | |
| Aflatoxins B1, B2, G1, and G2 | Sigma-Aldrich | A9441-1VL | Dissolve the contents of the commercial vial in 5 mL of methanol to obtain 5 µg/mL for aflatoxins B1 and G1 and 1.5 µg/mL for B2 and G2 |
| Aflatoxin B1 (1mg) | Sigma-Aldrich | A6636-1MG | |
| Aflatoxin B2 (1mg) | Sigma-Aldrich | A9887-1MG | |
| Aflatoxin G1 (1mg) | Sigma-Aldrich | A0138-1MG | |
| Aflatoxin G2 (1mg) | Sigma-Aldrich | A0263-1MG | |
| Aflatoxin M1 (10 µg) | Sigma-Aldrich | CRM46319 | |
| Agar, Granulated (2kg) | Becton Dickinson | BD214510 | |
| Alumina oxide basic (60-325 mesh) | Fisher Scientific | A941-500 | |
| Basal medium | Murashige and Skoog | M5519 | |
| Bead Ruptor 24 | Omni International | 19-042E | |
| Beaker (1000mL) | Corning (Pyrex) | 10001L | |
| Beaker (250mL) | Corning (Pyrex) | 1000250 | |
| Beaker (400mL) | Corning (Pyrex) | 1000400 | |
| Beaker (600mL) | Corning (Pyrex) | 1000600 | |
| Blade, scalpel | Feather | #10 | |
| Centrifuge (LSE Compact) | Corning | Model: 6755 | |
| Centrifuge, micro | Corning | Model: 6770 | |
| Ceramic beads (2.8 mm) | Omni International | 19-646 | |
| Ceramic beads (6.5 mm) | Omni International | 19-682 | |
| Chromeleon 7 series Software | Thermo Scientific | ||
| Drill bit | Kyocera | 07896 | 1.6 mm |
| Drill bit | Kyocera | 07357 | 2.0 mm |
| Drill bit | Kyocera | 07985 | 2.34 mm |
| Ethanol (200 proof) | Decon Labs | 2805M | |
| Evaporator, nitrogen | organimation | 11106 | 6-position |
| Excel, Microsoft | Microsoft | Office 365 | |
| Filter paper (#4) | Cytiva Whatman | 1004-090 | |
| Filter paper cutter, stainless steel (ID 11.5mm) | Unknown | ||
| Filter paper, glass fibre | Cytiva Whatman | 934-AH | |
| Flask (2800mL) | Corning (Pyrex) | 44202XL | |
| Florisil (100-200 mesh) | Fisher Scientific | F101-500 | |
| Forceps | Integra Lifescience (Miltex) | PM-0300 | |
| Formic acid (88%, ACS) | Fisher Scientific | A118P-500 | |
| Freezer (-80oC) | Fisher Scientific | TSX70086D | |
| Funnel (15 x 80mm) | DWK Life Sciences (Kimax) | 2902060 | |
| Gelzan (medium) | Caisson Labs | G024 | |
| Glass rod (custom) | Custom made | ||
| Glass wool | Corning (Pyrex) | 3950 | |
| Handle, scalpel | Feather | #7 | |
| Hemocytometer | Hausser Scientific | 3100 | |
| Hydrogen peroxide | Fisher Scientific | H325-4 | 30%, Certified ACS |
| Ice bucket, round with lid | Corning | 432122 | |
| Incubator | Percival | 136VL | |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34120 | 8.2" x 4.39" |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34256 | 16.4" x 14.43" |
| Lab coat | Cenmed | B113660SBXL | |
| Methanol, Optima | Fisher Scientific | A454-4 | |
| Mini column rack (custom) | Custom made | ||
| Mixer, touch (maxi mix II) | Thermolyne | 37600 (model 231) | |
| Nitrile gloves | Microflex | XC310M | |
| Nitrogen gas, compressed (ultra high purity) | Jones Welding | ||
| Paper towel | Georgia-Pacific | 20023 (D400) | |
| pH meter | Fisher Scientific (Accumet) | 13-636-AB15 | |
| pH/ATC electrode | Fisher Scientific (Accumet) | 13-620-111 | |
| PhCR Photochemical Reactor | Waters (Vicam) | 600001222 | |
| Pipette, pasteur | Fisher Scientific | 13-678-20D | 9" |
| Pipettor (1 mL) (Reference 2) | Eppendorf | 4924000088 | |
| Pipettor (10 μL) (Reference) | Eppendorf | 022470051D | |
| Pipette tips: 10 μL, 200 μL, 1 mL | Eppendorf | F144054M | |
| Pipettor (200 µL)(Ergofit) | Fisher Scientific | 12-146-679 | |
| Plates, petri (100x15mm) | Fisher Scientific | FB0875713 | |
| Potato Dextrose Agar (500g) | Becton Dickinson | BD213400 | |
| Reinforced bead tube (2 mL) | Omni International | 19-660 | |
| Reinforced bead tube (7 mL) | Omni International | 19-651 | |
| Repipettor, Dispensette III (10mL) | Brandtech | 4701141 | |
| Resveratrol | Sigma-Aldrich | R5010-100MG | |
| Scoop (custom) | Custom made | ||
| screwcap jar (250 mL) | Corning (Pyrex) | 1395250 | |
| Silica gel, spherical (200-400 mesh) | Supelco | 97727-U | 100 g |
| Sodium Hydroxide | Fisher Scientific | S318-500 | |
| SPE extract clean 1.5-mL polypropylene column | American Chromotography Supplies | SP-5122382 | |
| SPE extract clean PP frits (for 1.5 mL minicolumn) | American Chromotography Supplies | SP-3119414 | |
| Spectrophotometer, UV-visible | Fisher Scientific | 14-385-351 (Genesys 50) | |
| Test tube | Corning (Pyrex) | 982516X | 16x125mm |
| Test tube (Disposable)(16x125mm) | Fisher Scientific | 14-961-31 | |
| Test tube (Disposable)(150x250mm) | Fisher Scientific | 14-961-34 | |
| Thermo Vanquish DAD detector (UPLC) | Thermo Scientific | VF-D11-A-01 | |
| Thermo Vanquish Fluourescense detector (UPLC) | Thermo Scientific | VF-D51-A | |
| Thermo Vanquish quaternary pump F (UPLC) | Thermo Scientific | VF-P20-A | |
| Thermo Vanquish Split Sampler FT (UPLC) | Thermo Scientific | VF-A10-A-02 | |
| Tween 20 (polysorbate 20) (enzyme grade) | Fisher Scientific | BP337-500 | |
| Vial caps (4mL) | Fisher Scientific | C4015-75A | |
| Vial caps (autosampler) | Fisher Scientific | C4010-60A | |
| Vials & caps (16 mL) | Thermo Scientific | B7800-4 | |
| Vials, glass (4mL) | Fisher Scientific | C4015-1 | |
| Vials, polypropylene (autosampler) (400mL) | Fisher Scientific | C4010-11 | |
| Water, Optima | Fisher Scientific | W6-4 |
参考文献
- Janila, P., et al. Molecular breeding for introgression of fatty acid desaturase mutant alleles (ahFAD2A and ahFAD2B) enhances oil quality in high and low oil containing peanut genotypes. Plant Sci. 242, 203-213 (2016).
- Rasooly, R., Hernlem, B., He, X., Friedman, M. Non-linear relationships between aflatoxin B1 levels and the biological response of monkey kidney vero cells. Toxins (Basel). 5 (8), 1447-1461 (2013).
- American Association for Cancer Research: AACR. An evaluation of chemicals and industrial processes associated with cancer in humans based on human and animal data: IARC Monographs Volumes 1 to 20. Cancer Res. 40 (1), 1-12 (1980).
- Turner, P. C. The molecular epidemiology of chronic aflatoxin driven impaired child growth. Scientifica. , 21 (2013).
- Williams, J. H., et al. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am. J. Clin. Nutr. 80 (5), 1106-1122 (2004).
- van Egmond, H. P., Jonker, M. A., Abbas, H. K. Worldwide regulations on aflatoxins. Aflatoxinandfood safety. , 77-93 (2005).
- European Commission. Commission Regulation (EC) 1525/98. Off. J. Eur. Comm. L. 201, 43-46 (1998).
- Bressano, M., et al. Introgression of peanut smut resistance from landraces to elite peanut cultivars (Arachis hypogaea L). PLoS ONE. 14 (2), e0211920 (2019).
- de Blas, F. J., et al. Identification of smut resistance in wild Arachis species and its introgression into peanut elite lines. Crop Sci. 59 (4), 1657-1665 (2019).
- Mallikarjuna, N., Pande, S., Jadhav, D. R., Sastri, D. C., Rao, J. N. Introgression of disease resistance genes from Arachis kempff-mercadoi into cultivated groundnut. Plant Breeding. 123 (6), 573-576 (2004).
- Moretzsohn, M. C., et al. Genetic diversity of peanut (Arachis hypogaea L.) and its wild relatives based on the analysis of hypervariable regions of the genome. BMC Plant Biol. 4, 1-10 (2004).
- Arias, R. S., et al. New tools to screen wild peanut species for aflatoxin accumulation and genetic fingerprinting. BMC Plant Biol. 18 (1), 170 (2018).
- Dorner, J. W., Cole, R. J., Sanders, T. H., Blankenship, P. D. Interrelationship of kernel water activity, soil temperature, maturity, and phytoalexin production in preharvest aflatoxin contamination of drought-stressed peanuts. Mycopathologia. 105 (2), 117-128 (1989).
- Paxton, J. D., Sharma, R. P., Salunkhe, D. K. Biosynthesis and accumulation of legume phytoalexins. Mycotoxins and phytoalexins. , 485-499 (1991).
- Cole, R. J., Dorner, J. W., Sharma, R. P., Salunkhe, D. K. Peanut phytoalexins. Mycotoxins and phytoalexins. , 501-509 (1991).
- Subba Rao, P. V., Strange, R. N., Daniel, M., Purkayastha, R. P. Chemistry, biology, and role of groundnut phytoalexins in resistance to fungal attack. Handbook of phytoalexin metabolism and action. , 199-227 (1995).
- Sobolev, V. S., Guo, B. Z., Holbrook, C. C., Lynch, R. E. Interrelationship of phytoalexin production and disease resistance in selected peanut genotypes. J. Agric. Food. Chem. 55 (6), 2195-2200 (2007).
- Paxton, J. Phytoalexins: a working redefinition. J. Phytopathol. 101, 106-109 (1981).
- Mansfield, J. W., Bailey, J. A., Mansfield, J. W. The role of phytoalexins in disease resistance. Phytoalexins. , 153-288 (1982).
- Strange, R. N., Ayers, P. G. Resistance: the role of the hypersensitive response and phytoalexins. Plant response to foliar pathogens. , 39-56 (1992).
- Sobolev, V. S., et al. Biological activity of peanut (Arachis hypogaea) phytoalexins and selected natural and synthetic stilbenoids. J. Agric. Food Chem. 59 (5), 1673-1682 (2011).
- Sobolev, V. S. Localized production of phytoalexins by peanut (Arachis hypogaea) kernels in response to invasion by Aspergillus Species. J. Agric. Food Chem. 56 (6), 1949-1954 (2008).
- Sobolev, V. S., Neff, S. A., Gloer, J. B. New stilbenoids from peanut (Arachis hypogaea) seeds challenged by an Aspergillus caelatus strain. J. Agric. Food Chem. 57 (1), 62-68 (2009).
- Trucksess, M. W., et al. Immunoaffinity column coupled with solution fluorometry or liquid chromatography postcolumn derivatization for determination of aflatoxins in corn, peanuts, and peanut butter: collaborative study. J. AOAC Int. 74 (1), 81-88 (1991).
- Dorner, J. W., Blankenship, P. D., Cole, R. J. Performance of two immunochemical assays in the analysis of peanuts for aflatoxin at 37 field laboratories. J. AOAC Int. 76 (3), 637-643 (1993).
- Stroka, J., Anklam, E. Immunoaffinity column cleanup with liquid chromatography using post-column bromination for determination of aflatoxins in peanut butter, pistachio paste, fig paste, and paprika powder: collaborative study. J. AOAC Int. 83 (2), 320-340 (2000).
- Pal, A., Acharya, D., Saha, D., Roy, D., Dhar, T. K. In situ sample cleanup during immunoassay: a simple method for rapid detection of aflatoxin B1 in food samples. J. Food Prot. 68 (10), 2169-2177 (2005).
- Sobolev, V. S. Simple, rapid, and inexpensive cleanup method for quantitation of aflatoxins in important agricultural products by HPLC. J. Agric. Food Chem. 55 (6), 2136-2141 (2007).
- Sobolev, V. S., Dorner, J. W. Cleanup procedure for determination of aflatoxins in major agricultural commodities by liquid chromatography. J. AOAC Int. 85 (3), 642-645 (2002).
- Levi, C. P., Borker, E. Survey of green coffee for potential aflatoxin contamination. J. AOAC. 51 (3), 600-602 (1968).
- Levi, C. P. Collaborative study on a method for detection of aflatoxins B1 in green coffee beans. J. AOAC. 52 (6), 1300-1303 (1969).
- Scott, P. M. Note on analysis of aflatoxins in green coffee. J. AOAC. 51, 609 (1968).
- Bicking, M. K. L., Kniseley, R. N., Svec, H. J. Coupled-column system for quantitating low levels of aflatoxins. J. AOAC. 66 (4), 905-908 (1983).
- Kamimura, H., et al. Simple, rapid cleanup method for analysis of aflatoxins and comparison with various methods. J. AOAC. 68 (3), 458-461 (1985).
- Hoogenboom, L. A., et al. Genotoxicity testing of extracts from aflatoxin-contaminated peanut meal, following chemical decontamination. Food Addit. Contam. 18 (4), 329-341 (2001).
- Castro, L., Vargas, E. A. Determining aflatoxins B1, B2, G1 and G2 in maize using Florisil clean up with thin layer chromatography and visual and densitometric Quantitation. Cienc. Tecnol. Ailment. Campinas. 21, 115-122 (2001).
- Arias, R. S., Dang, P. M., Sobolev, V. S. RNAi-mediated Control of Aflatoxins in Peanut: Method to Analyze Mycotoxin Production and Transgene Expression in the Peanut/Aspergillus Pathosystem. J. Vis. Exp. (106), e53398 (2015).
- Whitaker, T. B., Dorner, J. W., Giesbrecht, F. G., Slate, A. B. Variability among aflatoxin test results on runner peanuts harvested from small field plots. Peanut Sci. 31 (1), 59-63 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。