Method Article
大鼠气管切开术气管插管和随后的开胸术用于非存活应用
摘要
在这里,我们介绍了一种通过气管切开术进行气管插管,然后对大鼠进行开胸术的标准化程序,旨在提高 体内大鼠模型中 需要有创通气和胸部器官暴露的非存活应用的精度和可重复性。
摘要
气管插管和随后的通气通常是大鼠模型转化研究的基本要求,用于需要受控或高通气压力或进入胸腔和器官的各种干预措施。使用解剖学上存在的经口途径的常规气管插管非常适合生存实验。然而,该手术带来了一些挑战,包括通常所需的经验和技术技能水平更高、设备更先进,以及相关的插管失败率和并发症(如气管穿孔、暂时性全身性低氧和相关的气管渗漏)需要花费更多的时间。
因此,本手稿提出了在需要保证插管成功、恒定氧合水平、高通气压力或开胸时,在非存活大鼠模型中通过气管切开术进行气管插管的详细分步方案。
该方案强调了细致手术技术的重要性,以确保结果一致和可靠,特别是对于缺乏经验或缺乏常规通过直接喉镜进行口气管插管技术的研究人员。因此,预计该程序可以最大限度地减少动物的痛苦和不必要的动物损失。
引言
一般来说,啮齿动物能够比患者更长时间地补偿呼吸窘迫。它们可以在自主通气下保持心循环稳定和充分,持续时间更长,并且在更具侵入性的手术中,例如,甚至通过肝移植,众所周知,肝移植是心肺循环压力最大的手术之一 1,2,3。
然而,气管插管是源自各种生物医学领域的各种环境和干预措施的大鼠模型转化研究的基本要求,在当今的科学领域中是必不可少的 4,5,6,7,8,9,10,11 .虽然在大鼠中进行的大多数实验动物工作通常仍然不需要有创通气12,但有一些实验设置需要插管和受控通气辅助。这些实验设置包括任何需要安全气道、高通气压力和腹腔镜检查或直接进入胸腔和器官的实验。
特别是在需要进入胸腔和器官的情况下,气管插管是必不可少的,因为一旦胸膜腔内的负压以及肋间肌和横膈膜的吸气机制丢失,肺塌陷将导致致命的呼吸功能不全13。
虽然有许多关于啮齿动物无创口腔气管插管方法的出版物 14,15,16,17,但似乎缺乏通过气管切开术进行有创气管插管的手术方案。尽管后者具有侵入性,仅允许在非存活动物模型中应用,但通过气管切开插管具有很大的优势。这些挑战包括更陡峭的学习曲线、更高和更持久的成功率、更少的技术设备以及更高的成功监控机会 18,19。
插管成功对结局至关重要。虽然各种假插管以及患者的反复插管尝试显然与不良事件和并发症有关,就像死亡一样严重20,21,但此类事件在试验动物中也是有害的。在最好的情况下,它们代表了实验中的强混杂变量,但它们也可能导致动物不必要的损失。因此,如果实验设置和策略允许,以非侵入性为代价提高插管成功率是有意义的。
这种通过外科气管切开术进行插管的标准化方案具有几个优点,包括减少插管成功率的可变性、最大限度地减少对心肺生理参数的影响以及参数的全面研究控制和作。它有助于提供安全的气道,特别是对于通过直接喉镜进行气管插管手术的没有经验的研究人员,并允许研究人员在高度受控的条件下进行非生存研究。我们重点介绍关键的解剖标志,并提供有关解决手术过程中遇到的常见挑战的见解。
研究方案
此处描述的所有动物活动均已获得德国卡尔斯鲁厄巴登-符腾堡州地区委员会的机构动物护理和使用委员会 (IACUC) 的批准。根据机构标准和德国动物使用和护理法律以及欧洲共同体理事会 (2010/63/EU) 的指令以及 ARRIVE 指南对实验动物进行管理,并在认可的设施中进行。使用来自 Janvier Labs 的雄性 Spraque Dawley 大鼠,订购重量为 400 g。
1. 程序准备(图 1)
- 通过将插管与尖端成 135° 角折叠 1°,通过 Luer 锁将它们连接到塑料灌注管,并使用手术蚊夹施加张力来准备手术准备钩(图 1A、B)。
- 准备啮齿动物手术暴露设备。
注意:除了商业平台的可用性外,这些平台也可以很容易地以经济高效的方式自行构建,如本研究所示。- 为此,请使用 40 厘米 x 50 厘米、厚度为 4 毫米的钢板。使用钢钻头在所需位置创建几个 8 mm 的孔,用于后续的张力点。将 Y 形固定杆放在这些位置。
- 在手术暴露装置的钢板顶部放置加热垫,以提供热支持。
- 准备带有连接塑料管和手术蚊夹的手术准备钩,以便稍后对组织施加张力以进行手术暴露。
- 取下带有公鲁尔锁端的 10 mL 塑料注射器的塞子,并切断注射器的近端。如图所示,将远端部分插入通风袋中,并用热缩管覆盖并使用实验室火炬轻轻加热,将其密封(图 1D-F)。
- 缩短和斜切不同尺寸的静脉导管,并将导丝从尖端为柔性丝端的动脉导导管插入最适合相应动物大小的导管尺寸(大概为 14 G)中,用于插管期间后续的 Seldinger 技术22,23(图 1G,H)。
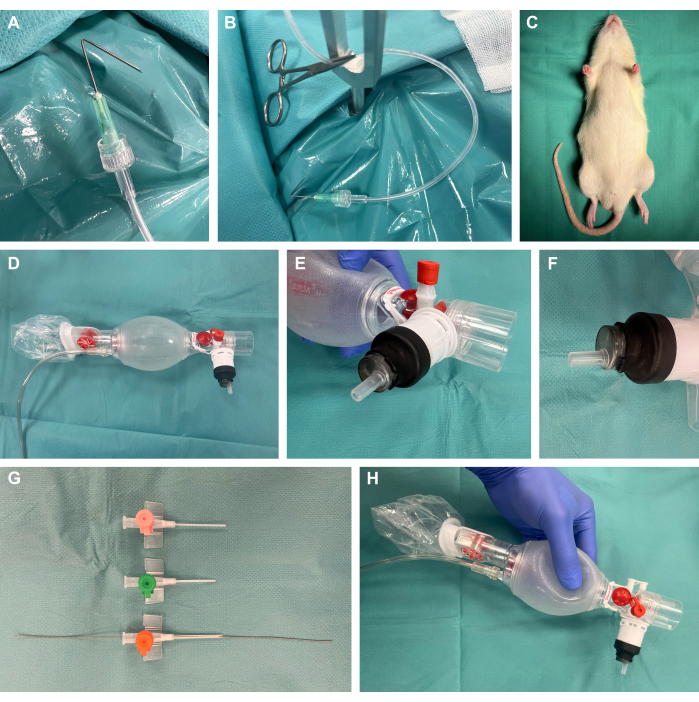
图 1:实验装置。(A) 连接到灌注管的折叠套管,用作手术准备钩。(B) 带夹子的准备钩,位于金属固定杆中。 (C) 干预前镇静动物。(D) 新生儿科的通气袋。(E-F)使用热缩管将 Luer-lock 注射器气密地安装到通气袋上。(G) 不同尺寸的缩短和斜面静脉导管,带有来自 Seldinger 技术的动脉导导管装置的导丝。(H) 最终定制结构。请单击此处查看此图的较大版本。
2. 麻醉和镇痛
- 用选择的药物麻醉大鼠。
注:在这里,使用氯胺酮 10% (100 mg/mL)、甲苯噻嗪 2% (20 mg/mL)、卡洛芬 50 mg/mL 和异氟醚建立麻醉和镇痛。使用甲苯噻嗪和卡洛芬的 1:10 稀释液作为应用储备液。- 通过使用蒸发器将动物置于以 5 L/min 的流入速率充满 100% 氧气并补充 4% (v) 异氟醚的诱导箱中来诱导麻醉。
- 失去知觉后,从诱导箱中取出动物并 (ip.) 注射 (ip) 100 mg/kg 体重氯胺酮和 4 mg/kg 体重甲苯噻嗪。
注:这相当于 40 mg 动物的 40 mg 氯胺酮(0.4 mL 原始溶液)和 1.6 mg 甲苯噻嗪(0.08 mL 原始溶液或 0.8 mL 1:10 溶液)。 - 将动物放回充满异氟醚的诱导箱中,直到腹腔注射的效果开始。
- 通过测试大鼠对用力的脚趾捏合缺乏反应来保证适当的麻醉深度。
- 将眼药膏涂抹在眼睛上。
- 在手术过程中评估并维持麻醉深度。
- 当麻醉作用似乎随着时间的推移(大约每小时)而减弱时,向动物额外注射 (s.c) 50 mg/kg 体重氯胺酮和 1 mg/kg 体重的甲苯噻嗪。这相当于 400 mg 动物的 20 mg 氯胺酮(0.2 mL 原始溶液)和 0.4 mg 甲苯噻嗪(0.2 mL 1:10 溶液)。
- 在开胸前提供额外的镇痛剂,皮下注射 5 mg/kg 体重的卡洛芬。这相当于 400 mg 动物的 2 mg 卡洛芬(0.04 mL 原始溶液或 0.4 mL 1:10 溶液)。
3. 手术准备(图 2)
- 通过经鼻新生儿面罩吸入 100% 氧气,使动物循环充满氧气(图 2A)。
- 5 分钟后,如上所述,从经鼻新生儿面罩切换到带有男性塑料注射器鲁尔锁尖端的新生儿通气袋的结构,并在注射器尖端靠近动物鼻尖的情况下提供溢流氧气(图 2B)。
- 在所需长度上做一个正中胸宫颈皮肤切口,并使用手术准备钩露出手术位置(图 2C,D)。
- 用细剪刀钝性解剖颈筋膜,推进准备工作。暴露胸锁乳突肌和舌骨下肌,并在左外侧膜夹层后将正中舌骨下肌向右偏侧化(图 2E-G)。
- 使用覆盖夹对气管进行钝性解剖和气管隧道(图 2H-I)。
- 使用硅胶血管环吊索气管,并使用聚丝缝合线双吊索远端气管,以便以后气管插管固定(图 2J-N)。

图 2:气管的准备。(A) 通过面罩吸入氧气。(B) 从面罩切换到公 Luer-lock 注射器进行氧气应用。(C) 胸宫颈皮肤切口。(D) 通过颈筋膜进行准备。(E) 胸锁乳突肌和舌下肌的暴露。(F) 正中舌骨下肌的偏侧化。(G) 朝向气管的钝性夹层。(H) 使用覆盖夹在气管上挖隧道。 (I) 使用硅胶血管环吊索气管。(J-N)使用聚丝缝合线对气管进行尾部双吊索,用于以后的气管插管固定。请单击此处查看此图的较大版本。
4. 插管程序(图 3)
- 使用无创钳尾部拉长气管(图 3A、B)。
- 使用剪刀对圆周 180° 的气管进行部分切口(图 3C-F)。
- 将带有柔性端的 Seldinger 导丝引入气管(图 3G-H),然后将适当周长的改良静脉导管引入由 Seldinger 钢丝引导的气管中(图 3I-N)。
- 取下 Seldinger 线(图 3O),将气管导管的鲁尔锁尖端连接到改良的通气袋,然后开始高频和低潮气量的温和肺保护性手动通气(图 3P)。只要未进行正中开胸手术且肺部不在视线范围内,就进行手动通气。
- 用滑动结系住先前放置的锁定缝合线,以避免空气泄漏和意外导管移除(图 3Q-T)。

图 3:通过气管切开术进行气管插管。(A) 准备后的初始情况。(B) 使用无创钳延长气管尾部。(C-F)部分切开圆周 180° 的气管。(G,H)将 Seldinger 导丝引入气管。(I-M)在 Seldinger 线引导下将改良的静脉导管引入气管。(N-O)移除 Seldinger 线。(P) 气管导管与改良通气袋的鲁尔锁连接。(Q-T)系扎先前放置的锁定缝合线,以避免意外拔除导管。请单击此处查看此图的较大版本。
5. 手动通气和正中开胸术(图4)
- 使用钝而稳定的材料剪刀从剑突开始正中开胸术(图 4A、B),并继续通过胸骨进行颅骨切开术。使用剪刀向胸后推进和切割时,请务必暂停通风几秒钟,以避免对肺部造成创伤(图 4C-E)。
- 使用手术准备钩获得胸部暴露并去除纵隔浆膜(图 4F-H)。
- 以所需的频率和潮气量继续手动通气并扩大监测(例如,建立动脉内血压测量,根据目的或相应的研究问题安装中心静脉或肺动脉导管)(图 4I-L)。

图 4:手动通气和正中开胸手术。(A) 插管后的初始情况。(B-E)正中开胸术从剑突开始。(F-I)使用手术准备钩进行胸部暴露。(J) 通风期间的最终设置。(K-L) 手动通气的过程。请单击此处查看此图的较大版本。
6. 安乐死
- 通过在深度麻醉的动物中使用剪刀进行突然的尖锐心脏切除术来实现安乐死。
结果
对 10 只雄性大鼠 (平均体重 405 ± 30 g) 进行了气管插管插管和随后的开胸手术,用于非存活应用。该手术由一名二年级外科住院医师进行。由插管和通气超过 20 分钟的存活率定义的成功率为 100%。从皮肤切口到固定插管的准备和插管程序的平均持续时间为 6:55 ± 0:53 分钟(表 1)。
| 使用的动物数量 | 10 |
| 体重(平均值和标准差) | 405 ± 30 克 |
| 插管成功率 | 100% |
| 手术持续时间(平均值和标准差) | 6:55 ± 0:53 分钟 |
| 平均血氧饱和度 | 96% |
| 最低血氧饱和度 | 92% |
表 1:代表性结果。 该方案在 10 只动物中的代表性结果。
通过后腿上的一次性自粘式脉搏血氧饱和度探头监测饱和度,并且从未低于 92%。控制自主通气直至隔膜切开。所有大鼠都存活了实验测量所需的 20 分钟,直到通过突然的锐利心脏切除术进行故意安乐死(图 5)。

图 5:外周血氧饱和度。 在整个手术期间测量外周血氧饱和度。 请单击此处查看此图的较大版本。
讨论
仅在美国,每年就有大约 1.1 亿只大鼠和小鼠用于动物实验24。虽然没有可靠的统计数据,但其中有一定比例的人将接受支持通气,尤其是在肺和心脏研究以及麻醉学领域。这些动物中的大多数接受无创口气管插管,这带来了许多挑战。这些包括较慢的学习曲线、较高的插管失败率、更多的再插管次数以及相关的呼吸并发症以及呼吸泄漏25。因此,无创插管通常需要更有经验的研究人员、更先进的技术,如光纤、二氧化碳测定法和机械呼吸机,以及更多的财力和物质资源26。因此,插管的整个方面是一个有意义的混杂因素,与随后的统计分析和结果的个体间异质性相关。然而,无创气管内插管通常是纵向实验设计中唯一可行的选择。
替代方案是在纵向实验中用于所需的长期气管通路的气管切开术,或在非存活实验中用于"一次性使用"的外科气管切开术。虽然有关于大鼠气管切开术的显微外科技术的方案27,但目前没有在非存活大鼠模型中通过气管切开术进行气管插管的方案。
因此,本文描述的大鼠通过气管切开术进行气管插管和随后的开胸术的标准化程序对于从事非生存研究的研究人员来说是一种有价值的方法。该程序既不需要专业人员,也不需要广泛的培训。它的插管成功率远高于口气管插管,并且允许更受控的手术步骤。
所提出技术的局限性主要包括程序的侵入性,以及连续与非生存实验的排他性兼容性。由于皮肤和软组织以及切口气管瘘的大缺损,拔管和从该手术中恢复既不可行也不推荐,尤其是与开胸手术结合时。
在解决手术过程中遇到的常见挑战时,我们想提请注意以下几点和建议:应尽可能广泛地准备设备和药物。实验者应通过精细准备和使用非创伤棉签仔细进行止血控制。实验者应准备至少 0.5 cm 长度的气管,以便有足够的活动性,并使用硅胶血管环,以免在切口后丢失气管,因为当气管由于背景现象而丢失在组织深度时,这会导致误吸和窒息。仅用剪刀一划清晰地切开气管。理想情况下,应该切开 180° 的圆周。低于此阈值可能会导致插管失败。高于此阈值可能会导致气管卡住,两端缩回组织深度,随后窒息。打结聚丝缝合线以固定插管时,应使用滑动结,以确保足够的密封性,以避免漏气或管子意外脱位,同时避免管子意外关闭。在缝合过程中将 Seldinger 钢丝留在原位可以避免意外闭合。使用通气袋进行手动通气时,应严格避免高潮气量对肺部造成气压伤。相反,人们应该以肺保护性、高频率和低潮气通气为目标,尤其是在未进行开胸手术且无法目视评估肺容量的情况下。
通过提供详细且可重复的方法,该协议促进了实验程序的标准化,提高了研究之间的数据可靠性和可比性。因此,该方法有助于完善临床前研究中的科学技术,最终提高生理学、药理学、外科和生物医学领域研究结果的转化相关性。
披露声明
作者没有什么可披露的。
致谢
作者衷心感谢巴登-符腾堡州科学、研究和艺术部 (MWK) 和德国研究基金会 (DFG) 通过赠款 INST 35/1314-1 FUGG 和 INST 35/1503-1 FUGG SDS@hd支持的数据存储服务。此外,作者非常感谢 NCT(德国海德堡国家肿瘤疾病中心)通过其结构化博士后计划和外科肿瘤学项目的支持。我们还感谢巴登-符腾堡州议会批准的国家资金对海德堡曼海姆创新校园健康 + 生命科学联盟的支持,该计划来自 Alexander Studier-Fischer 的结构化博士后计划:健康人工智能 (AIH) - DKFZ、EMBL、海德堡大学、海德堡大学医院、曼海姆大学医院、中央心理健康研究所、 以及马克斯·普朗克医学研究所 (Max Planck Institute for Medical Research)。此外,我们感谢曼海姆大学医学中心 DKFZ Hector 癌症研究所提供的支持。对于出版费,我们感谢 Deutsche Forschungsgemeinschaft 在"Open Access Publikationskoste"资助计划中的财政支持以及海德堡大学。
材料
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
参考文献
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。